La diabetes mellitus tipo 2 (DM2) es una comorbilidad común en pacientes con insuficiencia cardiaca (IC) con fracción de eyección conservada (ICFEP). Estudios anteriores han demostrado que las mujeres diabéticas tienen mayor riesgo de desarrollar insuficiencia cardiaca que los hombres. Sin embargo, el pronóstico a largo plazo de los pacientes diabéticos con insuficiencia cardiaca en función del sexo no se ha explorado ampliamente. En este estudio, nuestro objetivo fue evaluar el impacto diferencial de la DM2 en la mortalidad por todas las causas en hombres frente a mujeres con ICFEP tras un ingreso por IC aguda.
MétodosSe incluyeron prospectivamente 1.019 pacientes consecutivos con ICFEP dados de alta tras un episodio de IC aguda en hospital terciario. Se empleó un análisis de regresión de Cox multivariante para evaluar la interacción entre el sexo y la DM2 con respecto al riesgo de mortalidad total a largo plazo. Las estimaciones de riesgo se expresaron como razones de riesgo (HR).
ResultadosLa edad media de la cohorte fue de 75,6±9,5 años y 609 (59,8%) eran mujeres. La proporción de DM2 fue similar entre ambos sexos (45,1 frente al 49,1%; p=0,211). Tras una mediana de seguimiento (intervalo intercuartílico) de 3,6 (1-4-6,8) años, 646 (63,4%) pacientes murieron. Tras ajustar por factores de riesgo, comorbilidades, biomarcadores, parámetros ecográficos y tratamiento al alta, el análisis multivariate mostró un efecto pronóstico diferencial de DM2 (valor de p para la interacción=0,007). La DM2 se asoció con un mayor riesgo de mortalidad por todas las causas en mujeres (HR=1,77; IC95%, 1,41-2,21; p<0,001) pero no en varones (HR=1,23; IC95%, 0,94-1,61; p=0,127).
ConclusionesTras un episodio de IC aguda en pacientes con ICFEF, la DM2 confiere un mayor riesgo de mortalidad en las mujeres. Se requieren más estudios que evalúen el impacto de la DM2 en mujeres con ICFEP.
Palabras clave
La insuficiencia cardiaca (IC) con fracción de eyección del ventrículo izquierdo (FEVI) conservada (IC-FEc) es la forma más prevalente de IC en mujeres y ancianos1. La diabetes mellitus tipo 2 (DM2) es una frecuente comorbilidad de estos pacientes que se asocia con un pronóstico menos favorable2–4.
El efecto de la DM2 en las complicaciones cardiovasculares muestra, al parecer, interacción con un sexo en particular. El sexo femenino confiere una protección especial contra la enfermedad cardiovascular, pero dicha protección se pierde en presencia de DM25. La diabetes también se asocia con un aumento significativo de la incidencia de IC en varones y mujeres, aunque las mujeres diabéticas se exponen a un riesgo relativo de IC mayor que los varones6. No obstante, apenas se han investigado las diferencias de pronóstico entre varones y mujeres en el contexto de la DM2 con diagnóstico confirmado de IC-FEc. Pese al mayor número de mujeres con IC-FEc que de varones, las mujeres todavía están infrarrepresentadas en los ensayos clínicos y numerosos estudios carecen de datos suficientes para explorar las diferencias relativas a un sexo en particular. Se espera que esta situación se enmiende con la incorporación del sexo como importante variable biológica independiente por parte del National Institute of Health estadounidense, aunque la información científica disponible hasta el momento es todavía escasa7. Los registros observacionales cumplen una función primordial al ofrecer la evidencia científica necesaria de los pacientes que no están debidamente representados en los ensayos clínicos aleatorizados. Así pues, el presente estudio se propone evaluar el efecto diferencial de la DM2 en el riesgo de mortalidad total y mortalidad por una causa específica de los varones frente a las mujeres con IC-FEc tras su hospitalización por insuficiencia cardiaca aguda (ICA).
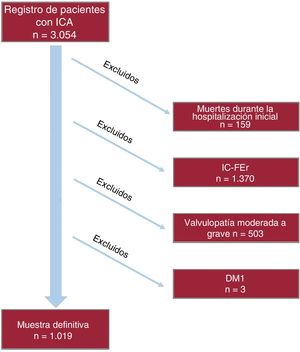
MÉTODOSDiseño y pacientes del estudioEn este estudio de cohortes observacional prospectivo, se incluyó una serie consecutiva de 3.054 pacientes ingresados por ICA en el servicio de cardiología de un centro terciario de referencia desde el 1 de enero de 2004 hasta el 1 de agosto de 2016. Se definió la ICA con arreglo a las guías de práctica clínica8-10. Se incluyó en el registro a los pacientes con IC de nueva aparición o con IC crónica reagudizada. Se excluyó del análisis definitivo del presente estudio a los pacientes que fallecieron durante la hospitalización inicial, así como a los pacientes con FEVI < 50%, disfunción valvular significativa (valvulopatía primaria moderada a grave) y DM1, como se muestra en el diagrama de flujo (figura 1). La muestra del estudio definitiva incluyó a 1.019 pacientes con IC-FEc. Durante el ingreso hospitalario inicial, se emplearon cuestionarios de registro predefinidos para la recogida sistemática de los datos demográficos y de antecedentes clínicos, constantes vitales, electrocardiograma de 12 derivaciones, parámetros ecocardiográficos y de laboratorio y toma de medicamentos. La FEVI se evaluó por ecocardiografía bidimensional y se calculó mediante el método bidimensional de Simpson (96 ± 24 h tras el ingreso). Se emplearon 2 equipos disponibles en el mercado a lo largo del estudio: Agilent Sonos 5500 e ie33 (Philips Medical Systems, Massachusetts, Estados Unidos). Se definió la IC-FEc al ingreso como una FEVI ≥ 50%, alteraciones estructurales o funcionales en el ecocardiograma (dilatación de la aurícula izquierda o hipertrofia del ventrículo izquierdo) y valores elevados de péptidos natriuréticos según lo establecido en las actuales guías de práctica clínica8-10. También se registró el tratamiento al alta.
Estado diabético tipo 2 por sexoSe estableció el diagnóstico de DM2 revisando las historias clínicas de los pacientes al ingreso hospitalario inicial. Se analizó la DM2 como variable dicotómica y se clasificó a los pacientes en función del sexo en 4 grupos: a) varones sin DM2; b) varones con DM2; c) mujeres sin DM2, y d) mujeres con DM2.
Principios éticosEl estudio se atiene a las normas éticas establecidas en la Declaración de Helsinki y fue aprobado por el comité de ética local del centro hospitalario (Hospital Clínico Universitario de Valencia). Todos los pacientes dieron su consentimiento informado.
Objetivos y seguimientoEl objetivo primario fue la incidencia de la mortalidad por cualquier causa durante el seguimiento, mientras que los objetivos secundarios se centraban en la mortalidad cardiovascular, que incluía las variables muerte súbita, muerte por IC progresiva, muerte atribuible a otras causas cardiovasculares (como síndrome coronario agudo o ictus) y causa de muerte desconocida. Para el personal responsable de la asignación de los objetivos durante el seguimiento, el estado de la DM2 del paciente estaba enmascarado.
Análisis estadísticoLas variables continuas se expresan como media ± desviación estándar o mediana [intervalo intercuartílico], según procediera, y las variables categóricas, como n (%). Se compararon las variables continuas basales en función del estado diabético con la prueba de la t de Student o de la suma de rangos, según procediera, y las variables discretas, con la prueba de la χ2. Se evaluó la interacción entre el sexo y el estado diabético durante el seguimiento mediante el análisis de regresión de Cox para el objetivo primario y por el método de regresión de riesgos competitivos adaptado de Cox para la mortalidad cardiovascular11. La estimación del riesgo se expresa como hazard ratio (HR) y su intervalo de confianza del 95% (IC95%). Se analizó el conjunto de variables enumeradas en la tabla 1 como factores de confusión probables. La selección de las covariables incluidas en el modelo multivariante se realizó partiendo de los conocimientos previos o de la verosimilitud biológica con independencia del valor de p. Se determinó el supuesto de linealidad en paralelo para todas las variables continuas y la transformación de la variable, si procedía, mediante la técnica de polinomiales fraccionados. Después, se obtuvo un modelo parsimonioso reducido a partir de una selección escalonada retrógrada. El supuesto de proporcionalidad para la función de riesgo en el tiempo se evaluó por medio del análisis de los residuos de Schoenfeld. Se aplicó el estadístico C de Harrell en la estimación de la capacidad discriminatoria de los modelos multivariantes. El modelo multivariante definitivo para el objetivo primario incluyó las covariables siguientes: edad, índice de masa corporal, ingreso previo por ICA, cardiopatía isquémica, índice de Charlson, frecuencia cardiaca, fibrilación auricular, tasa de filtrado glomerular estimada, hemoglobina, sodio, fracción aminoterminal del propéptido natriurético cerebral, diámetro de la aurícula izquierda y tratamiento de la IC (inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II o de los receptores de aldosterona o bloqueadores beta). El estadístico C de Harrell de este modelo fue de 0,713. En el caso de la mortalidad cardiovascular, el modelo multivariante definitivo incluyó las covariables siguientes: edad, índice de masa corporal, ingreso previo por ICA, tasa de filtrado glomerular estimada, sodio, fracción aminoterminal del propéptido natriurético cerebral y tratamiento de la IC al alta (inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II o de los receptores de aldosterona o bloqueadores beta). El estadístico C de Harrell de dicho modelo resultó de 0,701.
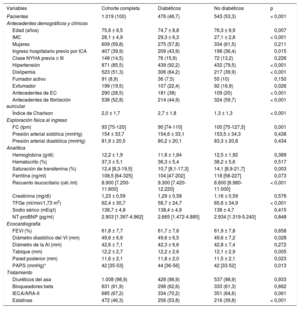
Características basales de los pacientes con IC-FEc en función del sexo
| Variables | Cohorte completa | Varones | Mujeres | p |
|---|---|---|---|---|
| Pacientes | 1.019 (100) | 410 (40,2) | 609 (59,8) | < 0,001 |
| Antecedentes demográficos y clínicos | ||||
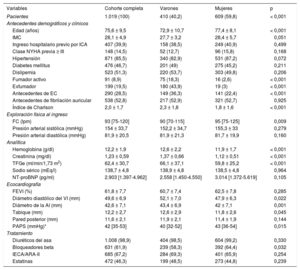
| Edad (años) | 75,6 ± 9,5 | 72,9 ± 10,7 | 77,4 ± 8,1 | < 0,001 |
| IMC | 28,1 ± 4,9 | 27,7 ± 3,2 | 28,4 ± 5,7 | 0,051 |
| Ingreso hospitalario previo por ICA | 407 (39,9) | 158 (38,5) | 249 (40,9) | 0,499 |
| Clase NYHA previa ≥ III | 148 (14,5) | 52 (12,7) | 96 (15,8) | 0,168 |
| Hipertensión | 871 (85,5) | 340 (82,9) | 531 (87,2) | 0,072 |
| Diabetes mellitus | 476 (46,7) | 201 (49) | 275 (45,2) | 0,211 |
| Dislipemia | 523 (51,3) | 220 (53,7) | 303 (49,8) | 0,206 |
| Fumador activo | 91 (8,9) | 75 (18,3) | 16 (2,6) | < 0,001 |
| Exfumador | 199 (19,5) | 180 (43,9) | 19 (3) | < 0,001 |
| Antecedentes de EC | 290 (28,5) | 149 (36,3) | 141 (22,4) | < 0,001 |
| Antecedentes de fibrilación auricular | 538 (52,8) | 217 (52,9) | 321 (52,7) | 0,925 |
| Índice de Charlson | 2,0 ± 1,7 | 2,3 ± 1,8 | 1,8 ± 1,6 | < 0,001 |
| Exploración física al ingreso | ||||
| FC (lpm) | 93 [75-120] | 90 [70-115] | 95 [75-125] | 0,009 |
| Presión arterial sistólica (mmHg) | 154 ± 33,7 | 152,2 ± 34,7 | 155,3 ± 33 | 0,279 |
| Presión arterial diastólica (mmHg) | 81,9 ± 20,5 | 81,9 ± 21,3 | 81,7 ± 19,9 | 0,160 |
| Analítica | ||||
| Hemoglobina (g/dl) | 12,2 ± 1,9 | 12,6 ± 2,2 | 11,9 ± 1,7 | < 0,001 |
| Creatinina (mg/dl) | 1,23 ± 0,59 | 1,37 ± 0,66 | 1,12 ± 0,51 | < 0,001 |
| TFGe (ml/min/1,73 m2) | 62,4 ± 30,7 | 66,1 ± 37,1 | 59,8 ± 25,2 | < 0,001 |
| Sodio sérico (mEq/l) | 138,7 ± 4,8 | 138,9 ± 4,8 | 138,5 ± 4,8 | 0,964 |
| NT-proBNP (pg/ml) | 2.903 [1.397-4.962] | 2.558 [1.450-4.550] | 3.014 [1.372-5.619] | 0,105 |
| Ecocardiografía | ||||
| FEVI (%) | 61,8 ± 7,7 | 60,7 ± 7,4 | 62,5 ± 7,8 | 0,285 |
| Diámetro diastólico del VI (mm) | 49,6 ± 6,9 | 52,1 ± 7,0 | 47,9 ± 6,3 | 0,022 |
| Diámetro de la AI (mm) | 42,6 ± 7,1 | 43,4 ± 6,9 | 42 ± 7,1 | 0,001 |
| Tabique (mm) | 12,2 ± 2,7 | 12,6 ± 2,9 | 11,8 ± 2,6 | 0,045 |
| Pared posterior (mm) | 11,6 ± 2,1 | 11,9 ± 2,1 | 11,4 ± 1,9 | 0,144 |
| PAPS (mmHg)* | 42 [35-53] | 40 [32-52] | 43 [36-54] | 0,015 |
| Tratamiento | ||||
| Diuréticos del asa | 1.008 (98,9) | 404 (98,5) | 604 (99,2) | 0,330 |
| Bloqueadores beta | 631 (61,9) | 239 (58,3) | 392 (64,4) | 0,032 |
| IECA/ARA-II | 685 (67,2) | 284 (69,3) | 401 (65,9) | 0,254 |
| Estatinas | 472 (46,3) | 199 (48,5) | 273 (44,8) | 0,239 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; EC: enfermedad coronaria; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; ICA: insuficiencia cardiaca aguda; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAPS: presión arterial pulmonar sistólica; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
Los valores expresan media ± desviación estándar, n (%) o mediana [intervalo intercuartílico].
Se efectuó un análisis de sensibilidad solo de los pacientes con DM2 con un ajuste multivariante por edad, índice de masa corporal, índice de Charlson, fibrilación auricular, frecuencia cardiaca, tasa de filtrado glomerular estimada, sodio, fracción aminoterminal del propéptido natriurético cerebral, control glucémico (glucohemoglobina [HbA1c]) y tratamiento con antidiabéticos al alta (insulina, metformina, sulfonilurea e inhibidores de la dipeptidil peptidasa 4).
Se consideró indicativo de significación estadística en todos los análisis un valor de p bilateral < 0,05. Los análisis estadísticos se efectuaron con el paquete estadístico Stata 2014, versión 14.1 (StataCorp LLC, College Station, Texas, Estados Unidos).
RESULTADOSCaracterísticas basalesDe los 1.019 pacientes con IC-FEc participantes en el presente estudio, 476 (46,7%) presentaban DM2, con prevalencias similares entre sexos (el 45,1 frente al 49,1%; p = 0,211). La media de edad de la cohorte era 75,6 ± 9,5 años, 609 (59,8%) eran mujeres y 407 (39,9%) habían ingresado previamente por ICA. La mediana [intervalo intercuartílico] de los valores de la fracción aminoterminal del propéptido natriurético cerebral se situó en 2.903 [1.397-4.962] pg/ml.
En la tabla 1 y la tabla 2 se resumen las características basales de la cohorte completa estratificadas por sexo y estado diabético respectivamente. Se hallaron diferencias entre los grupos en torno a los parámetros clínicos, bioquímicos y ecocardiográficos. En general, las mujeres eran mayores y tenían una frecuencia cardiaca más elevada, una menor tasa de filtrado glomerular estimada y presiones arteriales pulmonares más altas. Igualmente, mostraban tendencia a un índice de masa corporal superior. Por el contrario, las mujeres tenían un menor número de enfermedades concomitantes y con mayor frecuencia se les pautó al alta tratamiento con bloqueadores beta y menos con inhibidores de la enzima de conversión de la angiotensina.
Características basales de los pacientes con IC-FEc en función de la diabetes
| Variables | Cohorte completa | Diabéticos | No diabéticos | p |
|---|---|---|---|---|
| Pacientes | 1.019 (100) | 476 (46,7) | 543 (53,3) | < 0,001 |
| Antecedentes demográficos y clínicos | ||||
| Edad (años) | 75,6 ± 9,5 | 74,7 ± 8,8 | 76,3 ± 9,9 | 0,007 |
| IMC | 28,1 ± 4,9 | 29,3 ± 6,3 | 27,1 ± 2,8 | < 0,001 |
| Mujeres | 609 (59,8) | 275 (57,8) | 334 (61,5) | 0,211 |
| Ingreso hospitalario previo por ICA | 407 (39,9) | 209 (43,9) | 198 (36,4) | 0,015 |
| Clase NYHA previa ≥ III | 148 (14,5) | 76 (15,9) | 72 (13,2) | 0,226 |
| Hipertensión | 871 (85,5) | 439 (92,2) | 432 (79,5) | < 0,001 |
| Dislipemia | 523 (51,3) | 306 (64,2) | 217 (39,9) | < 0,001 |
| Fumador activo | 91 (8,9) | 36 (7,5) | 55 (10) | 0,150 |
| Exfumador | 199 (19,5) | 107 (22,4) | 92 (16,9) | 0,026 |
| Antecedentes de EC | 290 (28,5) | 181 (38) | 109 (20) | < 0,001 |
| Antecedentes de fibrilación auricular | 538 (52,8) | 214 (44,9) | 324 (59,7) | < 0,001 |
| Índice de Charlson | 2,0 ± 1,7 | 2,7 ± 1,8 | 1,3 ± 1,3 | < 0,001 |
| Exploración física al ingreso | ||||
| FC (lpm) | 93 [75-120] | 90 [74-110] | 100 [75-127,5] | 0,001 |
| Presión arterial sistólica (mmHg) | 154 ± 33,7 | 154,6 ± 33,1 | 153,5 ± 34,3 | 0,438 |
| Presión arterial diastólica (mmHg) | 81,9 ± 20,5 | 80,2 ± 20,1 | 83,3 ± 20,8 | 0,434 |
| Analítica | ||||
| Hemoglobina (g/dl) | 12,2 ± 1,9 | 11,8 ± 1,84 | 12,5 ± 1,92 | 0,389 |
| Hematocrito (%) | 37,3 ± 5,1 | 36,3 ± 5,4 | 38,2 ± 5,6 | 0,517 |
| Saturación de transferrina (%) | 12,4 [8,3-19,5] | 10,7 [8,1-17,3] | 14,1 [8,9-21,7] | 0,003 |
| Ferritina (ng/ml) | 108,5 [64-325] | 104 [47-202] | 118 [58-227] | 0,073 |
| Recuento leucocitario (cél./ml) | 8.900 [7.200-11.600] | 9.300 [7.420-12.220] | 8.600 [6.980-11.000] | < 0,001 |
| Creatinina (mg/dl) | 1,23 ± 0,59 | 1,29 ± 0,58 | 1,16 ± 0,59 | 0,576 |
| TFGe (ml/min/1,73 m2) | 62,4 ± 30,7 | 58,7 ± 24,7 | 65,6 ± 34,9 | < 0,001 |
| Sodio sérico (mEq/l) | 138,7 ± 4,8 | 138,4 ± 4,9 | 138 ± 4,7 | 0,415 |
| NT-proBNP (pg/ml) | 2.903 [1.397-4.962] | 2.665 [1.472-4.885] | 2.934 [1.319-5.240] | 0,848 |
| Ecocardiografía | ||||
| FEVI (%) | 61,8 ± 7,7 | 61,7 ± 7,6 | 61,9 ± 7,8 | 0,658 |
| Diámetro diastólico del VI (mm) | 49,6 ± 6,9 | 49,6 ± 6,5 | 49,6 ± 7,2 | 0,028 |
| Diámetro de la AI (mm) | 42,6 ± 7,1 | 42,3 ± 6,6 | 42,8 ± 7,4 | 0,272 |
| Tabique (mm) | 12,2 ± 2,7 | 12,2 ± 2,6 | 12,1 ± 2,9 | 0,005 |
| Pared posterior (mm) | 11,6 ± 2,1 | 11,8 ± 2,0 | 11,5 ± 2,1 | 0,023 |
| PAPS (mmHg)* | 42 [35-53] | 44 [36-56] | 42 [33-52] | 0,013 |
| Tratamiento | ||||
| Diuréticos del asa | 1.008 (98,9) | 428 (98,9) | 537 (98,9) | 0,933 |
| Bloqueadores beta | 631 (61,9) | 298 (62,6) | 333 (61,3) | 0,662 |
| IECA/ARA-II | 685 (67,2) | 334 (70,2) | 351 (64,6) | 0,061 |
| Estatinas | 472 (46,3) | 256 (53,8) | 216 (39,8) | < 0,001 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; EC: enfermedad coronaria; FC: frecuencia cardiaca; HbA1c: glucohemoglobina; ICA: insuficiencia cardiaca aguda; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; iDPP-4: inhibidores de la dipeptidil peptidasa 4; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAPS: presión arterial pulmonar sistólica; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
Los valores expresan media ± desviación estándar, n (%) o mediana [intervalo intercuartílico].
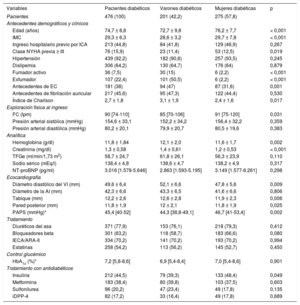
Los pacientes con DM2 estaban expuestos a más factores de riesgo cardiovascular, mayor frecuencia de ingresos previos por IC, una carga más alta de enfermedades concomitantes y una agudización más acentuada de la IC. Los pacientes diabéticos recibieron una proporción mayor de IECA/ARA-II y estatinas al alta. Entre los pacientes con DM2, las mujeres eran mayores y tenían mayor índice de masa corporal y peor clase funcional al inicio del estudio (tabla 3). En lo que respecta a los parámetros ecocardiográficos, las mujeres tenían menores diámetro y grosor parietal del ventrículo izquierdo, pero presiones arteriales pulmonares más altas.
Características basales de los pacientes con diabetes mellitus tipo 2 e IC-FEc en función del sexo
| Variables | Pacientes diabéticos | Varones diabéticos | Mujeres diabéticas | p |
|---|---|---|---|---|
| Pacientes | 476 (100) | 201 (42,2) | 275 (57,8) | |
| Antecedentes demográficos y clínicos | ||||
| Edad (años) | 74,7 ± 8,8 | 72,7 ± 9,8 | 76,2 ± 7,7 | < 0,001 |
| IMC | 29,3 ± 6,3 | 28,6 ± 3,2 | 29,7 ± 7,8 | < 0,001 |
| Ingreso hospitalario previo por ICA | 213 (44,8) | 84 (41,8) | 129 (46,9) | 0,267 |
| Clase NYHA previa ≥ III | 76 (15,9) | 23 (11,4) | 53 (12,5) | 0,019 |
| Hipertensión | 439 (92,2) | 182 (90,6) | 257 (93,5) | 0,245 |
| Dislipemia | 306 (64,2) | 130 (64,7) | 176 (64) | 0,879 |
| Fumador activo | 36 (7,5) | 30 (15) | 6 (2,2) | < 0,001 |
| Exfumador | 107 (22,4) | 101 (50,5) | 6 (2,2) | < 0,001 |
| Antecedentes de EC | 181 (38) | 94 (47) | 87 (31,6) | 0,001 |
| Antecedentes de fibrilación auricular | 217 (45,6) | 95 (47,3) | 122 (44,4) | 0,530 |
| Índice de Charlson | 2,7 ± 1,8 | 3,1 ± 1,9 | 2,4 ± 1,6 | 0,017 |
| Exploración fisica al ingreso | ||||
| FC (lpm) | 90 [74-110] | 85 [70-106] | 91 [75-120] | 0,031 |
| Presión arterial sistólica (mmHg) | 154,6 ± 33,1 | 152,2 ± 34,2 | 156,4 ± 32,2 | 0,359 |
| Presión arterial diastólica (mmHg) | 80,2 ± 20,1 | 79,9 ± 20,7 | 80,5 ± 19,6 | 0,383 |
| Analítica | ||||
| Hemoglobina (g/dl) | 11,8 ± 1,84 | 12,1 ± 2,0 | 11,6 ± 1,7 | 0,002 |
| Creatinina (mg/dl) | 1,3 ± 0,58 | 1,4 ± 0,61 | 1,2 ± 0,53 | < 0,001 |
| TFGe (ml/min/1,73 m2) | 58,7 ± 24,7 | 61,8 ± 26,1 | 56,3 ± 23,9 | 0,110 |
| Sodio sérico (mEq/l) | 138,4 ± 4,8 | 138,6 ± 4,7 | 138,2 ± 4,9 | 0,317 |
| NT-proBNP (pg/ml) | 3.016 [1.578-5.646] | 2.863 [1.593-5.195] | 3.149 [1.577-6.261] | 0,298 |
| Ecocardiografía | ||||
| Diámetro diastólico del VI (mm) | 49,6 ± 6,4 | 52,1 ± 6,6 | 47,8 ± 5,6 | 0,009 |
| Diámetro de la AI (mm) | 42,3 ± 6,6 | 43,3 ± 6,5 | 41,6 ± 6,6 | 0,806 |
| Tabique (mm) | 12,2 ± 2,6 | 12,6 ± 2,8 | 11,9 ± 2,3 | 0,006 |
| Pared posterior (mm) | 11,8 ± 1,9 | 12 ± 2,1 | 11,8 ± 1,9 | 0,025 |
| PAPS (mmHg)* | 45,4 [40-52] | 44,3 [38,8-49,1] | 46,7 [41-53,4] | 0,002 |
| Tratamiento | ||||
| Diuréticos del asa | 371 (77,9) | 153 (76,1) | 218 (79,3) | 0,412 |
| Bloqueadores beta | 301 (63,2) | 118 (58,7) | 183 (66,6) | 0,080 |
| IECA/ARA-II | 334 (70,2) | 141 (70,2) | 193 (70,2) | 0,994 |
| Estatinas | 258 (54,2) | 113 (56,2) | 145 (52,7) | 0,450 |
| Control glucémico | ||||
| HbA1c (%)* | 7,2 [5,8-8,6] | 6,9 [5,4-8,4] | 7,0 [5,4-8,6] | 0,901 |
| Tratamiento con antidiabéticos | ||||
| Insulina | 212 (44,5) | 79 (39,3) | 133 (48,4) | 0,049 |
| Metformina | 183 (38,4) | 80 (39,8) | 103 (37,5) | 0,603 |
| Sulfonilurea | 96 (20,2) | 47 (23,4) | 49 (17,8) | 0,135 |
| iDPP-4 | 82 (17,2) | 33 (16,4) | 49 (17,8) | 0,689 |
AI: aurícula izquierda; ARA-II: antagonistas del receptor de la angiotensina II; EC: enfermedad coronaria; FC: frecuencia cardiaca; HbA1c: glucohemoglobina; ICA: insuficiencia cardiaca aguda; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; iDPP-4: inhibidores de la dipeptidil peptidasa 4; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAPS: presión arterial pulmonar sistólica; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
Los valores expresan media ± desviación estándar, n (%) o mediana [intervalo intercuartílico].
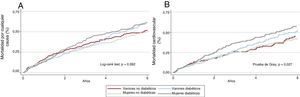
Tras una mediana de seguimiento de 3,6 [1,4-6,8] años, fallecieron 646 pacientes (63,4%). Se observaron tasas de mortalidad más altas entre los pacientes con DM2 (1,86 frente a 1,59 de cada 10 personas/año; p = 0,037). Sin embargo, las tasas de mortalidad de varones y mujeres resultaron similares (1,70 frente a 1,72 de cada 10 personas/año; p = 0,888). Al comparar los grupos clasificados en función de la DM2 y el sexo, las curvas de Kaplan-Meier mostraron una tendencia estadística al alza de mayor riesgo de mortalidad en el caso de las mujeres diabéticas (figura 2A). Estas diferencias se hallaron tras el primer año de seguimiento, pero se acentuaron a los 3 años del alta.
A: curvas de Kaplan-Meier de mortalidad por cualquier causa para la insuficiencia cardiaca con fracción de eyección conservada en función del sexo y el estado diabético. B: funciones de incidencia acumulada de mortalidad cardiovascular para la insuficiencia cardiaca con fracción de eyección conservada en función del sexo y el estado diabético.
En el análisis multivariante, tras ajustar por las variables de confusión probables (como son los factores de riesgo identificados, las enfermedades concomitantes, los biomarcadores, los parámetros ecográficos y el tratamiento al alta), el efecto pronóstico diferencial de la DM2 entre sexos resultó significativo (para la interacción, p = 0,007). La DM2 se asoció con mayor riesgo de mortalidad por cualquier causa en las mujeres (HR = 1,77; IC95%, 1,41-2,21; p < 0,001), pero no en los varones (HR = 1,23; IC95%, 0,94-1,61; p = 0,127).
Mortalidad cardiovascularDurante el seguimiento, se registraron 434 muertes cardiovasculares (un 67,2% del total de muertes). Entre los grupos clasificados por DM2 y sexo, las mujeres con DM2 mostraron la incidencia acumulada de mortalidad cardiovascular más alta (figura 2B). Tras el ajuste multivariante, que incluía la mortalidad no cardiovascular como evento adverso competitivo y los factores pronóstico definidos, las mujeres con DM2 evidenciaron un incremento del riesgo de mortalidad cardiovascular (HR = 1,74; IC95%, 1,35-2,25; p = 0,001). Sin embargo, la DM2 no confiere un exceso de riesgo en el caso de los pacientes varones (HR = 1,27; IC95%, 0,92-1,76; p = 0,150).
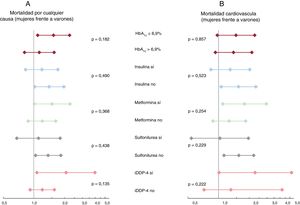
Exceso de mortalidad de las mujeres con DM2: efecto de su control y tratamientoDe 476 pacientes con DM2, se registraron 312 muertes por cualquier causa y 215 muertes cardiovasculares. La mediana de HbA1c no difirió entre mujeres y varones (el 7% [1,6] frente al 6,9% [1,5]; p = 0,365). Se pautó insulina a las mujeres con mayor frecuencia, sin que se produjeran diferencias en el tratamiento con antidiabéticos orales (tabla 3). Tras el ajuste multivariante que incluía los factores pronósticos identificados y los posibles factores de confusión (tratamiento con antidiabéticos y valores de HbA1c), la DM2 se asoció con un aumento del riesgo de mortalidad de las mujeres, pero no el de los varones. Se observó este incremento del riesgo tanto en la mortalidad por cualquier causa (HR = 1,31; IC95%, 1,02-1,69; p = 0,036) como en la mortalidad cardiovascular (HR = 1,44; IC95%, 1,06-1,94; p = 0,019). El análisis del subgrupo reveló que el efecto del sexo en los riesgos de mortalidad cardiovascular y por cualquier causa se mantuvo homogéneo a lo largo del control glucémico y del tratamiento con antidiabéticos (figura 3A y B).
DISCUSIÓNEl nuevo hallazgo significativo del presente estudio reside en que la DM2 se asoció con mayores riesgos de mortalidad cardiovascular y por cualquier causa para las mujeres con IC-FEc, pero no para los varones. Este efecto resultó independiente de otros factores de riesgo notables, como la edad, el índice de masa corporal y las comorbilidades, así como de los objetivos indirectos de agudización de la enfermedad y el tratamiento médico de la IC. Hay que añadir que también se halló exceso de riesgo para las mujeres tras ajustar por el control glucémico y el tratamiento con antidiabéticos durante el evento de referencia.
La mayor parte de los datos existentes sobre el efecto de la DM2 y la IC provienen de los pacientes con IC y FEVI reducida (IC-FEr). Los investigadores del estudio CHARM demostraron que la DM2 es un predictor independiente de la morbimortalidad en la IC-FEr y la IC-FEc, lo que apunta un efecto adverso mayor entre aquellos con IC-FEc12. El riesgo de mortalidad que confiere la DM2 se asemejó entre ambos grupos de IC-FEr e IC-FEc, pero únicamente el último estaba expuesto a mayor riesgo de ingresos por IC. En un registro prospectivo de pacientes con IC-FEr asiático, la DM se asoció en ambos sexos con mayores tasas de ingresos y mortalidad por cualquier causa, pero este efecto era más grave en el caso de las mujeres13.
En el contexto de la IC-FEc, algunos estudios previos han demostrado con solvencia que la DM2 identifica un subgrupo de pacientes con peor estado funcional y expuestos a un mayor riesgo de complicaciones clínicas14, aunque en dichos estudios no se estableció una diferencia entre mujeres y varones. De hecho, por lo que se conoce hasta el momento, el presente estudio es el primero que plantea un comportamiento más agresivo de la DM2 en el caso de las mujeres con IC-FEc. En sintonía con los hallazgos del presente estudio, y salvando las distancias propias de las características de la muestra, un subanálisis del ensayo EMPAREG también demostró que las mujeres con DM2 ingresaban por IC con mayor frecuencia que los varones15.
Se conjetura ampliamente acerca de los motivos que inducen este efecto diferencial entre los sexos. En primer lugar, se puede aducir, como se ha demostrado en otros entornos cardiovasculares, que las mujeres reciben un control glucémico y un tratamiento de la DM2 y la IC menos intensivos que los varones16-18. Sin embargo, pensamos que dicho argumento no es firme para explicar los presentes hallazgos, debido a que no existe un tratamiento bien establecido para la IC-FEc y, a excepción de la mayor prescripción de bloqueadores beta para las mujeres, no hubo diferencias en la prescripción de otros medicamentos al alta. Igualmente, y en lo que respecta al control y el tratamiento de la DM, se hallaron similares valores de HbA1c y tratamientos con antidiabéticos en ambos sexos, salvo por la mayor prescripción de insulina a las mujeres. Además, el exceso de riesgo en el caso de las mujeres no registró variación estadística tras ajustar por los tratamientos y el control glucémico al alta. No obstante, se requieren estudios adicionales que evalúen la influencia de la vigilancia, los cambios terapéuticos y el control glucémico a lo largo del seguimiento. En segundo lugar, se puede conjeturar que la DM2 y la IC se diagnostican en fases más tardías en el caso de las mujeres.
Las mujeres a menudo presentan factores de confusión, como obesidad y valores inferiores de péptidos natriuréticos, que demoran la adopción de una estrategia diagnóstica y terapéutica idónea19,20. Por último, es preciso abordar las causas cardiacas. Las mujeres con DM2 mostraron un fenotipo de IC-FEc más grave, con mayores disfunción diastólica del ventrículo izquierdo o IC del ventrículo derecho21. En efecto, las mujeres con DM2 suelen tener una presión arterial pulmonar sistólica más alta y una hipertrofia del ventrículo izquierdo más pronunciada22,23. Se ignoran las razones biológicas de estas diferencias cardiacas relacionadas con el sexo. Sin embargo, se ha demostrado el empeoramiento de la miocardiopatía diabética que afecta a un sexo en particular en ciertos estudios que miden los cambios estructurales y funcionales de los pacientes diabéticos sin cardiopatía estructural y de los pacientes cardiacos21,24. En otros estudios básicos con ratones se han confirmado dichos cambios y se han ampliado los datos a escala molecular que prueban que la disfunción cardiaca aparece con mayores celeridad y gravedad en las hembras que en los machos25. Se desconoce en parte el mecanismo patogénico que explicaría este comportamiento, aunque se han propuesto ciertas hipótesis. Según una de estas hipótesis, la hiperglucemia perjudicaría en mayor medida la estructura del ventrículo izquierdo de las mujeres23. Por otro lado, se ha planteado el descenso precoz de concentraciones de la proteína antiapoptótica Pim1 como clave molecular del empeoramiento de la miocardiopatía diabética que afecta a un sexo en particular. De hecho, la recuperación de los valores de Pim1 propició la reversión de los cambios estructurales y moleculares y aumentó la supervivencia de los cardiomiocitos de las hembras diabéticas25. Además, esta diferente respuesta a la DM2 en función del sexo se ha vinculado a la actividad estrogénica26.
LimitacionesEl presente estudio presenta ciertas limitaciones. En primer lugar, se trata de un estudio observacional unicéntrico con numerosos factores de confusión posibles. A pesar del ajuste multivariante, no se descarta totalmente la influencia de factores de confusión residuales. No obstante, este estudio observacional proporciona datos reales, que resultan en especial necesarios a la hora de estudiar a los pacientes que no están debidamente representados en los ensayos clínicos. En segundo lugar, la ausencia de un cribado uniforme de la DM2 y la escasez de información acerca de la duración de la enfermedad, tanto de la DM2 como de la IC, representan también ciertas limitaciones. En tercer lugar, en el presente estudio no se valoraron los cambios de tratamiento (para la IC y antidiabéticos) o del control glucémico en el tiempo. De este modo, no fue posible evaluar la influencia de los cambios evolutivos de estos parámetros. Siguiendo esta línea argumental y teniendo en cuenta que los inhibidores del cotransportador de sodio-glucosa de tipo 2 y los agonistas del receptor del péptido de tipo glucagón 1 estaban infrautilizados en el momento de realizarse este estudio, tampoco se pudo estimar la influencia de este grupo farmacológico en los presentes hallazgos. En cuarto lugar, es probable que la exclusión de los pacientes fallecidos durante la hospitalización inicial haya introducido algún sesgo de selección. Por último, la falta de valoración homogénea de los parámetros de la función del ventrículo derecho y de la función diastólica izquierda impidió una evaluación pormenorizada de las diferencias cardiacas entre los sexos.
CONCLUSIONESDe los pacientes con IC-FEc, la DM2 confiere mayor riesgo de mortalidad a las mujeres que a los varones. Se precisan estudios adicionales que identifiquen los mecanismos patogénicos subyacentes a estos hallazgos, el efecto diferencial para varones y mujeres y la estrategia terapéutica idónea para mejorar el pronóstico de las mujeres diabéticas con IC-FEc.
- –
La diabetes mellitus y la IC-FEc son comorbilidades frecuentes.
- –
La diabetes mellitus es un factor de riesgo en la evolución de la IC.
- –
Existe evidencia del empeoramiento de la miocardiopatía diabética que afecta a un sexo en particular.
- –
La diabetes agrava el pronóstico de las mujeres con IC-FEc, pero no el de los varones.
- –
Entre las mujeres diabéticas con insuficiencia cardiaca, se halló exceso de riesgo de mortalidad por cualquier causa, mortalidad cardiovascular e ingresos hospitalarios.
Este trabajo ha recibido financiación parcial de las subvenciones de la Sociedad Española de Cardiología: Investigación Clínica en Cardiología, Subvención SEC 2015, CIBERCV 16/11/00420, 16/11/00403, FEDER y PIE15/00013. Los autores no manifiestan otra financiación, relación financiera o conflicto de intereses alguno relacionados con este trabajo.
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses que declarar.