El desarrollo de los inhibidores del receptor plaquetario P2Y12 ha sido fundamental para el tratamiento de los pacientes con síndrome coronario agudo. En los últimos años, múltiples evidencias experimentales y clínicas sustentan que los inhibidores del receptor P2Y12 ejercen efectos pleotrópicos más allá de sus propiedades antiagregantes plaquetarias. La explicación potencial es que, aparte de en las plaquetas, el receptor P2Y12 también se encuentra en una amplia variedad de células y puede modular la respuesta inflamatoria, la función endotelial, el tono vascular y el daño por isquemia/reperfusión. Hay estudios en distintos modelos animales y algún ensayo clínico que han demostrado el potencial cardioprotector de la administración de inhibidores del receptor P2Y12 mediante un mecanismo asociado con la activación de vías de señalización implicadas en la protección miocárdica endógena (p. ej., poscondicionamiento isquémico). Sin embargo, a diferencia de los demás inhibidores del receptor P2Y12, el ticagrelor ha mostrado una vía adicional de cardioprotección a través de mecanismos relacionados con una mayor biodisponibilidad de adenosina, una molécula producida principalmente por las células endoteliales en respuesta a isquemia y con múltiples efectos cardiovasculares beneficiosos. En este capítulo se revisan brevemente las diferencias entre los mecanismos de acción de los distintos inhibidores del receptor P2Y12 y se ahonda en los efectos cardioprotectores atribuidos a estos más allá de su efecto antiagregante, en especial los asociados con la adenosina y derivados únicamente del tratamiento con ticagrelor.
Palabras clave:
El tratamiento antiagregante plaquetario doble con ácido acetilsalicílico y un inhibidor del receptor plaquetario P2Y12 ha sido fundamental para el tratamiento de pacientes con infarto agudo de miocardio (IAM) con y sin intervención coronaria percutánea 1-6. Sin embargo, la presencia de varias limitaciones con el uso de clopidogrel estimuló la búsqueda de nuevos inhibidores del receptor P2Y12, que culminó con la aparición del prasugrel y el ticagrelor. En comparación con el clopidogrel, la administración de los nuevos inhibidores de P2Y12 se asocia con índices de eventos cardiovasculares mayores e IAM más bajos 1,2. A continuación se revisan las diferentes propiedades farmacocinéticas y farmacodinámicas de los distintos inhibidores del receptor P2Y12 actualmente usados en la clínica (tabla)7.
Características de los diferentes inhibidores del receptor P2Y12 plaquetario
| Clase de fármaco | Conversión metabólica | Reversible | Vía de administración | Vida media | Posología | Restauración de la función plaquetaria | Duración de la acción | |
|---|---|---|---|---|---|---|---|---|
| Clopidogrel | Tienopiridina | Sí, profármaco | No | Oral | 6 h | Dosis de carga, 300 o 600 mg; dosis de mantenimiento, 75 mg/24 h | 5 días* | 5-10 días |
| Prasugrel | Tienopiridina | Sí, profármaco | No | Oral | 3 h | Dosis de carga, 60 mg; dosis de mantenimiento, 10 mg/24 h | 7 días | 5-10 días |
| Ticagrelor | Ciclopentil tiazolo pirimidina | No, acción directa | Sí | Oral | 7 h | Dosis de carga, 180 mg; dosis de mantenimiento, 90 mg/12 h | 3-4 días* | 1 día |
| Cangrelor | Análogo de ATP | No, acción directa | Sí | Intravenosa | 3-5 min | Dosis de carga, 30 pg/kg; dosis de mantenimiento, 4 pg/kg/min | 3-60 min | 1 h |
Las tienopiridinas clopidogrel (segunda generación) y prasugrel (tercera generación) son profármacos que, tras su metabolización hepática, generan metabolitos activos de corta duración que bloquean irreversiblemente la activación plaquetaria dependiente de la adenosina difosfato (ADP) al establecer enlaces covalentes con residuos de cisteína en el receptor plaquetario P2Y12 cerca del sitio de unión del ligando8. Los procesos de biotransformación que generan metabolitos activos difieren significativamente entre las 2 tienopiridinas9-12. El clopidogrel sufre un proceso de inactivación (~85%) por las esterasas intestinales, la glucoproteína-P (también conocida como ABCB1) regula su absorción y lo biotransforman múltiples isoenzimas del citocromo P450 (CYP450) tras pasar por 2 procesos de metabolización hepática. Estas características contribuyen a: a) una escasa biodisponibilidad del fármaco (< 10%); b) una reducida formación de metabolito activo; c) un inicio de acción lento pese a usarse dosis de carga; d) un grado de inhibición de la función plaquetaria inducida por ADP del 40 al 50% tras repetidas dosis de mantenimiento, y e) una gran variabilidad interindividual de respuesta al fármaco debida a la presencia de polimorfismos tanto en la glucoproteína-P como en las diferentes isoenzimas de CYP450 (principalmente CYP2C19).
El prasugrel, por el contrario, se activa por esterasas intestinales, no se une a la glucoproteína-P y requiere un solo paso metabólico de las isoenzimas de CYP450 (CYP3A4 y CYP2B6). Por consiguiente, comparado con el clopidogrel, el prasugrel: a) presenta mayor biodisponibilidad (~75-80%); b) alcanza más rápidamente un profundo grado de inhibición plaquetaria inducida por ADP (~80%) tras dosis de mantenimiento, y c) produce una respuesta de inhibición plaquetaria mucho más predecible10,12-15. Sin embargo, hay que resaltar que, dado que el prasugrel es mucho más potente que el clopidogrel, se tarda más que con este en recuperar la función plaquetaria tras la suspensión del tratamiento. De hecho, la guía actual recomienda periodos de espera antes de una cirugía de 5 y de 7 días tras suspender el tratamiento con clopidogrel y prasugrel respectivamente16 (la ficha técnica dice 7 días).
Inhibidores reversibles del receptor P2Y12El ticagrelor es un compuesto que pertenece a la clase química denominada ciclopentiltriazolopirimidinas y actúa uniéndose de manera reversible al receptor plaquetario P2Y12 en un sitio diferente del ADP17. Por lo tanto, no impide la unión del ligando, pero imposibilita el cambio conformacional del receptor P2Y12 inducido tras la unión del ADP y por consiguiente su activación/señalización18. Esta propiedad hace que el ticagrelor tenga una vida media de 7 a 12 h, por lo que debe administrarse 2 veces al día19. En comparación con el clopidogrel, el ticagrelor comparte con el prasugrel una inhibición plaquetaria más profunda (~80%), precoz (2 h) y constante tras la estimulación con ADP20,21, lo que se traduce en un mayor beneficio clínico22. Merece destacar que la administración del ticagrelor triturado deriva en una inhibición plaquetaria más temprana (1 h) que con los comprimidos estándar23. Se considera que este perfil farmacodinámico rápido, potente y predecible resulta de sus características farmacocinéticas. En este aspecto, al contrario que las tienopiridinas, el ticagrelor es activo directamente, es decir, no es un profármaco. Su biodisponibilidad tras la ingestión oral es de aproximadamente el 36%. Además, la metabolización del ticagrelor se produce a través de isoenzimas de CYP450 (CYP3A4 y 3A5) que lo convierten en un metabolito activo (AR-C124910XX) equipotente al compuesto original y con un perfil farmacocinético similar24. De hecho, un 30-40% del efecto antiagregante plaquetario del ticagrelor se atribuye al AR-C124910XX25. Además, dado su metabolismo, su actividad antiagregante no se ve afectada por la presencia de polimorfismos en CYP2C1926,27. Finalmente, la naturaleza reversible del ticagrelor hace que se requiera suspender la administración del fármaco durante solo 3-4 días antes de la cirugía19 (la ficha técnica dice 7 días).
Entre los inhibidores reversibles del receptor P2Y12 también se encuentra el cangrelor, que tiene una estructura química similar a la del ticagrelor; sin embargo, a diferencia de los demás inhibidores del receptor P2Y12, el cangrelor es solo para uso intravenoso28,29. Por ello, el cangrelor se presenta como una buena opción para los pacientes con infarto que no pueden tomar medicamentos orales (inconsciencia, sedación, náuseas o vómitos) o están tratados con morfina30. Dado que no es un profármaco y que su administración es intravenosa, alcanza un grado óptimo y potente (~88%) de inhibición plaquetaria en cuestión de minutos y no presenta ni variabilidad de respuesta ni interacciones farmacológicas relevantes. De hecho, el cangrelor muestra un perfil farmacocinético lineal dependiente de la dosis31. La vida media del cangrelor es muy corta (3-5 min), se metaboliza rápidamente a través de un proceso de desfosforilación a partir de una endonucleotidasa localizada en el endotelio vascular y, por ello, la función plaquetaria se recupera en 30-60 min después de parar su infusión.
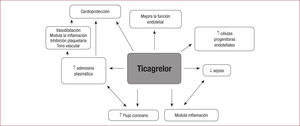
Efectos Extraplaquetarios de los Inhibidores del Receptor P2Y12Durante los últimos años ha habido múltiple evidencia experimental y clínica de que los inhibidores del P2Y12, además de sus propiedades antiagregantes plaquetarias, ejercen efectos derivados del bloqueo del receptor P2Y12 que también está en gran variedad de células, como las del músculo liso vascular, los leucocitos, los macrófagos, las células de la microglía y las células dendríticas32-36. Se ha demostrado la capacidad de los inhibidores de P2Y12 de mejorar la función endotelial37, modular la inflamación38,39 y el tono vascular40 y de ejercer efectos protectores contra el daño por isquemia/reperfusión41-43. Precisamente es en torno a los mecanismos relacionados con la cardioprotección que los inhibidores del receptor P2Y12 han recibido gran atención de la comunidad científica y cardiológica durante los últimos años.
Efectos cardioprotectores asociados a los inhibidores del receptor P2Y12Múltiples estudios experimentales y algún ensayo clínico han señalado que los inhibidores del receptor P2Y12 tienen efectos cardioprotectores más allá de sus efectos antiagregantes. De hecho, se ha demostrado que la administración de clopidogrel, prasugrel, ticagrelor y cangrelor reduce el tamaño del infarto en modelos experimentales41-45, a pesar de que las propiedades cardioprotectoras asociadas con clopidogrel y prasugrel no han sido concordantes43,46.
En clínica, solo se han realizado estudios con clopidogrel en los que se ha observado que la administración de una dosis de carga (especialmente la de 600 mg) reduce la liberación de enzimas de daño cardiaco (p. ej., la isoenzima MB de la creatincinasa y troponinas) en pacientes con IAM con elevación del ST (IAMCEST). Sin embargo, se desconoce si estos efectos beneficiosos derivan de un efecto cardioprotector o de una mejora en el flujo coronario fruto de sus propiedades antiagregantes47,48.
Aunque los mecanismos por los que los inhibidores de P2Y12 ejercen sus efectos cardioprotectores son en gran medida desconocidos, se ha propuesto que se relacionan con la activación de las vías endógenas de cardioprotección vinculadas con el poscondicionamiento isquémico41,42,47,49. El poscondicionamiento isquémico consiste en breves episodios de reoclusión coronaria aplicada al inicio de la reperfusión que involucran la activación de receptores de membrana, entre los que se hallan los receptores de la adenosina, y derivan en la activación de vías de señalización cardioprotectoras50,51. Se ha demostrado en distintos modelos experimentales que la aplicación del poscondicionamiento isquémico tiene un efecto cardioprotector potente y constante. La implementación del poscondicionamiento isquémico ha reducido el tamaño del infarto en algunos ensayos clínicos, aunque no en todos. Ha sido eficaz sobre todo en pacientes que iban a someterse a implante de stent o con un tiempo entre la aparición de los síntomas y la revascularización < 6 h52. Se ha postulado que la variabilidad en la eficacia observada con la implementación del poscondicionamiento isquémico, además de atenuarse por la presencia de comorbilidades50, también está determinada por las dosis de antiagregantes plaquetarios administrada. De este modo, se ha señalado que la administración de una dosis óptima de un inhibidor del receptor P2Y12 puede condicionar el corazón antes de la revascularización, con lo que se descartaría cualquier posible efecto del poscondicionamiento isquémico, pues ambas estrategias actuarían en las mismas vías de señalización cardioprotectora52.
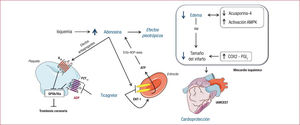
Efectos cardioprotectores asociados únicamente con ticagrelor: papel de la adenosinaEn el estudio clínico multicéntrico y aleatorizado PLATO53, se demostró superioridad del ticagrelor frente al clopidogrel en pacientes con síndrome coronario agudo (SCA), pues redujo la morbilidad y la mortalidad cardiovasculares y con similar incidencia de hemorragias mayores relacionadas con la cirugía de revascularización coronaria53,54. Además, un estudio post hoc del ensayo PLATO indicó que el ticagrelor, comparado con el clopidogrel, reduce la muerte súbita53, así como el riesgo de eventos isquémicos recurrentes, incluida la muerte cardiovascular y coronaria, en pacientes diabéticos con antecedentes de IAM55. A pesar de que sus ventajas farmacocinéticas/farmacodinámicas pueden contribuir a explicar la clara superioridad clínica del ticagrelor sobre el clopidogrel, se ha demostrado que el ticagrelor ejerce efectos beneficiosos derivados tanto del bloqueo extraplaquetario del receptor P2Y12 como de su capacidad singular de incrementar la biodisponibilidad de adenosina (figura 1 y figura 2). El ticagrelor inhibe la captación celular de adenosina inhibiendo un receptor, el transportador de nucleósidos equilibrador tipo 1 (ENT-1), presente en los glóbulos rojos56. Este bloqueo previene la captación de adenosina por los hematíes, con lo cual aumenta su concentración extracelular y su actividad biológica, particularmente en los sitios de isquemia y lesión tisular en los que se libera la adenosina como respuesta a la falta de oxígeno57. Por otro lado, se ha propuesto que el ticagrelor puede inducir la liberación de ATP por los glóbulos rojos58. Una vez en el torrente sanguíneo, el ATP liberado se degrada a adenosina por enzimas ecto-ADP-ásicas (CD39 y CD73) presentes en las células endoteliales (mayoritariamente), los leucocitos y los propios eritrocitos. En ambos casos, el ticagrelor induce un incremento en las concentraciones locales de adenosina. Se ha demostrado que la adenosina produce una amplia gama de beneficios en el sistema cardiovascular, como vasodilatación, disminución de la adhesión de leucocitos a la pared del vaso, inhibición de la agregación plaquetaria y protección contra el daño por infarto (figura 1 y figura 2)59. De hecho, actualmente el ensayo REDUCE-MVI60 y el estudio PREDICT61 están evaluando si el ticagrelor, a través de los mecanismos mediados por ENT-1/adenosina, mejora la función microvascular de, respectivamente, los pacientes con IAMCEST y los diabéticos que van a someterse a procesos de revascularización.
Efectos cardioprotectores del ticagrelor. La isquemia induce un incremento en la liberación de adenosina. El ticagrelor, mediante el bloqueo del receptor ENT-1 presente en los eritrocitos, previene que los eritrocitos capten adenosina. Además, el ticagrelor induce que los eritrocitos liberen adenosina trifosfato (ATP), que se convierte en adenosina por la actividad endotelial de las ecto-ADP-asas. Estas acciones del ticagrelor producen una mayor biodisponibilidad de adenosina en la zona isquémica que, además de inducir la inhibición plaquetaria, tiene efectos protectores directos en el corazón y previene el daño miocárdico inducido por el infarto agudo de miocardio. Concretamente, limita la formación de edema (efecto de la reducción de acuaporina-4 y la mayor actividad de AMPK) y reduce el tamaño final del infarto, efecto de la mayor actividad de la ciclooxigenasa 2 (COX2) y la consiguiente liberación de prostaciclina (PGI2). ADP: adenosina difosfato; AMPK: proteincinasa activada por adenosina monofosfato; GPIIb/IIIa: glucoproteína IIb/IIIa; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; RM: resonancia magnética.
En cuanto a las propiedades cardioprotectoras, se ha demostrado en un modelo de oclusión coronaria transitoria en ratas que el ticagrelor disminuye el tamaño del infarto62 y mejora la función cardiaca transcurridas 4 semanas a través de un mecanismo dependiente de adenosina43. Cabe destacar que, en estos estudios en roedores, el tratamiento con clopidogrel no resultó en efecto cardioprotector alguno43,62. Recientemente nuestro grupo ha estudiado en un modelo preclínico de IAM el potencial cardioprotector del ticagrelor y el clopidogrel mediante evaluación con resonancia magnética cardiaca. Realizar estudios en un modelo animal con un sistema cardiovascular y un patrón de evolución de infarto muy similares a los humanos63, junto con el uso de resonancia magnética que permite precisar los posibles efectos cardiacos estructurales y funcionales, aproxima los resultados a la clínica humana. Respecto a los resultados en los animales que no recibieron tratamiento antiagregante plaquetario, tanto el ticagrelor como el clopidogrel mejoraron la viabilidad miocárdica; a pesar de esto, nuestro estudio demuestra que a las 24 h del IAM el tratamiento con ticagrelor redujo el tamaño del infarto en mayor medida que el clopidogrel62. Es más, el ticagrelor, a diferencia del clopidogrel, fue capaz de limitar la formación de edema miocárdico posinfarto. El edema miocárdico es una consecuencia patológica relacionada con la isquemia y la posterior revascularización del corazón infartado y contribuye en gran medida a la muerte del miocardiocito64. Se observó una clara correlación entre el tamaño del infarto y la presencia de edema62. Cabe destacar que ambos fármacos se administraron a dosis que ejercían un grado similar de inhibición plaquetaria, con lo que se excluyó cualquier efecto miocárdico derivado de la inhibición plaquetaria. También se demostró que los efectos cardioprotectores derivados del tratamiento con ticagrelor (reducción de la necrosis y el edema miocárdicos) estaban mediados por la adenosina. En este aspecto, y en consonancia con estudios previos, se observó que el ticagrelor, vía un incremento en la biodisponibilidad de adenosina, incrementa en el miocardio infartado la actividad de la enzima ciclooxigenasa 2 (COX2), con la consiguiente liberación de prostaciclina (PGI2), una molécula con importantes propiedades vasoprotectoras y vasodilatadoras (figura 2)62. Estas observaciones pueden contribuir a explicar parcialmente la reducción en la eficacia del ticagrelor observada en pacientes norteamericanos, para quienes la dosis de mantenimiento de ácido acetilsalicílico recetada suele ser > 300 mg, lo cual inhibe la actividad de COX262,65. Es más, estos hallazgos sustentan un posible beneficio derivado del tratamiento crónico con ticagrelor y dosis diarias de ácido acetilsalicílico bajas (80-100 mg), que no afectan a la actividad de la enzima. De hecho, el reciente ensayo multicéntrico y aleatorizado PEGASUS-TIMI-54 concluyó que la administración conjunta de ácido acetilsalicílico a dosis baja y ticagrelor (90 mg/12 h o 60 mg/12 h) a pacientes (> 21.000) con antecedentes de infarto de miocardio o con alto riesgo (definido como paciente mayor, diabético, con enfermedad renal crónica o enfermedad multivaso) redujo significativamente los eventos cardiovasculares66.
Nuestro estudio también arroja luz sobre otros posibles efectos beneficiosos relacionados con la capacidad del ticagrelor de reducir la formación de edema mediante mecanismos asociados con la adenosina. Concretamente, el tratamiento con ticagrelor se asoció con mayor activación de la vía de señalización de la proteincinasa activada por adenosina monofosfato (AMPK) y una reducción en la expresión de acuaporina-4 en el miocardio infartado (figura 2). Tanto la AMPK como la acuaporina-4 son proteínas que regulan la formación del edema, y su actividad/expresión está modulada por la adenosina.
Específicamente, la AMPK es un complejo enzimático del que se ha demostrado que, además de actuar como un sensor clave del estado de energía en momentos de estrés (p. ej., isquemia)67, previene la formación de edemas ventriculares68. Es más, estudios recientes han propuesto que la activación de la AMPK también protege contra el daño y la inflamación tisular inducidos por sepsis69. En línea con estas observaciones, un análisis post hoc del ensayo PLATO ha demostrado que el tratamiento con ticagrelor reduce la mortalidad por sepsis de los pacientes con SCA70. Por otro lado, se ha demostrado que la acuaporina-4, una proteína de membrana implicada en el transporte de moléculas de agua, es la principal causa del edema posinfarto71,72. Nuestros resultados no excluyen que el ticagrelor, al igual que el clopidogrel, pueda haber tenido un efecto de poscondicionamiento isquémico a través de la inhibición de P2Y12. De hecho, en nuestro estudio en cerdos, ambos antiagregantes plaquetarios (clopidogrel y ticagrelor) redujeron el tamaño de la lesión agudamente tras la inducción de IAM, en comparación con los animales no tratados. Sin embargo, también pone de relieve la existencia de un efecto cardioprotector adicional y único relacionado con la capacidad del ticagrelor de incrementar la biodisponibilidad de adenosina, un factor clave para alcanzar cardioprotección. En este aspecto, la administración exógena de un bolo de adenosina durante la reperfusión en el ámbito clínico ha tenido resultados discordantes y la mayoría desalentadores, posiblemente por la corta (segundos) semivida de la adenosina, que los glóbulos rojos captan rápidamente, con lo que se reduce su biodisponibilidad en el área de isquemia73. Por el contrario, un estudio reciente en ratas ha demostrado que la administración conjunta de ticagrelor y rosuvastatina (un activador de la ecto-5'-nucleotidasa CD73 que facilita la conversión de ATP en adenosina) induce un efecto sinérgico en la reducción del tamaño del infarto asociado con un incremento de las concentraciones plasmáticas de adenosina46.
Finalmente, también cabe mencionar los efectos secundarios del tratamiento con ticagrelor, como disnea y pausas ventriculares; se ha postulado que podrían derivar del incremento en las concentraciones plasmáticas de adenosina. Es este aspecto, la administración de teofilina, un inhibidor del receptor de adenosina, se ha mostrado capaz de revertir la sensación de disnea74,75. Se ha planteado la hipótesis de que la disnea podría ser el resultado de la inhibición de P2Y12 en las neuronas sensoriales, especialmente cuando se utiliza un inhibidor reversible de P2Y12 como el ticagrelor76. De todos modos, sí se sabe que la disnea inducida con ticagrelor no está causada por alteraciones de la función cardiaca o pulmonar, que generalmente es transitoria y leve, tiende a ocurrir tempranamente tras comenzar el tratamiento y conduce a la interrupción prematura de este solo en un pequeño porcentaje de pacientes77. Por otro lado, las pausas ventriculares son mayoritariamente asintomáticas, nocturnas y sin consecuencias clínicas75 (véase en la ficha técnica las advertencias y precauciones especiales en el empleo).
Conclusiones y Direcciones FuturasHay múltiple evidencia de que, más allá de su primordial función antiagregante plaquetaria, los inhibidores del receptor P2Y12 tienen potencial para ejercer efectos beneficiosos en el marco del SCA, ya sea mediante el bloqueo extraplaquetario del receptor o un incremento en la biodisponibilidad de adenosina, característica solo atribuida al ticagrelor y que refuerza su superioridad sobre el clopidogrel en el ensayo PLATO53. Sin embargo, los esfuerzos aún siguen centrados no solo en dilucidar los mecanismos subyacentes a las acciones extraplaquetarias de los distintos inhibidores de P2Y12, sino en confirmar que estas acciones se producen en humanos. Es necesario determinar las implicaciones clínicas de estos efectos cardioprotectores para optimizar el tratamiento de los pacientes con SCA sometidos a angioplastia primaria e ir hacia una personalización del tratamiento identificando los subgrupos de pacientes que podrían obtener mayor beneficio con un inhibidor del receptor P2Y12 específico. Asimismo hay que examinar si las propiedades cardioprotectoras atribuidas al bloqueo del receptor P2Y12 podrían verse atenuadas por comorbilidades y comedicaciones, como sucede con el poscondicionamiento isquémico.
AgradecimientosAgradecemos el continuo apoyo de la Fundación de Investigación Cardiovascular y la Fundación Jesús Serra.
FinanciaciónEl trabajo analizado en esta revisión ha sido financiado por el Programa Nacional de Salud (SAF2016-76819R concedido a LB; SAF2015-71653R concedido a GV) del Ministerio de Ciencia e Innovación; una beca de la Sociedad Española de Cardiología (Beca FEC Investigación Básica 2016 a GV); CIBERCV (LB, GV) del Instituto de Salud Carlos III; FEDER «Una Manera de Hacer Europa», Fundació La Marató de TV3 (155/U/2015 a GV) «CERCA Programme/Generalitat de Catalunya».
Conflicto de InteresesL. Badimon y G. Vilahur han disfrutado de un proyecto de investigación competitivo de AstraZeneca, Suecia, para estudiar los efectos cardioprotectores del ticagrelor.