La identificación del riesgo isquémico del paciente con infarto es determinante para ayudar a decidir, desde el ingreso hospitalario, las mejores estrategias de abordaje, así como el tratamiento antiagregante óptimo que contribuirá a mejorar el pronóstico. Esta medición del riesgo, potenciada en los últimos años, aporta una evaluación cuantitativa con información sobre el pronóstico de los pacientes en el corto y largo plazo. En este artículo se revisa cómo valorar el riesgo isquémico de los pacientes ingresados por infarto, las escalas más utilizadas y la valoración del riesgo residual del paciente con infarto, además de cómo identificar a los pacientes con elevado riesgo a medio y largo plazo. Se discutirá también la importancia de las características angiográficas y de la revascularización percutánea en el pronóstico de estos pacientes.
Palabras clave:
Durante los últimos 30 años, el abordaje de los pacientes que han sufrido un infarto agudo de miocardio (IAM) ha experimentado grandes mejoras1. Hasta la década de los años ochenta, el tratamiento se limitaba a proporcionar alivio sintomático y el tratamiento de complicaciones como las arritmias, la insuficiencia cardiaca o la angina posinfarto. Posteriormente, la introducción del tratamiento antitrombótico con ácido acetilsalicílico y fibrinolisis sistémica (o intracoronaria) resultó en reducciones significativas de la mortalidad de los pacientes con IAM con elevación del segmento ST (IAMCEST). En la década de los noventa, se introdujo gradualmente la angioplastia coronaria percutánea; actualmente la intervención coronaria percutánea primaria es el tratamiento de elección para los pacientes que han sufrido un IAMCEST.
En el mismo periodo, se fueron incorporando y consolidando el tratamiento antitrombótico y anticoagulante, la mejor estratificación del riesgo y la revascularización coronaria en el síndrome coronario agudo (SCA) sin elevación del segmento ST (SCASEST).
Además, se generalizó el uso en prevención secundaria de fármacos de demostrada eficacia pronóstica, como el ácido acetilsalicílico, los inhibidores de P2Y12, los bloqueadores beta, los hipolipemiantes y los inhibidores del eje renina-angiotensina-aldosterona para los pacientes con disfunción sistólica del ventrículo izquierdo o con alto riesgo.
En combinación, todos estos desarrollos remodelaron el mapa de tratamiento del paciente con IAM y contribuyeron enormemente a mejorar su pronóstico.
Un registro multicéntrico holandés, de más de 14.000 pacientes con IAM incluidos en el periodo 1985-2008, mostró una reducción de la mortalidad ajustada a 30 días del 80% (odds ratio [OR] = 0,20; intervalo de confianza del 95% [IC95%], 0,14-0,28) durante el periodo 2000-2008 comparado con el periodo 1985-19902.
La espectacular mejora pronóstica en el IAM se ha demostrado también en un registro nacional danés, que incluyó a más de 230.000 pacientes hospitalizados por un primer episodio de IAM entre 1984 y 20083: la mortalidad ajustada a 30 días se redujo en un 63% (hazard ratio [HR] = 0,37; IC95%, 0,35-0,38) entre los periodos 2004-2008 y 1984-1988. A 1 año de seguimiento, se observó también una reducción de la mortalidad ajustada del 52% (HR = 0,48; IC95%, 0,47-0,51).
No cabe duda de que las mejoras previas en la mortalidad han resultado de cambios en el tratamiento médico farmacológico e intervencionista4-7.
Los eventos adversos durante el curso evolutivo de los pacientes que han sufrido un IAM suelen condensarse en los primeros meses tras el evento inicial8-11. De hecho, el pronóstico a corto-medio plazo tras un IAM es una de las áreas más estudiadas en cardiología. Sin embargo, el envejecimiento de la población mundial y la creciente prevalencia de supervivientes al IAM a largo plazo han hecho que aumente la carga de la enfermedad12,13.
Por otro lado, después del primer año de sufrir un IAM, el tratamiento antiagregante plaquetario doble, entre otros fármacos de prevención secundaria, así como la rehabilitación cardiaca y el seguimiento cardiológico a menudo se interrumpen y la adhesión en general a las medidas de prevención secundaria se debilita, lo que a su vez facilita la aparición de nuevos eventos cardiovasculares14. De este modo, el estudio del pronóstico a largo plazo se ha convertido en una prioridad en la cardiología actual.
Riesgo Residual del Paciente Con iamVarios estudios contribuyeron al conocimiento de la carga de eventos adversos a largo plazo en el IAM. Fox et al.15 analizaron la incidencia de eventos cardiovasculares a 5 años en una cohorte de más de 3.500 pacientes con SCA. Se empleó intervención coronaria percutánea en el 50% de los pacientes con IAM sin elevación del segmento ST (IAMSEST) y el 69% con IAMCEST. Al cabo de 5 años, el 53,6% de los pacientes reingresaron por un nuevo SCA. La tasa de nuevas revascularizaciones durante el seguimiento fue del 17%.
Cabe resaltar que en el estudio de Fox et al.15 se incluyó a pacientes con SCA inscritos en 1999-2009, y se podría especular que la revascularización coronaria que se usó solo en el 50% de los pacientes durante el evento índice pudo exagerar la tasa de recidivas. Por otro lado, este estudio no distingue entre eventos cardiovasculares durante el primer año y después.
En un estudio sueco, Jernberg et al.16 estudiaron la incidencia de eventos cardiovasculares durante el primer año y los años sucesivos en aquellos que se mantuvieron libres de eventos durante el primer año. En los 108.315 pacientes con IAM estudiados entre 2006 y 2011, la tasa de revascularización con intervención coronaria percutánea o cirugía durante la hospitalización fue del 50%. Durante el primer año, la incidencia del evento combinado (IAM no mortal, ictus no mortal o muerte cardiovascular) fue del 18,3% (el 55,5% fue a expensas de IAM y el 31%, por muerte cardiovascular). En cambio, la incidencia de complicaciones en los que se mantuvieron libres de eventos durante el primer año y a los que se siguió 2,5 años fue del 20% (IAM, 40,8%; muerte cardiovascular, 40,6%). Los hallazgos de este estudio ponen de relieve el elevado riesgo de eventos recurrentes más allá del primer año que tuvo lugar en 1 de cada 5 pacientes.
En un centro de España, Abu-Assi et al.11 estudiaron en más de 4.500 pacientes con SCA (2003-2010) la incidencia de eventos cardiovasculares durante el primer año y, en los pacientes que se mantuvieron libres de eventos durante el primer periodo de seguimiento, los años sucesivos. A diferencia de los 2 estudios previos, el porcentaje de revascularizaciones durante el evento índice fue de aproximadamente un 70%. La incidencia acumulada de IAM no mortal, ictus no mortal o muerte cardiovascular durante el primer año fue del 7,3% (la mayoría de los eventos [185/329] se produjeron a expensas de reIAM). En contraste, el objetivo final del estudio se observó en el 21,5% de los pacientes libres de eventos durante el primer año, con un seguimiento de 4,9 ± 2,4 años. De este estudio se puede concluir que aproximadamente 1 de cada 14 pacientes que sufren un SCA y sobreviven a la fase de hospitalización tendrá un IAM, un ictus o morirá de causa cardiovascular durante el primer año, mientras que, de los que sobreviven al primer año y se mantienen libres de eventos, 1 de cada 5 sufrirá un IAM, un ictus o morirá de causa cardiovascular. La mayoría de los eventos registrados en este estudio fueron en forma de IAM, lo cual está en línea con otros estudios15,16 y es de especial relevancia, dado que la enfermedad coronaria es la causa de muerte más frecuente en Europa y el IAM es el principal factor que contribuye a ello.
Además, recientemente esta escala propuesta por Abu-Assi et al.11 se ha validado en una población externa y ha mostrado una capacidad de discriminación y una calibración aceptables, lo que indica su posible utilidad para estratificar a los pacientes con SCA17.
A diferencia de los 3 estudios anteriormente analizados, Rapsomaniki et al.18 estudiaron el riesgo de eventos adversos de los pacientes con IAM sin eventos durante el primer año. Este estudio multicéntrico, con participación de Suecia, Reino Unido, Francia y Estados Uni-dos, incluyó a más de 220.000 pacientes. A los 3 años de seguimiento, la incidencia ajustada del evento combinado varió del 24,4% (Francia) al 25,9% (Suecia). La conclusión más importante que se puede extraer de este estudio es que hay un elevado riesgo de recurrencia después del primer año de sufrir un IAM, con independencia del país y el sistema sanitario.
En conjunto, los estudios previos apuntan a que los pacientes que han sufrido un IAM tienen un elevado riesgo residual de nuevos eventos cardiovasculares tanto durante el primer año como a más largo plazo. Además, los resultados de los estudios previos llevan un mensaje importante para los clínicos: incluso varios años después del IAM índice, los pacientes siguen teniendo un alto riesgo de IAM y muerte y pueden beneficiarse de la prevención secundaria a largo plazo.
Identificación de Pacientes Con iam de Alto Riesgo ISQUÉMico a Largo PlazoNo cabe duda de que los pacientes que sufren un evento coronario agudo son una población a la que siempre se tendrá que considerar en riesgo. Sin embargo, el riesgo de sufrir nuevos eventos y muerte es heterogéneo, por lo que la estratificación del riesgo de futuros eventos adversos es de especial importancia. La correcta estratificación del riesgo de recidivas podría ayudar a los clínicos a optimizar el uso de recursos sanitarios y reducir la elevada carga de riesgo residual de eventos recurrentes.
En este sentido, los determinantes de que se produzcan nuevos eventos adversos a largo plazo se han estudiado ampliamente en los últimos años9,15-18. Sin embargo, cabe destacar que la mayoría de esos estudios no distinguieron entre eventos durante el primer año y después. Caracterizar el curso evolutivo después de un SCA en relación con la ocurrencia de los principales eventos cardiovasculares adversos e identificar los precursores de dichos eventos podrían ayudar a individualizar el seguimiento clínico y evaluar la efectividad de los tratamientos, además de optimizar la asignación de recursos.
Dos estudios han evaluado de manera diferencial los predictores de IAM no mortal, ictus no mortal y muerte cardiovascular durante o después del primer año11,16. En la tabla 1 se resumen dichos predictores y la magnitud de su efecto en la ocurrencia de los eventos estudiados. Cabe destacar que en el estudio de Jernberg et al.16 los predictores de los eventos ocurridos durante el primer año fueron prácticamente los mismos que para los registrados después.
Predictores independientes de eventos adversos durante o después del primer ano
| Predictores independientes de eventos adversos (IAM no mortal, ictus no mortal o muerte cardiovascular) durante el primer ano comparado con después, según Jernberg et al. 16 y Abu-Assi et al. 11.Predictor | Primer ano HR (IC95%) | Anos sucesivos HR (IC95%) |
|---|---|---|
| Jernberg et al.16 | ||
| Edad | ||
| 60-69 anos | 1,37 (1,30-1,45) | 1,44 (1,34-1,56) |
| 70-79 anos | 2,13 (2,03-2,24) | 2,35 (2,19-2,52) |
| > 80 anos | 3,96 (3,78-4,15) | 4,91 (4,58-5,25) |
| Mujer | 0,91 (0,89-0,93) | 0,88 (0,85-0,91) |
| IAM previo | 1,44 (1,40-1,49) | 1,31 (1,26-1,37) |
| Ictus previo | 1,49 (1,44-1,54) | 1,51 (1,44-1,59) |
| Diabetes mellitus | 1,37 (1,34-1,40) | 1,47 (1,42-1,52) |
| Insuficiência cardiaca previa | 1,57 (1,53-1,61) | 1,68 (1,62-1,74) |
| Angina inestable previa | 1,13 (1,08-1,17) | 1,00 (0,96-1,05) |
| Sin revascularization durante el evento índice | 1,88 (1,83-1,93) | 1,92 (1,84-1,99) |
| Abu-Assi et al.11 | ||
| Edad (cada 1 ano de incremento) | 1,03 (1,01-1,03) | 1,03 (1,02-1,05) |
| Tabaquismo | 1,40 (1,01-1,94) | — |
| Diabetes mellitus | 1,32 (1,04-1,67) | 1,25 (1,05-1,50) |
| Arteriopatía perifèrica | — | 1,36 (1,06-1,73) |
| Ictus/AIT previos | — | 1,47 (1,12-1,97) |
| Cardiopatia isquèmica previa | 1,53 (1,21-1,94) | 2,04 (1,43-2,92) |
| Historia de fibrilación auricular | 1,50 (1,16-1,95) | |
| Historia de insuficiencia cardiaca | 2,05 (1,58-2,65) | 1,42 (1,15-1,75) |
| Creatinina sèrica (cada 1 mg/dl de incremento) | — | 1,25 (1,15-1,37) |
| IAMSEST | 1,50 (1,18-1,90) | 1,21 (1,02-1,43) |
| Enfermedad coronaria multivaso significativa | 1,59 (1,24-2,05) | 1,21 (1,01-1,51) |
| Sin revascularización durante el evento índice | — | 1,27 (1,05-1,55) |
AIT: accidente isquémico transitorio; HR: hazard ratio; IAM: infarto agudo de miocardio; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IC95%: intervalo de confianza del 95%.
Predictores independientes de eventos adversos (IAM no mortal, ictus no mortal o muerte cardiovascular) durante el primer año comparado con después, según Jernberg et al. 16 y Abu-Assi et al. 11.
En la serie de Abu-Assi11, los predictores de IAM, ictus o muerte cardiovascular consistieron en una interacción de factores de riesgo clásicos (edad, tabaquismo y diabetes mellitus), marcadores de la carga ateroesclerótica (cardiopatía isquémica previa, ictus/accidente isquémico transitorio previos, arteriopatía periférica y deterioro renal), además de indicadores de extensión de la enfermedad coronaria (IAMSEST e insuficiencia cardiaca).
Entre los predictores independientes de eventos después del primer año, se encuentran los 5 criterios de inclusión del estudio PEGASUS-TIMI 5419 y 5 de los 8 ítems que configuran la escala DAPT20.
Por lo tanto, actualmente se dispone de información sobre los determinantes del pronóstico de los pacientes con IAM más allá del primer año. El elevado riesgo de eventos recurrentes se ha visto recientemente reducido en 2 ensayos clínicos con la prolongación más de 1 año del tratamiento antiagregante plaquetario doble de pacientes con IAM19,21. De este modo, el uso del tratamiento doble más allá del primer año en pacientes con alto riesgo de eventos adversos brinda una oportunidad para mejorar el pronóstico de los pacientes que han sufrido un IAM.
Sin embargo, dicho tratamiento se asocia con un alto riesgo de complicaciones hemorrágicas, que a su vez acarrean igual o mayor riesgo de muerte que las complicaciones isquémicas22. Por lo tanto, resulta esencial establecer una adecuada estratificación de ambos riesgos para optimizar el beneficio de prolongar el tratamiento antiagregante doble.
Escalas de Riesgo Más UtilizadasEscalas de riesgo en el SCASESTEl SCA es una enfermedad de gran heterogeneidad y un amplio gradiente de riesgo. Las guías de práctica clínica europea y estadounidense23,24 recomiendan calcular las escalas de puntuación para evaluar riesgos y guiar las decisiones terapéuticas apoyándose en estas herramientas.
Además de aportar información de gran utilidad en una patología con tanta variación pronóstica, es sabido que los médicos tendemos a subestimar el riesgo basado en la evaluación clínica25, por lo que el uso de estas escalas siempre podrá añadir una información relevante y objetiva.
Son muchas las escalas propuestas en la valoración del SCASEST, si bien las 2 más utilizadas en la práctica clínica como predictores de riesgo de episodios isquémicos a corto o medio plazo son las escalas GRACE26 y TIMI27. La escala TIMI es muy sencilla; se basa en 7 variables y se puede calcular a la cabecera del paciente (tabla 2). En función de la puntuación, clasifica a los pacientes en 3 grupos: riesgo bajo (0-2), riesgo intermedio (3-4) y riesgo alto (5-7). Su principal virtud es la sencillez, pero en su contra tiene que resulta poco sólida (estadístico C = 0,65 para predecir el objetivo combinado de muerte, infarto o revascularización urgente a los 14 días). Si bien no es la escala recomendada por la Sociedad Europea de Cardiología, sí puede ser útil a la hora de valorar el dolor torácico en urgencias o incluso a aproximarnos a la mortalidad al año del SCASEST (estadístico C = 0,69).
Variables incluidas en la escala de riesgo TIMI
| Al menos 3 de los siguientes factores de riesgo:• Historia familiar de coronariopatía• Hipertensión arterial• Hipercolesterolemia• Diabetes• Fumador actual | 1 punto |
| Edad mayor de 65 anos | 1 punto |
| Evidencia de enfermedad coronaria previa | 1 punto |
| Uso de ácido acetilsalicilico en los 7 días previos | 1 punto |
| Al menos 2 episodios anginosos en las últimas 24 h | 1 punto |
| Alteraciones del segmento ST | 1 punto |
| Elevación de marcadores de dano miocàrdico (CK-MB o troponina) | 1 punto |
Datos procedentes de Antman et al. 26.
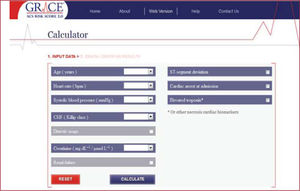
Por otro lado, la escala GRACE es más compleja en su cálculo y exige una calculadora o software específico debido a la utilización de 8 variables continuas28 (figura 1). En función de la puntuación obtenida, clasifica a los pacientes también en 3 categorías de riesgo de mortalidad hospitalaria y a los 6 meses. Así, considera bajo riesgo de mortalidad hospitalaria (< 1%) cuando la puntuación es < 109; riesgo intermedio (mortalidad, 1-3%) cuando está entre 109 y 140, y alto riesgo (> 3%) las puntuaciones > 140. Se puede considerar como muy sólida (estadístico C > 0,80 para mortalidad y C > 0,73 para mortalidad o infarto) y con mayor poder discriminatorio. Estas virtudes, junto con que es la más recomendada en las guías europeas, hacen que posiblemente sea la que más se utilice en la práctica habitual.
Escala de riesgo GRACE. Reproducido con permiso de The GRACE 2.0 ACS Risk Calculator28.
No se debe olvidar que estas escalas de puntuación son simples aproximaciones al problema. Entre las limitaciones, se debe mencionar que no incluyen comorbilidades ni nuevas herramientas de uso obligado en el tratamiento actual del SCASEST (troponina ultrasensible, péptidos natriuréticos, etc.).
Escalas de riesgo en el SCACESTEn el SCACEST, la estratificación del riesgo no ha tenido el mismo nivel de recomendación en las guías de práctica clínica. Existen múltiples escalas creadas para predecir riesgos en el SCACEST, pero probablemente las más utilizadas sean la TIMI29, la CADILLAC30, la PAMI31 y la GRACE32. Estas 4 escalas se han demostrado de gran utilidad en la estratificación del riesgo de muerte de los pacientes sometidos a angioplastia primaria, pero las de mayor poder predictivo33 son TIMI, CADILLAC y GRACE. En la búsqueda de la escala ideal, además de una capacidad predictiva alta, debe valorarse su complejidad y su aplicabilidad clínica.
Al igual que en el SCASEST, no hay que olvidar que las escalas de riesgo están desarrolladas para realizar predicciones grupales y nunca individuales. Y así, por muy buenas y completas que sean las escalas que usemos y por muy alta capacidad predictiva que tengan, nunca serán perfectas, por lo que deben usarse siempre como herramientas fundamentalmente orientativas.
Importancia de las Características AngiográficasAdemás de los factores de riesgo que se valoran tempranamente en el ingreso y determinan el riesgo hospitalario y a medio plazo, existen otras variables que siempre se debe tener en cuenta por asociarse con mayor riesgo a corto y largo plazo. Y aquí se debe incluir la extensión de la enfermedad coronaria, si el paciente ha sido revascularizado o no, el tipo de revascularización (completa o parcial) y el resultado de la revascularización.
Cuando se indica la doble antiagregación tras un evento isquémico agudo, se busca reducir los eventos derivados de la presencia de placas inestables, pero también reducir la trombosis subaguda y tardía de los stents implantados. Al fin y al cabo, la revascularización percutánea es mayoritariamente la opción de tratamiento electivo, tanto en el SCASEST (50-60%) como en el SCACEST (> 80%)34.
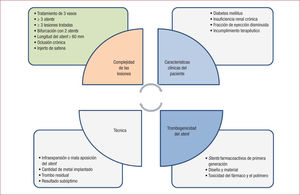
En la figura 2 se presentan variables angiográficas que tener en cuenta a la hora de valorar el riesgo isquémico, ya que pueden influir en la decisión del tratamiento antitrombótico óptimo.
Complejidad de las lesionesLa última guía sobre doble antiagregación35 hace referencia a la complejidad de la anatomía coronaria o de la angioplastia y su influencia pronóstica, si bien senala que la evidencia es escasa. Esta asociación al menos subjetiva entre angioplastias más complejas y necesidad de antiagregantes más potentes existe y será objeto de estudio en el futuro. En esta línea, un reciente estudio36 postula que en angioplastias complejas la prolongación de la doble antiagregación reduce significativamente la incidencia de eventos isquémicos. En ese estudio la angioplastia compleja se define como la presencia de al menos 1 de las siguientes características: tratamiento de 3 vasos, al menos 3 stents implantados, al menos 3 lesiones tratadas, bifurcaciones con implante de 2 stents, longitud del stent implantado > 60 mm u oclusión crónica. Además, el estudio muestra que el beneficio de prolongar la doble antiagregación es mayor según se incrementa el número de estas características.
Pero no se trata de un ensayo clínico, sino de un análisis post hoc de pacientes incluidos en diferentes ensayos clínicos, que no analizaba el beneficio de prolongar la doble antiagregación en relación con la complejidad de la angioplastia. Se puede considerar, por lo tanto, que es un estudio con resultados generadores de hipótesis. Por otro lado, la importancia de las variables angiográficas ya está reflejada en escalas actuales de valoración del riesgo trombótico. Así, la escala DAPT20, disenada para identificar a la población que se beneficiaría de prolongar la doble antiagregación más allá del año entre los pacientes revascularizados con stents, incluye entre sus variables el tratamiento percutáneo del injerto de safena, el implante de stents de diámetro < 3 mm o el uso de stents de paclitaxel. O el estudio PEGASUS, en la búsqueda de una población con infarto de alto riesgo que se beneficiaría de prolongar la doble antiagregación con ticagrelor, también incluyó en la selección de pacientes del estudio a aquellos que presentaban enfermedad multivaso19.
Trombosis del stentSi bien los nuevos stents farmacoactivos han disminuido de manera muy importante la trombosis subaguda y, sobre todo, tardía de los stents, es importante conocer los factores asociados con mayor trombosis porque se trata de una complicación muy grave y con elevada mortalidad37. Además, esta trombosis puede reducirse de manera muy notable con el prasugrel y el ticagrelor, como se mostró en sus estudios fundamentales38,39.
Los factores predictores de trombosis se pueden dividir en 3 grupos (figura 2): a) factores relacionados con el paciente y la lesión; b) factores relacionados con el procedimiento, y c) factores relacionados con el stent.
No cabe duda que debe tenerse en cuenta la inclusión de estas variables anatómicas en la valoración diaria de los pacientes a la hora de decidir el mejor tratamiento antitrombótico, pero va a exigir un esfuerzo anadido y, por supuesto, una relación más directa y fluida entre cardiólogos clínicos y hemodinamistas.
Tratamiento Antiagregante en el InfartoCasi 10 años después de la publicación de los estudios TRITON38 y PLATO39, no hay duda de la superioridad del prasugrel y el ticagrelor sobre el clopidogrel para el paciente con infarto, con una reducción importante de los eventos isquémicos y de la trombosis del stent. Los nuevos antiagregantes generan una inhibición plaquetaria más rápida y profunda, acompanada de menos variabilidad, lo que determina un mejor pronóstico que se refleja en una reducción significativa de las complicaciones isquémicas (especialmente de infarto agudo de miocardio con prasugrel y de infarto y muerte con ticagrelor). Por este motivo, las guías europeas23,40 relegan al clopidogrel para cuando los nuevos antiagregantes estén contraindicados.
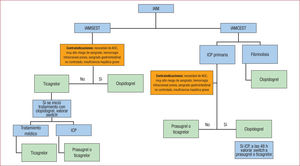
En lafigura 3 se propone un sencillo algoritmo que puede ser útil en la aproximación genérica al tratamiento antitrombótico del paciente con infarto.
Algoritmo de aproximación al tratamiento antitrombótico del paciente con infarto. AOC: anticoagulación oral crónica; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervencionismo coronario percutáneo.
El mayor uso del ticagrelor respecto al prasugrel en el IAMSEST se debe fundamentalmente a su utilidad en el pretratamiento y a que el ticagrelor cubre todo el espectro de pacientes del IAMSEST, desde los revascularizados con angioplastia, que son la mayoría, hasta el subgrupo de pacientes no revascularizados y tratados médicamente, que suelen ser un 30-35% de todas las series de IAMSEST.
Estas 2 ventajas, junto con su facilidad de uso y que evita en la mayoría de los casos la necesidad de cambiar a otro fármaco antiagregante más adecuado, han hecho que el ticagrelor sea el fármaco de elección en el SCASEST. El prasugrel quedaría relegado a los pacientes revascularizados con stents y el pretratamiento no estaría indicado41. Por ello el uso del ticagrelor en el momento del ingreso hospitalario parece la opción más razonable para la mayoría de los pacientes ingresados por SCASEST de riesgo moderado o alto, a la espera de cateterismo, sabiendo que, ya se lo revascularice con stent o no, será un fármaco bien indicado.
La excepción a la indicación de ticagrelor son los pacientes anticoagulados, los pacientes con sangrados activos o con muy alto riesgo hemorrágico y los que tengan contraindicado el fármaco (antecedentes de hemorragia intracraneal, asma o bradicardia sintomática).
Hay que tener en cuenta que muchos de los pacientes que ingresan por SCASEST ya están en tratamiento con clopidogrel o se les pauta en urgencias. Tras la valoración de riesgos, si estos pacientes son subsidiarios de beneficiarse del uso de nuevos antiagregantes, se puede plantear la opción de cambiar a estos fármacos, posiblemente tras el cateterismo.
El cambio de medicación o switch es una estrategia frecuente y segura en el tratamiento del SCA (varía entre el 10 y el 50% en diferentes series), y su objetivo es que los pacientes se beneficien de los nuevos antiagregantes aunque inicialmente se los tratara con clopidogrel.
Antiagregación en el IAMCESTEn el IAMCEST dirigido a angioplastia primaria, el prasugrel y el ticagrelor deben ser los fármacos electivos por su superioridad sobre clopidogrel.
No se dispone de información que ayude a decantarse por uno u otro, pues no ha habido estudios relevantes que los comparen directa-mente. Por otro lado, los subestudios en que el prasugrel y el ticagrelor mostraron superioridad sobre el clopidogrel se realizaron en poblaciones con diferencias claras y con medicación concomitante también distinta, lo cual no permite ni siquiera especular sobre las ventajas o desventajas de cada uno de los fármacos sobre el otro42.
El clopidogrel, además del ácido acetilsalicílico, sería el fármaco indicado para los pacientes tratados con fibrinolisis y los sometidos a angioplastia de rescate, si bien la última guía de IAMCEST plantea la posibilidad para los pacientes sometidos a angioplastia de cambiarlos a las 48 h a prasugrel o ticagrelor40. Por otro lado, se deberá tratar con clopidogrel a un importante porcentaje de pacientes remitidos a angioplastia primaria, ya que tiene un perfil de seguridad superior, tal y como se ha comentado en el IAMSEST.
ConclusionesIdentificar el riesgo isquémico de los pacientes con infarto es determinante, pues ayuda, desde el ingreso hospitalario, a decidir las mejores estrategias de abordaje y el mejor tratamiento antiagregante, lo que contribuirá a un mejor pronóstico en el corto y largo plazo.
La estratificación del riesgo sistemática permite determinar qué pacientes tienen más riesgo isquémico y, por lo tanto, más probabilidades de sufrir nuevos eventos a medio y largo plazo. Esta valoración clínica, junto con la valoración angiográfica de la enfermedad coronaria, debe ayudar a determinar qué pacientes son más vulnerables, para los que habrá que optar por regímenes antitrombóticos más potentes y, en muchas ocasiones, más largos.
Conflicto de InteresesJ.M. Ruiz-Nodar ha recibido honorarios por conferencias de AstraZeneca, Bayer y Menarini.
E. Abu-Assi es Editor Asociado de Revista Española de Cardiología.