La incidencia de síndrome coronario agudo en pacientes ancianos es elevada. Las complicaciones hemorrágicas empeoran el pronóstico en este escenario; a pesar de ello, los scores de riesgo hemorrágico disponibles no han sido validados específicamente en este subgrupo. Nuestro objetivo es analizar la capacidad predictiva de los principales scores de riesgo hemorrágico en pacientes de edad ≥ 75 años.
MétodosInclusión prospectiva de pacientes con síndrome coronario agudo consecutivos. Se registraron características basales, datos analíticos y hemodinámicos y la incidencia intrahospitalaria de hemorragias utilizando las definiciones CRUSADE, Mehran, ACTION y BARC. Se calcularon los scores CRUSADE, Mehran y ACTION de cada paciente y se analizó su capacidad predictiva de hemorragias mediante regresión logística binaria, cálculo de curvas receiver operating characteristic y áreas bajo la curva.
ResultadosSe incluyó a 2.036 pacientes con una media de edad de 62,1 años; el 18,1% (369 pacientes) era ≥ 75 años. Este subgrupo presentaba mayor riesgo hemorrágico (CRUSADE, 42 frente a 22; Mehran, 25 frente a 15; ACTION, 36 frente a 28; p<0,001) y una incidencia de hemorragias mayores ligeramente superior (CRUSADE, el 5,1 frente al 3,8%; p=0,250). La capacidad predictiva de los tres scores fue inferior en los ancianos (área bajo la curva, CRUSADE: ancianos, 0,63; jóvenes, 0,81; p=0,027; Mehran: ancianos, 0,67; jóvenes, 0,73; p=0,340; ACTION: ancianos, 0,58; jóvenes, 0,75; p=0,041).
ConclusionesLos scores de riesgo hemorrágico actualmente disponibles mostraron en el paciente anciano con síndrome coronario agudo un rendimiento claramente inferior al observado en pacientes más jóvenes.
Palabras clave
Las complicaciones hemorrágicas se asocian con un peor pronóstico en pacientes con síndrome coronario agudo (SCA)1–3. Las guías de práctica clínica4,5 recomiendan dirigir la estrategia terapéutica basándose tanto en el riesgo de eventos isquémicos como en el hemorrágico. Por dicho motivo, en los últimos años se ha desarrollado una serie de scores de riesgo diseñados para predecir las complicaciones hemorrágicas en este escenario6–8.
La incidencia de infarto agudo de miocardio aumenta con la edad, y es especialmente elevada en el paciente anciano9. La presencia de comorbilidades y fragilidad es frecuente en este escenario y se asocia con mayores incidencia de complicaciones —las hemorrágicas entre ellas— y consumo de recursos sanitarios10. Por ello, la atención del infarto agudo de miocardio en el anciano puede convertirse en un importante problema de salud pública en los próximos años. A pesar de ello, los pacientes ancianos están generalmente poco representados en los ensayos clínicos11,12, y la evidencia clínica sobre el manejo y la estratificación de riesgo del paciente anciano con SCA es escasa. No existe información sobre el rendimiento de los scores de riesgo hemorrágico en este subgrupo de edad.
Por lo tanto, los objetivos de este estudio son: a) analizar la incidencia de complicaciones hemorrágicas y sus características en los pacientes de edad ≥ 75 años, y b) evaluar la capacidad predictiva de los principales scores de riesgo de hemorragia disponibles en los pacientes de edad ≥ 75 años en comparación con los demás en una cohorte consecutiva de pacientes con SCA ingresados en la unidad coronaria de un hospital terciario.
MÉTODOSDiseño del estudioSe realizó un estudio observacional prospectivo de un solo centro hospitalario de referencia para SCA. Se incluyó prospectivamente a todos los pacientes con SCA admitidos en la unidad coronaria de nuestro centro entre octubre de 2009 y junio de 2012. El diagnóstico y el manejo terapéutico de los pacientes se realizaron de acuerdo con las recomendaciones actuales4,5.
Definiciones y recolección de los datosPersonal entrenado recogió prospectivamente los datos mediante un formulario estandarizado. Se registraron características basales, historia clínica, hallazgos bioquímicos y electrocardiográficos, parámetros ecocardiográficos y angiográficos, procedimientos realizados, tratamientos administrados durante la hospitalización, complicaciones y mortalidad intrahospitalaria. Se registró la incidencia de hemorragia intrahospitalaria, su localización, la necesidad de transfusión de hemoderivados, su repercusión hemodinámica y los requerimientos de intervención.
Eventos hemorrágicosPara la asignación de los eventos hemorrágicos se utilizaron las definiciones CRUSADE6, Mehran7, ACTION8 y BARC13. Todos los elementos que forman parte de dichas definiciones de hemorragia estaban incluidos en el formulario de recogida de datos. Se calculó el valor de los scores de riesgo hemorrágico CRUSADE6, Mehran7 y ACTION8, además del score de riesgo GRACE14, de cada paciente. Para los análisis por grupos de riesgo de los scores CRUSADE, Mehran y ACTION, se utilizaron las categorías previamente definidas6–8 para cada uno de estos scores.
Los parámetros hemodinámicos (frecuencia cardiaca, presión arterial sistólica) y el grado Killip se registraron al ingreso en la unidad coronaria. El aclaramiento de creatinina se calculó mediante la fórmula de Cockcroft-Gault15.
La cuantificación de la enfermedad coronaria se realizó teniendo en cuenta el número de territorios arteriales epicárdicos (descendente anterior, circunfleja, coronaria derecha) con estenosis de la luz arterial ≥ 70% (≥ 50% en el caso del tronco común izquierdo). La cuantificación de grado de estenosis se llevó a cabo mediante análisis visual.
Análisis estadísticoPara el análisis de los datos, se utilizó el paquete estadístico PASW Statistics 18 (Chicago, Illinois, Estados Unidos) y el software R 3.0.1. Las variables categóricas se expresan como número y porcentaje. Las variables cuantitativas se expresan como media ± desviación estándar. Las variables con distribución no normal se expresan como mediana [intervalo intercuartílico]. El análisis de la normalidad de las distribuciones se realizó mediante el test de Kolmogorov-Smirnoff.
La comparación de variables categóricas se realizó mediante el test de la χ2 o el test exacto de Fisher en caso indicado. Para el análisis de la incidencia de hemorragia en función de las diferentes categorías de riesgo, se utilizó asimismo el test de la χ2 con la prueba de tendencia lineal de Mantel y Haenszel. La comparación de variables cuantitativas se realizó mediante el test de la t de Student.
Para el análisis de la capacidad predictiva de los diferentes scores de riesgo hemorrágico, se utilizó un modelo de regresión logística binaria, con cálculo de curvas ROC (receiver operating characteristic) y la correspondiente ABC (área bajo la curva ROC). La comparación de las diferentes ABC se realizó mediante el método no paramétrico de DeLong16. Se realizaron dos tipos de comparaciones: en primer lugar, se analizó en pacientes de edad ≥ 75 años la capacidad de los scores CRUSADE, Mehran y ACTION para predecir hemorragias según las definiciones con que se diseñaron dichos scores, en comparación con los pacientes más jóvenes. Para dicha comparación se utilizó el método de DeLong con muestras independientes. En segundo lugar, se comparó las capacidades de los scores de riesgo hemorrágico CRUSADE, Mehran y ACTION y el GRACE para predecir hemorragias mayores según la reciente definición BARC13. Por razones de relevancia clínica, se consideraron para tal efecto las categorías BARC 3 y 5. Dicha comparación se realizó tanto en los pacientes de edad ≥ 75 años como en los más jóvenes, mediante el método de DeLong con muestras apareadas. Se excluyó de los análisis a los pacientes con valores desconocidos de los correspondientes scores de riesgo.
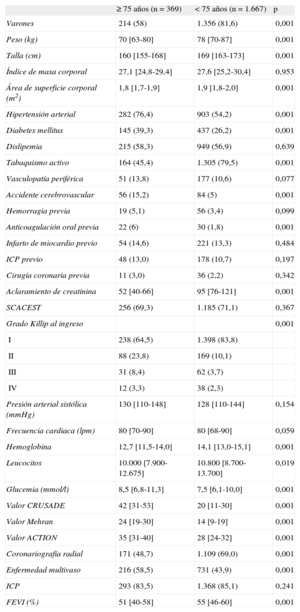
RESULTADOSSe incluyó a 2.036 pacientes (media de edad, 62,1 años), de los que 1.570 (77,1%) eran varones; 369 pacientes (18,1%) tenían edad ≥ 75 años. Las características de los pacientes en función de la edad se muestran en la tabla 1.
Características clínicas en función de la edad
| ≥ 75 años (n=369) | < 75 años (n=1.667) | p | |
| Varones | 214 (58) | 1.356 (81,6) | 0,001 |
| Peso (kg) | 70 [63-80] | 78 [70-87] | 0,001 |
| Talla (cm) | 160 [155-168] | 169 [163-173] | 0,001 |
| Índice de masa corporal | 27,1 [24,8-29,4] | 27,6 [25,2-30,4] | 0,953 |
| Área de superficie corporal (m2) | 1,8 [1,7-1,9] | 1,9 [1,8-2,0] | 0,001 |
| Hipertensión arterial | 282 (76,4) | 903 (54,2) | 0,001 |
| Diabetes mellitus | 145 (39,3) | 437 (26,2) | 0,001 |
| Dislipemia | 215 (58,3) | 949 (56,9) | 0,639 |
| Tabaquismo activo | 164 (45,4) | 1.305 (79,5) | 0,001 |
| Vasculopatía periférica | 51 (13,8) | 177 (10,6) | 0,077 |
| Accidente cerebrovascular | 56 (15,2) | 84 (5) | 0,001 |
| Hemorragia previa | 19 (5,1) | 56 (3,4) | 0,099 |
| Anticoagulación oral previa | 22 (6) | 30 (1,8) | 0,001 |
| Infarto de miocardio previo | 54 (14,6) | 221 (13,3) | 0,484 |
| ICP previo | 48 (13,0) | 178 (10,7) | 0,197 |
| Cirugía coronaria previa | 11 (3,0) | 36 (2,2) | 0,342 |
| Aclaramiento de creatinina | 52 [40-66] | 95 [76-121] | 0,001 |
| SCACEST | 256 (69,3) | 1.185 (71,1) | 0,367 |
| Grado Killip al ingreso | 0,001 | ||
| I | 238 (64,5) | 1.398 (83,8) | |
| II | 88 (23,8) | 169 (10,1) | |
| III | 31 (8,4) | 62 (3,7) | |
| IV | 12 (3,3) | 38 (2,3) | |
| Presión arterial sistólica (mmHg) | 130 [110-148] | 128 [110-144] | 0,154 |
| Frecuencia cardiaca (lpm) | 80 [70-90] | 80 [68-90] | 0,059 |
| Hemoglobina | 12,7 [11,5-14,0] | 14,1 [13,0-15,1] | 0,001 |
| Leucocitos | 10.000 [7.900-12.675] | 10.800 [8.700-13.700] | 0,019 |
| Glucemia (mmol/l) | 8,5 [6,8-11,3] | 7,5 [6,1-10,0] | 0,001 |
| Valor CRUSADE | 42 [31-53] | 20 [11-30] | 0,001 |
| Valor Mehran | 24 [19-30] | 14 [9-19] | 0,001 |
| Valor ACTION | 35 [31-40] | 28 [24-32] | 0,001 |
| Coronariografía radial | 171 (48,7) | 1.109 (69,0) | 0,001 |
| Enfermedad multivaso | 216 (58,5) | 731 (43,9) | 0,001 |
| ICP | 293 (83,5) | 1.368 (85,1) | 0,241 |
| FEVI (%) | 51 [40-58] | 55 [46-60] | 0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervencionismo coronario percutáneo; SCACEST: síndrome coronario agudo con elevación del segmento ST.
Enfermedad multivaso: estenosis significativa (> 60%) en dos o más territorios arteriales epicárdicos (descendente anterior, coronaria derecha, circunfleja).
Las variables categóricas se expresan como n (%) y las cuantitativas con distribución no normal, como mediana [intervalo intercuartílico].
Los pacientes ancianos tenían, en general, más factores de riesgo cardiovascular y otras comorbilidades, con mayor incidencia de signos de insuficiencia cardiaca y cifras de filtrado glomerular y hemoglobina al ingreso significativamente inferiores a las de los demás pacientes. Asimismo se apreciaron una coronariopatía más difusa y una peor función ventricular izquierda en los pacientes mayores. Además, se apreció un riesgo hemorrágico general significativamente más alto en este subgrupo, reflejado en la mayor puntuación en cada uno de los tres scores de riesgo hemorrágico en comparación con los pacientes más jóvenes. El número de pacientes con valores desconocidos de score CRUSADE fue 162 de 2.036 (8%); del Mehran, 252 de 2.036 (12,4%), y del ACTION, 85 de 2.036 (4,2%). No se apreciaron diferencias significativas por grupos de edad en el porcentaje de pacientes con valores descocidos.
Los datos referentes al manejo y la evolución intrahospitalaria por grupos de edad se muestran en la tabla 2. A los pacientes de más edad se los sometió con menor frecuencia a coronariografía por vía radial y se les prescribió con menor frecuencia tratamiento con prasugrel o inhibidores de la glucoproteína IIb/IIIa plaquetaria. Por contra, el tratamiento con bivalirudina se utilizó con mayor frecuencia en estos pacientes. Respecto a los procedimientos invasivos, se apreció una mayor utilización de contrapulsación intraaórtica y marcapasos provisional en los pacientes ancianos.
Manejo y evolución intrahospitalaria en función de la edad
| ≥ 75 años (n=369) | < 75 años (n=1.667) | p | |
| Ácido acetilsalicílico | 365 (98,9) | 1.618 (97,1) | 0,049 |
| Clopidogrel | 353 (95,9) | 1.594 (96,1) | 0,888 |
| Prasugrel | — | 22 (1,3) | 0,022 |
| Enoxaparina | 156 (42,4) | 711 (42,9) | 0,870 |
| Heparina no fraccionada | 211 (57,3) | 950 (57,3) | 0,979 |
| Bivalirudina | 59 (16,0) | 176 (10,6) | 0,003 |
| Inhibidores de GPIIb/IIIa | 28 (7,6) | 380 (22,9) | 0,001 |
| Procedimientos | |||
| Contrapulsación intraaórtica | 36 (9,8) | 95 (5,7) | 0,004 |
| Marcapasos provisional | 19 (5,1) | 46 (2,8) | 0,018 |
| Catéter de Swan-Ganz | 5 (1,4) | 44 (2,8) | 0,128 |
| Intubación orotraqueal | 17 (4,6) | 100 (6,0) | 0,299 |
| Ventilación no invasiva | 8 (2,2) | 20 (1,3) | 0,169 |
| Depuración extrarrenal | 7 (1,9) | 17 (1,0) | 0,186 |
| Evolución intrahospitalaria | |||
| Angina postinfarto | 20 (5,4) | 73 (4,4) | 0,386 |
| Reinfarto | 4 (1,1) | 12 (0,7) | 0,473 |
| Fibrilación ventricular | 16 (4,3) | 112 (6,7) | 0,200 |
| Bloqueo auriculoventricular | 14 (3,8) | 30 (1,8) | 0,017 |
| Fibrilación auricular | 61 (16,5) | 89 (5,3) | 0,001 |
| Hemorragias totales | 37 (10,0) | 121 (7,3) | 0,059 |
| Hemorragias BARC 3 y 5 | 13 (3,5) | 38 (2,3) | 0,167 |
| Hemorragias mayores CRUSADE | 19 (5,1) | 64 (3,8) | 0,250 |
| Hemorragias mayores ACTION | 19 (5,1) | 64 (3,8) | 0,250 |
| Hemorragias mayores Mehran | 23 (6,2) | 77 (4,6) | 0,194 |
| Transfusión de hemoderivados | 13 (3,5) | 40 (2,4) | 0,220 |
| Inestabilidad hemodinámica por hemorragia | 2 (0,5) | 11 (0,7) | 0,797 |
| Intervención por hemorragia | 2 (0,5) | 5 (0,3) | 0,617 |
| Infecciones | 21 (5,7) | 84 (5,0) | 0,608 |
| Nefrotoxicidad por contraste | 37 (10,0) | 53 (3,2) | 0,001 |
| Mortalidad intrahospitalaria | 29 (7,9) | 45 (2,7) | 0,001 |
GPIIb/IIIa: glucoproteína IIb/IIIa plaquetaria.
Las variables categóricas se expresan como n (%).
La evolución intrahospitalaria presentó asimismo algunas diferencias en función de la edad. Se apreció mayor incidencia de bloqueo auriculoventricular, fibrilación auricular y nefrotoxicidad asociada al contraste de la angiografía en los pacientes ancianos, así como mayor mortalidad hospitalaria. La incidencia de complicaciones hemorrágicas fue ligeramente superior en este subgrupo, aunque la diferencia no alcanzó significación estadística con ninguna de las definiciones utilizadas. Tampoco se apreciaron diferencias en la necesidad de transfusión de hemoderivados, la aparición de inestabilidad hemodinámica por hemorragia o la necesidad de intervención por hemorragia.
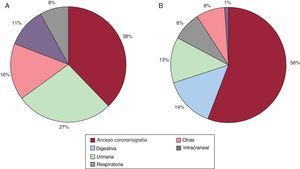
El análisis de la localización de las complicaciones hemorrágicas en función de la edad muestra algunas diferencias relevantes. En los ancianos, las localizaciones más frecuentes fueron la vía de acceso femoral, la vía urinaria y la intracraneal. Por el contrario, en los pacientes más jóvenes, las localizaciones más frecuentes fueron la vía de acceso, la digestiva y la urinaria. La figura 1 ilustra la localización de las hemorragias en ambos grupos de edad.
En los pacientes de edad < 75 años, la incidencia de hemorragia intrahospitalaria mostró una asociación significativa con las diferentes categorías de riesgo de cada uno de los scores analizados, creciendo de forma paralela a cada categoría de riesgo. Así, la incidencia de hemorragias mayores CRUSADE según los quintiles CRUSADE fue la siguiente: muy bajo riesgo, 7 de 790 (0,9%); bajo riesgo, 10 de 389 (2,6%); riesgo intermedio, 12 de 177 (6,8%); alto riesgo, 9 de 100 (9%); muy alto riesgo, 19 de 84 (22,6%) (p<0,001; prueba de tendencia lineal, p<0,001).
La incidencia de hemorragias mayores ACTION en cada categoría ACTION fue la siguiente: muy bajo riesgo, 2 de 166 (1,2%); bajo riesgo, 17 de 877 (1,9%); riesgo intermedio, 25 de 480 (5,2%); alto riesgo, 10 de 60 (16,7%), y muy alto riesgo, 6 de 17 (35,3%) (p<0,001; prueba de tendencia lineal, p<0,001).
Finalmente, la incidencia de hemorragias mayores Mehran en función de las categorías Mehran fue: bajo riesgo, 4 de 361 (1,1%); riesgo intermedio, 7 de 414 (1,7%); alto riesgo, 21 de 309 (6,8%), y muy alto riesgo, 35 de 368 (9,5%) (p<0,001; prueba de tendencia lineal, p<0,001).
Por el contrario, en los pacientes ancianos la asociación entre hemorragia intrahospitalaria y las diferentes categorías de riesgo de los scores analizados no alcanzó significación estadística. En este subgrupo, la incidencia de hemorragias mayores CRUSADE según los quintiles CRUSADE fue: muy bajo riesgo, 1 de 20 (5%); bajo riesgo, 1 de 62 (1,6%); riesgo intermedio, 3 de 73 (4,1%); alto riesgo, 4 de 83 (8,3%); muy alto riesgo, 8 de 96 (8,3%) (p=0,434; prueba de tendencia lineal, p=0,102).
La incidencia de hemorragias mayores ACTION en cada una de los categorías ACTION fue: muy bajo riesgo, 0 de 1 (0%); bajo riesgo, 2 de 80 (2,5%); riesgo intermedio, 11 de 202 (5,4%); alto riesgo, 3 de 58 (5,2%), y muy alto riesgo, 1 de 10 (10%) (p=0,781; prueba de tendencia lineal, p=0,271).
Finalmente, la incidencia de hemorragias Mehran mayores en función de las categorías Mehran fue: riesgo intermedio, 0 de 29 (0%); alto riesgo, 3 de 56 (5,4%), y muy alto riesgo, 19 de 247 (7,7%) (p=0,265; prueba de tendencia lineal, p=0,113).
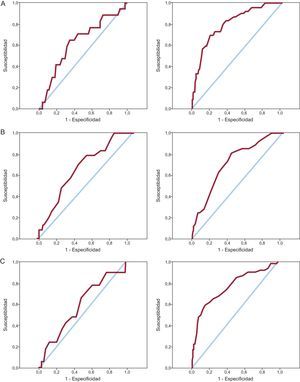
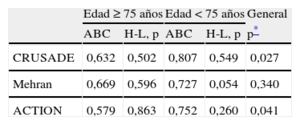
Capacidad predictiva en función de la edadLos tres scores de riesgo hemorrágico mostraron peor capacidad predictiva en los pacientes ancianos. Las diferencias resultaron claramente significativas con los scores CRUSADE y ACTION. La capacidad predictiva del score Mehran en los ancianos fue también inferior a la apreciada en los pacientes más jóvenes, aunque la diferencia no alcanzó significación estadística (tabla 3). La figura 2 muestra las curvas ROC sobre la predicción de complicaciones hemorrágicas de los scores CRUSADE, Mehran y ACTION en los ancianos y los pacientes jóvenes. La calibración, expresada mediante el test de Hosmer-Lemeshow, fue adecuada en la mayor parte de los casos, aunque algo inferior para el score Mehran en los pacientes jóvenes.
Capacidad de los scores CRUSADE, Mehran y ACTION para predecir hemorragias mayores (según sus propias definiciones) en función de la edad
| Edad ≥ 75 años | Edad < 75 años | General | |||
| ABC | H-L, p | ABC | H-L, p | p* | |
| CRUSADE | 0,632 | 0,502 | 0,807 | 0,549 | 0,027 |
| Mehran | 0,669 | 0,596 | 0,727 | 0,054 | 0,340 |
| ACTION | 0,579 | 0,863 | 0,752 | 0,260 | 0,041 |
ABC: área bajo la curva receiver operating characteristic; H-L: test de Hosmer-Lemeshow.
Ninguno de los tres scores de riesgo hemorrágico mostró una capacidad predictiva significativamente superior a la de los otros, resultados que se aprecian tanto en el grupo de ancianos como en el de pacientes más jóvenes (tabla 4).
Análisis comparativo de la capacidad de los scores CRUSADE, Mehran y ACTION para predecir hemorragias mayores (hemorragias BARC 3 y 5) en los dos grupos de edad
| ≥ 75 años | < 75 años | |||||||
| ABC | H-L, p | Comparación ABC | p | ABC | H-L, p | Comparación ABC | p | |
| CRUSADE | 0,523 | 0,271 | CRUSADE frente a Mehran | 0,749 | 0,740 | 0,318 | CRUSADE frente a Mehran | 0,389 |
| Mehran | 0,540 | 0,776 | CRUSADE frente a ACTION | 0,752 | 0,710 | 0,092 | CRUSADE frente a ACTION | 0,489 |
| ACTION | 0,545 | 0,992 | CRUSADE frente a GRACE | 0,092 | 0,718 | 0,758 | CRUSADE frente a GRACE | 0,924 |
| GRACE | 0,697 | 0,744 | Mehran frente a ACTIONMehran frente a GRACEACTION frente a GRACE | 0,9510,0990,187 | 0,742 | 0,796 | Mehran frente a ACTIONMehran frente a GRACEACTION frente a GRACE | 0,8580,4710,605 |
ABC: área bajo la curva receiver operating characteristic; H-L: test de Hosmer-Lemeshow.
El comportamiento del score GRACE en función de la edad fue ligeramente que el de los tres scores de riesgo hemorrágico (tabla 4). En los pacientes jóvenes, el GRACE mostró una capacidad predictiva adecuada, sin diferencias significativas con los tres scores de riesgo hemorrágico. Por el contrario, la capacidad predictiva del GRACE en los ancianos (aun siendo inferior a la apreciada en los pacientes jóvenes) sufrió una pérdida menor que la observada en los otros scores. De esta manera, y a pesar de no apreciarse diferencias estadísticamente significativas, hay una tendencia a un valor de ABC del score GRACE mayor que con los demás scores en el paciente anciano.
DISCUSIÓNLos principales hallazgos de nuestro estudio son: a) la incidencia de complicaciones hemorrágicas en los pacientes ≥ 75 años fue ligeramente superior que la del grupo de personas más jóvenes, sin apreciarse diferencias significativas en la gravedad de la hemorragia, aunque sí en su localización, y b) las principales herramientas actualmente disponibles para la estratificación del riesgo hemorrágico mostraron un rendimiento claramente inferior en los pacientes de edad más avanzada.
Las evidentes implicaciones pronósticas de las complicaciones hemorrágicas en pacientes con SCA1–3 confieren una especial relevancia a la estratificación del riesgo hemorrágico en este contexto. A pesar de que la estratificación del riesgo hemorrágico está mucho menos desarrollada que la valoración del riesgo de eventos isquémicos recurrentes17,18, se dispone actualmente de una serie de herramientas diseñadas para predecir las complicaciones hemorrágicas en este escenario6–8. La validación de dichos scores de riesgo en nuestro medio es especialmente relevante, debido a las notables diferencias demográficas, étnicas y socioculturales de nuestra población respecto a las poblaciones que sirvieron de base para su elaboración. En este sentido, Abu-Assi et al19 analizaron una cohorte española de 782 pacientes con SCA sin elevación del segmento ST consecutivos, y el score CRUSADE mostró una capacidad discriminatoria óptima en este contexto. En otra interesante aportación, de nuevo Abu-Assi et al20 compararon la capacidad predictiva de los scores CRUSADE, Mehran y ACTION en una amplia serie de 4.500 pacientes con SCA consecutivos, y apreciaron que la capacidad predictiva de los tres scores es adecuada en este escenario (con estadístico C > 0,70 excepto en los pacientes sometidos a manejo conservador), aunque algo superior con CRUSADE y ACTION. Por lo tanto, la capacidad predictiva de los principales scores de riesgo hemorrágico puede considerarse adecuadamente validada en nuestro medio.
Por otro lado, el manejo y la estratificación del riesgo en el paciente anciano con SCA presenta algunas particularidades evidentes21–23. La presencia de comorbilidades y/o fragilidad es frecuente en esta situación y se puede asociar con mayor incidencia de complicaciones y efectos adversos de los fármacos más frecuentemente utilizados en el SCA. Además, a pesar de la incidencia creciente de SCA en los pacientes ancianos9, estos están muy poco representados en los estudios11,12, por lo que la información sobre su manejo y la estratificación de riesgo es muy escasa. En nuestro conocimiento, ningún estudio ha analizado el rendimiento de los scores de riesgo hemorrágico de manera específica en el anciano. Abu-Assi et al19 describen, a pesar de no ser uno de los objetivos principales de su estudio, adecuada capacidad predictiva del score CRUSADE en los pacientes ≥ 75 años años (n=257; estadístico C=0,80; intervalo de confianza del 95%, 0,75-0,85). Algunas diferencias de dicha población respecto a nuestra serie podrían justificar las discrepancias con nuestros hallazgos. Dichos pacientes tenían mayor riesgo hemorrágico total (CRUSADE, mediana, 30 frente a 23 en nuestra serie). Además, que se tratara únicamente de pacientes con SCA sin elevación del segmento ST pudo motivar un tratamiento antitrombótico más intensivo y prolongado, lo que a su vez podría justificar la mayor incidencia de hemorragias mayores apreciada en esta serie (9,5%). No existen referencias sobre el rendimiento de los scores Mehran y ACTION en el paciente anciano.
Por otro lado, nuestros datos muestran una peor calibración del score Mehran en la población joven. El Mehran se elaboró a partir de pacientes procedentes de ensayos clínicos (ACUITY, HORIZONS), mientras que CRUSADE y ACTION parten de poblaciones procedentes de registros, con todas las diferencias en características clínicas y comorbilidades que ello pueda conllevar. Además, el score Mehran es el único de los tres que no incorpora variables como la clase Killip o datos hemodinámicos (frecuencia cardiaca o presión arterial) y, a diferencia de los demás, entre sus componentes hay variables referidas al tratamiento farmacológico. A pesar de que otros autores no han apreciado dichas diferencias en la calibración en nuestro medio20, las características diferenciales del score Mehran podrían explicar en parte las diferencias en la calibración apreciadas en nuestra serie, dato que se debería corroborar en series de mayor tamaño.
A pesar de ello, los datos procedentes de nuestra serie muestran por primera vez de forma consistente una peor capacidad discriminativa de los tres scores de riesgo hemorrágico en el paciente anciano con SCA. En nuestra opinión, la frecuente coexistencia de comorbilidades y fragilidad en estos pacientes puede alterar notablemente el manejo y su evolución clínica e implican una mayor complejidad en la predicción del riesgo de eventos tanto isquémicos como hemorrágicos. Este tipo de variables se cuantifican con muy poca frecuencia en los ensayos y registros en el área cardiovascular. Los estudios de los que se derivan los scores CRUSADE, Mehran y ACTION no son una excepción al respecto. Además, los pacientes ancianos estuvieron asimismo muy poco representados en dichas poblaciones6–8, con medias de edad comprendidas entre 62 y 67 años. Creemos que esta es una de las principales causas de la menor capacidad predictiva documentada en los ancianos de nuestra serie. La menor capacidad predictiva de hemorragias del score GRACE en los ancianos de nuestra serie (aunque algo menos evidente en comparación con los scores de riesgo hemorrágico), también podría deberse a razones similares.
La valoración de variables como la fragilidad, las comorbilidades o el estado funcional podría aportar una información muy relevante y contribuir de manera marcada a mejorar la estratificación pronóstica del paciente anciano con SCA24.
Por otro lado, la incidencia de hemorragia en los pacientes ancianos de nuestra serie fue superior que en los demás, aunque quizá en un grado menor que lo esperado. La edad es un conocido predictor de complicaciones hemorrágicas en pacientes con SCA25,26 y, de hecho, forma parte de los scores ACTION8 y Mehran7 e, indirectamente a través de filtrado gloerular, el score CRUSADE6. Es posible que el manejo terapéutico antitrombótico más conservador en los ancianos de nuestra serie (con menor utilización de antiagregantes potentes como prasugrel o inhibidores de la glucoproteína IIb/IIIa y la mayor utilización de fármacos teóricamente más seguros27 como la bivalirudina) haya podido contribuir a que las diferencias en la incidencia de hemorragia en función de la edad fuesen menores.
La distribución de localizaciones de las complicaciones hemorrágicas también resulta interesante. Pese a la mayor utilización de la vía de acceso femoral en los pacientes ancianos (condicionada probablemente por las características anatómicas de su circulación braquial y su situación hemodinámica más desfavorable al ingreso), la hemorragia en relación con la vía de acceso fue porcentualmente menos frecuente en este subgrupo. Creemos nuevamente que el manejo farmacológico más conservador en las personas de más edad podría estar implicado en esta aparente paradoja, así como en el menor protagonismo de la hemorragia digestivo que también se aprecia en estos pacientes. Asimismo, destaca el mayor protagonismo de la hemorragia del tracto urinario en los ancianos, condicionada probablemente por un mayor grado de comorbilidad preexistente, y también de la hemorragia intracraneal, asociación extensamente descrita previamente.
LimitacionesNuestro estudio tiene las limitaciones inherentes a las de un estudio de un solo centro, con un manejo terapéutico bastante homogéneo y una elevada prevalencia de SCA con elevación del segmento ST sometido a angioplastia primaria. Por otro lado, el hecho de haber incluido solo a pacientes ingresados en la unidad coronaria podría asimismo entrañar un cierto sesgo. Por lo tanto, se debería considerar nuestros hallazgos aplicables únicamente a poblaciones de perfil y manejo clínico similares, en espera de que se confirmen en escenarios diferentes. El tamaño muestral, especialmente en el subgrupo de ancianos, constituye otra limitación del trabajo. A pesar de que un número bajo de eventos puede limitar la precisión estadística del cálculo de la curva ROC, las notables diferencias objetivadas (de manera concordante, además, en los tres scores de riesgo hemorrágico estudiados) no son a nuestro juicio justificables por un tamaño muestral pequeño (teniendo en cuenta, además, el efecto conservador del método estadístico utilizado28). Por otro lado, el score Mehran se diseñó para predecir hemorragias a 30 días y no solo durante el periodo intrahospitalario como en nuestro estudio. Finalmente, el registro de la fragilidad y las comorbilidades asociadas podría haber aportado información relevante para la asociación estudiada.
A pesar de estas limitaciones, creemos que los hallazgos de nuestro estudio ilustran con claridad las carencias actuales en la estratificación de riesgo hemorrágico del paciente anciano con SCA y la necesidad de desarrollar nuevas herramientas para perfeccionarla.
CONCLUSIONESLos pacientes ancianos de nuestra serie tenían mayor riesgo hemorrágico y una incidencia de complicaciones hemorrágicas levemente superior. Nuestro estudio describe, por primera vez, un rendimiento subóptimo de los scores de riesgo hemorrágico en el paciente anciano con SCA. La cuantificación de factores como fragilidad y comorbilidades podría, en nuestra opinión, contribuir a mejorar la capacidad predictiva en este escenario clínico.
CONFLICTO DE INTERESESNinguno.