Los balones liberadores de paclitaxel tienen demostrada eficacia en el tratamiento y la prevención de la restenosis. Sin embargo, no todos los dispositivos comercializados son igualmente efectivos; por ello es importante comparar los resultados en un modelo preclínico. Nuestro objetivo es analizar la seguridad y la eficacia preclínicas de distintos dispositivos.
MétodosEn 17 cerdos domésticos (25±3 kg) se implantaron 51 stents metálicos (Architect®, iVascular), uno en cada rama coronaria principal, y se sobredilataron con distintos balones de control (n=10) o liberadores de paclitaxel: balón liberador de paclitaxel 1 (iVascular) (n=15); balón liberador de paclitaxel 2 (iVascular) (n=16) e In.Pact Falcon® (Medtronic) (n=10). Tras 28 días, se analizaron los resultados de restenosis (angiografía e histomorfometría) y de reparación vascular: daño vascular, endotelización, persistencia de fibrina e inflamación.
ResultadosLos distintos balones liberadores de paclitaxel mostraron valores similares de estenosis en el seguimiento significativamente menores que los controles: angiografía, el 9±12% frente al 34±18% (p<0,0001); histomorfometría, el 22±8% frente al 51±18% (p<0,0001). Los grados de daño vascular (0,6±0,5) e inflamación (0,8±0,3) fueron bajos, sin diferencias entre los grupos. Los marcadores del efecto farmacológico fueron significativamente distintos entre los dispositivos liberadores de paclitaxel (sin diferencias entre ellos) y los controles: superficie endotelizada, el 87±10% frente al 99±2% (p=0,0007); grado de fibrina, 2,1±0,7 frente a 0,4±0,5 (p<0,0001). No hubo diferencias entre los distintos balones liberadores de paclitaxel.
ConclusionesEn este modelo preclínico, los balones liberadores de paclitaxel analizados mostraron una reducción significativa de la restenosis. Aunque no se observaron datos de daño vascular o inflamación persistentes, sí se apreciaron los efectos de la acción farmacológica en forma de endotelización retrasada y acumulación de fibrina.
Palabras clave
Los stents coronarios proporcionan recubrimiento y un soporte luminal que elimina prácticamente el fenómeno de recuperación elástica y el posterior remodelado negativo del vaso, con lo que se reduce la incidencia de restenosis respecto a la angioplastia con balón en un 30%1,2. Sin embargo, los stents metálicos no solo no disminuyen la hiperplasia intimal, sino que conllevan un comportamiento hiperproliferativo. Los stents farmacoactivos han eliminado prácticamente la aparición de restenosis causada por proliferación neointimal3,4. A cambio, se ha demostrado un marcado enlentecimiento y deterioro de la reparación vascular5–8 que puede traducirse clínicamente en la aparición de trombosis del stent5–7 y desarrollo de neoaterosclerosis9,10. La presencia de un recubrimiento polimérico permanente se ha relacionado con fenómenos de inflamación persistente, hipersensibilidad y reparación vascular deficiente tanto en modelos experimentales11,12 como en estudios necrópsicos humanos5,6,13.
Para evitar estos efectos indeseables, se han propuesto sistemas alternativos para la administración de fármacos antiproliferativos como los balones liberadores de paclitaxel (BLP), de demostrada eficacia en la prevención y el tratamiento de la restenosis tanto en modelos animales14,15 como en estudios clínicos16,17. Sin embargo, no todos los BLP disponibles actualmente ofrecen los mismos resultados18–22, por lo que parece pertinente realizar análisis comparativos de distintos dispositivos. Los objetivos de este estudio son comparar los resultados en seguridad y eficacia de distintos BLP en el recomendado modelo animal porcino de arterias coronarias sanas23,24 y determinar la cinética de liberación y depósito arterial del fármaco.
MÉTODOSModelo animalPara la realización de este estudio experimental, aleatorizado, controlado y ciego en el análisis de las muestras finales, se emplearon 17 cerdos domésticos (raza large white) de 2-3 meses de edad y 25±3 kg de peso, procedentes de la granja experimental de nuestro centro. Todos los procedimientos se llevaron a cabo según la normativa legal vigente española (Real Decreto 53/2013, de 1 de febrero, por el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación y otros fines científicos, incluyendo la docencia) y europea (Directiva 2010/63/UE) y tras la aprobación del comité ético local del protocolo del estudio.
Se pretrató a todos los animales, 24 h antes del procedimiento, con ácido acetilsalicílico (325 mg) y clopidogrel (300 mg). El protocolo anestésico y la preparación quirúrgica de los animales se han descrito previamente25,26. En breve, tras la preparación de los animales y la administración de 5.000 UI de heparina intravenosa, se realizó abordaje de la arteria carótida izquierda para realizar angiografía de ambas coronarias tras la administración de nitroglicerina intracoronaria.
Procedimiento coronarioCon el objetivo de implantar los dispositivos con una relación de tamaños stent:arteria de 1,1–1,2, se localizó el mejor segmento en cada una de las tres coronarias mayores. Tras el paso de la guía de angioplastia, en cada coronaria mayor se implantó un stent de cromo-cobalto (Architect®, iVascular) de 14 mm de longitud y 3,5 mm (en descendente anterior y coronaria derecha) o 3 mm (en circunfleja) de calibre. La presión de hinchado se ajustó para alcanzar la sobredimensión deseada. Tras el implante de los stents, se realizó posdilatación con distintos balones del mismo calibre que el stent implantado y 20 mm de longitud, según tabla de asignación aleatorizada. El hinchado se realizó a la presión nominal que marcan los fabricantes durante 1 min (26 balones) o 2 min (25 balones) de manera aleatorizada para el análisis de posibles diferencias en la liberación del fármaco por los dispositivos.
Dispositivos analizadosLos balones empleados y su número fueron los siguientes:
- 1.
Balón convencional de angioplastia, sin fármaco, control (n=10): Xperience® (iVascular).
- 2.
BLP 1 (n=15): formulación experimental 1 (iVascular). Sobre la base del balón Xperience®, se aplica paclitaxel (3μg/mm2 de superficie) en formulación nanocristalina combinada con un plastificante biocompatible mediante tecnología de deposición ultrasónica TransferTech®, que proporciona un fino recubrimiento homogéneo. El fabricante calcula un tiempo de liberación del fármaco a priori en 30-60 s, de modo que el inflado del balón por encima de 60 s no proporcionaría liberación adicional de fármaco.
- 3.
BLP 2 (n=16): formulación experimental 2 (iVascular). Similar al BLP 1, con matriz transportadora del fármaco más hidrófila. La combinación de los grupos hidrófilos de esta nueva matriz con los grupos hidrófugos ya presentes en la cadena principal proporciona un aumento de la polaridad en el recubrimiento, lo que potencialmente incrementa la solubilidad del propio fármaco.
- 4.
BLP 3 (n=10): BLP comercial In.Pact Falcon® (Medtronic). La formulación de paclitaxel (3 μg/mm2 de superficie) también es cristalina, emplea como excipiente urea y se aplica al balón mediante la tecnología FreePac®.
Todos los materiales fueron suministrados por iVascular, incluidos BLP 1 y BLP 2, dispositivos aún no comercializados. Tras la aplicación del tratamiento, se conservaron los balones para analizar la cantidad de paclitaxel remanente en ellos mediante cromatografía líquida de alta resolución.
Análisis angiográficoAl finalizar el procedimiento descrito en cada arteria, se realizó una nueva coronariografía tras la administración intracoronaria de nitroglicerina para determinar el diámetro luminal mínimo del stent. A los 28 días, se realizó coronariografía de control para la determinación del diámetro luminal mínimo al seguimiento. Para las mediciones de ambas variables y los diámetros de referencia de la arteria tratada (valor promedio de los segmentos arteriales situados 5 mm proximales y distales a los bordes del stent), se empleó el software de cuantificación automática Medis QCA-CMS®, versión 6.1. Se calculan los parámetros de restenosis angiográficos:
Pérdida tardía (late loss) = diámetro luminal mínimo inicial – diámetro luminal mínimo seguimiento
Porcentaje de estenosis por angiografía = [1 – (diámetro luminal mínimo seguimiento/diámetro de referencia)] × 100.
Tras completar el estudio angiográfico de control, se sacrificó a los animales y se procedió al estudio anatomopatológico completo. Tras el explante del corazón y la perfusión de las arterias coronarias a presión-fijación inicialmente con solución salina tamponada con fosfato y a continuación con paraformaldehído al 4%, se disecaron los segmentos arteriales tratados respetando al menos los 5 mm proximales y distales. La inclusión en resina de estas muestras permitió realizar secciones circunferenciales representativas de los segmentos proximal, central y distal de cada una de las muestras, para ofrecer así valores medios en cada segmento estudiado. Tras la desplastificación de las secciones, se procedió a la tinción mediante las habituales técnicas de hematoxilina-eosina y elastina de Van Gieson. Con el fin de determinar una potencial toxicidad farmacológica a distancia, se realizó el estudio microscópico de distintos órganos (pulmón, riñones, hígado, bazo) y del miocardio suplido por las arterias tratadas.
El análisis histomorfométrico se realizó sobre imágenes digitalizadas de las arterias recogidas con un microscopio Olympus PRovis AX70® (Tokio, Japón) con cámara digital Nikon DXM 1200® incorporada, empleando el software ImageJ-NIH Image 1,4 (National Institutes of Health, Estados Unidos). La planimetría de las áreas luminal y de lámina elástica interna permite calcular las dos variables de restenosis derivadas de la histología:
Área de neoíntima = área de lámina elástica interna – área luminal
Porcentaje de estenosis por histología = [1 – (área luminal/área lámina elástica interna)] × 100.
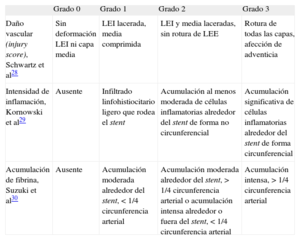
El análisis histopatológico de la seguridad de los tratamientos se basa en el análisis semicuantitativo de cuatro parámetros fundamentales27 (tabla 1): el grado de daño vascular (injury score) según Schwartz et al28, la intensidad de la inflamación según Kornowski et al29, la acumulación de fibrina persistente según Suzuki et al30 y el grado de (re)endotelización mediante el cálculo del porcentaje aproximado de cobertura de la superficie luminal por células endoteliales. Dada la elevada cantidad de superficie recubierta por células endoteliales a los 28 días del tratamiento, se realizó una valoración adicional en la que se consideró la rendotelización como total cuando la cobertura de la superficie por células endoteliales era ≥ 95%27.
Escalas de valoración histopatológica de la seguridad28
| Grado 0 | Grado 1 | Grado 2 | Grado 3 | |
| Daño vascular (injury score), Schwartz et al28 | Sin deformación LEI ni capa media | LEI lacerada, media comprimida | LEI y media laceradas, sin rotura de LEE | Rotura de todas las capas, afección de adventicia |
| Intensidad de inflamación, Kornowski et al29 | Ausente | Infiltrado linfohistiocitario ligero que rodea el stent | Acumulación al menos moderada de células inflamatorias alrededor del stent de forma no circunferencial | Acumulación significativa de células inflamatorias alrededor del stent de forma circunferencial |
| Acumulación de fibrina, Suzuki et al30 | Ausente | Acumulación moderada alrededor del stent,<1/4 circunferencia arterial | Acumulación moderada alrededor del stent, >1/4 circunferencia arterial o acumulación intensa alrededor o fuera del stent,<1/4 circunferencia arterial | Acumulación intensa, >1/4 circunferencia arterial |
LEE: lámina elástica externa; LEI: lámina elástica interna.
Para comprobar la tasa de transferencia del paclitaxel a la arteria, la remanencia de fármaco en el balón y la liberación al torrente sanguíneo, se realizó una fase experimental sobre 3 animales adicionales con el siguiente protocolo: tras obtener canulación selectiva de coronarias izquierda y derecha según la metodología descrita previamente, se implantaron stents de cromo-cobalto en los segmentos proximal o medio de cada una de las ramas coronarias mayores que se usaron como marcadores. Distal a cada uno de los stents, se realizó una dilatación con balones BLP 1 durante 60 s a presiones entre 7 y 10 atm para obtener relaciones balón:arteria de 1,1-1,2. Se programaron distintos tiempos de seguimiento (15-30 min, 2 balones; 60-90 min, 2; 2 h, 2; 24 h, 3), tras los cuales se extrajeron las arterias tratadas para su inmediata congelación y posterior análisis. En los mismos plazos temporales se extrajeron muestras de sangre periférica.
La determinación de paclitaxel se realizó mediante cromatografía líquida de alta resolución. Las zonas arteriales tratadas se procesaron mediante digestión de la muestra, los extractos se concentraron a sequedad y se redisolvieron con 1 ml de acetonitrilo. Tras la inyección de la muestra en el equipo de cromatografía líquida de alta resolución (1260 Infinity HPLC-Chip/MS System, Agilent Technologies), se cuantificó la cantidad de paclitaxel por interpolación a una recta de calibrado, y los resultados se expresaron en microgramo de paclitaxel/gramo de tejido. El flujo de trabajo fue de 0,8ml/min, a través de una columna Zorbax Eclipse Plus, C18, 5 μm, 4,6×100 mm y detección a 227 nm.
Metodología estadísticaLos valores se expresan como proporciones y como media±desviación estándar, según corresponda al tipo de variable. Las variables semicuantitativas, como las escalas de las variables de seguridad analizadas por histopatología, se presentan como media±desviación estándar (la forma más habitual en las publicaciones previas) y como proporciones (como se recomienda en los documentos de consenso23,24).
Se analizan las diferencias de las medias de los grupos con un test de la t de Student y análisis de las varianzas; para comparaciones múltiples, se utilizan los métodos post-hoc de Dunnett (comparación con control) y de Tukey (comparación de todos los pares). Las variables semicuantitativas se analizan mediante el test de la χ2 y el exacto de Fisher. Para valorar la potencial influencia que distintas variables (relación stent:arteria, arteria tratada, tiempo de hinchado e injury score) pueden tener en los resultados finales, se realizan análisis multivariables de regresión logística. Se consideran significativas las diferencias con p<0,05.
RESULTADOSTodos los stents se implantaron y sobredilataron con los balones asignados según el protocolo. Durante los procedimientos se produjeron 4 complicaciones transitorias sin relación con los dispositivos analizados: 1 embolia aérea en coronaria izquierda por insuficiente purgado del catéter, que se resolvió con infusión de aminas y oxígeno al 100%, y 3 casos (1 con BLP 1, 1 con BLP 2 y 1 con balón control) de trombosis coronarias distales causadas por retraso en la administración de heparina o dosis insuficiente de esta, que se resolvieron con trombectomía. En ninguno de los casos se observó afectación final de los dispositivos implantados y sobredilatados, que se conservaron permeables y con buen flujo. La relación de sobredilatación stent:arteria obtenida en estas fases alcanzó el objetivo programado, 1,21±0,14, sin diferencias significativas entre arterias o los distintos grupos de tratamiento. En los balones extraídos tras el tratamiento, se midieron muy pequeñas cantidades de paclitaxel respecto al cargado inicialmente: BLP 1, 1,04±1,47%; BLP 2, 0,46±0,56%, y BLP 3, 4,79±3,40%, sin diferencias significativas entre ellos.
Los animales completaron el seguimiento según lo previsto, y los controles angiográficos y los análisis histológicos programados se realizaron sin incidencias. En el análisis angiográfico final todos los segmentos tratados estaban permeables. En la necropsia se observaron pequeñas zonas de infarto no transmural en los 4 animales que sufrieron complicaciones durante el procedimiento; las demás muestras cardiacas no presentaron alteraciones relevantes. Los análisis microscópicos de los órganos a distancia no mostraron datos de toxicidad, hipersensibilidad o efecto alguno del fármaco empleado.
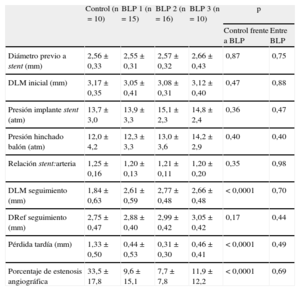
Análisis de eficacia antirreestenóticaSe observan diferencias significativas (p<0,0001) entre el balón control y los distintos BLP, tanto en la pérdida tardía (1,33±0,5 frente a 0,4±0,42mm) como en el porcentaje de estenosis por angiografía (33,5±17,8% frente a 9,4±11,8%). Las diferencias entre los distintos sistemas BLP o según el tiempo de hinchado (1 o 2 min) no son significativas (tabla 2 y tabla 1 del material suplementario).
Resultados angiográficos iniciales y a los 28 días
| Control (n=10) | BLP 1 (n=15) | BLP 2 (n=16) | BLP 3 (n=10) | p | ||
| Control frente a BLP | Entre BLP | |||||
| Diámetro previo a stent (mm) | 2,56±0,33 | 2,55±0,31 | 2,57±0,32 | 2,66±0,43 | 0,87 | 0,75 |
| DLM inicial (mm) | 3,17±0,35 | 3,05±0,41 | 3,08±0,31 | 3,12±0,40 | 0,47 | 0,88 |
| Presión implante stent (atm) | 13,7±3,0 | 13,9±3,3 | 15,1±2,3 | 14,8±2,4 | 0,36 | 0,47 |
| Presión hinchado balón (atm) | 12,0±4,2 | 12,3±3,3 | 13,0±3,6 | 14,2±2,9 | 0,40 | 0,40 |
| Relación stent:arteria | 1,25±0,16 | 1,20±0,13 | 1,21±0,11 | 1,20±0,20 | 0,35 | 0,98 |
| DLM seguimiento (mm) | 1,84±0,63 | 2,61±0,59 | 2,77±0,48 | 2,66±0,48 | <0,0001 | 0,70 |
| DRef seguimiento (mm) | 2,75±0,47 | 2,88±0,40 | 2,99±0,42 | 3,05±0,42 | 0,17 | 0,44 |
| Pérdida tardía (mm) | 1,33±0,50 | 0,44±0,53 | 0,31±0,30 | 0,46±0,41 | <0,0001 | 0,49 |
| Porcentaje de estenosis angiográfica | 33,5±17,8 | 9,6±15,1 | 7,7±7,8 | 11,9±12,2 | <0,0001 | 0,69 |
BLP: balón liberador de paclitaxel; DLM: diámetro luminal mínimo en el stent; DRef: diámetro de referencia.
Los datos expresan media ± desviación estándar.
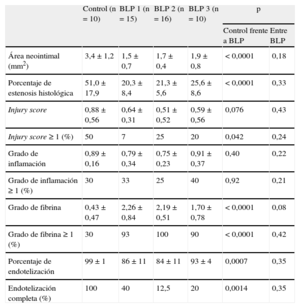
Se analizan adecuadamente por histomorfometría todos los segmentos arteriales para un total de 153 secciones. De forma concordante con los resultados angiográficos, se aprecian mejores resultados de restenosis (p<0,0001) con los distintos BLP que con el control. No se detectan diferencias entre los distintos BLP en función del tiempo de hinchado (tabla 3, tabla 2 del material suplementario y figura 1).
Resultados histológicos a los 28 días
| Control (n=10) | BLP 1 (n=15) | BLP 2 (n=16) | BLP 3 (n=10) | p | ||
| Control frente a BLP | Entre BLP | |||||
| Área neointimal (mm2) | 3,4±1,2 | 1,5±0,7 | 1,7±0,4 | 1,9±0,8 | <0,0001 | 0,18 |
| Porcentaje de estenosis histológica | 51,0±17,9 | 20,3±8,4 | 21,3±5,6 | 25,6±8,6 | <0,0001 | 0,33 |
| Injury score | 0,88±0,56 | 0,64±0,31 | 0,51±0,52 | 0,59±0,56 | 0,076 | 0,43 |
| Injury score ≥ 1 (%) | 50 | 7 | 25 | 20 | 0,042 | 0,24 |
| Grado de inflamación | 0,89±0,16 | 0,79±0,34 | 0,75±0,23 | 0,91±0,37 | 0,40 | 0,22 |
| Grado de inflamación ≥ 1 (%) | 30 | 33 | 25 | 40 | 0,92 | 0,21 |
| Grado de fibrina | 0,43±0,47 | 2,26±0,84 | 2,19±0,51 | 1,70±0,78 | <0,0001 | 0,08 |
| Grado de fibrina ≥ 1 (%) | 30 | 93 | 100 | 90 | <0,0001 | 0,42 |
| Porcentaje de endotelización | 99±1 | 86±11 | 84±11 | 93±4 | 0,0007 | 0,35 |
| Endotelización completa (%) | 100 | 40 | 12,5 | 20 | 0,0014 | 0,35 |
BLP: balón liberador de paclitaxel.
Salvo otra indicación los datos expresan media ± desviación estándar.
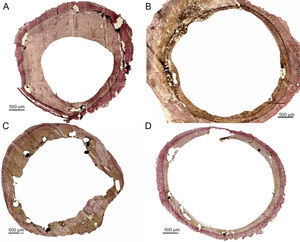
Secciones centrales de distintos stents sobredilatados con distintos balones, tinción elastina de Van Gieson. A: balón control; crecimiento neointimal significativo, sin datos de inflamación en profundidad, cobertura endotelial uniforme. Balones liberadores de paclitaxel, B: balón 1 (iVascular); C: balón 2 (iVascular), y D: balón 3 (In.Pact Falcon, Medtronic): escaso crecimiento neointimal, sin datos de inflamación en profundidad, endotelización aceptable.
Se repiten los análisis estadísticos excluyendo las arterias que habían presentado los eventos mencionados previamente, sin variación significativa en los resultados. Se realizan análisis multivariables para valorar la potencial contribución de distintos factores conocidos en los valores observados. De forma independiente, se observa menor grado de restenosis en coronaria derecha que en descendente anterior (p<0,02) y, constante en todos los modelos, con cualquier BLP que con el control (p<0,01), sin diferencias entre los distintos BLP.
Análisis de la seguridadEl análisis histológico demuestra de manera general un grado de daño vascular (injury score) bajo, sin diferencias significativas entre los grupos (control, 0,88±0,56 frente a todos los BLP, 0,58±0,46; p=0,07). El mismo fenómeno se observa en el grado de inflamación, en general muy bajo (control, 0,89±0,16 frente a todos los BLP, 0,80±0,31; p=0,4). No se observa ningún caso de necrosis de la túnica media. Sin embargo, se detectan dos diferencias significativas, características de la liberación de paclitaxel (figura 2): a) la acumulación persistente de fibrina es significativamente mayor en los BLP (2,09±0,73, sin diferencias entre ellos) que en el control (0,43±0,47; p=0,0001), y b) el porcentaje de superficie luminal endotelizada es significativamente inferior en los BLP (87±10%, sin diferencias significativas entre ellos) que en el control (99±1%; p=0,0007). Se observa reendotelización total (cobertura endotelial ≥ 95%) en el 100% de los balones control frente al 40% de los BLP 1, el 12,5% de los BLP 2 y el 20% de los BLP 3.
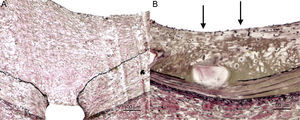
Detalle de la respuesta arterial, tinción elastina de Van Gieson. A: balón control; crecimiento neointimal significativo, con endotelización completa de la superficie luminal, sin datos de inflamación y sin restos de fibrina. B: balón liberador de paclitaxel 1 (iVascular); menor crecimiento neointimal, con aceptable endotelización luminal pero no completa (flechas) y acumulación importante de fibrina alrededor del stent en profundidad (color parduzco).
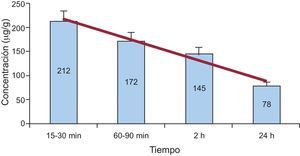
Las cantidades de paclitaxel detectadas en las arterias tratadas en este grupo de animales muestran un descenso progresivo de las concentraciones desde las primeras determinaciones a los 15-30 min con 212±32 μg/g de tejido hasta las observadas a las 24 h, en las que aún se detectan 78±9 μg/g de tejido (figura 3). No se observaron concentraciones de paclitaxel detectables en sangre periférica en ningún punto.
DISCUSIÓNLos principales resultados de este ensayo son: a) los BLP empleados en este modelo preclínico reducen de manera equivalente y significativa la restenosis causada por el implante de stent, tanto por angiografía como por histología; b) no se observa una reacción inflamatoria persistente ni un mayor grado de daño vascular que con los balones control, y c) la liberación efectiva de paclitaxel desde estos dispositivos se caracteriza por causar un retraso en la reparación vascular respecto al control, objetivable en forma de menor grado de reendotelización y mayor persistencia de fibrina en profundidad alrededor del stent.
Todos los parámetros de eficacia antirreestenótica analizados demuestran de forma consistente la superioridad de los distintos BLP frente al control sin fármaco. Estudios previos ya han demostrado la superior eficacia de distintos BLP comerciales sobre el balón control14,15, aunque en algunos casos las diferencias no eran evidentes en todos los parámetros analizados20,21. El modelo empleado es muy similar a otros anteriores con seguimiento de 28 días (equiparables a 6 meses en humanos), con valores de sobredimensión (stent:arteria, 1,21±0,14) y valores de estenosis porcentual por angiografía (33,5±17,8%) y por histología (51±17,9%) en el grupo control similares a los citados previamente14,15,20,26. En nuestra serie no hay diferencias entre los distintos BLP empleados ni en función de los tiempos de hinchado, que fue igual o superior al recomendado por los fabricantes. Estos resultados se corroboran en los análisis multivariables que limitan la influencia de posibles factores de confusión.
A pesar de la importante sobredimensión, el grado de daño vascular inducido no es muy elevado, con un valor medio de 0,64±0,49 (12 de los 51 stents presentaban injury score medio >1, pero ninguno alcanzó el valor 2). No hay diferencias entre los grupos de los distintos BLP, pero se aprecia una tendencia a mayor daño vascular en el grupo control. Esta relación no se confirma en el análisis multivariable, en el que solo se aprecia relación entre el injury score y la relación stent:arteria, ligeramente mayor en los controles (1,25±0,16) que en los BLP (1,20±0,14). No se observan entre los grupos diferencias en el grado de inflamación persistente, con valores bajos en todos los casos (media, 0,82±0,29). Este hallazgo descarta fenómenos de toxicidad, en consonancia con la ausencia de necrosis significativa de la media o de hipersensibilidad o alergia. La ausencia de los polímeros que se emplean en muchos de los stents liberadores de fármacos y que pueden perpetuar estos fenómenos anormales de reparación vascular5,6,11–13 explicaría esta respuesta.
Sin embargo, sí se observan dos fenómenos asociados con retraso en la reparación vascular, muy directamente relacionados con el efecto antiproliferativo del paclitaxel: la reendotelización es ligera pero significativamente menor con los BLP que con el control; la presencia de fibrina alrededor del stent también es significativamente mayor con los BLP que con el control. Esta observación coincide plenamente con lo descrito previamente: Joner et al20 demostraron que solo los BLP eficaces en la reducción de restenosis muestran menor grado de reendotelización y mayor grado de fibrina. Estas observaciones deben interpretarse como prueba de concepto de la transferencia efectiva de paclitaxel a la arteria. Algunos estudios previos refieren en forma descriptiva una adecuada endotelización de los stents sobredilatados con BLP a los 28 días14,15, si bien es cierto que la valoración de la reendotelización de la arteria tras estos tratamientos es compleja, como refleja la ausencia de una única clasificación para evaluarla27. En cualquier caso, la superficie endotelizada de los stents sobredilatados con BLP oscila entre el 84±3% y el 95±4%, muy similar a lo descrito previamente con los BLP con eficacia antirreestenótica20,21.
La transferencia del fármaco desde los BLP es muy elevada, pues menos del 10% del cargado inicialmente en el balón permanece tras el procedimiento. Las concentraciones de paclitaxel medidas demuestran su persistencia en la pared arterial hasta 24 h tras su administración, lo que explica que un tiempo mínimo de aplicación del fármaco puede traducirse en efectos a más largo plazo. Los valores medidos son prácticamente superponibles a los observados en otros estudios31, en los que se aprecia una reducción lineal de las concentraciones desde la aplicación del balón hasta las 24 h, con posterior persistencia de los valores, sin grandes cambios hasta los 28 días.
LimitacionesComo todos los modelos preclínicos, esta serie tiene sus limitaciones inherentes: ningún modelo animal reproduce todas las complejas características de la enfermedad humana. Los modelos de animal enfermo podrían reflejar algunas de estas particularidades, pero aún se desconoce su significado exacto, por ello se recomienda el modelo empleado para analizar la respuesta vascular a este tipo de dispositivos23,24. El modelo concreto de implante de stent coronario y posterior sobredilatación con balones no refleja exactamente todas las condiciones clínicas en que se usan estos dispositivos, pero constituye el mejor modelo experimental en términos de inducción de restenosis, como lo demuestra su uso en las series previamente publicadas14,15,20,21,31. Este modelo comparte características de las lesiones de novo y de la restenosis; la discutida menor eficacia de los BLP en la primera situación podría influir en la ausencia de diferencias entre los BLP. Si bien los resultados observados no permiten señalar diferencias entre los BLP analizados, no es descartable que existan entre otros diseños no incluidos en este estudio20,22. La evaluación histológica con valoraciones semicuantitativas también supone una limitación en la precisión; sin embargo, se emplean las escalas consensuadas23,24. El modelo empleado para el estudio farmacocinético también puede ser discutible por no tener en cuenta el importante papel que la presencia de placa aterosclerótica puede tener en la captación del fármaco.
CONCLUSIONESEn el modelo preclínico de coronarias normales porcinas con implante de stent y sobredilatación con balón, los BLP analizados muestran una reducción significativa de la restenosis en comparación con el control. Aunque no se observan datos de daño vascular o inflamación persistentes, sí se aprecian los efectos de la acción farmacológica en forma de endotelización retrasada y acumulación de fibrina en profundidad.
FINANCIACIÓNDesarrollado parcialmente con ayuda CDTI (Centro para el Desarrollo Tecnológico Industrial, Ministerio de Economía y Competitividad) IDI-20111025.
CONFLICTO DE INTERESESLos Dres. Armando Pérez de Prado y Felipe Fernández-Vázquez son asesores y reciben ayudas no condicionadas para la realización de distintos proyectos de investigación LVD Biotech/iVascular. María Molina, Alex Gómez y Luis Duocastella son empleados de LVD Biotech/iVascular. Luis Duocastella es accionista de LVD Biotech/iVascular. Los demás autores no tienen conflictos de intereses que declarar.