La diabetes mellitus está asociada a mayor riesgo de enfermedad cardiovascular y su prevalencia está en aumento. La diabetes mellitus induce estrés metabólico a las células vasculares, lo cual promueve la activación plaquetaria y la disfunción vascular. El grado de activación de las células vasculares se puede medir con el número y el fenotipo de las micropartículas circulantes. El objetivo de este estudio es investigar el efecto de una dosis de ácido acetilsalicílico con acción inhibidora plaquetaria en el número y el tipo de las micropartículas liberadas a la circulación.
MétodosSe inscribió a 43 pacientes diabéticos que recibieron una dosis diaria de 100mg de ácido acetilsalicílico durante 10 días, con objeto de cubrir el periodo medio de vida de las plaquetas en la circulación. Antes y después del periodo de intervención, se caracterizaron y cuantificaron las micropartículas circulantes mediante citometría de flujo.
ResultadosRespecto a los pacientes con diabetes mellitus tipo 2, aquellos con diabetes mellitus tipo 1 presentaron el doble de micropartículas circulantes positivas para factor tisular (derivadas de plaquetas y monocitos) y micropartículas positivas para selectina E de origen endotelial. El tratamiento con ácido acetilsalicílico inhibió significativamente las plaquetas, puesto que la generación de tromboxano derivado de la ciclooxigenasa 1 disminuyó un 99%. Se produjo una reducción significativa de las micropartículas derivadas de eritrocitos, monocitos activados y células de músculo liso tras 10 días de administración de ácido acetilsalicílico.
ConclusionesEstos resultados indican que: a) las células vasculares y hemáticas de los pacientes con diabetes mellitus tipo 1 están expuestas a un mayor estrés continuo, que se refleja en el origen y la cantidad de sus micropartículas; b) el tratamiento con ácido acetilsalicílico inhibe la activación de las células de la pared vascular y la liberación de micropartículas, y c) los efectos del ácido acetilsalicílico son similares en la diabetes mellitus tipos 1 y 2.
Palabras clave
La diabetes mellitus (DM) se asocia en gran medida a complicaciones microvasculares y macrovasculares y a un aumento del riesgo de enfermedad cardiovascular (ECV)1. Dado que la prevalencia de la DM está aumentando en todo mundo, se ha estimado que en 2030 habrá aproximadamente 552 millones de personas con DM, de las que más de un 95% tendrán DM tipo 2 (DM2)2. Se han propuesto diversos mecanismos para explicar el aumento del riesgo cardiovascular (CV) que se da en la DM, como el aumento de la tendencia a la formación de trombos intracoronarios, el aumento de la reactividad plaquetaria y el agravamiento de la disfunción endotelial3. Dado que hasta un 80% de los individuos con DM acaban falleciendo por causas CV, los tratamientos basados en la evidencia que reducen las ECV son de la máxima importancia.
La recomendación de emplear ácido acetilsalicílico (AAS) a dosis bajas para la prevención primaria de eventos CV en adultos con DM ha sido objeto de controversia2,3. El AAS es un fármaco antiinflamatorio no esteroideo y también el antiagregante plaquetario utilizado más comúnmente, debido a su bajo coste y la relativa ausencia de efectos adversos cuando se administra en dosis bajas. El AAS inhibe la formación de tromboxano A2 plaquetario, un potente vasoconstrictor y agonista plaquetario, a través de la acetilación de la ciclooxigenasa 1 en la posición de serina-530, con lo que impide la unión del ácido araquidónico al lugar activo enzimático4,5. Aparte de su efecto inhibidor de la formación de tromboxano, el AAS puede tener efectos pleotrópicos, que implican acciones antioxidantes y antiinflamatorias6, pero continúan sin estar claros los efectos del fármaco en cuanto a la inhibición de la activación celular en el compartimento vascular y la liberación de micropartículas.
Las micropartículas circulantes (MPc) son pequeñas microvesículas, ricas en fosfolípidos de entre 0,1 y 1 μm de diámetro, que liberan las células hemáticas o endoteliales activadas y se definen según su tamaño y la expresión de antígenos de tipos celulares específicos en su superficie7. Estudios recientes han demostrado que estas MPc desempeñan un papel clave en la trombosis, la inflamación y la angiogénesis8,9, que son esenciales en la instauración de las complicaciones diabéticas. Aunque están presentes en el plasma de los individuos sanos, en los trastornos vasculares se ha descrito un número elevado de determinados subgrupos activados específicos de MPc10–13. Las MPc proceden de las células y contienen fosfatidilserina, así como proteínas de superficie específicas en función de sus células de origen. Pueden proceder de plaquetas, células endoteliales, leucocitos, eritrocitos y células de músculo liso14. Algunas de ellas tienen propiedades procoagulantes potentes a causa de la exposición de fosfolípidos aniónicos, como la fosfatidilserina, de un modo similar que las plaquetas activadas, y proporcionan una superficie catalítica que puede promover la coagulación, puesto que la fosfatidilserina facilita la unión de los factores de la coagulación y la combinación de los complejos de la coagulación, con lo que acelera la formación de trombina15. Según lo indicado por una revisión16, los pacientes con DM y complicaciones diabéticas presentan diferentes patrones de MPc celulares, y las concentraciones sanguíneas de las MPc derivadas de plaquetas, las derivadas de células endoteliales y las micropartículas totales anexina V (AV)+ están aumentadas significativamente en la DM tipo 1 (DM1). En los pacientes con DM2, se han observado concentraciones de todas las micropartículas17 y las MPc plaquetarias, leucocitarias, monocitarias y de origen endotelial, en comparación con las de los sujetos de control de iguales características18–21.
Así pues, el objetivo de este estudio es determinar el efecto de la administración de AAS en la liberación de micropartículas y su fenotipo en pacientes diabéticos.
MÉTODOSPacientes diabéticosSe reclutó para el estudio en la clínica ambulatoria del Hospital de la Santa Creu i Sant Pau de Barcelona a un total de 43 pacientes diabéticos de atención primaria (varones y mujeres), de entre 41 y 73 años de edad, tratados según lo establecido en las guías internacionales. Los pacientes incluidos en el estudio tenían DM1 y DM2 y los criterios de exclusión fueron: toma de AAS o ibuprofeno en los últimos 10 días, contraindicaciones para el empleo de AAS o bloqueadores beta, úlcera péptica, aumento del riesgo hemorrágico y antecedentes de cáncer, trastornos inflamatorios, sepsis, infección o embarazo.
El protocolo del estudio fue aprobado por el comité de ética de investigación del hospital, y el ensayo se llevó a cabo según la Declaración de Helsinki. Todos los participantes dieron su consentimiento por escrito para la participación en el estudio. Después del examen de selección y la inclusión en el estudio, se realizó una historia clínica para registrar los datos de estilo de vida, médicos y terapéuticos, así como las determinaciones basales. A continuación, los pacientes iniciaron el periodo de intervención, durante el cual se les administraron 100mg de AAS diariamente durante 10 días. Se realizaron extracciones de sangre antes (situación basal) y después del periodo de intervención con AAS.
Con objeto de asegurar la adherencia al tratamiento con AAS y su eficacia, se verificó la inhibición de la ciclooxigenasa 1 y se determinó la inhibición de la formación de tromboxano B2 mediante un kit comercial de enzimoinmunoanálisis (Thromboxane B2 Express Eia Kit-Monoclonal, Cayman Chemical) siguiendo las recomendaciones del fabricante.
Sujetos de controlComo sujetos de control, se incluyó a 38 participantes con un riesgo CV moderado-alto, que no presentaban DM ni ECV, igualados en las variables sexo, edad, factores de riesgo CV clásicos y uso de estatinas. Se reclutó a los controles a partir de la cohorte SAFEHEART22, un estudio multicéntrico de larga duración prospectivo y abierto. Ninguno de los participantes del grupo de control estaba en tratamiento con AAS. Mediante un formulario estandarizado, en el momento de la inclusión se obtuvieron de todos los participantes datos relativos a las características demográficas y clínicas, los antecedentes CV, los factores de riesgo CV clásicos y el tratamiento actual para la hipercolesterolemia.
Obtención de muestras de sangreSe extrajeron muestras de sangre de la vena cubital, sin aplicar torniquete, utilizando una aguja de calibre 20, después de 10-14 h en ayunas, y se colocaron en tubos con citrato de sodio al 3,8%. Se retiraron las células sanguíneas mediante centrifugación a baja velocidad (250 × g, 15 min) a temperatura ambiente, con objeto de evitar la activación plaquetaria in vitro. Se realizó una cuidadosa aspiración del plasma rico en plaquetas, dejando una capa inalterada de alrededor de 0,1 cm por encima de las células. Se realizó una segunda centrifugación (11.000 × g, 10 min, a temperatura ambiente) con objeto de asegurar que se eliminaban por completo las células y las plaquetas, para obtener un plasma con depleción de plaquetas. Se aplicó una tercera etapa de centrifugación (11.000 × g, 2 min, a temperatura ambiente) con objeto de asegurar la eliminación completa de las plaquetas y obtener un plasma sin plaquetas. Todas las muestras se procesaron de manera idéntica y en un plazo de 60 min tras la extracción. Las muestras de plasma sin plaquetas de 250 μl se congelaron de inmediato en nitrógeno líquido y se conservaron a –80°C hasta su procesamiento para aislar y cuantificar las MPc.
Aislamiento y cuantificación de micropartículas circulantesSe aisló la fracción de MPc del plasma sin plaquetas mediante una centrifugación a alta velocidad en dos etapas. Resumidamente, se descongelaron muestras de 250 μl de plasma sin plaquetas congelado, manteniéndolas en hielo en proceso de fusión durante 1 h, y se centrifugaron a 20.000 × g durante 30min a 30°C para la sedimentación de las MPc. Se desecharon los sobrenadantes y se lavó el sedimento enriquecido en MPc con solución salina tamponada con citrato-fosfato (fosfato 1,4 mmol/l; NaCl 154 mmol/l; citrato trisódico 10,9 mM, y pH 7,4) antes de una segunda etapa de centrifugación de las mismas características. Por último, se resuspendieron los sedimentos de MPc restantes en 100 μl de solución tamponada de citrato-fosfato.
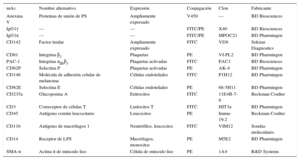
Se llevó a cabo un análisis de citometría de flujo de triple marcado, según lo descrito por Suades et al23. De manera resumida, se diluyeron 5 μl de suspensiones de MPc lavadas en 30 μl de solución salina tamponada con fosfato, con un contenido de CaCl2 2,5 mM (tampón de unión de anexina). A continuación, se agregaron combinaciones de 5 μl de AV conjugada con V450 (BD-horizon) con dos anticuerpos monoclonales específicos (mAc) (5 μl de cada uno) (tabla 1), marcados con isotiocianato de fluoresceína o ficoeritrina, o con anticuerpos de control isotípico. Las muestras se incubaron a oscuras durante 20 min a temperatura ambiente y se diluyeron con el tampón de unión de anexina antes de analizarlas de inmediato en un citómetro de flujo FACSCantoIITM (excepto en el caso de las micropartículas derivadas de células de músculo liso). Las micropartículas derivadas de células de músculo liso se cuantificaron por separado según un método descrito con anterioridad14. Resumidamente, se incubaron a oscuras 5 μl de la suspensión de MPc durante 20 min a temperatura ambiente, con 5 μl de AV-V450 y 5 μl de CD142-(factor tisular [FT])-isotiocianato de fluoresceína en un volumen final de 50 μl de tampón de unión de anexina. Las MPc se fijaron con 450 μl de tampón de unión de anexina/paraformaldehído al 2% durante 30 min y se centrifugaron a 20.000 × g durante 30 min para sedimentar las MPc. Después de eliminar el sobrenadante, las MPc se permeabilizaron con 20 μl de tampón de unión de anexina/saponina al 0,1% durante 20 min a temperatura ambiente y a oscuras. Tras la permeabilización, se añadieron 5 μl de actina de músculo liso-α-ficoeritrina a la suspensión de MPc y se incubó a oscuras durante 20 min a temperatura ambiente, y finalmente se diluyó con tampón de fijación de anexina antes de los análisis con el citómetro de flujo.
Moléculas de la superficie celular para la identificación y caracterización de las micropartículas circulantes
| mAc | Nombre alternativo | Expresión | Conjugación | Clon | Fabricante |
|---|---|---|---|---|---|
| Anexina V | Proteínas de unión de PS | Ampliamente expresado | V450 | — | BD Biosciences |
| IgG1γ | — | — | FITC/PE | X40 | BD Biosciences |
| IgG1κ | — | — | FITC/PE | MPOC21 | BD Pharmingen |
| CD142 | Factor tisular | Ampliamente expresado | FITC | VD8 | Sekisui Diagnostics |
| CD61 | Integrina β3 | Plaquetas | PE | VI-PL2 | BD Pharmingen |
| PAC-1 | Integrina αIIbβ3 | Plaquetas activadas | FITC | PAC1 | BD Biosciences |
| CD62P | Selectina P | Plaquetas activadas | PE | AK-4 | BD Pharmingen |
| CD146 | Molécula de adhesión celular de melanoma | Células endoteliales | FITC | P1H12 | BD Pharmingen |
| CD62E | Selectina E | Células endoteliales | PE | 68-5H11 | BD Pharmingen |
| CD235a | Glucoporina A | Eritrocitos | FITC | 11E4B-7-6 | Beckman Coulter |
| CD3 | Correceptor de células T | Linfocitos T | FITC | HIT3a | BD Pharmingen |
| CD45 | Antígeno común leucocitario | Leucocitos | PE | Immu-19.2 | Beckman Coulter |
| CD11b | Antígeno de macrófagos 1 | Neutrófilos, leucocitos | FITC | VIM12 | Sondas moleculares |
| CD14 | Receptor de LPS | Macrófagos, monocitos | PE | M5E2 | BD Pharmingen |
| SMA-α | Actina α de músculo liso | Célula de músculo liso | PE | 1A4 | R&D Systems |
FITC: isotiocianato de fluoresceína; LPS: lipopolisacárido; mAc: anticuerpo monoclonal; PE: ficoeritrina; PS: fosfatidilserina; SMA: actina de músculo liso.
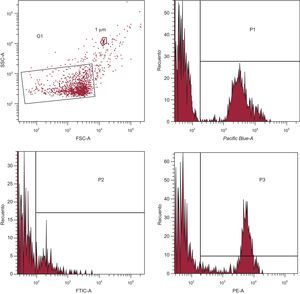
La adquisición se llevó a cabo a 1 min por muestra. Se obtuvieron datos de dispersión frontal, dispersión lateral y fluorescencia en una escala logarítmica. Las MPc se identificaron y cuantificaron en función de sus características de dispersión frontal/dispersión lateral, según su tamaño, la unión a la AV y la reactividad contra mAc para células específicas (figura 1).
Estrategia de selección y adquisición para la detección de las micropartículas circulantes en el análisis FACS. Se establecieron los límites de selección antes de los análisis mediante el Flow Check YG Size Range Calibration Kit (Polysciences; Warrington, Pensilvania, Estados Unidos). G1 se fijó según el tamaño de las micropartículas circulantes y su granularidad (definida como < 1 μm). Se seleccionaron las micropartículas anexina V+ circulantes cuantificadas en el canal Pacific Blue (P1) de G1. Se seleccionaron las micropartículas circulantes unidas a los anticuerpos marcados con isotiocianato de fluoresceína (P2) y/o ficoeritrina (P3) (véase la tabla 1) de P1 y se cuantificaron. FITC: isotiocianato de fluoresceína; FSC: dispersión frontal; PE: ficoeritrina; SSC: dispersión lateral.
La contribución de los granulocitos se infirió restando los agranulocitos (linfocitos más monocitos) del total de leucocitos, en vez de marcación con mAc específicos. Se establecieron los límites de aceptación siguiendo los criterios descritos con anterioridad23. El límite inferior de detección se estableció como umbral por encima del ruido electrónico de fondo del citómetro de flujo. Para identificar los eventos con tinción positiva, también se establecieron umbrales basados en las muestras incubadas con la misma concentración final de anticuerpos de control isotípico, tras los experimentos de titulación. El nivel de fijación de AV se corrigió respecto a la autofluorescencia utilizando señales de fluorescencia obtenidas con micropartículas en solución salina tamponada con fosfato y carente de calcio.
Los datos se analizaron con el programa informático FACSDivaTM (versión 6.1.3, Becton Dickinson). La concentración de MPc (número de MPc por microlitro de plasma sin plaquetas) se determinó mediante fórmula de Nieuwland15, con base en el volumen de la muestra, el caudal del citómetro de flujo y el número de eventos positivos para fluorescencia (N), de la siguiente manera: MPc/μl = N × (Vf / Va) × (Vt / FR) × (1 / Vi) [donde Vf (μl) es el volumen final de suspensión de MPc lavadas, Va (μl) es el volumen de suspensión de MPc lavadas utilizado para cada análisis de marcación, Vt (μl) es el volumen total de suspensión de MPc antes del análisis por citometría de flujo, FR (μl/min) es el caudal del citómetro de flujo en el modo de funcionamiento bajo (volumen medio de suspensión de micropartículas analizado en 1 min), 1 es la unidad de volumen en microlitros, y Vi (μl) es el volumen original de plasma utilizado para el aislamiento de las micropartículas. Se determinó el caudal de flujo antes de cada experimento. Con objeto de reducir el ruido de fondo, los tampones se prepararon el mismo día y se filtraron mediante filtros con poros de 0,2 μm en condiciones de baja presión por vacío.
Análisis estadísticoLos análisis estadísticos se realizaron con el programa SPSS Statistical Analysis System (versión 22.0). Se utilizó estadística descriptiva [media ± desviación estándar o n (%)] para describir las características basales de los pacientes y las variables de valoración de los resultados. Para el análisis de los cambios aparecidos tras el tratamiento con AAS, se utilizó una prueba de la t de Student bilateral para muestras apareadas con los datos obtenidos antes y después de la intervención. Se utilizó un análisis de varianza de una vía para comparar las diferencias existentes en los cambios de las variables de valoración en función del tipo de DM. Se tomó como criterio de valoración principal el cambio de las MPc después del tratamiento con AAS. Se consideraron significativos los valores de p < 0,05.
RESULTADOSCaracterísticas basalesLas características basales de los 43 pacientes diabéticos incluidos en el estudio (13 con DM1 y 30 con DM2; media de tiempo de evolución de la enfermedad, 17 años) se presentan en la tabla 2, y en la se recogen las características de los controles. La media de edad de la población diabética era 55 años; un 56% eran varones; un 21%, fumadores activos; un 93% presentaba dislipemia, y un 91% eran hipertensos. Un 53% de los pacientes estaban en tratamiento con inhibidores de la enzima de conversión de la angiotensina; un 65%, con antagonistas del receptor de la angiotensina II; un 7%, con bloqueadores beta; un 19%, con doxazosina; un 37%, con diuréticos; un 77%, con estatinas, y un 33%, con ezetimiba.
Características basales de los 43 pacientes diabéticos estudiados
| Todos | DM1 (n = 13) | DM2 (n = 30) | p | |
|---|---|---|---|---|
| Edad (años) | 55 ± 10 | 47 ± 5 | 59 ± 10 | < 0,0001 |
| Varones | 24 (55,8) | 7 (53,8) | 17 (56,7) | 0,798 |
| Fumadores actuales | 9 (20,9) | 3 (23,1) | 6 (20,0) | 0,317 |
| Dislipemia | 40 (93,0) | 8 (61,5) | 29 (96,7) | 0,001 |
| Hipertensión | 40 (90,7) | 10 (76,9) | 30 (100,0) | 0,02 |
| Evolución (años) | 17 ± 10 | 25 ± 10 | 13 ± 9 | 0,001 |
| Retinopatía | 5 (11,6) | 3 (23,1) | 2 (6,7) | 0,655 |
| Nefropatía | 1 (2,3) | 1 (7,7) | 0 (0,0) | 0,06 |
| Polineuropatía | 3 (7,0) | 1 (7,7) | 2 (6,7) | 0,564 |
| Eventos cardiovasculares | 0 (0) | 0 (0) | 0 (0) | 1,000 |
| Índice de masa corporal (kg/m2) | 25,70 ± 3,04 | 24,38 ± 2,21 | 26,12 ± 3,25 | 0,086 |
| Índice de masa corporal > 25 kg/m2 | 21 (48,8) | 5 (38,5) | 17 (56,7) | 0,011 |
| Presión arterial sistólica (mmHg) | 138 ± 14 | 132 ± 15 | 141 ± 12 | 0,054 |
| Presión arterial diastólica (mmHg) | 81 ± 8 | 80 ± 8 | 81 ± 9 | 0,840 |
| Glucosa (mmol/l) | 8,5 ± 2,8 | 8,9 ± 3,9 | 8,3 ± 2,1 | 0,529 |
| HbA1c(%) | 7,8 ± 0,7 | 7,9 ± 0,5 | 7,7 ± 0,8 | 0,447 |
| Triglicéridos (mmol/l) | 1,4 ± 1,2 | 1,5 ± 2,0 | 1,3 ± 0,7 | 0,753 |
| Colesterol total (mmol/l) | 4,8 ± 0,9 | 5,3 ± 1,0 | 4,6 ± 0,8 | 0,027 |
| Colesterol unido a LDL (mmol/l) | 2,6 ± 0,7 | 2,6 ± 0,6 | 2,6 ± 0,7 | 0,185 |
| Colesterol unido a HDL (mmol/l) | 1,4 ± 0,4 | 1,5 ± 0,5 | 1,3 ± 0,4 | 0,805 |
| Cociente colesterol unido a LDL/colesterol unido a HDL | 2,1 ± 0,8 | 1,8 ± 0,7 | 2,2 ± 0,8 | 0,142 |
| Colesterol no unido a HDL (mmol/l) | 3,5 ± 0,8 | 3,8 ± 0,9 | 3,3 ± 0,8 | 0,150 |
| Potasio (mEq/l) | 4,8 ± 0,3 | 4,6 ± 0,3 | 4,8 ± 0,2 | 0,014 |
| Urea (mmol/l) | 7,5 ± 1,8 | 6,8 ± 1,5 | 7,8 ± 1,8 | 0,079 |
| Creatinina en plasma (mmol/l) | 82,1 ± 16,6 | 76,8 ± 18,5 | 85,0 ± 15,7 | 0,142 |
| Creatinina en orina (pmol/l) | 8,1 ± 3,6 | 8,7 ± 4,1 | 7,8 ± 3,4 | 0,505 |
| Filtrado glomerular (ml/min) | 50,3 ± 19,5 | 57,1 ± 3,6 | 49,4 ± 20,6 | 0,625 |
| Fármacos antidiabéticos | ||||
| Metformina | 22 (51,2) | 0 (0,0) | 22 (73,3) | < 0,0001 |
| Sulfonilurea | 5 (11,6) | 0 (0,0) | 5 (16,7) | < 0,0001 |
| Glinidas | 8 (18,6) | 0 (0,0) | 8 (26,7) | < 0,0001 |
| Sitagliptina | 6 (13,9) | 0 (0,0) | 6 (20,0) | < 0,0001 |
| Insulina | 35 (81,4) | 11 (84,6) | 24 (80,0) | 0,428 |
| Antiagregantes plaquetarios | 15 (34,9) | 3 (23,1) | 12 (40,0) | 0,012 |
| Fármacos antihipertensivos | ||||
| IECA | 23 (53,5) | 8 (61,5) | 15 (50,0) | 0,523 |
| ARA–II | 28 (65,1) | 3 (23,1) | 25 (83,3) | < 0,0001 |
| Bloqueadores beta | 3 (7,0) | 1 (7,7) | 2 (6,7) | 0,317 |
| Bloqueadores alfa | 8 (18,6) | 4 (30,8) | 4 (13,3) | 0,851 |
| Diuréticos | 16 (37,2) | 2 (15,4) | 14 (46,7) | 0,002 |
| Fármacos hipolipemiantes | ||||
| Estatinas | 33 (76,7) | 6 (46,2) | 27 (90,0) | < 0,0001 |
| Ezetimiba | 14 (32,6) | 1 (7,7) | 13 (43,3) | 0,001 |
ARA-II: antagonistas de los receptores de la angiotensina II; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; HBA1c: glucohemoglobina; HDL: lipoproteínas de alta densidad; IECA: inhibidores de la enzima de conversión de la angiotensina; LDL: lipoproteínas de baja densidad.
Los valores expresan n (%) o media ± desviación estándar. Valor de p según un análisis de la varianza de una vía para las variables cuantitativas y según prueba de la X2 para las variables cualitativas.
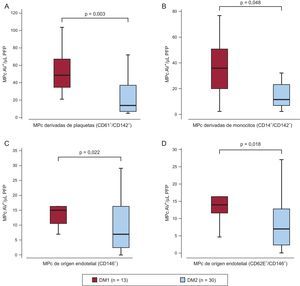
Los pacientes con DM1 tenían una media de 25 ± 10 años de evolución de la enfermedad, mientras que con DM2, 13 ± 9 años (análisis de la varianza de una vía, p = 0,001). En la situación basal, los pacientes con DM1 tenían aproximadamente el doble de MPc FT+ de origen plaquetario y monocitario y MPc CD62E+/– de origen endotelial que los participantes con DM2 (figura 2), lo cual posiblemente refleje la exposición a estrés metabólico durante toda la vida. De hecho, los valores basales de estas MPc mostraron correlación positiva con el tiempo de evolución de la enfermedad (Spearman, ρ = 0,371, ρ = 0,402, ρ = 0,330 y ρ = 0,335; p = 0,014, p = 0,008, p = 0,029 y p = 0,025, para las MPc FT+ derivadas de plaquetas y monocitos y las MPc CD62E+/– de origen endotelial respectivamente).
Diferencias en las micropartículas circulantes anexina V+ basales según el tipo de diabetes mellitus. Gráficos de caja y bigotes que muestran el número de micropartículas circulantes positivas para el factor tisular (CD142+) de origen plaquetario (CD61+) (A) y de origen monocitario (CD14+) (B) y micropartículas circulantes de origen endotelial (CD146+) (C) y micropartículas circulantes de células endoteliales activadas (CD146+/CD62E+) (D) antes de la intervención con ácido acetilsalicílico según el tipo de diabetes mellitus. AAS: ácido acetilsalicílico; AV: anexina V; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; MPc: micropartículas circulantes; PFP: plasma libre de plaquetas. Las líneas del interior de los recuadros corresponden a los valores de mediana, los recuadros superior e inferior indican los percentiles 25 y 75, respectivamente, y las barras superiores e inferiores de fuera de los recuadros corresponden a los percentiles 10 y 90 respectivamente. Valor de p obtenido mediante un análisis de la varianza del número de micropartículas circulantes dependiendo del tipo de diabetes mellitus.
En comparación con los controles, antes del tratamiento con AAS, los pacientes presentaban mayores concentraciones de todas las MPc cuantificadas, excepto las MPc de origen eritrocitario (CD235ab+), CD11b+/AV+ y el conjunto de las cargadas con FT (CD142+), que mostraron valores similares a las de los controles ().
Inhibición de la activación plaquetariaComo medida de la eficacia del AAS, se determinó la concentración de tromboxano B2 en suero (obtenido en la misma extracción de sangre que para los tubos con citrato) antes y después de la intervención con 100 mg de AAS durante 10 días. Después del tratamiento con AAS, la inhibición de la ciclooxigenasa 1 fue > 99%, ya que la concentración basal de tromboxano B2 era de alrededor de 18,8 ± 2,8 ng/ml y, después de la intervención, 0,26 ± 0,19 ng/ml, lo cual indica ausencia de seudorresistencia al AAS y que el cumplimiento de la intervención fue excelente.
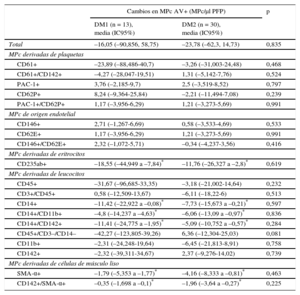
Cambios inducidos por el ácido acetilsalicílico en las micropartículas circulantesLos efectos generales del AAS fueron similares en ambos tipos de DM (tabla 3). En consecuencia, los cambios observados en la liberación de micropartículas tras la intervención con AAS se expresaron teniendo en cuenta conjuntamente ambos tipos de DM.
Cambios en las micropartículas circulantes después de la intervención con ácido acetilsalicílico según el tipo de diabetes mellitus
| Cambios en MPc AV+ (MPc/μl PFP) | p | ||
|---|---|---|---|
| DM1 (n = 13), media (IC95%) | DM2 (n = 30), media (IC95%) | ||
| Total | –16,05 (–90,856, 58,75) | –23,78 (–62,3, 14,73) | 0,835 |
| MPc derivadas de plaquetas | |||
| CD61+ | –23,89 (–88,486-40,7) | –3,26 (–31,003-24,48) | 0,468 |
| CD61+/CD142+ | –4,27 (–28,047-19,51) | 1,31 (–5,142-7,76) | 0,524 |
| PAC-1+ | 3,76 (–2,185-9,7) | 2,5 (–3,519-8,52) | 0,797 |
| CD62P+ | 8,24 (–9,364-25,84) | –2,21 (–11,494-7,08) | 0,239 |
| PAC-1+/CD62P+ | 1,17 (–3,956-6,29) | 1,21 (–3,273-5,69) | 0,991 |
| MPc de origen endotelial | |||
| CD146+ | 2,71 (–1,267-6,69) | 0,58 (–3,533-4,69) | 0,533 |
| CD62E+ | 1,17 (–3,956-6,29) | 1,21 (–3,273-5,69) | 0,991 |
| CD146+/CD62E+ | 2,32 (–1,072-5,71) | –0,34 (–4,237-3,56) | 0,416 |
| MPc derivadas de eritrocitos | |||
| CD235ab+ | –18,55 (–44,949 a –7,84)* | –11,76 (–26,327 a –2,8)* | 0,619 |
| MPc derivadas de leucocitos | |||
| CD45+ | –31,67 (–96,685-33,35) | –3,18 (–21,002-14,64) | 0,232 |
| CD3+/CD45+ | 0,58 (–12,509-13,67) | –6,11 (–18,22-6) | 0,513 |
| CD14+ | –11,42 (–22,922 a –0,08)* | –7,73 (–15,673 a –0,21)* | 0,597 |
| CD14+/CD11b+ | –4,8 (–14,237 a –4,63)* | –6,06 (–13,09 a –0,97)* | 0,836 |
| CD14+/CD142+ | –11,41 (–24,775 a –1,95)* | –5,09 (–10,752 a –0,57)* | 0,284 |
| CD45+/CD3–/CD14– | –42,27 (–123,805-39,26) | 6,36 (–12,304-25,03) | 0,081 |
| CD11b+ | –2,31 (–24,248-19,64) | –6,45 (–21,813-8,91) | 0,758 |
| CD142+ | –2,32 (–39,311-34,67) | 2,37 (–9,276-14,02) | 0,739 |
| MPc derivadas de células de músculo liso | |||
| SMA-α+ | –1,79 (–5,353 a –1,77)* | –4,16 (–8,333 a –0,81)* | 0,463 |
| CD142+/SMA-α+ | –0,35 (–1,698 a –0,1)* | –1,96 (–3,64 a –0,27)* | 0,225 |
AV: anexina V; DM1: diabetes mellitus tipo 1; DM2: diabetes mellitus tipo 2; IC95%: intervalo de confianza del 95%; MPc: micropartículas circulantes; PFP: plasma libre de plaquetas; SMA: actina de músculo liso.
Los marcadores utilizados fueron CD61 para las plaquetas, CD146 para las células endoteliales, CD235ab para los eritrocitos, CD45 para el total de leucocitos, CD3 para los linfocitos y CD14 para los monocitos como origen de los agranulocitos. La subpoblación de granulocitos se infirió restando la subpoblación de agranulocitos de la fracción de leucocitos, y se utilizó la actina de músculo liso-α para las células de músculo liso. Los demás CD se utilizaron como biomarcadores de la activación celular (véase la tabla 1).
p < 0,05 para la comparación antes-después de la intervención (prueba de la t de Student para muestras apareadas). Valor de p obtenido mediante un análisis de la varianza de una vía para los cambios de las micropartículas circulantes tras la intervención de ácido acetilsalicílico, según el tipo de diabetes mellitus.
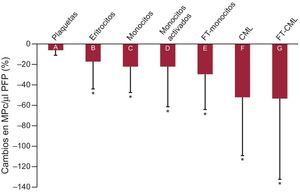
Tal como se muestra en la figura 3, al cabo de 10 días de administración de AAS, las MPc de origen eritrocitario (CD235a+/AV+) disminuyeron en un ∼17%. Las MPc derivadas de monocitos disminuyeron en un ∼22% (CD14+/AV+) y las MPc procedentes de monocitos activos se redujeron también (un ∼22 las MPc CD11b+/CD14+/AV+ y un 29% las MPc CD142+/CD14+/AV+). Además, las MPc derivadas de células de músculo liso se redujeron en un ∼52% (actina de músculo liso-α+/AV+) y las MPc derivadas de células de músculo liso que expresaban el FT (CD142+/actina de músculo liso-α+/AV+) disminuyeron también en un ∼54%.
Diferencias expresadas en porcentaje de disminución de las micropartículas circulantes anexina V+ antes y después de la intervención con ácido acetilsalicílico. A: CD61+. B: CD235a+. C: CD14+. D: CD14+/CD11b+. E: CD14+/CD142+. F: actina alfa de músculo liso+. G: actina alfa de músculo liso+/CD142+. Se utilizó el CD61 como biomarcador de las plaquetas, el CD235a para los eritrocitos, el CD14 para los monocitos y la actina alfa de músculo liso para las micropartículas originadas en células de músculo liso. Se utilizaron el CD142 (factor tisular) y el CD11b (integrina αM) como biomarcadores de activación celular. AV: anexina V; CML: célula de músculo liso; MPc: micropartículas circulantes; FT: factor tisular. *p < 0,05 para la comparación antes-después de la intervención (prueba de la t de Student para muestras apareadas).
Por otra parte, las concentraciones de MPc CD11b+/CD14+/AV+, actina de músculo liso-α+/AV+ y CD142+/actina de músculo liso-α+/AV+ alcanzaron después de la intervención con AAS valores similares a las de los controles no diabéticos con riesgo CV elevado.
Las concentraciones plasmáticas del total de MPc (AV+) y de MPc derivadas de plaquetas (CD61+/AV+), células endoteliales (CD146+/AV+), linfocitos (CD3+/AV+) y granulocitos (CD45+/CD3–/CD14–/AV+) no se modificaron con el tratamiento con AAS. La intervención con AAS no influyó en las concentraciones de MPc originadas en las plaquetas activadas, las células endoteliales, los linfocitos y los granulocitos.
DISCUSIÓNLas MPc son capaces de unirse a las células circulantes o al endotelio y participar en la comunicación intercelular a través de una amplia variedad de modos de transmitir información sobre inflamación y activación celular, supervivencia y apoptosis celulares, función endotelial, remodelado vascular y angiogénesis, con lo que aceleran la progresión de la ECV. En consecuencia, las estrategias para reducir las MPc pueden retardar las complicaciones CV.
El AAS se administra para la prevención primaria y secundaria de la ECV en los pacientes diabéticos. Mientras que la prevención secundaria con dosis bajas de AAS parece demostrada24,25, la relación beneficio-riesgo de la administración de AAS para la prevención primaria de la ECV en estos pacientes continúa en controversia4–6,26–28, teniendo en cuenta sus efectos colaterales, en especial la hemorragia digestiva alta.
Los resultados principales de este estudio son que un tratamiento con AAS 100 mg/día reduce la liberación y la activación de micropartículas derivadas de eritrocitos, monocitos y células de músculo liso en los pacientes diabéticos que aún no han presentado un evento vascular. Que se sepa, esta es la primera vez que se ha investigado la liberación de micropartículas por diversos tipos de células del compartimento vascular después de un tratamiento con AAS en pacientes diabéticos.
El AAS no redujo el número de micropartículas de origen plaquetario ni la liberación de micropartículas de plaquetas activadas en los diabéticos, lo cual concuerda con otros datos presentados anteriormente que indican que en la DM2 la toma de AAS no tiene efecto alguno en las MPc derivadas de las plaquetas29. Esta ausencia de efecto en la liberación de micropartículas de origen plaquetario se ha observado también en voluntarios sanos30, en los que la administración de 100 mg de AAS durante 7 días no produjo diferencia alguna en el número de MPc de origen plaquetario detectadas. No hubo diferencias en las MPc de origen endotelial ni en las MPc FT+ o las MPc AV+ entre los voluntarios sanos tratados con AAS y los tratados con placebo. Esto se ha observado también en un estudio de casos y controles llevado a cabo en pacientes diabéticos17, en el que los pacientes que recibieron el tratamiento con AAS no mostraron diferencias significativas en cuanto al número de MPc derivadas de plaquetas en comparación con los pacientes que no lo recibieron. Un estudio de la enfermedad coronaria estable también mostró que el AAS no modifica las concentraciones de MPc de origen plaquetario en estos pacientes31.
En el presente estudio se observó que las MPc FT+ derivadas de monocitos y células de músculo liso se reducen tras el tratamiento con AAS. Las micropartículas derivadas de las células promueven la formación del trombo in vivo de modo dependiente del FT9,32, y se ha señalado que las altas concentraciones de MPc FT+ en los pacientes diabéticos intervienen en la señalización transcelular o en procesos angiogénicos distintos de la función procoagulante clásica de las micropartículas FT+ estudiados anteriormente12. Además, las micropartículas FT+ derivadas de los monocitos constituyen el segundo conjunto más grande de micropartículas trombogénicas, después de las derivadas de las plaquetas33. También se observó una disminución de la liberación de micropartículas derivadas de los monocitos (CD11b+/CD14+/AV+) después de los 10 días de tratamiento con AAS. Tiene interés señalar que se observaron altas concentraciones de MPc derivadas de monocitos activados en los pacientes con DM2 en comparación con los controles21. Anteriormente se ha observado una relación entre las MPc CD11b+ y el nivel de riesgo CV y la carga de placa aterosclerótica de sujetos con diferentes grados de carga de ECV34.
Además, en este estudio se observó que en el momento de la inclusión los pacientes con DM1 tenían un número de MPc FT+ de origen plaquetario y monocitario y de MPc CD62E+/– de origen endotelial aproximadamente el doble que los pacientes con DM2, lo cual podría atribuirse a la exposición al estrés metabólico durante toda la vida de los pacientes con DM1. Estos resultados concuerdan con los de Sabatier et al17, que observaron que los pacientes con DM1 tenían un número significativamente superior de micropartículas derivadas de las plaquetas y de origen endotelial, y demostraron que los pacientes con DM1 y DM2 mostraban perfiles de micropartículas diferenciados. No obstante, el 90% de los pacientes con DM2 estaban en tratamiento con estatinas, y ello podría haber contribuido a producir esa menor cantidad de micropartículas observada.
LimitacionesEl estudio no está exento de limitaciones. Los pacientes diabéticos suelen estar polimedicados (tabla 1). La medicación concomitante puede influir en la liberación de micropartículas, pero esta cuestión se resuelve en parte con el diseño del estudio, ya que se cuantificaron las MPc antes y después de la intervención de 10 días en cada paciente, por lo que la medicación concomitante no se modificó. No fue posible obtener datos sobre los efectos del AAS en los controles (pacientes con un riesgo CV alto pero sin DM ni ECV), ya que la intervención de 10 días de AAS no estaba justificada según el criterio del comité de ética del centro. Las guías actuales no especifican un umbral de riesgo CV a partir del cual deba usarse sistemáticamente AAS en los pacientes diabéticos para la prevención de la ECV. Aunque la población estudiada era de pacientes diabéticos de la práctica clínica real, tratados según lo indicado en las guías, sin signos de enfermedad aterosclerótica y que acudían a una clínica del metabolismo, es posible que no sea representativa de la población diabética total con riesgo de ECV elevado.
CONCLUSIONESUna intervención de 10 días con AAS en la prevención primaria de pacientes diabéticos (tratados según las guías) no influye en la liberación de micropartículas derivadas de las plaquetas. Tiene interés señalar que las células que muestran una reducción de la liberación de micropartículas y, por lo tanto, una atenuación de la activación, son células de músculo liso y células inmunitarias. Estos tipos de células mostraron una reducción significativa de la liberación de micropartículas portadoras de epítopos de activación celular.
En resumen, los resultados obtenidos indican que: a) los pacientes con DM1 y DM2 tienen perfiles de liberación de micropartículas distintos, lo cual refleja un estrés más continuo en los pacientes con DM1; b) el tratamiento con AAS inhibe la activación de las células de la pared vascular y la liberación de micropartículas, y c) los efectos del AAS son similares en la DM1 y la DM2.
FINANCIACIÓNG. Chiva-Blanch disfruta de una beca de formación posdoctoral Sara Borrell (CD13/00023) del Instituto de Salud Carlos III. Este trabajo ha sido posible gracias a la financiación del Ministerio de Economía y Competitividad de España (Plan Estatal de I+D+i 2013-2016, SAF2013-42962-R, concedida a L. Badimon) y de la Red de Investigación Cardiovascular del Instituto de Salud Carlos III (RIC, RD12/0042/0027 concedida a L. Badimon). Todo está cofinanciado por los Fondos de la Unión Europea y FEDER (Fondo Europeo de Desarrollo Regional) «Una manera de hacer Europa».
CONFLICTO DE INTERESESNinguno.
Estamos en deuda con los pacientes diabéticos que participaron en el estudio.