El pronóstico de los pacientes con estenosis aórtica grave con bajo gradiente aórtico y fracción de eyección normal es controvertido. Nuestro estudio analiza el pronóstico de estos pacientes y su relación con el gradiente de presión y el flujo valvular aórtico.
MétodosCohorte retrospectiva de 363 pacientes consecutivos con estenosis aórtica grave y fracción de eyección normal, dividida en cuatro grupos según índice de volumen sistólico mayor o menor que 35 ml/m2 y gradiente aórtico medio mayor o menor que 40 mmHg. Grupo I, flujo normal y gradiente elevado (n = 169; 47%); grupo II, flujo normal y bajo gradiente (n = 98; 27%); grupo III, bajo flujo y gradiente elevado (n = 54; 15%), y grupo IV, bajo flujo y bajo gradiente (n = 42; 12%). El objetivo primario es la mortalidad total.
ResultadosLos factores de riesgo independientes de mortalidad son la edad (hazard ratio = 1,04; intervalo de confianza del 95%, 1,01-1,08) y la fibrilación auricular (hazard ratio = 2,21; intervalo de confianza del 95%, 1,24-3,94). El tratamiento quirúrgico se asocia a mayor supervivencia en todos los grupos (hazard ratio = 0,25; intervalo de confianza del 95%, 0,13-0,49). Los pacientes con bajo flujo presentan mayor mortalidad que los pacientes con flujo normal (el 26,6 frente al 13,6%; p = 0,004). El grupo II muestra mejor pronóstico (hazard ratio = 0,4; intervalo de confianza del 95%, 0,2-0,9).
ConclusionesLos pacientes con estenosis aórtica grave, fracción de eyección normal y bajo flujo aórtico presentan peor pronóstico. El análisis del flujo aórtico mediante ecocardiografía Doppler es útil en la estratificación de riesgo y en la toma de decisiones terapéuticas en pacientes con estenosis aórtica.
Palabras clave
La estenosis aórtica (EA) es una afección muy común en nuestro entorno y su incidencia está aumentando debido al envejecimiento de la población. Actualmente, es la principal causa de recambio valvular en Europa y Estados Unidos1.
Los síntomas clínicos y la gravedad de la estenosis, generalmente determinada por ecocardiografía, son las claves para la indicación de cirugía en estos pacientes. Los parámetros habituales que definen la gravedad son el área valvular aórtica (AVA) < 1 cm2 (o área indexada < 0,6 cm2/m2) o un gradiente medio > 40 mmHg2. Basándonos en el AVA, un número sustancial de pacientes con EA grave presenta un gradiente aórtico bajo, a pesar de tener una fracción de eyección (FE) normal3. Hachicha et al4 describieron que en muchos casos el bajo gradiente se debe a un volumen sistólico (VS) reducido, estos pacientes tendrían una mayor poscarga y, consecuentemente, un mayor remodelado concéntrico, cavidades ventriculares menores y una disfunción miocárdica a pesar de FE normal, lo que resultaría en un menor VS y, en consecuencia, menor gradiente4–10. Sin embargo, bajo gradiente no equivale a bajo flujo aórtico; así, pacientes con bajo flujo pueden presentar un gradiente aórtico elevado, y un número significativo de los pacientes con gradiente aórtico bajo tienen un VS y flujo aórtico normal11–14. Hay debate acerca de los mecanismos y el pronóstico de los pacientes con EA de bajo gradiente y FE normal y sobre la propia definición de gravedad de la EA basada en el AVA < 1 cm2. En este sentido, algunos autores subrayan las dificultades y los posibles errores en el cálculo del AVA por ecocardiografía Doppler, así como las inconcordancias en la propia definición de gravedad al sustentarse en el AVA y en el gradiente aórtico, y cuestionan que esos pacientes tengan una verdadera EA grave y proponen una modificación de los valores de corte de gravedad del AVA12,13.
Este estudio pretende documentar en nuestra población las características demográficas, los mecanismos fisiopatológicos y el pronóstico de los pacientes con EA grave y FE normal según el gradiente y el flujo valvular aórtico.
MÉTODOSPoblaciónSe trata de un estudio retrospectivo realizado en el Hospital Universitario Son Espases. Utilizando nuestra base de datos ecocardiográfica EchoPAC® (General Electric Healthcare, Waukesha, WI, Estados Unidos) revisamos todos los estudios realizados entre enero de 2007 y febrero de 2010 y seleccionamos a los pacientes con EA grave (AVA < 1 cm2) y FE preservada (FE ≥ 50%). Se excluyó a los pacientes con estudio subóptimo, insuficiencia aórtica moderada-grave o valvulopatía mitral. El seguimiento se realizó mediante contacto personal en la consulta, revisión de historia informatizada, informes médicos o contacto telefónico. El estudio fue aprobado por el comité de investigación del hospital.
Variables clínicasLos datos clínicos incluyen edad, sexo, hábito tabáquico, índice de masa corporal, diagnóstico de hipertensión arterial, diabetes mellitus, hipercolesterolemia, fibrilación auricular (FA) y enfermedad coronaria (definida como angina de pecho, infarto de miocardio, evidencia angiográfica de enfermedad coronaria, intervención coronaria percutánea o cirugía de revascularización miocárdica).
Medidas ecocardiográficasLos índices ecocardiográficos Doppler de gravedad de la EA incluyen la medida de la velocidad máxima transvalvular, gradiente máximo y medio e integral tiempo-velocidad del jet aórtico. El AVA se obtuvo mediante el uso de la ecuación de continuidad estándar y se indexó por la superficie corporal. El índice de volumen sistólico (IVS) es el VS indexado por superficie corporal y medido por Doppler en el tracto de salida del ventrículo izquierdo.
La resistencia vascular sistémica, la distensibilidad arterial sistémica y la impedancia valvuloarterial se calcularon mediante las respectivas fórmulas5. La determinación de la presión arterial sistólica no se realizó en el momento del estudio ecocardiográfico en 16 pacientes. Las dimensiones del ventrículo izquierdo (VI) se tomaron de acuerdo con las guías de la American Society of Echocardiography (ASE) y se indexaron por superficie corporal. Los volúmenes telediastólico y telesistólico se calcularon mediante el método de volumen de Teichholz15. La masa del VI y el grosor relativo de la pared se midieron según la fórmula recomendada por la ASE. La FE del VI se obtuvo en todos los pacientes con el método de Teichholz y por estimación visual. El acortamiento fraccional mesocárdico y el trabajo sistólico del VI se calcularon mediante las fórmulas recomendadas15,16.
CoronariografíaSe realizó coronariografía a un total de 259 pacientes (71,3%). Se definió enfermedad coronaria por una estenosis ≥ 50% del tronco común izquierdo y/o una estenosis ≥ 70% de las arterias coronarias epicárdicas.
Análisis estadísticoLa cohorte de pacientes se dividió en cuatro grupos según el flujo transaórtico fuera normal o disminuido (IVS > 35 o < 35 ml/m2) y el gradiente estuviera elevado o disminuido (gradiente medio > 40 o < 40 mmHg), de acuerdo con las actuales guías de práctica clínica. Se definieron los siguientes grupos: grupo I, flujo normal y gradiente elevado; grupo II, flujo normal y bajo gradiente; grupo III, bajo flujo y gradiente elevado, y grupo IV, bajo flujo y bajo gradiente.
Los resultados se expresan en media (intervalo de confianza del 95% [IC95%]), mediana [intervalo intercuartílico] o porcentajes. Las diferencias entre grupos de pacientes se analizaron usando el test de ANOVA o Kruskal-Wallis para variables continuas y el test de la χ2 o el de Fisher para variables categóricas. El objetivo primario fue la mortalidad total. La supervivencia se obtuvo mediante curvas de Kaplan-Meier para cada uno de los grupos. Las diferencias entre los grupos en cuanto a los factores de riesgo se determinaron mediante el log rank test. El efecto de las variables clínicas y ecocardiográficas en la supervivencia se determinó usando un modelo de riesgos proporcionales de Cox, incluyendo el recambio valvular aórtico como variable dependiente del tiempo. En el análisis multivariable se incluyeron todas las posibles variables asociadas y aquellas con p < 0,2 en el análisis univariable. Se utilizó el programa informático SPSS para Windows® versión 15.
RESULTADOSLa población de nuestro estudio incluyó a 363 pacientes consecutivos: 186 mujeres, 177 varones; mediana de edad, 77 [71-82] años. El seguimiento de los pacientes fue una mediana de 25,3 [14,8-33,2] meses después de la inclusión. No se pudo dar seguimiento a 4 de 363 pacientes (1,1%).
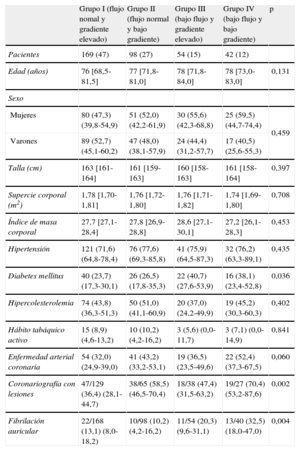
La tabla 1 muestra las características basales de la población. Los pacientes con bajo gradiente (grupos II y IV) mostraron mayor asociación con enfermedad arterial coronaria; la máxima diferencia se dio entre los grupos I y IV. No hubo diferencias significativas entre los diferentes grupos en cuanto a edad, sexo, índice de masa corporal, área corporal, hipertensión arterial, hábito tabáquico e hipercolesterolemia. Los pacientes con EA grave de bajo flujo (grupos III y IV) eran mayores (78 frente a 76 años; p = 0,047), tenían mayor prevalencia de diabetes mellitus y FA y, además, mostraron una tendencia al predominio femenino (el 57,3 frente al 42,7%; p = 0,167).
Características basales de la población del estudio
| Grupo I (flujo nomal y gradiente elevado) | Grupo II (flujo normal y bajo gradiente) | Grupo III (bajo flujo y gradiente elevado) | Grupo IV (bajo flujo y bajo gradiente) | p | |
| Pacientes | 169 (47) | 98 (27) | 54 (15) | 42 (12) | |
| Edad (años) | 76 [68,5-81,5] | 77 [71,8-81,0] | 78 [71,8-84,0] | 78 [73,0-83,0] | 0,131 |
| Sexo | |||||
| Mujeres | 80 (47,3) (39,8-54,9) | 51 (52,0) (42,2-61,9) | 30 (55,6) (42,3-68,8) | 25 (59,5) (44,7-74,4) | 0,459 |
| Varones | 89 (52,7) (45,1-60,2) | 47 (48,0) (38,1-57,9) | 24 (44,4) (31,2-57,7) | 17 (40,5) (25,6-55,3) | |
| Talla (cm) | 163 [161-164] | 161 [159-163] | 160 [158-163] | 161 [158-164] | 0,397 |
| Supercie corporal (m2) | 1,78 [1,70-1,81] | 1,76 [1,72-1,80] | 1,76 [1,71-1,82] | 1,74 [1,69-1,80] | 0,708 |
| Índice de masa corporal | 27,7 [27,1-28,4] | 27,8 [26,9-28,8] | 28,6 [27,1-30,1] | 27,2 [26,1-28,3] | 0,453 |
| Hipertensión | 121 (71,6) (64,8-78,4) | 76 (77,6) (69,3-85,8) | 41 (75,9) (64,5-87,3) | 32 (76,2) (63,3-89,1) | 0,435 |
| Diabetes mellitus | 40 (23,7) (17,3-30,1) | 26 (26,5) (17,8-35,3) | 22 (40,7) (27,6-53,9) | 16 (38,1) (23,4-52,8) | 0,036 |
| Hipercolesterolemia | 74 (43,8) (36,3-51,3) | 50 (51,0) (41,1-60,9) | 20 (37,0) (24,2-49,9) | 19 (45,2) (30,3-60,3) | 0,402 |
| Hábito tabáquico activo | 15 (8,9) (4,6-13,2) | 10 (10,2) (4,2-16,2) | 3 (5,6) (0,0-11,7) | 3 (7,1) (0,0-14,9) | 0,841 |
| Enfermedad arterial coronaria | 54 (32,0) (24,9-39,0) | 41 (43,2) (33,2-53,1) | 19 (36,5) (23,5-49,6) | 22 (52,4) (37,3-67,5) | 0,060 |
| Coronariografía con lesiones | 47/129 (36,4) (28,1-44,7) | 38/65 (58,5) (46,5-70,4) | 18/38 (47,4) (31,5-63,2) | 19/27 (70,4) (53,2-87,6) | 0,002 |
| Fibrilación auricular | 22/168 (13,1) (8,0-18,2) | 10/98 (10,2) (4,2-16,2) | 11/54 (20,3) (9,6-31,1) | 13/40 (32,5) (18,0-47,0) | 0,004 |
Valores expresados como media (intervalo de confianza del 95%), mediana [intervalo intercuartílico] o n/N (%).
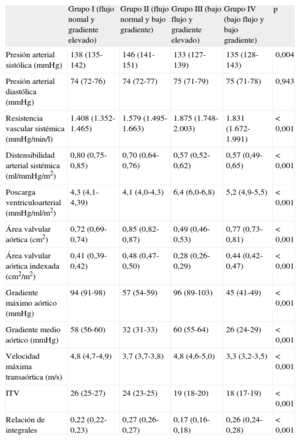
La tabla 2 muestra los datos de la gravedad de la EA y la poscarga arterial y total. Por definición, los grupos I y III tenían mayores gradientes. Los pacientes con gradiente elevado y bajo flujo (grupo III) tenían menores AVA y AVA indexada y menor relación de integrales, lo que indica mayor gravedad de la estenosis que en los demás grupos. Los pacientes del grupo IV, con bajo gradiente y bajo flujo, tenían mayor gravedad de la estenosis que los del grupo II, con bajo gradiente y flujo normal, pese a tener menores gradientes.
Índices de gravedad de la estenosis aórtica y poscargas arterial y total
| Grupo I (flujo nomal y gradiente elevado) | Grupo II (flujo normal y bajo gradiente) | Grupo III (bajo flujo y gradiente elevado) | Grupo IV (bajo flujo y bajo gradiente) | p | |
| Presión arterial sistólica (mmHg) | 138 (135-142) | 146 (141-151) | 133 (127-139) | 135 (128-143) | 0,004 |
| Presión arterial diastólica (mmHg) | 74 (72-76) | 74 (72-77) | 75 (71-79) | 75 (71-78) | 0,943 |
| Resistencia vascular sistémica (mmHg/min/l) | 1.408 (1.352-1.465) | 1.579 (1.495-1.663) | 1.875 (1.748-2.003) | 1.831 (1.672-1.991) | < 0,001 |
| Distensibilidad arterial sistémica (ml/mmHg/m2) | 0,80 (0,75-0,85) | 0,70 (0,64-0,76) | 0,57 (0,52-0,62) | 0,57 (0,49-0,65) | < 0,001 |
| Poscarga ventriculoarterial (mmHg/ml/m2) | 4,3 (4,1-4,39) | 4,1 (4,0-4,3) | 6,4 (6,0-6,8) | 5,2 (4,9-5,5) | < 0,001 |
| Área valvular aórtica (cm2) | 0,72 (0,69-0,74) | 0,85 (0,82-0,87) | 0,49 (0,46-0,53) | 0,77 (0,73-0,81) | < 0,001 |
| Área valvular aórtica indexada (cm2/m2) | 0,41 (0,39-0,42) | 0,48 (0,47-0,50) | 0,28 (0,26-0,29) | 0,44 (0,42-0,47) | < 0,001 |
| Gradiente máximo aórtico (mmHg) | 94 (91-98) | 57 (54-59) | 96 (89-103) | 45 (41-49) | < 0,001 |
| Gradiente medio aórtico (mmHg) | 58 (56-60) | 32 (31-33) | 60 (55-64) | 26 (24-29) | < 0,001 |
| Velocidad máxima transaórtica (m/s) | 4,8 (4,7-4,9) | 3,7 (3,7-3,8) | 4,8 (4,6-5,0) | 3,3 (3,2-3,5) | < 0,001 |
| ITV | 26 (25-27) | 24 (23-25) | 19 (18-20) | 18 (17-19) | < 0,001 |
| Relación de integrales | 0,22 (0,22-0,23) | 0,27 (0,26-0,27) | 0,17 (0,16-0,18) | 0,26 (0,24-0,28) | < 0,001 |
ITV: integral tiempo-velocidad del jet aórtico.
Las cifras expresan media (intervalo de confianza del 95%).
Los pacientes con flujo normal y bajo gradiente (grupo II) presentaban menor gravedad de la estenosis que los demás grupos. En este grupo, encontramos una mayor presión sistólica que en el resto. Los pacientes con bajo flujo (grupos III y IV) tenían mayores valores de resistencia vascular sistémica y menores valores de distensibilidad arterial, lo que indica mayor poscarga vascular. La poscarga total del VI (impedancia valvuloarterial) también era mayor en el grupo de bajo flujo, especialmente en pacientes con gradiente elevado (grupo III).
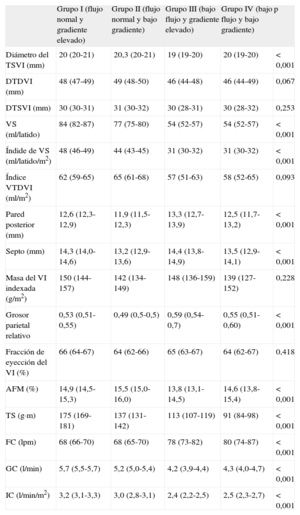
La tabla 3 muestra una comparación de la geometría del VI y los parámetros de función sistólica entre los cuatro grupos. Los pacientes con bajo flujo (grupos III y IV) tenían menores cavidades ventriculares que los de flujo normal (grupos I y II) (diámetro telediastólico del ventrículo izquierdo, 46 frente a 48 mm; p = 0,012; índice VTDVI, 57 frente a 63 ml; p = 0,023). No hubo diferencias en el grado de hipertrofia entre los diferentes grupos y todos mostraron remodelado concéntrico, más pronunciado en los pacientes con gradiente elevado y bajo flujo (grupo III).
Datos ecocardiográficos de la geometría y la función sistólica del ventrículo izquierdo
| Grupo I (flujo nomal y gradiente elevado) | Grupo II (flujo normal y bajo gradiente) | Grupo III (bajo flujo y gradiente elevado) | Grupo IV (bajo flujo y bajo gradiente) | p | |
| Diámetro del TSVI (mm) | 20 (20-21) | 20,3 (20-21) | 19 (19-20) | 20 (19-20) | < 0,001 |
| DTDVI (mm) | 48 (47-49) | 49 (48-50) | 46 (44-48) | 46 (44-49) | 0,067 |
| DTSVI (mm) | 30 (30-31) | 31 (30-32) | 30 (28-31) | 30 (28-32) | 0,253 |
| VS (ml/latido) | 84 (82-87) | 77 (75-80) | 54 (52-57) | 54 (52-57) | < 0,001 |
| Índide de VS (ml/latido/m2) | 48 (46-49) | 44 (43-45) | 31 (30-32) | 31 (30-32) | < 0,001 |
| Índice VTDVI (ml/m2) | 62 (59-65) | 65 (61-68) | 57 (51-63) | 58 (52-65) | 0,093 |
| Pared posterior (mm) | 12,6 (12,3-12,9) | 11,9 (11,5-12,3) | 13,3 (12,7-13,9) | 12,5 (11,7-13,2) | < 0,001 |
| Septo (mm) | 14,3 (14,0-14,6) | 13,2 (12,9-13,6) | 14,4 (13,8-14,9) | 13,5 (12,9-14,1) | < 0,001 |
| Masa del VI indexada (g/m2) | 150 (144-157) | 142 (134-149) | 148 (136-159) | 139 (127-152) | 0,228 |
| Grosor parietal relativo | 0,53 (0,51-0,55) | 0,49 (0,5-0,5) | 0,59 (0,54-0,7) | 0,55 (0,51-0,60) | < 0,001 |
| Fracción de eyección del VI (%) | 66 (64-67) | 64 (62-66) | 65 (63-67) | 64 (62-67) | 0,418 |
| AFM (%) | 14,9 (14,5-15,3) | 15,5 (15,0-16,0) | 13,8 (13,1-14,5) | 14,6 (13,8-15,4) | < 0,001 |
| TS (g·m) | 175 (169-181) | 137 (131-142) | 113 (107-119) | 91 (84-98) | < 0,001 |
| FC (lpm) | 68 (66-70) | 68 (65-70) | 78 (73-82) | 80 (74-87) | < 0,001 |
| GC (l/min) | 5,7 (5,5-5,7) | 5,2 (5,0-5,4) | 4,2 (3,9-4,4) | 4,3 (4,0-4,7) | < 0,001 |
| IC (l/min/m2) | 3,2 (3,1-3,3) | 3,0 (2,8-3,1) | 2,4 (2,2-2,5) | 2,5 (2,3-2,7) | < 0,001 |
AFM: acortamiento fraccional mesocárdico; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; FC: frecuencia cardiaca; GC: gasto cardiaco; IC: índice cardiaco; TS: trabajo sistólico; TSVI: tracto de salida del ventrículo izquierdo; VI: ventrículo izquierdo; VS: volumen sistólico; VTDVI: volumen telediastólico del ventrículo izquierdo.
Pared posterior y septo, grosor en diástole (mm).
Las cifras expresan media (intervalo de confianza del 95%).
No se encontraron diferencias entre los distintos grupos en la FE; no obstante, el acortamiento fraccional mostró menores valores en los pacientes con bajo flujo y gradiente elevado (grupo III) y mayores en los pacientes con flujo normal y bajo gradiente (grupo II). Los pacientes con bajo flujo (grupos III y IV) mostraron también menores trabajos sistólicos, gasto cardiaco e índice cardiaco, con un aumento compensatorio de la frecuencia cardiaca. En general, el IVS era menor en los pacientes con FA 38,0 (IC95%, 35,2-40,9) frente a 43,0 (IC95%, 41,9-44,0) ml/m2, y al especificar por grupos, únicamente el grupo IV no mostró diferencias: grupo I, 43,8 (IC95%, 37,8-51,1) frente a 47,0 (IC95%, 41,0-52,8); grupo II, 37,0 (IC95%, 36,0-44,4) frente a 44,0 (IC95%, 38,7-48,2); grupo III, 28,1 (IC95%, 27,0-32,0) frente a 32,0 (IC95%, 29,0-34,0); grupo IV, 31,0 (IC95%, 26,1-33,5) frente a 32,0 (IC95%, 29,2-34,0).
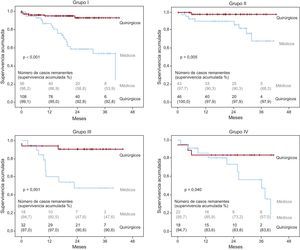
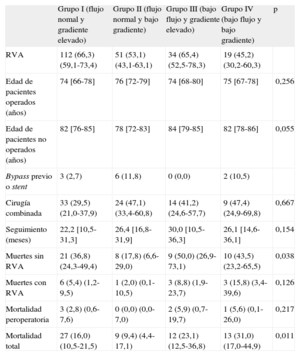
La tabla 4 muestra el seguimiento clínico de los cuatro grupos. Un total de 216 pacientes (60,2%) fueron sometidos a recambio valvular aórtico, con una mediana de seguimiento posquirúrgico de 20,9 [11,2-29,6] meses. La mediana de seguimiento de los pacientes con tratamiento médico fue 20,1 [9,2-30,9] meses. Los pacientes operados eran significativamente más jóvenes en todos los grupos. Los pacientes con bajo gradiente (grupos II y IV) fueron intervenidos con menor frecuencia que los pacientes con gradiente elevado, el 50,7 frente al 65,8% (p = 0,005). Durante el seguimiento, hubo 61 muertes (16,8%). La mortalidad de los pacientes intervenidos quirúrgicamente fue del 6,0% (13 de 216), frente al 33,6% (48 de 143) de los tratados de forma conservadora. Los pacientes con bajo flujo (grupos III y IV) tuvieron mayor mortalidad que los pacientes con flujo normal (mortalidad total, el 26,6 frente al 13,6%; p = 0,004). En los cuatro grupos, la mortalidad fue menor entre los pacientes intervenidos que entre los tratados de manera conservadora (figura). Los pacientes del grupo II tuvieron menor mortalidad durante el seguimiento, y esta diferencia fue todavía mayor para los intervenidos quirúrgicamente. Seis de los pacientes intervenidos fallecieron durante el periodo postoperatorio.
Resultados clínicos
| Grupo I (flujo nomal y gradiente elevado) | Grupo II (flujo normal y bajo gradiente) | Grupo III (bajo flujo y gradiente elevado) | Grupo IV (bajo flujo y bajo gradiente) | p | |
| RVA | 112 (66,3) (59,1-73,4) | 51 (53,1) (43,1-63,1) | 34 (65,4) (52,5-78,3) | 19 (45,2) (30,2-60,3) | |
| Edad de pacientes operados (años) | 74 [66-78] | 76 [72-79] | 74 [68-80] | 75 [67-78] | 0,256 |
| Edad de pacientes no operados (años) | 82 [76-85] | 78 [72-83] | 84 [79-85] | 82 [78-86] | 0,055 |
| Bypass previo o stent | 3 (2,7) | 6 (11,8) | 0 (0,0) | 2 (10,5) | |
| Cirugía combinada | 33 (29,5) (21,0-37,9) | 24 (47,1) (33,4-60,8) | 14 (41,2) (24,6-57,7) | 9 (47,4) (24,9-69,8) | 0,667 |
| Seguimiento (meses) | 22,2 [10,5-31,3] | 26,4 [16,8-31,9] | 30,0 [10,5-36,3] | 26,1 [14,6-36,1] | 0,154 |
| Muertes sin RVA | 21 (36,8) (24,3-49,4) | 8 (17,8) (6,6-29,0) | 9 (50,0) (26,9-73,1) | 10 (43,5) (23,2-65,5) | 0,038 |
| Muertes con RVA | 6 (5,4) (1,2-9,5) | 1 (2,0) (0,1-10,5) | 3 (8,8) (1,9-23,7) | 3 (15,8) (3,4-39,6) | 0,126 |
| Mortalidad peroperatoria | 3 (2,8) (0,6-7,6) | 0 (0,0) (0,0-7,0) | 2 (5,9) (0,7-19,7) | 1 (5,6) (0,1-26,0) | 0,217 |
| Mortalidad total | 27 (16,0) (10,5-21,5) | 9 (9,4) (4,4-17,1) | 12 (23,1) (12,5-36,8) | 13 (31,0) (17,0-44,9) | 0,011 |
RVA: Recambio valvular aórtico.
Valores expresados como n (%) (intervalo de confianza del 95%) o mediana [intervalo intercuartílico].
Curvas de supervivencia de los cuatro grupos en función del tipo de tratamiento. Los valores de significación hacen referencia a la comparación entre los dos tipos de tratamiento: médico y quirúrgico. Grupo I: flujo normal y gradiente elevado; Grupo II: flujo normal y bajo gradiente; Grupo III: bajo flujo y gradiente elevado; Grupo IV: bajo flujo y bajo gradiente.
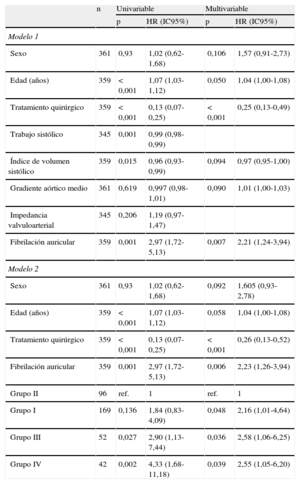
La tabla 5 muestra los predictores de mortalidad total en los análisis univariable y multivariable. Los factores asociados a un aumento de mortalidad en el análisis univariable fueron la edad, el tratamiento médico, el IVS, el trabajo sistólico y la FA, pero no el gradiente medio ni la impedancia valvuloarterial.
Análisis univariable y multivariable de los predictores de mortalidad
| n | Univariable | Multivariable | |||
| p | HR (IC95%) | p | HR (IC95%) | ||
| Modelo 1 | |||||
| Sexo | 361 | 0,93 | 1,02 (0,62-1,68) | 0,106 | 1,57 (0,91-2,73) |
| Edad (años) | 359 | < 0,001 | 1,07 (1,03-1,12) | 0,050 | 1,04 (1,00-1,08) |
| Tratamiento quirúrgico | 359 | < 0,001 | 0,13 (0,07-0,25) | < 0,001 | 0,25 (0,13-0,49) |
| Trabajo sistólico | 345 | 0,001 | 0,99 (0,98-0,99) | ||
| Índice de volumen sistólico | 359 | 0,015 | 0,96 (0,93-0,99) | 0,094 | 0,97 (0,95-1,00) |
| Gradiente aórtico medio | 361 | 0,619 | 0,997 (0,98-1,01) | 0,090 | 1,01 (1,00-1,03) |
| Impedancia valvuloarterial | 345 | 0,206 | 1,19 (0,97-1,47) | ||
| Fibrilación auricular | 359 | 0,001 | 2,97 (1,72-5,13) | 0,007 | 2,21 (1,24-3,94) |
| Modelo 2 | |||||
| Sexo | 361 | 0,93 | 1,02 (0,62-1,68) | 0,092 | 1,605 (0,93-2,78) |
| Edad (años) | 359 | < 0,001 | 1,07 (1,03-1,12) | 0,058 | 1,04 (1,00-1,08) |
| Tratamiento quirúrgico | 359 | < 0,001 | 0,13 (0,07-0,25) | < 0,001 | 0,26 (0,13-0,52) |
| Fibrilación auricular | 359 | 0,001 | 2,97 (1,72-5,13) | 0,006 | 2,23 (1,26-3,94) |
| Grupo II | 96 | ref. | 1 | ref. | 1 |
| Grupo I | 169 | 0,136 | 1,84 (0,83-4,09) | 0,048 | 2,16 (1,01-4,64) |
| Grupo III | 52 | 0,027 | 2,90 (1,13-7,44) | 0,036 | 2,58 (1,06-6,25) |
| Grupo IV | 42 | 0,002 | 4,33 (1,68-11,18) | 0,039 | 2,55 (1,05-6,20) |
Grupo I: flujo normal y gradiente elevado; Grupo II: flujo normal y bajo gradiente; Grupo III: bajo flujo y gradiente elevado; Grupo IV: bajo flujo y bajo gradiente; HR: hazard ratio (representa el incremento de mortalidad por unidad de incremento de la variable); IC95%: intervalo de confianza del 95%; ref.: categoría referente.
En el análisis multivariable, los factores de riesgo de mortalidad independientes fueron la edad y la FA, mientras que el tratamiento quirúrgico (recambio valvular aórtico con o sin cirugía de revascularización) la redujo muy significativamente (hazard ratio [HR] = 0,25; IC95%, 0,13-0,49). El sexo, el IVS y el gradiente medio aórtico no alcanzaron significación estadística, aunque los resultados muestran mayor mortalidad entre los varones y con la disminución del IVS y el aumento del gradiente. El trabajo sistólico, la impedancia valvuloarterial y el AVA presentaron gran colinealidad con el IVS (r ≈ 0,9) y no se incluyeron en el modelo 2.
En el modelo 2, se analizan las diferencias entre los cuatro grupos de nuestro estudio; en el grupo II (bajo gradiente y flujo normal) hubo menor mortalidad que la observada en los demás grupos (HR = 0,4; IC95%, 0,2-0,9; p = 0,02). No se encontró interacción entre la variable grupo y la intervención quirúrgica.
Hipertensión, diabetes mellitus, enfermedad arterial coronaria, cirugía de revascularización coronaria concomitante, distensibilidad arterial sistémica, resistencia vascular sistémica, FE, acortamiento fraccional mesocárdico, grosor relativo de la pared y gasto cardiaco no se asociaron significativamente con la mortalidad.
DISCUSIÓNNuestro estudio muestra, como hallazgos más relevantes, que en los pacientes con EA grave, definida como una AVA < 1 cm2 y FE normal, la disminución del flujo valvular aórtico es un indicador de peor pronóstico y que el tratamiento quirúrgico reduce la mortalidad en todos los grupos de este estudio (figura).
Estenosis aórtica de bajo flujoEl presente estudio muestra un 27% de pacientes con esta condición, en concordancia con trabajos previos4,6,13. En nuestra población, un 56% de los pacientes con bajo flujo tenían gradientes elevados (grupo III), lo que confirma que bajo flujo no es igual a bajo gradiente aórtico. Nuestros resultados reafirman la hipótesis previa4–10 de que estos pacientes con EA grave y bajo flujo tienen mayor poscarga, resultado de la combinación de obstrucción valvular y aumento de la resistencia periférica, lo que determinaría un mayor remodelado ventricular concéntrico y disfunción miocárdica.
A semejanza de observaciones previas14, encontramos dos grupos claramente diferenciados de bajo flujo aórtico; uno con menor gravedad de la estenosis y gradientes bajos (grupo IV), y otro con mayor obstrucción valvular y gradientes elevados (grupo III). En ambos se observa una reducción del VS y peor pronóstico que en los pacientes con EA grave y flujo normal. En este sentido, ambos grupos de bajo flujo presentan mayor prevalencia de FA que los pacientes con flujo normal. La FA puede reflejar una enfermedad más avanzada, dado su valor pronóstico en el análisis multivariable, aparte de que la pérdida de la contracción auricular pueda disminuir el llenado ventricular y contribuir a reducir el gasto cardiaco. En general, los pacientes en FA presentan menor IVS (38 frente a 43). En un estudio previo, la FA se había asociado a menor supervivencia tras la cirugía de los pacientes con EA grave y disfunción ventricular17. En el seguimiento de un estudio reciente18, en una población de EA grave con FE normal y asintomática de la que se excluyó a los pacientes en FA, los pacientes con bajo flujo también presentaron un pronóstico significativamente peor. En nuestro estudio, la FA se comporta como un factor de riesgo independiente de mortalidad.
Los pacientes del grupo IV (bajo flujo y bajo gradiente) tratados quirúrgicamente tuvieron peor supervivencia que los operados del grupo III (bajo flujo y gradiente elevado). Los pacientes del grupo III presentan una EA crítica, y la disminución de la función contráctil y el menor VS posiblemente estén relacionados con la gravedad de la obstrucción valvular, mientras que los resultados del grupo IV (con menor gravedad de la estenosis) indican la coexistencia de otros factores además de la obstrucción valvular. En nuestra población, a semejanza del estudio de Clavel et al19, la enfermedad arterial coronaria es significativamente más prevalente en este grupo. El grupo IV constituye un grupo más heterogéneo y que suma mayor comorbilidad (edad, diabetes mellitus, cardiopatía isquémica, fibrilación auricular, etc.), con tendencia a mayor mortalidad total, menor indicación quirúrgica y peores resultados quirúrgicos que los demás grupos. Por otra parte y quizá relacionado, Herrmann et al20 describieron que los pacientes con bajo flujo y bajo gradiente tenían mayor grado de fibrosis miocárdica en el subendocardio y menor función longitudinal calculada mediante 2D-strain, anomalías que resultaron irreversibles tras el recambio valvular aórtico, y atribuyeron a estos hallazgos los peores resultados observados tras la cirugía. Recientemente, en un estudio prospectivo, Adda et al21 también han objetivado un grave deterioro de la función longitudinal del VI por 2D-strain en los pacientes con bajo gradiente y bajo flujo.
Estenosis aórtica grave de bajo gradienteRepresenta el 39% de los pacientes de nuestro estudio. La mayoría de los pacientes con bajo gradiente tenían un flujo aórtico normal (70% del grupo II). Estos pacientes tenían menores gravedad de la estenosis y remodelado ventricular, con mejores índices de función cardiaca y, por lo tanto, mejor pronóstico que los pacientes de los demás grupos. El 30% de los pacientes con EA grave de bajo gradiente tenían bajo flujo (grupo IV, el 12% del total de los pacientes con EA), con un pronóstico peor que los pacientes con bajo gradiente y flujo normal (grupo II) y similar al de los pacientes con gradientes elevados. Dichos hallazgos coinciden con los resultados de Dumesnil et al14 y difieren del estudio de Jander et al22, en el que los pacientes con EA grave y bajo gradiente con flujo aórtico normal o bajo presentaban un pronóstico semejante que con EA moderada.
En nuestro estudio, al igual que en otras series, se interviene con menor frecuencia a los pacientes con bajo gradiente10,14,22, posiblemente por la percepción clínica de que tienen una EA menos grave. Nuestros hallazgos corroboran que un gradiente aórtico bajo no excluye una EA grave y hay beneficio con la cirugía para estos pacientes, independientemente del valor del gradiente aórtico10,14,18,23–25.
Implicaciones clínicasNuestros resultados muestran que la EA grave con bajo flujo tiene peor pronóstico que con flujo normal. Cabe resaltar la mayor prevalencia de FA en estos pacientes con bajo flujo, que además tiene valor pronóstico.
Este trabajo confirma el beneficio de la cirugía de reemplazo valvular para todos los pacientes sintomáticos con estenosis grave (AVA < 1 cm2 de acuerdo con las actuales guías), independientemente del gradiente aórtico. Consideramos importante reseñar que la gran mayoría de los pacientes de este estudio tenían un AVA < 0,8 cm2, y sólo los pacientes del grupo II (bajo gradiente y flujo normal) tenían mayoritariamente un AVA > 0,8 cm2 (tabla 2).
Los pacientes del grupo II tienen menor gravedad de la estenosis y mejor pronóstico que los demás grupos. En este marco, diferentes publicaciones han propuesto un reajuste de los valores de corte para definir la gravedad de la estenosis13,22, y que se clasifique a estos pacientes en particular como estenosis moderada-grave26. No obstante, como se observa en este estudio, este grupo también se beneficia de la cirugía de recambio valvular. Se trata de un grupo limítrofe y controvertido, en el cual es de suma importancia la evaluación clínica cuidadosa de los síntomas y/o la estratificación usando pruebas adicionales, como la ergometría, el score de calcificación aórtica, etc.
Limitaciones del estudioLa principal limitación de nuestro estudio es su carácter retrospectivo y la falta de aleatorización del tratamiento quirúrgico, si bien todos los pacientes fueron referidos a cirugía debido a la presencia de síntomas tras ser evaluados en sesión médico-quirúrgica.
Los pacientes no intervenidos suponen un grupo heterogéneo. En algunos de ellos, debido a comorbilidades que podrían no estar bien reflejadas en nuestro estudio (como edad avanzada, calidad de vida, deterioro cognitivo), no se consideró la cirugía. En otros pacientes, los síntomas podrían haberse atribuido a origen no cardiaco o la EA podría haberse considerado no grave. Algunos pacientes rechazaron la cirugía. A pesar de todo, pensamos que estas limitaciones reflejan la práctica diaria y el manejo de los pacientes con EA grave en nuestro entorno.
Por último, hay que resaltar la importancia de la correcta medición del gradiente aórtico (es posible subestimarlo en algunos pacientes de los grupos II y IV) y del IVS y, por lo tanto, del tracto de salida del ventrículo izquierdo y la integral tiempo-velocidad del jet aórtico por ecocardiografía Doppler27, más aún, si cabe, en presencia de FA debido a la diferente duración del R-R28. Que se trate de un estudio retrospectivo implica que los valores podrían haberse obtenido con estos errores potenciales. Sin embargo, las diferencias en el pronóstico entre los grupos II y IV descartarían, a nuestro entender, que se tratara de una clasificación artificial basada en un error de cálculo del VS.
CONCLUSIONESNuestro estudio muestra el peor pronóstico de la EA de bajo flujo y FE normal. Estos resultados indican que el análisis del flujo aórtico mediante el IVS por ecocardiografía Doppler puede ser de utilidad en la estratificación de riesgo y en la toma de decisiones terapéuticas en pacientes con EA.
CONFLICTO DE INTERESESNinguno.