La obesidad es un importante factor de riesgo cardiovascular, y parece ser que la localización de los depósitos de grasa determina de manera importante su impacto metabólico. El tejido adiposo visceral (TAV) ejerce un efecto perjudicial en la homeostasis metabólica, pero pocos estudios longitudinales han evaluado el impacto pronóstico de la relación entre el TAV y el tejido adiposo subcutáneo (TAS). Este estudio tiene por objetivo evaluar si el cociente TAV/TAS se asocia con la mortalidad por todas las causas y los eventos cardiacos.
MétodosRegistro basado en estudio de cohortes retrospectivo. Se eligió para el estudio a pacientes sin enfermedad cardiaca conocida remitidos a coronariografía por tomografía computarizada (TC) por sospecha de enfermedad arterial coronaria (EAC). Se incluyó a todos los pacientes con información disponible sobre el TAV, las áreas del TAS y el score de calcio de las arterias coronarias (CAC). Se evaluó el criterio de valoración combinado de mortalidad por todas las causas, infarto de miocardio o revascularización al menos 1 mes después de la TC cardiaca.
ResultadosLa población final incluida fue de 713 participantes (el 61% varones; media de edad, 57,7±10,2 años), seguidos una media de 1,3 años. Sufrieron el criterio de valoración combinado 66 pacientes, que mostraron una mayor relación TAV/TAS (1,06±0,74 frente a 0,80±0,52; p=0,0001). El cociente TAV/TAS fue un predictor independiente de muerte y eventos cardiacos (HR=1,43; IC95%, 1,03-1,99), independientemente de los factores de riesgo cardiovascular, la CAC y la presencia de EAC.
ConclusionesEl cociente TAV/TAS a nivel abdominal fue un predictor independiente de eventos coronarios y muerte, independientemente de los factores de riesgo cardiovascular, la CAC o la presencia de EAC. Esta relación es una medida derivada de la TC y puede ser útil para identificar mejor a los pacientes con mayor riesgo de muerte o eventos cardiacos.
Palabras clave
La obesidad es una epidemia mundial que constituye un verdadero reto, puesto que al menos un tercio de la población adulta es obesa1. Se asocia a la mayoría de las enfermedades cardiovasculares, incluida la hipertensión, las enfermedades coronarias y la insuficiencia cardiaca2,3.
Las repercusiones negativas de la obesidad no están relacionadas únicamente con la cantidad de grasa, sino también con la «calidad» y su distribución4. Un aumento de la acumulación de grasa en el abdomen, sobre todo en el compartimento visceral, se asocia a los factores de riesgo metabólico y la ateroesclerosis5,6. El tejido adiposo visceral (TAV) es metabólicamente activo y secreta adipocinas que causan inflamación vascular y resistencia a la insulina7,8. El TAV se asocia a la enfermedad cardiovascular y constituye un marcador del riesgo cardiometabólico9. Los datos prospectivos del Framingham Heart Study respaldan el papel del TAV como factor predictivo de mortalidad y enfermedad cardiovascular10,11, pero son escasos los estudios longitudinales que han explorado esta asociación, y su validez externa es escasa12–15. En cambio, la acumulación de grasa en el compartimento subcutáneo se asocia a un efecto metabólico neutro o incluso beneficioso16. En consecuencia, el cociente de grasa visceral respecto a grasa subcutánea (cociente TAV/tejido adiposo subcutáneo [TAS]) puede aportar una mejor evaluación de las repercusiones cardiometabólicas reales de la distribución de la grasa corporal, dados los diferentes efectos de estos depósitos de grasa anatómicamente parecidos pero funcionalmente diferentes.
El objetivo de este estudio es evaluar si el cociente de TAV/TAS abdominal se asocia a la mortalidad por cualquier causa y la morbilidad cardiovascular.
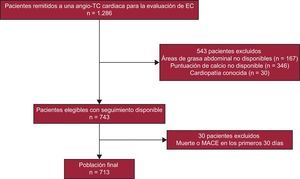
MÉTODOSParticipantes del estudioSe llevó a cabo un estudio de cohorte retrospectivo basado en un registro con datos de la Unidad de Diagnóstico e Intervención Cardiovascular de un hospital terciario. La muestra del estudio se obtuvo a partir del total de pacientes remitidos a angiografía por tomografía computarizada (TC) coronaria para evaluación de enfermedad coronaria (EC) entre enero de 2008 y diciembre de 2013. La mayor parte de los pacientes (n = 584) fueron remitidos sin una exploración previa para valorar la isquemia y en los demás (n = 129) la prueba de esfuerzo previa en cinta sin fin o la TC de emisión fotónica única no habían sido concluyentes. Para este estudio solo se tuvo en cuenta a los pacientes del área de asistencia primaria cubierta por nuestro centro. Se excluyó a los pacientes con enfermedad cardiovascular conocida (infarto de miocardio, ictus o intervención de revascularización previos, valvulopatía cardiaca, miocarditis o miocardiopatía previas) o con una enfermedad grave con peligro para la vida (esperanza de vida < 1 año). Formaron la población final los pacientes de los que se disponía de datos completos sobre las áreas del tejido adiposo abdominal y la puntuación de calcio arterial coronario (CAC), a los que se dio seguimiento un máximo de 3 años (figura 1).
Diagrama de flujo de la selección de los pacientes. Del total de 1.286 pacientes iniciales remitidos a TC cardiaca por sospecha de EC, formaron la población final 713 pacientes. angio-TC: angiografía por tomografía computarizada; EC: enfermedad coronaria; MACE: eventos adversos cardiovasculares mayores; TC: tomografía computarizada.
El protocolo del estudio se atuvo a las normas éticas de la Declaración de Helsinki de 1975 y fue aprobado por el comité de ética de investigación del centro. Todos los participantes dieron su consentimiento informado por escrito para participar en el estudio.
Evaluación de los factores de riesgoLa hipertensión arterial se definió por la presencia de antecedentes de hipertensión (según lo indicado por la guía de la Sociedad Europea de Cardiología17) o por estar en tratamiento médico con fármacos antihipertensivos. Los antecedentes de tabaquismo se evaluaron clasificando a los pacientes como nunca fumadores, exfumadores (participantes que habían fumado durante un mínimo de 6 meses en su vida pero no fumaban cuando se incorporaron al estudio) y fumadores actuales. La diabetes mellitus tipo 2 se definió por los antecedentes de diabetes (según los actuales criterios de consenso mundial18) o por recibir tratamiento médico para la diabetes. Los antecedentes familiares de EC prematura se definieron por la existencia de un familiar de primer grado que hubiera sufrido un infarto de miocardio mortal o no mortal o una intervención de revascularización coronaria antes de los 55 años (varones) o los 65 años (mujeres). Se consideró que había dislipemia si el paciente tenía antecedentes de dislipemia o tomab fármacos hipolipemiantes (estatinas, ezetimiba o fibratos).
Protocolo de la tomografía computarizada cardiacaEn todos los pacientes se realizó una exploración de TC multidetectores cardiaca en un escáner de TC de 64 cortes (SOMATOM, Sensation 64, Siemens Medical Solutions; Forchheim, Alemania) con 3 adquisiciones diferentes: la primera para la cuantificación de la grasa abdominal, la segunda para la cuantificación del CAC y la tercera para la angiografía coronaria. Para evaluar la grasa abdominal, se realizó una TC de abdomen con un solo corte, entre L4 y L5, según el método descrito por Borkan et al.19. Los parámetros de exploración fueron de 120 kV y 216 mA con un grosor de 5 mm. Esto produjo una exposición estimada a la radiación de 0,06 mSv. Un experto que desconocía la identidad del paciente utilizó el corte obtenido para medir la distribución de la grasa abdominal: se utilizó un cursor en flecha para trazar el área de TAV delimitando la capa muscular de la pared abdominal20 y se identificó el tejido adiposo en las áreas con valores de atenuación de entre −150 y −50 unidades Hounsfield (HU)21. Se midió el área de grasa abdominal total y se obtuvo el área de TAS restando el TAV del área de grasa abdominal total. Como estimación de la contribución relativa del TAV a la grasa abdominal total, se calculó el cociente del área de TAV respecto a la de TAS (cociente TAV/TAS).
Se utilizaron los siguientes parámetros para la cuantificación del CAC: colimación, 24 × 1,2 mm; rotación del túnel, 330 ms; factor de paso, 0,2; voltaje del tubo, 120 kV y corriente del tubo, 190 mAs. La reconstrucción de las imágenes de la adquisición para la puntuación del calcio se realizó usando un grosor de corte efectivo de 3 mm. La puntuación de CAC se presentó en forma de la puntuación Agatston media y se calculó usando un umbral de detección de 130 HU utilizando un programa informático semiautomático (Syngo Calcium Scoring, Siemens Medical Solutions) según lo descrito anteriormente22.
Tras la adquisición del CAC, se realizó la angio-TC (colimación, 64 x 0,6 mm; corriente del tubo, 850 mAs; todos los demás parámetros, similares a los de la adquisición de CAC). Se utilizó una modulación de la corriente del tubo con pulsos electrocardiográficos para reducir la dosis de radiación empleada, con aplicación de la corriente completa del tubo al 60-65% del intervalo RR. En los pacientes con peso corporal < 70 kg, el voltaje del tubo se redujo a 100 kV. Se inyectó un bolo de 80-100 ml de contraste (Ultravist, iopromida 370 mg/ml, Bayer Schering Pharma AG; Berlín, Alemania) a 5 ml/s mediante un inyector de potencia (Stellant D, Medrad Inc.; Warrendale, Pennsylvania, Estados Unidos) seguido de un chaser (perseguidor) de 40 ml de solución salina, empleando un catéter de acceso dedicado de calibre 18 en una vena antecubital. Se utilizó una técnica de rastreo del bolo, con una región de interés situada en el interior de la aorta ascendente, que se ajustó para detectar un umbral predefinido de 150 HU. Para la evaluación de la EC, se procesaron conjuntos multifásicos de imágenes reconstruidas de TC en una estación de trabajo dedicada (Aquarius Tera Recon Inc.; San Mateo, California, Estados Unidos) y un cardiólogo experimentado los analizó para la detección de al menos 1 estrechamiento del diámetro luminal > 50% en cualquier segmento arterial coronario. La presencia de segmentos con una calcificación intensa que impidiera la evaluación de la luz se clasificó como positiva de EC.
Seguimiento de los pacientes y objetivo combinadoAplicando la política de nuestro departamento, solo se dio seguimiento a los pacientes del área de asistencia primaria cubierta por nuestro centro, con objeto de obtener información sobre los eventos adversos cardiovasculares mayores (MACE). Los datos de seguimiento de los pacientes se obtuvieron mediante entrevistas telefónicas y examen del registro de la historia clínica electrónica a los 12 y a los 36 meses de la TC cardiaca. El objetivo combinado incluyó la muerte por cualquier causa, el infarto de miocardio o las intervenciones de revascularización (intervención coronaria percutánea o cirugía de revascularización coronaria) al menos 1 mes después de la TC cardiaca. El infarto de miocardio se definió según lo establecido en la definición de consenso más reciente23. La decisión de llevar a cabo una revascularización miocárdica la tomó el cardiólogo o el cirujano cardiaco que atendía al paciente.
Análisis estadísticoLas variables continuas se presentan en forma de media ± desviación estándar o mediana [intervalo intercuartílico]. Las variables discretas se expresan mediante frecuencias y porcentajes.
Se utilizó una prueba de la t para muestras independientes para evaluar las diferencias en las áreas de tejido adiposo abdominal y en el cociente TAV/TAS entre los participantes en función de la presencia o ausencia del objetivo combinado.
Se utilizó una regresión de riesgos proporcionales de Cox para el análisis multivariable empleando los siguientes modelos: el modelo 1 incluyó la edad y el sexo; el modelo 2 incluyó la edad, el sexo, el estado actual de tabaquismo, los antecedentes de hipertensión, diabetes mellitus tipo 2, dislipemia y los antecedentes familiares de EC prematura. El modelo 3 incluyó todas las variables del modelo 2 junto con la puntuación de calcio coronario. Se construyó un modelo final (modelo 4) incluyendo todas las variables del modelo 3 más una variable dicotómica para la presencia/ausencia de EC. Se evaluó el cumplimiento de la asunción de riesgos proporcionales de los modelos de Cox con los residuos de Schoenfeld24. No hubo indicio alguno de desviación respecto a la presunción de proporcionalidad. Los parámetros de TAV, TAS, cociente TAV/TAS y CAC + 1 se incluyeron en los modelos mediante el logaritmo de base 2, dado que su distribución era asimétrica (se evaluó la proporcionalidad empleando la prueba de Kolmogorov-Smirnov). Una variación de una unidad en la transformación logarítmica de base 2 sería equivalente a un aumento al doble en la variable de interés.
Todos los análisis estadísticos se realizaron con el programa Stata 13.1 para Mac (StataCorp; College Station, Texas, Estados Unidos).
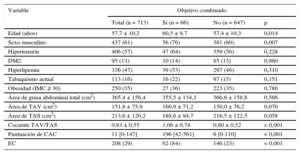
RESULTADOSCaracterísticas de los participantes y resultados del seguimientoFormaron la población final del estudio 713 participantes; 437 (61%) eran varones y la media de edad, 57,7 ± 10,2 años. Las características de los participantes según la incidencia del objetivo combinado durante el periodo de seguimiento se muestran en la tabla 1.
Características de los participantes
| Variable | Objetivo combinado | |||
|---|---|---|---|---|
| Total (n = 713) | Sí (n = 66) | No (n = 647) | p | |
| Edad (años) | 57,7 ± 10,2 | 60,5 ± 9,7 | 57,4 ± 10,3 | 0,014 |
| Sexo masculino | 437 (61) | 56 (76) | 381 (60) | 0,007 |
| Hipertensión | 406 (57) | 47 (64) | 359 (56) | 0,228 |
| DM2 | 95 (13) | 10 (14) | 85 (13) | 0,960 |
| Hiperlipemia | 336 (47) | 39 (53) | 297 (46) | 0,310 |
| Tabaquismo actual | 113 (16) | 16 (22) | 97 (15) | 0,151 |
| Obesidad (IMC ≥ 30) | 250 (35) | 27 (36) | 223 (35) | 0,786 |
| Área de grasa abdominal total (cm2) | 365,4 ± 156,4 | 355,5 ± 134,3 | 366,6 ± 158,8 | 0,566 |
| Área de TAV (cm2) | 151,8 ± 75,9 | 166,9 ± 71,2 | 150,0 ± 76,2 | 0,070 |
| Área de TAS (cm2) | 213,6 ± 120,2 | 188,6 ± 94,7 | 216,5 ± 122,5 | 0,058 |
| Cociente TAV/TAS | 0,83 ± 0,55 | 1,06 ± 0,74 | 0,80 ± 0,52 | < 0,001 |
| Puntuación de CAC | 11 [0-147] | 196 [42-561] | 6 [0-110] | < 0,001 |
| EC | 208 (29) | 62 (84) | 146 (23) | < 0,001 |
CAC: calcio arterial coronario; DM2: diabetes mellitus tipo 2; EC: enfermedad coronaria; IMC: índice de masa corporal; TAS: tejido adiposo subcutáneo; TAV: tejido adiposo visceral.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Durante una mediana de seguimiento de 1,3 [intervalo intercuartílico, 1,1-1,9] años hubo 18 muertes, 2 infartos de miocardio y 54 intervenciones de revascularización, con un total de 66 episodios del objetivo combinado. Estos participantes presentaban un aumento significativo del cociente TAV/TAS (1,06 ± 0,74 frente a 0,80 ± 0,52; p = 0,0001) y una tendencia estadísticamente significativa a un valor más alto de TAV (166,9 ± 71,2 frente a 150,0 ± 76,2 cm2) y un valor más bajo de TAS (188,6 ± 94,7 frente a 216,5 ± 122,5 cm2) (tabla 1).
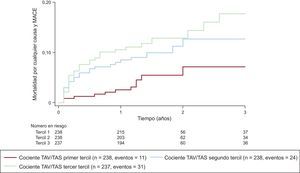
La tasa total de eventos fue de 6,0 (intervalo de confianza del 95% [IC95%], 4,7-7,6) por 100 personas-años de seguimiento (el 1,2% de los pacientes sin EC obstructiva; el 19,1% de los pacientes con EC obstructiva en la angio-TC). Hubo un aumento significativo en la tasa de eventos en los sucesivos terciles del cociente TAV/TAS (3,0 eventos en el primer tercil, 6,5 eventos en el segundo y 8,5 eventos cada 100 personas-años en el último; p = 0,0076). En la figura 2 se muestran las curvas de riesgo acumulado del objetivo combinado a lo largo del tiempo en función del tercil del cociente TAV/TAS.
Incidencia acumulada del objetivo combinado a lo largo del tiempo, según el tercil del cociente TAV/TAS. Hubo un aumento en la tasa de eventos en los sucesivos terciles del cociente TAV/TAS; MACE: eventos adversos cardiovasculares mayores; TAS: tejido adiposo subcutáneo; TAV: tejido adiposo visceral.
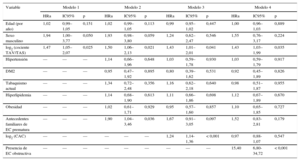
En el análisis con ajuste por edad y sexo, un aumento al doble del cociente TAV/TAS se asoció a un aumento del riesgo del objetivo combinado de 1,47 (IC95%, 1,05-2,07) (tabla 2). Esta asociación siguió siendo significativa tras un ajuste por los factores de riesgo cardiovascular tradicionales (modelo 2, hazard ratio [HR] ajustada = 1,50; IC95%, 1,06-2,13).
Análisis de regresión de Cox multivariable para la evaluación del log2 (cociente TAV/TAS) como predictor del objetivo combinado (mortalidad por cualquier causa o eventos adversos cardiovasculares mayores)
| Variable | Modelo 1 | Modelo 2 | Modelo 3 | Modelo 4 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HRa | IC95% | p | HRa | IC95% | p | HRa | IC95% | p | HRa | IC95% | p | |
| Edad (por año) | 1,02 | 0,99–1,05 | 0,151 | 1,02 | 0,99–1,05 | 0,113 | 0,99 | 0,95–1,02 | 0,447 | 1,00 | 0,96–1,03 | 0,889 |
| Sexo masculino | 1,94 | 1,00–3,77 | 0,050 | 1,93 | 0,98–3,80 | 0,059 | 1,24 | 0,62–2,47 | 0,546 | 1,55 | 0,76–3,17 | 0,224 |
| log2 (cociente TAV/TAS) | 1,47 | 1,05–2,07 | 0,025 | 1,50 | 1,06–2,13 | 0,021 | 1,43 | 1,01–2,01 | 0,041 | 1,43 | 1,03–1,99 | 0,035 |
| Hipertensión | — | — | — | 1,14 | 0,66–1,96 | 0,648 | 1,03 | 0,59–1,78 | 0,930 | 1,03 | 0,59–1,79 | 0,917 |
| DM2 | — | — | — | 0,95 | 0,47–1,92 | 0,895 | 0,80 | 0,39–1,62 | 0,531 | 0,92 | 0,45–1,89 | 0,826 |
| Tabaquismo actual | — | — | — | 1,34 | 0,72–2,48 | 0,356 | 1,16 | 0,62–2,18 | 0,640 | 0,98 | 0,51–1,87 | 0,955 |
| Hiperlipidemia | — | — | — | 1,14 | 0,68–1,90 | 0,613 | 1,11 | 0,66–1,86 | 0,698 | 1,12 | 0,67–1,89 | 0,670 |
| Obesidad | — | — | — | 1,02 | 0,61–1,71 | 0,929 | 0,95 | 0,57–1,60 | 0,857 | 1,10 | 0,65–1,85 | 0,727 |
| Antecedentes familiares de EC prematura | — | — | — | 1,90 | 1,04–3,46 | 0,036 | 1,67 | 0,91–3,05 | 0,097 | 1,52 | 0,83-2,81 | 0,179 |
| log2 (CAC) | — | — | — | — | — | — | 1,24 | 1,14-1,36 | < 0,001 | 0,97 | 0,88-1,07 | 0,547 |
| Presencia de EC obstructiva | — | — | — | — | — | — | — | — | — | 15,40 | 6,80-34,72 | < 0,001 |
CAC: calcio arterial coronario; DM2: diabetes mellitus tipo 2; EC: enfermedad coronaria; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; TAS: tejido adiposo subcutáneo; TAV: tejido adiposo visceral.
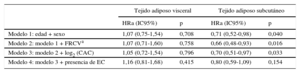
El TAV no mostró asociación con el objetivo combinado en los análisis multivariables (tabla 3). Sin embargo, los valores de TAS superiores presentaban asociación independiente con menor riesgo de muerte o de MACE, con independencia de la edad, el sexo, los factores de riesgo cardiovascular y el CAC (HR = 0,70; IC95% 0,51-0,97; p = 0,033).
Análisis de regresión de Cox multivariable para la evaluación de la asociación entre los tejidos adiposos abdominales visceral y subcutáneo y el objetivo combinado de mortalidad por cualquier causa y eventos adversos cardiovasculares mayores
| Tejido adiposo visceral | Tejido adiposo subcutáneo | |||
|---|---|---|---|---|
| HRa (IC95%) | p | HRa (IC95%) | p | |
| Modelo 1: edad + sexo | 1,07 (0,75-1,54) | 0,708 | 0,71 (0,52-0,98) | 0,040 |
| Modelo 2: modelo 1 + FRCVa | 1,07 (0,71-1,60) | 0,758 | 0,66 (0,48-0,93) | 0,016 |
| Modelo 3: modelo 2 + log2 (CAC) | 1,05 (0,72-1,54) | 0,796 | 0,70 (0,51-0,97) | 0,033 |
| Modelo 4: modelo 3 + presencia de EC | 1,16 (0,81-1,68) | 0,415 | 0,80 (0,59-1,09) | 0,154 |
CAC: calcio arterial coronario; EC: enfermedad coronaria; FRCV: factores de riesgo cardiovascular; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal.
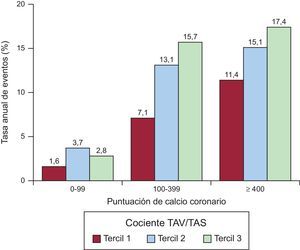
En el modelo que incluía la puntuación de CAC y los factores de riesgo de EC tradicionales, un aumento al doble en el cociente TAV/TAS se asoció a un aumento de 1,43 (IC95%, 1,01-2,01) veces en el riesgo del objetivo combinado (tabla 2). Parece que el CAC y el cociente TAV/TAS tuvieran un efecto aditivo en cuanto a la predicción del objetivo combinado de muerte o MACE (figura 3).
Tasas anuales de eventos del objetivo combinado estratificadas según la puntuación de CAC y los terciles del cociente TAV/TAS. El CAC y el cociente TAV/TAS parecían tener un efecto aditivo en la predicción del objetivo combinado de muerte o MACE. CAC: calcio arterial coronario; MACE: eventos adversos cardiovasculares mayores; TAS: tejido adiposo subcutáneo; TAV: tejido adiposo visceral.
La prevalencia de EC fue del 29% (208 pacientes). El cociente TAV/TAS fue un predictor significativo del objetivo combinado (aumento de 1,43 veces en el riesgo de muerte o de MACE al aumentar al doble el cociente TAV/TAS) tras ajustar por los factores de riesgo cardiovasculares, el CAC y la presencia de EC (modelo 4) (tabla 2).
DISCUSIÓNEn este estudio, en el que se incluyó una población adulta remitida a angio-TC para evaluar una posible EC, sin antecedentes conocidos de enfermedad cardiovascular previa, se observó que el aumento del cociente TAV/TAS abdominal se asociaba a mayores mortalidad total e incidencia de MACE, con independencia de los factores de riesgo vascular tradicionales, el CAC y la presencia de EC obstructiva. Que sepamos, este es el primer estudio de cohorte en el que se explora la influencia de la distribución relativa de la grasa abdominal entre el compartimento visceral y el subcutáneo en la mortalidad total y la incidencia de eventos cardiovasculares.
Durante una mediana de seguimiento de 1,3 años, hubo 66 eventos del objetivo combinado (6,0 cada 100 personas-años de seguimiento). Estos resultados concuerdan con un metanálisis de la asociación entre la EC detectada mediante angio-TC y los eventos cardiacos, que incluyó 32 estudios y 41.960 pacientes durante una media de seguimiento de 1,96 años, en el que se observó una tasa de MACE combinados del 5,8% en el seguimiento25. Tal como se preveía, los pacientes con una estenosis coronaria de al menos un 50% en la angio-TC cardiaca presentaron durante el seguimiento una tasa de MACE superior (el 19,1 frente al 1,2% de los pacientes sin EC obstructiva).
Cada vez se aprecia más claramente que el tejido adiposo es un regulador importante de la homeostasis cardiovascular. Por ejemplo, durante las últimas décadas se lo ha considerado un origen abundante de células madre mesenquimatosas que producen varios factores con propiedades angiogénicas e inmunomoduladoras que podrían desempeñar un papel en el direccionamiento de la medicina regenerativa para el corazón26. Además, el efecto del TAV y el TAS en la salud cardiovascular sigue siendo objeto de debate, pues hay datos contradictorios al respecto, lo cual indica la necesidad de disponer de un mejor biomarcador de las repercusiones de la distribución de grasa en el riesgo cardiovascular27. Según la «hipótesis de la vena porta»28, el TAV se asocia a un aumento del aporte de ácidos grasos libres al hígado y la producción de mediadores inflamatorios clave, como el factor de necrosis tumoral alfa y la interleucina 6, con lo que da lugar a resistencia a la insulina e inflamación sistémica de bajo grado29. Por otro lado, el papel del TAS en el riesgo cardiometabólico continúa siendo controvertido. En estudios previos se ha demostrado que el TAS puede asociarse a factores de riesgo metabólico y un aumento de la resistencia a la insulina, a pesar de tener una asociación más débil que el TAV5,30. Sin embargo, en los pacientes con sobrepeso y obesidad, una cifra de TAS más alta se asocia a la sensibilidad a la insulina16, lo cual indica que, en los pacientes con un aumento de la grasa corporal, la distribución relativa de la grasa en el compartimento abdominal puede ser importante para determinar sus repercusiones metabólicas generales. En este estudio, el TAV no fue un factor independiente predictivo del objetivo combinado. Sin embargo, nuestros resultados indican que el área del TAS era menor en los participantes que fallecieron o sufrieron un MACE durante el seguimiento, aunque este resultado no fue estadísticamente significativo (p = 0,0584), y que un valor del TAS superior se asociaba a un menor riesgo de muerte o eventos cardiacos tras introducir el ajuste por edad, sexo y presencia de factores de riesgo cardiovascular y CAC. Nuestros resultados respaldan un papel protector del TAS que, según los datos publicados con anterioridad, puede asociarse a una mejora de la sensibilidad a la insulina y, por lo tanto, un mejor perfil metabólico16.
El TAV afecta no solo a la homeostasis metabólica, sino también a la función cardiaca, en especial en la diástole. Un aumento del TAV se asocia a un deterioro de la función diastólica, tanto en personas asintomáticas31 como en quienes han sufrido un infarto de miocardio32. Su posible influencia negativa en la salud cardiovascular parece estar ligada a una mayor actividad metabólica que la del TAS, con la producción de mediadores inflamatorios que generan un estado proinflamatorio sistémico que constituye un elemento clave en la fisiopatología de la insuficiencia cardiaca con fracción de eyección conservada33. Sin embargo, en nuestra población, el TAV no fue un predictor significativo de muerte o eventos cardiacos. No obstante, incluso tras introducir un ajuste por los factores de riesgo tradicionales, la puntuación de CAC y la presencia de estenosis coronaria de al menos un 50%, un valor del cociente TAV/TAS más alto predijo mortalidad y MACE durante una mediana de seguimiento de 1,3 años. Estas observaciones respaldan el nuevo paradigma del «modelo de depósito de grasa ectópico» respecto a la contribución de la grasa corporal al riesgo metabólico34. Un TAS disfuncional favorece el depósito ectópico de grasa en otros compartimentos, lo que se asocia a resistencia a la insulina e inflamación35. Así, el cociente TAV/TAS puede aportar un índice de la repercusión cardiometabólica de la composición de la grasa corporal mejor que la cuantificación absoluta de cada depósito de manera independiente.
El cociente TAV/TAS fue un predictor significativo de MACE y mortalidad por cualquier causa, con independencia de la puntuación de CAC, que es un predictor potente y bien validado de eventos coronarios y mortalidad36,37. Teniendo en cuenta que el CAC es una estimación de la carga total de placa coronaria, nuestra hipótesis es que un valor más alto del cociente TAV/TAS puede asociarse a un aumento de la inflamación sistémica crónica de bajo grado que predisponga a los pacientes a tener placas vulnerablesy sufrir rotura de placas y trombosis38, por lo que el CAC y el cociente TAV/TAS parecen tener un efecto aditivo en el riesgo de muerte y de eventos cardiacos, tal como se muestra en la figura 3.
LimitacionesLas limitaciones de este estudio son su diseño observacional y la precaución que debe tenerse al extraer conclusiones sobre la causalidad. Todas las decisiones de realizar una revascularización miocárdica las tomaron el cardiólogo y el cirujano cardiaco que atendían al paciente. Se excluyeron las intervenciones de revascularización realizadas durante el primer mes siguiente a la TC coronaria, para evitar las intervenciones motivadas inmediatamente por el resultado de la angio-TC. Así pues, se puede asumir que la mayoría de las intervenciones de revascularización se realizaron a causa de una angina persistente a pesar del tratamiento antiisquémico o por una prueba de isquemia positiva. Nuestra cohorte estaba formada por población caucásica, por lo que queda por demostrar la validez externa de los resultados, en especial para otros grupos étnicos. Solo los pacientes de nuestra área de asistencia primaria fueron objeto del seguimiento para la obtención exacta de la información sobre los MACE. Estos pacientes debían acudir necesariamente a nuestro centro si tenían un MACE, y por consiguiente intentamos reducir al mínimo la posible pérdida de información sobre los MACE que fueran tratados en otros centros. Solo se dispuso del seguimiento de 3 años de una pequeña parte de la muestra inicial (n = 107). Un análisis de sensibilidad () no mostró diferencias significativas en cuanto a edad, sexo, factores de riesgo cardiovascular, puntuación de calcio, áreas de grasa abdominal y prevalencia de EC entre los grupos definidos por la presencia o ausencia de información de seguimiento de 3 años. Además, no se obtuvo sistemáticamente información detallada sobre los medicamentos prescritos a los pacientes.
CONCLUSIONESEste estudio puso de manifiesto que el cociente TAV/TAS es un predictor independiente de mortalidad y MACE. Además de la cuantificación del CAC, este marcador puede llegar a tener trascendencia clínica como instrumento para identificar mejor a los pacientes con un aumento del riesgo de muerte y de enfermedad cardiovascular.
CONFLICTO DE INTERESESNinguno.
- –
La obesidad es un factor de riesgo cardiovascular bien establecido y hay evidencia reciente de que su repercusión cardiovascular depende no solo de la cantidad, sino también de su localización.
- –
En el compartimento abdominal, el TAV parece tener una influencia negativa en la salud cardiovascular, pero el papel del TAS no está tan bien establecido. Además, la asociación entre el cociente TAV/TAS y la enfermedad no se ha explorado suficientemente.
- –
Este estudio retrospectivo aporta datos longitudinales que indican que el cociente entre TAV y TAS en el compartimento abdominal se asocia de manera independiente a mortalidad por cualquier causa y MACE.
- –
Ese cociente puede llegar a tener trascendencia clínica como instrumento para identificar mejor a los pacientes con un aumento del riesgo de muerte y de enfermedad cardiovascular.