La afección cardiaca determina el pronóstico y las opciones de tratamiento en la amiloidosis familiar relacionada con la transtiretina. Las técnicas de mapeo T1 de resonancia magnética cardiaca son útiles para determinar el volumen extracelular miocárdico. En este estudio se planteó la hipótesis de que el volumen extracelular miocárdico permite la identificación de la amiloidosis cardiaca y está correlacionado con el grado de deterioro neurológico en la amiloidosis familiar relacionada con la transtiretina.
MétodosA un total de 31 pacientes con amiloidosis familiar relacionada con la transtiretina (19 varones; media de edad, 49 ± 12 años; 26 pacientes con la mutación Val30Met), se les realizaron estudios de mapeo T1 con resonancia magnética cardiaca y una evaluación neurológica con la Neuropathy Impairment Score of the Lower Limb, el cuestionario Norfolk Quality of Life y el índice de Karnofsky.
ResultadosCinco pacientes tenían amiloidosis cardiaca (en todos los casos, confirmada mediante gammagrafía con 99mTc-DPD). El valor medio del volumen extracelular estaba aumentado en los pacientes con amiloidosis cardiaca (0,490 ± 0,131 frente a 0,289 ± 0,035; p = 0,026). El volumen extracelular mostró correlación con la edad (R = 0,467; p = 0,008), fracción aminoterminal del propéptido natriurético tipo B (Rs = 0,846; p < 0,001), el grosor máximo de la pared (R = 0,621; p < 0,001), el índice de masa ventricular izquierda (R = 0,685; p < 0,001), la fracción de eyección del ventrículo izquierdo (R = –0,378; p = 0,036), la puntuación de la Neuropathy Impairment Score of the Lower Limb (Rs = 0,604; p < 0,001), el cuestionario Norfolk Quality of Life (Rs = 0,529; p = 0,003) y el índice de Karnofsky (Rs = –0,517; p = 0,004). Se consideró que un valor de corte del volumen extracelular de 0,357 es diagnóstico de amiloidosis cardiaca con sensibilidad y especificidad del 100% (p < 0,001). El volumen extracelular y la fracción aminoterninal del propéptido natriurético tipo B son los únicos parámetros cardiacos que mostraron correlación significativa con las puntuaciones neurológicas.
ConclusionesLa cuantificación del volumen extracelular permite la identificación de la amiloidosis cardiaca y está correlacionada con el grado de deterioro neurológico en la amiloidosis familiar relacionada con la transtiretina. Esta técnica no invasiva puede ser un instrumento útil para el diagnóstico precoz de amiloidosis cardiaca y el seguimiento de la afección cardiaca y extracardiaca.
Palabras clave
La amiloidosis familiar relacionada con la transtiretina (TTR), también denominada polineuropatía amiloide familiar (PAF-TTR), es un trastorno hereditario autosómico dominante causado por mutaciones del gen de la TTR1.
En dicho trastorno, la proteína TTR mutada precipita y forma depósitos extracelulares de amiloide, principalmente en los nervios periféricos y el corazón1,2. Aunque generalmente el deterioro neurológico es lo que produce las manifestaciones clínicas predominantes, la afección cardiaca con frecuencia es lo que determina el pronóstico2–4.
Los tratamientos existentes para la PAF-TTR incluyen el trasplante de hígado5 y el fármaco estabilizante de la TTR tafamidis6. Están en estudio otros varios compuestos, con resultados iniciales prometedores7. Actualmente se recomienda iniciar el tratamiento farmacológico o indicar el trasplante de hígado cuando se identifiquen los primeros signos y síntomas de deterioro neurológico8,9.
Lamentablemente, cuando aparecen los primeros síntomas, los depósitos de amiloide pueden ser ya lo suficientemente significativos para comprometer el curso clínico posterior del paciente. Por lo tanto, se necesitan métodos que permitan detectar precozmente los depósitos de amiloide. Además, sería deseable disponer de un método que cuantificara la cantidad de amiloide presente en los tejidos con el paso del tiempo, con objeto de realizar un seguimiento de la respuesta al tratamiento y establecer un valor umbral para iniciar el tratamiento2.
La amiloidosis cardiaca (AC) es una de las principales causas de muerte de los pacientes con PAF-TTR2,3,5, y en un importante número de pacientes con PAF-TTR hay una afección cardiaca infradiagnosticada2,10.
El diagnóstico definitivo de AC requiere evidencia histológica de depósitos de amiloide2–4; sin embargo, la biopsia endomiocárdica tiene riesgos asociados y a menudo se prefiere un método diagnóstico no invasivo basado en técnicas de diagnóstico por imagen. En los pacientes con PAF-TTR confirmada genéticamente, se acepta la presencia de AC en casos de aumento inexplicado del grosor o la masa ventricular y signos típicos de AC en la gammagrafía con 99mTc-DPD o en la resonancia magnética cardiaca (RMC)2,8,11.
Las técnicas de mapeo T1 en la RMC permiten obtener, mediante una sencilla ecuación, una estimación del volumen cardiaco ocupado por componentes extracelulares12,13. Dado que los depósitos de amiloide asociados a la TTR son extracelulares, el valor del volumen extracelular cardiaco (VEC) refleja la cantidad de depósito de amiloide TTR existente en el miocardio y podría ser un instrumento útil para diagnosticar AC y dar seguimiento a su progresión13,14. Además, el VEC cardiaco puede reflejar la cantidad de depósito de amiloide presente en otros tejidos.
Este estudio tuvo un doble objetivo: determinar si el aumento del VEC permite la identificación de AC en los pacientes con PAF-TTR y explorar la posibilidad de que el VEC cardiaco esté correlacionado con el grado de deterioro neurológico causado por los depósitos extracardiacos de amiloide TTR.
MÉTODOSPoblación en estudioTras la autorización del comité ético de investigación, en cinco centros de España se incluyó a 31 pacientes con PAF-TTR demostrada genéticamente (19 varones; media de edad, 49 ± 12 años) que se encontraban en diferentes estadios de la enfermedad. Todos los participantes dieron su consentimiento informado por escrito y fueron examinados mediante RMC.
Los criterios de inclusión exigían una tasa de filtrado glomerular > 30ml/min/1,72 m2 y que no hubiera otras contraindicaciones para el uso de RMC (p. ej., dispositivos cardiacos).
Los criterios de exclusión fueron las contraindicaciones formales para la RMC y el infarto de miocardio previo.
Evaluación clínicaSe realizó una historia clínica y una exploración física detallada a todos los pacientes y se obtuvo una muestra de sangre antes del examen de RMC. Se determinaron los valores de creatinina, albúmina, hematocrito y fracción aminoterminal del propéptido natriurético tipo B (NT–proBNP). Se investigó asimismo la respuesta ortostática mediante el examen del cambio de presión arterial al pasar de decúbito a bipedestación15.
Un médico adecuadamente capacitado realizó ese mismo día la evaluación neurológica, que incluyó las siguientes pruebas: la escala Neuropathy Impairment Score-Lower Limbs (NIS–LL), el Norfolk Quality of Life Diabetic Neuropathy Questionnaire (Norfolk QOL–DN) y el índice de Karnofsky. Estas escalas se eligieron por su bajo grado de complejidad y por su uso previo en ensayos con fármacos para la PAF–TTR6,7. Aplicó las escalas siempre el mismo médico para reducir la variabilidad. La NIS–LL (0 a 88) es la suma de puntuaciones de las funciones motora, refleja y sensitiva (táctil, vibratoria, posicional y a la punción del primer dedo) en las extremidades inferiores (que son las que primero se ven afectadas en la PAF–TTR)16. Un paciente sin anomalías neurológicas tendría una puntuación de 0. La escala Norfolk QOL–DN es un cuestionario de 35 ítems (47 ítems en la versión en español), organizada temáticamente en cinco dominios: función física/neuropatía de fibras grandes, actividades de la vida diaria, síntomas, neuropatía de fibras pequeñas y neuropatía del sistema autónomo17. La puntuación total de calidad de vida es la suma de todos los dominios y puede tener valores entre 0 (la mejor calidad de vida) y 138 (la peor calidad de vida posible). El estado funcional de Karnofsky refleja el estado de salud general del paciente (valores de 100 a 0)18. En 2 pacientes no se llevó a cabo la evaluación neurológica debido a la coexistencia de otros trastornos que afectaban a las extremidades inferiores (poliomielitis y espondiloartritis con radiculopatía). No se incluyó a estos 2 pacientes en el análisis estadístico de la correlación neurológica con el VEC ni en la división en subgrupos clínicos. Sin embargo, sí se los incluyó en el análisis de los parámetros cardiacos, y ninguno de ellos presentaba AC.
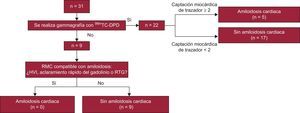
El resultado positivo en cuanto a afección cardiaca se basó en lo observado en la gammagrafía con 99mTc-DPD y en la RMC. La miocardiopatía amiloidótica se definió por la presencia de una captación biventricular intensa del trazador (grado 2 o 3 según lo definido por Perugini et al)19 en los pacientes examinados mediante gammagrafía con 99mTc-DPD (22 participantes). También se consideró presencia de AC que la RMC mostrara hipertrofia ventricular izquierda (HVI) (> 12 mm en ausencia de hipertensión arterial o valvulopatías) y, además, un rápido aclaramiento del gadolinio/realce tardío de gadolinio (RTG), típico de la amiloidosis, y una amiloidosis extracardiaca demostrada mediante biopsia2–4,11,20. No se realizó gammagrafía a 9 pacientes debido a que la técnica no estaba disponible en los centros que remitieron al paciente. En estos casos, solo se tuvieron en cuenta los datos de la RMC para definir la AC (figura 1). Para el análisis estadístico, se dividió a los pacientes incluidos en tres grupos según su estado clínico: portador de mutación asintomático (n = 5), deterioro neurológico sin AC (n = 19) y con AC (n = 5). Todos los pacientes con AC presentaban también deterioro neurológico.
Protocolo de resonancia magnética cardiacaSe realizó a todos los participantes un examen de RMC estándar con un escáner clínico de 3 T (Achieva, Philips Healthcare; Best, Países Bajos). Se realizaron secuencias de cine y de RTG convencionales21. Antes de administrar el contraste, se realizó la adquisición de las secuencias de mapeo T1 de Modified Look-Locker Inversion Recovery (MOLLI) en proyección de eje corto a nivel basal y a nivel medio de la cavidad (2 cortes) y de cuatro cámaras (1 corte). Se administró un bolo de 0,1 mmol/kg de contraste de gadolinio (gadopentetatodimeglumina, Magnevist, Bayer; Berlín, Alemania) y se adquirieron las imágenes de RTG estándares 15 min después. A continuación se administró gadolinio DTPA mediante un sistema de infusión a una velocidad de 0,00115 mmol/kg/min durante como mínimo 20 min, hasta alcanzar un equilibrio del contraste entre sangre y miocardio. Después de completar la infusión continua, se llevó a cabo una nueva adquisición de mapas T1 tipo MOLLI, que permitió determinar el cambio de los tiempos T1 antes y después de alcanzar un estado de equilibrio, según lo publicado previamente12.
Todas las imágenes de RMC y los mapas se analizaron offline en una estación de trabajo Philips (Philips; Best, Países Bajos).
Cálculo del volumen extracelularSe generaron los mapas T1 mediante ajuste no lineal de la intensidad de señal al modelo previamente propuesto22. El valor de T1 fue la media de las determinaciones completas de T1 obtenidas en las proyecciones de eje corto a nivel basal y medio del ventrículo (región de interés [ROI] completa del miocardio). Se excluyeron automáticamente los valores extremos ±2 desviaciones estándar de la media del valor de T1 de una ROI situada en el tabique. El volumen extracelular cardiaco se calculó según un método descrito con anterioridad12.
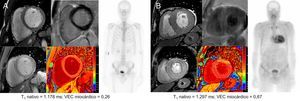
En la figura 2 se presentan algunos ejemplos de valores de VEC de un portador de mutación asintomático y un paciente con AC.
Resultados de la RMC cardiaca y la angiografía en un portador de mutación asintomático (A) y un paciente con amiloidosis cardiaca (B). Imágenes de RMC correspondientes a cine de eje corto, RTG (arriba) y mapeo T1 (abajo). RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; VEC: volumen extracelular.
Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los datos cualitativos se expresan como porcentajes y se compararon mediante prueba exacta de Fisher. Las variables con distribución normal se expresan como media ± desviación estándar, mientras que las variables de distribución no normal se expresan como mediana [intervalo intercuartílico]. Para el análisis estadístico, se utilizó la prueba de la t de Student y la prueba no paramétrica de Mann-Whitney en las comparaciones de dos grupos.
La correlación entre las variables se evaluó con el coeficiente de Pearson (R) o la rho de Spearman (Rs). Se utilizó un ANOVA (análisis de la varianza) de una vía o un análisis de Kruskal-Wallis para evaluar la correlación de las variables continuas con el estado clínico. La significación estadística se definió por un valor de p < 0,05. Todo el análisis se llevó a cabo empleando el programa estadístico SPSS, versión 20.0.0 (IBM Corp.; Armonk, Nueva York, Estados Unidos).
RESULTADOSSe incluyó en el estudio a 31 pacientes, con una media de edad de 49 ± 12 (intervalo, 34–71) años (19 varones [61%]), con una PAF–TTR diagnosticada genéticamente. La mutación más frecuente fue Val30Met (n = 26 [84%]). Otras mutaciones identificadas fueron delV122 (n = 3 [10%]), Glu89Gln (n = 1 [3%]) y Glu89Lys (n = 1 [3%]). En total, 21 pacientes (68%) procedían de las dos regiones de España con PAF–TTR por Val30Met endémica: Huelva (n = 14) y Mallorca (n = 7). A 5 participantes (4 varones) con una media de edad de 40 ± 6 años se los consideró portadores genéticos asintomáticos, lo cual se definió como un individuo sin signo alguno de enfermedad. Las mutaciones de los portadores genéticos asintomáticos fueron delV122 (n = 3), Glu89Lys (n = 1) y Val30Met (n = 1).
A 13 pacientes (42%) se les había practicado anteriormente un trasplante hepático y ningún paciente estaba en tratamiento con tafamidis cuando se llevó a cabo la exploración por RMC. Todos los pacientes trasplantados de esta cohorte eran del tipo Val30Met y procedían de una de las regiones endémicas. Ninguno de ellos formaba parte del subgrupo de portadores asintomáticos, ya que este tratamiento está indicado solo cuando hay manifestaciones de la enfermedad. Sin embargo, solo uno de estos pacientes presentaba una afección cardiaca.
Diecinueve pacientes (61%) mostraban signos de un deterioro neurológico aislado. Había hipotensión ortostática en 9 pacientes (33%), y 12 (39%) tenían alteraciones gastrointestinales (estreñimiento/diarrea). Ninguno presentaba infecciones urinarias.
Se diagnosticó AC a 5 pacientes (4 varones; edad, 65 ± 8 años) (figura 1). Los pacientes con AC presentaban las mutaciones Val30Met (n = 4) y Glu89Gln (n = 1). Todos los pacientes con AC presentaban también cierto grado de deterioro neurológico.
En el examen de RMC, todos los pacientes con AC mostraron HVI y un rápido aclaramiendo del gadolinio. El patrón de RTG en los pacientes con AC fue diverso: RTG transmural general (n = 2), RTG transmural excepto en los segmentos laterales basal y medio (n = 1), RTG moteado no isquémico (n = 1) y ausencia de RTG (n = 1). Ninguno de los pacientes con patrón de RTG transmural presentaba otras características que indicaran un infarto de miocardio previo, como anomalías del movimiento de la pared o adelgazamiento de la pared ventricular.
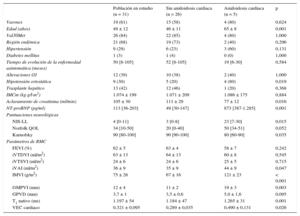
En la tabla 1 se presenta un resumen de las características clínicas y los resultados de la RMC.
Características clínicas, afección neurológica y observaciones de la resonancia magnética cardiaca
| Población en estudio (n = 31) | Sin amiloidosis cardiaca (n = 26) | Amiloidosis cardiaca (n = 5) | p | |
|---|---|---|---|---|
| Varones | 19 (61) | 15 (58) | 4 (80) | 0,624 |
| Edad (años) | 49 ± 12 | 46 ± 11 | 65 ± 8 | 0,001 |
| Val30Met | 26 (84) | 22 (85) | 4 (80) | 1,000 |
| Región endémica | 21 (68) | 19 (73) | 2 (40) | 0,296 |
| Hipertensión | 9 (29) | 6 (23) | 3 (60) | 0,131 |
| Diabetes mellitus | 1 (3) | 1 (4) | 0 (0) | 1,000 |
| Tiempo de evolución de la enfermedad asintomática (meses) | 50 [8-105] | 52 [8-105] | 19 [6-30] | 0,584 |
| Alteraciones GI | 12 (39) | 10 (38) | 2 (40) | 1,000 |
| Hipotensión ortostática | 9 (30) | 5 (20) | 4 (80) | 0,019 |
| Trasplante hepático | 13 (42) | 12 (46) | 1 (20) | 0,368 |
| IMCm (kg·g/l·m2) | 1.074 ± 199 | 1.071 ± 209 | 1.086 ± 175 | 0,884 |
| Aclaramiento de creatinina (ml/min) | 105 ± 30 | 111 ± 29 | 77 ± 12 | 0,016 |
| NT-proBNP (pg/ml) | 113 [36-203] | 49 [30-147] | 873 [387-1.285] | 0,001 |
| Puntuaciones neurológicas | ||||
| NIS-LL | 4 [0-11] | 3 [0-8] | 23 [7-30] | 0,015 |
| Norfolk QOL | 34 [10-50] | 20 [0-40] | 50 [34-51] | 0,052 |
| Karnofsky | 90 [80-100] | 90 [90-100] | 80 [60-90] | 0,035 |
| Parámetros de RMC | ||||
| FEVI (%) | 62 ± 5 | 63 ± 4 | 58 ± 7 | 0,242 |
| iVTDVI (ml/m2) | 63 ± 13 | 64 ± 13 | 60 ± 8 | 0,545 |
| iVTSVI (ml/m2) | 24 ± 6 | 24 ± 6 | 25 ± 5 | 0,715 |
| iVAI (ml/m2) | 36 ± 9 | 35 ± 9 | 44 ± 9 | 0,047 |
| IMVI (g/m2) | 75 ± 26 | 67 ± 16 | 121 ± 23 | < 0,001 |
| GMPVI (mm) | 12 ± 4 | 11 ± 2 | 19 ± 3 | 0,003 |
| GPVD (mm) | 3,7 ± 1 | 3,5 ± 0,6 | 5,0 ± 1,6 | 0,095 |
| T1 nativo (ms) | 1.197 ± 54 | 1.184 ± 47 | 1.265 ± 31 | 0,001 |
| VEC cardiaco | 0,321 ± 0,095 | 0,289 ± 0,035 | 0,490 ± 0,131 | 0,026 |
FEVI: fracción de eyección del ventrículo izquierdo; GI: gastrointestinales; GMPVI: grosor máximo de la pared del ventrículo izquierdo; GPVD: grosor de la pared del ventrículo derecho; IMCm: índice de masa corporal modificado; iMVI: índice de masa ventricular izquierda; iVTDVI: índice de volumen telediastólico ventricular izquierdo; iVAI: índice de volumen auricular izquierdo; iVTSVI: índice de volumen telesistólico ventricular izquierdo; NIS-LL: Neuropathy Impairment Score-Lower Limbs; NT–proBNP: fracción aminoterminal del propéptido natriurético tipo B; QOL: Quality of Life; RMC: resonancia magnética cardiaca; VEC: volumen extracelular.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
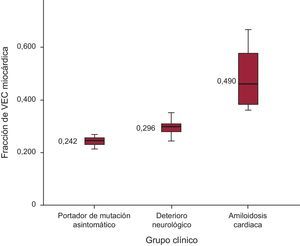
Los valores medios del VEC aumentaban en los diversos grupos clínicos en los portadores de mutación asintomáticos, los pacientes con síntomas tan solo neurológicos y los pacientes con AC (0,242 ± 0,02, 0,296 ± 0,027 y 0,490 ± 0,130; p < 0,001) (figura 3). La variabilidad del VEC interobservadores e intraobservador no mostró diferencias significativas (R = 0,66; p < 0,005 y R = 0,94; p < 0,005 respectivamente).
Aunque hubo una correlación directa entre el VEC y la edad (tabla 2), no se observaron diferencias del VEC medio según el sexo (varones frente a mujeres, 0,325 ± 0,103 frente a 0,316 ± 0,085; p = 0,794), los factores de riesgo cardiovascular (hipertensión frente a ausencia de hipertensión, 0,357 ± 0,125 frente a 0,307 ± 0,078; p = 0,184; diabetes frente a ausencia de diabetes, 0,305 ± 0,000 frente a 0,322 ± 0,096; p = 0,864) o el tipo de mutación (Val30Met frente a otras mutaciones, 0,324 ± 0,084 frente a 0,309 ± 0,151; p = 0,752).
Correlaciones del volumen extracelular miocárdico con diversos parámetros
| VEC | R | p |
|---|---|---|
| Edad | 0,467 | < 0,01 |
| IMCm | –0,185 | 0,364 |
| Tiempo de evolución de la enfermedad sintomática* | 0,366 | < 0,05 |
| Grosor máximo de la pared del VI | 0,621 | < 0,01 |
| Grosor del VD | 0,440 | < 0,05 |
| Índice de masa del VI | 0,685 | < 0,01 |
| iVTDVI | 0,018 | 0,925 |
| iVTSVI | 0,143 | 0,442 |
| FEVI | –0,378 | < 0,05 |
| Índice de área de AI | 0,592 | < 0,01 |
| Índice de volumen de AI | 0,418 | < 0,05 |
| NT-proBNP* | 0,820 | < 0,01 |
| NIS-LL* | 0,604 | < 0,01 |
| Norfolk QOL* | 0,529 | < 0,01 |
| Karnofsky* | –0,517 | < 0,01 |
AI: aurícula izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IMCm: índice de masa corporal modificado; iVTDVI: índice de volumen telediastólico ventricular izquierdo; iVTSVI: índice de volumen telesistólico ventricular izquierdo; NIS-LL: Neuropathy Impairment Score-Lower Limbs; NT-proBNP: fracción aminoterminal del propéptido natriurético tipo B; QOL: Quality of Life; VD: ventrículo derecho; VEC: volumen extracelular; VI: ventrículo izquierdo.
El VEC mostró correlación con varios parámetros cardiacos (tabla 2). El VEC cardiaco tenía una correlación directa con los valores indexados de la masa del ventrículo izquierdo, el grosor máximo de la pared del ventrículo izquierdo, el grosor del ventrículo derecho y el valor indexado de área/volumen de la aurícula izquierda y de NT–proBNP. El volumen extracelular tenía correlación inversa con la fracción de eyección del ventrículo izquierdo (tabla 2); sin embargo, la máxima correlación era la que se daba con la concentración de NT–proBNP (Rs = 0,820; p < 0,001).
Los valores de VEC cardiaco (0,522 ± 0,126 frente a 0,292 ± 0,037; p = 0,034) y T1 nativo fueron significativamente mayores en los pacientes con RTG positivo (1.263 ± 35 frente a 1.188 ± 49 ms; p = 0,007) y con una cinética del gadolinio rápida (0,461 ± 0,137 frente a 0,288 ± 0,036; p = 0,027; 1.264 ± 27 frente a 1.181 ± 45 ms; p < 0,001).
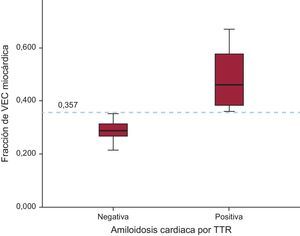
Todos los pacientes con AC mostraron un aumento de los valores del VEC. El valor medio del VEC estaba aumentado en los pacientes con AC en comparación con los pacientes sin AC (0,490 ± 0,131 frente a 0,289 ± 0,035; p = 0,026). Además, el valor de corte de VEC = 0,357 calculado mediante la curva ROC (receiver operating characteristic) fue diagnóstico de AC con sensibilidad y especificidad del 100% (p < 0,001) (figura 4).
Volumen extracelular y manifestaciones neurológicasLas puntuaciones de NIS-LL, Norfolk y Karnofsky mostraron correlación con el VEC (tabla 2), mientras que el T1 nativo solo se correlacionó con la escala NIS–LL (Rs = 0,403; p = 0,030). El NT-proBNP se correlacionó también con la puntuación NIS–LL (Rs = 0,720; p < 0,01), la Norfolk–QoL (Rs = 0,616; p < 0,01) y el índice de Karnofsky (Rs = –0,708; p < 0,01). También se observaron diferencias estadísticamente significativas en las puntuaciones de NIS–LL y Karnofsky en los distintos grupos clínicos, de tal manera que las peores puntuaciones eran las del grupo de AC (tabla 1).
DISCUSIÓNSegún nuestro conocimiento, este estudio es el primero que evalúa la utilidad del VEC cardiaco determinado mediante técnicas de mapeo T1 de RMC para el diagnóstico de AC en una población formada exclusivamente por pacientes con PAF–TTR. Este estudio pone de manifiesto que el VEC cardiaco aumenta de manera importante en los pacientes con PAF–TTR que presentan AC y que el VEC aumenta a lo largo del espectro de gravedad clínica de la enfermedad. Además, nuestro estudio indica que el VEC cardiaco se correlaciona con las manifestaciones neurológicas de la enfermedad.
La amiloidosis es el paradigma de las enfermedades de depósito que afectan al espacio extracelular1–4. En la PAF–TTR, los depósitos de amiloide aumentan progresivamente y afectan principalmente a los nervios y el corazón1–4,23. Aunque generalmente los síntomas neurológicos son los que dominan el cuadro clínico, la afección cardiaca es lo que con frecuencia determina el pronóstico2–4,23. Se puede utilizar las biopsias de nervios y cardiacas para confirmar el depósito de amiloide2–4, pero no sirven como método de seguimiento debido a que el depósito de amiloide tiene una distribución poco uniforme y por la imposibilidad de repetir biopsias en exactamente la misma localización.
Tanto las pruebas cardiacas como las neurológicas utilizadas en el seguimiento de la PAF–TTR han mostrado varias limitaciones. Por un lado, las pruebas neurológicas dependen de la capacidad del médico de obtener datos y no son específicas de un único tipo de neuropatía24. En cambio, la RMC y la gammagrafía con 99mTc-DPD proporcionan una respuesta de sí/no respecto a la presencia de enfermedad amiloide cardiaca, pero no aportan un valor preciso de la carga de amiloide que luego se pueda seguir a lo largo del tiempo.
Una técnica no invasiva que permita la detección precoz de los depósitos de amiloide y al mismo tiempo pueda estimar la carga de amiloide en los tejidos sería de especial utilidad en la PAF–TTR. Además, a pesar de los avances recientes en las técnicas no invasivas, el diagnóstico de la AC continúa planteando un verdadero reto y, con frecuencia, las manifestaciones características y fácilmente reconocibles solo se observan en fases avanzadas2,11. Si nuestros resultados se confirman en otros estudios, el VEC podría resultar de extraordinaria utilidad para diagnosticar precozmente la afección cardiaca en la PAF–TTR.
El cálculo del VEC mediante la RMC y las técnicas de mapeo T1 tienen el potencial de llegar a ser el método de elección para la cuantificación objetiva del amiloide en la PAF–TTR.
Se ha demostrado ya la utilidad del mapeo T1 en el diagnóstico diferencial de la HVI y se ha descrito que los valores nativos del T1 y el VEC son más altos en los pacientes con AC que en los controles sanos, los pacientes con miocardiopatía hipertrófica y los pacientes con estenosis aórtica grave13.
Hasta la fecha, el VEC se ha estudiado en el contexto de la AC, sobre todo en pacientes con amiloidosis AL (amyloid light-chain)25–28. Sado et al13 publicaron los primeros valores de VEC en la afección cardiaca por amiloidosis, en 27 pacientes con amiloidosis AL cardiaca, utilizando un escáner de 1,5 T y una secuencia de FLASH IR (fast low-angle single-shot inversion recovery) aplicando tiempos de inversión crecientes de 140 a 900 ms para permitir la cuantificación de T1. Ese estudio puso de manifiesto una diferencia muy notable de VEC entre los pacientes con AC y los pacientes con otros trastornos cardiacos13. Posteriormente, otros grupos han descrito su experiencia principalmente en la amiloidosis AL y también empleando un escáner de 1,5 T25–28. Los valores de VEC observados oscilaron entre 0,44 ± 0,12 y 0,46 ± 0,07. Algunos de los datos publicados para la amiloidosis AL se basaron en los valores de T1, con tiempos de T1 previos al contraste de 1.140 ± 6127, 1.130 ± 6825 y 1.080 ± 8728 en un escáner de 1,5 T con una secuencia ShMOLLI. Hasta el momento, solo un grupo ha presentado su experiencia en AC ATTR (amyloidogenic transthyretin), pero solo se presentaron los valores de T1 previos al contraste25. En ese estudio, un grupo de 85 pacientes con ATTR (35 con ATTR hereditaria) mostró un tiempo T1 nativo de 1.097 ± 43 ms y no se presentaron datos de VEC. Teniendo en cuenta los datos previos de VEC, nuestros resultados de VEC en los pacientes con PAF–TTR con afección cardiaca, de 0,490 ± 0,131, concuerdan con lo publicado anteriormente sobre la amiloidosis AL cardiaca.
En nuestra cohorte, un valor de VEC de 0,357 fue diagnóstico de AC, con sensibilidad y especificidad del 100%. Serán necesarios estudios de tamaño muestral mayor para abordar adecuadamente todo el espectro del VEC en esta enfermedad y determinar el valor de corte más apropiado para usarlo como umbral diagnóstico.
El hecho de que el VEC refleje con exactitud la afección cardiaca en la PAF–TTR está respaldado también en nuestro estudio por la observación de que el VEC se correlacionó con varios parámetros cardiacos y de manera muy intensa con los valores de NT–proBNP (Rs = 0,820; p < 0,001). Se ha descrito que la concentración de NT-proBNP es un factor pronóstico en la amiloidosis AL29, pero los datos de amiloidosis TTR existentes son escasos10,30. Algunas evidencias recientes indican que el NT–proBNP y el cambio de la masa del ventrículo izquierdo son marcadores de la progresión de la enfermedad en los pacientes con PAF–TTR31,32.
Por último, nuestro estudio ha puesto de manifiesto que el VEC se correlaciona con la afección neurológica de los pacientes con PAF-TTR y que el VEC muestra una progresión a lo largo del espectro de gravedad de la enfermedad. Estas observaciones respaldan el concepto de que el seguimiento de la carga de amiloide con VEC podría ser viable en los pacientes con PAF–TTR, tal como se ha descrito ya en modelos murinos33.
Como se ha comentado antes, el trasplante hepático es una alternativa terapéutica para estos pacientes, que evita la producción de proteína amilogénica. Tan solo 1 de los 13 pacientes con trasplante hepático de nuestro estudio presentaba signos de AC. Podría defenderse la existencia de un «efecto protector cardiaco» del trasplante hepático en estos pacientes en función de nuestros resultados, pero se entiende que continúan siendo necesarios estudios prospectivos de mayor tamaño muestral para determinar la utilidad del VEC en el seguimiento de los diferentes tratamientos para la PAF–ATTR existentes.
Por último, el VEC es un instrumento prometedor en investigación humana y podría utilizarse como indicador indirecto de la respuesta a nuevos compuestos, lo que facilitaría la realización de ensayos clínicos en esta enfermedad minoritaria. Desde un punto de vista clínico, el VEC podría utilizarse para el seguimiento de la respuesta farmacológica y facilitar la toma de decisiones respecto al trasplante hepático, aun cuando la simple cuantificación de la carga de amiloide puede no reflejar el mecanismo patológico específico de la amiloidosis.
LimitacionesEste estudio tiene la limitación de un tamaño muestral pequeño, a pesar de su carácter multicéntrico. La PAF-TTR es una enfermedad rara; además, los trastornos de la conducción que requieren el empleo de marcapasos y la nefropatía no son complicaciones infrecuentes de esta enfermedad, lo cual limita el uso de exploraciones de RMC en la investigación. Serán necesarios nuevos estudios con series de pacientes más amplias y con mutaciones diversas para confirmar nuestras observaciones.
Otra limitación es la ausencia de biopsias endomiocárdicas para confirmar la AC. Las biopsias endomiocárdicas conllevan ciertos riesgos y, por lo tanto, actualmente se acepta la existencia de AC en pacientes con PAF–TTR en presencia de una mutación patógena y signos que indiquen AC en las exploraciones de diagnóstico por imagen cardiaca8. Concretamente, los 5 pacientes con AC de nuestro estudio presentaban las características típicas de la afección cardiaca tanto en la RMC como en la gammagrafía (figura 1).
Algunos pacientes de nuestro estudio tenían hipertensión o diabetes. Estos factores de riesgo cardiovascular no se consideraron criterios de exclusión en estudios previos en este campo25,26, si bien no se puede descartar su influencia en los valores de VEC.
Es muy probable que el VEC cardiaco se correlacione con la carga de afección cardiaca en la AC, pero esto está aún pendiente de demostrarse con resultados de biopsias y autopsias. Aunque las técnicas de mapeo T1 con escáneres de 3 T han sido validadas anteriormente en voluntarios sanos34, hay pocos datos sobre los valores de VEC empleando valores de 3 T en la amiloidosis.
Por último, una parte significativa de los pacientes habían recibido un trasplante hepático, y no se sabe cuál es la influencia de este tratamiento en la afección cardiaca.
CONCLUSIONESLa cuantificación del VEC cardiaco mediante RMC permite la identificación de AC y se correlaciona con el grado de deterioro neurológico de los pacientes con PAF–TTR. Además, el VEC aumenta a lo largo del espectro de gravedad de la enfermedad. Esta técnica no invasiva podría llegar a ser un instrumento muy útil para el diagnóstico temprano de AC y para el seguimiento de los depósitos de amiloide cardiacos y extracardiacos en esta enfermedad si nuestros resultados se confirman en otros estudios.
FINANCIACIÓNEste trabajo fue financiado en parte por una subvención de investigación de Fundación Mutua Madrileña y por el Instituto de Salud Carlos III (RD12/0042/0066 y RD12/0042/0054). Las subvenciones están respaldadas por el Plan Estatal de Investigación Científica y Técnica y de Innovación 2013-2016 y por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa».
CONFLICTO DE INTERESESJ. Sánchez-González es empleado de Philips.
- -
La amiloidosis hereditaria relacionada con la transti-retina es una enfermedad rara en la que los depósitos aumentan de manera progresiva y afectan principalmente a los nervios y el corazón. Las pruebas cardiológicas y neurológicas para el seguimiento de la progresión de la enfermedad tienen varias limitaciones.
- -
Las nuevas técnicas de caracterización de los tejidos con la RMC tienen especial interés en la amiloidosis, puesto que permiten la cuantificación del espacio extracelular y los depósitos de amiloide. Se ha descrito que los valores nativos de T1 y VEC son más altos en la amiloidosis cardiaca que en los controles sanos y en otras causas de hipertrofia.
- -
Se ha descrito que los valores de VEC cardiaco se correlacionan con parámetros cardiacos en otros tipos de amiloidosis cardiaca como la amiloidosis AL.
- -
En el presente estudio se muestra que los valores de VEC permiten la identificación de la afección cardiaca en los pacientes con amiloidosis hereditaria relacionada con la transtiretina.
- -
Los valores del VEC cardiaco aumentan a lo largo del espectro de gravedad de la enfermedad.
- -
Este es el primer estudio en el que se demuestra correlación entre el VEC cardiaco y las manifestaciones neurológicas de la enfermedad.
- -
Estos resultados indican la posibilidad de utilizar el VEC como instrumento para el diagnóstico de la enfermedad, el seguimiento de su progresión y la evaluación de la respuesta al tratamiento.
Damos las gracias a Kenneth McCreath por la corrección de la redacción inglesa y a Noemi Escalera, Maite Dubraska, Ángel Macías y Braulio Pérez por su excelente ayuda técnica.