En el año 2009 se llevaron a cabo en España 2.343 procedimientos de ablación con catéter de aleteo, taquicardia macrorreentrante atípica o taquicardia auricular focal, con un crecimiento del 8% sobre el año anterior, lo que da una idea de la importancia clínica de estas arritmias. La clasificación tradicional que distingue la taquicardia auricular del aleteo auricular basándose en criterios de frecuencia y morfología de ondas ha dejado de ser relevante, en un momento en que el desarrollo de la electrofisiología clínica puede permitir una intervención curativa sobre la arritmia, basada en su mecanismo, y se hace muy necesario acercar la experiencia del laboratorio a la clínica. En esta revisión se dibuja el panorama actual de los mecanismos de taquicardias auriculares, tanto focales como reentrantes, procurando establecer lazos con los conceptos clásicos que permitan al clínico enfrentarse a los diagnósticos diferenciales y hacer las indicaciones correctas de tratamiento, incluido el estudio electrofisiológico. Algunos de los conceptos expuestos son complejos, pero creemos que es necesario apuntar la perspectiva de los métodos electrofisiológicos que permiten dibujar las bases anatómicas de las arritmias, que hoy resultan más fácilmente comprensibles gracias a la construcción de moldes anatómicos con sistemas computarizados de navegación.
Palabras clave
La electrofisiología clínica ha ido desarrollando desde la década de los años setenta el conocimiento de los mecanismos y los sustratos patológicos de las taquicardias auriculares. El análisis del electrocardiograma (ECG) ya había llevado a una clasificación relacionada con hipótesis patogénicas, pero la cartografía de la activación auricular y el estudio de las respuestas a la estimulación han permitido una definición más precisa de los mecanismos y sus bases anatómicas, lo que permite abordar un tratamiento «curativo» por medio de ablación con catéter o cirugía, en muchos casos. Por otro lado, la cirugía cardiaca, especialmente la de las cardiopatías congénitas, y más recientemente algunos tratamientos de ablación con radiofrecuencia están demostrando un potencial arritmogénico notable que está dando luz a una nueva generación de taquicardias iatrogénicas de futuro incierto.
En esta revisión se intenta dibujar una perspectiva de las taquicardias auriculares en un contexto clínico, ligando las manifestaciones clínicas con los mecanismos electrofisiológicos y los sustratos patogénicos, para llegar así a la perspectiva pronóstica y la toma de decisiones terapéuticas racionales.
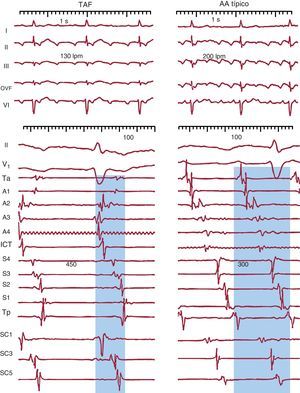
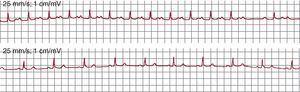
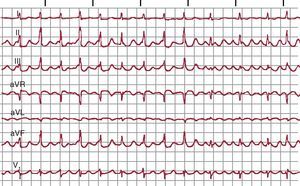
Diagnóstico electrocardiográficoTaquicardia auricular focalLa taquicardia auricular focal (TAF) se define como un ritmo auricular rápido, regular, no originado en el nódulo sinusal, con ondas P de morfología estable en el ECG y que precisa sólo de estructuras auriculares para su mantenimiento1 (Figura 1). La alternancia de ondas P y líneas de base estables indica que la taquicardia así definida en el ECG sea de mecanismo focal (TAF) con periodos de reposo entre descargas del foco (Figura 2), pero hay excepciones a esta regla.
Figura 1. Electrocardiograma y registros endocárdicos de taquicardia auricular focal y aleteo auricular típico en un mismo paciente. Los paneles inferiores muestran registros endocárdicos bipolares de la aurícula derecha anterior (Ta-A4 de arriba abajo), el istmo cavotricuspídeo, la aurícula derecha septal de abajo arriba (S4-Tp) y el seno coronario de proximal a distal (SC1-SC5). El sombreado azul muestra la porción del ciclo de la taquicardia cubierta por la activación, < 50% en la taquicardia auricular focal y el 100% en el aleteo auricular, incluso considerando sólo registros de aurícula derecha. AA: aleteo auricular; ICT: istmo cavotricuspídeo; OVF: onda de velocidad de flujo; SC: seno coronario; TAF: taquicardia auricular focal.
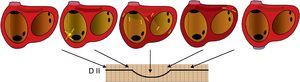
Figura 2. Representación esquemática de la secuencia de activación auricular en una taquicardia auricular focal originada en la porción inferior de la cresta terminal, en relación con la onda P en derivación II. Las flechas indican el progreso de la activación. Las líneas de base planas corresponden a periodos de ausencia de activación. D: derivación.
Aleteo auricularSe ha denominado clásicamente aleteo auricular (AA) o flutter a una taquicardia auricular de muy alta frecuencia (240-350 lpm), con ondas auriculares que producen una oscilación continua sin línea de base plana1 (Figura 1). Este patrón indicaría actividad continua durante todo el ciclo de activación auricular, como en el caso del AA típico (común) (Figura 3), pero puede haber un patrón de ondulación continua en TAF rápidas, en las que la duración de la onda P es muy próxima a la longitud de ciclo (LC).
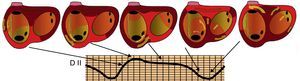
Figura 3. Representación esquemática de la secuencia de activación auricular en un aleteo auricular típico en relación con la onda de aleteo auricular en derivación II. En este caso no hay periodos de silencio porque la activación gira constantemente. La porción más plana de la onda de aleteo auricular corresponde a la activación del istmo cavotricuspídeo, con poca masa miocárdica D: derivación.
Los diagnósticos ECG clásicos de taquicardia y AA tienen hoy poca vigencia porque el tratamiento se basa en el abordaje directo del mecanismo de activación, ya sea TAF o taquicardia auricular macrorreentrante (TAMR) y, aunque algunos patrones muy típicos ayudan a la localización de un foco de TAF o desvelar el mecanismo del AA típico, en muchos casos sólo el estudio electrofisiológico permitirá definirlo con precisión.
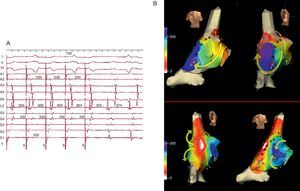
Mecanismos electrofisiológicosTaquicardia auricular focalLa TAF se caracteriza por activación auricular radial y centrífuga a partir del punto de origen (Figura 2, Figura 4), que puede localizarse en cualquier parte de las aurículas, las venas pulmonares, cava superior o seno coronario2. Esta definición no entra en determinar si el mecanismo de esta descarga focal es una despolarización acelerada en fase 4 del potencial de acción, pospotenciales (oscilaciones de la membrana) o una reentrada de diámetro muy pequeño (microrreentrada). En algunos casos el mecanismo electrofisiológico se puede colegir de la respuesta a la estimulación o a fármacos3, pero la importancia práctica de definir el mecanismo de descarga del foco iniciador es hoy por hoy escasa.
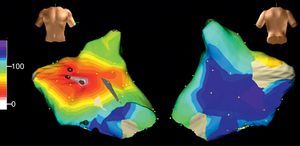
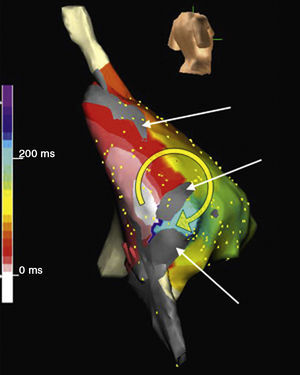
Figura 4. Cartografía electroanatómica (Navx®) de taquicardia auricular focal originada en la aurícula izquierda paraseptal. La imagen del torso indica la posición de las vistas (anterior a la izquierda, posterior con angulación caudal a la derecha). La escala de tiempo, a la izquierda, marca blanco el inicio de activación y violeta el final. Obsérvese la propagación centrífuga uniforme (blanco → amarillo → verde → azul → violeta) que converge en la aurícula izquierda posterior.
El ECG de la TAF registra ondas P regulares con una morfología que depende de la localización del foco2, a frecuencia que puede estar muy próxima a la sinusal, en torno a 100 lpm, o ser muy alta, por encima de 200 lpm (excepcionalmente hasta 300 lpm). Cuando la frecuencia es lenta, el diagnóstico sólo es posible por la distinta morfología (eje, configuración) de la onda P con respecto al ritmo sinusal (Figura 5). La LC o intervalo P-P de la TAF suele ser regular, pero cuando se registra su inicio y su terminación no es infrecuente una aceleración durante los 4-5 ciclos iniciales y una prolongación u oscilación de los ciclos que preceden a la interrupción espontánea. En algunos casos de TAF sostenidas estables, pueden registrarse oscilaciones del ciclo base (Figura 6A). En ausencia de otras anomalías, la activación auricular en la TAF es radial y rápida, pero cuando hay zonas de bloqueo de conducción, la activación se desvía haciéndose asimétrica y puede semejar una activación «circular», como en la TAMR (Figura 6B).
Figura 5. Derivación II del electrocardiograma de una taquicardia auricular focal (arriba) a 100 lpm y ritmo sinusal (abajo) del mismo paciente. Se confirma el mecanismo auricular de la taquicardia auricular focal porque no se interrumpe al bloquearse una onda P. Véase la diferencia de morfología de la onda P.
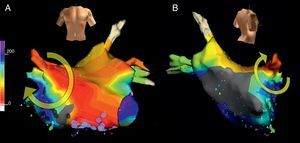
Figura 6. A: electrocardiograma y registros endocárdicos de aurícula derecha de una taquicardia auricular focal en un paciente intervenido por tetralogía de Fallot. Los registros A1→A5 son de aurícula derecha anterior de arriba a abajo, S5→S1 de aurícula derecha septal de abajo a arriba y L2 del foco de taquicardia en aurícula derecha lateral media-alta (véase B). A la izquierda del registro se está estimulando (S) el techo de la aurícula derecha (T) a longitud de ciclo 300 ms con captura de todos los puntos de registro salvo L2, que muestra oscilaciones de ciclo independientes con y sin estimulación. Obsérvese que el electrograma de L2 es tardío durante la estimulación y muy precoz tras la estimulación. Escala de tiempo en milisegundos. B: cartografía electroanatómica de taquicardia auricular macrorreentrante de cicatriz y taquicardia auricular focal en el mismo paciente del registro A. Los puntos oscuros marcan la posición de la cicatriz (electrogramas dobles de bloqueo de conducción). La activación en taquicardia auricular macrorreentrante (arriba) desciende la aurícula derecha anterior (flechas amarillas, naranja→amarillo→verde→azul) y gira hacia la pared posterior entre el extremo inferior de la cicatriz y la cava inferior. La cava superior parece incluirse en el obstáculo central del circuito. Puntos rojos y azules marcan el istmo donde la aplicación de radiofrecuencia cortó la taquicardia. La activación de la taquicardia auricular focal (abajo) se inicia junto a la cicatriz (blanco) pero no se propaga a la aurícula derecha anterior por efecto de la cicatriz (flechas) y la aurícula derecha anterior se activa muy tardíamente (azul). Esta taquicardia auricular focal se abolió con aplicaciones sobre la zona de origen blanca.
Taquicardia auricular macrorreentranteEn un mecanismo de TAMR, la activación auricular se produce de un modo continuo, sin interrupción, por un frente que rota en torno a un obstáculo formado por estructuras anatómicas (orificios valvulares o venosos), cicatrices o áreas de bloqueo funcional (anisotrópico) (Figura 7). El diámetro del circuito debería ser ≥ 2 cm para poder cartografiarlo correctamente con las técnicas de electrofisiología actuales, y circuitos más pequeños serían difíciles de distinguir de mecanismos focales1.
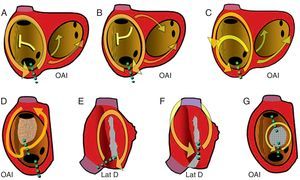
Figura 7. Esquemas de taquicardia auricular macrorreentrante de aurícula derecha observables en la clínica. En la visión oblicua anterior izquierda de la aurícula derecha se muestran los orificios de las cavas y el seno coronario y la cresta terminal (rayado vertical). Las flechas indican la dirección de la activación. Las líneas de puntos verdes marcan los istmos críticos de cada circuito, objetivo de ablación. A: aleteo auricular típico. B: aleteo auricular típico inverso. C: aleteo auricular típico con conducción a través de la cresta terminal. D: taquicardia auricular macrorreentrante con zona inexcitable de bajo voltaje no quirúrgica. E: taquicardia auricular macrorreentrante de cicatriz sin incluir la cava superior. F: taquicardia auricular macrorreentrante con istmo entre dos cicatrices e incluyendo la cava superior. G: taquicardia auricular macrorreentrante en torno a parche septal. Lat D: lateral derecha. OAI: oblicua anterior izquierda.
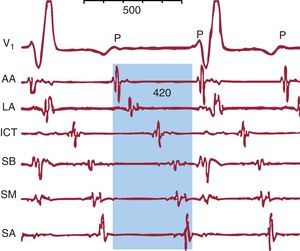
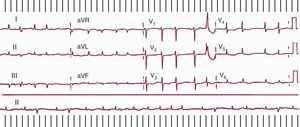
El AA típico, también llamado «común» por su frecuencia de presentación, destaca entre todas las TAMR por su dependencia de la estructura anatómica de la aurícula derecha (AD) y su clara identificación en el ECG4, pero otras TAMR resultan más difícilmente clasificables, especialmente en pacientes con antecedentes de cirugía cardiaca con atriotomías amplias o los que hayan sido sometidos a ablación amplia del miocardio de la aurícula izquierda (AI) para el tratamiento de la fibrilación auricular5. El ECG de una TAMR puede semejar una TAF con ondas P separadas por líneas de base isoeléctricas a frecuencias ≤ 200 lpm cuando hay zonas de conducción muy lenta en el circuito de reentrada, que generan potenciales de muy baja amplitud que no se detectan en el ECG de superficie, aunque sí en los registros intracardiacos (Figura 8). Por otro lado, una TAF puede producir un patrón de oscilación continua en el ECG si la LC es tan corta que se aproxima a la duración de la despolarización auricular (Figura 9).
Figura 8. Taquicardia auricular macrorreentrante con patrón electrocardiográfico de taquicardia auricular. V1 muestra ondas P regulares de bajo voltaje. Los registros endocárdicos de aurícula derecha anterior alta, lateral alta, septal baja, septal media, septal alta e istmo cavotricuspídeo muestran actividad eléctrica de muy bajo voltaje durante todo el ciclo de la taquicardia auricular macrorreentrante (sombreado azul) que el electrocardiograma no registra. AA: anterior alta; ICT: istmo cavotricuspídeo; LA: lateral alta; SA: septal alta; SB: septal baja; SM; septal media.
Figura 9. Taquicardia auricular focal (origen en vena pulmonar) a 300 lpm con patrón de ondulación continua en el electrocardiograma.
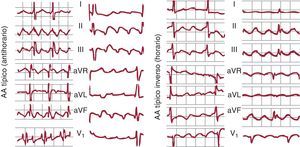
Aleteo auricular típicoEl AA típico es la TAMR más frecuente, y en general se puede identificar por un patrón de ECG muy característico en derivaciones inferiores que, aunque se describe frecuentemente como una onda negativa, es en realidad una ondulación compleja con una fase descendente lenta, seguida de un pequeño descenso rápido (la «onda negativa») y un rápido ascenso que termina en una deflexión positiva, para enlazar de nuevo con el descenso lento del ciclo siguiente (Figura 1, Figura 3, Figura 10). En V1 se pueden registrar deflexiones positivas, bifásicas o a veces negativas.
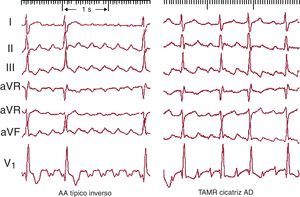
Figura 10. A la izquierda electrocardiograma en 2 casos de aleteo auricular típico (antihorario), con las típicas ondas multifásicas en II, III y aVF y con deflexiones bifásica y positiva en V1. A la derecha, 2 casos de aleteo auricular típico inverso (horario), con ondas de aspecto positivo en II, III y aVF y el típico patrón de W en V1 (véase el texto para más explicación). AA: aleteo auricular.
La alta incidencia del AA típico y su patrón reproducible en el ECG se deben a la sólida configuración anatómica del circuito, que conduce la activación circular en torno al anillo tricúspide. La activación asciende en la AD septal, gira en el techo para hacerse descendente en la AD anterolateral y finalmente pasa entre el anillo tricúspide y la vena cava inferior para alcanzar de nuevo la AD septal. El circuito se hace estable por la presencia de un gran obstáculo en la AD posterior, constituido por los orificios de las venas cavas superior e inferior, unidos por la cresta terminal (Figura 7, Figura 10).
La cartografía de AD durante AA típico demuestra una línea de bloqueo de la conducción en la pared posterolateral, entre los orificios de las venas cavas, que obliga el giro del frente de activación en torno a estos orificios. Hoy se acepta que esta línea de bloqueo se debe a la anisotropía de la cresta terminal, que por su disposición vertical facilita la conducción desde el nódulo sinusal a la AD inferior, pero bloquea la conducción transversal en la pared posterior6, 7. Spach et al estudiaron músculos pectíneos de la AD del perro, en los que los miocitos están dispuestos en paralelo; demostraron que la conducción en sentido longitudinal al haz de miocardio era mucho más rápida que en sentido transversal, y esta diferencia se relacionaba con la resistencia intercelular en una y otra dirección8 y la disposición de las uniones intercelulares de baja resistencia (gap junctions) en los extremos de los miocitos9. Se ha podido relacionar el bloqueo de la conducción transversal en la cresta terminal10, 11 y el mismo grosor de la cresta12 con la incidencia clínica de AA típico.
En un 90% de los casos, el giro de la activación en el circuito de AA típico es antihorario en una visión oblicua anterior izquierda (descendiendo la AD anterior y ascendiendo la septal). Esta preferencia podría deberse a una mayor facilidad para el bloqueo de la conducción descendente en la AD septal baja, donde el miocardio es de muy escaso grosor y alineamiento irregular. Si una extrasístole se bloquea a este nivel, la conducción del frente de activación descendente por la cara anterior podría reentrar la AD septal a través del istmo cavotricuspídeo (ICT), y así se inicia el giro antihorario. El AA típico inverso (horario) recorre el mismo circuito descendiendo la AD septal y ascendiendo por la AD anterolateral, con la misma línea de bloqueo en la AD posterolateral y el mismo cierre inferior a través de ICT (Figura 7, Figura 10). El patrón de ECG es distinto del AA antihorario, con inscripción en cara inferior de deflexiones positivas melladas en forma de M y en V1 de onda negativa, ancha, mellada en forma de W (Figura 10).
El cierre inferior del circuito es el ICT, un segmento relativamente estrecho de miocardio entre la vena cava inferior y el anillo tricúspide, que por sus dimensiones y fácil acceso se acepta como el objetivo ideal para la ablación con catéter. Las ramificaciones finales de la cresta terminal se insertan en el anillo tricúspide en el ICT con un alineamiento irregular de las fibras13, lo que lentifica moderadamente la conducción a este nivel por la anisotropía local14.
Se han descrito variaciones del este circuito del AA típico en las que la activación cruza la cresta terminal a algún nivel, a la vez que gira por delante de la cava superior15, pero estas variaciones no tienen trascendencia clínica ni terapéutica (Figura 9).
Aleteo atípicoEl término AA atípico resulta ser un «cajón de sastre» que incluye patrones de ECG y mecanismos de taquicardia diversos5, 16. La literatura actual incluye bajo este término TAMR con ondas P bien definidas, líneas de base planas y frecuencia ≤ 200 lpm, junto con taquicardias rápidas sin línea de base estable que no encajen en la morfología característica del AA típico17, 18, 19, 20. Para no caer en la confusión, describiremos los circuitos de TAMR según su base anatómica, partiendo de la base de que sólo el estudio electrofisiológico permite una definición de los mecanismos para guiar un abordaje terapéutico eficaz.
Taquicardia macrorreentrante auricular derechaLas atriotomías amplias empleadas para la corrección de una comunicación interauricular o interventricular, resecar un mixoma o reparar una válvula tricúspide pueden crear un obstáculo suficiente para constituirse en obstáculo central de una TAMR, que se localiza generalmente en la pared anterior o lateral de la AD. Menos frecuente es la TAMR en torno a un parche de cierre de una comunicación auricular (Figura 7). Aunque infrecuentemente, se puede encontrar a veces zonas inexcitables, indicio de cicatriz, en la pared lateral de la AD, como base de una TAMR, en pacientes no sometidos a cirugía (Figura 7)18, 19. Se ha postulado que estas áreas de bajo voltaje, de naturaleza hoy por hoy desconocida, podrían reflejar zonas de fibrosis.
En su forma más sencilla, la TAMR de cicatriz es un circuito localizado en la pared lateral de la AD, en cuyo centro hay una línea de bloqueo, constituida por la misma cicatriz (Figura 6, Figura 7, Figura 11). El punto de giro inferior localizado entre el extremo de la cicatriz y la vena cava inferior es estrecho y suele ser una zona de conducción lenta. El punto de giro superior puede ser el extremo de la cicatriz o el orificio de la cava superior, que se puede integrar funcionalmente en el obstáculo central (Figura 6, Figura 7). En aurículas muy dilatadas, especialmente tras la cirugía de Fontan, se puede encontrar zonas inexcitables, de bajo voltaje, en las paredes de AD (Figura 11) que contribuyen a canalizar los circuitos de TAMR21, 22, 23. En pacientes sometidos a cirugía de Mustard o Senning, a la complejidad de las barreras cicatriciales se añade la enorme dificultad de acceso a las porciones de las aurículas aisladas por los parches utilizados para reconducir el flujo sanguíneo24, 25.
Figura 11. Cartografía electroanatómic (Navx®) de taquicardia auricular macrorreentrante en paciente intervenido por atresia tricuspídea en visión posterolateral derecha. Nótese las zonas inexcitables de bajo voltaje (gris). La escala de tiempos marca arbitrariamente el punto de inicio (blanco) por detrás de un istmo entre dos zonas inexcitables. La activación gira en torno a una de las zonas inexcitables (blanco a rojo→amarillo→verde→azul) para volver a pasar el istmo. La aplicación de radiofrecuencia en este punto interrumpió la taquicardia.
Una de las más importantes lecciones de las TAMR de cicatriz es que pueden ser evitables si la atriotomía quirúrgica se prolonga hasta un obstáculo anatómico fijo, que sería la vena cava inferior en las atriotomías de AD lateral. Un caso muy particular es el del trasplante cardiaco, en el que la sección de la pared posterior de la AD del donante crea una preparación experimental para la producción de AA típico, lo que explica que esta arritmia sea común en corazones trasplantados, aunque sería prevenible si en la misma intervención se hiciese una ablación (sección, criocirugía, radiofrecuencia) del ICT del donante, cuidando de proteger la arteria coronaria derecha.
Taquicardia macrorreentrante auricular izquierdaLa estructura anatómica de la AI no contiene los grandes obstáculos de la AD, y quizá por eso las TAMR de la AI han sido poco frecuentes. En pacientes sin antecedentes de cirugía la TAMR de AI se produce en presencia de amplias áreas inexcitables de bajo voltaje y áreas de bloqueo de conducción que forman el núcleo central del circuito, ya sea por sí mismas, ya sea por su anexión a algún obstáculo anatómico (orificios de las venas pulmonares u orejuela) (Figura 12, Figura 13)17, 26, 27. La TAMR de AI se asocia a cardiopatías orgánicas (miocardiopatías, valvulopatías) y a patrones de grave trastorno de conducción interauricular (bloqueo del haz de Bachmann)28. Un sustrato frecuente de la TAMR de AI son las atriotomías quirúrgicas de cirugía valvular mitral29 o de cirugía de fibrilación auricular30. En los últimos años, el gran auge de la ablación de la fibrilación auricular, con destrucción de amplias zonas de miocardio auricular, ha dado pie a una alta incidencia de TAMR de la AI en estos pacientes31, 32, 33, que lleva a la necesidad de nuevos procedimientos de ablación en un buen número de ellos.
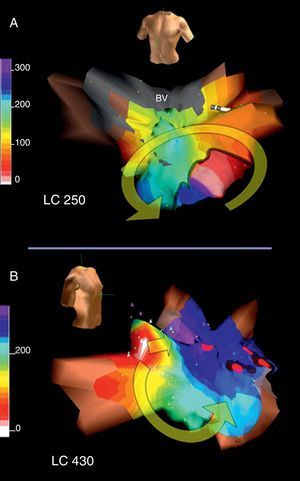
Figura 12. A: cartografía electroanatómica (Navx®) en visión anterior, de un circuito de taquicardia auricular macrorreentrante en torno al anillo mitral en paciente sin antecedentes quirúrgicos; obsérvese la amplia zona inexcitable de bajo voltaje (en gris) en la aurícula izquierda posterosuperior. B: cartografía en visión oblicua anterior derecha de una taquicardia auricular focal muy lenta (ciclo, 430 ms) inducible tras la interrupción de la taquicardia auricular macrorreentrante con aplicaciones de radiofrecuencia entre la zona de bajo voltaje y el anillo mitral (puntos rojos); esta taquicardia auricular focal se origina en la vena pulmonar superior derecha (área blanca); como en el caso de la figura 6, una línea de bloqueo obliga al giro del frente de activación que termina al otro lado de esta zona de bloqueo (azul-violeta). BV: bajo voltaje; LC: longitud del ciclo.
Figura 13. Cartografía electroanatómica (Navx®) en visión anterior (A) y posterolateral derecha (B) de una taquicardia auricular macrorreentrante girando en torno a la vena pulmonar superior derecha. Obsévense las zonas inexcitables de bajo voltaje, especialmente en la aurícula izquierda posterior.
Diagnóstico clínicoCuando el ECG registra una taquicardia en un paciente sin cardiopatía, de presentación paroxística, con ondas P bien delimitadas a frecuencia entre 180 y 220 lpm, y se puede observar que la conducción auriculoventricular (AV) no es constante (bloqueo Wenckebach o 2:1) durante la taquicardia, el diagnóstico de TAF es muy probable. Si se puede registrar al inicio de la taquicardia una aceleración y antes de su terminación espontánea una deceleración de la frecuencia (fenómeno de «calentamiento y enfriamiento»), el mecanismo focal por automatismo anormal se hace casi seguro. Si el paciente espontáneamente no muestra bloqueo AV, se puede inducirlo por medio de maniobras vagales o por la inyección intravenosa de adenosintrifosfato (ATP) o adenosina. La interrupción de la taquicardia con estas maniobras hace más probable que el mecanismo sea una reentrada con participación del nodo AV (intranodal o por vía accesoria).
Cuando el ECG registra una taquicardia a > 240 lpm con un patrón típico de AA antihorario u horario (ya comentado) y bloqueo AV fijo o variable, en un paciente con o sin cardiopatía orgánica, sin antecedentes de cirugía cardiaca, el diagnóstico de AA típico dependiente del ICT es casi seguro. Si la morfología de las ondas no se aprecia bien, se puede aumentar el grado de bloqueo AV con masaje carotídeo o con la inyección de ATP o adenosina, registrando en ese momento las derivaciones de los miembros y V1. En pacientes con antecedentes de atriotomía quirúrgica el patrón ECG de AA típico deja de ser específico (Figura 14).
Figura 14. Electrocardiograma de un paciente con atriotomía quirúrgica. A la izquierda un aleteo auricular típico de giro horario que en II, III y aVF se asemeja al aleteo auricular típico de giro antihorario, pero tiene las típicas ondas en W en V1. A la derecha el patrón de electrocardiograma es muy sugerente de aleteo auricular típico de giro antihorario, pero el circuito de taquicardia auricular macrorreentrante giraba en torno a la cicatriz de aurícula derecha lateral, sin participación del istmo cavotricuspídeo. AA: aleteo auricular; AD: aurícula derecha; TAMR: taquicardia auricular macrorreentrante.
En presencia de un patrón de ECG de AA atípico, las posibilidades son muchas, entre ellas TAF o TAMR de AI, especialmente si hay historia de cirugía cardiaca o de ablación del miocardio auricular para el tratamiento de la fibrilación auricular. En pacientes con estas lesiones auriculares complejas, ni el mismo patrón de AA típico permite predecir el mecanismo de taquicardia y además pueden coexistir mecanismos de TAF y TAMR.
Diagnóstico electrofisiológicoEstablecer un mecanismo auricularSi la taquicardia no está presente al inicio del estudio, se inducirá por medio de estimulación programada con o sin infusión de isoproterenol. Si la taquicardia no muestra bloqueo AV espontáneamente, se demostrará el origen auricular por medio de la estimulación ventricular, que puede disociar el ritmo ventricular de la taquicardia sin modificarla.
Patrón de activación auricularUna vez confirmado el mecanismo auricular, se hará una cartografía de activación auricular que determine la localización del foco de origen de una TAF (Figura 4, Figura 6, Figura 12) o la configuración anatómica de un circuito de TAMR, localizando el istmo o los istmos críticos cuya ablación permita interrumpirlo (figs. Figura 6 y Figura 11, Figura 12, Figura 13). La técnica de cartografía se basa en la medida de los retrasos de activación de múltiples puntos de una o las dos aurículas con respecto a una referencia temporal que puede ser el inicio de la onda P o un punto de registro endocárdico estable tomado como referencia 0 (arbitraria). La utilización de catéteres multipolares permite obtener varios registros simultáneos como referencia (Figura 15), monitorizar la estabilidad del circuito y revelar la proporción del ciclo cubierto por la activación auricular, que en la TAF suele ser < 50%, mientras que en la TAMR puede ser el 100% si se obtienen suficientes registros (figs. Figura 1, Figura 8, Figura 16, Figura 17). Cuando el foramen oval no es permeable, se puede hacer registros desde el seno coronario para obtener tiempos de activación próximos al anillo mitral inferior y desde la arteria pulmonar derecha para registrar la activación del techo de la AI (Figura 15), pero la cartografía detallada de la AI exigirá un cateterismo transeptal.
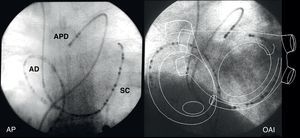
Figura 15. Imágenes fluoroscópicas de catéteres-electrodo multipolares en la aurícula derecha, seno coronario y arteria pulmonar derecha en proyecciones anteroposterior y oblicua anterior izquierda. El esquema de la anatomía auricular muestra las áreas que registran estos catéteres. AD: aurícula derecha; AP: anteroposterior; APD: arteria pulmonar derecha; OAI: oblicua anterior izquierda; SC: seno coronario.
Figura 16. A: encarrilamiento de aleteo auricular típico (antihorario) por estimulación (S) del istmo cavotricuspídeo. La activación de la aurícula derecha anterior es descendente (Ta→A4) tanto en los ciclos estimulados como al detener la estimulación, demostrando que los frentes estimulados siguen el circuito. En cada ciclo se produce un segundo frente estimulado en dirección contraria al circuito (antidrómico) que colisiona con el frente encarrilado en el ciclo anterior (esquema). B: idéntico fenómeno con secuencia inversa en un aleteo auricular típico horario. La aurícula derecha septal muestra secuencia descendente (Tp-S4) durante el encarrilamiento, igual que tras la estimulación. El primer ciclo (retorno) tras la estimulación es igual que los ciclos espontáneos de aleteo auricular en los 2 casos y no se observa cambio de morfología en el electrocardiograma ni de secuencia en los electrogramas (encarrilamiento oculto, sin fusión), lo que es típico de un istmo estrecho del circuito de taquicardia auricular macrorreentrante. ICT: istmo cavotricuspídeo.
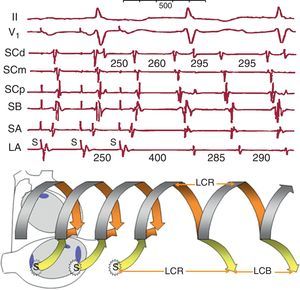
Figura 17. Encarrilamiento de una taquicardia auricular macrorreentrante de aurícula izquierda mediante estimulación en aurícula derecha lateral alta. Se muestran registros de aurícula derecha septal alta y baja y senos coronario proximal, medio y distal. El esquema (abajo) representa el circuito de taquicardia auricular macrorreentrante en la aurícula izquierda desplegado en el tiempo como un helicoide. El frente estimulado (flecha amarilla) alcanza el circuito y lo penetra en dirección ortodrómica y antidrómica en cada ciclo, y al cortar la estimulación el circuito se restablece a su ciclo basal. Los registros muestran la inversión de la secuencia de electrogramas de lateral alta, septal alta, septal baja y seno coronario proximal durante estimulación (S), mientras no cambia la secuencia de seno coronario distal→seno coronario medio (fusión del frente estimulado y el encarrilado en el circuito). Al cortar la estimulación la taquicardia auricular macrorreentrante vuelve al ciclo basal de 295 ms, como muestran los senos coronarios distal y medio, pero en el punto de estimulación (lateral alta) la longitud del ciclo de retorno es más larga porque, al estar fuera del circuito, se añaden los tiempos de conducción hacia y desde el circuito (flechas amarillas). LA: lateral alta; LCB: longitud del ciclo basal; LCR: longitud del ciclo de retorno; SA: septal alta; SB: septal baja; SCd: seno coronario distal; SCm: seno coronario medio; SCp: seno coronario proximal.
Una cartografía manual, punto a punto, anotada sobre un esquema de la anatomía auricular es posible en muchas taquicardias de la AD, más accesible y con grandes obstáculos que dejan menos alternativas a la TAMR; sin embargo, las variaciones de los circuitos TAMR en la AI son tales que sólo se puede definirlos claramente con una cartografía computarizada apoyada en un sistema de navegación que localice la posición de los electrodos exploradores. Los sistemas de navegación informatizados traducen la escala de tiempo en escala de colores y facilitan la lectura de la propagación de la activación. Aun con estas herramientas, no es fácil dibujar estos circuitos, porque pueden desestabilizarse durante el movimiento de los catéteres para la cartografía o la estimulación programada para estudiar datos de encarrilamiento.
Estimulación durante taquicardia: encarrilamiento transitorioLa estimulación auricular a frecuencias más altas que la de la taquicardia es muy útil para confirmar un mecanismo TAMR y para confirmar si un punto concreto forma parte del circuito, pero las maniobras de estimulación pueden interrumpir la taquicardia o alterar su mecanismo, por lo que lo ideal es hacer inicialmente una cartografía de activación y confirmar los datos de esta con la estimulación en un mínimo de puntos escogidos y a frecuencias muy próximas a la de la taquicardia. El registro de múltiples puntos de ambas aurículas durante las pruebas de estimulación ayuda a detectar la fusión de frentes de activación, característica de la TAMR, y también a localizar de un modo aproximado el circuito, dirigiendo a una u otra aurícula la cartografía detallada de la activación.
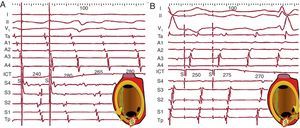
En la TAF la estimulación por encima de la frecuencia del foco captura las aurículas completamente, y al interrumpir la estimulación se puede reanudar la TAF tras una pausa debida a supresión del automatismo del foco con la estimulación. Cuando se consigue registrar en el origen de la TAF se puede observar a veces el mantenimiento de la actividad espontánea de este, que no es capturado durante la estimulación (bloqueo de entrada) (Figura 6A). En contraste con esto, en una TAMR se observa el fenómeno del encarrilamiento transitorio, consistente en que durante la estimulación se capturan completamente las aurículas, pero de modo que la secuencia de activación reentrante se mantiene, al menos parcialmente (Figura 16, Figura 17). Se suele decir que el circuito es encarrilado, pero también se puede concebir este fenómeno como que los frentes de activación estimulados se encarrilan en la estructura anatomofuncional del circuito, en lugar de propagarse radialmente desde el punto de estimulación. La coexistencia de un frente de activación TAMR y otro estimulado en cada ciclo se conoce como fusión constante, un fenómeno sólo posible en una TAMR (Figura 17). La fusión puede no detectarse fácilmente cuando la estimulación se hace en una zona estrecha del circuito, como por ejemplo el ICT en el AA típico, y se habla entonces de encarrilamiento oculto (sin fusión) (Figura 16).
Al interrumpir la estimulación de una TAMR, si esta no desestabiliza o interrumpe el circuito, se vuelve a la LC y secuencia de activación basales y la medida de este primer ciclo de retorno tras la estimulación nos permite determinar si el punto estimulado está dentro del circuito (LC retorno=LC basal) (Figura 16) o a distancia del mismo (LC retorno>LC basal) (Figura 17). Esta maniobra es clave para localizar los istmos críticos del circuito y dirigir las aplicaciones de radiofrecuencia durante la ablación.
Tratamiento farmacológico y ablaciónTaquicardia auricular focalLa TAF puede darse en ausencia de cardiopatía demostrable por exploraciones no invasivas e invasivas y no es infrecuente en personas jóvenes o niños, pero también se observa en contextos patológicos como miocardiopatías, cardiopatías congénitas intervenidas quirúrgicamente o en edades avanzadas, en el contexto del síndrome de bradicardia-taquicardia. El sustrato anatomopatológico está muy poco estudiado, y en los pocos casos provenientes de series quirúrgicas o autopsias, se han descrito desde estructuras similares a un nódulo sinusal hasta focos de inflamación, fibrosis o perimiocarditis, mientras en otros casos no se encontraron anormalidades significativas34, 35, 36. Recientemente se ha prestado mucha atención al sustrato anatómico de las descargas focales de las venas pulmonares en el contexto de la fibrilación auricular, y se ha atribuido a las fibras miocárdicas semiaisladas por tejido fibroso en los manguitos venosos el origen de la descarga focal37, 38, 39. Sin embargo, aunque se haya descrito hace tiempo el origen de algunas TAF en las venas pulmonares, el contexto clínico es distinto y podría tratarse de sustratos diferentes. Estudios detallados de la propagación de la activación en la TAF han demostrado largos trayectos desde al foco hasta el punto de inicio de la activación radial del miocardio auricular40, a lo largo de los cuales alguna estructura aísla eléctricamente el estímulo, lo que podría indicar que los focos de taquicardia pueden originarse en zonas del miocardio auricular relativamente aisladas por fibrosis, inflamación o alguna anomalía estructural.
La TAF frecuentemente se manifiesta como crisis paroxísticas de taquicardia en un corazón normal y en estos casos puede tratarse empíricamente con bloqueadores beta, antagonistas del calcio (diltiazem, verapamilo) o fármacos antiarrítmicos (amiodarona, flecainida, propafenona, sotalol), pero la posibilidad de una curación hace muy atractiva la ablación con catéter tras un estudio electrofisiológico. En niños muy pequeños, por debajo de los 3-4 años merece la pena intentar un control farmacológico porque la TAF puede desaparecer con el tiempo41. Es importante valorar las TAF que ocurren en el contexto de una miocardiopatía dilatada, porque la miocardiopatía puede deberse a la misma TAF (taquimiocardiopatía) y podría recuperarse la función cardiaca normal tras la ablación42. En pacientes con cardiopatías complejas intervenidas quirúrgicamente, puede ser necesario intervenir sobre varios mecanismos de taquicardia en uno o varios procedimientos. En 2009 se registró en España un total de 8.546 procedimientos de ablación, de los que 283 tenían como objetivo una TAF43.
La ablación con catéter de la TAF se realiza por la aplicación de radiofrecuencia en el punto de máxima precocidad de activación endocárdica. Cuando el foco está cercano al endocardio, se puede conseguir la ablación con electrodos sólidos de 4 mm, pero si el foco es epicárdico, puede ser necesario utilizar electrodos irrigados para mayor penetración de la lesión. Algunos casos pueden necesitar ablación epicárdica, ya sea quirúrgica o por punción pericárdica. Antes de aplicar radiofrecuencia, se debe hacer estimulación de alta intensidad (10-20 mA) con el catéter de ablación para asegurarse de que no está próximo el nervio frénico y evitar lesionarlo.
La inducción de las TAF puede ser difícil, y en ocasiones la misma presión del catéter puede interrumpirla, haciendo imposible la aplicación de radiofrecuencia durante la taquicardia. En estos casos la cartografía computarizada con navegador puede delimitar la localización del foco y guiar las aplicaciones de radiofrecuencia. La difícil inducibilidad también hace incierto el éxito de la ablación en algunos casos y puede ser causa de recurrencias tras la ablación43. La necesidad de un acceso transeptal para la ablación de TAF originada en la AI puede ser una limitación en algunos laboratorios43.
Aleteo típicoEl AA típico tiene una clara preferencia por el sexo masculino (80%) y puede tener una presentación paroxística o persistente. Las manifestaciones clínicas dependen mucho de la conducción AV, que tiende a ser 2:1 en la mayor parte de los casos, con frecuencia ventricular regular en torno a 140-150 lpm, generalmente mal tolerada por palpitaciones, mareo, disnea o dolor precordial. Algunos pacientes no sufren síntoma alguno hasta que la alta frecuencia sostenida causa disfunción sistólica ventricular (taquimiocardiopatía), con caída en insuficiencia cardiaca franca. El control de la frecuencia ventricular puede ser muy difícil en el AA típico, y controlar el cuadro clínico puede requerir una cardioversión eléctrica.
El AA típico tiene una historia natural frecuentemente entrelazada con la fibrilación auricular. En un seguimiento de 8-10 años, más del 50% de los pacientes con AA sufren algún episodio de fibrilación44 y, por otro lado, es muy frecuente que los pacientes tratados con fármacos antiarrítmicos por fibrilación auricular sufran episodios de AA45. En pacientes con episodios tanto de AA como de fibrilación, el riesgo de embolia es igual que en los que tienen sólo fibrilación, mientras que los que padecen sólo AA tienen un riesgo menor44, 46. A pesar de esto, se recomienda la anticoagulación crónica del AA con los mismos criterios que la fibrilación auricular47.
Los fármacos antiarrítmicos de clase I (procainamida, flecainida, propafenona) son poco efectivos para el tratamiento del AA típico48, 49, y además pueden ser arritmogénicos al lentificar la frecuencia del AA, facilitando la conducción AV 1:1 a frecuencias ≥ 200 lpm con un ensanchamiento del QRS que semeja una taquicardia ventricular45, 50. Son muy efectivos para el tratamiento del AA los antiarrítmicos bloqueadores de canales de K+ como la ibutilida48, 49 (no disponible en España), capaces de cardiovertir a ritmo sinusal el 80% de los casos tras administración intravenosa, pero es necesario monitorizar la arritmogenia secundaria a prolongación del intervalo QT y posible inducción de taquicardia ventricular polimorfa (torsades de pointes). La cardioversión eléctrica es muy eficaz51 y puede llevarse a cabo por choque de corriente continua o por estimulación auricular con un electrodo temporal o un marcapasos implantado52.
Por su eficacia y las escasas complicaciones, la ablación con catéter del ICT se considera el tratamiento de elección del AA típico, especialmente si es recurrente53. En España, en 2009 se registraron 1.859 procedimientos de ablación del ICT, con un 95% de éxito43. La ablación del ICT consiste en la creación de una línea de necrosis a través del ICT desde el anillo tricúspide a la cava inferior (Figura 7)54. Es importante que el resultado de la ablación sea el bloqueo completo, bidireccional del ICT, demostrado por técnicas de estimulación y registro a ambos lados del ICT, porque esto previene la recidiva del AA en un 95% de los casos, mientras que la mera inducción de retrasos de conducción prolongados o bloqueo unidireccional se sigue de recidivas de un 30-50%55, 56. Las complicaciones del procedimiento son escasas53, 54, 55, 56, 57, 58, 59.
Cuando el patrón ECG es característico y no hay antecedentes de cirugía cardiaca, se acepta hacer ablación del ICT sin otra demostración del mecanismo del AA. En casos en que la morfología no es tan clara o la enfermedad asociada hacen posible la presencia de circuitos atípicos de TAMR, asociados o no al AA típico, resulta necesario el estudio electrofisiológico de la taquicardia clínica, ya sea espontánea o inducida durante el estudio por medio de estimulación basal o durante infusión de isoproterenol. Con un solo catéter-electrodo multipolar introducido desde la cava inferior, se puede demostrar la secuencia circular de activación de la AD y el catéter deflectable utilizado para la aplicación de radiofrecuencia registrará la activación en el ICT haciendo «puente» entre la activación de la AD anterior y AD septal bajas, sea cual sea la dirección de giro (Figura 16). Aunque la cartografía así obtenida sea muy expresiva, se recomienda demostrar la participación del ICT por medio de la estimulación del ICT, comprobando que el ciclo local tras estimulación es ≤ 20 ms más largo que el basal del AA. Durante el encarrilamiento del ICT se puede comprobar el mantenimiento de la activación circular en la mayor parte de la AD, lo que demuestra que los estímulos se están encarrilando en el circuito (Figura 16).
El seguimiento a largo plazo tras la ablación muestra una incidencia del 30-40% de fibrilación auricular, más frecuente en los casos con episodios documentados previamente57, 58, 59. Esto indica que el AA y la fibrilación comparten factores patogénicos en común y que la interrupción del ICT puede no prevenir la evolución del remodelado auricular común a ambas arritmias, que es detectable en forma de retrasos de conducción14, 60. Es evidente que el ICT no es la causa del AA típico, sino un accesorio imprescindible del circuito de TAMR que lo hace vulnerable a la ablación con catéter, de modo que la ablación no modifica las anomalías electrofisiológicas y anatómicas que han llevado a la aparición del AA y que, de progresar, podrían llevar a la fibrilación. Estas consideraciones nos llevan a concluir que el tratamiento efectivo a largo plazo del AA típico, al igual que se propone para la fibrilación auricular, seguramente debería incluir medidas de prevención secundaria, dirigidas a los factores patogénicos tratables (hipertensión, bronconeumopatía, apnea de sueño), para mantener el ritmo sinusal estable a largo plazo. La investigación de métodos eficaces para esta prevención secundaria debería ser un proyecto prioritario de los próximos años.
Taquicardia macrorreentrante/aleteo atípicoEl Registro Español de Ablación con Catéter recogió en 2009 un total de 201 procedimientos de ablación de «taquicardia auricular macrorreentrante/aleteo auricular atípico»43. Estas taquicardias son más complejas de estudiar, la incidencia de complicaciones es mayor y los resultados de la ablación resultan menos claros que en la TAF o el AA típico. Las separaremos para su estudio según su localización anatómica en la AD o la AI.
Taquicardia macrorreentrante auricular derechaEn la AD pueden producirse TAMR no dependientes del ICT, especialmente en pacientes con antecedentes de atriotomía quirúrgica, ya sea por enfermedades congénitas (comunicación interauricular o interventricular, cirugía de Fontan, Mustard o Senning) o adquiridas (mixoma, valvulopatía de tricúspide). Los circuitos de TAMR se forman aquí en torno a las barreras constituidas por las cicatrices quirúrgicas y generalmente se localizan en la pared lateral o posterolateral de la AD con un punto de giro casi siempre localizado entre el borde inferior de la cicatriz y la vena cava inferior, que constituye el istmo crítico del circuito y el objetivo de la ablación del circuito (Figura 7)61. Las TAMR posquirúrgicas de la AD se asocian casi constantemente con el AA típico, de modo que el tratamiento definitivo debe incluir la ablación del istmo entre la cicatriz y la cava inferior de la cara lateral y la del ICT. En las TAMR basadas en zonas inexcitables de bajo voltaje en la AD, sin antecedentes quirúrgicos, se puede interrumpir el circuito por medio de la ablación de un istmo crítico, pero la experiencia publicada es escasa y el resultado a largo plazo es incierto18, 19.
En pacientes sometidos a cirugía de Fontan puede haber circuitos de TAMR sencillos en torno a suturas, pero cuando la AD está muy dilatada pueden formarse múltiples áreas inexcitables, de bajo voltaje, con potencial para sostener circuitos varios, y el tratamiento de ablación no siempre tiene éxito completo21, 22, 23. También pueden asociarse en estos casos taquicardias focales. La recidiva de nuevas taquicardias en estos pacientes es muy frecuente a largo plazo.
Taquicardia macrorreentrante auricular izquierdaEstudio electrofisiológico y ablación de TAMR de la AI implican los riesgos de un abordaje transeptal y de posibles embolias sistémicas durante la manipulación de los catéteres en la AI43. Es recomendable descartar la presencia de trombos por medio de un ecocardiograma transesofágico antes del procedimiento. Es un procedimiento complejo que requiere un sistema minucioso y una cuidadosa elaboración e interpretación de los mapas de activación obtenidos. El movimiento de catéteres o la estimulación pueden interrumpir el circuito o alterarlo, lo que a veces hace imposible definirlo. En muchos casos, a pesar de todo, se consigue interrumpir la taquicardia, pero no es infrecuente que luego se induzca otra TAMR o una TAF (Figura 12). El pronóstico a largo plazo de la ablación de TM de la AI no es bien conocido y se ha descrito alta incidencia de fibrilación auricular en el seguimiento a medio plazo17, 26, 27. Dados los riesgos y el dudoso pronóstico a largo plazo, las indicaciones de estudio electrofisiológico y ablación de TAMR de AI deben hacerse en pacientes sin respuesta a tratamiento médico y con mala tolerancia de la taquicardia, en los que el balance riesgo-beneficio puede ser favorable.
Estrategias de control de frecuenciaLa estrategia de control de frecuencia ventricular es una alternativa válida en muchos pacientes con suficiente tolerancia de la taquicardia. La digoxina, los bloqueadores beta y los antagonistas del calcio, solos o en combinación, pueden permitir controlar la frecuencia ventricular en límites aceptables desde una valoración clínica. En casos en que no se controla satisfactoriamente la frecuencia, puede estar indicada la ablación del nodo AV con implante de un marcapasos con respuesta de frecuencia de estimulación al ejercicio.
Taquicardia auricular multifocalLa taquicardia multifocal es una arritmia poco frecuente, caracterizada por ondas P de morfología cambiante a intervalos irregulares con frecuencia > 100 lpm. El ritmo ventricular también se hace irregular y a primera vista semeja una fibrilación auricular, pero una mirada atenta permite observar las ondas P separadas por intervalos de línea de base isoeléctrica (Figura 18).
Figura 18. Taquicardia auricular multifocal en un paciente con hipomagnesemia e hipopotasemia secundarias a fístula entérica postoperatoria. El ritmo es completamente irregular y se observan ondas P bien definidas, aunque de morfologías cambiantes, algunas no conducidas por su precocidad.
La taquicardia multifocal aparece en pacientes con alteraciones importantes de la homeostasis, como insuficiencia respiratoria con hipoxemia o graves alteraciones electrolíticas (hipopotasemia, hipomagnesemia) y también con la administración de inhibidores de la fosfodiesterasa o catecolaminas, y se atribuye a automatismo anormal por pospotenciales62. En los primeros meses o años de la vida, se puede presentar con un cuadro de taquimiocardiopatía e insuficiencia cardiaca debidos a frecuencias muy altas, pero puede desaparecer en el seguimiento a medio plazo63. La clave del tratamiento está en la corrección de la hipoxemia y las alteraciones electrolíticas, incluyendo administración intravenosa de sulfato magnésico64. Cuando la hipotensión o la insuficiencia respiratoria no los contraindican, la taquicardia multifocal puede responder a la administración de bloqueadores beta o verapamilo.
Conflicto de interesesEl Dr. García Cosío ha recibido becas de financiación para docencia de Medtronic, y apoyo tecnológico de St. Jude Medical y financiación para asistencia congresos de St. Jude Medical, Medtronic y Sanofi, y ejerce labores de consultoría para Bayer y Biotronik.
Recibido 17 Noviembre 2011
Aceptado 19 Noviembre 2011
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario de Getafe, Ctra. de Toledo Km 12,5, 28905 Getafe, Madrid, España. fgarciacosio.hugf@salud.madrid.org