Evaluar el efecto del déficit de hierro y la anemia en la capacidad de esfuerzo submáxima de pacientes con insuficiencia cardiaca crónica.
MétodosSe llevó a cabo un estudio transversal unicéntrico en un grupo de pacientes estables con insuficiencia cardiaca crónica. En el momento de incluirlos en el estudio, los pacientes aportaron información basal y realizaron una prueba de marcha de 6 minutos para evaluar la capacidad de ejercicio submáxima y los síntomas desencadenados por el esfuerzo. Al mismo tiempo, se obtuvieron muestras de sangre para la evaluación serológica. El déficit de hierro se definió como un valor de ferritina < 100 ng/ml o una saturación de transferrina < 20% cuando la ferritina era < 800 ng/ml. Se efectuaron también determinaciones de otros marcadores del estado del hierro.
ResultadosSe consideró aptos para la inclusión en el estudio a 538 pacientes con insuficiencia cardiaca. La media de edad era 71 años y el 33% se encontraba en las clases III/IV de la New York Heart Association. La distancia media recorrida en la prueba de marcha de 6 minutos por los pacientes con alteración del estado del hierro fue 285±101 m, en comparación con los 322±113 m del otro grupo (p=0,002). Los síntomas durante la prueba fueron más frecuentes en los pacientes con déficit de hierro (el 35 frente al 27%; p=0,028) y el síntoma registrado con más frecuencia fue la fatiga. Los análisis de regresión logística multivariables mostraron que el aumento de la concentración de receptor de transferrina soluble, que indica un estado anormal del hierro, se asociaba de manera independiente con una clase avanzada de la New York Heart Association (p < 0,05). En el análisis multivariable realizado empleando modelos aditivos generalizados, el receptor de transferrina soluble y el índice de ferritina, biomarcadores que miden el estado del hierro, mostraron una asociación lineal, significativa e independiente con la capacidad de ejercicio submáxima (p=0,03 en ambos casos). En cambio, en el análisis multivariable los valores de hemoglobina no mostraron una asociación significativa con la distancia recorrida en la prueba de marcha de 6 minutos.
ConclusionesEn los pacientes con insuficiencia cardiaca crónica, el déficit de hierro, pero no así la anemia, se asoció con deterioro de la capacidad de ejercicio submáxima y limitación funcional sintomática.
Palabras clave
A pesar de la introducción de nuevos tratamientos y los avances recientes en el tratamiento de la insuficiencia cardiaca crónica (ICC), la limitación funcional y los síntomas limitantes son frecuentes en los pacientes que reciben un tratamiento óptimo. La disnea y la fatiga son los principales síntomas que motivan el deterioro de la capacidad de ejercicio1. Estos factores fomentan la incapacidad de llevar a cabo las actividades diarias e influyen en el estado de salud percibido por los propios pacientes. En consecuencia, el deterioro de la calidad de vida relacionada con la salud (CdVRS) y la aparición de síntomas como disnea o fatiga que conducen a una clase funcional de la New York Heart Association (NYHA) avanzada han pasado a ser importantes resultados centrados en el paciente que es preciso abordar2.
La evaluación objetiva del estado funcional se ha realizado con frecuencia determinando la capacidad de ejercicio máxima mediante prueba de esfuerzo con determinación de intercambio cardiopulmonar de gases3. Sin embargo, también se puede estimar las limitaciones funcionales en la realización de las actividades diarias que la ICC conlleva al estudiar la capacidad de ejercicio submáxima. Como alternativa a la prueba de esfuerzo con determinación del intercambio de gases cardiopulmonar, la prueba de marcha de 6 minutos (PM6M) o prueba del pasillo es un método sencillo para medir de manera objetiva la capacidad funcional submáxima y obtener, por lo tanto, una perspectiva más realista respecto a la capacidad de los pacientes para realizar las actividades diarias4,5.
Los mecanismos subyacentes al deterioro de la capacidad de ejercicio en la ICC son numerosos y no conocidos por completo. Esto puede explicar por qué las opciones terapéuticas con efecto favorable en el pronóstico, como los bloqueadores beta, no han mostrado un efecto beneficioso en términos de capacidad funcional6. La evidencia reciente indica que el déficit de hierro (DH) es una comorbilidad frecuente7 que puede asociarse con deterioro de la capacidad de ejercicio máxima8, peor CdVRS9,10 y unos resultados menos favorables11 en los pacientes con ICC, independientemente de que haya anemia. Además, varios ensayos han mostrado que la administración intravenosa de hierro puede mejorar la capacidad funcional y reducir los síntomas de los pacientes con ICC y DH12,13. Los datos de estos estudios indican que el estado del hierro puede desempeñar un papel en la capacidad de ejercicio submáxima. Sin embargo, estos estudios se centraron solamente en pacientes con DH seleccionados, por lo que tenían poca potencia para evaluar la influencia del estado del hierro y/o la presencia de anemia en la capacidad de ejercicio submáxima y la aparición de síntomas en un espectro de pacientes más amplio. Así pues, el objetivo de este estudio es investigar las repercusiones del estado del hierro en la capacidad de ejercicio submáxima estimada con la distancia recorrida en la PM6M. También se exploró la influencia del estado del hierro en la clase funcional de la NYHA y en la presencia de síntomas en una cohorte de pacientes con ICC visitados en la práctica clínica diaria14.
MÉTODOSPoblación en estudio e inscripciónPara los fines de este estudio, se analizaron la asociación de la capacidad de ejercicio submáxima con el estado del hierro/anemia en una cohorte de pacientes euvolémicos estables con ICC. La metodología de este estudio se ha publicado ya con anterioridad9. El estudio se llevó a cabo según lo establecido en la Declaración de Helsinki, el protocolo del estudio fue aprobado por el comité ético de investigación clínica local y todos los pacientes dieron su consentimiento informado por escrito después de la inscripción. Para la inclusión en el estudio, los pacientes debían estar en situación estable y haber sido diagnosticados de ICC con fracción de eyección del ventrículo izquierdo (FEVI) reducida o conservada (≥ 45%), según los criterios diagnósticos de la Sociedad Europea de Cardiología15. Los criterios de exclusión del estudio fueron: incapacidad para realizar la PM6M, valvulopatía primaria significativa, concentración de hemoglobina < 8,5g/dl, signos clínicos de sobrecarga de líquidos, enfermedad pericárdica, miocardiopatía restrictiva, miocardiopatía hipertrófica, enfermedad maligna activa y hepatopatía crónica. Se excluyó también a los pacientes sin evaluación del estado del hierro o una PM6M disponibles en el examen de selección inicial. Con la aplicación de estos criterios, 538 pacientes formaron la cohorte final. En el momento de la inscripción, se extrajo a todos los pacientes una muestra de sangre periférica y se obtuvo la información clínica y demográfica relevante, incluida la clase funcional de la NYHA, el tratamiento médico en curso y la determinación más reciente de la FEVI.
Se mantuvo los datos del estado del DH y la anemia de los pacientes enmascarados al personal médico y de enfermería que participaba en la inscripción y en la obtención de datos.
Estado del hierro y otras determinaciones analíticasEl DH se definió mediante los criterios de la guía de la Kidney Disease Outcomes Quality Initiative: ferritina < 100 ng/ml o saturación de transferrina (TSAT) < 20% cuando la ferritina es < 800 ng/ml16. Se determinó el hierro sérico por espectrofotometría; la ferritina y la transferrina en suero se determinaron mediante inmunoturbidimetría. La TSAT se estimó empleando la fórmula: TSAT hierro sérico (μg/dl)/[transferrina sérica (mg/dl)×1,25]17. Las evaluaciones adicionales del estado del hierro utilizadas fueron: ancho de distribución eritrocitaria18, en la que los valores > 15% indican anisocitosis por DH, receptor de transferrina soluble en suero (sTfR) (determinado por enzimoinmunoanálisis)19 e índice de ferritina. Se ha propuesto que el índice de ferritina puede ser un instrumento útil en el diagnóstico de los estados de DH, de tal manera que un cociente > 2 indica DH. El índice de ferritina se calcula dividiendo el valor de sTfR (expresado en nmol/l o mg/l) por el log10 ferritina (ng/ml) y, por tanto, aumenta si aumenta el sTfR o se reduce la ferritina20. La anemia se definió como hemoglobina < 12g/dl en las mujeres y < 13g/dl en los varones21. La hemoglobina se determinó por colorimetría láser de impedancia. En el momento de la inclusión, ninguno de los pacientes recibía transfusiones de sangre, tratamiento con eritropoyetina o administración de hierro por vía intravenosa.
Capacidad de ejercicio submáximaLa capacidad de ejercicio submáxima se evaluó con la PM6M. Cada paciente realizó una única PM6M utilizando un protocolo estandarizado, según lo descrito en estudios y guías previos22. Llevó a cabo la prueba una enfermera especialmente preparada, que debía pedir al paciente que recorriera caminando la distancia más larga posible en un plazo de 6min a lo largo de un pasillo de 24 m. El paciente podía detener o ralentizar la marcha en cualquier momento y reanudarla luego en función del grado de fatiga. La prueba de esfuerzo se interrumpía a petición del paciente. Se registró la distancia total recorrida en 6min, la interrupción prematura de la prueba y la presencia de síntomas durante esta. Síntomas como disnea, fatiga, angina y claudicación intermitente, así como síntomas de bajo gasto (definidos como desvanecimiento, debilidad y reducción de la presión arterial), se evaluaron mediante un cuestionario y se presentaron al final de la prueba. Si se registraban varios síntomas, se elegía el más limitante. Para clasificar a los pacientes en dos categorías de capacidad de ejercicio (deteriorada o conservada), se optó por utilizar un valor umbral de 300 m. Anteriormente se ha descrito que este umbral es un factor predictor de mortalidad y morbilidad en la ICC con disfunción ventricular izquierda23.
Análisis estadísticosLos datos demográficos y otros basales se resumieron mediante estadística descriptiva básica en los grupos definidos según el estado del hierro. Para las variables cuantitativas, se calculó la media aritmética±desviación estándar o la mediana [intervalo intercuartílico], según procediera, y se obtuvieron los valores de p mediante una prueba de la t de Student para dos muestras (se utilizó la prueba de la U de Mann-Whitney para los datos asimétricos). Para las variables cualitativas, se calcularon los porcentajes dentro de los grupos especificados, y se obtuvieron los valores de p mediante la prueba de la χ2.
El análisis preliminar de la capacidad funcional en los grupos con deterioro y sin deterioro del estado del hierro se llevó a cabo usando los métodos descriptivos antes indicados.
Las asociaciones existentes entre la capacidad de ejercicio submáxima (conservada, ≥ 300 m; deteriorada, < 300 m) en la PM6M y las características basales se evaluaron con un análisis de regresión logística sin ajustar (univariable).
Para explicar las interacciones entre el estado del hierro y la anemia en cuanto a la capacidad de ejercicio submáxima, se elaboraron varios modelos. Dichos modelos se ajustaron respecto a las covariables que mostraban una asociación estadística significativa con la capacidad funcional en los análisis univariables, como edad, sexo, FEVI, frecuencia cardiaca, estado del hierro, hemoglobina, hipertensión, diabetes mellitus, enfermedad renal crónica, uso de inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II, concentraciones de prohormona N-terminal del péptido natriurético cerebral (NT-proBNP) y proteína C reactiva. La clase funcional de la NYHA está relacionada de manera directa e intensa con la intolerancia al ejercicio en los pacientes con ICC y puede concebirse como una medida alternativa de la capacidad de ejercicio submáxima8. Así pues, se optó prospectivamente por excluir la NYHA de los modelos en que la distancia recorrida en la PM6M era la variable dependiente.
Se utilizaron modelos aditivos generalizados para analizar la regresión de la anemia y los biomarcadores del DH respecto a la distancia recorrida en la PM6M. Los modelos aditivos generalizados son un enfoque más flexible para la modelización, que tiene en cuenta la no linealidad de la relación, proporcionan una exploración más exacta de las variables continuas y proporcionan un patrón que refleja la forma y la tendencia de la asociación. En todos ellos se determinó el valor de p para el efecto no paramétrico (prueba de no linealidad) y el valor de p para la asociación. Se introdujo en los modelos un ajuste respecto a las covariables antes mencionadas.
Se elaboró un modelo de regresión logística (ajustado respecto a las covariables antes mencionadas, incluida la hemoglobina) para explorar la interacción del estado del hierro y la clase funcional de la NYHA.
Todas las pruebas estadísticas y los intervalos de confianza se elaboraron con un nivel de error de tipo I (alfa) del 5% sin introducir ajustes respecto a la multiplicidad, y se consideraron estadísticamente significativos los valores de p ≤ 0,05. Los análisis se realizaron con el programa R 2.15.1.
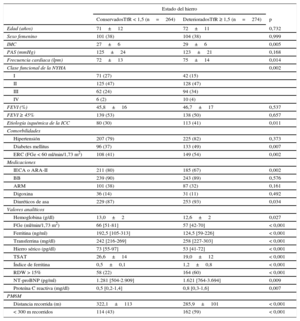
RESULTADOSSe incluyó a un total de 538 pacientes con ICC estable que participaron en el estudio. En la tabla 1 se muestran las características clínicas basales de la cohorte completa según el estado del hierro. Hasta un 45% de los pacientes presentaban anemia. Se identificó DH en 329 (61%) pacientes de la cohorte total. La clase funcional avanzada (III o IV) de la NYHA fue más frecuente en los pacientes con DH y anemia. La distancia media recorrida por la cohorte total fue 304±109 m (FEVI conservada frente a reducida, 288±103 frente a 319±112 m; p=0,001). El porcentaje de pacientes con deterioro de la capacidad de ejercicio submáxima (distancia recorrida en la PM6M < 300 m) fue mayor entre los que tenían un estado anormal del hierro (tabla 1). Completaron la prueba 505 pacientes (94%) y 125 (23%) se detuvieron durante ella y luego continuaron caminando.
Características basales según el estado del hierro
| Estado del hierro | |||
|---|---|---|---|
| ConservadosTfR < 1,5 (n=264) | DeterioradosTfR ≥ 1,5 (n=274) | p | |
| Edad (años) | 71±12 | 72±11 | 0,732 |
| Sexo femenino | 101 (38) | 104 (38) | 0,999 |
| IMC | 27±6 | 29±6 | 0,005 |
| PAS (mmHg) | 125±24 | 123±21 | 0,168 |
| Frecuencia cardiaca (lpm) | 72±13 | 75±14 | 0,014 |
| Clase funcional de la NYHA | 0,002 | ||
| I | 71 (27) | 42 (15) | |
| II | 125 (47) | 128 (47) | |
| III | 62 (24) | 94 (34) | |
| IV | 6 (2) | 10 (4) | |
| FEVI (%) | 45,8±16 | 46,7±17 | 0,537 |
| FEVI ≥ 45% | 139 (53) | 138 (50) | 0,657 |
| Etiología isquémica de la ICC | 80 (30) | 113 (41) | 0,011 |
| Comorbilidades | |||
| Hipertensión | 207 (79) | 225 (82) | 0,373 |
| Diabetes mellitus | 96 (37) | 133 (49) | 0,007 |
| ERC (FGe < 60 ml/min/1,73 m2) | 108 (41) | 149 (54) | 0,002 |
| Medicaciones | |||
| IECA o ARA-II | 211 (80) | 185 (67) | 0,002 |
| BB | 239 (90) | 243 (89) | 0,576 |
| ARM | 101 (38) | 87 (32) | 0,161 |
| Digoxina | 36 (14) | 31 (11) | 0,492 |
| Diuréticos de asa | 229 (87) | 253 (93) | 0,034 |
| Valores analíticos | |||
| Hemoglobina (g/dl) | 13,0±2 | 12,6±2 | 0,027 |
| FGe (ml/min/1,73 m2) | 66 [51-81] | 57 [42-70] | < 0,001 |
| Ferritina (ng/ml) | 192,5 [105-313] | 124,5 [59-226] | < 0,001 |
| Transferrina (mg/dl) | 242 [216-269] | 258 [227-303] | < 0,001 |
| Hierro sérico (pg/dl) | 73 [55-97] | 53 [41-72] | < 0,001 |
| TSAT | 26,6±14 | 19,0±12 | < 0,001 |
| Índice de ferritina | 0,5±0,1 | 1,2±0,8 | < 0,001 |
| RDW > 15% | 58 (22) | 164 (60) | < 0,001 |
| NT-proBNP (pg/ml) | 1.281 [504-2.909] | 1.621 [764-3.694] | 0,009 |
| Proteína C reactiva (mg/dl) | 0,5 [0,2-1,4] | 0,8 [0,3-1,6] | 0,007 |
| PM6M | |||
| Distancia recorrida (m) | 322,1±113 | 285,9±101 | < 0,001 |
| < 300 m recorridos | 114 (43) | 162 (59) | < 0,001 |
PM6M: prueba de marcha de 6 min; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcorticoides; BB: bloqueadores beta; ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; ICC: insuficiencia cardiaca crónica; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fragmento aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAS: presión arterial sistólica; RDW: ancho de distribución eritrocitaria; sTfR: receptor de transferrina soluble en suero; TSAT: saturación de transferrina.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Los valores de filtrado glomerular estimado, ferritina, transferrina, hierro sérico, fragmento aminoterminal del propéptido natriurético cerebral y proteína C reactiva se compararon con la prueba de Mann-Whitney.
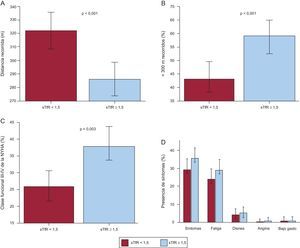
Los pacientes con deterioro del estado del hierro presentaron peor capacidad de ejercicio submáxima en el análisis realizado sin ajustar (figura 1A). La distancia media recorrida 6min fue 285±101 m en el grupo de DH, frente a los 322±113 m de los pacientes con un estado del hierro normal (p<0,005). Además, el porcentaje de individuos con deterioro de la capacidad de ejercicio fue superior en el grupo con estado anormal del hierro (el 59 frente al 43%; p<0,001) (figura 1B) y la clase funcional de la NYHA avanzada tuvo una prevalencia superior en el grupo de DH (el 26 frente al 36%; p<0,05) (figura 1C). La alteración del estado del hierro mostró asociación significativa con la presencia de síntomas durante la PM6M. Los síntomas fueron más frecuentes en los pacientes con anormalidad del hierro que en los pacientes sin DH (el 35 frente al 27%; p<0,05) (figura 1D). El síntoma aparecido con más frecuencia fue la fatiga, que mostró una asociación significativa con el estado del hierro. No se observaron diferencias significativas en los demás síntomas, incluida la disnea.
Asociación entre la capacidad de ejercicio submáxima, la clase funcional de la New York Heart Association y los síntomas según el estado del hierro. A: distancia recorrida en la prueba de marcha de 6 minutos. B: porcentaje de pacientes con deterioro de la capacidad de ejercicio submáxima. C: porcentaje de pacientes en clase funcional avanzada (III-IV) de la New York Heart Association. D: síntomas referidos por los pacientes durante la prueba de marcha de 6 minutos. NYHA: New York Heart Association; sTfR: receptor de transferrina soluble en suero.
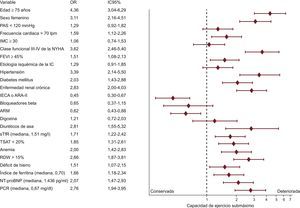
Con objeto de explorar la asociación entre la capacidad de ejercicio submáxima y las características basales, se llevó a cabo un análisis de regresión logística binario univariable (figura 2). Se identificaron varios factores asociados con peor capacidad de ejercicio submáxima, como edad avanzada, sexo femenino y comorbilidades como hipertensión, diabetes mellitus y enfermedad renal crónica. La anemia y el DH, al igual que el sTfR alto, la TSAT baja, el índice de ferritina alto y el ancho de distribución eritrocitaria > 15%, también tenían asociación con el deterioro de la capacidad de ejercicio en el análisis sin ajustar.
Factores clínicos asociados al deterioro de la capacidad de ejercicio submáxima definida como una distancia recorrida en la prueba de marcha de 6 minutos< 300 m (análisis de regresión logística univariable). ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas de receptores de mineralcorticoides; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; NT-proBNP: fragmento aminoterminal del propéptido natriurético cerebral; NYHA; New York Heart Association; PAS: presión arterial sistólica; PCR: proteína C reactiva; RDW: ancho de distribución eritrocitaria; sTfR: receptor de transferrina soluble en suero; TSAT: saturación de transferrina.
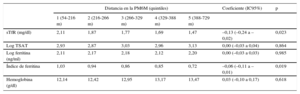
En los modelos aditivos generalizados multivariables, con un ajuste respecto a los factores significativos identificados en el análisis univariable, el estado anormal del hierro evaluado con el sTfR (p=0,023) y el índice de ferritina (p=0,019) mostró una asociación significativa con peor capacidad de ejercicio submáxima, mientras que no ocurrió así con la hemoglobina (p=0,61) (tabla 2). Es interesante señalar que, al analizar la influencia en la capacidad de ejercicio de los elementos que formaban parte de la definición del DH (TSAT y ferritina) por separado, ninguno de estos factores mostró una asociación significativa.
Valores estimados de diferentes biomarcadores del hierro y la hemoglobina distribuidos según la distancia recorrida en la prueba de marcha de 6 minutos por quintiles (análisis multivariables)
| Distancia en la PM6M (quintiles) | Coeficiente (IC95%) | p | |||||
|---|---|---|---|---|---|---|---|
| 1 (54-216 m) | 2 (216-266 m) | 3 (266-329 m) | 4 (329-388 m) | 5 (388-729 m) | |||
| sTfR (mg/dl) | 2,11 | 1,87 | 1,77 | 1,69 | 1,47 | –0,13 (–0,24 a –0,02) | 0,023 |
| Log TSAT | 2,93 | 2,87 | 3,03 | 2,96 | 3,13 | 0,00 (–0,03 a 0,04) | 0,864 |
| Log ferritina (ng/ml) | 2,11 | 2,17 | 2,18 | 2,12 | 2,20 | 0,00 (–0,03 a 0,03) | 0,985 |
| Índice de ferritina | 1,03 | 0,94 | 0,86 | 0,85 | 0,72 | –0,06 (–0,11 a –0,01) | 0,019 |
| Hemoglobina (g/dl) | 12,14 | 12,42 | 12,95 | 13,17 | 13,47 | 0,03 (–0,10 a 0,17) | 0,618 |
PM6M: prueba de marcha de 6 minutos; IC95%: intervalo de confianza del 95%; sTfR: receptor de transferrina soluble en suero; TSAT: saturación de transferrina.
En todos los modelos se introdujo un ajuste respecto a edad, sexo, frecuencia cardiaca, fracción de eyección del ventrículo izquierdo, hipertensión, diabetes mellitus, enfermedad renal crónica, tratamiento con inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II, logaritmo del fragmento aminoterminal del propéptido natriurético cerebral y logaritmo de proteína C reactiva.
En los biomarcadores del estado del hierro se ha introducido un ajuste respecto a la hemoglobina, mientras que en el quinto modelo (hemoglobina) se ha introducido un ajuste respecto al receptor de transferrina soluble en suero como medida del estado del hierro.
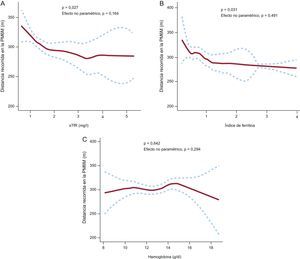
En ninguno de los modelos aditivos generalizados elaborados para explorar la asociación de los biomarcadores del DH (sTfR e índice de ferritina) con la hemoglobina, se identificó un componente no lineal en las relaciones con la distancia recorrida en la PM6M (para el efecto no paramétrico: p=0,16, p=0,49 y p=0,29 respectivamente), lo cual implica que no se puede asumir la no linealidad. Sin embargo, lo importante en estos modelos es la inspección visual de los gráficos. El patrón y la forma de la línea reflejan la tendencia de la asociación. Este modelo confirmó también la intensa asociación existente entre los biomarcadores del hierro y la capacidad de ejercicio submáxima (p=0,027 y p=0,031 respectivamente), mientras que la hemoglobina no mostró esta asociación (p=0,642). Según lo que se muestra en el modelo 1 y 2 (figura 3), una menor capacidad de ejercicio estaba relacionada con un valor más alto de los biomarcadores del DH (lo cual refleja mayor DH).
Análisis multivariable empleando modelos aditivos generalizados para evaluar la relación entre los biomarcadores del déficit de hierro (A y B), la hemoglobina (C) y la distancia recorrida en metros en la prueba de marcha de 6 minutos. PM6M: prueba de marcha de 6 minutos; sTfR: receptor de transferrina soluble en suero. Las curvas punteadas indican el intervalo de confianza del 95% para el riesgo homogeneizado.
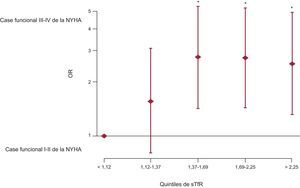
En otros modelos multivariables (figura 4), se estudió la influencia del sTfR dividido en quintiles como medida del estado del hierro por lo que respecta a la clase funcional avanzada de la insuficiencia cardiaca. En este análisis ajustado, un mayor agotamiento del hierro, que se reflejaba en un valor de sTfR superior, mostró asociación con una clase de la NYHA avanzada, y esta asociación era independiente de la anemia.
Modelo de regresión logística binario multivariable para evaluar la influencia del estado del hierro (estimado por los valores del receptor de transferrina soluble en suero) en la clase funcional avanzada (III o IV) de la New York Heart Association. NYHA: New York Heart Association; OR: odds ratio; sTfR: receptor de transferrina soluble en suero. *p < 0,05.
El principal hallazgo novedoso de este estudio descriptivo es que el deterioro de la capacidad de ejercicio submáxima de los pacientes con ICC se asocia con unos índices del metabolismo del hierro anormales, y esta observación es independiente del estado de la anemia y la hemoglobina. Anteriormente se ha descrito un deterioro de la capacidad de ejercicio en los pacientes con ICC y DH8, en estudios realizados mediante prueba de esfuerzo con intercambio de gases cardiopulmonar (y determinación del consumo máximo de oxígeno); sin embargo, en el presente estudio se evaluó un parámetro que mide la capacidad de ejercicio submáxima que está directamente relacionada con la capacidad del paciente para las actividades de la vida diaria y tiene implicaciones para la calidad de vida.
Además, se ha observado que los pacientes con DH refieren con más frecuencia síntomas durante el ejercicio submáximo y que el síntoma predominante es la fatiga. Por otra parte, el estado anormal del hierro se asoció a una clase funcional de la NYHA avanzada y esta asociación fue independiente de la presencia de anemia en el análisis multivariable.
Los pacientes con ICC, aunque reciban un tratamiento óptimo24, tienen limitaciones funcionales, especialmente como consecuencia de la intolerancia al ejercicio. Los síntomas cardinales de la ICC son la disnea y la fatiga, pero es poco lo que se sabe acerca del mecanismo exacto que da lugar a su presencia. A este respecto, se observó que la fatiga era el síntoma inducido por el ejercicio más común en estos pacientes, y que lo referían con más frecuencia los que presentaban un estado anormal del hierro.
Recientemente se ha señalado que el DH es una nueva comorbilidad primaria de los pacientes con ICC, y que tiene un efecto desfavorable por lo que respecta al pronóstico11, la CdVRS9,10 y la capacidad de ejercicio máxima8. Los datos del presente estudio aportan nueva evidencia sobre el papel principal del hierro en las medidas funcionales de la función de los pacientes con ICC. La evaluación del estado clínico de los pacientes con ICC puede realizarse fácilmente con la PM6M, que aporta también información sobre la capacidad para realizar las actividades de la vida diaria.
Estos resultados ponen de manifiesto una asociación lineal entre los biomarcadores del DH y la capacidad de ejercicio submáxima. Este tipo de asociación ya se había descrito entre el DH y la calidad de vida9. La intolerancia al ejercicio está directamente relacionada con la CdVRS en los pacientes con ICC25,26. La evidencia reciente pone de manifiesto que el DH es un factor determinante clave de la CdVRS en los pacientes con ICC9,10 y esta asociación está bien establecida con las puntuaciones globales y de la dimensión física, con independencia del estado anémico. Este estudio respalda esta asociación, por cuanto aporta la primera evidencia de que el DH predice de por sí la capacidad de ejercicio submáxima, lo cual refleja la incapacidad de llevar a cabo las actividades de la vida diaria. Así pues, se puede plantear la hipótesis de que el DH podría deteriorar la capacidad de ejercicio submáxima y fomentar la presencia de síntomas, afectando secundariamente a la capacidad para realizar las actividades de la vida diaria, que es uno de los principales factores determinantes de la CdVRS. Sin embargo, tendría interés diseñar nuevos estudios para confirmar que la influencia del DH en la capacidad de ejercicio submáxima es el elemento clave que relaciona el DH con el deterioro de la CdVRS.
La definición del DH en la ICC no está totalmente validada, por lo que se utilizó una estrategia de biomarcadores múltiples para caracterizar mejor el estado del hierro en los pacientes con ICC, según lo descrito en estudios previos9. Además, se utilizaron también otros parámetros como el sTfR y el índice de ferritina para evaluar el estado del hierro. Estos dos biomarcadores permiten obtener una descripción exacta del estado del hierro en los pacientes con trastornos inflamatorios crónicos, como la ICC. En el análisis ajustado, se observó que el deterioro de la capacidad de ejercicio submáxima, pero no la hemoglobina, mostraba una intensa correlación con el sTfR y el índice de ferritina (p<0,05 en ambos casos) (figura 3), lo cual indica que es el agotamiento de hierro, y no la anemia, el factor determinante clave de la capacidad de ejercicio submáxima. Es interesante señalar que, al analizar la influencia en la capacidad de ejercicio de los elementos que formaban parte de la definición del DH (TSAT y ferritina) por separado, ninguno de estos factores mostró una asociación significativa. Estos resultados confirman la importancia de utilizar simultáneamente diferentes parámetros para evaluar el efecto del DH en la ICC y parámetros más sofisticados del DH, como el sTfR, para reflejar el estado del hierro, dentro del espectro completo de gravedad de la pérdida de hierro.
Se ha demostrado que la determinación del sTfR es un buen marcador del DH; sin embargo, no se ha establecido claramente un valor de corte para los pacientes con ICC. A este respecto, al analizar la curva de la interacción entre el sTfR y la capacidad de ejercicio en metros (modelos aditivos generalizados), hubo una observación interesante, por cuanto el valor umbral de 300 m correspondía a un valor del sTfR de 1,6mg/l, que está próximo a algunos de los valores descritos anteriormente27 en pacientes con ICC avanzada (según la clase funcional de la NYHA) que presentan DH.
Una de las hipótesis para explicar este dato, descrita en publicaciones anteriores9,10, es que la anemia sea un simple indicador de mayor DH. El hierro desempeña un papel esencial en el transporte de oxígeno, el almacenamiento de oxígeno, las enzimas oxidativas y las proteínas de la cadena respiratoria que intervienen en el metabolismo energético de los músculos esquelético y cardiaco28. Los efectos del DH no se deben tan solo al papel del hierro en la eritropoyesis29. Para comprender el papel del hierro en la aparición de los síntomas y el deterioro funcional, es preciso considerar por separado el DH tisular y el déficit de transporte de oxígeno. La evidencia experimental disponible indica que el hierro mejora de por sí la función muscular y la capacidad de ejercicio de los animales30, y estos resultados resaltan el papel del hierro como cofactor en la función de los músculos esquelético y cardiaco. Algunos autores respaldan la hipótesis de que el DH puede subyacer a la disfunción mitocondrial29.
Además, a favor de esta hipótesis, la evidencia existente indica un efecto de los suplementos de hierro por vía intravenosa en pacientes con ICC y DH, anémicos y no anémicos, con un aumento de la distancia recorrida en la PM6M y mejoría de la capacidad funcional (clase funcional de la NYHA) y la calidad de vida global12,25. También hay nuevos datos obtenidos en un estudio de intervención en el que se evaluaron los efectos beneficiosos del tratamiento con hierro intravenoso en pacientes con DH13, y en el que se demostró una mejoría de la capacidad funcional, los síntomas y la CdVRS, lo cual respalda la hipótesis y los resultados del presente estudio. Sin embargo, no se han investigado todavía los efectos directos de los suplementos de hierro en los síntomas específicos de la ICC, como la fatiga o la disnea.
LimitacionesEste estudio tiene varias limitaciones que es preciso mencionar. En primer lugar, la distancia recorrida en la PM6M puede variar en función de la motivación del paciente y otros factores del individuo. Este estudio es de carácter transversal y, por lo tanto, el estado del hierro y la capacidad de ejercicio submáxima se determinaron en un único momento y no puede aportarse información acerca de los cambios a lo largo del tiempo, por lo que no es posible establecer una relación causal. Dado que el estudio se realizó en un solo centro, no está clara la aplicabilidad de sus resultados a otros países y orígenes étnicos. No se incluyó en el estudio a los pacientes que no podían realizar la PM6M; en consecuencia, se deberá evaluar con mayor detalle la asociación del DH y el deterioro funcional grave.
Es necesario un conocimiento más completo de la fisiopatología integrada que subyace a la compleja interacción entre respuesta al ejercicio y DH en los pacientes con ICC. Sin embargo, la contribución del DH a la generación de los síntomas en la ICC hace que el hierro sea un posible tratamiento de los pacientes, por lo que deberá realizarse una evaluación clínica mediante la PM6M, que podría ser útil para tomar la decisión de tratar a los pacientes con deterioro de la capacidad de ejercicio submáxima.
CONCLUSIONESLos pacientes con ICC y un estado anormal del hierro presentan deterioro de la capacidad de ejercicio submáxima con independencia de cuál sea el valor de la hemoglobina. Esto podría explicar la relación entre el deterioro de la CdVRS y el DH en los pacientes con ICC. Por consiguiente, la evaluación del estado del hierro en los pacientes con ICC puede completar la información relativa al estado clínico y puede ser útil para definir el plan terapéutico.
FINANCIACIÓNSe dispuso de ayuda para el análisis estadístico financiada por Vifor Pharma Ltd., Suiza.
CONFLICTO DE INTERESESJ. Comin-Colet formó parte de los comités directivos de los estudios FAIR-HF (Ferinject®Assessment in patients with Iron deficiency and chronic Heart Failure) y CONFIRM-HF (Ferric CarboxymaltOse evaluatioN on perFormance in patients with IRon deficiency in coMbination with chronic Heart Failure) y ha recibido honorarios por conferencias de Vifor Pharma Ltd.