Palabras clave
INTRODUCCIÓN
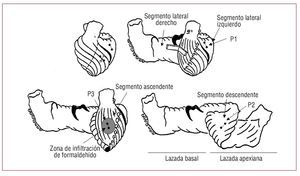
Según Torrent-Guasp y otros autores1-6, el miocardio ventricular está constituido por una banda muscular continua desde la raíz de la arteria pulmonar hasta la raíz de la aorta, que describe en el espacio un helicoide con dos espirales y delimita las dos cavidades ventriculares. Esta banda miocárdica estaría compuesta por la «lazada basal» y la «lazada apexiana». En la lazada basal predomina la horizontalidad y se divide en los segmentos derecho e izquierdo; en la lazada apexiana predomina la verticalidad y consta del segmento descendente y el segmento ascendente (fig. 1). La eyección se produciría por la contracción sucesiva de los segmentos basal derecho y basal izquierdo, lo que da lugar a un estrechamiento de la base del corazón, seguida por la contracción del segmento apexiano descendente, que a su vez produce acortamiento de las dimensiones longitudinales cardiacas aproximando la base al ápex. El llenado ventricular se iniciaría con la contracción del segmento apexiano ascendente, acompañado de un alargamiento longitudinal y seguido de la relajación de las paredes ventriculares. Durante el ciclo cardiaco el ápex permanece fijo, mientras que la base realiza un movimiento descendente, principal causa del acortamiento longitudinal y de la expulsión de la sangre, seguido de otro ascendente al que se atribuye la succión de la sangre procedente de la aurícula izquierda7-9.
Figura 1. Esquema en el que se muestran los segmentos de la banda miocárdica (Torrent-Guasp) y la posición de los pares de cristales implantados en el miocardio, representados como pequeños círculos unidos por una línea. En el primer esquema los cristales correspondientes al P2 subendocárdico (segmento descendente de la lazada apexiana) son círculos claros.
En la doctrina clásica, el llenado del ventrículo izquierdo se inicia con la relajación ventricular, un proceso activo consumidor de energía y que reduce la presión intraventricular a menos de la correspondiente a la aurícula izquierda. El cruce de presiones ocasiona la apertura de la válvula mitral y el inicio del llenado rápido precoz. Se considera que los factores determinantes de este mecanismo son la recuperación elástica, en la que intervienen distintos factores como la elastina contenida en colágeno de la matriz extracelular10, o la proteína titina, que da fuerza al sarcómero para su recuperación tras la deformación producida durante la sístole11, y la relajación de la pared miocárdica. Hemodinámicamente supone el 80% del volumen de llenado y se produce sin prácticamente contribución de factores auriculares10.
Difícil de imaginar y de demostrar es que la fase de relajación isovolumétrica y el llenado rápido que le sigue se produzcan como consecuencia de la contracción de la porción final de la banda muscular; sin embargo, esto explicaría por qué siempre que hay disfunción sistólica también la hay diastólica, por qué el índice T (la constante de tiempo de la caída de la presión durante la fase de contracción isovolumétrica) depende de la contractilidad, y el isoproterenol la mejora12, e incluso por qué la disfunción diastólica con función sistólica normal o «conservada» es todavía una entidad de dudosos significado, identificación y tratamiento13-17.
Los estudios experimentales que aquí presentamos se han realizado con el objetivo de conocer los mecanismos miocárdicos involucrados en el flujo transmitral de la protodiástole. En concreto queremos saber si la fase de llenado rápido ventricular es un proceso de relajación o de contracción18.
Para ello comprobaremos si la contracción del segmento ascendente de la lazada apexiana coincide en el tiempo con la llamada fase de relajación isovolumétrica del ventrículo izquierdo, si la inducción de hipocinesia o acinesia limitada a dicho segmento afecta negativamente al flujo transmitral precoz, la velocidad de caída de la presión intraventricular durante la fase isovolumétrica y la presión mínima que se alcanza en el ventrículo izquierdo.
MÉTODOS
Se han estudiado 12 cerdos de ambos sexos, con un peso medio de 28,2 ± 5,1 kg, procedentes de la Unidad de Veterinaria del Centro de Investigación de nuestro hospital. Los experimentos fueron realizados respetando la legislación española y europea sobre «Protección de animales usados en experimentación y otros propósitos científicos» (RD 223/1988 y RD 1201/2005). Los procedimientos quirúrgicos fueron realizados por investigadores en posesión del Título de ámbito europeo de Formación en experimentación animal (Real Decreto 1201/2005).
Preparación experimental
El día del experimento los animales son preanestesiados y sedados en estabulario mediante inyección intramuscular de midazolam (0,5 mg/kg) y ketamina (10 mg/kg). La anestesia se induce en quirófano experimental por vía intravenosa (tiopental 10 mg/kg de peso), donde se practica la intubación endotraqueal y la canalización de la yugular externa. Se mantiene la anestesia mediante Sevorane (2,5%) en una mezcla del 40% de oxígeno y el 60% de protóxido de nitrógeno suministrada con un respirador (Temel VT3, España). La analgesia y la relajación se inician con bromuro de vecuronio (0,08 mg/kg) y cloruro mórfico (0,7 mg/kg) en bolo intravenoso y se mantienen con bromuro de vecuronio (0,08 mg/kg de peso) y 20 mg de cloruro mórfico en 50 ml de suero en bomba de infusión a 12 ml/h. Se practica apertura del tórax mediante esternotomía media y se realiza pericardiectomía. La ventilación mecánica se ajusta entre 16 y 20 respiraciones/min y alrededor de 5 l/min de gas, según las oximetrías en sangre. El ECG periférico, el pH sanguíneo, gases en sangre, hematocrito y la temperatura rectal se controlan durante todo el experimento. La temperatura se mantiene con manta eléctrica.
Función segmentaria
Se implantan en el miocardio tres pares de microcristales ultrasónicos (Biopac Systems, Santa Bárbara, California, Estados Unidos). Un par en el mesocardio (aproximadamente a 4-5 mm de profundidad) de la cara lateral del ventrículo izquierdo correspondiente a la lazada basal, segmento lateral izquierdo (P1) siguiendo la dirección del eje longitudinal del corazón, otro par en el subendocardio de la cara anterior del tercio medio del ventrículo izquierdo entre la primera y la segunda diagonales de la arteria descendente anterior y en dirección tangencial a ella, zona correspondiente al segmento descendente de la lazada apexiana (P2), y finalmente otro par en el subepicardio (a 1-2 mm de profundidad) de la cara anterior del ventrículo izquierdo entre la primera y la segunda diagonales de la arteria descendente anterior y paralelo a la DA hacia la raíz aórtica, en zona correspondiente al segmento ascendente de la lazada apexiana (P3) (fig. 1). Los pares de microcristales se alinean siguiendo la dirección de las fibras musculares de la zona en la que están. La separación entre ellos es de 2 cm aproximadamente. Los pares de P2 se anclan en el subendocardio mediante punción transparietal alcanzando cavidad ventricular y retrocediendo hasta dejarlos en subendocardio, se sitúan alineados en cruz con los de P3 en el subepicardio. Los pares de cristales nos permiten conocer el desplazamiento relativo de ambos puntos de miocardio sobre los que se fijan y, por lo tanto, las propiedades dinámicas del segmento contenido entre ellos. La adquisición de las curvas de contractilidad miocárdica regional se realiza con Sonometrics Corporation Digital Ultrasonic Measurement System (London, Ontario, Canadá).
Presiones intracavitarias
A través de la pared libre del ventrículo izquierdo se implanta un catéter para control de la presión ventricular izquierda y otro a través de la orejuela para la medida de la presión intraauricular izquierda; ambos catéteres se conectan a transductores de presión (Transpac IV, Abbot, Irlanda).
Flujo aórtico
Se diseca la raíz aórtica y se coloca un medidor electromagnético de flujo (Transonic System, New Cork, Estados Unidos).
Flujo transmitral
Se realiza ecocardiograma Doppler (Interspec XL Doppler, Estados Unidos) con sonda de 5 MHz, directamente sobre epicardio, registrando el flujo transmitral desde un plano apical de cuatro cámaras, primero en situación basal y tras las inyecciones en la pared miocárdica del formaldehído diluido.
Inducción de acinesia segmentaria
Se realiza mediante inyecciones de formaldehído19 diluido al 2,5% con aguja atraumática en el subepicardio (1-2 mm de profundidad) del segmento ascendente de la lazada apexiana, donde están situados los cristales del par P2. Se inyecta un máximo de 0,8 ml de la dilución indicada distribuidos entre 3 y 4 inyecciones. Tras cada inyección se controla el efecto producido sobre la fracción de acortamiento segmentario hasta alcanzar una acinesia o discinesia del citado segmento miocárdico.
Recogida de datos
Se digitalizan y almacenan en memoria electrónica (BIOPAC Systems Inc, Santa Bárbara, California, Estados Unidos) los registros correspondientes a: ECG (DI, DII o DIII), presión del ventrículo izquierdo (PVI) en mmHg, presión auricular izquierda (PAI) en mmHg, flujo aórtico (ml/ min) y curvas de soniometría de los tres segmentos miocárdicos de la banda indicados. Por separado, las curvas y valores de las velocidades del flujo transmitral mediante la instrumentación de eco-Doppler (m/s).
Una vez finalizados los experimentos, los animales son sacrificados bajo anestesia mediante inyección intravenosa de cloruro potásico. Tras la extracción de la pieza anatómica (corazón), se comprueba la localización anatómica de los tres pares de cristales, se disecciona la pared anterior del ventrículo izquierdo siguiendo el trayecto de la arteria interventricular y se comprueba la profundidad a la que está implantado cada cristal, así como la zona muscular infiltrada con el formaldehído.
Parámetros analizados
En el eco-Doppler: velocidades máximas del flujo transmitral al comienzo (E) y al final (A) de la diástole y el cociente E/A. En las curvas de presión intracavitarias: la presión intraventricular izquierda sistólica máxima (PVI), el valor mínimo de la presión intraventricular izquierda (PVImín), la presión telediastólica del ventrículo izquierdo (PTDVI), el tiempo transcurrido desde el cierre de la válvula aórtica hasta que la presión intraventricular alcanza 10 mmHg por encima de la presión telediastólica que corresponde al tiempo de relajación isovolumétrica (TRI)12; en este punto podemos estar seguros de que se trata de la fase isovolumétrica con la válvula mitral todavía cerrada. En las curvas de función segmentaria la fracción de acortamiento (FAc%) y en las del flujo aórtico, el flujo medio aórtico (FlAo) y la relación temporal entre la finalización de la contracción de cada uno de los tres segmentos (P1, P2 y P3) y el final del flujo aórtico (tiempo cierre Ao-contracc P1, P2, P3). Todos estos parámetros se analizan antes y después de la inyección del formaldehído en el segmento ascendente. La fracción de acortamiento se mide después de cada inyección de formaldehído hasta constatar una alteración adecuada del segmento inyectado.
Análisis de los resultados
Las variables estudiadas son continuas, los resultados se presentan como media ± desviación estándar. Se han estudiado los cambios de las variables tras el bloqueo con formaldehído respecto a la situación basal. La comparación de medias se realizó mediante la prueba de la t de Student de muestras apareadas o la prueba no paramétrica de Mann-Witney para datos sin distribución normal. Se consideró significativo un valor de p < 0,05. Se ha utilizado el paquete estadístico SPSS versión 9.0.
RESULTADOS
Cambios hemodinámicos (tabla 1)
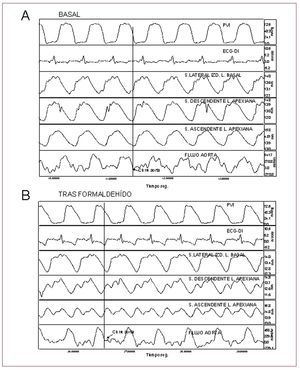
La inyección del formaldehído prolonga de un modo significativo el tiempo necesario para alcanzar los 10 mmHg por encima de la presión telediastólica en el ventrículo izquierdo tras el cierre aórtico, incrementa la presión mínima intraventricular izquierda que se alcanza en la protodiástole pasando de presiones negativas a positivas, eleva —aunque no de forma significativa— la PTDVI e incrementa significativamente la presión auricular media. No se producen de inmediato cambios significativos en el flujo aórtico ni en la presión intraventricular izquierda durante la sístole (fig. 2).
Figura 2. Registro de presión de ventrículo izquierdo (PVI), ECG, contractilidad segmentaria en segmentos: lateral izquierdo de la lazada basal, descendente de la lazada apexiana y ascendente de la lazada apexiana, y del flujo en raíz aórtica (Fl.Ao) en situación basal (A) y tras formaldehído (B). Las flechas indican los puntos correspondientes al cierre de la válvula aórtica. Los cambios inducidos por la inyección de formaldehído se describen en el texto.
Final de la contracción miocárdica y comienzo de la diástole
Para determinar el inicio de la fase de relajación isovolumétrica hemos identificado el final de la expulsión de sangre en la curva del flujo aórtico y la fase de contracción segmentaria en las curvas soniométricas correspondientes (fig. 2).
En todos los experimentos el segmento ascendente (P3) estaba en contracción después de finalizar el flujo aórtico y cerrarse la válvula aórtica. El final de la contracción del último segmento miocárdico se produjo en un tiempo promedio de 72,7 ± 26,3 ms tras el cierre aórtico, coincidiendo con la denominada fase de relajación isovolumétrica en la protodiástole (fig. 2), mientras que el segmento descendente (P2) alcanzaba la máxima contracción tras el cierre aórtico a los 10,6 ± 44,6 ms y el final de la contracción del segmento P1 (lazada basal) precedía el cierre de la válvula aórtica (tabla 1).
Flujo transmitral
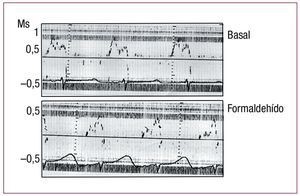
En la tabla 2 se puede apreciar el efecto producido en la fracción de acortamiento de los segmentos monitorizados por la inyección de formaldehído en el segmento ascendente de la lazada apexiana. Se produce una caída hasta niveles de discinesia (por protocolo) en el segmento inyectado (P3, segmento ascendente) y una hipocinesia en el segmento vecino, el descendente (P2) de la lazada apexiana. No se alteran las zonas correspondientes del segmento lateral izquierdo de la lazada basal (P1). Paralelamente, se afecta el flujo transmitral modificándose los valores de las velocidades de llenado ventricular en la protodiástole y cambiando la relación de E/A; así la onda E disminuyó al tiempo que la A se incrementó, descendiendo significativamente la relación E/A (p < 0,01) (tabla 2). Estos cambios se producían inmediatamente después de la infiltración del miocardio y dependiendo de su extensión, hasta un máximo después del cual ya no se producían incrementos con posteriores inyecciones. Paralelamente se producía un cambio evidente en la curva del flujo transmitral del eco-Doppler (fig. 3).
Figura 3. Cambios inmediatos en la velocidad del flujo transmitral, medido mediante eco-Doppler, secundarios a la infiltración con formaldehído al 2,5% en el segmento ascendente de la lazada apexiana. Figura corregida para su reproducción.
DISCUSIÓN
Cuando el ventrículo termina la eyección de la sangre finaliza la sístole y comienza la diástole. Desde ese momento y hasta que la válvula mitral se abre transcurre un tiempo con ambas válvulas cerradas que se conoce como fase de relajación isovolumétrica, durante la cual la presión intraventricular muestra una caída a velocidad constante12 y da lugar a gradientes de presión transparietales y transvalvulares hacia el interior de la cámara. Se produce un efecto de succión al que de modo inmediato se atribuye la rapidez en el llenado ventricular precoz y cuya pérdida total o parcial es causa de la disfunción diastólica del ventrículo izquierdo, sustrato fisiopatológico de la insuficiencia cardiaca con función sistólica conservada.
En la práctica clínica16,20,21 el diagnóstico de insuficiencia cardiaca por disfunción diastólica depende de tres condiciones: que haya signos o síntomas de insuficiencia cardiaca; una fracción de eyección del ventrículo izquierdo normal o ligeramente disminuida, y una presión de llenado del ventrículo izquierdo aumentada. Este último extremo repercute y se puede medir en la curva de llenado ventricular izquierdo del eco-Doppler, en la prolongación del periodo de relajación isovolumétrica, en la disminución en la velocidad protodiastólica E, en el alargamiento del tiempo de desaceleración, en el aumento en la velocidad telediastólica A y en la disminución del cociente E/A.
El llenado ventricular que identifica el tiempo diastólico hasta 19543,4 se atribuía a la contracción auricular; hoy se acepta que el ventrículo izquierdo participa activamente con la fuerza de succión a la que hemos hecho referencia. Es un proceso activo22,23 que consume energía y en el que hay intercambio de Ca2+. Diversos autores consideran la diástole como una consecuencia de la elongación de las fibras miocárdicas de las paredes de una cámara cerrada, sería un fenómeno ligado a la relajación muscular (separación de los filamentos de miosina) y a la recuperación elástica fibrilar en la que interviene la elastina contenida en una red de colágeno que forma el tejido conectivo extrafibrilar, así como la proteína titina como elemento de recuperación del sarcómero deformado durante la sístole10,11. Hay heterogeneidad en la activación mecánica ventricular durante la diástole, con gradientes de relajación subendocardio-subepicardio al comienzo de la diástole22,24,25.
En la teoría de Torrent-Guasp es un fenómeno sistólico ligado a la contracción muscular23,26. La expulsión de la sangre es consecuencia de la contracción del segmento descendente de la lazada apexiana, su contracción «atornilla» la base sobre el ápex aproximando ambas partes. El segmento siguiente y final de la banda muscular es el segmento ascendente de la lazada apexiana que está cubriendo al segmento descendente formando el epicardio de la cara anterior hasta la raíz aórtica y que ha sido «estirado y enrollado» por la contracción del segmento precedente. Al contraerse, el segmento ascendente realiza un movimiento de «destornillado» de la base alejándola del ápex, aumentando el eje longitudinal del corazón y produciendo una succión como ocurriría en el interior de un cilindro que se aleja de su émbolo, dinámica que se ha podido observar en humanos en estudios con resonancia magnética27.
En este trabajo hemos aportado datos que demuestran que la fuerza de succión producida durante la fase de relajación isovolumétrica depende de la contracción porque se produce durante la fase de contracción segmentaria, y además su funcionalidad está fuertemente ligada a la contracción del segmento ascendente de la lazada apexiana, en concreto:
1. Hemos podido comprobar que, al principio y durante la fase de relajación isovolumétrica del ventrículo izquierdo, el segmento ascendente de la lazada apexiana está contrayéndose.
2. La infiltración mediante formaldehído diluido del segmento ascendente de la lazada apexiana afecta directamente a la capacidad de reducir la presión intraventricular o, lo que es lo mismo, la fuerza de succión. Este aspecto se ha demostrado por la prolongación del tiempo necesario para que la presión intraventricular caiga hasta los 10 mmHg sobre la presión telediastólica, un nivel que nos permite asegurar que la válvula mitral está todavía cerrada y que la menor velocidad (es decir, más tiempo) en la caída de la presión es en cámara cerrada (isovolumétrica). También ha quedado demostrado por la menor presión intraventricular mínima alcanzada en la protodiástole que se afecta significativamente cuando infiltramos dicho segmento ascendente.
3. Como consecuencia de una menor velocidad de caída y de un menor descenso final en la presión intraventricular durante la fase isovolumétrica, el efecto de succión es menor y la velocidad del llenado ventricular disminuye durante la protodiástole, aumentando en compensación durante la telediástole, como consecuencia de una contracción de una aurícula izquierda más «llena». Esto se ha demostrado con los cambios en los valores de E, A y el cociente E/A, así como en el incremento progresivo desde la protodiástole de la presión auricular.
Limitaciones del estudio
La utilización de cristales ultrasónicos tiene sentido si asumimos que la estructura del miocardio parcial o totalmente sigue una ordenación en banda y que hemos implantado los dos cristales ultrasónicos en la misma línea que marca la dirección del movimiento fibrilar. Este método es incapaz de aislar la función de un segmento, ya que forma parte del mismo continuo que los otros, de modo que la ateración de cualquier segmento alterará la contracción de toda la banda, como ocurre en nuestro modelo en el que la inyección del segmento ascendente modifica también de un modo significativo la contracción de las fibras contenidas en P2 identificadas como pertenecientes al segmento descendente que es el vecino del inyectado.
Para la identificación de los segmentos y la dirección de sus fibras, así como en la comprobación post mortem en las piezas anatómicas, hemos contado con el asesoramiento del Dr. Torrent-Guasp. Las fibras subendocárdicas del segmento descendente en la zona de la cara anterior del ventrículo izquierdo transcurren en profundidad por el mesocardio cruzándose perpendicularmente con las del segmento ascendente28, extremo que hemos comprobado en las piezas anatómicas, y por esta razón los cristales anclados en el subendocardio han seguido una dirección que cruza perpendicularmente el par implantado en el epicardio correspondiente (segmento ascendente).
La afección muscular secundaria a la inyección de formaldehído diluido es difícil de estandarizar y desde luego afecta a todas las propiedades activas y pasivas de la fibra, disminuyendo hasta el límite la contracción, la relajación y la elasticidad. Se ha tratado de minimizar las variaciones por el formaldehído limitando en todos los experimentos la cantidad y el número de pinchazos y controlando el efecto según la alteración de la contractilidad del segmento inyectado y la comprobación de la alteración del flujo transmitral. A muchos investigadores, las teorías del Dr. Torrent-Guasp les han abierto vías por las que progresar en la comprensión de la fisiología del músculo cardiaco. Otros puntos siguen siendo difíciles de compatibilizar con los datos previos18.
CONCLUSIONES
En esta nueva concepción de la función diastólica participarían las tres propiedades de las fibras miocárdicas, siguiendo un cierto orden al tiempo que se sobreponen. La succión inicial con la cámara cerrada sería consecuencia de la contracción del último segmento de la banda, como hemos tratado de demostrar con los experimentos aquí presentados; la relajación fibrilar de los sucesivos segmentos con la válvula mitral ya abierta permitiría el llenado rápido y finalmente la distensibilidad permitiría que la pared miocárdica pueda ceder ante el incremento de presión/volumen de la inyección auricular.
AGRADECIMIENTOS
Trabajo realizado en memoria del Dr. Francisco Torrent-Guasp.
Full English text available from: www.revespcardiol.org
Este trabajo ha recibido una Ayuda FISS (99/1002).
Correspondencia: Dr. J. Cosín Aguilar.
Unidad de Cardiología Experimental, Centro de Investigación. Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: hernandiz_amp@gva.es
Recibido el 15 de julio de 2008.
Aceptado para su publicación el 14 de enero de 2009.