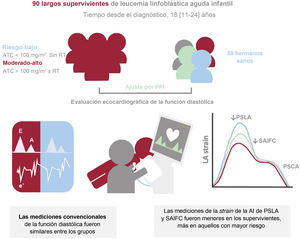
Los supervivientes a un cáncer infantil expuestos a tratamientos cardiotóxicos podrían tener un mayor riesgo de disfunción diastólica. Aunque la evaluación de la función diastólica puede ser difícil en sujetos jóvenes, el strain de la aurícula izquierda podría facilitar su valoración. Nuestro objetivo es valorar la función diastólica por métodos ecocardiográficos convencionales y strain auricular en una cohorte de largos supervivientes de leucemia linfoblástica aguda infantil.
MétodosSe inscribió a los supervivientes diagnosticados en nuestro centro entre 1985 y 2015 y a un grupo de control de hermanos sanos. Se compararon parámetros convencionales de función diastólica y strain auricular en fases de reservorio (SAr), conducto (SAcd) y contracción (SAct). Se ajustó mediante el inverso de la probabilidad de tratamiento para equilibrar las diferencias entre grupos.
ResultadosSe analizó a 90 supervivientes (edad, 24,6±9,7 años; una mediana de 18 [11-26] años desde el diagnóstico) y a 58 controles. El SAr y el SAcd fueron significativamente menores que en el grupo de control: 46,4±11,2 frente a 52,1±11,7 (p=0,003) y 32,5±8,8 frente a 38,2±9,3 (p=0,003) respectivamente. Los parámetros diastólicos convencionales y el SAct fueron similares. En un análisis ajustado por edad y sexo (riesgo al menos moderado, riesgo bajo, controles), la reducción del SAr y el SAcd se asoció con el grado de exposición a tratamientos cardiotóxicos: 45,4±10,5, 49,5±12,9, 52,1±11,7 (paj=0,003) y 31,7±9,0, 35,2±7,5, 38,2±9,3 (paj=0,001) respectivamente.
ConclusionesLos largos supervivientes de leucemia infantil presentaron una ligera alteración en la función diastólica del ventrículo izquierdo cuantificada mediante el strain auricular, pero no por parámetros convencionales. Esta alteración fue más marcada en pacientes con mayor exposición a tratamientos cardiotóxicos.
Palabras clave
La leucemia linfoblástica aguda (LLA) es el tipo de cáncer más frecuente en la población pediátrica. En las últimas décadas, los tratamientos antineoplásicos han aumentado las cifras de supervivencia, que a 5 años están por encima del 90%1. Esta mejora del pronóstico ha llevado a un incremento del número de supervivientes de leucemia infantil (SLI), que tienen un riesgo considerable de sufrir cardiotoxicidad asintomática y la consiguiente insuficiencia cardiaca (IC) durante el seguimiento a largo plazo2,3.
La mayoría de los estudios que incluyen la evaluación ecocardiográfica de SLI de larga duración se han centrado en la valoración de la función sistólica del ventrículo izquierdo (VI), con una alta prevalencia de disfunción sistólica del ventrículo izquierdo (DSVI) asintomática y subclínica4. La función diastólica también puede estar afectada por el efecto cardiotóxico de los tratamientos del cáncer5. Sin embargo, su valoración en SLI de larga duración ha arrojado resultados no concluyentes hasta la fecha, lo que podría explicarse en parte por una evaluación ecocardiográfica más compleja y su asociación con la edad6.
La strain de la aurícula izquierda (SAI) se ha propuesto como un marcador sensible de la disfunción diastólica (DD) y presenta una excelente correlación con las técnicas invasivas para la evaluación de las presiones de llenado del VI7,8. Hay pocos datos sobre el uso de la SAI en largos SLI. Se planteó la hipótesis de que la SAI podría verse afectada en los SLI, por lo que podría ser útil para detectar cambios sutiles en la función diastólica de estos pacientes.
El objetivo de este estudio es evaluar la función diastólica en una cohorte de largos SLI mediante la cuantificación automatizada de la SAI y parámetros convencionales.
MÉTODOSParticipantesEste trabajo se llevó a cabo en el marco del estudio CTOXALL. En resumen, el CTOXALL es un estudio transversal de una cohorte de un solo centro de supervivientes de LLA infantil diagnosticados entre 1985 y 2015, y un grupo de control compuesto por hermanos sanos. El objetivo del estudio CTOXALL es evaluar la prevalencia de cardiotoxicidad a largo plazo en SLI con nuevos parámetros ecocardiográficos y biomarcadores. Ya se había comunicado una alta prevalencia de DSVI subclínica en estos pacientes4. El presente estudio tiene como objetivo evaluar el valor añadido de la SAI en los parámetros ecocardiográficos convencionales (figura 1). El protocolo del estudio CTOXALL fue aprobado por el comité de ética de investigación clínica local de acuerdo con las normas institucionales y de buena práctica clínica. Se obtuvo el consentimiento informado por escrito de todos los participantes, padres o tutores legales.
Figura central. Evaluación de la strain de la aurícula izquierda en una cohorte de LLA infantil. Una cohorte de LLA infantil de larga duración mostró deterioro de la función diastólica detectada por strain de la aurícula izquierda, pero no por los parámetros convencionales. Este deterioro fue más acusado en aquellos con mayor riesgo en función de la exposición al tratamiento cardiotóxico. AI: aurícula izquierda; ATC: antraciclinas; PPI: ponderación de la probabilidad inversa; PSCA: pico de strain de contracción auricular; PSLA: pico de strain longitudinal auricular; RT: radioterapia; SAIFC: strain de la aurícula izquierda durante la fase de conducto.
Se valoró a los participantes desde mayo de 2019 hasta enero de 2022 en el Hospital Universitario Reina Sofía (Córdoba, España). Los supervivientes podían participar si se les había diagnosticado LLA antes de los 18 años y habían recibido la última dosis de antraciclina al menos 3 años antes de su inclusión en el estudio. Se excluyó a un individuo con cardiopatía congénita (comunicación interventricular). Se seleccionó una muestra de hermanos de supervivientes, sanos y dispuestos a participar, como grupo de comparación.
Evaluación clínicaTodos los pacientes pasaron por una evaluación clínica. La exposición a tratamientos cardiotóxicos y las dosis se recogieron de las historias clínicas. Las dosis acumuladas de antraciclina se convirtieron en equivalentes de doxorubicina mediante factores de conversión descritos previamente: 0,6 para daunorubicina, 0,8 para epirubicina y 10,5 para mitoxantrona9. Se tuvo en cuenta la exposición a la radioterapia cuando estaba implicada la zona del corazón, incluida la irradiación corporal total. De acuerdo con las directrices europeas sobre cardio-oncología, se clasificó como en bajo riesgo a los pacientes expuestos a una dosis acumulada de doxorrubicina <5Gy, dosis de radioterapia y <100mg/m2. A los demás pacientes se los clasificó como en riesgo moderado o superior10.
EcocardiogramaTodos los estudios fueron realizados por ecocardiografistas experimentados que utilizaron el mismo equipo (EPIQ CVx e iE33, Philips Medical Systems, Estados Unidos). Los parámetros ecocardiográficos estándar se obtuvieron de conformidad con las últimas recomendaciones11,12. Se utilizó el trazado manual de los márgenes de la aurícula izquierda (AI) en los planos apicales de 4 cámaras y de 2 cámaras para medir los volúmenes de la AI con el método biplano de discos (Simpson). La función diastólica del VI se evaluó según el algoritmo de la American Society of Echocardiography/European Association of Cardiovascular Imaging (ASE/EACVI), que se basa en las siguientes variables: velocidades de flujo mitral, velocidad en anillo mitral e’, relación E/e’, velocidad máxima del chorro regurgitante tricuspídeo y máximo volumen de la AI (VAI) indexado13.
En el presente estudio, se realizó a posteriori un análisis retrospectivo de la SAI mediante una evaluación semiautomática con AutoStrain (TomTec-Arena, TomTec Imaging Systems, Alemania). La SAI se midió desde un plano apical no acortado de 4 cámaras, como se recomienda en el documento de consenso de la ASE/EACVI sobre la estandarización de las imágenes de deformación14.
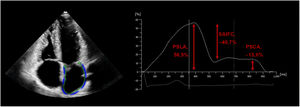
La telediástole ventricular y la onda R del electrocardiograma sirvieron como referencia temporal para definir el valor inicial cero de las curvas de SAI. La función de la AI se puede definir por 3 componentes: reservorio (desde la telediástole hasta la apertura de la válvula mitral), conducto desde la apertura de la válvula mitral, a lo largo de la diástasis hasta el inicio de la contracción auricular) y fase de contracción (desde el inicio de la contracción auricular hasta la telediástole). La SAI se evaluó durante estas 3 fases y se representó por el pico de strain longitudinal de la aurícula (PSLA), el pico de strain de contracción auricular (PSCA) y el strain de la AI durante la fase de conducto (SAIFC), que representan la función de reservorio, contracción y conducto de la AI respectivamente (figura 2). Después del cálculo automático con el software, el operador ajustó manualmente los contornos en caso necesario. Para simplificar, las mediciones de la SAI se muestran en valores absolutos.
Evaluación ecocardiográfica automatizada de la strain de la aurícula izquierda (SAI). El trazado automático de la aurícula izquierda se realizó desde el plano apical de 4 cámaras, como se muestra a la izquierda de la imagen. La referencia de tiempo para definir el valor inicial cero para la SAI se estableció en la telediástole ventricular y la onda R en el electrocardiograma. Los valores de pico de strain longitudinal auricular (PSLA), SAI durante la fase de conducto (SAIFC) y pico de strain de contracción auricular (PSCA) se representan en el gráfico de la derecha.
Para evaluar la variabilidad intraobservador e interobservadores, se seleccionaron al azar 20 ecocardiogramas y midieron la SAI, respectivamente, el mismo investigador que realizó el análisis y un segundo investigador.
Análisis estadísticosLas variables cualitativas se presentan como recuento (porcentaje) y las variables continuas, como media ± desviación estándar o mediana [intervalo intercuartílico] según su distribución, que se evaluó mediante la prueba de Shapiro-Wilk y gráficos Q-Q. Los supervivientes y los controles se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher en cuanto a las variables cualitativas y la prueba de la t de Student o la prueba de la U de Mann-Whitney en cuanto a las continuas, según correspondiera.
Se utilizaron modelos lineales generalizados para comparar las mediciones ecocardiográficas entre los grupos. Se utilizó la ponderación de la probabilidad inversa (PPI) del tratamiento para equilibrar las características de los 2 grupos15. Las puntuaciones de propensión se calcularon utilizando una regresión logística con la edad, el sexo, el índice de masa corporal, la frecuencia cardiaca y la presión arterial diastólica como covariables. Se usaron diferencias de medias estandarizadas antes y después de la ponderación para evaluar el balance. Se consideró que una diferencia <10% indicaba un balance adecuado. La distribución de la puntuación de propensión antes y después de la ponderación se representó gráficamente para evaluar el grado de solapamiento entre los 2 grupos. Los errores estándar de los coeficientes de regresión lineal de PPI se obtuvieron utilizando estimadores robustos de la varianza de tipo sándwich16.
Se utilizaron modelos de regresión lineal univariable y multivariable para comparar los parámetros ecocardiográficos entre los SLI con riesgo moderado o superior, los SLI con bajo riesgo y los controles, con la edad y el sexo como covariables en los modelos multivariables.
Las concordancias intraobservador e interobservadores se evaluaron mediante coeficientes de correlación intraclase y el método de Bland-Altman, que representa la diferencia de 2 mediciones (eje de ordenadas) frente a la media (eje de ordenadas) de cada individuo. El límite de concordancia se calculó como la diferencia media ± 1,96 desviaciones estándar.
Los análisis estadísticos se realizaron con los programas SPSS (versión 24; IBM Corp., Estados Unidos) y R (versión 4.0.3; R Foundation for Statistical Computing, Austria).
RESULTADOSCaracterísticas de los participantesDurante el periodo mencionado, 170 pacientes menores de 18 años fueron diagnosticados de LLA en nuestro centro. De ellos, 52 habían muerto antes del inicio del periodo de selección. Entre los 118 supervivientes de larga duración, no se incluyó a 28 (no se pudo localizar a 17; 10 se negaron a participar y a 1 se le diagnosticó una cardiopatía congénita). Por lo tanto, 90 pacientes integraron definitivamente el grupo de SLI.
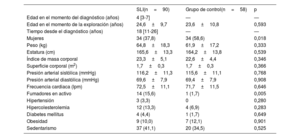
El grupo de SLI tenía una mediana de edad de 4 [3-8] años en el momento del diagnóstico y 34 (37,8%) eran mujeres. La media de edad en el momento de la inclusión era 24,6 ± 9,7 años. La mediana de tiempo desde el diagnóstico fue de 18 [11-26] años. El grupo de control estaba compuesto por 58 hermanos sanos. Las características de los grupos no ponderados se muestran en la tabla 1. Los 2 grupos eran comparables en edad, medidas corporales y prevalencia de factores de riesgo, pero había una mayor proporción de mujeres en el grupo de control (el 37,8 frene al 56,6%; p=0,018). La prevalencia de sedentarismo fue alta en ambos grupos (el 41,1 frente al 34,5%; p=0,525). El tabaquismo fue más frecuente en el grupo de SLI (el 15,6 frente al 1,7%; p=0,005). Las variables utilizadas en los modelos de PPI de las comparaciones ecocardiográficas entre los grupos, incluido el sexo, estaban bien equilibradas después de la ponderación, con diferencias de medias estandarizadas < 10% en todas las covariables (figura 1 del material adicional).
Características de los supervivientes de leucemia linfoblástica aguda infantil y de los controles
| SLI(n=90) | Grupo de control(n=58) | p | |
|---|---|---|---|
| Edad en el momento del diagnóstico (años) | 4 [3-7] | — | — |
| Edad en el momento de la exploración (años) | 24,6±9,7 | 23,6±10,8 | 0,593 |
| Tiempo desde el diagnóstico (años) | 18 [11-26] | — | — |
| Mujeres | 34 (37,8) | 34 (58,6) | 0,018 |
| Peso (kg) | 64,8±18,3 | 61,9±17,2 | 0,333 |
| Estatura (cm) | 165,6±13,3 | 164,2±13,8 | 0,539 |
| Índice de masa corporal | 23,3±5,1 | 22,6±4,4 | 0,346 |
| Superficie corporal (m2) | 1,7±0,3 | 1,7±0,3 | 0,366 |
| Presión arterial sistólica (mmHg) | 116,2±11,3 | 115,6±11,1 | 0,768 |
| Presión arterial diastólica (mmHg) | 69,6±7,9 | 69,4±7,9 | 0,908 |
| Frecuencia cardiaca (lpm) | 72,5±11,1 | 71,7±11,5 | 0,646 |
| Fumadores en activo | 14 (15,6) | 1 (1,7) | 0,005 |
| Hipertensión | 3 (3,3) | 0 | 0,280 |
| Hipercolesterolemia | 12 (13,3) | 4 (6,9) | 0,283 |
| Diabetes mellitus | 4 (4,4) | 1 (1,7) | 0,649 |
| Obesidad | 9 (10,0) | 7 (12,1) | 0,901 |
| Sedentarismo | 37 (41,1) | 20 (34,5) | 0,525 |
LLA: leucemia linfoblástica aguda; SLI: supervivientes de leucemia linfoblástica aguda infantil.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Los detalles de los tratamientos cardiotóxicos recibidos por los SLI se muestran en la tabla 2. Todos ellos estuvieron expuestos a antraciclinas. La dosis de antraciclina acumulada isotóxica fue una mediana de 138 [72-192] mg/m2. Tres pacientes (3,3%) recibieron radiación torácica y a 17 (18,9%) se les realizó trasplante de progenitores hematopoyéticos. En total, se clasificó a 23 supervivientes (25,6%) en bajo riesgo de acuerdo con las recomendaciones actuales. La prevalencia de DSVI asintomática (fracción de eyección del ventrículo izquierdo [FEVI] < 50%) fue del 12,2% y la de DSVI subclínica (strain longitudinal global [SLG] < 18,5%), del 26,6%.
Tratamientos cardiotóxicos recibidos por los supervivientes
| SLI(n=90) | |
|---|---|
| Exposición a antraciclinas | 90 (100)* |
| Doxorubicina | 16 (17,8) |
| Daunorubicina | 90 (100) |
| Epirubicina | 9 (10,0) |
| Mitoxantrona | 12 (13,3) |
| Dosis acumulada de doxorubicina (mg/m2) | 138 [72-192] |
| < 100 mg/m2 | 23 (25,6) |
| 100-250 mg/m2 | 61 (67,7) |
| > 250 mg/m2 | 6 (6,7) |
| Exposición a radioterapia | 3 (3,3) |
| TPH | 17 (18,9) |
LLA: leucemia linfoblástica aguda; SLI: supervivientes de LLA infantil; TCMH: trasplante de progenitores hematopoyéticos.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Las mediciones diastólicas ecocardiográficas convencionales estaban disponibles y eran viables en todos los pacientes. No hubo casos de DD ni de función diastólica indeterminada según el algoritmo de la ASE/EACVI.
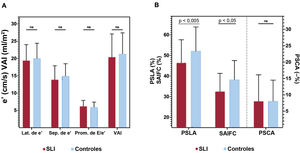
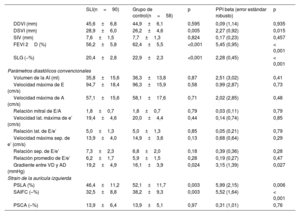
Comparación de parámetros ecocardiográficos entre supervivientes y controlesMediciones diastólicas convencionalesLos parámetros convencionales de la función diastólica basados en el Doppler tisular del anillo mitral y los valores de VAI indexado estaban dentro de los límites normales y no había diferencias entre los grupos: velocidad lateral e’ (cm/s) (19,4 ± 4,6 frente a 20,0 ± 4,4; p=0,439), velocidad septal e’ en cm/s (13,9 ± 4,0 frente a 14,9 ± 3,6; p=0,131), relación promedio E/e’ (6,2 ± 1,7 frente a 5,9 ± 1,5; p=0,279) y VAI indexado (ml/m2) (20,65 ± 6,8 frente a 21 ± 6,1; p=0,277). Después del ajuste mediante PPI, estos parámetros diastólicos se mantuvieron similares entre los grupos. El gradiente entre el ventrículo derecho y la aurícula derecha estaba dentro de los límites de la normalidad en ambos grupos, pero fue ligeramente mayor en los supervivientes (19,2±4,9 frente a 16,1±3,9; p=0,024). Esta diferencia continuó siendo significativa después del ajuste con PPI (tabla 3 y figura 3A).
Mediciones ecocardiográficas de los SLI y los controles
| SLI(n=90) | Grupo de control(n=58) | p | PPI beta (error estándar robusto) | p | |
|---|---|---|---|---|---|
| DDVI (mm) | 45,6±6,8 | 44,9±6,1 | 0,595 | 0,09 (1,14) | 0,935 |
| DSVI (mm) | 28,9±6,0 | 26,2±4,6 | 0,005 | 2,27 (0,92) | 0,015 |
| SIV (mm) | 7,6±1,5 | 7,7±1,3 | 0,824 | 0,17 (0,23) | 0,457 |
| FEVI 2D (%) | 56,2±5,8 | 62,4±5,5 | <0,001 | 5,45 (0,95) | < 0,001 |
| SLG (−%) | 20,4±2,8 | 22,9±2,3 | <0,001 | 2,28 (0,45) | < 0,001 |
| Parámetros diastólicos convencionales | |||||
| Volumen de la AI (ml) | 35,8±15,6 | 36,3±13,8 | 0,87 | 2,51 (3,02) | 0,41 |
| Velocidad máxima de E (cm/s) | 94,7±18,4 | 96,3±15,9 | 0,58 | 0,99 (2,87) | 0,73 |
| Velocidad máxima de A (cm/s) | 57,1±15,6 | 58,1±17,6 | 0,71 | 2,02 (2,85) | 0,48 |
| Relación mitral de E/A | 1,8±0,7 | 1,8±0,7 | 0,79 | 0,03 (0,11) | 0,79 |
| Velocidad lat. máxima de e’ (cm/s) | 19,4±4,6 | 20,0±4,4 | 0,44 | 0,14 (0,74) | 0,85 |
| Relación lat. de E/e’ | 5,0±1,3 | 5,0±1,3 | 0,85 | 0,05 (0,21) | 0,79 |
| Velocidad máxima sep. de e’ (cm/s) | 13,9±4,0 | 14,9±3,6 | 0,13 | 0,68 (0,64) | 0,29 |
| Relación sep. de E/e’ | 7,3±2,3 | 6,8±2,0 | 0,18 | 0,39 (0,36) | 0,28 |
| Relación promedio de E/e’ | 6,2±1,7 | 5,9±1,5 | 0,28 | 0,19 (0,27) | 0,47 |
| Gradiente entre VD y AD (mmHg) | 19,2±4,9 | 16,1±3,9 | 0,024 | 3,15 (1,39) | 0,027 |
| Strain de la aurícula izquierda | |||||
| PSLA (%) | 46,4±11,2 | 52,1±11,7 | 0,003 | 5,99 (2,15) | 0,006 |
| SAIFC (–%) | 32,5±8,8 | 38,2±9,3 | 0,003 | 5,52 (1,64) | < 0,001 |
| PSCA (–%) | 13,9±6,4 | 13,9±5,1 | 0,97 | 0,31 (1,01) | 0,76 |
AD: aurícula derecha; AI: aurícula izquierda; DDVI: diámetro diastólico del ventrículo izquierdo; DSVI: diámetro sistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; PPI: ponderación de la probabilidad inversa; PSCA: pico de strain de contracción auricular; PSLA: pico de strain longitudinal auricular; SAIFC: strain de la aurícula izquierda durante la fase de conducto; SIV: septo interventricular; SLG: strain longitudinal global; SLI: supervivientes de leucemia linfoblástica aguda infantil; VD: ventrículo derecho.
Salvo otra indicación, los valores expresan media ± desviación estándar.
Comparación de parámetros ecocardiográficos entre supervivientes y controles. Los parámetros ecocardiográficos tradicionales de la función diastólica no mostraron diferencias entre supervivientes y controles (A). El pico de strain longitudinal auricular (PSLA) y la strain de la aurícula izquierda durante la fase de conducto (SAIFC) fueron significativamente inferiores en el grupo de supervivientes. El pico de strain de contracción auricular (PSCA) fue similar entre los grupos (B). Lat.: lateral; NS: no significativo; Prom.: promedio; Sep.: septal; SLI: supervivientes de leucemia infantil; VAI: volumen de la aurícula izquierda indexado.
Se dispuso de los parámetros automatizados de la SAI (PSLA, PSCA y SAIFC) de todos los pacientes y eran valorables el 91,9% de ellos. El PSLA y el SAIFC estaban dentro de los límites normales, pero fueron significativamente más bajos en los supervivientes que en los controles (respectivamente, 46,4 ± 11,2 frente a 52,1 ± 11,7, p=0,003; y 32,5 ± 8,8 frente a 38,2 ± 9,3; p=0,003). El PSCA también estaba dentro de la normalidad, pero fue similar en los 2 grupos (13,9 ± 6,4 frente a 13,9 ± 5,1; p=0,971). De manera similar, después del ajuste mediante PPI, el PSLA y el SAIFC, pero no el PSCA, se redujeron en comparación con el grupo de control (tabla 3 y figura 3B).
Hubo una correlación débil entre el PSLA y la SLG (r=0,29; p=0,001), una correlación moderada entre el SAIFC y la SLG (r=0,35; p=0,001) y ninguna correlación entre el PSCA y la SLG (r=0,02; p=0,801). Después del ajuste multivariable por edad, sexo y SLG, las diferencias en el PSLA y el SAIFC entre los supervivientes y los controles continuaron siendo significativas (PSLA, p=0,030; SAIFC, p=0,007). Al igual que en el análisis no ajustado y ajustado por PPI, no hubo diferencias significativas en el PSCA entre los grupos (p=0,894).
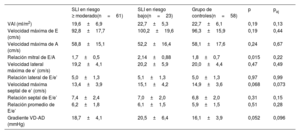
Comparación de parámetros ecocardiográficos según el riesgo de cardiotoxicidadEntre los SLI, 23 (25,6%), 61 (67,7%) y 6 (6,7%) pacientes, respectivamente, podrían clasificarse como en riesgo bajo, moderado y alto según la guía europea de cardio-oncología10. Teniendo en cuenta esta clasificación, se formaron 3 grupos para el análisis posterior: SLI en riesgo moderado o superior (n=67), SLI en bajo riesgo (n=23) y controles (n=58). En el análisis no ajustado, la mayoría de las mediciones diastólicas ecocardiográficas convencionales fueron similares entre los 3 grupos, excepto la relación E/A y el gradiente sistólico máximo entre el ventrículo derecho y la aurícula derecha (AD-VD), que fueron más altos en el grupo de SLI en bajo riesgo. Después del ajuste por edad y sexo, todos los parámetros diastólicos convencionales fueron comparables entre los 3 grupos (tabla 4).
Mediciones ecocardiográficas convencionales según el riesgo de cardiotoxicidad
| SLI en riesgo ≥ moderado(n=61) | SLI en riesgo bajo(n=23) | Grupo de controles(n=58) | p | paj | |
|---|---|---|---|---|---|
| VAI (ml/m2) | 19,6±6,9 | 22,7±5,3 | 22,7±6,1 | 0,19 | 0,13 |
| Velocidad máxima de E (cm/s) | 92,8±17,7 | 100,2±19,6 | 96,3±15,9 | 0,19 | 0,44 |
| Velocidad máxima de A (cm/s) | 58,8±15,1 | 52,2±16,4 | 58,1±17,6 | 0,24 | 0,67 |
| Relación mitral de E/A | 1,7±0,5 | 2,14±0,88 | 1,8±0,7 | 0,015 | 0,22 |
| Velocidad lateral máxima de e’ (cm/s) | 19,2±4,1 | 20,2±5,9 | 20,0±4,4 | 0,47 | 0,49 |
| Relación lateral de E/e’ | 5,0±1,3 | 5,1±1,3 | 5,0±1,3 | 0,97 | 0,99 |
| Velocidad máxima septal de e’ (cm/s) | 13,4±3,9 | 15,1±4,2 | 14,9±3,6 | 0,068 | 0,073 |
| Relación septal de E/e’ | 7,4±2,4 | 7,0±2,0 | 6,8±2,0 | 0,31 | 0,15 |
| Relación promedio de E/e’ | 6,2±1,8 | 6,1±1,5 | 5,9±1,5 | 0,51 | 0,28 |
| Gradiente VD-AD (mmHg) | 18,7±4,1 | 20,5±6,4 | 16,1±3,9 | 0,052 | 0,096 |
Gradiente VD-AD: gradiente de presión entre el ventrículo derecho y la aurícula derecha; PPI: ponderación por la probabilidad inversa; SLI: supervivientes de leucemia linfoblástica aguda infantil; VAI: volumen de la aurícula izquierda indexado.
Los valores expresan media ± desviación estándar.
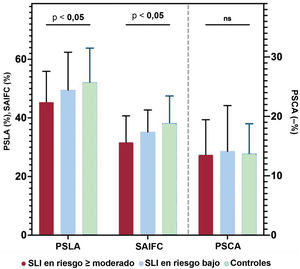
En cambio, se encontraron diferencias estáticamente significativas en las mediciones de la SAI, ya que hubo una disminución progresiva de los valores del PSLA y la SAIFC según la exposición al tratamiento cardiotóxico: PSLA (%), 45,4±10,5, 49,5±12,9 y 52,1±11,7 (p=0,007) y SAIFC (–%), 31,7±9,0, 35,2±7,5 y 38,2±9,3 (p=0,001) en los SLI en riesgo moderado o superior, aquellos con riesgo bajo y los controles respectivamente. Estas diferencias se mantuvieron significativas después del ajuste por edad y sexo (PSLA, paj=0,003; SAIFC, paj=0,001). El PSCA fue similar entre los 3 grupos en los análisis no ajustado y ajustado (figura 4).
Comparación de los parámetros de la strain de la aurícula izquierda según el riesgo de cardiotoxicidad. Se encontraron diferencias estadísticamente significativas en las mediciones de la strain de la aurícula izquierda entre los grupos de riesgo: pico de strain longitudinal auricular (PSLA) y strain de la aurícula izquierda durante la fase de conducto (SAIFC) desacelerados progresivamente según la exposición al tratamiento cardiotóxico. El pico de strain de contracción auricular (PSCA) fue similar entre los 3 grupos. NS: no significativo; SLI: supervivientes de leucemia infantil.
Los coeficientes de correlación intraclase de la concordancia intraobservador fueron 0,97 (intervalo de confianza del 95% [IC95%], 0,93-0,99), 0,95 (IC95%, 0,89-0,98) y 0,98 (IC95%, 0,97-0,99) para PSLA, SAIFC y PSCA respectivamente. Los coeficientes de correlación intraclase de la concordancia interobservadores fueron 0,93 (IC95%, 0,84-0,97), 0,90 (IC95%, 0,76-0,97) y 0,97 (IC95%, 0,96-0,98). Los gráficos de Bland-Altman se muestran en la figura 2 del material adicional.
DISCUSIÓNEn este estudio se evaluó la función diastólica en una cohorte de largos supervivientes de LLA infantil con mediciones ecocardiográficas convencionales y SAI. Los principales resultados fueron los siguientes: a) los valores de la SAI de los SLI estaban reducidos en comparación con los de sus hermanos sanos; b) esta reducción fue más pronunciada en los supervivientes en mayor riesgo según la exposición al tratamiento, y c) en cambio, los parámetros diastólicos ecocardiográficos convencionales fueron similares en ambos grupos y entre las categorías de riesgo de cardiotoxicidad.
Hasta hace poco, la cardiotoxicidad inducida por antraciclinas era casi sinónimo de DSVI, definida como una disminución de la FEVI17–19. En los últimos años, avances importantes en los medios diagnósticos, en el contexto de un conocimiento más profundo de los mecanismos moleculares implicados en la cardiotoxicidad por antraciclinas, han permitido ir más allá de la visión «centrada en la FEVI» a favor de un enfoque más global20,21. A este respecto, los biomarcadores y la medición de la SLG del VI facilitan la detección precoz de cardiotoxicidad subclínica en pacientes con FEVI normal, por lo cual se recomiendan en el seguimiento periódico de pacientes que han recibido tratamientos cardiotóxicos10,22–24. Además, se ha observado un empeoramiento de la función diastólica del VI que persiste en pacientes con cáncer de mama tratadas con doxorubicina25.
Disfunción diastólica basada en parámetros ecocardiográficos convencionalesEl riesgo de DSVI e IC de los largos supervivientes de cáncer infantil está claramente demostrado, pero falta acuerdo respecto al deterioro de la función diastólica del VI en estos pacientes26–28. De hecho, existe una notable variación entre los estudios que evalúan la prevalencia de DD en supervivientes de cáncer infantil, que va del 0 al 29%27,29,30. Al parecer, esta variación está determinada fundamentalmente por 3 factores: la edad de los supervivientes en el momento de la evaluación ecocardiográfica, el porcentaje de pacientes expuestos a radioterapia mediastínica y los parámetros utilizados para definir la DD. Christiansen et al.27 encontraron una prevalencia de DD del 29% en una cohorte de 125 supervivientes de linfoma infantil (mediana de edad de 33 años en el momento del estudio). La definición de DD se basó en un solo parámetro (reducción del e’ septal y/o e’ lateral) y, sobre todo, fue frecuente en pacientes expuestos a radioterapia mediastínica, que recibió hasta el 50%. En cambio, Slieker et al.31 no encontraron deterioro de la función diastólica en 546 supervivientes pediátricos de cáncer infantil. Los supervivientes eran más jóvenes (mediana de edad de 14 años en el momento de la evaluación) y solo el 12% de estos recibió radioterapia mediastínica. En consonancia con este último estudio, no se encontraron casos de DD basados en parámetros ecocardiográficos convencionales, lo que coincide con la edad relativamente joven de los participantes (media, 25 años) con una exposición excepcional a la radioterapia mediastínica (solo 3 pacientes). Por medio de un mecanismo de daño microvascular y la generación de especies reactivas del oxígeno, la radiación podría provocar fibrosis intersticial que causaría una reducción de la distensibilidad de las paredes del VI. Esto conduce a un riesgo de DD 7 veces mayor para los pacientes tratados con radioterapia en comparación con la población general32. Mediante la producción de especies reactivas y radicales libres y la inhibición de la topoisomerasa IIβ, las antraciclinas causan la muerte celular de los miocitos y fibrosis intersticial. Estas alteraciones generan rigidez de la pared ventricular, problemas de relajación y, a la larga, presiones de llenado altas y DD33,34. De hecho, según la teoría de la acumulación de células senescentes, se cree que los supervivientes de cáncer infantil tienen un fenotipo de envejecimiento acelerado35. Por lo tanto, la prevalencia variable de DD comunicada en la bibliografía podría interpretarse como imágenes de diferentes etapas de un fenómeno dinámico que estaría impulsado principalmente por la senescencia celular y, al parecer, potenciado por diferentes exposiciones, como la radioterapia mediastínica y la dosis acumulada de antraciclina. Debido a las limitaciones de la evaluación multiparamétrica de la función diastólica36 y la superposición entre los valores normales y los patológicos, los parámetros ecocardiográficos convencionales podrían ser insuficientes para detectar las primeras etapas de DD en supervivientes de cáncer infantil.
Disfunción diastólica a partir de la strain de la aurícula izquierdaLa SAI se ha propuesto como una medida única, sensible y reproducible de DD37,38. Aunque esta medición está influida por la SLG del VI, se ha demostrado que tiene relación independiente con las presiones de llenado del VI39,40. En consecuencia, se observa una correlación de leve a moderada entre PSLA/SAIFC y SLG y estas mediciones se mantuvieron considerablemente reducidas en los supervivientes, independientemente de que la SLG fuera reducida. Además, la fibrosis de la pared de la AI se ha asociado con una reducción del PSLA41 y es un predictor de mortalidad y hospitalizaciones de pacientes con IC42. El PSCA corresponde a la contracción auricular activa y parece estar menos asociado con las presiones de llenado y la función diastólica43. Especulamos que el menor grosor de la pared de la aurícula izquierda y el fenotipo diferencial de miocardiocitos auriculares podrían estar asociados con una menor susceptibilidad del miocardio auricular a la lesión inducida por antraciclinas44.
Hay pocos datos sobre la SAI en largos supervivientes de cáncer infantil. Loar et al.45 evaluaron la SAI en una cohorte de 45 supervivientes pediátricos de cáncer infantil (mediana de edad, 11,8 años) y encontraron una reducción del PSLA y la SAIFC en comparación con un grupo de controles sanos. No se encontraron diferencias en las mediciones diastólicas convencionales o el PSCA entre los grupos. Los pacientes expuestos a dosis de antraciclina ≥ 250mg/m2 presentaron los valores más bajos de PSLA. A pesar de la edad más joven de los participantes en el estudio, estos resultados coinciden con los observados en el nuestro y respaldan por completo la hipótesis de que existen alteraciones sutiles en la función diastólica de los supervivientes de cáncer infantil que pueden detectarse por la SAI en la adolescencia y la edad adulta temprana. Suponemos que este deterioro diastólico sutil, que al parecer es más pronunciado en pacientes expuestos a dosis más altas de antraciclinas, podría constituir una etapa subclínica temprana de DD que podría empeorar con los cambios relacionados con el envejecimiento en el llenado del VI, lo que en última instancia generaría un mayor riesgo de DD e IC manifiesta con el paso del tiempo46,47.
Fortalezas y limitacionesHasta donde sabemos, este es el mayor estudio que evalúa la DD en largos supervivientes de cáncer infantil con un enfoque integral que aplica tanto el algoritmo multiparamétrico de la ASE/EACVI como las mediciones de la SAI. Aunque el diseño transversal del estudio impidió evaluar el valor pronóstico del deterioro de la SAI en estos pacientes, permite mostrar hallazgos novedosos en el contexto del avance continuo de las técnicas de imagen cardiaca. Cabe destacar que, a pesar de un seguimiento medio de casi 20 años desde el diagnóstico, la mayoría de los participantes eran adultos jóvenes en el momento de la evaluación, lo que puede limitar la precisión de los parámetros diastólicos convencionales en nuestra muestra. En cambio, una fortaleza del estudio es el uso de mediciones más robustas basadas en la strain. Además, aunque los ecocardiogramas no se analizaron en un laboratorio central, se utilizó software automatizado para la cuantificación. Otra fortaleza del estudio es la inclusión de una población homogénea de supervivientes con tratamientos similares basados en protocolos, lo que reduce el sesgo de confusión derivado de la heterogeneidad en la edad de presentación, los regímenes de tratamiento y otros factores no cuantificables relacionados con la enfermedad. Sin embargo, esto significó un bajo porcentaje de pacientes expuestos a radioterapia, un factor que está muy asociado con la DD. En este sentido, la conformación del grupo de control con hermanos sanos redujo factores genéticos y ambientales no cuantificables, pero resultó en diferencias de sexo entre los 2 grupos, lo que podría condicionar los hallazgos. Aparte esta consideración, el uso de PPI permitió un buen equilibrio entre el sexo y otras covariables relevantes.
CONCLUSIONESLos largos supervivientes de LLA infantil presentaron alteración de la función diastólica en comparación con sus hermanos sanos cuando esta se evaluó con SAI, pero no mediante parámetros convencionales. Este deterioro fue más pronunciado en los supervivientes expuestos a tratamientos más agresivos. Se necesitan estudios longitudinales para determinar si este hallazgo es una etapa temprana de DD en estos pacientes.
- -
Los largos supervivientes de LLA tratados con antraciclinas están en riesgo de sufrir disfunción diastólica.
- -
Los parámetros ecocardiográficos convencionales de función diastólica pueden no ser lo suficientemente sensibles para detectar etapas tempranas de DD.
- -
Parece que la SAI está deteriorada en supervivientes de cáncer en edad pediátrica.
- -
La disfunción diastólica es un proceso relacionado con la edad que podría acelerarse en los SLI a causa de la exposición a tratamientos cardiotóxicos.
- -
La SAI se reduce en los largos supervivientes de cáncer infantil en comparación con los controles. Por lo tanto, la SAI podría ser un marcador temprano de DD en estos pacientes.
- -
Se necesitan estudios prospectivos y traslacionales para confirmar el valor predictivo de la SAI y su asociación con las características moleculares del envejecimiento.
El estudio CTOXALL recibió becas de investigación de la Sociedad Española de Cardiología (Madrid, España) y la Sociedad Andaluza de Cardiología (Granada, España).
CONTRIBUCIÓN DE LOS AUTORESC. Fernández-Avilés y R. González-Manzanares contribuyeron por igual al presente trabajo como primeros autores. J.C. Castillo y M. Pan contribuyeron por igual como autores sénior. Conceptualización: C. Fernández-Avilés, R. González-Manzanares, J.C. Castillo, D. Mesa y J.R. Molina. Metodología: R. González-Manzanares, S. Ojeda y M. Pan. Análisis formal: R. González-Manzanares. Investigación: R. González-Manzanares, J.R. Molina, C. Fernández-Avilés, G. Heredia, A. Resúa, F.J. Hidalgo y J. López-Aguilera. Recursos: D. Mesa, M. Anguita y M. Pan. Tratamiento de datos: R. González-Manzanares, C. Fernández-Avilés y G. Heredia. Redacción-borrador original: C. Fernández-Avilés y R. González-Manzanares. Redacción-revisión y edición: J.C. Castillo, S. Ojeda, F. Hidalgo, J. López-Aguilera, D. Mesa, M. Anguita y M. Pan. Supervisión: J.R. Molina, D. Mesa, M. Anguita, J.C. Castillo, S. Ojeda y M. Pan. Administración del proyecto: J.C. Castillo. Obtención de financiación: R. González-Manzanares.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.