El tratamiento de resincronización cardiaca (TRC) es una alternativa terapéutica no farmacológica para los pacientes con insuficiencia cardiaca (IC) leve, moderada o grave refractaria a la medicación, en clase I, II, III y IV de la New York Heart Association (NYHA), con una duración del QRS prolongada y con una disminución grave de la fracción de eyección ventricular izquierda (FEVI). Los ensayos clínicos1, 2, 3, 4, 5, 6, 7, 8, 9, 10 han puesto de manifiesto que el TRC reduce las hospitalizaciones por IC y la mortalidad y mejora la calidad de vida y la función cardiaca, descrita como el remodelado inverso del ventrículo izquierdo (VI). Sin embargo, el número de pacientes que no responden a ese tratamiento sigue siendo de hasta un 30-35%11.
Los ensayos clínicos que evalúan los efectos del TRC han utilizado diferentes medidas de los resultados a lo largo del tiempo. En los ensayos clínicos iniciales se utilizaron parámetros clínicos como la clase funcional de la NYHA, la prueba de los 6 min de marcha y las evaluaciones de la calidad de vida. El objetivo de valoración clínica fue la reducción de las hospitalizaciones por IC7. Los médicos suelen evaluar subjetivamente los parámetros clínicos y puede que no estén relacionados con un beneficio en cuanto a la mortalidad a largo plazo. La determinación de la clase funcional de la NYHA parece ser una medida fiable del estado funcional en los pacientes con cardiopatías; sin embargo, no se ha establecido aún su reproducibilidad12. La valoración de la mejora de los parámetros ecocardiográficos, la determinación de la FEVI y la reducción de los volúmenes telediastólico y telesistólico del VI son medidas más objetivas y que presentan alta correlación con el beneficio observado en cuanto a la mortalidad a largo plazo13, 14. Se acepta que el criterio de la reducción del 15% del volumen telesistólico del VI define a los pacientes que responden al tratamiento; sin embargo, el número de pacientes que no responden puede ser de hasta un 43%13. Es importante resaltar que la respuesta clínica y ecocardiográfica no siempre va en la misma línea; por ejemplo, los pacientes con una mejora del estado clínico puede que no muestren siempre siempre un remodelado inverso significativo. Además, los cambios individuales de la FEVI son a menudo difíciles de detectar debido a la alta variabilidad en las mediciones. En la Tabla 1 se resumen las principales características de los ensayos clínicos aleatorizados importantes sobre el TRC1, 2, 3, 4, 5, 6, 7, 8, 9, 10.
Tabla 1. Ensayos clínicos aleatorizados del tratamiento de resincronización cardiaca
| Ensayos | Pacientes (n) | Mujeres (%) | Variables de valoración primarias | Variables de valoración secundarias | Etiología isquémica (%) | FEVI (%) | QRS (ms) |
| PATH-CHF | 41 | 50 | 6MWT, VO2 máximo | Clase de la NHYA, CdV, hospitalizaciones | 29 | 21±7 | 175 |
| MUSTIC-SR | 58 | 26 | 6MWT | NYHA, CdV, VO2 máximo, IM, VI, hospitalizaciones, mortalidad total | 37 | 23±7 | 174 |
| MIRACLE | 453 | 32 | 6MWT, NHYA, CdV | VO2 máximo, FEVI, DTDVI, IM, respuesta clínica combinada | 54 | 22±6 | 166 |
| MIRACLE ICD | 555 | 23 | 6MWT, NYHA, CdV | VO2 máximo, FEVI, volúmenes VI, IM, puntuación clínica combinada | 70 | 24±6 | 164 |
| COMPANION | 1.520 | 22 | Mortalidad por todas las causas u hospitalización | Mortalidad por todas las causas y mortalidad cardiaca | 56 | 21 | 159 |
| CARE-HF | 814 | 26 | Mortalidad por todas las causas | NYHA, CdV, FEVI, VTSVI, hospitalización por insuficiencia cardiaca | 38 | 25 | 160 |
| REVERSE | 610 | 21 | Puntuación clínica combinada de la IC | VTSVI | 54 | 27±7 | 153 |
| MADIT-CRT | 1.820 | 25 | IC o muerte | VTSVI, cambio de VTDVI, episodios múltiples de IC | 57 | 24±5 | 162 |
| RAFT | 1.798 | 17 | Mortalidad por todas las causas u hospitalización por IC | Mortalidad por todas las causas, mortalidad cardiaca, hospitalización por IC | 67 | 23±5 | 158 |
6MWT: prueba de los 6 min de marcha; CARE-HF: Cardiac Resynchronization-Heart Failure; CdV: calidad de vida; COMPANION: Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure; DTDVI: dimensión telediastólica ventricular izquierda; FEVI: fracción de eyección ventricular izquierda; IC: insuficiencia cardiaca; IM: insuficiencia mitral; MADIT-CRT: Multicenter Automatic Defibrillator Implantation Trial–Cardiac Resynchronization Therapy; MIRACLE: Multicenter InSync Randomized Clinical Evaluation; MIRACLE-ICD: Multicenter InSync Implantable Cardioverter Defibrillator trial; MUSTIC: Multisite Simulation in Cardiomyopathies; NYHA: New York Heart Association; PATH-CHF: Pacing Therapies in Congestive Heart Failure trial; RAFT: Resynchronization-Defibrillation for Ambulatory Heart Failure; REVERSE: Resynchronization Reverses Remodeling in Systolic Left Ventricular Dysfunction; VI: ventricular izquierdo; VO2: volumen de oxígeno; VTSVI: volumen telesistólico ventricular izquierdo.
En este artículo queremos presentar una guía práctica y completa para el clínico sobre la forma de abordar el manejo de un paciente que no mejora tras el inicio del TRC y cómo identificar las razones de la falta de respuesta. Sin embargo, una revisión exhaustiva y completa de todos los factores que se asocian a la falta de respuesta al TRC (p. ej., características clínicas basales como edad, sexo, etiología isquémica, fibrilación auricular, comorbilidades, colocación de los electrodos, etc.)6, 8, 9 queda fuera del alcance del artículo y se ha comentado ya detalladamente en otras publicaciones15.
Evaluación clínica de un paciente sin respuesta al TRATAMIENTO DE RESINCRONIZACIÓN CARDIACAPaso 1. Verificar el electrocardiograma con y sin marcapasosAl evaluar a un paciente con un dispositivo de TRC implantado y una respuesta clínica al TRC insatisfactoria, el primer paso recomendado es realizar y analizar el electrocardiograma (ECG) de 12 derivaciones, posiblemente con un ECG basal para realizar una comparación directa. Si no se dispone de un ECG basal, puede compararse el efecto agudo del TRC en la secuencia de conducción eléctrica con marcapasos activo e inactivo, a menos que el paciente tenga dependencia del marcapasos. En los pacientes dependientes de marcapasos, el ECG con TRC debe compararse con el marcapasos apical ventricular derecho convencional.
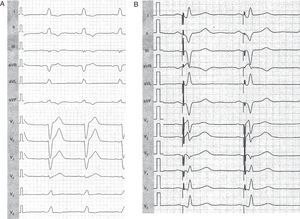
La primera evaluación debe incluir la morfología y la duración basales del QRS. Si la duración del QRS basal sin marcapasos es<150 ms, es menos probable que el paciente sufra una disincronía mecánica y, por lo tanto, también menos probable que responda al tratamiento. Las guías actuales recomiendan como criterio de inclusión para TRC una amplitud del QRS relativamente baja, ≥ 120 ms. Sin embargo, la media de duración del QRS en los amplios ensayos clínicos aleatorizados que se han realizado es de aproximadamente 160 ms (Tabla 1). Varios estudios han indicado que el TRC es más efectivo en los pacientes con un complejo QRS más ancho, puesto que muestran mayor grado de disincronía. Por lo que respecta a la morfología del QRS, un patrón típico de bloqueo de rama izquierda del haz de His (BRIHH) se asocia a mejor resultado clínico, según lo indicado por un subanálisis recientemente publicado del estudio MADIT-CRT16. Los pacientes con BRIHH presentaron mayor efecto beneficioso en la reducción de los episodios de IC o las muertes con TRC (razón de riesgos [HR]=0,047; p<0,001) en comparación con los pacientes sin BRIHH (HR=1,24; p=0,257). El riesgo de arritmias ventriculares o muerte se redujo también significativamente con el TRC en los pacientes portadores de desfibriladores que tenían BRIHH, pero no en los que no tenían BRIHH (bloqueo de rama derecha del haz de His [BRDHH] y retraso de la conducción intraventricular). En consonancia con lo indicado por observaciones previas, el remodelado inverso del VI y la mejora de la FEVI fueron significativamente mayores en los pacientes con BRIHH que en los pacientes sin BRIHH. En la Figura 1A se muestra un BRIHH típico en una mujer de 45 años de edad con una miocardiopatía dilatada de origen no isquémico. Después del TRC, la resincronización efectiva se pone de manifiesto por el cambio del eje del QRS y la reducción de su amplitud (Figura 1B).
Figura 1. Electrocardiografía de una mujer de 45 años, a la que se había aplicado un tratamiento de resincronización cardiaca y que presentaba un bloqueo de rama izquierda del haz de His. A: antes de la resincronización. B: después de la implantación del tratamiento de resincronización cardiaca. Obsérvese los cambios en las derivaciones I (onda S de nueva aparición) y V1 (onda R de nueva aparición) que indican la activación inicial a partir de una localización ventricular izquierda.
La amplitud del QRS en la situación basal y con marcapasos son fáciles de medir y constituyen un parámetro básico de la resincronización con el TRC. Cuanto más se reduce la amplitud del QRS con el TRC, más beneficioso es este tratamiento. Un reciente subestudio del estudio PROSPECT ha indicado que la diferencia de la amplitud del QRS basal respecto al observado con marcapasos predice los resultados clínicos en los pacientes tratados con TRC17. Sin embargo, hay que señalar que la reducción de la amplitud del QRS con el TRC es un marcador específico pero no sensible de la respuesta al TRC. Muchos pacientes que no presentan cambios significativos de la amplitud del QRS podrían tener de todos modos una respuesta favorable al TRC.
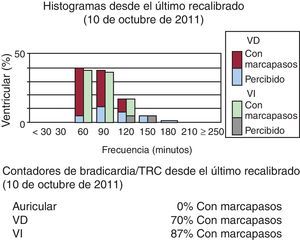
También es importante evaluar si el paciente está en ritmo sinusal normal o en fibrilación auricular. La fibrilación auricular es frecuente en los pacientes con IC y en los pacientes portadores de TRC implantado. Los episodios de fibrilación auricular paroxística o persistente de nueva aparición se asocian a un peor resultado clínico en los pacientes con TRC. La fibrilación auricular conduce a menudo a una taquicardia con pérdida de la captura del VI o latidos con fusión/seudofusión con una resincronización ineficaz (Figura 2). Si no se consigue un control del ritmo mediante cardioversión y/o tratamiento antiarrítmico, es esencial controlar la frecuencia ventricular para asegurar la captura biventricular. Algunos pacientes necesitan una ablación del nódulo auriculoventricular (AV) para asegurar un marcapasos ventricular del 100%, y se ha demostrado que este enfoque agresivo mejora la tolerancia al ejercicio, el remodelado inverso del VI y la FEVI, con un beneficio de supervivencia significativo en esta población de pacientes. El papel del aislamiento de venas pulmonares continúa siendo controvertido. Algunos estudios más pequeños han mostrado un efecto favorable de esta intervención en pacientes con IC; sin embargo, ninguno se llevó a cabo en pacientes con TRC. Dos grandes ensayos aleatorizados, el AMICA (NCT00652522) y el CASTLE-AF (NCT00643188), actualmente están reclutando a pacientes para evaluar los efecto del aislamiento de venas pulmonares en pacientes tratados con TRC.
Figura 2. Tratamiento de resincronización cardiaca en un paciente con fibrilación auricular y signos de pérdida de la captura ventricular izquierda con una resincronización ineficaz. En este paciente el electrodo auricular estaba inactivo debido a una fibrilación auricular permanente. El histograma ventricular muestra unas frecuencias ventriculares altas y el 87% del marcapasos ventricular izquierdo sólo se muestra en los recuentos de bradicardia/TRC en la parte inferior de la imagen. TRC: tratamiento de resincronización cardiaca; VD: ventricular derecho; VI: ventricular izquierdo.
Las extrasístoles ventriculares frecuentes, que se observan más a menudo en los pacientes con miocardiopatía de origen isquémico, inhiben el marcapasos del VI y reducen la eficacia del TRC. En pacientes con una carga elevada de extrasístoles unifocales ventriculares, podría plantearse la ablación percutánea; sin embargo, los datos clínicos al respecto todavía son escasos.
Después de determinar la frecuencia y el ritmo subyacentes, debemos evaluar la captura del VI. La falta de captura del VI es una causa frecuente de falta de respuesta al TRC. Los latidos que se producen con el marcapasos biventricular muestran un eje del QRS en el plano frontal en el cuadrante superior derecho y una onda R dominante en la derivación V1. Si la V1 tiene un complejo QRS negativo, debe sospecharse una pérdida de la captura del VI o una posición no óptima del electrodo del VI.
Es importante identificar los latidos de fusión y seudofusión y corregirlos mediante el acortamiento del retraso AV con objeto de garantizar un marcapasos ventricular del 100%.
Paso 2. Verificación del dispositivo (interrogación del dispositivo)La interrogación del dispositivo proporciona una amplia gama de informaciones sobre el estado de la IC del paciente. Se debe verificar los parámetros de sensibilidad y de marcapasos auriculares, ventriculares derechos y del VI. La falta de captura es una complicación tardía frecuente del TRC y puede hacer que no haya respuesta. A menudo se observa también una estimulación del nervio frénico en los pacientes tratados con TRC, que en algunos casos podría asociarse a un desplazamiento del electrodo del VI.
El porcentaje de estimulación del VI debe ser alto, de hasta un 90%, para garantizar una aplicación óptima del TRC. Podría ser inferior en caso de desplazamiento del electrodo del VI, fibrilación auricular paroxística o permanente o extrasístoles ventriculares frecuentes. Es frecuente que el contador del dispositivo no detecte la fusión y la seudofusión y que el porcentaje de marcapasos del VI se registre falsamente como normal (es decir, > 90%).
La determinación y optimización del retraso AV y el retraso ventriculoventricular (VV) son esenciales en los pacientes que no responden al TRC. Se recomienda realizar una optimización del retraso AV en todos los pacientes, guiado por el dispositivo o por ecocardiografía; este aspecto se comentará con mayor detalle en el Paso 4. Los datos existentes sobre la optimización del retraso VV y su papel en los pacientes con TRC son limitados y controvertidos. La mayoría de los estudios indican que la preactivación del VI o el marcapasos simultáneo VI-vtrículo derecho son óptimos en los pacientes con TRC. Los pacientes que no responden al TRC deben ser evaluados y optimizados siempre respecto al tiempo VV.
Los sensores de dispositivo integrados realizan un seguimiento continuo de la actividad física y la variabilidad de la frecuencia cardiaca y de parámetros como el cambio de la ventilación por minuto, que reflejan la impedancia torácica, y se ha demostrado que proporciona una información clínicamente relevante sobre el estado de la IC de los pacientes con TRC. La variabilidad de la frecuencia cardiaca es una medida efectiva y representativa de la gravedad de la IC. Cuando se compara con una referencia basal, refleja los cambios de la FEVI y del patrón de llenado del VI. En consecuencia, la mejora en la variabilidad de la frecuencia cardiaca proporciona una evidencia de respuesta favorable al TRC.
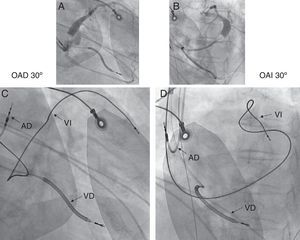
Paso 3. Verificación de la posición de los electrodosLa localización del electrodo VI es probablemente uno de los factores contribuyentes más importantes en la respuesta al TRC; por consiguiente, es crucial determinar la posición del electro del VI en todos los pacientes que no responden al TRC. Las radiografías de tórax (posteroanterior y perfil) o la fluoroscopia son los métodos preferidos para valorar la posición del electrodo del VI. La proyección oblicua anterior izquierda, que muestra la proyección del eje corto del corazón, es útil para clasificar la pared del VI en las posiciones anterior, anterolateral, lateral, posterolateral y posterior del electrodo del VI. La proyección oblicua anterior derecha, que muestra el eje largo, se utiliza para definir las posiciones basal, ventricular media y apical del electrodo. En general, se recomienda implantar el electrodo del VI en una rama colateral, de basal a mediolateral o posterolateral, del seno coronario, si hay una vena apta para ello. La posición anterior del electrodo del VI se asocia a peor pronóstico y falta de respuesta al TRC18 (Figura 3). Sin embargo, un reciente subestudio publicado por Singh et al19 ha indicado que la posición del electrodo del VI —definida como lateral, posterior o anterior— no influyó en los resultados clínicos en los pacientes con IC leve tratados con TRC. Además, en ese estudio, cualquier localización apical del electrodo del VI se asoció a un riesgo de IC o muerte significativamente superior al de las localizaciones basal o ventricular media del electrodo del VI. Esto ayuda a comprender que el marcapasos apical en el TRC podría inducir una mayor heterogeneidad en la activación del VI y una mayor disincronía, por lo que debe evitarse. Sin embargo, el patrón de activación individual podría ser muy variable incluso en pacientes con BRIHH y también en pacientes con BRDHH o con retraso de la conducción intraventricular; así pues, hay fundamento para un TRC optimizado de forma individualizada durante la implantación20.
Figura 3. Paciente con tratamiento de resincronización cardiaca que presenta una posición anterior media no óptima del electrodo ventricular izquierdo. A: flebografía del seno coronario en una proyección oblicua anterior derecha de 30°. B: flebografía del seno coronario en una proyección oblicua anterior izquierda de 30°. C: posiciones finales del electrodo en la proyección oblicua anterior derecha de 30°. D: posiciones finales del electrodo en la proyección oblicua anterior izquierda de 30°. Posición del electrodo auricular derecho en la orejuela auricular derecha, el electrodo de ventricular derecho en el vértice del ventrículo derecho, electrodo del ventrículo izquierdo en la vena anterior media; los electrodos del electrocardiograma externo se observan en la pared torácica. Estados Unidos. AD: electrodo auricular derecho; OAD: oblicua anterior derecha; OAI: oblicua anterior izquierda; VD: electrodo ventricular derecho; VI: electrodo ventricular izquierdo. Reproducido con el amable permiso del Prof. Helmut Klein, University of Rochester, Nueva York, Estados Unidos.
Si el paciente sin respuesta tiene una localización no óptima del electrodo del VI, debe considerarse la posible conveniencia de implantar un segundo electrodo del VI. La tomografía computarizada podría ser un método útil para evaluar las ramas colaterales del seno coronario con vistas a la implantación del segundo electrodo del VI. Si no es posible la implantación transvenosa del electrodo del VI, se podría considerar un abordaje epicárdico a través de una minitoracotomía. Algunos autores proponen incluso la implantación endocárdica transeptal del electrodo del VI. La implantación endocárdica transeptal de un electrodo de VI se realiza con electrodos endocárdicos atornillados (screw-in) que se introducen a través del tabique interauricular y la válvula mitral y se fijan a la pared del VI. Se ha demostrado que los marcapasos endocárdicos son más fisiológicos que los epicárdicos en observaciones experimentales y clínicas. Además, esta técnica tiene la ventaja de colocar el electrodo del VI en el interior de la cavidad ventricular, sin limitaciones causadas por las ramas del seno coronario. Sin embargo, los datos existentes sobre la seguridad a largo plazo y la eficacia de este método son muy limitados. Los pacientes necesitan anticoagulación a largo plazo y los datos relativos al posible riesgo de agravamiento de una insuficiencia mitral (debido a la posición transmitral del electrodo) son escasos.
Algunos estudios más pequeños han señalado que la localización del electrodo en el ventrículo derecho puede desempeñar un papel en la respuesta al TRC. En algunos ensayos, la posición apical ventricular derecha del electrodo ha dado peores resultados que las posiciones más altas en el tabique ventricular derecho o en el infundíbulo, lo que podría explicarse porque el marcapasos apical crea una activación más heterogénea y, por lo tanto, más disincronía. Se necesitan datos a mayor escala para explorar con más detalle esta cuestión.
Paso 4. Verificación del efecto de resincronización mecánica mediante ecocardiografíaLa evaluación ecocardiográfica inmediatamente después de la implantación del dispositivo o durante los procedimientos de seguimiento aporta una información más detallada sobre la respuesta y sobre los pacientes que no responden al TRC. El perfil de llenado transmitral mejora de forma aguda en la mayoría de los pacientes con el inicio del TRC. Sin embargo, si continúa siendo demasiado corto (inferior al 40-45% de la duración del ciclo correspondiente) o si sigue alterado, puede optimizarse con el cambio del retraso AV en la programación del dispositivo. El ensayo SMART AV puso de manifiesto que los pacientes con un retraso AV normal no obtenían efecto beneficioso con la optimización AV guiada por ecocardiografía o por el dispositivo, en comparación con lo observado en contextos empíricos; sin embargo, en este estudio prospectivo y aleatorizado no se incluyó a pacientes con conducción AV prolongada21. Otros datos indican que los pacientes con un intervalo AV largo obtienen efecto beneficioso con la optimización del retraso AV22. Ante un paciente sin respuesta y unos parámetros de llenado transmitral patológicos, se sugiere optimizar el retraso AV, preferiblemente con ecocardiografía. Es de destacar que el retraso AV óptimo se modifica con el tiempo; por consiguiente, se recomienda una evaluación adicional del patrón de llenado transmitral y del retraso AV cada 6 meses.
Otros marcadores importantes son la reducción inmediata de la insuficiencia mitral funcional y el aumento agudo del dP/dt del VI23. Los cambios hemodinámicos agudos que se producen con el TRC pueden ser objeto de monitorización latido a latido mediante el inicio o el cese del marcapasos VI.
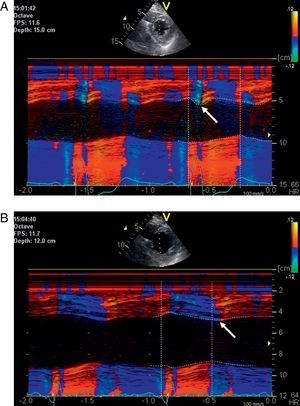
El flash septal presistólico es un marcador sensible de la disincronía y predice una respuesta favorable en el TRC (Figura 4A y B). Si se observa un flash septal en un paciente sin respuesta al TRC, indica un diagnóstico de disincronía grave que podría deberse a una posición no óptima del electrodo o a unos ajustes no óptimos del dispositivo; se recomienda una optimización VV.
Figura 4. Imágenes de ecocardiografía del paciente de la figura 1 . A: movimiento sistólico inicial hacia dentro del tabique (flash septal, flecha blanca) antes del tratamiento de resincronización durante el bloqueo de la rama izquierda del haz de His. B: normalización del movimiento del tabique con desaparición del flash septal y movimiento hacia dentro máximo tardío del tabique (flecha blanca) durante el tratamiento de resincronización cardiaca activo con una ligera preactivación del ventrículo izquierdo (–20 ms).
Las evaluaciones adicionales incluyen confirmar o descartar disincronía mecánica interventricular o intraventricular del VI. La disincronía mecánica interventricular se mide mediante la diferencia del intervalo de preeyección aórtica y pulmonar. Su descenso inmediato muestra una resincronización efectiva. La disincronía intraventricular puede evaluarse mediante técnicas de imagen de Doppler tisular con codificación de color, que se miden con la desviación estándar del tiempo transcurrido desde el inicio del QRS hast las velocidades longitudinales máximas (Ts) en los segmentos basal y medio de las paredes inferoseptal, lateral, inferior, anterior, anteroseptal y posterior, en un modelo de 12 segmentos. Algunos datos indican que la disincronía de la deformación del corazón (strain) bidimensional (2D) basada en el examen de rastreo de marcas (speckle tracking) 2D es una medida mejor y más reproducible de la disincronía que la que proporcionan las técnicas de imagen de velocidad tisulares para el seguimiento de los cambios de la disincronía mecánica con el TRC. Las técnicas de ecocardiografía tridimensionales (3D) analizan el movimiento regional de la pared con el empleo de los desplazamientos regionales en 3D y, por consiguiente, calculan el strain 3D. La disincronía se evalúa con técnicas de imagen paramétricas de forma cualitativa o cuantitativa mediante la suma regional de los desplazamientos de la pared del VI24. La medición de la disincronía 3D evalúa todos los segmentos del VI y nos permite mostrar también los patrones de disincronía apical aislados.
La presencia o incluso el agravamiento de la disincronía interventricular es un problema frecuente en los pacientes que no responden al TRC. La optimización VV es un instrumento útil para corregir la disincronía intraventricular mediante la programación del dispositivo. Dado que los ajustes óptimos del retraso VV son muy variables en los pacientes con TRC, se recomienda una optimización VV con ecocardiografía. Los índices habituales de disincronía en las imágenes Doppler tisulares no reflejan claramente los cambios de los parámetros hemodinámicos. Por consiguiente, se prefieren los parámetros hemodinámicos (volumen de eyección del VI) al guiar la optimización VV con la ecocardiografía. Si la eliminación de la disincronía intraventricular no es posible en los pacientes sin respuesta al TRC; puede ser necesaria una modificación del electrodo del VI o incluso una suspensión del TRC en ciertos casos25.
Una nueva opción terapéutica en los pacientes sin respuesta al TRC es la modulación de la contractilidad cardiaca, según lo descrito por Nagele et al26. La modulación de la contractilidad cardiaca aplica una estimulación de alta energía no excitatoria durante el periodo refractario absoluto, con lo que aumenta la entrada de Ca y, por lo tanto, mejora la contractilidad en los pacientes con IC, sobre todo en los que presentan QRS estrecho y reducción de la FEVI. Se trató con éxito a un total de 16 pacientes sin respuesta al TRC con el empleo de modulación de la contractilidad cardiaca; sin embargo, un segundo procedimiento podría suponer un riesgo adicional para los pacientes26.
Paso 5. Verificación de la medicaciónEs frecuente que los pacientes sin respuesta reciban un tratamiento médico inadecuado. Mullens et al25 indican que hasta un 24% de los pacientes no tomaban uno de los fármacos prescritos para el tratamiento de la IC. La suspensión de la medicación se da con frecuencia con el agravamiento de la IC, la disfunción renal progresiva o cuando se produce un efecto secundario. Tiene gran importancia reiniciar el tratamiento médico y aumentar suficientemente la posología según lo indicado en las guías actuales. Los pacientes con arritmias auriculares o ventriculares de nuevo inicio podrían requerir, además, fármacos antiarrítmicos. No sólo es esencial la prescripción de la medicación, sino también una evaluación cuidadosa del cumplimiento del paciente en cuanto a la medicación y la restricción de líquidos.
Paso 6. Verificación de las comorbilidadesLos pacientes ancianos presentan varias comorbilidades, como diabetes, cardiopatía isquémica y enfermedades vasculares y cerebrales, que comportan un mayor riesgo de mortalidad por cualquier causa y que podrían atenuar los efectos beneficiosos del TRC. La reducción de la función renal, la anemia y la hipotensión se asocian a un mal pronóstico en los pacientes tratados con TRC.
La etiología de la enfermedad subyacente desempeña también un papel importante. El ensayo MADIT-CRT puso de relieve que los pacientes isquémicos y no isquémicos obtenían un beneficio clínico similar en la IC levemente sintomática o asintomática; sin embargo, los pacientes no isquémicos mostraron un remodelado inverso más pronunciado que el de los pacientes isquémicos. El beneficio clínico fue significativamente diferente dentro de los subgrupos de riesgo de los pacientes isquémicos y no isquémicos, lo cual indica que la evaluación del riesgo debe basarse en la etiología subyacente de la IC27.
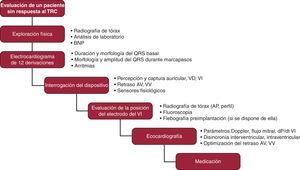
ConclusionesLa falta de respuesta al TRC es un problema frecuente, que exige una evaluación compleja de los datos electrocardiográficos y ecocardiográficos basales y posteriores al TRC, así como interrogar el dispositivo, valorar la posición del electrodo y optimizar cuidadosamente el tratamiento médico (Figura 5). En caso de agravamiento del estado hemodinámico, se podría considerar el cese del TRC. Con la optimización de la respuesta individual en sus diversos aspectos, se aumentará al máximo el efecto beneficioso del TRC.
Figura 5. Propuesta de evaluación escalonada en los pacientes sin respuesta al tratamiento de resincronización cardiaca. AP: anteroposterior; AV: auriculoventricular; BNP: péptido natriurético cerebral; TRC: tratamiento de resincronización cardiaca; VD: electrodo ventricular derecho; VI: electrodo ventricular izquierdo; VV: ventriculoventricular.
Conflicto de interesesValentina Kutyifa ha recibido honorarios por consultoría de Boston Scientific, Biotronik y Servier. Ole A. Breithardt ha recibido honorarios por conferencias de GE Healthcare, Alemania.
Full English text available from: www.revespcardiol.org
Autor para correspondencia: Medizinische Klinik 2, Universitätsklinikum Erlangen, Ulmenweg 18, DE-91054 Erlangen, Alemania. ole.breithardt@uk-erlangen.de