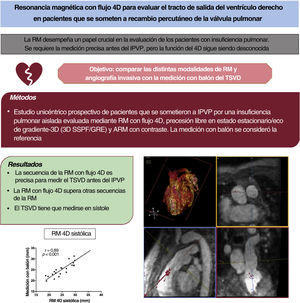
La resonancia magnética (RM) con flujo 4D suele utilizarse para evaluar el ventrículo derecho y las arterias pulmonares antes del implante percutáneo de la válvula pulmonar (IPVP). Como el IPVP está limitado por el tamaño del tracto de salida del ventrículo derecho (TSVD), se necesita medirlo con precisión para planificar la intervención. El objetivo del presente estudio es comparar diferentes modalidades de RM con la medición invasiva del TSVD con balón.
MétodosEstudio unicéntrico prospectivo de pacientes sometidos a IPVP por insuficiencia pulmonar aislada evaluada mediante RM con flujo 4D, precesión libre en estado estacionario/gradiente eco 3D (3D SSFP/GRE) y angiografía por RM con contraste. La medición con balón se consideró la referencia.
ResultadosSe incluyó a 23 adultos (media de edad, 38,4±12,5 años). En 18 pacientes el IPVP fue exitoso. El diámetro medio del TSVD más pequeño fue de 25,4±4,3 mm medido con balón y 25,6±3,8 mm y 21,8±3,6 mm por RM con flujo 4D en sístole y diástole respectivamente. Comparados con los medidos con balón, los diámetros de TSVD se correlacionaron mejor cuando se estimaron mediante RM con flujo 4D sistólico (r=0,89; p<0,001) que mediante RM con flujo 4D diastólico (r=0,71; p<0,001), angiografía por R; 3D con contraste (r=0,73; p<0,001) o 3D SSFP/GRE (r=0,50; p=0,04), y no se correlacionaron de manera significativa cuando se realizaron en 2D en diástole o sístole. La diferencia media entre la RM con flujo 4D sistólico y la medición con balón fue de 0,2 mm (IC95%, –3,5 a 3,9 mm), en tanto que con las otras técnicas fue mayor.
ConclusionesAdemás de la cuantificación de la insuficiencia de la válvula pulmonar, la RM con flujo 4D permite una estimación fiable de los diámetros del TSVD, sobre todo en sístole, lo que es fundamental antes de planificar el IPVP.
Palabras clave
La disfunción del tracto de salida del ventrículo derecho (TSVD) es una preocupación importante en adultos con cardiopatía congénita (CC). A partir de los 40 años, la incidencia acumulada de recambio de la válvula pulmonar (RVP) de los pacientes con tetralogía de Fallot es de aproximadamente el 50%1.
La resonancia magnética (RM) es fundamental a la hora de decidir el recambio de válvula pulmonar (RVP) de los pacientes con disfunción del TSVD, tal como destacan las guías vigentes2,3. La RM evalúa con precisión la dilatación y la disfunción del ventrículo, así como la gravedad de la insuficiencia pulmonar4.
Desde 2000, el implante percutáneo de la válvula pulmonar (IPVP) ha surgido como una alternativa al reemplazo quirúrgico5,6. Sin embargo, la idoneidad de los dispositivos sigue siendo una cuestión importante. En un estudio, casi la mitad de los pacientes que acudieron para someterse a un cateterismo no se hicieron un IPVP, principalmente por el tamaño prohibitivo del TSVD, sobre todo cuando no está obstruido7. Es necesaria una evaluación precisa de la morfología y el tamaño del TSVD mediante mediciones no invasivas para mejorar la selección de los pacientes que pueden beneficiarse de un IPVP y de aquellos que se someterán directamente a una intervención quirúrgica.
El flujo 4D como imagen volumétrica de contraste de fase con resolución temporal y codificación de velocidad en 3 direcciones se está convirtiendo en una parte de la evaluación exhaustiva de la CC en la RM8–10. Además de la información hemodinámica y de flujo11, la RM con flujo 4D proporciona información anatómica volumétrica con resolución temporal que puede ser adecuada para medir con precisión el TSVD a lo largo del ciclo cardiaco sin añadir tiempo de exploración.
El objetivo de este estudio es comparar las mediciones del TSVD nativo entre las distintas secuencias de imagen de la RM, tal como el flujo 4D, y los resultados del cateterismo.
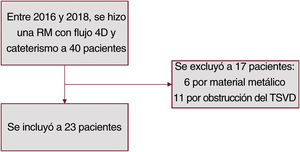
MÉTODOSEste estudio unicéntrico incluyó, durante un periodo de 24 meses, a 23 pacientes consecutivos que se sometieron a cateterismo para un IPVP entre 2016 y 2018. Antes del IPVP se hizo una RM a todos los pacientes (figura 1).
Los criterios de inclusión fueron: pacientes adultos (< 18 años) con insuficiencia pulmonar relacionada con CC evaluada mediante RM y que requerían IPVP según el tratamiento habitual.
Los criterios de exclusión fueron: los pacientes con material metálico previo en el árbol pulmonar, marcapasos cardiaco o desfibrilador. También se excluyó a los pacientes con obstrucción residual significativa del TSVD, evaluados mediante ecocardiografía transtorácica. Se definió como obstrucción significativa un gradiente máximo entre el ventrículo derecho y la arteria pulmonar > 50 mmHg o una presión sistólica del ventrículo derecho por encima de la mitad de la presión sistémica. El comité ético de la institución aprobó este protocolo de investigación (CPP n.o 2014-11-06) y se obtuvo el consentimiento individual y la firma de cada paciente.
El mismo operador (G. Soulat) hizo todas las mediciones de la RM retrospectivamente y sin tener en cuenta las mediciones del cateterismo. Las mediciones de la RM no sirvieron para orientar la remisión a IPVP o RVP quirúrgico. Desde 2019, nuestro centro utiliza la RM de flujo 4D para aconsejar la remisión a cateterismo o intervención quirúrgica. Como referencia se utilizó la medición con balón durante el IPVP. Por protocolo habitual, no se hizo ninguna tomografía computarizada (TC) a los pacientes.
Protocolo del cateterismo y análisis de los datosPara el IPVP se empleó anestesia general y una guía fluoroscópica monoplanar (Siemens Medical Solutions, Alemania) con un enfoque estandarizado12. La angiografía del TSVD se hizo en 2 planos ortogonales para evaluar y medir el sitio propuesto para implantar el dispositivo. Las mediciones con angiografía pulmonar invasiva (API) se hicieron en sístole y en diástole. A continuación, se hizo la medición con un balón Tyshak distensible de 30 mm (NuMed, Estados Unidos). Las mediciones se hicieron en 2 planos ortogonales, y en cada uno de los métodos (API diastólica, API sistólica y medición con balón) se midió y promedió el diámetro mínimo del TSVD ([diámetro 1 + diámetro ortogonal 2] / 2). Todas las mediciones del cateterismo se hicieron después de medir hasta una distancia conocida en el TSVD (catéter angiográfico multitrack o balón Tyshak).
Para el IPVP se utilizaron varios métodos con la válvula Melody (Medtronic, Estados Unidos) o más recientemente con la válvula SAPIEN (Edwards Lifesciences, Estados Unidos)6,13,14.
Protocolo de la resonancia magnética y análisis de los datosLas exploraciones con RM se hicieron en un sistema de 1,5 o 3 T (sistemas Signa HDxT, Artist, Discovery MR 750w, o Architect, GE Healthcare, Estados Unidos) con una bobina de superficie de disposición fásica de 8 o 32 canales. Las secuencias cinerradiográficas de precesión libre en estado estacionario (SSFP) previas al contraste se adquirieron en las proyecciones axial, del eje largo y del eje corto en apnea para abarcar todo el VD, tal como se recomienda15. Se adquirieron sucesivamente secuencias sincronizadas de SSFP 3D en diástole a 1,5 T (parámetros radiológicos: resolución espacial, 2,1 × 2,1 × 3,6 mm; ángulo de inclinación, 65̊; TR, 3,6ms; TE, 1,6ms) o de eco de gradiente 3D a 3 T (parámetros radiológicos: resolución espacial, 2,2 × 2,2 × 2,8 mm; ángulo de inclinación, 20̊; TR, 3,1ms; TE, 1,3ms) y 3 secuencias cinerradiográficas de SSFP 2D en los planos ortogonal al TSVD (parámetros radiológicos: resolución espacial, 7,0 × 1,8 × 2,1; ángulo de inclinación, 50̊; TR, 3,1ms; TE, 1,32 ms), ortogonal a las áreas mínimas y obtenidas en una sola apnea. Por último, también se adquirió una angiografía por RM (ARM) 3D con contraste y sin sincronizar a 1,5 y 3 T (parámetros radiológicos: resolución espacial, 0,7-0,8 × 1,9-2,2 × 2,4-3,0 mm; ángulo de inclinación, 25-30̊; TR, 3,2-3,9ms; TE, 1,1-1,3 ms) del árbol pulmonar en una sola contención de la respiración (figura 2). Habitualmente se inyectaba contraste de gadolinio 0,20 mmol/kg (gadobenato de dimeglumina o gadoterato de meglumina) durante la adquisición de la RM.
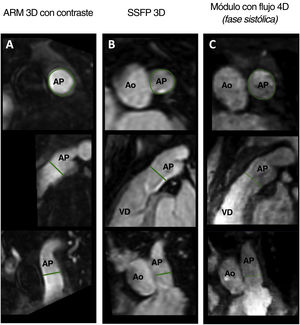
Ejemplo de medición del tracto de salida del ventrículo derecho (TSVD). Tres planos perpendiculares del TSVD en la misma localización en el mismo paciente mediante angiografía por resonancia magnética (ARM) con contraste (A), precesión libre en estado estacionario (SSFP) 3D (B) y magnitud del flujo 4D en la fase sistólica (C). Se hicieron mediciones del diámetro en el plano perpendicular a la línea central (en la parte superior) y se promediaron. Ao: aorta; AP: arteria pulmonar; VD: ventrículo derecho.
El vídeo 1 del material adicional ilustra el interés de los métodos 4D (volumen tridimensional más tiempo) en el análisis de estas estructuras geométricas complejas que se mueven y orientan de un modo distinto a lo largo del tiempo.
Inmediatamente después de la inyección de gadolinio, se hizo la adquisición de una RM con flujo 4D sincronizada con el electrocardiograma (ECG) de 8 min de duración en una orientación de volumen sagital que cubría todo el volumen cardiaco. La secuencia de pulso consistió en una secuencia eco de gradiente sincronizada con el ECG retrospectivo con codificación de velocidad en 3 direcciones (velocidad de codificación, 250-450cm/s en todas las direcciones para evitar el solapamiento de velocidad en el TSVD).
Los parámetros radiológicos fueron: resolución espacial promedio, 2,0 × 2,4 × 1,8 mm; ángulo de inclinación, 15̊; TR, 4,2-5ms; TE, 1,60ms; ancho de banda, 62kHz; proyecciones por segmento, 2. En la resonancia basal se utilizaron las secuencias de investigación o clínicas disponibles. El posprocesado de flujo 4D se llevó a cabo con el software interno (Lattido, Universidad Favaloro-CONICET, Buenos Aires, Argentina, y Université de Paris, Francia). Para las mediciones se utilizó únicamente la imagen de magnitud, perpendicular a la línea central del vaso con reformateo multiplanar telediastólico y telesistólico.
En todas las técnicas tridimensionales, las mediciones se tomaron perpendicularmente a la línea central en la parte más estrecha del TSVD, desde el anillo pulmonar hasta la bifurcación pulmonar. Se promediaron los diámetros máximo y mínimo tal como se ilustra en la figura 2.
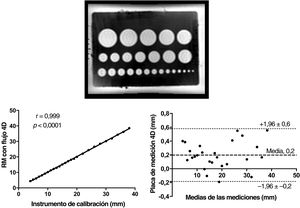
Estudio de simulaciónHasta donde se sabía, puesto que el flujo 4D no estaba validado para medir la longitud, se realizó un estudio de simulación para comprobar la precisión de las mediciones de diámetro y longitud. Se colocó una tabla de referencia de medición de dispositivos de oclusión del septo interauricular (con diámetros calibrados) en un depósito de agua que contenía una solución de gadolinio para que sirviera de simulación estacionaria para comprobar las secuencias clínicas (figura 2).
ReproducibilidadG. Soulat, con 7 años de experiencia en RM en la CC, realizó las mediciones mediante RM. Para evaluar la variabilidad entre observadores16, un segundo operador (Y. Alattar) con 3 años de experiencia y sin conocimiento de los resultados previos analizó parte de los datos del flujo 4D.
Análisis estadísticoLas variables basales se expresan en media±desviación estándar o mediana [intervalo intercuartílico], según sea el caso. Las correlaciones univariantes entre cada modalidad de las mediciones se comunicaron mediante los coeficientes de correlación de Pearson si se superaba la prueba de normalidad con la prueba de Shapiro-Wilk, y se representaron en un gráfico de Bland-Altman. Para comprobar la reproducibilidad de las mediciones con flujo 4D entre observadores, se calculó el coeficiente de correlación intraclase (CCI). Se utilizó un valor de p <0,05 para indicar la significación estadística. Se hizo un análisis con el software GraphPad Prism, versión 6 (GraphPad Software, Estados Unidos).
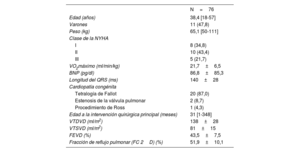
RESULTADOSEn la tabla 1 se resumen las características iniciales de los pacientes. La CC era una tetralogía de Fallot reparada con anterioridad en todos los pacientes menos en 3, con una media de edad de 38,4±12,5 años. Todos los pacientes presentaban un TSVD nativo, menos 1 que presentaba aloinjertos.
Características de los pacientes
| N=76 | |
|---|---|
| Edad (años) | 38,4 [18-57] |
| Varones | 11 (47,8) |
| Peso (kg) | 65,1 [50-111] |
| Clase de la NYHA | |
| I | 8 (34,8) |
| II | 10 (43,4) |
| III | 5 (21,7) |
| VO2máximo (ml/min/kg) | 21,7±6,5 |
| BNP (pg/dl) | 86,8±85,3 |
| Longitud del QRS (ms) | 140±28 |
| Cardiopatía congénita | |
| Tetralogía de Fallot | 20 (87,0) |
| Estenosis de la válvula pulmonar | 2 (8,7) |
| Procedimiento de Ross | 1 (4,3) |
| Edad a la intervención quirúrgica principal (meses) | 31 [1-348] |
| VTDVD (ml/m2) | 138±28 |
| VTSVD (ml/m2) | 81±15 |
| FEVD (%) | 43,5±7,5 |
| Fracción de reflujo pulmonar (FC 2D) (%) | 51,9±10,1 |
FC: fase de contraste; FEVD: fracción de eyección del ventrículo derecho; NYHA: New York Heart Association; VTDVD: volumen telediastólico del ventrículo derecho; VTSVD: volumen telesistólico del ventrículo derecho.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
En 18 de los 23 pacientes el IPVP fue satisfactorio. En 3 pacientes se hizo un IPVP con una válvula Edwards XT de 29 mm, en 8 pacientes se implantó una válvula clásica Melody de 22 mm y en el resto se practicaron varias técnicas para implantar la válvula Melody en un TSVD grande (enjaulamiento o método no convencional). En un paciente, el TSVD era demasiado grande para implantar una Melody y en una segunda fase se hizo un IPVP con una SAPIEN XT de 29 mm.
Precisión de las mediciones del diámetro con flujo 4D en la simulación
En la figura 3 se muestran las correlaciones y los gráficos de Bland-Altman. Los diámetros de la placa de medición oscilaron entre 4 y 38 mm. La diferencia media entre las estimaciones de diámetro con flujo 4D y con la simulación fue de 0,2±0,2 mm, con una sobrestimación máxima de hasta 0,6 mm para un diámetro que oscilaba entre 30 y 40 mm (1,7%). Las mediciones globales con flujo 4D fueron precisas y muy fiables con la placa de medición in vitro.
Precisión de la medición con flujo 4D, con una placa de medición para la comunicación interauricular. Fila superior: placa de medición de la RM con flujo 4D. Fila inferior: análisis de regresión lineal y análisis de Bland-Altman para comparar entre la placa de medición y la RM con flujo 4D. RM: resonancia magnética.
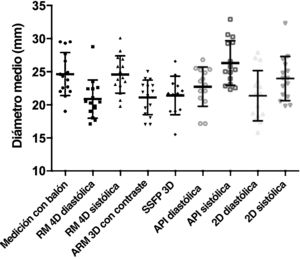
En la figura 4 se muestran los gráficos de las estimaciones de diámetro del TSVD entre las distintas secuencias de RM, así como entre la sístole y la diástole. El diámetro medio del TSVD fue de 25,4±4,3 mm según la medición con balón, 25,6±3,8 mm según la RM con flujo 4D en la sístole y 21,8±3,6 mm en la diástole.
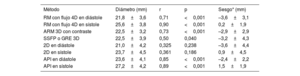
Comparación entre las mediciones obtenidas mediante resonancia magnética y las del cateterismoEn la tabla 2 se presentan las correlaciones entre cada modalidad de medición y la medición con balón. Los valores de 2D en la diástole y la sístole no se correlacionaron de manera significativa con la medición con balón (p=0,24 y p=0,19 respectivamente).
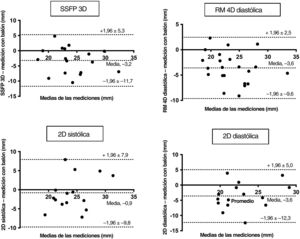
Comparación del flujo 4D, la ARM 3D, la SSFP 3D, 2D y la angiografía con la medición con balón como método de referencia
| Método | Diámetro (mm) | r | p | Sesgo* (mm) |
|---|---|---|---|---|
| RM con flujo 4D en diástole | 21,8±3,6 | 0,71 | <0,001 | –3,6±3,1 |
| RM con flujo 4D en sístole | 25,6±3,8 | 0,90 | <0,001 | 0,2±1,9 |
| ARM 3D con contraste | 22,5±3,2 | 0,73 | <0,001 | –2,9±2,9 |
| SSFP o GRE 3D | 22,5±3,9 | 0,50 | 0,040 | –3,2±4,3 |
| 2D en diástole | 21,0±4,2 | 0,325 | 0,238 | –3,6±4,4 |
| 2D en sístole | 23,7±4,5 | 0,361 | 0,186 | 0,9±4,5 |
| API en diástole | 23,6±4,1 | 0,85 | <0,001 | –2,4±2,2 |
| API en sístole | 27,2±4,2 | 0,89 | <0,001 | 1,5±1,9 |
API: angiografía pulmonar invasiva; ARM: angiografía por resonancia magnética; GRE: gradiente eco; RM: resonancia magnética; SSFP: precesión libre en estado estacionario.
En la figura 5 se muestran los gráficos de regresión lineal y de Bland-Altman donde se comparan la RM con flujo 4D en la sístole, la ARM 3D con contraste y la angiografía invasiva en la sístole y la diástole con la medición con balón.
El análisis de Bland-Altman (figura 5) confirmó la ausencia de sesgo significativo, con límites de concordancia del 95% relativamente estrechos para la RM con flujo 4D en la sístole. La magnitud de las diferencias observadas fue moderada, tal como se refleja en el 95% de los valores que oscilan entre –3,5 y 3,9 mm. Aunque la correlación entre la angiografía sistólica y diastólica, la RM 3D con contraste, la RM 4D diastólica y la SSFP 3D fueron buenas o moderadas, el análisis de Bland-Altman mostró un sesgo mayor (+1,5 mm, 2,4 mm, –2,9 mm, 3,6 y 3,2mm respectivamente) con límites de concordancia del 95% amplios (–2,3 a 5,3 mm; –6,7 a 2,0 mm; –8,7 a 2,8 mm; –11,7 a 5,3 mm y –9,6 a 2,5 mm respectivamente) (figura 5 y figura 6).
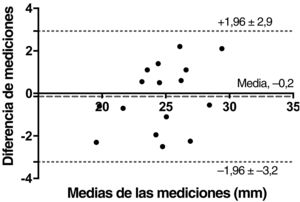
Reproducibilidad del flujo 4D sistólico entre observadoresLa reproducibilidad entre observadores de las estimaciones de la medición con flujo 4D fue muy buena con un ICC de 0,92 (intervalo de confianza del 95% [IC95%], 0,77-0,97; p <0,0001). El análisis de Bland-Altman confirmó la ausencia de sesgo significativo puesto que fue de –0,2±1,5 mm (figura 7).
DISCUSIÓNEn este estudio, la secuencia de RM con flujo 4D parecía ser un instrumento preciso para medir el TSVD nativo antes del IPVP, y superó las mediciones de la ARM 3D con contraste y la SSFP/GRE 3D, con una medición sistólica próxima a la medición con balón. Además, puesto que el tamaño del TSVD cambia a lo largo del ciclo cardiaco, el momento de la medición es crucial, y se observó que la medición sistólica tanto con flujo 4D como en la angiografía invasiva es la que más se aproxima a la medición con balón. Como el flujo 4D se utiliza cada vez más en la exploración con RM16, cuando se examina a pacientes con tetralogía de Fallot reparada para evaluar la insuficiencia pulmonar y la posible estenosis funcional asociada a lo largo del TSVD, los resultados fomentan el uso adicional de información anatómica para estimar mejor el tamaño sistólico máximo del TSVD antes de planificar el IPVP (figura 8).
Figura central. La secuencia de RM con flujo 4D es al parecer un instrumento preciso para medir el TSVD nativo antes del IPVP y supera las mediciones de otras modalidades de RM, con una medición sistólica próxima a la medición con balón. ARM: angiografía por resonancia magnética; GRE: gradiente eco; IPVP: implante percutáneo de la válvula pulmonar; RM: resonancia magnética; SSFP: precesión libre en estado estacionario; TSVD: tracto de salida del ventrículo derecho.
Además de la RM, en otros centros se utilizan sistemáticamente otras modalidades de diagnóstico por imagen para medir el TSVD. La TC tiene una resolución espacial excelente y permite estimar con precisión el tamaño y la anatomía del TSVD. No obstante, para evaluar el corazón a lo largo de todo el ciclo cardiaco o incluso con una resonancia sincronizada de manera prospectiva, la exposición a la radiación a menudo requiere más de 1 mSv de radiación con rayos X17. Tales cuestiones sobre el riesgo de radiación son cruciales en pacientes con CC. Cohen et al.18 observaron que el aumento de la exposición a dosis bajas de radiación ionizante por la obtención de imágenes cardiacas en adultos con CC suscitaba preocupación por el riesgo de neoplasia maligna a lo largo de la vida. Curiosamente, un gran número de procedimientos (≥ 6 procedimientos, como la TC) se relacionaron con un riesgo considerablemente elevado de cáncer (OR = 3,08; IC95%, 1,77-5,37). Aun así, el número de exposiciones a dosis bajas de radiación ionizante y de exposiciones que tuvieron lugar a edades más tempranas entre 1990 y el 2005 en pacientes con CC está aumentando19. Hasta la fecha, la guía fomenta evitar la TC en la medida de lo posible4.
El presente estudio proporciona información dinámica, con la RM con flujo 4D, sobre los cambios del TSVD durante el ciclo cardiaco. En este caso se observó un aumento de hasta el 20% del TSVD en la sístole, tal como se mostró anteriormente en el estudio con TC 4D20. Estas observaciones son importantes porque la mayoría de las ARM y las adquisiciones de registros de RM cardiaca del corazón entero con frecuencia se adquieren mayormente en diástole o incluso sin sincronización del ECG para reducir el tiempo de adquisición y la duración de la apnea21. Recientemente, en algunos estudios se ha confirmado la necesidad de realizar la adquisición en sístole21,22. La SSFP 2D fue muy poco eficaz, lo cual era de esperar puesto que los planos de la adquisición se localizaron durante la exploración de la RM previa en el entorno de formas complicadas del TSVD que entraban y salían de los planos durante el ciclo cardiaco. En el presente estudio, la ARM e incluso en mayor medida la SSFP/GRE 3D también produjeron resultados decepcionantes, que en el caso de la ARM pueden atribuirse a la ausencia de sincronización del ECG y a que las mediciones se hicieron en el periodo diastólico en el caso de la SSFP 3D22. El uso de un volumen sistólico en la SSFP sincronizada con el ECG llevaría probablemente a mejores resultados, pero esto no se evaluó22.
Otras técnicas de RM podrían ser una alternativa al flujo con 4D para obtener una adquisición volumétrica de resolución temporal del TSVD. La secuencia de la SSFP con resolución temporal requerirá una mayor validación y su disponibilidad no es amplia23. No obstante, la adquisición de registros de SSFP 3D sistólica o de resolución temporal específica del TSVD requeriría tiempo adicional de adquisición en los protocolos de la RM, ya de por sí largos en el contexto de la CC. Por otro lado, el flujo 4D ya tiende a incluirse en los protocolos de la RM en los pacientes con tetralogía de Fallot reparada y proporciona información útil relacionada con el flujo24–26. Con las imágenes de magnitud de flujo 4D posteriores al contraste para estimar la geometría del TSVD, no se requieren otras adquisiciones específicas para medir el TSVD, lo que simplifica el procedimiento. La mayor precisión de las mediciones con flujo 4D en sístole no fue ninguna sorpresa ya que, durante la eyección del VD en sístole, la calidad de las imágenes de fase y módulo es mucho mejor que durante la diástole, cuando las velocidades son muy inferiores, lo que produce más ruido y peor calidad de la imagen.
Por último, otra solución propuesta es un modelo cardiaco impreso en 3D para comprender mejor la anatomía y predecir el IPVP27,28. No obstante, la resolución espacial de la RM con flujo 4D es inferior a la de la TC, lo que limita su uso para la impresión cardiaca en 3D29. Además, la fusión de las distintas técnicas de obtención de imágenes podría ser útil para guiar las intervenciones, aunque la TC sigue siendo más apropiada que la RM en esta indicación a costa de la exposición a radiaciones30.
La medición precisa del TSVD para planificar el IPVP será incluso más importante en el futuro si se tiene en cuenta que uno de los mayores desafíos es expandir el IPVP a una más amplia población de pacientes, en especial a aquellos con TSVD nativo grande. Así pues, la válvula autoexpandible Venus P (Venus Medtech, China) ha recibido recientemente la marca CE31, mientras que la válvula autoexpandible Harmony TPV (Medtronic, Estados Unidos) recibió la aprobación de la Food and Drug Administration en 202132. Otros dispositivos se hallan en evaluación, como el adaptador de anclaje para la válvula de 29 mm SAPIEN 3 con Alterra Adaptive Prestent (Edwards Lifesciences, Estados Unidos)33. Estos nuevos dispositivos permitirían, en teoría, el IPVP en un TSVD nativo de hasta 40 mm y seguirían requiriendo una evaluación precisa del tamaño del TSVD nativo antes de practicar el IPVP. Aun así, aunque la fiabilidad de la medida con la RM con flujo 4D fue apropiada en el actual intervalo de valores del sistema, tiene que confirmarse para valores mayores.
LimitacionesEn primer lugar, a pesar de las características clínicas homogéneas, la población del presente estudio procedía de un único centro y el tamaño de la muestra era pequeño. Aunque la precisión fue buena y se constató una buena correlación con la medición con balón, la reproducibilidad de las medidas suscita cierta preocupación. Por su diseño, este estudio no evaluó el valor predictivo de las mediciones respecto al éxito del IPVP.
Puesto que la medición con balón era el patrón de referencia, se incluyó en el estudio solo a los pacientes remitidos a cateterismo. Puede existir un posible sesgo, puesto que solo se incluyó a los pacientes considerados apropiados para el IPVP según el tratamiento de referencia después de excluir a aquellos cuyo TSVD se consideró demasiado grande. Tampoco pudo analizarse la eficacia del flujo 4D para excluir a los pacientes con un TSVD muy grande, que sigue siendo una contraindicación para las intervenciones quirúrgicas34.
Otra preocupación es el periodo de análisis, ya que a partir de 2019 se modificó el protocolo para remitir a los pacientes a cateterismo mediante RM 4D. En consecuencia, la inclusión de los pacientes fue anterior a ese momento, lo que permite comparar entre la RM 4D y la medición con balón y limita el sesgo.
CONCLUSIONESLa información anatómica de la RM con flujo 4D es precisa para medir el TSVD antes del IPVP y supera las secuencias de la RM habitual. El tamaño del TSVD cambia a lo largo del ciclo cardiaco y se observó que las mediciones sistólicas eran próximas a la medición con balón cuando se utilizaban como referencia. Se requieren más estudios para evaluar las mediciones con flujo 4D para predecir los resultados del IPVP y el éxito de su implementación.
FINANCIACIÓNLos autores declaran que esta investigación no ha recibido ninguna financiación.
CONTRIBUCIÓN DE LOS AUTORESG. Soulat concibió el trabajo, hizo la adquisición y el análisis, redactó el manuscrito y aprobó la versión final. E. Mousseaux concibió el trabajo, revisó el contenido intelectual y aprobó la versión final del manuscrito. Y. Alattar realizó la adquisición y el análisis y aprobó la versión final. G. Marcilhacy hizo la adquisición y el análisis y aprobó la versión final del manuscrito. U. Gencer realizó la adquisición y el análisis y aprobó la versión final. L. Iserin concibió el trabajo, revisó el contenido intelectual y aprobó la versión final del manuscrito. M. Ladouceur concibió el trabajo, revisó el contenido intelectual y aprobó la versión final del manuscrito. A. Legendre hizo adquisición parcial, revisó el contenido intelectual y aprobó la versión final del manuscrito. M. Laredo hizo adquisición parcial y el análisis, revisó el contenido intelectual y aprobó la versión final del manuscrito. D. Bonnet hizo adquisición parcial, revisó el contenido intelectual y aprobó la versión final del manuscrito. S. Malekzadeh hizo adquisición parcial, revisó el contenido intelectual y aprobó la versión final del manuscrito. G. Soulat concibió el trabajo, hizo la adquisición y el análisis, redactó el manuscrito y aprobó la versión final.
CONFLICTO DE INTERESESLos autores de este artículo afirman no tener relación alguna con ninguna de las empresas cuyos productos o servicios pueden estar relacionados con el tema del artículo.
- -
La RM con flujo 4D sirve para evaluar el ventrículo derecho y las arterias pulmonares.
- -
En la insuficiencia pulmonar es útil recurrir a la RM antes del implante percutáneo de la válvula pulmonar.
- -
Se utilizan las distintas secuencias de RM con flujo 4D, pero sigue desconociéndose el valor añadido.
- -
La secuencia de RM con flujo 4D es precisa para medir el TSVD antes del implante percutáneo de la válvula pulmonar.
- -
La RM con flujo 4D fue superior a las secuencias de RM habitual para medir el TSVD.
- -
En los pacientes con disfunción del TSVD, este tiene que medirse en la sístole.