Para lograr el éxito del dispositivo, se recomienda cierto sobredimensionamiento de la prótesis (SP) SAPIEN 3. Sin embargo, un aumento en el SP puede incrementar las tasas de implante de marcapasos definitivo (IMD). Por lo tanto, se investiga la influencia del SP en el fallo del dispositivo y el IMD.
MétodosSe trató con SAPIEN 3 a 804 pacientes en 3 centros. El SP, determinado mediante tomografía computarizada multicorte, se calculó y analizó como variable continua y categorizada en incrementos del 5%, con –4% a 0 como referencia.
ResultadosSe produjo fallo del dispositivo en el 8,8% de los pacientes. La mediana de SP fue menor en los pacientes con fallo del dispositivo que en aquellos con éxito (el +4 frente al +8%; p=0,038). El SP mostró un patrón de riesgo no lineal, con una tasa de fallo del dispositivo significativamente reducida para valores entre el +4 y el +22%. No hubo ningún caso de fuga paravalvular II+ entre un +10 y un +20% de SP. La tasa general de IMD fue del 16,2% y la mediana de SP fue significativamente mayor en los pacientes con IMD (IMD, el +9% frente a no IMD, el +7%; p=0,025), mientras que la profundidad del implante no varió entre pacientes con y sin IMD (6,9±1,7 frente a 6,6±1,9mm; p=0,101). El riesgo de IMD aumentó con el aumento del SP y fue mayor en las 2 categorías más altas.
ConclusionesEl incremento en el SP reduce el riesgo de fallo del dispositivo, pero aumenta el de IMD. No se halló un intervalo de SP ideal para minimizar los riesgos de fallo del dispositivo e IMD.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) tiene demostrada su superioridad frente al método convencional de cirugía de recambio de válvula aórtica para los pacientes con estenosis aórtica grave y alto riesgo quirúrgico1 y se ha probado recientemente que no es inferior en el caso de pacientes con riesgo intermedio2.
El desarrollo de nuevas prótesis valvulares percutáneas, así como la experiencia creciente en su implante, ha conducido a una mejora considerable de los resultados clínicos3,4. En este contexto, resulta crucial la elección del tamaño de la válvula protésica percutánea que mejor se ajuste a los parámetros del paciente. Así, en el presente estudio, para la elección de la prótesis valvular percutánea se emplearon con éxito las medidas del área del anillo aórtico obtenidas mediante tomografía computarizada multicorte (TCMC)5. Aunque se aconseja cierto grado de sobredimensionamiento de la prótesis (SP) al objeto de evitar las fugas paravalvulares (FPV)6, un SP excesivo exigiría nuevos implantes de marcapasos definitivos (IMD).
En el caso de la prótesis SAPIEN 3 (Edwards SAPIEN 3™ Heart Valve [S3]; Edwards Lifescience Corporation; Irvine, California, Estados Unidos), el propio fabricante establece unas recomendaciones de dimensionamiento de la prótesis según el SP calculado. Sin embargo, se desconoce la influencia de los distintos grados de SP en los riesgos de IMD y fallo del dispositivo. Además, hay incertidumbre respecto a un intervalo de SP ideal que minimice tanto el fallo del dispositivo como la necesidad del IMD.
Por lo tanto, se investiga el efecto del SP en el fallo del dispositivo y el IMD en una amplia población de pacientes sometidos a TAVI con la S3 en 2 centros hospitalarios distintos.
MÉTODOSPoblación de pacientes y procedimientosEl presente estudio es un subanálisis retrospectivo de un registro, publicado anteriormente, de pacientes consecutivos seleccionados prospectivamente a partir de una cohorte multicéntrica de pacientes tratados con TAVI, entre enero de 2014 y enero de 20168. Se practicaron TAVI por vía transfemoral con el dispositivo S3 a 810 pacientes con estenosis sintomática de la válvula aórtica nativa. Se excluyó a los pacientes (n=6) con resultados de la TCMC incompletos o no evaluables, lo que limitó el análisis a 804 pacientes. Con el propósito de valorar la incidencia de nuevos IMD, se excluyó a los pacientes portadores de marcapasos, de modo que quedaron 709 para la evaluación de nuevos IMD. Todos los pacientes dieron su consentimiento informado por escrito al procedimiento.
Evaluación de la tomografía computarizada multicorteEn cada centro hospitalario participante se obtuvieron las medidas del anillo aórtico a partir de la reconstrucción multiplanar de los datos extraídos de la TCMC, según las recomendaciones de la guía de práctica clínica de la Society of Cardiovascular Computed Tomography9, mediante una aplicación informática diseñada específicamente a dicho fin y aprobada por la Food and Drug Administration estadounidense (OsiriX MDTM 3.9.4, Pixmeo SARL; Ginebra, Suiza; o 3mensioTM, Pie Medical Imaging BV; Maastricht, Países Bajos). El área y el perímetro del anillo aórtico se determinaron a nivel del anillo virtual por planimetría directa. Se valoró visualmente la calcificación del aparato valvular aórtico a la altura de la cúspide aórtica y se clasificó en 2 grupos según fuera nula/leve frente a moderada/grave.
Definición de sobredimensionamiento de la prótesisEn el momento de la recogida de datos, la S3 se encontraba disponible en 3 tamaños de diámetro: 23, 26 y 29mm. Se calculó el SP en relación con el área anular de cada paciente (en porcentaje), según lo publicado previamente7, mediante la fórmula: (área nominal de la prótesis / área del anillo aórtico del paciente – 1)×100. El cardiólogo intervencionista que realizó el procedimiento tomó la decisión definitiva sobre el tamaño de la prótesis que debía implantarse. Distintos ejemplos de los diferentes grados de SP y de las dimensiones de expansión nominal de la S3, así como de las recomendaciones del fabricante acerca del dimensionamiento de la prótesis, se ilustran en la .
Estimación de la profundidad de la prótesisSe determinó la profundidad del implante de la prótesis en un laboratorio central (ISAResearch Center, Deutsches Herzzentrum München, Múnich, Alemania) a partir de la última aortografía que mostraba la prótesis en proyección ortogonal conforme a las descripciones de estudios previos7. Se trazó el anillo aórtico nativo en la intersección del nadir de los senos de Valsalva y se definió la profundidad del implante (en milímetros) como la distancia desde el anillo aórtico hasta la porción distal de la prótesis. Se utilizó para el cálculo de todas las medidas la aplicación informática QAngio® XA, versión 7.3 (Medis Medical Imaging Systems; Leiden, Países Bajos) con calibración isocéntrica, aprobada por la Food and Drug Administration. Se estimó la profundidad de la prótesis de 783/804 (97,4%) pacientes mediante una aortografía de evaluación del desplegamiento de la prótesis tras el implante. En caso de que se hubieran desplegado varias válvulas protésicas (n=9), se valoró la profundidad de la prótesis que se proyectase más interiormente en el tracto de salida del ventrículo izquierdo.
Seguimiento y definición de los objetivosLos objetivos del estudio fueron el fallo del dispositivo en la cohorte completa de pacientes (n=804) y un nuevo IMD a los 30 días en pacientes sin marcapasos al inicio del estudio (n=709). Se define fallo del dispositivo como el fracaso en la consecución del objetivo de éxito del dispositivo, según se plantea en el documento de consenso actualizado del Valve Academic Research Consortium-21, que es una variable combinada de ausencia de muerte durante el procedimiento, posicionamiento adecuado de una sola válvula protésica en su posición anatómica correcta y función normal de la prótesis (ausencia de desajuste paciente-prótesis, gradiente protésico medio <20 mmHg y ausencia de insuficiencia aórtica protésica moderada o grave). La decisión terapéutica con respecto al IMD se dejó a discreción del cardiólogo clínico encargado del paciente. Se clasificaron los datos conforme a las variables definidas en Valve Academic Research Consortium-210.
Análisis estadísticoLas variables continuas expresan media±desviación estándar o mediana [intervalo intercuartílico] y se compararon mediante la prueba de la t de Student para datos no apareados o la prueba de la U de Mann-Whitney, según correspondiera. Las comparaciones entre las variables discretas se efectuaron con la prueba de la χ2 o la prueba exacta de Fisher. Se evaluó la asociación del SP con el fallo del dispositivo en el análisis univariable. Además, se analizó la correlación del SP con cada objetivo mediante los modelos de regresión logística univariable y multivariable y se calcularon las odds ratio (OR) y sus respectivos intervalos de confianza del 95% (IC95%). Se ajustaron los modelos multivariables con las variables que alcanzaron un valor de p <0,1 en los análisis univariables.
Se evaluó la asociación de SP con ambos objetivos desde 2 enfoques: en primer lugar, se analizó el gradiente de riesgo en el continuo de SP con ambos resultados binarios empleando splines cúbicos restringidos con 4 nodos en los percentiles 5, 35, 65 y 95, según se ha publicado recientemente11. Se calcularon las OR (IC95%), del SP como variable continua para ambos objetivos. En segundo lugar, se estimó el SP en 7 categorías con incrementos del 5% de SP cada una: –5% e inferior, –4% a 0%,+1% a+5%,+6% a+10%,+11% a+15%,+16% a+20% y>+20%. Se tomó como referencia la categoría de valores entre el –4% y el 0% con su mediana en el –2%, que representa la categoría inferior dentro del intervalo de SP recomendado por el fabricante. También se aplicaron estos análisis a los 2 factores que contribuyeron al fallo del dispositivo, en concreto, una FPV II+y un gradiente elevado (≥ 20 mmHg).
Se consideró indicativo de significación estadística un valor de p bilateral <0,05 en todos los análisis. En los análisis se empleó el paquete estadístico Stata/MP®, versión 13.0 (StataCorp LLC; College Station, Texas, Estados Unidos).
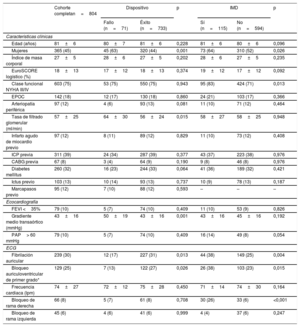
RESULTADOSEn total, conformaron la población del estudio 804 pacientes, cuyas características basales clínicas y tomográficas se recogen en la tabla 1 y la tabla 2. La media de edad fue de 81±6 años y la media del EuroSCORE logístico fue del 18±13%. Las características del procedimiento y de las complicaciones hospitalarias se muestran en la tabla 3. El TAVI se realizó manteniendo al paciente en sedación consciente en el 47% de los casos, y la mortalidad a los 30 días fue del 1,6%.
Características basales clínicas, ecocardiográficas y electrocardiográficas
| Cohorte completan=804 | Dispositivo | p | IMD | p | |||
|---|---|---|---|---|---|---|---|
| Fallo (n=71) | Éxito (n=733) | Sí (n=115) | No (n=594) | ||||
| Características clínicas | |||||||
| Edad (años) | 81±6 | 80±7 | 81±6 | 0,228 | 81±6 | 80±6 | 0,096 |
| Mujeres | 365 (45) | 45 (63) | 320 (44) | 0,001 | 73 (64) | 310 (52) | 0,026 |
| Índice de masa corporal | 27±5 | 28±6 | 27±5 | 0,202 | 28±6 | 27±5 | 0,235 |
| EuroSCORE logístico (%) | 18±13 | 17±12 | 18±13 | 0,374 | 19±12 | 17±12 | 0,092 |
| Clase funcional NYHA III/IV | 603 (75) | 53 (75) | 550 (75) | 0,943 | 95 (83) | 424 (71) | 0,013 |
| EPOC | 142 (18) | 12 (17) | 130 (18) | 0,860 | 24 (21) | 103 (17) | 0,366 |
| Arteriopatía periférica | 97 (12) | 4 (6) | 93 (13) | 0,081 | 11 (10) | 71 (12) | 0,464 |
| Tasa de filtrado glomerular (ml/min) | 57±25 | 64±30 | 56±24 | 0,015 | 58±27 | 58±25 | 0,948 |
| Infarto agudo de miocardio previo | 97 (12) | 8 (11) | 89 (12) | 0,829 | 11 (10) | 73 (12) | 0,408 |
| ICP previa | 311 (39) | 24 (34) | 287 (39) | 0,377 | 43 (37) | 223 (38) | 0,976 |
| CABG previa | 67 (8) | 3 (4) | 64 (9) | 0,190 | 9 (8) | 46 (8) | 0,976 |
| Diabetes mellitus | 260 (32) | 16 (23) | 244 (33) | 0,064 | 41 (36) | 189 (32) | 0,421 |
| Ictus previo | 103 (13) | 10 (14) | 93 (13) | 0,737 | 10 (9) | 78 (13) | 0,187 |
| Marcapasos previo | 95 (12) | 7 (10) | 88 (12) | 0,593 | – | – | – |
| Ecocardiografía | |||||||
| FEVI <35% | 79 (10) | 5 (7) | 74 (10) | 0,409 | 11 (10) | 53 (9) | 0,826 |
| Gradiente medio transaórtico (mmHg) | 43±16 | 50±19 | 43±16 | 0,001 | 43±16 | 45±16 | 0,192 |
| PAP> 60 mmHg | 79 (10) | 5 (7) | 74 (10) | 0,409 | 16 (14) | 49 (8) | 0,054 |
| ECG | |||||||
| Fibrilación auricular | 239 (30) | 12 (17) | 227 (31) | 0,013 | 44 (38) | 149 (25) | 0,004 |
| Bloqueo auriculoventricular de primer grado* | 129 (25) | 7 (13) | 122 (27) | 0,026 | 26 (38) | 103 (23) | 0,015 |
| Frecuencia cardiaca (lpm) | 74±27 | 72±12 | 75±28 | 0,450 | 71±14 | 74±30 | 0,164 |
| Bloqueo de rama derecha | 66 (8) | 5 (7) | 61 (8) | 0,708 | 30 (26) | 33 (6) | <0,001 |
| Bloqueo de rama izquierda | 45 (6) | 4 (6) | 41 (6) | 0,999 | 4 (4) | 37 (6) | 0,247 |
CABG: cirugía de revascularización aortoconaria; ECG: electrocardiograma; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMD: implante de marcapasos definitivo; NYHA: New York Heart Association; PAP: presión arterial pulmonar.
Los valores expresan media±desviación estándar o n (%).
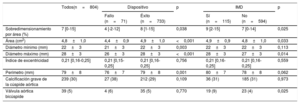
Medidas del anillo aórtico obtenidas en la TCMC
| Todos(n=804) | Dispositivo | p | IMD | p | |||
|---|---|---|---|---|---|---|---|
| Fallo (n=71) | Éxito (n=733) | Sí (n=115) | No (n=594) | ||||
| Sobredimensionamiento por área (%) | 7 [0-15] | 4 [-2-12] | 8 [1-15] | 0,038 | 9 [2-15] | 7 [0-14] | 0,025 |
| Área (cm2) | 4,8±1,0 | 4,4±0,9 | 4,9±1,0 | <0,001 | 4,9±0,9 | 4,8±1,0 | 0,033 |
| Diámetro mínimo (mm) | 22±3 | 21±3 | 22±3 | 0,003 | 22±3 | 22±3 | 0,113 |
| Diámetro máximo (mm) | 28±3 | 26±3 | 28±3 | <0,001 | 28±3 | 27±3 | 0,014 |
| Índice de excentricidad | 0,21 [0,16-0,25] | 0,21 [0,15-0,25] | 0,21 [0,16-0,25] | 0,756 | 0,21 [0,16-0,25] | 0,21 [0,16-0,25] | 0,559 |
| Perímetro (mm) | 79±8 | 76±7 | 79±8 | 0,001 | 80±7 | 78±8 | 0,062 |
| Calcificación grave de la cúspide aórtica | 239 (30) | 27 (38) | 212 (29) | 0,109 | 36 (31) | 185 (31) | 0,973 |
| Válvula aórtica bicúspide | 39 (5) | 4 (6) | 35 (5) | 0,770 | 19 (9) | 23 (4) | 0,025 |
IMD: implante de marcapasos definitivo; TCMC: tomografía computarizada multicorte.
Los valores expresan media±desviación estándar, n (%) o mediana [intervalo intercuartílico].
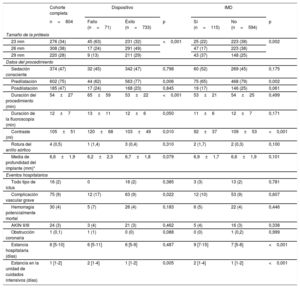
Características del procedimiento y resultados hospitalarios
| Cohorte completa | Dispositivo | IMD | |||||
|---|---|---|---|---|---|---|---|
| n=804 | Fallo (n=71) | Éxito (n=733) | p | Sí (n=115) | No (n=594) | p | |
| Tamaño de la prótesis | |||||||
| 23 mm | 276 (34) | 45 (63) | 231 (32) | <0,001 | 25 (22) | 223 (38) | 0,002 |
| 26 mm | 308 (38) | 17 (24) | 291 (49) | 47 (17) | 223 (38) | ||
| 29 mm | 220 (28) | 9 (13) | 211 (29) | 43 (37) | 148 (25) | ||
| Datos del procedimiento | |||||||
| Sedación consciente | 374 (47) | 32 (45) | 342 (47) | 0,798 | 60 (52) | 269 (45) | 0,175 |
| Predilatación | 602 (75) | 44 (62) | 563 (77) | 0,006 | 75 (65) | 468 (79) | 0,002 |
| Posdilatación | 185 (47) | 17 (24) | 168 (23) | 0,845 | 19 (17) | 146 (25) | 0,061 |
| Duración del procedimiento (min) | 54±27 | 65±59 | 53±22 | <0,001 | 53±21 | 54±25 | 0,499 |
| Duración de la fluoroscopia (min) | 12±7 | 13±11 | 12±6 | 0,050 | 11±6 | 12±7 | 0,171 |
| Contraste (ml) | 105±51 | 120±68 | 103±49 | 0,010 | 92±37 | 109±53 | <0,001 |
| Rotura del anillo aórtico | 4 (0,5) | 1 (1,4) | 3 (0,4) | 0,310 | 2 (1,7) | 2 (0,3) | 0,100 |
| Media de profundidad del implante (mm)* | 6,6±1,9 | 6,2±2,3 | 6,7±1,8 | 0,079 | 6,9±1,7 | 6,6±1,9 | 0,101 |
| Eventos hospitalarios | |||||||
| Todo tipo de ictus | 16 (2) | 0 | 16 (2) | 0,385 | 3 (3) | 13 (2) | 0,781 |
| Complicación vascular grave | 75 (9) | 12 (17) | 63 (9) | 0,022 | 12 (10) | 53 (9) | 0,607 |
| Hemorragia potencialmente mortal | 30 (4) | 5 (7) | 26 (4) | 0,183 | 6 (5) | 22 (4) | 0,446 |
| AKIN II/III | 24 (3) | 3 (4) | 21 (3) | 0,462 | 5 (4) | 16 (3) | 0,338 |
| Obstrucción coronaria | 1 (0,1) | 1 (1) | 0 (0) | 0,088 | 0 (0) | 1 (0,2) | 0,999 |
| Estancia hospitalaria (días) | 6 [5-10] | 6 [5-11] | 6 [5-9] | 0,487 | 9 [7-15] | 7 [5-8] | <0,001 |
| Estancia en la unidad de cuidados intensivos (días) | 1 [1-2] | 2 [1-4] | 1 [1-2] | 0,005 | 2 [1-4] | 1 [1-2] | <0,001 |
AKIN: clasificación de la Acute Kidney Injury Network; IMD: implante de marcapasos definitivo.
Los valores expresan media±desviación estándar, n (%) o mediana [intervalo intercuartílico].
Se emplearon los tamaños de prótesis de 23, 26 y 29 mm en el 34, el 38 y el 28% de los pacientes respectivamente. La mediana de SP fue del 7% (0-15%) y en el 80% de los casos se encontraba dentro del intervalo de SP recomendado por el fabricante. La ilustra la mediana de los valores de SP para cada categoría, así como las tasas de dilatación y la distribución del tamaño de la prótesis dentro de cada una de ellas.
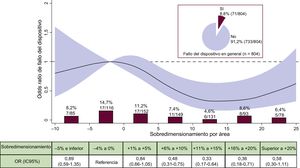
Fallo del dispositivoEl fallo del dispositivo se produjo en el 8,8% de los pacientes y los factores individuales que contribuyeron a este desenlace se muestran en la . Las características basales del procedimiento y tomográficas de los pacientes según el fallo del dispositivo se presentan en la tabla 1, la tabla 2 y la tabla 3. La mediana de SP fue significativamente menor en los pacientes con fallo del dispositivo que para aquellos en los que se logró el éxito del dispositivo (el 4% [–2 a 12] frente al 8% [1 a 15]; p=0,038).
Como variable continua y aplicando la premisa de linealidad del riesgo, el SP no mostró asociación con el riesgo de fallo del dispositivo en el análisis univariable (OR=0,986; IC95%, 0,965-1,012; p=0,131, por cada % de incremento), ni en el multivariable (OR, 0,997; IC95%, 0,971-1,024; p=0,838, por cada % de incremento) (). Ahora bien, cuando se analizó el gradiente de riesgo empleando splines cúbicos restringidos (figura 1), se detectó una asociación no lineal del SP con el fallo del dispositivo, con la consiguiente reducción significativa de riesgo dentro del grado de SP recomendado por el fabricante, con valores entre el+5% y el+20% respecto a la categoría de referencia. La figura 1 ofrece, además, las tasas brutas y OR de fallo del dispositivo por cada categoría de SP. La tasa de fallo del dispositivo fue superior (14,7%) en la categoría de referencia (SP, –4% a 0%) e inferior en la categoría de valores entre el+11% y el+15% (4,6%; OR=0,33; IC95%, 0,17-0,64).
Incidencia y riesgo de fallo del dispositivo según el sobredimensionamiento de la prótesis. Tasa bruta de fallo del dispositivo (%, n/N) por categorías de sobredimensionamiento de la prótesis en porcentaje. OR con su IC95% (área en rojo) de fallo del dispositivo según el sobredimensionamiento de la prótesis en porcentaje. IC95%: intervalo de confianza del 95%; OR: odds ratio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
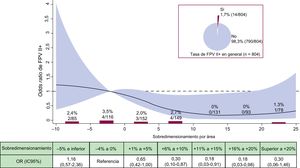
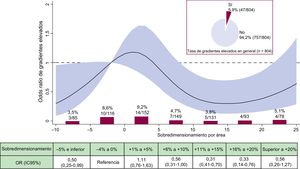
La recopila los factores individuales que contribuyeron al fallo/éxito del dispositivo por categorías de SP. La figura 2 y la figura 3 detallan las tasas brutas y el riesgo de FPV II+y los gradientes elevados (≥ 20 mmHg) por SP respectivamente. En general, se identificó la FPV de tipo II+en el 1,7% de los pacientes. La figura 2 ilustra que no se produjo ninguna FPV II+dentro de la horquilla de valores entre el+11% y el+20% de SP, que abarca las 2 categorías más amplias en el intervalo de dimensionamiento de la prótesis recomendado. Por su parte, la figura 3 muestra que un incremento de SP originó un descenso de la tasa y del riesgo de gradientes elevados. Comparado con la categoría de referencia, el riesgo de gradientes elevados se redujo significativamente en el intervalo entre el+9% y el+21% de SP.
Incidencia y riesgo de FPV II+según el sobredimensionamiento de la prótesis. Tasa bruta de FPV II+(%, n/N) por categorías de sobredimensionamiento de la prótesis en porcentaje. OR con su IC95% (área en rojo) de FPV II+según el sobredimensionamiento de la prótesis en porcentaje. FPV: fuga paravalvular; IC95%: intervalo de confianza del 95%; OR: odds ratio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Incidencia y riesgo de gradientes elevados (≥ 20mmHg) según el sobredimensionamiento de la prótesis. Tasa bruta de gradientes elevados (%, n/N) por categorías de sobredimensionamiento de la prótesis en porcentaje. OR con su IC95% (área en rojo) de gradientes elevados según el sobredimensionamiento de la prótesis en porcentaje. IC95%: intervalo de confianza del 95%; OR: odds ratio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
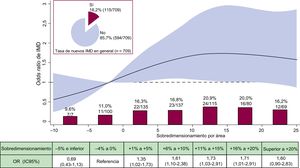
La incidencia general de nuevos IMD a los 30 días fue del 16,2%. Las variables basales clínicas y tomográficas y las características del procedimiento según el IMD se muestran en la tabla 1, la tabla 2 y la tabla 3. El motivo principal para un IMD fue la transitoriedad o persistencia del bloqueo auriculoventricular de tipo III en el 56,5% de los pacientes (para información detallada, véase la ). La mediana de grado de SP fue significativamente mayor en los pacientes con IMD frente a aquellos sin IMD (el 9% [2 a 15] frente al 7% [0 a 14]; p=0,025); además, el riesgo de IMD se incrementó de manera significativa con el aumento del SP (OR=1,021; IC95%, 1,002-1,042; p=0,039, por cada % de incremento). No se hallaron diferencias significativas en la profundidad del implante entre los pacientes con IMD frente a aquellos sin IMD (tabla 3).
En el análisis multivariable, el SP se mantuvo como un predictor independiente de nuevo IMD (por cada % de incremento) (OR=1,028; IC95%, 1,005-1,051; p=0,017) con independiencia de la profundidad del implante. La muestra los resultados pormenorizados del análisis multivariable.
La forma funcional del SP para predecir el IMD reveló un gradiente de riesgo casi lineal, generándose un menor riesgo a valores inferiores y un riesgo elevado para valores entre el+3% y el+18% respecto a la categoría de referencia. No se detectó un incremento del riesgo en valores> 15% (figura 4). Las tasas brutas por categorías muestran las tasas de IMD más bajas en las 2 categorías inferiores de SP, a saber, la categoría de referencia y la del valor del –5% e inferior (figura 4). Se produjo un incremento escalonado en cada intervalo de la categoría de SP. Dentro del intervalo de dimensionamiento de la prótesis recomendado, en las 2 categorías superiores de SP (entre el+11% y el+15%, y entre el+16% y el+20%) se encontraron las tasas de IMD más altas, del 20,9 y el 20,0% respectivamente.
Incidencia y riesgo de IMD según el sobredimensionamiento de la prótesis. Tasa bruta de IMD (%, n/N) por categorías de sobredimensionamiento de la prótesis en porcentaje. OR con su IC95% (área en rojo) de IMD según el sobredimensionamiento de la prótesis en porcentaje. IC95%: intervalo de confianza del 95%; IMD: implante de marcapasos definitivo; OR: odds ratio. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se evaluó el efecto del SP con el sistema S3 sobre el fallo del dispositivo y el IMD en una amplia cohorte tratada con TAVI de 3 centros hospitalarios con gran volumen de pacientes. Se demostró que un aumento de SP se traduce en una disminución significativa del fallo del dispositivo, aunque conlleva, al mismo tiempo, un incremento del riesgo de IMD, incluso dentro de los intervalos de dimensionamiento de la prótesis recomendados. No se halló un intervalo ideal en el que se minimizara el riesgo para ambos objetivos.
Sobredimensionamiento de la prótesis y fallo del dispositivoLa función del dimensionamiento y del SP guiados por TCMC se ha investigado, principalmente, con el fin de abordar las FPV6. En el caso de la S3, se ha demostrado que para prevenir la FPV requiere un menor SP que su antecesor, el sistema SAPIEN XT®12. En un estudio anterior sobre el SAPIEN XT® se publicó que con un SP discreto entre el+5% y el+10% se obtienen menores tasas de FPV II+que con un infradimensionamiento relativo13. Una investigación reciente sobre el uso de la válvula percutánea autoexpandible Medtronic CoreValve® ha evidenciado además que el aumento de SP muestra un efecto positivo en la tasa de FPV14.
En el presente estudio, al aumentar el SP, se obtuvo una respuesta no lineal en la predicción del fallo del dispositivo. En cuanto al fallo del dispositivo, se detectó el intervalo de SP ideal en los valores entre el+10 y el+20%. Es preciso mencionar que, incluso en esta amplia población que incluye a más de 800 pacientes, no se halló ningún caso de FPV II+dentro de dicho intervalo, lo cual se asocia con un descenso significativo del riesgo. Así pues, en lo que respecta al fallo del dispositivo y en especial a las FPV, parece recomendable la elección de una amplitud de SP entre el+10% y el+20% al objeto de alcanzar los mejores resultados.
Otro hallazgo de interés es que un menor SP muestra una asociación significativamente mayor con una incidencia y un riesgo de gradientes residuales elevados, lo cual constituye otro importante factor contribuyente al fallo del dispositivo. Este nuevo hallazgo apunta un cierto desajuste paciente-prótesis e indica que se precisaría cierto SP con el fin de evitar gradientes residuales.
Implantes de marcapasos definitivos y mecanismos de acción subyacentesLos nuevos IMD representan una complicación relevante y frecuente tras una intervención de TAVI. Las investigaciones previas no han demostrado ningún efecto negativo de los nuevos IMD en los resultados15. No obstante, otros estudios recientes han identificado la estimulación crónica como un predictor independiente de la mortalidad al año16,17. Además, el IMD aumenta los costes totales y es una causa importante de prolongación de la estancia hospitalaria16.
Tras la salida al mercado de la S3, los primeros datos publicados señalaron una incidencia de IMD de entre el 13% y el 25,5%18-20. Los estudios más recientes muestran tasas de nuevos IMD entre el 11,6%21 y el 16%7. En la presente evaluación se hallaron tasas comparables del 16% de nuevos IMD a los 30 días.
Existe escasez de datos en relación con el efecto del SP determinado mediante TCMC en la incidencia del IMD después de una intervención de TAVI, en general y especialmente en el caso de la S3, ya que para abordar esta cuestión se ha empleado sobre todo la ecocardiografía22,23. Un estudio previo, que incluyó una cohorte más pequeña, ha demostrado recientemente que un SP fuera del intervalo establecido por TCMC se asocia con un aumento de la tasa de IMD con la S37. En otro estudio se observó una asociación del SP con la aparición o el agravamiento de alteraciones de conducción tras una intervención de TAVI, pero no así con el IMD. Sin embargo, ese estudio determinó el SP a partir de los datos obtenidos mediante la TCMC realizada tras el procedimiento5. En el presente estudio, y con una población más numerosa, se halló un incremento escalonado de las tasas de IMD con el aumento del SP. Se trata de una nueva observación y reviste interés que el SP siga siendo un predictor independiente de IMD tras el ajuste de los demás factores importantes predictivos de IMD, como son el bloqueo completo de la rama derecha, la fibrilación auricular y la profundidad del implante7,24. Se observó, al emplear splines cúbicos restringidos, un incremento significativo del riesgo de IMD para valores entre el+3% y el+18% de SP, que representa la horquilla mayor del intervalo de dimensionamiento de la prótesis recomendado. Por lo tanto, respecto al riesgo de IMD, parece recomendable un menor SP cuando se realiza el procedimiento con la S3.
Existen otros mecanismos de acción subyacentes a las alteraciones de conducción predisponentes a un IMD en el TAVI. En el implante de la S3, puede influir un marco expandible mayor desplegado en el tracto de salida del ventrículo izquierdo25. El posicionamiento de la prótesis a mayor profundidad por debajo del anillo aórtico ocasiona alteraciones de conducción inducidas por estrés mecánico o daño directo al sistema de conducción eléctrica. Los estudios anteriores han demostrado que la profundidad del implante influye en las tasas de IMD con de la S37,26. En el presente estudio, las medidas del laboratorio central muestran una media de profundidad del implante de 6,6 mm, que es acorde con los datos publicados previamente, aunque no se haya demostrado su efecto en las tasas de IMD en los análisis univariable y multivariable.
Se ha identificado recientemente, con el implante de la S3, la calcificación a la altura de la cúspide no coronaria como predictor independiente del IMD27. En el presente análisis, se valoró visualmente la distribución de calcio a la altura de la cúspide aórtica, pero no se demostró asociación con el IMD.
Fortalezas y limitacionesLas principales fortalezas del presente estudio estriban en el amplio número de pacientes provenientes de centros hospitalarios con gran volumen de intervenciones de TAVI, así como en la evaluación de la profundidad del implante por un laboratorio central. Sus limitaciones residen en la naturaleza observacional del estudio y en que el laboratorio central no haya realizado el análisis de las medidas determinadas en la TCMC y los resultados tras el procedimiento. La cantidad de calcio del aparato valvular aórtico se graduó visualmente, y su efecto, especialmente en lo relativo al fallo del dispositivo, puede haberse subestimado.
CONCLUSIONESEn una amplia cohorte de 3 centros hospitalarios con gran volumen de intervenciones de TAVI, se demostró una respuesta no lineal en forma de U del fallo del dispositivo asociada con el aumento del SP dentro del intervalo de dimensiones de la prótesis recomendado. No obstante, el incremento del SP aumenta el riesgo de IMD, aun en grados menores de SP. No se halló un intervalo de SP ideal para minimizar los riesgos tanto del fallo del dispositivo como del IMD. Por lo tanto, en los casos particulares de amplitudes límite entre 2 tamaños de prótesis, los resultados del presente estudio indican que la elección de la válvula más grande redundará en mayores tasas de éxito del procedimiento, sobre todo en los ya portadores de marcapasos. Sin embargo, se justifica la elección de un tamaño menor de prótesis para pacientes expuestos a alto riesgo de IMD (es decir, un bloqueo completo de la rama derecha previo).
CONFLICTO DE INTERESESC. Pellegrini recibió dietas de transporte de baja cuantía de Edwards Lifescience Corporation; W.-K. Kim es supervisor de Symetis S.A. y de St. Jude Medical/Abbot y recibió honorarios por conferencias de Edwards Lifescience Corporation; A.M. Kasel recibió honorarios como supervisor y por conferencias de Edwards Lifescience Corporation; M. Hilker recibió honorarios como supervisor de Symetis S.A.; H. Möllmann recibió honorarios como supervisor y por conferencias de Edwards Lifescience Corporation y Symetis S.A.; C. Hengstenberg recibió honorarios como supervisor y por conferencias de Edwards Lifescience Corporation y Symetis S.A.; O. Husser recibió dietas de transporte de baja cuantía de Edwards Lifescience Corporation, al igual que honorarios como supervisor y por conferencias de Symetis S.A.
- –
Se recomienda cierto grado de SP en el implante de la S3 al objeto de lograr el éxito del dispositivo y evitar las FPV.
- –
El análisis demostró una respuesta no lineal en forma de U del fallo del dispositivo asociada con el aumento del SP dentro del interalo de dimensiones de la prótesis recomendado. No obstante, el incremento del SP aumenta el riesgo de IMD, aun en grados menores de SP. No se halló un intervalo de SP ideal para minimizar los riesgos de fallo del dispositivo e IMD. En consecuencia, los pacientes con alto riesgo de IMD obtendrán mayor ventaja de un SP menor, mientras que un mayor SP redundará en la mejoría de los pacientes portadores de un marcapasos definitivo.