Evaluar la hemodinámica valvular a largo plazo de las válvulas percutáneas (VCP), y determinar la incidencia, las características y los factores asociados con la degeneración estructural valvular (DEV).
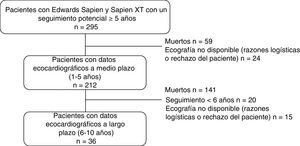
MétodosSe incluyó a 212 pacientes a los que se realizó un implante percutáneo de válvula aórtica. Todos los pacientes tenían un seguimiento potencial mínimo de 5 años y al menos 1 examen de ecocardiografía transtorácica (ETT) al menos 1 año tras el procedimiento. Todos los pacientes tuvieron una ETT a 1-5 años y 36, una segunda ETT a los 6-10 años. La DEV se definió como subclínica y clínicamente relevante. A 15 pacientes se les realizó una ecocardiografía transesofágica en el momento del diagnóstico de DEV y 85 tuvieron una evaluación por tomografía computarizada tras 1 (0,5-2) año.
ResultadosSe observó un aumento del gradiente valvular y una disminución gradual del área valvular (p<0,01). A los 8 años de seguimiento, un 30,2% de los pacientes tenían DEV (clínicamente relevante en el 9,3%). En los casos de DEV, la ecocardiografía transesofágica reveló engrosamiento y movilidad reducida de los velos valvulares en un 80 y un 73% de los casos respectivamente. No se encontraron factores basales o de procedimiento relacionados con la DEV. La tomografía computarizada demostró infraexpansión (3,5%) o excentricidad (8,2%) de la VCP, pero ninguno de estos hallazgos se asoció con DEV.
ConclusionesLos resultados de este estudio demuestran un deterioro progresivo (en un periodo de hasta 10 años) de la hemodinámica de las VCP aórticas, con una tasa de DEV de cerca del 30% (clínicamente relevante en < 10%). La morfología/movilidad de los velos valvulares estaba afectada en la gran mayoría de los casos de DEV, pero la geometría de la VCP no tuvo impacto significativo en la hemodinámica valvular.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) es la primera línea de tratamiento para el paciente con estenosis aórtica grave sintomática y con un riesgo quirúrgico de intermedio a alto1,2, y los ensayos recientes han servido de base para su expansión a pacientes con menos riesgo3,4. Por lo tanto, a pesar de que la durabilidad a largo plazo de las válvulas percutáneas (VP) pudiera parecer poco relevante en el tratamiento de una población inicialmente anciana y con alto riesgo, hoy se ha convertido en uno de los aspectos más importantes del TAVI.
La degeneración estructural de la válvula (DEV), algo frecuente tanto en válvulas quirúrgicas bioprotésicas como en VP, es la consecuencia de un proceso multifactorial, representado principalmente por la calcificación del tejido orgánico y las alteraciones en la integridad de los velos valvulares, que finalmente provoca disfunción valvular5–7. Se ha observado un buen funcionamiento de la válvula a medio plazo después del TAVR, pero hay pocos datos disponibles sobre la perdurabilidad de la VP a largo plazo (> 5 años). Además, hay resultados contradictorios sobre el funcionamiento hemodinámico de la VP a largo plazo y la frecuencia de DEV8–13. Entre otras explicaciones, en parte puede estar relacionado con los análisis no emparejados de los datos ecocardiográficos en la mayoría de los estudios8–12. Además, a diferencia de las bioprótesis quirúrgicas, las VP están sometidas a fuerzas externas que ocasionan diferentes grados de infraexpansión o excentricidad, lo que podría influir en la tensión en las áreas comisurales de los velos valvulares y, en consecuencia, en la durabilidad de la válvula14–17. Sin embargo, ningún estudio hasta la fecha ha evaluado el impacto de la circularidad/infraexpansión del armazón de la VP en la durabilidad de la válvula y los hallazgos en la morfología de los velos valvulares en casos de DEV. Por lo tanto, los objetivos de este estudio son: a) evaluar la hemodinámica a largo plazo de las VP mediante ecocardiografía transtorácica (ETT), y b) determinar la incidencia, las características y los factores asociados con la DEV.
MÉTODOSSe sometió a TAVI a una serie consecutiva de 295 pacientes con estenosis aórtica grave sintomática de la válvula nativa entre 2007 y 2012 en nuestro centro. Se implantó a todos los pacientes una válvula de tipo balón expandible Edwards SAPIEN (n=170) o SAPIEN XT (n=125) (Edwards Lifesciences, Estados Unidos). Se dio seguimiento clínico y ecocardiográfico a todos los pacientes tras 1 y 12 meses, y anualmente a partir de entonces. Los datos basales, del procedimiento y del seguimiento se recopilaron prospectivamente en una base de datos específica.
Valoración ecocardiográficaLos estudios mediante ecocardiografía transtorácica (ETT) llevados a cabo por ecocardiógrafos experimentados antes del alta hospitalaria se utilizaron como marco de referencia que facilita la comparación a fin de evaluar la aparición de DEV. Se predeterminaron 3 periodos distintos para evaluar la hemodinámica de la VP: alta hospitalaria, seguimiento a medio plazo (1-5 años) y a largo plazo (6-10 años). Se utilizó la última ecocardiografía de cada periodo para efectuar los análisis. La evaluación ecocardiográfica a medio plazo se pudo realizar en 212 pacientes (el 90% de la población en riesgo) en un tiempo medio de 3±2 años, mientras que la evaluación ecocardiográfica a largo plazo se pudo realizar en 36 pacientes (el 70% de la población en riesgo) en una media de 7±1 años (hasta 10 años después del TAVI) (figura 1).
Siguiendo las recomendaciones actuales, se obtuvieron parámetros cualitativos y semicuantitativos durante las valoraciones ecocardiográficas18,19. El gradiente transprotésico medio (GTPM) se obtuvo mediante la fórmula de Bernoulli y el área efectiva del orificio (AEO) de la VP se calculó mediante la ecuación de continuidad. El diámetro del tracto de salida del ventrículo izquierdo se midió inmediatamente proximal al stent de la VCP20. La diferenciación entre insuficiencia aórtica (IAo) intraprotésica (central) y paravalvular se realizó mediante la evaluación en multiples planos con Doppler color y su gravedad se valoró mediante un enfoque integral multiparamétrico.
La DEV se definió como subclínica o clínicamente relevante como ya se había descrito20,21. La DEV subclínica se diagnosticó como: a) un aumento absoluto del GTPM >10mmHg con una disminución concomitante del AEO >0,3cm2 (y/o disminución del índice de velocidad Doppler >0,08), y/o la aparición de al menos IAo intraprotésica leve o un aumento de al menos 1 grado de insuficiencia valvular intraprotésica preexistente, que produzca un grado de insuficiencia menor o igual que moderado, o b) un cambio en la morfología (es decir, engrosamiento, calcificación, flail o formación de pannus valvular) y/o movilidad (es decir, reducida o avulsionada) de los velos valvulares de la VP. La DEV clínicamente relevante se definió como un aumento del GTPM >20mmHg con una disminución concomitante del AEO >0,6cm2 (y/o disminución del índice de velocidad por Doppler >0,15), lo que generó una estenosis aórtica grave según la guía de práctica clínica vigente, o nueva aparición o aumento de al menos 1 grado de insuficiencia intraprotésica que cause IAo de moderada a grave.
Se recopilaron datos sobre las ecocardiografías transesofágicas (ETE) realizadas en el momento del diagnóstico de la DEV. Se evaluó y se registró la presencia de trombosis valvular o calcificación, la morfología y la movilidad de los velos valvulares y la gravedad y el tipo de la IAo.
Tomografía computarizada multidetectoresSe realizó tomografía computarizada multidetectores (TCMD) de manera incidental en 137 pacientes después del TAVI. De estos, se pudo evaluar adecuadamente la geometría y la integridad estructural de las VP en 85 exámenes (el 40,1% de los 212 pacientes con al menos 1 ETT en un seguimiento ≥1 año), realizados una mediana de 1 (0,5-2) año después del TAVI. Un radiólogo con experiencia, desconocedor de los hallazgos ecocardiográficos y la evolución clínica del paciente, volvió a analizar todas las TCMD orientadas a elementos estructurales de la VP implantada, como fractura, circularidad y expansión. Aunque todas las TCMD estaban sincronizadas con el electrocardiograma (ECG), el radiólogo responsable de su implementación estableció el protocolo de examen y el uso de medios de contraste.
Los bordes externos de la VP se tomaron como referencia para obtener el diámetro externo y el área en 3 niveles de corte transversal distintos (entrada, stent medio y salida) durante la diástole al 75% del intervalo RR. Después de obtener estas mediciones, se evaluaron la expansión y la circularidad/excentricidad de la prótesis. Las VP eran circulares si el índice de excentricidad, calculado como 1 – diámetro externo mínimo de la VP / diámetro externo máximo de la VP, era < 10%17,22. La infraexpansión de la VP se definió como el área externa de la VP dividida entre el área externa nominal ≤ 90%17,23.
Análisis estadísticosLas variables continuas se expresan como media ± desviación estándar o mediana [intervalo intercuartílico], según correspondiera. Las comparaciones entre variables numéricas se realizaron mediante la suma de rangos de Wilcoxon o la prueba de la t de Student. Las variables categóricas se presentan en cifras absolutas (porcentajes) y se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher. Los cambios graduales en GTPM, AEO e insuficiencia intraprotésica se evaluaron con medidas repetidas de análisis de la varianza. Los valores de GTPM y AEO se transformaron logarítmicamente para estabilizar las variaciones. Los valores de p presentados se basan en esta transformación. La incidencia de DEV se evaluó mediante análisis de riesgos competitivos (por muertes). Se aplicaron modelos de riesgos proporcionales de Cox para determinar los factores asociados con la DEV. Las variables relevantes con p < 0,10 en los análisis univariable se incluyeron en el modelo multivariante. Los resultados se consideraron significativos cuando se alcanzó un valor de p <0,05 de dos colas. Los análisis estadísticos se realizaron con el software estadístico SAS versión 9.4 (SAS Institute Inc., Estados Unidos).
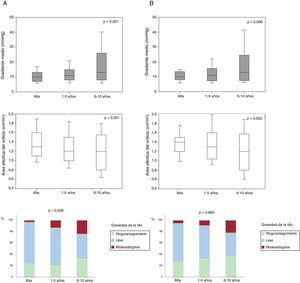
RESULTADOSHemodinámica de la válvula percutáneaLos datos ecocardiográficos sobre los cambios hemodinámicos graduales de la VP, que incluyen el GTPM, el AEO y la IAo intraprotésica de la población general, se muestran en la figura 2A. Desde el alta hasta el seguimiento a medio plazo, se observaron un aumento leve, pero considerable, del GTPM (Δ=1,94± 7,4mmHg; p <0,001), una disminución del AEO (Δ=–0,09± 0,43cm2; p=0,005) y mayor proporción de grados más altos de IAo (p=0,011). Del seguimiento a medio plazo al seguimiento a largo plazo, también se observaron un aumento adicional del GTPM (Δ=6,0± 11,9mmHg; p=0,004), junto con una disminución del AEO (Δ=–0,19± 0,44cm2; p=0,02) y un aumento en la proporción de grados más altos de IAo (p=0,038).
Cambios graduales de la hemodinámica de la válvula cardiaca percutánea. A: datos ecocardiográficos no emparejados de pacientes con al menos 1 ecocardiografía transtorácica 1 año después del TAVI (n=212); p <0,001 para los cambios tanto en el gradiente medio como en el área efectiva del orificio valvular y p=0,038 para una mayor proporción de grados más altos de insuficiencia intraprotésica desde el alta hasta los 6-10 años de seguimiento. B: datos ecocardiográficos apareados de pacientes con ecocardiografía transtorácica en el momento del alta hospitalaria, seguimiento a medio plazo (1-5 años) y a largo plazo (6-10 años) (n=36); p=0,006, p=0,002 y p=0,669 para los cambios en el gradiente medio, el área efectiva del orificio y para mayor proporción de grados más altos de insuficiencia intraprotésica respectivamente. IAo: insuficiencia aórtica.
Los datos ecocardiográficos apareados de 36 pacientes obtenidos en los 3 periodos de tiempo preespecificados revelaron un aumento considerable del GTPM y una disminución del AEO (Δ=5,9± 11,8; p=0,006; Δ=–0,19± 0,44cm2; p=0,002, respectivamente), aunque no se observó ningún cambio importante en la gravedad de la IAo (p=0,669) durante todo el seguimiento (figura 2B).
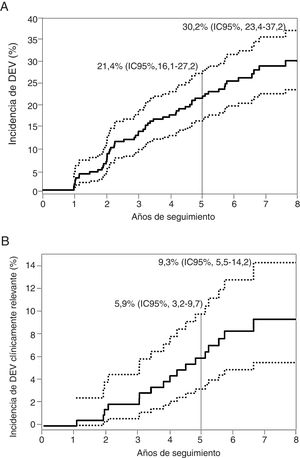
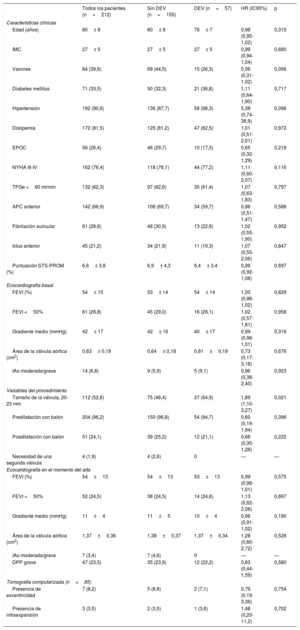
Incidencia, características y factores asociados con la degeneración estructural de válvulasLos principales datos basales, del procedimiento, de la ecocardiografía en el momento del alta y de la TCMD después del TAVI de pacientes con al menos 1 evaluación ecocardiográfica al menos 1 año después del TAVI se muestran en la tabla 1, en general y según la presencia de DEV. Se produjo DEV en 57 pacientes (26,9%) y fue subclínica y clínicamente relevante en 40 (el 18,9%; el 70,2% de la cohorte de DEV) y 17 pacientes (el 8,0%; el 29,8% de la cohorte de DEV) respectivamente. La incidencia total de DEV a los 8 años de seguimiento alcanzó el 30,2% (intervalo de confianza del 95% [IC95%], 23,4-37,2%), el 21,9% (IC95%, 15,8-28,6%) y el 9,3% (IC95%, 5,5-14,2%) subclínicos y clínicamente relevantes respectivamente (figura 3). El tiempo medio para el diagnóstico de cualquier tipo de DEV fue 3± 2 años; por lo tanto, a la mayoría (48 pacientes, 84%) se los diagnosticó en el seguimiento a medio plazo; 34 (60%) y 14 (24%) presentaron DEV subclínica y clínicamente relevante. En el seguimiento a largo plazo hubo otros 9 casos de DEV (16%), de los cuales 6 (11%) fueron subclínicos y 3 (5%), clínicamente relevantes ().
Datos basales, del procedimiento y de la ecocardiografía en el momento del alta, y de la TCMD después del TAVI según el estado de la degeneración estructural de la válvula
| Todos los pacientes (n=212) | Sin DEV (n=155) | DEV (n=57) | HR (IC95%) | p | |
|---|---|---|---|---|---|
| Características clínicas | |||||
| Edad (años) | 80± 8 | 80± 8 | 78± 7 | 0,98 (0,95-1,02) | 0,315 |
| IMC | 27± 5 | 27± 5 | 27± 5 | 0,99 (0,94-1,04) | 0,680 |
| Varones | 84 (39,6) | 69 (44,5) | 15 (26,3) | 0,56 (0,31-1,02) | 0,056 |
| Diabetes mellitus | 71 (33,5) | 50 (32,3) | 21 (36,8) | 1,11 (0,64-1,90) | 0,717 |
| Hipertensión | 192 (90,6) | 136 (87,7) | 56 (98,3) | 5,38 (0,74-38,9) | 0,096 |
| Dislipemia | 172 (81,5) | 125 (81,2) | 47 (82,5) | 1,01 (0,51-2,01) | 0,972 |
| EPOC | 56 (26,4) | 46 (29,7) | 10 (17,5) | 0,65 (0,32-1,29) | 0,218 |
| NYHA III-IV | 162 (76,4) | 118 (76,1) | 44 (77,2) | 1,11 (0,60-2,07) | 0,116 |
| TFGe <60 ml/min | 132 (62,3) | 97 (62,6) | 35 (61,4) | 1,07 (0,63-1,83) | 0,797 |
| APC anterior | 142 (66,9) | 108 (69,7) | 34 (59,7) | 0,86 (0,51-1,47) | 0,588 |
| Fibrilación auricular | 61 (28,8) | 48 (30,9) | 13 (22,8) | 1,02 (0,55-1,90) | 0,952 |
| Ictus anterior | 45 (21,2) | 34 (21,9) | 11 (19,3) | 1,07 (0,55-2,06) | 0,847 |
| Puntuación STS-PROM (%) | 6,6± 3,8 | 6,9± 4,3 | 6,4± 3,4 | 0,99 (0,92-1,06) | 0,697 |
| Ecocardiografía basal | |||||
| FEVI (%) | 54± 15 | 53± 14 | 54± 14 | 1,00 (0,98-1,02) | 0,829 |
| FEVI <50% | 61 (28,8) | 45 (29,0) | 16 (28,1) | 1,02 (0,57-1,81) | 0,958 |
| Gradiente medio (mmHg) | 42± 17 | 42± 16 | 40± 17 | 0,99 (0,98-1,01) | 0,316 |
| Área de la válvula aórtica (cm2) | 0,63± 0,19 | 0,64± 0,18 | 0,61±0,19 | 0,73 (0,17-3,18) | 0,676 |
| IAo moderada/grave | 14 (6,8) | 9 (5,9) | 5 (9,1) | 0,96 (0,38-2,40) | 0,923 |
| Variables del procedimiento | |||||
| Tamaño de la válvula, 20-23 mm | 112 (52,8) | 75 (48,4) | 37 (64,9) | 1,89 (1,10-3,27) | 0,021 |
| Predilatación con balón | 204 (96,2) | 150 (96,8) | 54 (94,7) | 0,60 (0,19-1,94) | 0,396 |
| Posdilatación con balón | 51 (24,1) | 39 (25,2) | 12 (21,1) | 0,66 (0,35-1,28) | 0,222 |
| Necesidad de una segunda válvula | 4 (1,9) | 4 (2,6) | 0 | — | — |
| Ecocardiografía en el momento del alta | |||||
| FEVI (%) | 54±13 | 54±13 | 53±13 | 0,99 (0,98-1,01) | 0,575 |
| FEVI <50% | 52 (24,5) | 38 (24,5) | 14 (24,6) | 1,13 (0,62-2,06) | 0,697 |
| Gradiente medio (mmHg) | 11±4 | 11±5 | 10±4 | 0,96 (0,91-1,02) | 0,190 |
| Área de la válvula aórtica (cm2) | 1,37±0,36 | 1,38±0,37 | 1,37±0,34 | 1,28 (0,60-2,72) | 0,528 |
| IAo moderada/grave | 7 (3,4) | 7 (4,6) | 0 | — | — |
| DPP grave | 47 (23,5) | 35 (23,9) | 12 (22,2) | 0,83 (0,44-1,59) | 0,580 |
| Tomografía computarizada (n=85) | |||||
| Presencia de excentricidad | 7 (8,2) | 5 (8,8) | 2 (7,1) | 0,79 (0,19-3,36) | 0,754 |
| Presencia de infraexpansión | 3 (3,5) | 2 (3,5) | 1 (3,6) | 1,48 (0,20-11,2) | 0,702 |
APC: arteriopatía coronaria; DEV: degeneración estructural de la válvula; DPP: desajuste paciente-prótesis; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IAo: insuficiencia aórtica; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; NYHA: clase funcional de la New York Heart Association; STS-PROM: Society of Thoracic Surgeons-Predicted Risk of Mortality. TAVI: implante percutáneo de vá lvula aórtica; TCMD: tomografía computarizada multidetectores; TFGe: tasa de filtrado glomerular estimada.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
Análisis de riesgos competitivos (por muertes) de la incidencia de DEV durante 8 años de seguimiento. A: incidencia de cualquier tipo de degeneración estructural de la válvula. B: incidencia de degeneración estructural de la válvula clínicamente relevante. DEV: degeneración estructural de la válvula; IC95%: intervalo de confianza del 95%.
El desarrollo o aumento de la IAo intraprotésica fue la causa más frecuente de DEV tanto en la cohorte subclínica (27 pacientes, 68%) como en la clínicamente relevante (12 pacientes, 71%). Si bien la estenosis solo de la VP fue la segunda causa de DEV en la cohorte subclínica (10 pacientes, 25%), fue la causa menos frecuente en los pacientes con DEV clínicamente relevante (1 paciente, 6%). La disfunción valvular mixta, con estenosis de la VP y criterios de IAo intraprotésica, fue la causa principal de DEV en 3 (7%) y 4 (23%) pacientes de las cohortes de DEV subclínica y clínicamente relevante.
Hubo 16 pacientes con DEV entre los 36 pacientes con datos de ecocardiografía a largo plazo. Este subgrupo específico mostró un aumento considerable del GTPM (Δ=13,2± 14,5mmHg; p <0,001) y de la proporción de grados más altos de IAo intraprotésica (p=0,045), con una disminución gradual del AEO (Δ=–0,32± 0,55cm2; p <0,001), independientemente del tipo de DEV ().
La DEV empeoró gradualmente, ya que la DEV subclínica de 3 pacientes (7,5%) progresó a DEV clínicamente relevante y, con el tiempo, se observó disfunción valvular mixta en 2 (20%) y 4 (14,8%) pacientes en principio diagnosticados de estenosis de la VP aislada e IAo intraprotésica aislada respectivamente.
Se reintervino en la válvula aórtica a 12 (5,66%) pacientes. Los motivos para la reintervención fueron DEV subclínica en 4 pacientes (33%), DEV clínicamente relevante en 5 (42%), deterioro valvular no estructural en forma de insuficiencia paravalvular grave en 2 (17%) y 1 paciente (8%) fue reintervenido en otro país por causas desconocidas. A todos, menos a 1 paciente reintervenido por DEV, se les realizó un procedimiento de TAVI en TAVI. Todos los casos con degeneración no estructural de la válvula se trataron mediante reemplazo quirúrgico de la válvula aórtica.
Aunque las VP más pequeñas (p=0,021) fueron más frecuentes en la cohorte de DEV (tabla 1), ningún factor específico se asoció por sí solo con DEV (análisis multivariante) ().
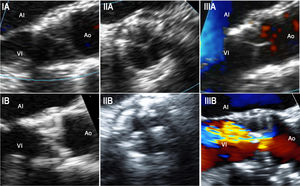
Datos de ecocardiografía transesofágicaA 15 pacientes se les realizó una ETE en el momento del diagnóstico de la DEV (media, 5± 1 años después del TAVI) (). En esta cohorte, la DEV se presentó con más frecuencia secundaria a la aparición o aumento de la insuficiencia intraprotésica (8 pacientes; 53,3%), seguida de estenosis de la VP (5 pacientes; 33,3%) y degeneración mixta de la VP (2 pacientes; 13,3%). No se observó trombosis de la VP. La ETE determinó con precisión el grado y el tipo de IAo al mostrar velos valvulares engrosados/calcificados y movilidad anormal de estos en 12 (80%) y 11 (73%) pacientes respectivamente (figura 4).
Imágenes de la ecocardiografía transesofágica de pacientes con degeneración estructural de la válvula (IA). Vista en eje largo intraprocedimiento de una válvula SAPIEN XT que muestra los delgados velos de la VP (IB). Vista en eje largo de una válvula SAPIEN XT tomada 5,5 años después del implante en un paciente con VP a causa de estenosis, que muestra velos valvulares engrosados y calcificados (IIA). Vista en eje corto intraprocedimiento de una válvula SAPIEN XT que muestra velos valvulares delgados de la VP (IIB). Vista en eje corto de una válvula SAPIEN XT tomada 5,5 años después del implante de VP en un paciente con VP a causa de estenosis, que muestra velos valvulares engrosados y calcificados (IIIA). Imagen de Doppler color en eje largo intraprocedimiento de una válvula SAPIEN XT que muestra velos valvulares delgados de la VP y sin insuficiencia aórtica residual (IIIB). Imagen de Doppler color en eje largo de una válvula SAPIEN XT tomada 5,3 años después del implante de VP en un paciente con VP a causa de la aparición de insuficiencia aórtica intraprotésica grave, aunque también se observaron velos valvulares de la VP engrosados y calcificados. AI: aurícula izquierda; Ao: aorta; VP: válvula percutánea; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
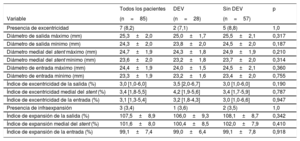
Las características clínicas y del procedimiento de los 85 pacientes con exámenes de TCMD analizables en el seguimiento se muestran en la . En una mediana de 1 (0,5-2) años después del TAVI, no se observaron fracturas del stent entre los 85 estudios de TCMD analizables. En general, 7 VP (8,2%) eran excéntricas y 3 (3,4%) estaban infraexpandidas. Aunque se observó una expansión considerablemente menor en la entrada al compararla con el nivel de salida del stent (p <0,001), la circularidad de la VP se mantuvo similar en todos los niveles (p=0,993).
Los datos obtenidos al alta y de la última ETT disponible no mostraron impacto alguno de la excentricidad o la infraexpansión de la VP en los parámetros ecocardiográficos graduales (GTPM, p=0,947; AEO, p=0,594; IAo, p=0,119) (figura 5). Un total de 28 pacientes con DEV (el 49,1% de la cohorte de DEV) se encontraban entre los pacientes de la cohorte de TCMD y no se observaron diferencias en las mediciones de la TCMD y la excentricidad o la infraexpansión de la VP entre pacientes con y sin DEV (todos, sin diferencias significativas) (tabla 2).
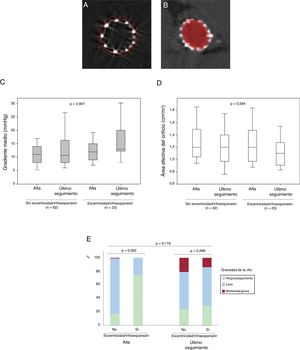
Cambios en la hemodinámica valvular desde el alta hasta la última ecocardiografía de seguimiento de la cohorte con una TCMD después del TAVI según la excentricidad y la expansión de la VP. A: imagen de TCMD de una válvula SAPIEN de 26mm infraexpandida; la línea de puntos delimita el área nominal de la VP, mientras que la línea continua delimita el área obtenida de la VP. B: imagen de TCMD de una válvula SAPIEN excéntrica de 23mm; la figura elíptica muestra la excentricidad de la VP. C y D: gradiente aórtico medio y área efectiva del orificio; p=0,947 y p=0,594 para la diferencia entre la ausencia y la presencia de excentricidad/infraexpansión respecto al gradiente medio transprotésico y el área efectiva del orificio en el momento del alta y con la última ecocardiografía disponible del seguimiento respectivamente. E: insuficiencia valvular intraprotésica; p=0,119 para los cambios en las proporciones de gravedad aórtica desde el alta hasta la última ecocardiografía de seguimiento disponible. IAo: insuficiencia aórtica; TAVI: implante percutáneo de válvula aórtica; TCMD: tomografía computarizada multidetectores; VP: válvula percutánea.
Datos de tomografía computarizada multidetectores según la presencia de degeneración estructural de la válvula (n=85)
| Todos los pacientes | DEV | Sin DEV | p | |
|---|---|---|---|---|
| Variable | (n=85) | (n=28) | (n=57) | |
| Presencia de excentricidad | 7 (8,2) | 2 (7,1) | 5 (8,8) | 1,0 |
| Diámetro de salida máximo (mm) | 25,3±2,0 | 25,0±1,7 | 25,5±2,1 | 0,317 |
| Diámetro de salida mínimo (mm) | 24,3±2,0 | 23,8±2,0 | 24,5±2,0 | 0,187 |
| Diámetro medial del stent máximo (mm) | 24,7±1,9 | 24,3±1,8 | 24,9±1,9 | 0,210 |
| Diámetro medial del stent mínimo (mm) | 23,6±2,0 | 23,2±1,8 | 23,7±2,0 | 0,314 |
| Diámetro de entrada máximo (mm) | 24,4±1,9 | 24,0±1,5 | 24,5±2,1 | 0,360 |
| Diámetro de entrada mínimo (mm) | 23,3±1,9 | 23,2±1,6 | 23,4±2,0 | 0,755 |
| Índice de excentricidad de la salida (%) | 3,0 [1,0-6,0] | 3,5 [2,0-6,7] | 3,0 [1,0-6,0] | 0,190 |
| Índice de excentricidad medial del stent (%) | 3,4 [1,8-5,5] | 4,2 [1,9-5,6] | 3,4 [1,7-5,9] | 0,787 |
| Índice de excentricidad de la entrada (%) | 3,1 [1,3-5,4] | 3,2 [1,8-4,3] | 3,0 [1,0-6,6] | 0,947 |
| Presencia de infraexpansión | 3 (3,4) | 1 (3,6) | 2 (3,5) | 1,0 |
| Índice de expansión de la salida (%) | 107,5±8,9 | 106,0±9,3 | 108,1±8,7 | 0,342 |
| Índice de expansión medial del stent (%) | 101,6±8,0 | 100,4±8,5 | 102,0±7,9 | 0,410 |
| Índice de expansión de la entrada (%) | 99,1±7,4 | 99,0±6,4 | 99,1±7,8 | 0,918 |
DEV: degeneración estructural de la válvula.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Las principales conclusiones de este estudio, que incluyó a pacientes que habían recibido una VP de tipo balón expandible, son las siguientes: a) se observó una disminución discreta pero significativa del AEO y un aumento del GTPM durante un periodo de seguimiento de 10 años; b) se produjo DEV en aproximadamente 1/4 pacientes (subclínica y clínicamente relevante en 2/3 y 1/3 pacientes con DEV respectivamente); c) la mayoría de los pacientes con DEV evaluados por ETE presentaron velos valvulares engrosados y con movilidad reducida, pero ninguno mostraba signos de trombosis de la VP, y d) la TCMD no mostró fractura del armazón del stent, pero sí una baja incidencia de excentricidad o infraexpansión de la VP, y no se observó relación entre la circularidad/expansión del VP y la DEV.
Actualmente, hay datos contradictorios sobre la hemodinámica de las VP, pues algunos artículos revelan AEO y GTPM estables en seguimientos de hasta 5 años24–29, mientras que otros muestran una disminución considerable del AEO y una tendencia al aumento del GTPM7,30. Últimamente, estudios con un seguimiento más largo han demostrado una hemodinámica estable de la VP después de 5 años10–12. Sin embargo, ninguno de estos estudios ha presentado datos ecocardiográficos apareados. Una publicación reciente con una comparación de datos apareados entre el alta y las últimas ETT disponibles en el seguimiento evidenció gradientes transprotésicos máximos más bajos y una reducción de la gravedad de la IAo en el seguimiento a largo plazo13. Sin embargo, las VP autoexpandibles (sistema CoreValve en aproximadamente 2/3 pacientes) contribuyeron principalmente a la obtención de estos resultados, ya que no se observó ningún cambio significativo en la hemodinámica de la válvula en los pacientes tratados con una válvula de tipo balón expandible13. En cambio, nuestro análisis de datos apareados de ETT realizadas con datos de 3 periodos distintos mostraron un aumento gradual y significativo del GTPM con una disminución gradual del AEO. Curiosamente, este análisis reveló que la IAo empeoraba exclusivamente entre los pacientes de la cohorte con DEV.
Mientras que se produce DEV en menos del 5% de los pacientes con TAVI hasta los 5 años7,24–30, se han comunicado tasas que van del 0 al 50% después del punto de referencia de los 5 años9–13,31. Cabe destacar que las definiciones de DEV son diferentes entre los artículos publicados. No obstante, las incidencias a largo plazo de la DEV han continuado variando del 0 al 15% con la aplicación de los criterios propuestos por la European Association for Cardio-Thoracic Surgery/European Association of Percutaneous Cardiovascular Interventions (EACTS-EAPCI)32 en periodos de seguimiento parecidos9–13. Una posible limitación de esta definición es la aceptación de valores absolutos de GTPM ≥ 20mmHg en cualquier ecocardiografía durante el seguimiento como diagnóstico de DEV. Esto puede motivar una importante sobrestimación de la incidencia de DEV, ya que puede clasificar como DEV los casos graves de desajuste paciente-prótesis. La definición utilizada en nuestro estudio no incluye valores absolutos de GTPM como diagnósticos de DEV y exige que haya deterioro hemodinámico valvular durante el seguimiento para confirmar la DEV. Datos recientes del ensayo NOTION revelaron tasas de DEV del 24% tras el reemplazo quirúrgico de válvula aórtica y del 4,8% tras el TAVI según las definiciones de la EACTS-EACPI, pero 2 veces menor (el 14,1 y el 2,1% respectivamente) si se tiene en cuenta el deterioro hemodinámico durante el seguimiento10. Finalmente, las mediciones precisas del Doppler son muy importantes para el diagnóstico de DEV, y la variabilidad en este tipo de mediciones en diferentes periodos de tiempo después del TAVI también puede afectar a las tasas de DEV notificadas en diferentes estudios.
Es comprensible que la causa principal de DEV varíe según los criterios de diagnóstico aplicados. En una revisión reciente, Foroutan et al.6 encontraron que la DEV después del TAVI se debió principalmente a la estenosis de la VP (58%), y fueron menos frecuentes la IAo (39%) y la etiología mixta (3%), mientras que en nuestro estudio la mayoría de los casos de DEV tenían la IAo intraprotésica como causa principal de DEV. Aunque se sabe que la DEV es un proceso gradual, nuestro estudio es el primero en mostrar la progresión de la degeneración de la VP a lo largo de un seguimiento a largo plazo, como se puede observar en los cambios en la gravedad (el 7,5% de la DEV subclínica progresó a DEV clínicamente relevante) y en los criterios de DEV (el 20 y el 15% de la DEV debida a estenosis de la VP y a IAo intraprotésica, respectivamente, evolucionaron a disfunción mixta de la VP).
En el ámbito del reemplazo quirúrgico de la válvula aórtica, la DEV tradicionalmente equivalía a reintervención valvular21,33. Sin embargo, aplicando las mismas definiciones de DEV que en nuestro estudio, Rodríguez-Gabella et al.21 reportaron unas tasas de DEV subclínica y clínicamente relevante del 30,1 y el 6,6% respectivamente, en una cohorte de bioprótesis aórticas quirúrgicas con una mediana de seguimiento de 10 años. En otra serie de reemplazo quirúrgico de la válvula aórtica, Salaun et al.34 comunicaron una tasa del 30,9% de DEV general en una mediana de seguimiento de 10 años. Por lo tanto, estos resultados son parecidos a los observados en nuestra cohorte de pacientes con VCP.
El proceso de crimping, los velos valvulares cada vez más delgados y una mayor interacción entre los velos valvulares y el armazón de la válvula debida a la expansión asimétrica o incompleta de la VP se han considerado factores potenciales de mayor evolución a DEV tras el TAVI en comparación con la bioprótesis quirúrgica5,14–16,22. Sin embargo, estos aspectos potencialmente negativos podrían compensarse por una menor tasa de desajustes graves paciente-prótesis y gradientes residuales más bajos en pacientes tratados con VP, lo que podría explicar las tasas considerablemente más altas de DEV después del reemplazo quirúrgico de la válvula aórtica en comparación con el TAVI observadas en el ensayo NOTION, incluso cuando se utilizó una definición más rigurosa de DEV10.
De manera parecida que en un estudio anterior de TCMD de la VP de tipo balón expandible17, no se observaron fracturas del armazón del stent de la VP en nuestro estudio. Además, la tasa de excentricidad de la VP (8%) se encontraba dentro del intervalo comunicado con anterioridad (4-14%)17,35. Delgado et al.35 mostraron que había relación entre tasas de excentricidad más altas, calcificación grave de la válvula aórtica e incidencia de IAo moderada después del procedimiento, observada por las evaluaciones de la ETT 1 mes después del TAVI. En cambio, Willson et al.17 comunicaron que no había relación entre la circularidad de la VP y la hemodinámica valvular en el seguimiento de 1 año. Del mismo modo, en nuestro estudio se informa por primera vez de la falta de relación entre la excentricidad o infraexpansión de la VP y una peor hemodinámica valvular o aparición de DEV en el seguimiento a largo plazo. Además, aunque nuestra tasa de VP infraexpandidas (3,4%) fue menor que el 8% notificado por Wilson et al.17, ambos estudios revelaron índices de expansión considerablemente inferiores en la entrada de la VP (a nivel ventricular) en comparación con el nivel de salida (aórtico). La fuerza de restricción del anillo aórtico, especialmente en presencia de un sobredimensionamiento excesivo de la VP, y la ausencia de resistencia biológica del tejido en la salida valvular (a nivel aórtico) probablemente expliquen la diferencia en la expansión en diferentes niveles de la VP.
Actualmente se recomienda la evaluación ecocardiográfica de los pacientes tratados mediante TAVI en el momento del alta hospitalaria, a los 6 y a los 12 meses y anualmente a partir de entonces18,19. Aunque la ETT debería ser la primera modalidad de imagen realizada, se recomienda la ETE en presencia de hallazgos anormales en la ETT36. Mientras que el engrosamiento y la calcificación de los velos valvulares a menudo se observan después de periodos de tiempo más largos, la trombosis de la VP se ha descrito tradicionalmente como un evento temprano7,37. Sin embargo, los análisis histológicos de las VP explantadas revelaron que, aunque parecía que la fibrosis y la calcificación de los velos valvulares estaban asociadas con la duración del seguimiento, la trombosis valvular se producía independientemente del plazo38. Por lo tanto, la obtención de imágenes detalladas de pacientes con DEV es fundamental para establecer la causa del deterioro valvular. Nuestro estudio es el primero en ofrecer datos de ETE de pacientes con DEV obtenidos en el seguimiento a largo plazo. En general, la trombosis valvular se excluyó correctamente como la causa de la DEV y los velos valvulares engrosados y con movilidad reducida estaban presentes en la gran mayoría de los casos. Por último, la ETE estableció con precisión el grado y el tipo de IAo, lo que ayudó a decidir la estrategia de tratamiento más adecuada.
LimitacionesEl perfil de alto riesgo y la edad avanzada de la población del estudio se tradujeron en una elevada tasa de mortalidad en el seguimiento, lo que afectó negativamente al número de pacientes en riesgo de DEV. Si bien se había especificado previamente la realización de exámenes ecocardiográficos anuales después del TAVI, los datos de las ecocardiografías en el seguimiento fueron incompletos. Con todo, se pudo consultar el análisis ecocardiográfico apareado hasta en el 90 y el 70% de los pacientes en riesgo en un seguimiento de 1-5 y > 5 años, algo parecido o superior a la tasa notificada en estudios anteriores en este ámbito. No se dispuso en este estudio de un laboratorio central para el análisis ecocardiografico. Además, los estudios de TCMD fueron oportunistas y sin inyección de contraste, lo que impidió una evaluación más precisa (comparada con la ETE) de la trombosis valvular. Asimismo, los estudios de ETE y TCMD no se realizaron de manera sistemática y un posible sesgo de selección podría haber influido en los resultados relacionados con estas modalidades de imagen. A pesar de todo, esto se compensó parcialmente por el hecho de que no se observaron diferencias clínicas importantes entre los pacientes con y sin estudios de TCMD en el seguimiento (). Por último, no hubo datos disponibles sobre la medicación vasodilatadora en el momento del examen ecocardiográfico de seguimiento.
CONCLUSIONESSe produjo un deterioro gradual leve pero significativo de la hemodinámica de la VP durante un periodo de seguimiento de 10 años. Esto se tradujo en grados de DEV en general y clínicamente relevante a los 8 años de seguimiento de alrededor del 30 y el 9% respectivamente, lo que parece comparable a lo notificado en las series quirúrgicas. Es importante destacar que la geometría del armazón del stent de la VP según lo establecido por TCMD no tuvo impacto alguno en los graduales cambios hemodinámicos de la válvula. Se necesitan más estudios con mayor número de pacientes y periodos de seguimiento aún más extensos para aclarar todavía más la incidencia y los factores asociados con la DEV.
- -
El TAVI es un tratamiento establecido para pacientes con estenosis aórtica grave sintomática y un riesgo quirúrgico de intermedio a alto.
- -
La extensión del TAVI a pacientes con menor riesgo ha hecho que la durabilidad a largo plazo de la VP sea un aspecto fundamental.
- -
Actualmente se dispone de información escasa y controvertida sobre la hemodinámica de la VP a largo plazo y no hay datos sobre: a) el impacto a largo plazo de la geometría de la VP en la durabilidad de la válvula, y b) la morfología/movilidad de los velos valvulares en casos de DEV.
- -
Este estudio de 212 pacientes con VP reveló un aumento significativo del gradiente medio y una disminución gradual del área de la VP a largo plazo.
- -
A los 8 años de seguimiento, a pesar del deterioro hemodinámico leve, menos de 1/3 pacientes mostraron DEV (clínicamente relevante en menos del 10%); la ETE reveló engrosamiento de los velos valvulares y movilidad reducida en la mayoría de las VP evaluadas con DEV, y la TCMD no mostró impacto alguno de la geometría de la VP en los cambios hemodinámicos de la válvula y el desarrollo gradual de DEV.
P. Pibarot tiene contratos Core Lab con Edwards Lifesciences, por los cuales no recibe remuneración directa. J. Rodés-Cabau ha recibido becas de investigación institucional de Edwards Lifesciences y Medtronic. Todos los demás autores declaran no tener ningún conflicto de intereses relacionado con el contenido de este artículo.
J. Rodés-Cabau dirige la cátedra de investigación Fondation Famille Jacques Larivière para el desarrollo de intervenciones cardiacas estructurales.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.01.029.