No está bien definida la estrategia antitrombótica para los pacientes sometidos a implante percutáneo de válvula aórtica (TAVI) que precisan anticoagulación crónica por fibrilación auricular. Este trabajo compara la incidencia de eventos hemorrágicos tardíos en pacientes en tratamiento con anticoagulantes orales de acción directa (ACOD) o antagonistas de la vitamina K (AVK).
MétodosEstudio observacional unicéntrico que incluyó a pacientes sometidos a TAVI que precisaron anticoagulación al alta entre 2015 y 2021. El objetivo primario fue cualquier evento hemorrágico clínicamente relevante tras el alta. Los objetivos secundarios fueron ictus, ingreso por insuficiencia cardiaca y mortalidad por cualquier causa.
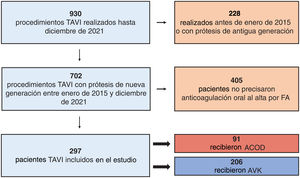
ResultadosDe 702 pacientes de TAVI, 297 precisaron tratamiento anticoagulante al alta, 206 con AVK (69,4%) y 91 con ACOD (30,6%). No hubo diferencias significativas respecto a características basales, intraprocedimiento ni hospitalarias, salvo por una mejor función renal en los pacientes con ACOD. La mediana de seguimiento fue 2,8 años. Tuvieron mayor riesgo de eventos hemorrágicos los pacientes con ACOD que los tratados con AVK tras ajuste por covariables (HR=2,27; IC95% 1,21-4,26; incidencia en pacientes con ACOD y con AVK, 9,7 y 4,2 eventos/100 pacientes-año de seguimiento). No hubo diferencias estadísticamente significativas en las tasas de ictus (HR=1,28; IC95% 0,4-4,3), hospitalización por insuficiencia cardiaca (HR=0,92; IC95% 0,46-1.86) ni mortalidad (HR=1,02; IC95% 0,68-1,55).
ConclusionesEn pacientes de edad avanzada sometidos a TAVI y anticoagulados por fibrilación auricular, el uso de ACOD frente a AVK se asoció con un incremento de eventos hemorrágicos tardíos.
Palabras clave
El tratamiento de pacientes con estenosis aórtica grave sintomática mediante el implante percutáneo de válvula aórtica (TAVI) se ha incrementado con el tiempo y su papel ha ido evolucionando. Gracias a la evidencia creciente de distintos ensayos clínicos en pacientes con riesgo intermedio y bajo1–3 y a los avances técnicos de un procedimiento menos invasivo que una cirugía cardiaca4,5, actualmente el TAVI es una técnica de elección en el abordaje de la estenosis aórtica grave en pacientes mayores de 75 años6.
Sin embargo, aún existe controversia en cuanto al tratamiento antitrombótico tras el TAVI. El ensayo POPular TAVI demostró el aumento de los eventos hemorrágicos con doble antiagregación plaquetaria, sin que se evidenciaran diferencias en eventos isquémicos o muerte comparada con la antiagregación plaquetaria simple con ácido acetilsalicílico7. Sin embargo, todavía se desconoce cuál es la mejor opción para los pacientes con fibrilación auricular (FA) que precisan anticoagulación crónica. Se ha demostrado que los anticoagulantes orales de acción directa (ACOD) son una alternativa segura y eficaz frente a la anticoagulación con antagonistas de la vitamina K en varios ensayos clínicos pivotales8. Sin embargo, la extrapolación de estos resultados a pacientes con prótesis aórtica biológica y, en concreto, a pacientes sometidos a TAVI es controvertida. Además, el ensayo ENVISAGE-TAVI (Edoxaban Versus Vitamin K Antagonist for Atrial Fibrillation After TAVI) presentó un aumento de la incidencia de hemorragia mayor con edoxabán respecto a AVK en pacientes anticoagulados por FA tras un TAVI9.
El objetivo del presente estudio es evaluar la aparición de eventos hemorrágicos tardíos (tras la hospitalización) en pacientes sometidos a TAVI que precisan anticoagulación por FA comparando a los pacientes anticoagulados con ACOD o con AVK.
MÉTODOSDiseño y población de estudioEstudio observacional y unicéntrico con inclusión prospectiva de los pacientes sometidos a TAVI en nuestro centro entre enero de 2015 y diciembre de 2021. Se eligió este intervalo temporal con el objetivo de incluir a pacientes que recibieron prótesis de última generación cuyo tratamiento con ACOD para la prevención del ictus en la FA estuviese disponible y generalizado en nuestro medio. Se excluyó del estudio a los pacientes con FA valvular (con prótesis valvular mecánica o estenosis mitral significativa) o que recibían anticoagulación oral por otros motivos (p. ej., embolia pulmonar previa sin antecedente de FA).
La muestra se subdividió en pacientes tratados con ACOD y tratados con AVK al alta tras el TAVI. La elección de una terapia u otra quedaba a juicio del médico clínico responsable del caso. En los pacientes en tratamiento con AVK, se controlaron adecuadamente la dosis y la concentración sanguínea asegurando un tiempo en rango terapéutico>65%. Durante la estancia hospitalaria previa al TAVI, todos los pacientes recibieron heparina de bajo peso molecular y ninguno estaba en tratamiento con ACOD ni AVK por protocolo interno del centro.
El estudio se desarrolló según las recomendaciones de la Declaración de Helsinki. El Comité de Ética Asistencial local aprobó la recolección de datos y la realización del estudio. Todos los pacientes firmaron el consentimiento informado para el procedimiento y la recolección de datos.
Variables de estudioLos datos basales, del procedimiento, de la estancia hospitalaria y del alta se recogieron prospectivamente en una base de datos específica para TAVI.
Objetivo primario del estudioSe consideró como objetivo primario cualquier evento hemorrágico por el que el paciente precisase atención médica. Los eventos hemorrágicos se categorizaron según las escalas del Valve Academic Research Consortium (VARC) tanto en su segunda como en la tercera versión10,11. Se consideraron objetivos secundarios el accidente cerebrovascular o ictus, el ingreso por insuficiencia cardiaca y la mortalidad por cualquier causa. Se realizó un subanálisis tomando como objetivo las hemorragias mayores categorizadas como VARC 3 o 4.
SeguimientoTras el implante se realizó un seguimiento sistemático presencial ambulatorio de los pacientes a los 3 meses, a 1 año y anualmente desde entonces. Todos los eventos clínicos relevantes en el seguimiento se recogieron prospectivamente en una base de datos dedicada. Se interpeló a los pacientes de forma directa sobre los eventos del estudio, y se hizo una búsqueda de estos en la historia clínica del paciente. El acceso completo a la historia médica de cada paciente (en todos los centros sanitarios, tanto de atención hospitalaria como primaria) disponible en la comunidad autónoma donde se realizó el estudio minimizó la pérdida de eventos relevantes.
Análisis estadísticoLas variables continuas se presentaron como media±desviación estándar y las categóricas, como número absoluto y porcentaje. Las comparaciones se realizaron utilizando la prueba de la t de Student para variables cuantitativas con distribución normal y la prueba de la U de Mann-Whitney para variables de distribución no normal. Las variables cualitativas se compararon mediante prueba de la χ2 o el test de Fischer.
Se utilizó el modelo de regresión de Cox junto con hazard ratio (HR) y su intervalo de confianza del 95% (IC95%) para comparar las tasas de objetivos clínicos según el grupo de tratamiento (ACOD frente a AVK). Se realizó un modelo multivariable ajustando por edad y sexo, y por variables basales en las que presentaron diferencias significativas entre grupos. Se utilizó el método de Kaplan-Meier para la representación gráfica de las curvas de incidencia acumulada de los objetivos de estudio y el log-ranktest para el análisis de significación estadística. Un valor de p<0,05 se consideró significativo en todos los análisis realizados. Para el análisis estadístico se utilizó el software STATA V.14.0 (STATA Corp., Estados Unidos).
RESULTADOSDe 702 pacientes sometidos a TAVI entre enero de 2015 y diciembre de 2021, un total de 297 precisaron anticoagulación oral al alta por FA. De ellos, 206 (69,4%) recibieron tratamiento anticoagulante con AVK y 91 (30,6%) con ACOD. El diagrama de flujo del estudio se presenta en la figura 1.
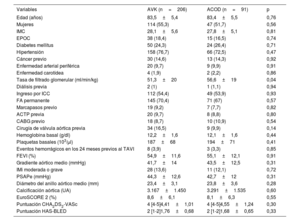
La media de edad fue 83,5±5,5 años y 161 pacientes (54.2%) eran mujeres. Las características basales de los pacientes según su grupo de anticoagulación al alta (AVK frente a ACOD) se presentan en la tabla 1. No hubo diferencias significativas entre grupos con respecto a edad, sexo, índice de masa corporal o las principales comorbilidades cardiovasculares. Hubo una tendencia a una mejor función renal basal entre los pacientes que recibieron ACOD frente a AVK (tasa de filtrado glomerular estimada, 56,6±19ml/kg/min con ACOD frente a 51,3±20ml/kg/min con AVK; p=0,04). Las cifras de hemoglobina (12,1±1,6 frente a 12,2±1,6 g/dl; p=0,44) y plaquetas (194±71 frente a 187±68×103 unidades/μl; p=0,41) basales no presentaron diferencias estadísticamente significativas entre grupos. La cohorte presentaba un riesgo intermedio-alto por EuroSCORE 2 (8,4±6,2%), sin diferencias significativas entre grupos (8,6±6,1 con AVK frente a 8,1±6,3 con ACOD; p=0,55).
Características basales de ambos grupos
| Variables | AVK (n=206) | ACOD (n=91) | p |
|---|---|---|---|
| Edad (años) | 83,5±5,4 | 83,4±5,5 | 0,76 |
| Mujeres | 114 (55,3) | 47 (51,7) | 0,56 |
| IMC | 28,1±5,6 | 27,8±5,1 | 0,81 |
| EPOC | 38 (18,4) | 15 (16,5) | 0,74 |
| Diabetes mellitus | 50 (24,3) | 24 (26,4) | 0,71 |
| Hipertensión | 158 (76,7) | 66 (72,5) | 0,47 |
| Cáncer previo | 30 (14,6) | 13 (14,3) | 0,92 |
| Enfermedad arterial periférica | 20 (9,7) | 9 (9,9) | 0,91 |
| Enfermedad carotídea | 4 (1,9) | 2 (2,2) | 0,86 |
| Tasa de filtrado glomerular (ml/min/kg) | 51,3±20 | 56,6±19 | 0,04 |
| Diálisis previa | 2 (1) | 1 (1,1) | 0,94 |
| Ingreso por ICC | 112 (54,4) | 49 (53,9) | 0,93 |
| FA permanente | 145 (70,4) | 71 (67) | 0,57 |
| Marcapasos previo | 19 (9,2) | 7 (7,7) | 0,82 |
| ACTP previa | 20 (9,7) | 8 (8,8) | 0,80 |
| CABG previo | 18 (8,7) | 10 (10,9) | 0,54 |
| Cirugía de válvula aórtica previa | 34 (16,5) | 9 (9,9) | 0,14 |
| Hemoglobina basal (g/dl) | 12,2±1,6 | 12,1±1,6 | 0,44 |
| Plaquetas basales (103/μl) | 187±68 | 194±71 | 0,41 |
| Eventos hemorrágicos en los 24 meses previos al TAVI | 8 (3,9) | 3 (3,3) | 0,85 |
| FEVI (%) | 54,9±11,6 | 55,1±12,1 | 0,91 |
| Gradiente aórtico medio (mmHg) | 41,7±14 | 43,5±12,5 | 0,31 |
| IMi moderada o grave | 28 (13,6) | 11 (12,1) | 0,72 |
| PSAPe (mmHg) | 44,3±12,6 | 42,7±12 | 0,31 |
| Diámetro del anillo aórtico medio (mm) | 23,4±3,1 | 23,8±3,6 | 0,28 |
| Calcificación aórtica (UA) | 3.167±1.450 | 3.291±1.535 | 0,60 |
| EuroSCORE 2 (%) | 8,6±6,1 | 8,1±6,3 | 0,55 |
| Puntuación CHA2DS2-VASc | 4 [4-5]4,41±1,01 | 4 [4-5]4,55±1,24 | 0,30 |
| Puntuación HAS-BLED | 2 [1-2]1,76±0,68 | 2 [1-2]1,68±0,65 | 0,33 |
ACOD: anticoagulantes orales de acción directa; ACTP: angioplastia coronaria transluminal percutánea; AVK: antagonistas de la vitamina K; CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; ICC: insuficiencia cardiaca congestiva; IMi: insuficiencia mitral; PSAPe: presión sistólica de la arteria pulmonar estimada.
* Las comparaciones para CHA2DS2-VASc y HAS-BLED se realizaron con la prueba de la U de Mann-Whitney.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
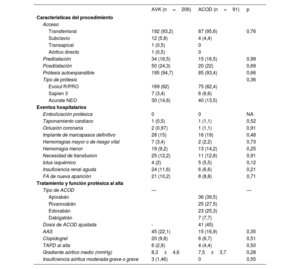
No hubo diferencias significativas entre grupos en las características basales ecocardiográficas ni con respecto a las dimensiones y la calcificación valvular aórticas (tabla 1). Los datos relacionados con el procedimiento se encuentran en la tabla 2. La mayor parte de los implantes se realizaron por vía transfemoral (94%) y con prótesis autoexpandibles (94,3%), sin diferencias estadísticamente significativas entre grupos en aspectos relacionados con el implante.
Características del procedimiento y de la estancia hospitalaria en ambos grupos
| AVK (n=206) | ACOD (n=91) | p | |
|---|---|---|---|
| Características del procedimiento | |||
| Acceso | |||
| Transfemoral | 192 (93,2) | 87 (95,6) | 0,76 |
| Subclavio | 12 (5,8) | 4 (4,4) | |
| Transapical | 1 (0,5) | 0 | |
| Aórtico directo | 1 (0,5) | 0 | |
| Predilatación | 34 (16,5) | 15 (16,5) | 0,99 |
| Posdilatación | 50 (24,3) | 20 (22) | 0,69 |
| Prótesis autoexpandible | 195 (94,7) | 85 (93,4) | 0,66 |
| Tipo de prótesis | 0,36 | ||
| Evolut R/PRO | 169 (82) | 75 (82,4) | |
| Sapien 3 | 7 (3,4) | 6 (6,6) | |
| Acurate NEO | 30 (14,6) | 40 (13,5) | |
| Eventos hospitalarios | |||
| Embolización protésica | 0 | 0 | NA |
| Taponamiento cardiaco | 1 (0,5) | 1 (1,1) | 0,52 |
| Oclusión coronaria | 2 (0,97) | 1 (1,1) | 0,91 |
| Implante de marcapasos definitivo | 28 (15) | 16 (19) | 0,48 |
| Hemorragias mayor o de riesgo vital | 7 (3,4) | 2 (2,2) | 0,73 |
| Hemorragia menor | 19 (9,2) | 13 (14,2) | 0,25 |
| Necesidad de transfusion | 25 (12,2) | 11 (12,6) | 0,91 |
| Ictus isquémico | 4 (2) | 5 (5,5) | 0,12 |
| Insuficiencia renal aguda | 24 (11,6) | 6 (6,6) | 0,21 |
| FA de nueva aparición | 21 (10,2) | 8 (8,8) | 0,71 |
| Tratamiento y función protésica al alta | |||
| Tipo de ACOD | — | — | |
| Apixabán | 36 (39,5) | ||
| Rivaroxabán | 25 (27,5) | ||
| Edoxabán | 23 (25,3) | ||
| Dabigatrán | 7 (7,7) | ||
| Dosis de ACOD ajustada | - | 41 (45) | |
| AAS | 45 (22,1) | 15 (16,9) | 0,35 |
| Clopidogrel | 20 (9,8) | 6 (6,7) | 0,51 |
| TAPD al alta | 6 (2,9) | 4 (4,4) | 0,50 |
| Gradiente aórtico medio (mmHg) | 8,3±4,6 | 7,5±3,7 | 0,28 |
| Insuficiencia aórtica moderada-grave o grave | 3 (1,46) | 0 | 0,55 |
AAS: ácido acetilsalicílico; ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; FA: fibrilación auricular; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan n (%) o media±desviación estándar.
Los eventos hospitalarios se muestran en la tabla 2. No existieron diferencias significativas entre grupos respecto a las tasas de hemorragia mayor o de riesgo vital (el 3,4% con AVK frente al 2,2% con ACOD; p=0,73), hemorragia menor (el 9,2 frente al 14,2%; p=0,25) o necesidad de transfusión sanguínea durante el ingreso (el 12,2 frente al 12,6%; p=0,91). Hubo tendencia a una mayor tasa de insuficiencia renal aguda entre los pacientes que recibieron AVK al alta (el 11,6 frente al 6,6%; p=0,2) y una mayor tasa de ictus isquémico entre los pacientes que recibieron ACOD al alta (el 2% con AVK frente al 5,5% con ACOD; p=0,12). El tratamiento antiagregante plaquetario concomitante al alta se expone en la tabla 2, y no se evidencian diferencias significativas entre grupos en cuanto al uso de AAS, clopidogrel o tratamiento antiagregante plaquetario doble. Ningún paciente recibió inhibidores del P2Y12 de mayor potencia que clopidogrel. De los 10 pacientes que recibieron tratamiento antiagregante plaquetario doble al alta, la estrategia de duración fue de 1 mes para 3 de ellos, de 3 meses para 5 y de 6 meses para 2. Los motivos para dar tratamiento antiagregante plaquetario concomitante al anticoagulante se exponen en la tabla 1 del material adicional.
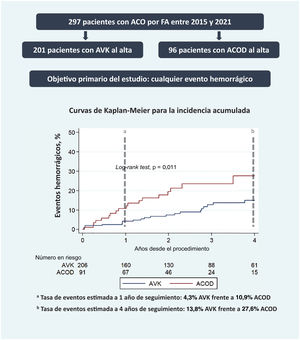
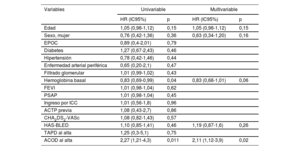
La mediana de seguimiento en general fue de 2,8 [intervalo intercuartílico, 1,6-4,2] años. Durante el seguimiento, 26 pacientes (12,6%) en tratamiento con AVK y 19 (20,9%) con ACOD presentaron eventos hemorrágicos. La incidencia total de eventos hemorrágicos fue de 5,7/100 pacientes-año de seguimiento (9,7 en el grupo de ACOD y 4,2 en el de AVK). Los pacientes que recibían ACOD tuvieron mayor riesgo de eventos hemorrágicos que los tratados con AVK (HR=2,27; IC95%, 1,21-4,26; p=0,011). Las curvas de incidencia acumulada estimadas mediante el método de Kaplan-Meier se muestran en la figura 2. Estos resultados resultaron concordantes tras ajustar por edad, sexo y función renal basal (HR=2,30; IC95%, 1,21-4,34; p=0,01). Los análisis univariable y multivariable para el objetivo primario de cualquier evento hemorrágico se muestra en la tabla 3.
Figura central. Incidencia acumulada de eventos hemorrágicos a 4 años de seguimiento según el grupo de tratamiento anticoagulante al alta tras el TAVI (AVK frente a ACOD). ACO: anticoagulantes orales; ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; FA: fibrilación auricular.
aTasa de eventos estimada por el método de Kaplan-Meier a 1 año de seguimiento: el 4,3% con AVK frente al 10,9% con ACOD.
bTasa de eventos estimada por el método de Kaplan-Meier a 4 años de seguimiento: el 13,8% con AVK frente al 27,6% con ACOD.
Análisis de regresión de Cox univariable y multivariable para el objetivo primario de cualquier tipo de evento hemorrágico
| Variables | Univariable | Multivariable | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 1,05 (0,98-1,12) | 0,15 | 1,05 (0,98-1,12) | 0,15 |
| Sexo, mujer | 0,76 (0,42-1,36) | 0,36 | 0,63 (0,34-1,20) | 0,16 |
| EPOC | 0,89 (0,4-2,01) | 0,79 | ||
| Diabetes | 1,27 (0,67-2,43) | 0,46 | ||
| Hipertensión | 0,78 (0,42-1,46) | 0,44 | ||
| Enfermedad arterial periférica | 0,65 (0,20-2,1) | 0,47 | ||
| Filtrado glomerular | 1,01 (0,99-1,02) | 0,43 | ||
| Hemoglobina basal | 0,83 (0,69-0,99) | 0,04 | 0,83 (0,68-1,01) | 0,06 |
| FEVI | 1,01 (0,98-1,04) | 0,62 | ||
| PSAP | 1,01 (0,98-1,04) | 0,45 | ||
| Ingreso por ICC | 1,01 (0,56-1,8) | 0,96 | ||
| ACTP previa | 1,08 (0,43-2,7) | 0,86 | ||
| CHA2DS2-VASc | 1,08 (0,82-1,43) | 0,57 | ||
| HAS-BLED | 1,10 (0,85-1,41) | 0,46 | 1,19 (0,87-1,6) | 0,26 |
| TAPD al alta | 1,25 (0,3-5,1) | 0,75 | ||
| ACOD al alta | 2,27 (1,21-4,3) | 0,011 | 2,11 (1,12-3,9) | 0,02 |
ACOD: anticoagulantes orales de acción directa; ACTP: angioplastia coronaria transluminal percutánea; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; PSAP: presión sistólica de la arteria pulmonar; TAPD: tratamiento antiagregante plaquetario doble.
En el subanálisis para hemorragias tipo 3 o 4 según la VARC-3 como objetivo, se observó una tendencia estadística a mayor riesgo de hemorragia en los pacientes en tratamiento con ACOD frente a AVK (log-rank test, 0,05; AVK frente a ACOD, incidencias de 1,8 y 4,7 eventos/100 pacientes-año) (figura 1 del material adicional).
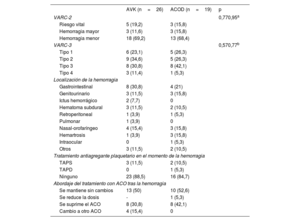
Las características de los eventos hemorrágicos para ambos grupos se presentan en la tabla 4. La hemorragia gastrointestinal fue la más frecuente en ambos (el 30,8% del grupo de AVK y el 21% del grupo de ACOD), seguido del genitourinario (el 11,5% de las hemorragias en pacientes con AVK y el 15,8% de los pacientes con ACOD). No hubo diferencias significativas en la distribución relativa de la gravedad de la hemorragia evaluada por las escalas VARC-2 (el 30,7% de las hemorragias catalogadas como mayores o de riesgo vital en el grupo de AVK frente al 31,5% en el de ACOD; p=0,95) ni VARC-3 (el 42,3% de hemorragias de tipos 3 o 4 en los pacientes con AVK frente al 47,3% en el grupo de ACOD; p=0,77).
Eventos hemorrágicos tras el alta hospitalaria en ambos grupos
| AVK (n=26) | ACOD (n=19) | p | |
|---|---|---|---|
| VARC-2 | 0,770,95a | ||
| Riesgo vital | 5 (19,2) | 3 (15,8) | |
| Hemorragia mayor | 3 (11,6) | 3 (15,8) | |
| Hemorragia menor | 18 (69,2) | 13 (68,4) | |
| VARC-3 | 0,570,77b | ||
| Tipo 1 | 6 (23,1) | 5 (26,3) | |
| Tipo 2 | 9 (34,6) | 5 (26,3) | |
| Tipo 3 | 8 (30,8) | 8 (42,1) | |
| Tipo 4 | 3 (11,4) | 1 (5,3) | |
| Localización de la hemorragia | |||
| Gastrointestinal | 8 (30,8) | 4 (21) | |
| Genitourinario | 3 (11,5) | 3 (15,8) | |
| Ictus hemorrágico | 2 (7,7) | 0 | |
| Hematoma subdural | 3 (11,5) | 2 (10,5) | |
| Retroperitoneal | 1 (3,9) | 1 (5,3) | |
| Pulmonar | 1 (3,9) | 0 | |
| Nasal-orofaríngeo | 4 (15,4) | 3 (15,8) | |
| Hemartrosis | 1 (3,9) | 3 (15,8) | |
| Intraocular | 0 | 1 (5,3) | |
| Otros | 3 (11,5) | 2 (10,5) | |
| Tratamiento antiagregante plaquetario en el momento de la hemorragia | |||
| TAPS | 3 (11,5) | 2 (10,5) | |
| TAPD | 0 | 1 (5,3) | |
| Ninguno | 23 (88,5) | 16 (84,7) | |
| Abordaje del tratamiento con ACO tras la hemorragia | |||
| Se mantiene sin cambios | 13 (50) | 10 (52,6) | |
| Se reduce la dosis | - | 1 (5,3) | |
| Se suprime el ACO | 8 (30,8) | 8 (42,1) | |
| Cambio a otro ACO | 4 (15,4) | 0 | |
ACO: anticoagulantes orales; TAPD: tratamiento antiagregante plaquetario doble; TAPS: tratamiento antiagregante plaquetario simple; VARC: Valve Academic Research Consortium.
Un total de 15 pacientes sufrieron un ictus durante el seguimiento, 10 (4,9%) en el grupo de AVK y 5 (5,5%) en el de ACOD. No hubo diferencias estadísticamente significativas en las tasas de ictus entre los pacientes de ambos grupos (HR=1,28; IC95%, 0,4-4,3; p=0,68). Las curvas de incidencia acumulada estimadas mediante el método de Kaplan-Meier para el objetivo secundario de ictus se muestran en la figura 3A.
Incidencia acumulada según el grupo de tratamiento anticoagulante al alta tras el TAVI (AVK frente a ACOD) para los eventos secundarios de ictus (A), hospitalización por insuficiencia cardiaca (B) y mortalidad por cualquier causa (C). ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; IC: insuficiencia cardiaca.
Tampoco hubo diferencias estadísticamente significativas en los objetivos secundarios de hospitalización por insuficiencia cardiaca (HR=0,92; IC95%, 0,46-1,86; p=0,84) y mortalidad por cualquier causa (HR=1,02; IC95%, 0,68-1,55; p=0,91) (figura 3B y C).
DISCUSIÓNLos principales hallazgos de nuestro estudio se pueden resumir de esta forma: a) existe una elevada incidencia de eventos hemorrágicos en pacientes sometidos a TAVI que precisan un tratamiento anticoagulante (> 5 eventos/100 pacientes-año de seguimiento); b) los pacientes que fueron dados de alta con tratamiento con ACOD presentaron una mayor tasa de eventos hemorrágicos tardíos que los tratados con AVK, y c) no hubo diferencias significativas entre ambos grupos (ACOD frente a AVK) en las tasas de ictus, insuficiencia cardiaca ni mortalidad por cualquier causa.
El riesgo hemorrágico siempre ha sido una cuestión clínica relevante en la población con TAVI. Por un lado, la estenosis aórtica grave se ha asociado con la disminución de factor de von Willebrand, debido al estrés dinámico que el flujo turbulento valvular conlleva, lo que favorece la hemorragia en estos pacientes. Además, se ha demostrado que los eventos hemorrágicos, tanto tempranos (relacionados con el procedimiento) como tardíos, tienen un impacto pronóstico en los pacientes sometidos a TAVI12,13. El riesgo hemorrágico tardío de los pacientes con TAVI no está bien detallado. Ensayos clínicos como el PARTNER 1 y 2 (en pacientes con riesgo intermedio-alto como en nuestra cohorte) han reportado tasas de hemorragia en torno al 15% al año de seguimiento, si bien se incluyeron también los eventos relacionados con el procedimiento1,14. En una cohorte de 372 pacientes consecutivos sometidos a TAVI, la tasa de eventos hemorrágicos al año de seguimiento fue del 11%, y tenían mayor riesgo aquellos con insuficiencia perivalvular significativa15. En nuestra cohorte en general la incidencia acumulada a 4 años fue del 19%, lo que pone de manifiesto que es una complicación tardía de relevante magnitud.
El tratamiento antitrombótico en pacientes con TAVI ha sido un tema de debate desde el inicio de este tratamiento y es uno de los elementos principales con impacto en el riesgo hemorrágico residual tras el TAVI. Para los pacientes que no precisan anticoagulación oral, la estrategia de tratamiento antiagregante plaquetario simple se ha extendido en los últimos años, dado su mejor perfil de seguridad (comparado con el tratamiento antiagregante plaquetario doble) y no se observa perjuicio en cuanto al riesgo isquémico7,16.
Sin embargo, el tratamiento antitrombótico de los pacientes que se someten a TAVI y con necesidad de anticoagulación por FA es aún controvertido, con escasos estudios que arrojen evidencia robusta al respecto. Parece claro que la adición de tratamiento antiagregante plaquetario al tratamiento anticoagulante de base (salvo si es estrictamente necesario por una revascularización coronaria reciente) no ha demostrado ningún beneficio y sí un aumento muy notorio de eventos hemorrágicos17. Con respecto a la selección del mejor fármaco anticoagulante, en el ensayo clínico ENVISAGE se evidenció más riesgo de hemorragia mayor entre los pacientes con TAVI tratados con edoxabán que en los tratados con AVK (9,7 y 7 eventos/100 personas-año de seguimiento)9. Estos datos están en línea con nuestra serie, si bien en nuestra cohorte no se encontraron diferencias significativas respecto a los tipos de hemorragia, mientras que el ENVISAGE observó fundamentalmente un aumento de hemorragia gastrointestinal con el uso de edoxabán. En el estudio ATLANTIS (Anti-Thrombotic Strategy After Trans-Aortic Valve Implantation for Aortic Stenosis) se comparó apixabán con el estándar de tratamiento. En los pacientes con FA que precisaban anticoagulación oral crónica (frente a AVK en el grupo de control), no se observaron diferencias significativas respecto al objetivo de seguridad de hemorragia ni en el resto de los objetivos clínicos entre estos 2 tratamientos (apixabán frente a AVK)18. Cabe destacar que el periodo de seguimiento en estos 2 estudios es relativamente bajo, con resultados a 1 y 2 años tras el TAVI respectivamente, mientras que en nuestra cohorte la mediana de seguimiento fue cercana a los 3 años. Además, cabe destacar que en nuestra cohorte las tasas de tratamiento antiagregante plaquetario concomitante fueron bajas (de un ∼30%, frente a un ∼60% en el ensayo ENVISAGE), así como un porcentaje muy alto (90%) de pacientes que ya presentaban un diagnóstico previo de FA y estaban anticoagulados. Creemos que este hecho podría condicionar un mejor control terapéutico ya desde el alta del procedimiento en los pacientes que recibían AVK (en su mayoría no recibieron un tratamiento con AVK de novo), lo que se tradujo en bajas tasas de complicaciones hemorrágicas en este grupo.
Estudios observacionales previos han comparado ambas estrategias de anticoagulación. En el análisis de Jocheim et al.19 se observaron tasas de hemorragia similares, mientras que el riesgo isquémico fue mayor en pacientes con ACOD19. Algunos estudios han reportado datos opuestos a los observados en nuestra cohorte, ya que apuntan un mayor riesgo general de hemorragia en los pacientes en tratamiento con AVK20,21. Estas diferencias podrían explicarse por el hecho de que las causas de tratamiento anticoagulante iban más allá de la FA21, lo que podría sesgar en parte los resultados, ya que los pacientes con prótesis mitral mecánica (tratados con AVK) en general presentan mayores riesgos de hemorragia y de mortalidad que la media, mientras que los pacientes sin FA y en tratamiento anticoagulante por embolia pulmonar tienen, en general, menos riesgo tanto isquémico como hemorrágico. Otro estudio que ha reportado resultados en la misma línea presenta la limitación de que los pacientes en tratamiento con AVK representaban la parte más antigua de la cohorte sometida a procedimientos de TAVI, además de tener una mayor tasa de tratamiento antiagregante plaquetario doble al alta22. Por lo tanto, se puede considerar que los factores fundamentales que explican nuestros resultados son, por un lado, la baja tasa de tratamiento antiagregante plaquetario concomitante al alta y, por otro, la elevada prevalencia de FA previa a la TAVI y de anticoagulación crónica mantenida previa al procedimiento.
Otro estudio relevante es el FRAIL AF, en el cual, pese a que no eran pacientes sometidos a TAVI, sí incluyó a pacientes de edad avanzada (media de 83 años, similar a nuestra cohorte). En este estudio se observó una mayor incidencia de hemorragia en los pacientes aleatorizados a cambio de AVK por ACOD frente a aquellos que mantenían su tratamiento previo con AVK23. La incidencia de hemorragia en este estudio fue prácticamente el doble que en nuestra muestra (17,8 y 10,5 eventos/100 pacientes-año frente a 9,3 y 4,4 respectivamente), ya que se trataba de pacientes con gran fragilidad.
Nuestro estudio no es un ensayo clínico aleatorizado, pero cabe destacar la buena comparabilidad entre grupos para las características evaluadas. Además, los principales factores de riesgo hemorrágico (edad, sexo femenino, hemoglobina basal, uso concomitante de antiagregantes plaquetarios, insuficiencia perivalvular significativa tras el TAVI) se distribuían de modo similar entre los grupos, mientras que la función renal, otro factor de riesgo hemorrágico ampliamente reconocido, fue mejor en el grupo con ACOD, por lo que no creemos que haya afectado a la dirección de los hallazgos. Además, los resultados se mantuvieron tras ajustar por esta variable. Otra característica que tener en cuenta es que los pacientes tratados con AVK presentaban un buen control de la razón internacional normalizada (INR) en nuestra cohorte, con un tiempo en rango terapéutico del 71%. Este buen control también se observó en el ENVISAGE (68,2%) y el FRAIL-AF (65-74%). Probablemente estos resultados no sean extrapolables a poblaciones con peor control de su tratamiento anticoagulante ni a aquellas que deben iniciarlo de novo.
Con respecto a la localización y la magnitud de la hemorragia, es relevante destacar que la tendencia se mantiene similar en un subanálisis para hemorragias mayores (catalogadas como tipo 3 o 4 según la VARC-3), por lo que no se puede atribuir los hallazgos del estudio exclusivamente a hemorragias leves o menores. Aun así, hay que destacar el hecho de que se produjesen 2 eventos de ictus hemorrágico en el grupo de AVK y ninguno en el de ACOD, ya que es uno de los eventos clínicos en que los ACOD han presentado mayor superioridad hasta la fecha.
Existen posibles estrategias que pueden ayudar al abordaje del riesgo hemorrágico y la terapia antitrombótica de nuestros pacientes con TAVI. En primer lugar, respetando el tratamiento con AVK de aquellos que presentan un control óptimo de la dosificación y sin eventos clínicos relevantes. En segundo lugar, ajustando adecuadamente el tratamiento antitrombótico y suspendiendo la antiagregación siempre que sea posible. En último lugar, podrían plantearse estrategias alternativas como el uso combinado de TAVI con implante de dispositivo de cierre de orejuela, que demostró ser no inferior respecto al tratamiento médico óptimo en un combinado de mortalidad por cualquier causa, ictus y hemorragia mayor a los 2 años en un reciente ensayo clínico pendiente de publicación (NCT03173534)24.
LimitacionesNuestro estudio presenta limitaciones. Se trata de un estudio observacional y unicéntrico. Sin embargo, el hecho de estar desarrollado en un único centro ha permitido un seguimiento estricto de los pacientes y acceder a su historia clínica completa, lo que evita pérdidas de seguimiento o de eventos relevantes. El hecho de que no existiese un protocolo estricto de utilización de un grupo farmacológico u otro favoreció que la muestra fuese comparable entre grupos, aunque, dada la naturaleza observacional del estudio, la posible existencia de factores de confusión desconocidos y no balanceados existe. En nuestro medio la terapia con ACOD precisa de visado de inspección médica, lo que puede influir en un sesgo de selección. Sin embargo, en nuestra cohorte ningún paciente dado de alta con un ACOD ha precisado cambio de nuevo a AVK por rechazo de la inspección médica, por lo que creemos que la influencia de este hecho es marginal. Además, los datos del tiempo en rango terapéutico durante el seguimiento clínico de los pacientes con AVK son difíciles de obtener, por lo que podría existir un sesgo por infradosificación. El estudio no siguió las directrices SAGER para las variables de sexo y género. Por último, el tamaño muestral impide comparaciones directas entre diferentes ACOD u entre ACOD individualizados frente a AVK. Para ello son necesarios futuros estudios en la práctica clínica real.
CONCLUSIONESEn pacientes de edad avanzada en tratamiento anticoagulante por FA sometidos a TAVI, el uso de ACOD frente a AVK se asoció con un incremento de eventos hemorrágicos tardíos, pero no se demostraron diferencias significativas en las tasas de ictus o mortalidad por cualquier causa.
FINANCIACIÓNNo se ha recibido financiación para el desarrollo de este artículo.
CONSIDERACIONES ÉTICASEl estudio se desarrolló de acuerdo con las recomendaciones de la Declaración de Helsinki. El Comité de Ética Asistencial local aprobó la recolección de datos y la realización del estudio. Todos los pacientes firmaron el consentimiento informado para el procedimiento y la recolección de datos.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se ha utilizado inteligencia artificial para el desarrollo de este artículo.
CONTRIBUCIÓN DE LOS AUTORESConcepto, diseño, escritura del artículo, búsqueda de la literatura y análisis estadístico: A. Alperi, R. Ptaszynski y P. Avanzas. Análisis e interpretación: todos los autores. Revisión crítica: todos los autores. Aprobación final del artículo: todos los autores. A. Alperi y R. Ptaszynski comparten la primera autoría de este manuscrito.
CONFLICTO DE INTERESESP. Avanzas es editor asociado de Rev Esp Cardiol; se ha seguido el procedimiento editorial establecido en la Revista para garantizar la gestión imparcial del manuscrito. Los demás autores no presentan conflicto de intereses.
- –
El mejor tratamiento anticoagulante de elección para pacientes sometidos a TAVI con FA es aún desconocido. Recientemente, un ensayo clínico ha demostrado que el uso de edoxabán se asocia con mayor riesgo hemorrágico en estos pacientes. Además, se ha observado que, en pacientes frágiles y ancianos con buen control con fármacos antagonistas de la vitamina K, el cambio a anticoagulantes orales de acción directa se asoció con mayor riesgo de hemorragia que con la continuación del tratamiento anticoagulante previo.
- –
En una cohorte de la práctica clínica real de pacientes con FA sometidos a TAVI, el uso de anticoagulantes orales de acción directa (ACOD) se asoció con mayor riesgo de eventos hemorrágicos en general en el seguimiento a 4 años con respecto al uso de antagonistas de la vitamina K.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2024.03.008