El efecto a largo plazo del trasplante intracoronario de células madre de médula ósea tras un síndrome coronario agudo con elevación del ST (SCACEST) es controvertido. Exponemos la evolución a largo plazo de los parámetros relacionados con la función ventricular izquierda en 29 pacientes con SCACEST sometidos a esta técnica. Se realizó resonancia magnética cardiaca basal, al sexto mes y a largo plazo (27 [24-35] meses). La fracción de eyección del ventrículo izquierdo mejoró significativamente al sexto mes (47,6±8,9% frente a 52,7±11,6%; p=0,001), mejora que se mantuvo en el seguimiento a largo plazo (52,4±11,8%; p=0,01 frente a basal, y p=0,999 frente a sexto mes). No se produjeron cambios significativos en los parámetros basales de volumen telediastólico o telesistólico ventricular izquierdo. Nuestro análisis indica que la mejora de la fracción de eyección tras el trasplante celular ocurre tempranamente, dentro de los primeros 6 meses y no se modifica a largo plazo.
Palabras clave
El objetivo de la terapia con células madre de médula ósea (CMMO) en el síndrome coronario agudo con elevación del segmento ST (SCACEST) es la recuperación del miocardio dañado tras el evento isquémico. Se han realizado diversos estudios con esta terapia, inicialmente para demostrar su seguridad y factibilidad1,2 y posteriormente para evaluar su impacto en los parámetros de función ventricular y remodelado tras el infarto1,3,4,5,6. No obstante, el efecto a largo plazo del trasplante intracoronario de CMMO en el remodelado ventricular tras un SCACEST es controvertido. Nuestro objetivo es analizar la evolución a largo plazo de los parámetros de función ventricular izquierda en los pacientes con SCACEST sometidos a trasplante intracoronario de CMMO incluidos en el estudio TECAM-piloto (terapia celular aplicada al miocardio).
MétodosEl TECAM-piloto es un ensayo clínico cuyo objetivo era valorar la factibilidad y la seguridad de un programa de trasplante intracoronario de CMMO en pacientes con un primer episodio de SCACEST reciente y reperfusión exitosa de la arteria causante. Se realizó entre 2002 y 2005 e incluyó a 64 pacientes con SCACEST con un seguimiento de 58 meses [intervalo intercuartílico (RIQ), 48-60]. El protocolo de inclusión, trasplante y seguimiento clínico se ha descrito previamente2.
En todos los pacientes realizamos un seguimiento clínico y de imagen al sexto mes. En los 29 que pertenecían a nuestra área de salud se realizó un seguimiento clínico y de imagen por resonancia magnética cardiaca (RMC) a largo plazo. Estos 29 pacientes constituyen nuestro grupo de estudio. A los demás pacientes no se ha realizado estudio de imagen a largo plazo porque no estaba incluido en el protocolo original y el seguimiento se realizó en sus hospitales de referencia.
Resonancia magnéticaLa RMC basal, al sexto mes y largo plazo (27 [24-35] meses), se realizó con un equipo General-Electric Signa 4.0 con antena de cuerpo tipo Phased-array y acoplamiento electrocardiográfico. Se realizaron secuencias de eco de gradiente en apnea en un plano longitudinal horizontal (4 cámaras) y longitudinal vertical (2 cámaras) y una secuencia eco de gradiente multicorte en eje corto del ventrículo izquierdo que lo cubría totalmente de base a ápex.
De forma centralizada, en la Unidad de Imagen Cardiaca del Hospital Clínico de Valladolid (ICICORELAB), un experto en RMC realizó el análisis. Se realizaron análisis semicuantitativo de la contractilidad segmentaria siguiendo un modelo de 16 segmentos y análisis cuantitativo de volúmenes ventriculares, masa cardiaca y fracción de eyección del ventrículo izquierdo (FEVI) utilizando el software MASS 6.1.2.
Análisis estadísticoLas variables continuas se expresan como mediana [RIQ] o media±desviación estándar y las categóricas, como valor absoluto y porcentaje. La presunción de normalidad en las variables cuantitativas se ha comprobado mediante el test de Shapiro-Wilk. En las comparaciones se utilizaron las pruebas de la t de Student y la U de Mann Whitney para variables continuas y la de la χ2 para las categóricas.
Para evaluar la evolución basal, al sexto mes y a largo plazo de los distintos parámetros de RMC se realizó un ANOVA de medidas repetidas.
Se consideró estadísticamente significativo un valor de p<0,05 y se utilizó el paquete estadístico SPSS 15.0 (Chicago, Illinois, Estados Unidos).
ResultadosDe los 29 pacientes, 24 (83%) eran varones, con una media de edad de 59±11 años. Hemos comparado las características de nuestro grupo de estudio con las de los pacientes del TECAM-piloto a los que no se realizó RMC a largo plazo, sin encontrar diferencias en cuanto a perfil clínico, tamaño del infarto o terapia administrada (Tabla 1). La Tabla 2 refleja el seguimiento al sexto mes y largo plazo (63,5 [58-75] meses) del total de pacientes del TECAM-piloto.
Tabla 1. Características del grupo de estudio (29 pacientes) y comparación con el grupo de pacientes sin seguimiento por resonancia a largo plazo (35 pacientes)
| Grupo con RM a largo plazo (n=29) | Grupo sin RM a largo plazo (n=35) | p | |
| FRCV | |||
| Tabaquismo | 19 (66) | 19 (54) | 0,362 |
| Dislipemia | 14 (48) | 11 (31) | 0,169 |
| Hipertensión arterial | 12 (41) | 12 (34) | 0,56 |
| Diabetes mellitus | 5 (17) | 4 (11) | 0,72 |
| Localización del infarto | 0,835 | ||
| Anterior | 23 (79) | 27 (77) | |
| No anterior | 6 (21) | 8 (23) | |
| Arteria causante del infarto | 0,632 | ||
| Descendente anterior | 23 (79) | 27 (77) | |
| Coronaria derecha | 4 (14) | 7 (20) | |
| Circunfleja | 2 (7) | 1 (3) | |
| Tipo revascularización | 0,406 | ||
| Angioplastia tras fibrinolisis | 20 (69) | 25 (71) | |
| Angioplastia primaria | 6 (21) | 6 (17) | |
| Angioplastia tardía (> 12h) | 3 (10) | 4 (11) | |
| Viabilidad en el ecocardiograma con dobutamina | 7 (24) | 8 (23) | 0,999 |
| Tratamiento al alta | |||
| AAS | 28 (97) | 33 (94) | 0,999 |
| Clopidrogrel | 24 (83) | 31 (89) | 0,72 |
| Anticoagulantes | 3 (10) | 5 (14) | 0,72 |
| Bloqueadores beta | 26 (90) | 34 (97) | 0,321 |
| Antagonistas del calcio | 1 (3) | 1 (3) | 0,999 |
| IECA | 23 (79) | 23 (66) | 0,228 |
| ARA-II | 1 (3) | 1 (3) | 0,999 |
| Tiempo dolor-reperfusión (min) | 173 [93-330] | 150 [90-225] | 0,75 |
| Tiempo dolor-fibrinolisis | 145 [90-200] | 135 [90-180] | 0,67 |
| Tiempo dolor-aguja | 480 [300-840] | 720 [240-1.320] | 0,446 |
| CPK máxima (U/l) | 2.370 [1.281-4.450] | 2.098 [1.331-4.221] | 0,912 |
| Troponina T máxima (ng/ml) | 6,1 [3,1-11,4] | 6,3 [3,2-10,7] | 0,871 |
| Días SCACEST-implante celular | 11 [8-14] | 9 [7-11] | 0,012 |
| Número de células implantadas | 75×106 [55-120] | 79×106 [48-90] | 0,395 |
| CD34+ (%) | 0,92 [0,65-1,45] | 1,1 [0,82-1,7] | 0,254 |
| CD133+ (%) | 0,66 [0,4-0,98] | 0,76 [0,54-1,2] | 0,462 |
| CD117+ (%) | 2 [1,2-2,6] | 2,3 [1,6-3] | 0,144 |
AAS: ácido acetilsalicílico; ARA-II: antagonistas de los receptores de la angiotensina II; CPK: creatincinasa; FRCV: factores de riesgo cardiovascular; IECA: inhibidores de la enzima de conversión de la angiotensina; RM: resonancia magnética; SCACEST: síndrome coronario agudo con elevación del segmento ST.
Los datos expresan n (%) o mediana [intervalo intercuartílico].
Tabla 2. Seguimiento del grupo total de pacientes del TECAM-piloto al sexto mes y a largo plazo
| Sexto mes | Largo plazo | |
| RMC | ||
| VTDVI (ml) | 166±46 | – |
| VTSVI (ml) | 84±40 | – |
| IMR | 1,4±0,38 | – |
| FEVI (%) | 51±12 | – |
| Eventos clínicos en el seguimiento | 17 (27) | 11 (17%) |
| IAM/angina | 8 (13) | 6 (9) |
| Nueva ACTP | 4 (6) | 4 (6) |
| Muerte cardiovascular | 0 | 0 |
| Muerte no cardiovascular | 0 | 4 (8%) |
| Neoplasia | 0 | 3 |
| Neumonía | 0 | 1 |
| Otros | 6 (9) | 3 (5) |
| Complicación vascular femoral | 2 | 0 |
| AIT | 1 | 0 |
| Flutter auricular | 1 | 0 |
| Infección local | 2 | 0 |
| Implante de desfibrilador | 0 | 3 |
| Clase clínica III o IV de la NYHA | 0 | 0 |
ACTP: angioplastia coronaria transluminal percutánea; AIT: accidente isquémico transitorio; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; IMR: índice de motilidad regional; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los datos expresan n (%) o media±desviación estándar.
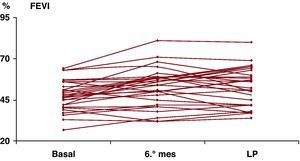
Los resultados de la RMC basal, al sexto mes y largo plazo se muestran en las Figura 1, Figura 2. No observamos diferencias estadísticamente significativas en los volúmenes telediastólico (VTD) ni telesistólico (VTS) del ventrículo izquierdo entre los tres estudios. Se observó una mejora significativa en la FEVI al sexto mes (47,6±8,9% frente a 52,7±11,6%; p=0,001), que se mantenía a largo plazo (Figura 2) (52,4±11,8%; p=0,01 frente a basal, y p=0,999 frente a sexto mes). También encontramos una mejora significativa en el índice de motilidad regional al sexto mes (1,52±0,32 basal frente a 1,35±0,36 al sexto mes, p=0,004); no obstante, esta mejora no se observa a largo plazo (1,43±0,34, p=0,353 frente a basal).
Figura 1. Evolución de los parámetros de función ventricular. IMR: índice de motilidad regional; LP: largo plazo; VTD: volumen telediastólico; VTS: volumen telesistólico.
Figura 2. Evolución de la fracción de eyección. FEVI: fracción de eyección del ventrículo izquierdo; LP: largo plazo.
No hemos encontrado ningún factor asociado a la mejora de la FEVI en nuestros pacientes. No obstante, el pequeño tamaño muestral limita la validez de esta observación.
DiscusiónNuestros resultados señalan que la terapia celular produce una mejoría temprana de la función ventricular, que se mantiene a largo plazo, como ya se ha apuntado en estudios previos.
La mayoría de los estudios en terapia celular tienen un seguimiento limitado (3-6 meses) y en la mayoría de ellos el trasplante de CMMO tras el infarto conlleva una discreta pero significativa mejora de los parámetros de función ventricular1,4,6. Son escasos los estudios que analizan el efecto a largo plazo de esta terapia y sus resultados son controvertidos. El estudio BOOST1 (BOne marrOw transfer to enhance ST-elevation infarct regeneration) mostró una mejora significativa de la FEVI mediante RMC al sexto mes en el grupo con terapia celular. Sin embargo, en el seguimiento a 18 meses3 las diferencias entre ambos grupos desaparecieron, por la mejoría del grupo control que se igualaba al grupo de trasplante celular. En un subestudio del REPAIR-AMI5 (Reinfusion of Enriched Progenitor cells And Infarct Remodeling in Acute Myocardial Infarction study) con seguimiento a 12 meses mediante RMC, se observó una mejora significativa de los parámetros de función ventricular y remodelado en relación con el trasplante de CMMO, pero sólo en los pacientes con una peor FEVI basal. En el seguimiento a 3 años del ensayo ASTAMI7 (Autologous Stem cell Transplantation in Acute Myocardial Infarction) el trasplante intracoronario de CMMO no se asoció a una mejora de la FEVI, en comparación con el grupo control. El estudio de Cao et al8, con seguimiento hasta los 4 años con ecocardiograma, encontró una mejora significativa, desde el sexto mes de seguimiento, de la FEVI y algunos parámetros de remodelado en el grupo de trasplante intracoronario de CMMO. Esta mejora se mantenía a largo plazo.
Se han propuesto varias explicaciones a las diferencias observadas entre los distintos estudios: pequeño tamaño muestral, distintas técnicas de imagen utilizadas en el seguimiento, tiempo infarto-implante celular, procesamiento celular o diferentes dosis de CMMO administradas.
El mecanismo por el cual la terapia con CMMO produce mejoría en la función ventricular es controvertido y se han propuesto varias hipótesis: algunos estudios han observado mejoras significativas en los parámetros de remodelado, fundamentalmente una disminución del VTS en el seguimiento4,5,6,8. Otros autores han señalado que la mejora puede deberse a un aumento del índice de motilidad regional en la zona perinfarto1,3. Sin embargo, otros trabajos muestran mejoras en la FEVI sin encontrar diferencias en los parámetros de remodelado ventricular1,4. En nuestro grupo no hemos encontramos variaciones significativas en el VTD o el VTS entre el estudio basal, al sexto mes y a largo plazo, por lo que la mejora de la FEVI en nuestros pacientes no está producida por estos parámetros. Sí observamos una mejora significativa al sexto mes en el índice de motilidad regional, lo que podría explicar el incremento inicial de la FEVI. Sin embargo, esta mejora inicial desaparecía en el seguimiento a largo plazo, por lo que no puede ser la causa de la mejoría de la función ventricular en nuestro grupo. Sin duda, el pequeño tamaño muestral limita la capacidad para encontrar diferencias en estos parámetros.
LimitacionesLa principal limitación de este estudio es la falta de un grupo control, por lo que no podemos concluir que la mejora de la FEVI observada en nuestros pacientes esté relacionada con el trasplante de CMMO en mayor medida que con el tratamiento estándar tras el infarto. Otra limitación es el escaso número de pacientes, que puede haber influido en que no hayamos observado variaciones significativas en los volúmenes ventriculares o índice de motilidad a largo plazo. Además, no se ha realizado RMC en el seguimiento a largo plazo a todos los pacientes del estudio original, lo que puede ser un sesgo de selección; no obstante, las características del infarto y el tratamiento administrado no difieren entre los pacientes seguidos y los no seguidos. Es evidente que se necesitan estudios multicéntricos, aleatorizados y con un periodo de seguimiento largo para poder confirmar nuestros resultados y determinar el verdadero papel de la terapia con CMMO en el remodelado postinfarto tras un SCACEST.
FinanciaciónEstudio parcialmente financiado por la Red Cooperativa de Enfermedades Cardiovasculares, RECAVA del Instituto de Salud Carlos III.
Conflicto de interesesNinguno.
Recibido 23 Febrero 2010
Aceptado 2 Junio 2010
Autor para correspondencia: Servicio de Cardiología, Hospital Clínico Universitario de Valladolid, Avda. Ramón y Cajal 3, 47005 Valladolid, España. arevillaorodea@gmail.com