Palabras clave
INTRODUCCIÓN
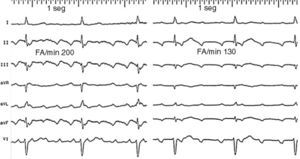
El término flúter designa un patrón electrocardiográfico de taquicardia auricular ≥ 240/min, en forma de ondulación continua, uniforme y regular, frente a las ondas P separadas por líneas isoeléctricas, características de la taquicardia auricular, con una frecuencia < 240/min (fig. 1). Pero los estudios electrofisiológicos han desvelado los mecanismos subyacentes a un electrocardiograma (ECG) de flúter y taquicardia auricular, lo que ha hecho inadecuada la clasificación clásica basada en el ECG. En este trabajo intentaremos dibujar una perspectiva actual del flúter auricular y otros mecanismos de taquicardia macrorreentrante (TMR) en su contexto clínico y una descripción de los métodos de mapeo y ablación que hacen posible el tratamiento invasivo de muchos de estos circuitos.
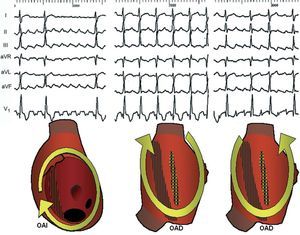
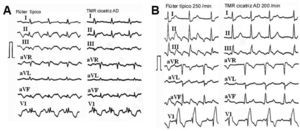
Fig. 1. Patrones de flúter típico (izquierda) y taquicardia auricular focal (derecha) en un mismo paciente. En ambos casos se registran ondas de apariencia negativa en las derivaciones inferiores, pero en el flúter hay una ondulación continua, sin línea de base estable, mientras que en la taquicardia auricular hay segmentos isoeléctricos claramente definidos que separan las ondas P negativas en cara inferior. FA/min: frecuencia auricular/min.
El término macrorreentrada designa una activación circular (reentrante) que gira alrededor de un obstáculo de «gran» tamaño, que arbitrariamente se define como de varios centímetros de diámetro1. El flúter típico, que se apoya en la estructura anatómica de la aurícula derecha (AD)2,3, es la TMR auricular más frecuente, pero en los últimos años se está produciendo una incidencia creciente de TMR debidas a cicatrices, ya sean las de cirugía cardiaca con atriotomías, ya sean las de la ablación auricular izquierda (AI) para el tratamiento de la fibrilación auricular, lo que complica el tratamiento de los pacientes que reciben estas técnicas.
Las relaciones entre flúter y fibrilación auricular son complejas. Es frecuente que ambas arritmias ocurran en diversos momentos en el mismo paciente y los estudios epidemiológicos muestran una tendencia a que los pacientes que inicialmente presentan sólo flúter desarrollen fibrilación al cabo de los años4. El flúter y la fibrilación podrían ser expresiones de un mismo sustrato arritmogénico, lo que haría necesario matizar el concepto de «curación» del flúter, ya que la ablación con catéter no actuaría en ese sustrato difuso. Por desgracia, hasta hace poco tiempo los estudios clínicos mezclaban a los pacientes con ambas arritmias y las señas de identidad del flúter quedan ocultas, al ser mucho menos frecuente que la fibrilación. Así, mientras tenemos información directa sobre la significación pronóstica, o el tratamiento farmacológico y anticoagulante de la fibrilación, los datos sobre el flúter son escasos y las recomendaciones clínicas al uso están marcadas por impresiones clínicas y acuerdos de expertos en lugar de datos5.
FLUTER TIPICO
Mecanismo del flúter típico
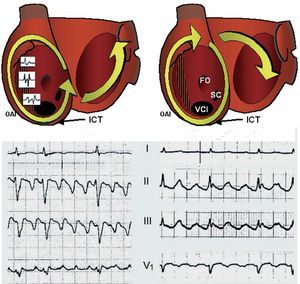
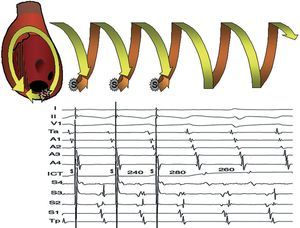
El flúter típico1, que se debe al giro de la activación alrededor de la AD (fig. 2), es el mecanismo del 75-80% de las TMR auriculares. El circuito está delimitado por delante por el anillo tricúspide y por detrás por un obstáculo mixto, anatómico y funcional, formado por las venas cavas y la cresta terminal2,3. El frente de activación desciende por la AD anterolateral y asciende por la AD septal (giro antihorario en visión oblicua anterior izquierda), con un paso obligado entre la vena cava inferior y el anillo tricúspide inferior, zona bautizada como istmo cavotricuspídeo (ICT). El giro en la AD alta puede hacerse por delante de la cava superior o a través de alguna porción permeable de la cresta terminal en otros casos. La longitud de ciclo es típicamente 240-200 ms, con una gran estabilidad (variaciones de < 20 ms), pero bajo tratamiento farmacológico o si hay retraso de conducción auricular, la longitud de ciclo (LC) puede llegar a 300 ms. Esta circunstancia es frecuente en el flúter recurrente tras ablación.
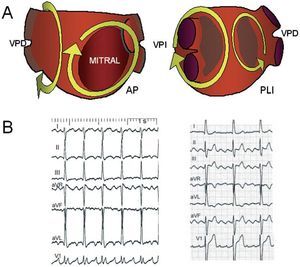
Fig. 2. Mecanismo y patrón electrocardiográfico de flúter típico (izquierda) y flúter típico inverso (derecha) en 2 pacientes distintos. Los esquemas muestran las aurículas en visión oblicua anterior izquierda con los anillos valvulares ampliados para mostrar la posición de la vena cava inferior (VCI), el seno coronario (SC), la fosa oval (FO) y la cresta terminal (CT). En el flúter típico, la reentrada en torno al anillo tricúspide es antihoraria (descendente en la AD anterior y ascendente en la AD septal), y en el típico inverso el giro es en sentido contrario. Hay un bloqueo funcional en la cresta terminal que produce potenciales dobles. El istmo cavotricuspídeo (ICT) es paso obligado del frente de activación circular. La activación de la aurícula izquierda es pasiva desde el circuito. Para más explicación, véase el texto. OAI: oblicua anterior izquierda.
Anisotropía miocárdica
Tiene gran interés el papel de la cresta terminal como línea de bloqueo funcional porque pone de relieve la importancia de la estructura miocárdica en la conducción del impulso cardiaco. En los haces de fibras miocárdicas la resistencia es menor y la velocidad de conducción mayor en sentido longitudinal que en sentido transversal al eje del haz6. Esta «asimetría» funcional se denomina anisotropía. En la cresta terminal, la anisotropía es muy acentuada porque las uniones intercelulares de baja resistencia (gap junctions) tienen una disposición término-terminal preferente, y la velocidad de conducción puede ser 10 veces mayor en sentido logitudinal que transversal7. La conducción transversal por la cresta terminal es posible en muchos casos con frecuencias bajas, pero a la frecuencia del flúter el bloqueo transversal es la norma8-10.
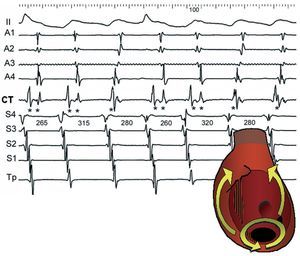
El bloqueo en la cresta da lugar al registro local de potenciales dobles, en los que cada uno de los componentes muestra la activación a uno y otro lado de la cresta11,12 (figs. 2 y 3). En el flúter, la anisotropía de la cresta terminal podría ser más acentuada que en la fibrilación auricular9, lo que apuntaría a posibles diferencias en el mecanismo de arritmias con sustratos electrofisiológicos similares. La anisotropía puede ser aumentada por los fármacos antiarrítmicos8, lo que ayudaría a explicar por qué los pacientes tratados con fármacos por una fibrilación auricular pueden desarrollar un flúter13-15. La anisotropía miocárdica puede ser también un determinante de la lentitud relativa de conducción en el ICT16, donde la dirección de los haces miocárdicos es entrecruzada y variable17,18.
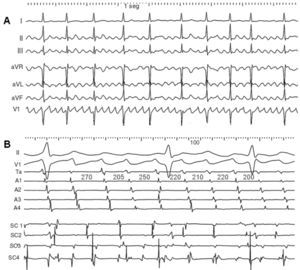
Fig. 3. Los potenciales dobles como marcadores de bloqueo de conducción en la cresta terminal (CT). Se muestran derivación II y registros de aurícula derecha (AD) anterior de arriba abajo (A1-A4), CT media-baja (CT) y aurícula derecha septal de inferior a superior (S4-Tp). Hay una alternancia de flúter típico, con bloqueo a lo largo de la CT, y de reentrada de bucle inferior, con conducción a su través. El bloqueo en la CT produce dobles potenciales (**) y activación descendente de AD anterior, mientras que cuando hay conducción por la CT el potencial local es único (*) y la activación de AD anterior es ascendente. La AD septal se activa siempre de abajo arriba. Valores en ms.
La aurícula derecha como un sustrato ideal de macrorreentrada
La combinación de grandes orificios valvulares y venosos con el obstáculo funcional en la cresta terminal hace de la AD un asiento ideal de la reentrada, y ésta es probablemente la causa de que el flúter típico tenga esa característica imagen electrocardiográfica y funcional19,20. El modelo experimental de flúter de Rosenblueth y García Ramos descrito en 194721 se basaba en un obstáculo anatómico que unía las venas cavas con una lesión de aplastamiento en la AD posterior. Esta lesión experimental replicaría el papel de la cresta terminal en el flúter humano. La disposición irregular de los haces miocárdicos en el ICT provocaría un cierto freno de la conducción en esta localización, lo que facilitaría el sostenimiento del circuito reentrante.
Flúter típico inverso
El giro antihorario de la activación (descendiendo la AD anterolateral) ocurre en el 90% de flúter típicos, pero en un 10% se registra un giro inverso u horario (ascendiendo la AD anterolateral y descendiendo la AD septal)22 (fig. 2). El motivo de esta preferencia no está aclarado, pero puede relacionarse también con la anisotropía miocárdica. Se ha detectado una mayor facilidad de bloqueo de la cresta terminal en dirección medio-lateral que latero-medial10 y en el ICT, una mayor facilidad para el bloqueo unidireccional horario, lo que facilitaría el inicio de la reentrada en sentido opuesto (antihorario). En cualquier caso, en el flúter típico inverso el circuito es idéntico, el abordaje terapéutico el mismo y sólo cambia el sentido de la activación y el patrón electrocardiográfico.
Variantes del flúter típico
La cresta terminal puede ser permeable a la conducción en sentido transversal en algunos puntos durante el flúter, de modo que el obstáculo en la pared posterior de la AD sería de amplitud variable23. En la mayor parte de los casos esto se traduce solamente en patrones de activación de la AD anterior que se hace en parte ascendente (a partir del punto donde la cresta es permeable). Donde la cresta es permeable no se registran potenciales dobles, sino únicos, aunque pueden ser anchos, ya que la conducción sigue siendo lenta (fig. 3). Se ha denominado «reentrada de asa inferior» (lower loop reentry), un circuito que rota solamente en torno a la VCI24. Estas variantes del flúter típico tienen el mismo tratamiento por ablación del ICT, que sigue siendo un punto crítico del circuito. Su importancia radica en que los patrones de ECG y de electrogramas pueden ser confusos, lo que debe tenerse en cuenta durante el estudio electrofisiológico (EF) para aplicar las técnicas oportunas de mapeo y encarrilamiento.
El electrocardiograma del flúter típico
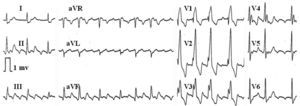
El flúter típico tiene un patrón característico en derivaciones II, III y/o aVF que fue llamado «común» y «en dientes de sierra». Es una ondulación compleja con un segmento lentamente descendente seguido de una deflexión negativa que cambia rápidamente a positiva para enlazar con el ciclo siguiente (figs. 1, 2 y 4). La frecuencia está generalmente entre 250 y 320/min, pero puede ser menor en presencia de fármacos o tras ablación del ICT. El patrón puede ser difícil de reconocer si la conducción AV es 2:1, pero se puede revelar con el aumento del grado de bloqueo mediante masaje del seno carotídeo o con verapamilo, ATP o adenosina intravenosos.
Fig. 4. Conducción auriculoventricular variable en un flúter típico. El patrón de ondas auriculares se mantiene regular, con frecuencia constante, aunque la morfología cambia en algunos puntos por la superposición de la onda T.
El flúter típico inverso produce ondas de aspecto positivo en derivaciones inferiores, frecuentemente con melladuras, pero lo más típico es una onda negativa mellada, como una W en V125 (figs. 2 y 5).
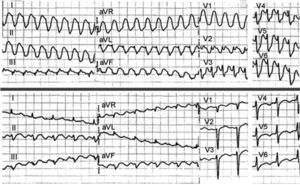
Fig. 5. Tres taquicardias macrorreentrantes (TMR) de aurícula derecha (AD) en un mismo paciente, operado de una comunicación interauricular. Izquierda: flúter típico inverso. Las ondas negativas dobles («W») en V1 son típicas, mientras en II, III y aVF la ondulación continua tiene aspecto positivo con melladuras, pero también deflexiones negativas prominentes. Centro: taquicardia macrorreentrante (TMR) de cicatriz con giro horario en OAD. La conducción auriculoventricular 2:1 hace difícil discernir el tipo de onda auricular, pero parece difásica en II y aVF y positiva en V1. Derecha: TMR de cicatriz con giro antihorario en OAD. El electrocardiograma muestra un patrón indistinguible del flúter típico. OAD: oblicua anterior derecha.
El circuito del flúter típico puede producir un ECG atípico en pacientes con cardiopatía orgánica, atriotomías quirúrgicas o lesiones de ablación auricular26. La onda de flúter se debe en parte a la activación AI, lo que explicaría la falta de especificidad del ECG27. En casos con ECG atípico, sólo el estudio electrofisiológico puede aclarar el mecanismo. Por otro lado, un ECG de flúter típico en pacientes sin cirugía o ablación previa predice un circuito típico, dependente del ICT con el 90% de probabilidad (fig. 6).
Fig. 6. Visión de conjunto de las relaciones entre los mecanismos de macrorreentrada auricular y los patrones de electrocardiograma (ECG). La anchura del triángulo en cada mecanismo de taquicardia indica la frecuencia relativa de ese patrón con ese mecanismo. Flúter atípico designa cualquier patrón auricular de ondulación continua y frecuencia (240/min), que no reúne las condiciones del flúter típico o típico inverso (v. texto). Taquicardia auricular designa los patrones con ondas P bien definidas entre líneas de base estables con frecuencia < 240 lat/min. AD: aurícula derecha; AI: aurícula izquierda; TMR; taquicardia macrorreentrante; ICT: istmo cavotricuspídeo.
Respuesta ventricular en el flúter
Es una paradoja clásica de las arritmias auriculares que una frecuencia de activación auricular más alta produce mayor grado de bloqueo AV y menor frecuencia ventricular. En el flúter, la conducción AV es frecuentemente 2:1, incluso en reposo y bajo fármacos frenadores de la conducción, y si la frecuencia del flúter es más lenta la conducción puede ser hasta 1:1 (fig. 7). Pero la frecuencia ventricular también puede ser irregular debido a patrones complejos de bloqueo en el nodo AV, por lo que no se debe diagnosticar sistemáticamente fibrilación auricular cuando la respuesta ventricular es irregular (fig. 4). La irregularidad de los complejos QRS puede hacer difícil reconocer un patrón regular auricular, pero ésa no es una dificultad insalvable con una observación atenta y cuidadosa.
Fig. 7. Arriba: flúter típico lento (200/min) con conducción AV 1:1 y QRS ancho en una paciente tratada con flecainida por fibrilación auricular paroxística. Abajo: unos minutos después, paso espontáneo a conducción 2:1 con normalización del complejo QRS.
Etiopatogenia del flúter típico
Los antecedentes y las enfermedades asociadas al flúter son similares a los de la fibrilación auricular, incluidos la hipertensión arterial, la enfermedad coronaria, las valvulopatías, la enfermedad pulmonar obstructiva crónica, las miocardiopatías y un 15-20% de corazones aparentemente sanos, pero con un 80% de individuos varones28-30. La dilatación de la AD se asocia al flúter31, mientras la disfunción ventricular izquierda32 y la dilatación AI se asocian con la incidencia de fibrilación después de la ablación del flúter33. Estudios electrofisiológicos del flúter han demostrado retrasos de la conducción similares a los detectados en la fibrilación34,35, lo que tendería a confirmar la presencia de un sustrato electrofisiológico común.
La presentación clínica del flúter con frecuencia se entrelaza con la fibrilación auricular. En algunos casos, el flúter es un iniciador de la fibrilación y la ablación de flúter reduce la incidencia de fibrilación31. En otros casos, los focos ectópicos iniciadores en la fibrilación son la causa del flúter, y éste desaparece tras la ablación de los focos36. Finalmente, el flúter puede aparecer en pacientes que inicialmente presentaban sólo fibrilación, al ser tratados con fármacos antiarrítmicos13,14.
Manifestaciones clínicas
El flúter puede ser paroxístico, con un cuadro clínico similar al de otras arritmias paroxísticas. Cuando el paciente tiene flúter y fibrilación paroxísticos, el flúter suele tolerarse peor debido a la frecuencia ventricular más alta. La conducción AV en el flúter auricular tiende a ser 2:1, con una frecuencia ventricular estable de 130-150 lat/min, y responde con mayor dificultad que la fibrilación a la digitalización o a los bloqueadores beta y los antagonistas del calcio. Ocasionalmente se observa conducción AV 1:1, con una frecuencia ventricular en torno a 240-250 lat/min en ausencia de preexcitación. Cuando el flúter es persistente, la frecuencia ventricular elevada puede producir una miocardiopatía dilatada (taquimiocardiopatía), que es reversible37. En otros casos, especialmente en ancianos, la conducción AV puede ser 3:1 o 4:1, con una frecuencia ventricular bien tolerada o incluso lenta.
Los fármacos antiarrítmicos (amiodarona, flecainida, propafenona) pueden hacer pasar la fibrilación a flúter, y también pueden hacer disminuir la frecuencia del flúter a ≤ 200/min. En esta situación puede haber conducción AV 1:1 con un complejo QRS ensanchado por aberrancia de conducción, imitando una taquicardia ventricular13,14 (fig. 7).
Se estima que la incidencia de embolia sistémica en el flúter se sitúa en torno a 1/3 la de la fibrilación38 y no hay estudios que permitan valorar el balance riesgo/beneficio de las diversas estrategias de anticoagulación en pacientes que presenten exclusivamente flúter. Cuando el flúter se asocia con fibrilación, el riesgo es determinado por la fibrilación39.
Tratamiento del flúter típico
Las indicaciones de tratamiento están marcadas por su mala tolerancia, la escasa o adversa respuesta a los fármacos antiarrítmicos y la posibilidad de eliminar el circuito por ablación con catéter. Los estudios que comparan el mantenimiento del ritmo frente al control de la frecuencia en la fibrilación auricular40-42 no son aplicables al flúter, porque la tolerancia clínica de éste es peor y por la eficacia de la ablación.
Cardioversión y fármacos antiarrítmicos
La cardioversión eléctrica del flúter tiene un éxito próximo al 100%, pero el flúter también se puede interrumpir en un 85-90% de los casos con estimulación rápida de AD, usando un marcapaso transitorio o un marcapaso definitivo43 (fig. 8). La disponibilidad de estas dos técnicas hace sencillo resolver el problema de un flúter agudamente mal tolerado con un mínimo de riesgo.
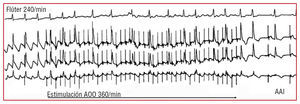
Fig. 8. Cardioversión de un flúter auricular por estimulación rápida en un paciente portador de marcapaso auricular (AAI). La estimulación rápida (espículas) cambia totalmente el patrón del flúter típico del ECG y, al interrumpirse la estimulación, el ritmo es estimulado a demanda por el propio marcapasos.
La cardioversión farmacológica del flúter con antiarrítmicos tipo IC (flecainida, propafenona) no está indicada porque, al contrario que en la fibrilación auricular, la eficacia es reducida (cerca del 40%) y, además, el enlentecimiento del flúter puede llevar a conducción AV 1:1 (fig. 7)13,14,44-46. Serían efectivos para interrumpir el flúter en administración intravenosa los fármacos de clase III (dofetilida, ibutilida), que primariamente prolongan la duración del potencial de acción sin frenar la conducción miocárdica, pero a cambio tienen el riesgo de producir taquicardias ventriculares polimorfas (torsade de pointes)44. Estos fármacos de clase III no están disponibles en España.
La incidencia de recurrencias del flúter tras la cardioversión podría ser inferior que en la fibrilación47,48 por lo que, en los casos en que la tolerancia de la arritmia sea buena, se puede contemplar una estrategia conservadora, de observación clínica tras la cardioversión de un primer episodio. En cambio, si se producen recurrencias o si el primer episodio es mal tolerado, el tratamiento debe ser la ablación con catéter, que ofrece una prevención de recurrencias en más del 90% de los casos a largo plazo30.
Cuando el flúter es una consecuencia del tratamiento de una fibrilación con fármacos antiarrítmicos se suele considerar la aparición de flúter como un éxito parcial y muchos de estos enfermos se consiguen estabilizar en ritmo sinusal manteniendo el fármaco antiarrítmico tras una ablación del circuito de flúter. Es lo que se conoce como terapia híbrida49,50.
Estudio electrofisiológico, mapeo y ablación con catéter
La ablación del flúter se basa en la bien establecida base mecanística y anatómica, que hace del ICT un paso obligado del circuito51,52, y su objetivo es el bloqueo bidireccional del ICT53,54 por aplicación de radiofrecuencia o crioablación. La clara definición anatómica del objetivo permite un procedimiento reglado mediante la utilización de un catéter de referencia con múltiples electrodos que cubren la AD anterior y septal para registrar la secuencia de activación, y otro deflectable para mapear, estimular y hacer la ablación del ICT55,56. Cuando el ECG es típico y no hay antecedentes de atriotomía, se puede hacer la ablación del ICT en ritrmo sinusal, pero con cirugía previa, cuando varios circuitos son posibles o cuando el ECG no es típico o muestra varios patrones, resulta imprescindible confirmar la participación de la AD y el ICT en el circuito por técnicas de mapeo y estimulación durante flúter espontáneo o inducido.
Encarrilamiento transitorio del flúter
El encarrilamiento transitorio fue descrito en pacientes con flúter durante el postoperatorio de cirugía cardiaca57, y luego se ha confirmado en otras taquicardias reentrantes. La estimulación de la AD alta a una frecuencia superior a la del flúter aceleraba la frecuencia auricular, pero manteniendo la negatividad de las ondas en derivaciones inferiores, y al interrumpir la estimulación se restablecía el patrón y la frecuencia basales. Si la estimulación cambiaba la polaridad de la onda, el flúter se interrumpía y daba paso a ritmo sinusal. Esta aceleración del circuito con la estimulación, mientras se mantiene su configuración, es la esencia del encarrilamiento. En realidad es el circuito el que encarrila la activación, como los raíles encarrilan un tren, y ese encarrilamiento conduce el frente de activación estimulado por dentro del circuito. Cada estímulo actito al penetrarlo en el mismo sentido de la activación basal y, a la vez, lo detiene al penetrarlo en el sentido inverso57-59 (fig. 9).
El encarrilamiento tiene muchos aspectos interesantes, pero uno es esencial en la práctica: la duración del ciclo de retorno (primero no estimulado) medida en el punto de estimulación (fig. 9). Si se estimula en el mismo circuito, el ciclo de retorno es similar (diferencia ¾ 20 ms) al basal del flúter. Pero si el punto estimulado está fuera del circuito, al ciclo de retorno de la taquicardia se suman los tiempos de conducción hasta y desde el circuito, por lo que el ciclo de retorno en el punto de estimulación es largo. Basándose en este principio, el encarrilamiento del flúter desde el ICT confirma o descarta si es un flúter típico (fig. 10).
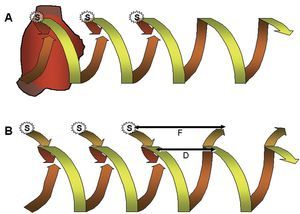
Fig. 9. Representación esquemática del mecanismo del encarrilamiento de una TMR. La activación circular reentrante se muestra con una dimensión de tiempo, dibujando una forma helicoidal (muelle o tirabuzón). Arriba (A): encarrilamiento del flúter auricular típico por estimulación (S) en la AD alta. A la derecha se muestran 2 ciclos espontáneos de la TMR, ascendente en el septo y descendente en la AD anterior. Cada estímulo inicia un frente de activación descendente en AD anterior, igual al del flúter, pero adelantado, y a la vez inicia otro frente hacia la AD septal que colisiona con la activación ascendente del circuito de flúter. El último frente estimulado reinicia el circuito de flúter a la frecuencia previa a la estimulación y el primer ciclo «de retorno» es igual al ciclo del flúter, porque se está estimulando en el mismo circuito. Abajo (B): cuando el estímulo que encarrila se aplica a una distancia del circuito, el primer ciclo no estimulado es igual al basal de la taquicardia dentro del circuito (D), pero en el punto de estimulación a este intervalo se añaden los tiempos de conducción hasta el circuito y desde el circuito, lo que produce un ciclo más largo (F). Tanto en A como en B hay una «fusión» entre la activación del circuito que permanece igual a la basal y la cambiada por el frente estimulado.
Fig. 10. Encarrilamiento «oculto» de flúter común estimulando el istmo carotricuspídeo (ICT). De arriba abajo el trazado muestra derivaciones I, II y V1 y registros de AD anterior, de arriba (Ta) abajo (A4), a continuación ICT y AD septal de inferior (S4) a techo (Tp). El panel superior muestra esquemáticamente la secuencia de la activación, descendente en AD anterior y ascendente en AD septal. Los primeros 3 ciclos son encarrilados (S) y desde ICT y longitud de ciclo (LC) de todo el circuito se ha acortado a 240 ms, pero la AD anterior aún se activa de arriba abajo y no hay cambios en el ECG (encarrilamiento oculto, sin fusión). Al interrumpir la estimulación, el flúter vuelve a la LC original (280 ms) y el ciclo de retorno en ICT es igual a la LC del flúter, lo que demuestra que está dentro del circuito.
Ablación con catéter
El objetivo de la ablación es el ICT, la parte más estrecha del circuito, bien delimitada anatómicamente, fácilmente accesible y lejana del nodo AV60 (fig. 11). La ablación busca producir un bloqueo completo, bidireccional y persistente del ICT, lo que requiere normalmente varias aplicaciones de radiofrecuencia o crioablación, entre el borde tricuspídeo y la VCI. Algunos autores propusieron seleccionar los puntos de ablación con ayuda del encarrilamiento61,62, pero esta práctica está abandonada a favor de la referencia anatómica apoyada en la secuencia de electrogramas del ICT. Si la ablación se hace durante el flúter, la activación se interrumpe bruscamente cuando el ICT se bloquea, lo que confirma su papel en el circuito. Sin embargo, el bloqueo que interrumpe el flúter puede ser transitorio y suele ser necesario continuar la ablación, mientras se comprueba la activación de la AD y del ICT por estimulación a uno y otro lado de éste53,54. Esta maniobra resulta imprescindible para confirmar el bloqueo del ICT y minimizar las recurrencias (5-10%). Una vez conseguido el bloqueo es necesario comprobar su persistencia durante 20-30 min, porque puede ser aún reversible63,64.
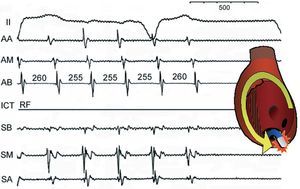
Fig. 11. Interrupción de un flúter auricular típico durante aplicación de radiofrecuencia (RF) en el istmo cavotricuspídeo (ICT). Se muestran derivación II y electrogramas de AD anterior alta (AA), media (AM) y baja (AB), ICT y AD septal baja (SB), media (SM) y alta (SA). La activación ascendente en la AD septal sigue a la descendente de la AD anterior hasta que se bloquea el ICT, lo que detiene el frente de activación. Valores en ms.
La ablación puede ser difícil técnicamente cuando el miocardio del ICT es grueso y la anatomía irregular, que dificulte la estabilidad del catéter17,18. La tendencia actual es utilizar aplicaciones de radiofrecuencia de hasta 60-70 W con electrodos largos (8-10 mm), o bien electrodos refrigerados con suero salino que con energías más bajas producen lesiones profundas, con lo que se consigue el bloqueo bidireccional en un 85-90% de los casos65,66. Las aplicaciones de radiofrecuencia pueden ser dolorosas y requieren sedación, mientras que la crioablación es indolora67.
Las complicaciones son infrecuentes. Aparte de una incidencia de problemas vasculares en las venas femorales, se ha descrito < 1% de bloqueo AV cuando la ablación se hace sobre la AD septal, en lugar del ICT68. Las aplicaciones con electrodo irrigado pueden, excepcionalmente, provocar perforación auricular y taponamiento cardiaco69.
Tras la ablación se interrumpe la administración de fármacos antiarrítmicos, excepto en los pacientes que desarrollaron flúter durante el tratamiento farmacológico de una fibrilación, en los que han de continuarse indefinidamente49,50.
Anticoagulación en pacientes con flúter auricular
No hay datos precisos sobre la incidencia de embolias sistémicas en pacientes con flúter, y mucho menos sobre el balance riesgo/beneficio de la anticoagulación70-72. En general se han adoptado las mismas pautas de anticoagulación que en pacientes con fibrilación; sin embargo, en casos con alto riesgo de hemorragias estas normas podrían hacerse más flexibles. Antes de una cardioversión, ya sea por corriente continua o estimulación, se anticoagula al paciente durante 3-4 semanas o se descartan trombos en la aurícula izquierda (AI) por ecografía transesofágica. Tras la cardioversión se mantiene la anticoagulación durante 4 semanas. La interrupción del flúter persistente por ablación se considera en este sentido igual que la cardioversión71.
Pronóstico a largo plazo
Una vez conseguido el bloqueo del ICT, el flúter recidiva en un 5-10% de los casos, generalmente en los 3 meses, y la reablación es, en general, más fácil técnicamente51,53,54,66-68. Algunos pacientes desarrollan otras taquicardias auriculares o necesitan marcapasos por enfermedad del nódulo sinusal concomitante 29,73. La ablación puede hacer que los fármacos antiarrítmicos previamente ineficaces se hagan eficaces en la prevención de las recidivas de flúter, lo que en casos escogidos proporciona otra alternativa terapéutica.
Aunque en algunos casos la ablación de flúter hace desaparecer episodios concomitantes de fibrilación auricular, la incidencia de fibrilación del 25-30% es el mayor condicionante del pronóstico y la calidad de vida de estos pacientes29,30,73-76. Esta incidencia es mayor en pacientes con fibrilación antes de la ablación o si hay disfunción ventricular izquierda o dilatación AI. Pero aun en estos casos, la ablación del flúter puede ser una interesante contribución al tratamiento, ya que los episodios de flúter suelen ser peor tolerados y, cuando el flúter ocurre durante el tratamiento farmacológico de la fibrilación, la ablación del flúter permite un control de ambas arritmias hasta en dos tercios de los casos49,50,76.
La ablación del flúter puede curarlo, pero la actuación clínica no debería detenerse aquí. Una historia detallada puede revelar la presencia de bronconeumopatía crónica, apnea de sueño, hipertensión arterial, obesidad u otros procesos cuyo tratamiento podría ayudar a detener el proceso arritmogénico subyacente.
FLÚTER ATIPICO Y TAQUICARDIAS MACRORREENTRANTES ATIPICAS
Desde la definición del circuito de flúter típico se han conocido otros tipos de TMR en ambas aurículas, en las que la activación gira en torno a una gran variedad de obstáculos orgánicos y/o funcionales. Aunque el ECG con frecuencia es clasificable como «taquicardia auricular», se suele usar el término flúter para designar estas arritmias reentrantes atípicas (flúter atípico, flúter izquierdo) (fig. 6). Son bien conocidas las TMR por atriotomías en la AD77 y, más recientemente, las causadas por la ablación con catéter de la fibrilación auricular78.
Taquicardias macrorreentrantes auriculares derechas
Las TMR atípicas se asocian con cardiopatía estructural, especialmente con antecedentes de cirugía cardiaca, no dependen del ICT y tienen como obstáculo central una cicatriz de atriotomía quirúrgica o zonas de bajo voltaje que se consideran cicatrizales, generalmente unidas a obstáculos anatómicos normales.
Taquicardias macrorreentrantes atípicas de cicatriz
La más simple está basada en una cicatriz quirúrgica en la AD lateral, que forma un obstáculo fijo, sola o unida a la VCS por una zona de bloqueo funcional79. El circuito tiene su punto de giro (istmo) en el borde inferior de la cicatriz, cerca de la VCI, o entre dos zonas cicatrizales de la AD lateral80-82. La TMRA de cicatriz casi siempre coexiste con el flúter típico, y frecuentemente se detecta tras la ablación de éste, al producirse un cambio de la secuencia de activación y del ECG. El encarrilamiento desde el ICT y la AD septal muestra ciclos de retorno más largos que el de la taquicardia (fig. 12), mientras que los ciclos de retorno mediante la estimulación de la AD lateral son iguales a los de la taquicardia. El mapeo de la pared lateral muestra una línea de electrogramas dobles de arriba abajo, cerrada en su extremo inferior por un electrograma fragmentado, que demuestra conducción lenta en el punto de giro72,83,84 (figs. 12 y 13). La presión del catéter de mapeo en este punto puede detener la taquicardia, lo que demuestra su relevancia para el circuito; la aplicación de radiofrecuencia interrumpe definitivamente el circuito. Se han descrito con poca frecuencia circuitos de reentrada en torno a un parche de cierre de un defecto septal interauricular85.
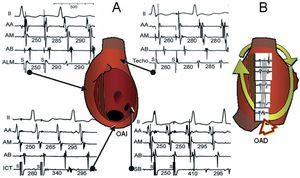
Fig. 12. Estudio electrofisiológico de una taquicardia macrorreentrante (TMR) de cicatriz de aurícula derecha (AD) tras ablación del ICT por flúter típico. A: 4 paneles con derivación II y registros endocavitarios de AD anterior alta (AA), media (AM), baja (AB) y electrodo explorador utilizado para encarrilar desde diversos puntos. La activación de AD anterior es descendente. El ciclo de retorno es de 340 ms en ICT y 410 ms en SB, más largos que la longitud de ciclo (LC) basal (280-295), porque están fuera del circuito. El ciclo de retorno es igual al basal en la AD anterolateral media (ALM) y techo de AD, que si forman parte del circuito. B: visión del circuito de MR en oblicua anterior derecha. En el centro se registra una línea de dobles potenciales que convergen en su parte inferior (flecha), donde la aplicación de radiofrecuencia interrumpió la taquicardia. Valores en ms.
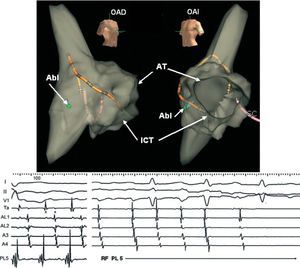
Fig. 13. Mapeo y ablación de flúter típico y taquicardia macrorreentrante (TMR) de cicatriz en arteria derecha (AD) con sistema Navx'®. Arriba: reconstrucción virtual de la anatomía de la AD en proyecciones oblicuas anterior derecha (OAD) e izquierda (OAI). Abajo: registro de derivaciones I, II y V1 y endocavitarios de AD superior (Ta), anterolateral alta y media (AL1, AL2) y anterior. Se identifican las posiciones del catéter de mapeo estable en la AD y de referencia espacial en seno coronario. El catéter explorador (Abl) está en la AD posterolateral (PL5), donde se registraba un potencial ancho y fragmentado. Nótese la activación descendente de la AD anterolateral y la presencia de potenciales dobles en los registros de AD lateral alta (* *), marcando una zona de bloqueo.
El ECG de la TMR de cicatriz puede ser muy similar al del flúter típico o completamente distinto (figs. 5, 6 y 14) por lo que, en presencia de antecedentes de atriotomía quirúrgica, la interpretación del ECG es difícil y el estudio electrofisiológico es imprescindible para precisar el diagnóstico. El patrón es habitualmente de «taquicardia auricular» (fig. 14), con una frecuencia < 240 lat/min y líneas isoeléctricas bien definidas. Resulta importante revisar los ECG registrados para detectar varios patrones que permitan sospechar la coexistencia de más de un circuito, para planear la ablación.
Fig. 14. Electrocardiograma de flúter típico y taquicardia macrorreentrante (TMR) de cicatriz de AD en dos pacientes. A: varón de 42 años con anomalía de Ebstein, operado de cierre de comunicación interauricular. B: varón de 40 años operado de cierre de comunicación interventricular. El flúter típico es fácilmente reconocible en el panel de la izquierda en ambos casos. La TMR de cicatriz dibuja líneas isoeléctricas entre ondas P, especialmente en B, con una frecuencia más lenta.
El tratamiento de la TMR de cicatriz es la ablación del istmo inferior, cercano a la VCI. Es necesario tener en cuenta la proximidad del nervio frénico para prevenir lesionarlo85. La cartografía de estas TMR puede facilitarse con la utilización de reconstrucciones virtuales de la anatomía auricular, que ayuden a orientar al operador hacia los puntos críticos (fig. 13), pero estas técnicas no son imprescindibles.
El pronóstico de la TMRA de cicatriz tras la ablación es excelente. En nuestra experiencia de 10 casos, en los últimos 10 años no se ha producido ninguna recidiva de la TMRA, aunque sí alguna del flúter típico. El flúter típico es la arritmia más frecuente en pacientes con atriotomías quirúrgicas86 y la ablación del ICT, y está indicada en estos casos, aunque no se haya documentado previamente el flúter típico.
Taquicardia macrorreentrante atípica sin atriotomía
Se han descrito TMR de AD no dependientes del ICT, en los que la activación gira en torno a la VCS, que con frecuencia incluyen también una zona o línea de bloqueo funcional en la AD lateral87-90. El punto de giro inferior del circuito está generalmente en la cara lateral de la aurícula, cerca de la VCI. El estudio electrofisiológico proporcionaría datos similares a los de la TMRA tras la atriotomía, y el tratamiento de ablación sería similar. Se han descrito circuitos de reentrada contenidos dentro de la VCS89. El pronóstico a largo plazo de estos casos no se conoce, debido a su escasa frecuencia, y debería estar condicionado por la enfermedad subyacente.
Taquicardia macrorreentrante atípica tras la cirugía de cardiopatías congénitas complejas
Los contextos arritmógenos más problemáticos son las cirugías de Mustard, Sening y Fontan. En las operaciones de Mustard y Senning, no sólo hay complejas incisiones que pueden ser la base de circuitos de reentrada, sino que el acceso al circuito puede ser muy difícil por la presencia del material sintético o parches de pericardio suturados para crear las derivaciones84,91. Incluso en estas situaciónes, el circuito de flúter dependiente del ICT es causante de la taquicardia, pero el acceso al ICT ha de hacerse por vía transaórtica, o atravesando los parches con técnica de punción transeptal, lo que supone un reto técnico importante.
Tras la cirugía de Fontan, a las cicatrices quirúrgicas se une la gran dilatación auricular con zonas de fibrosis miocárdica, que hacen enormemente compleja la delimitación de circuitos concretos89,93. En estos casos se ha propuesto la ablación durante ritmo sinusal, dirigida a unir unas zonas fibróticas con otras para impedir el giro de la activación. El pronóstico a largo plazo resulta incierto por el daño auricular preexistente y el añadido por la ablación.
A las TMR se pueden añadir mecanismos focales de taquicardia, lo que hace aún más compleja la valoración de estos pacientes92.
Taquicardia macrorreentrante de aurícula izquierda
Se asocian generalmente con cardiopatía orgánica y/o alteraciones del miocardio auricular importantes94. Las TMR de AI se apoyan generalmente en zonas amplias de inactividad eléctrica, consideradas cicatrizales, aunque carecemos de correlación anatómica95,96. Tras la cirugía valvular mitral, la cicatriz quirúrgica puede formar el centro de giro97. Los circuitos de TMR de AI pueden ser muy variados, sin predominio de ninguno en concreto. La activación puede girar en torno al anillo mitral, a las venas pulmonares o a zonas de inactividad eléctrica (fig. 15). El patrón de ECG es muy variable, desde un flúter atípico a una taquicardia a < 200 lat/min (figs. 6 y 15). El voltaje en las derivaciones inferiores tiende a ser bajo, mientras que en las precordiales derechas se registran deflexiones amplias98. La activación de la AD generalmente no es circular, pero podría aparentarlo en los casos con bloqueo del ICT, ya sea funcional o tras ablación, y en estos pacientes el ECG puede parecer un flúter típico. El encarrilamiento desde la AD mostrará ciclos de retorno largos, pero pueden ser cortos en el seno coronario. La definición de los circuitos necesita cateterismo transeptal y mapeo electroanatómico, con reconstrucción virtual de la anatomía auricular, para localizar los istmos críticos.
Fig. 15. A: esquemas de distintos circuitos descritos en taquicardia macrorreentrante (TMR) de la aurícula izquierda (AI). A la izquierda, proyección anteroposterior (AP); a la derecha, proyección posterolateral izquierda (PLI). VPD: venas pulmonares derechas; VPI: venas pulmonares izquierdas. Las zonas irregulares sombreadas son áreas de bajo voltaje, atribuidas a fibrosis miocárdica. B: electrocardiograma de 2 pacientes con TMR de AI, el de la izquierda con un patrón indicativo de «taquicardia auricular»; el de la derecha, de «flúter atípico».
El pronóstico de la TMR de AI es incierto. No disponemos de series amplias con seguimiento prolongado para conocer el balance riesgo-beneficio de la ablación de estos circuitos. Una proporción de al menos un 25% de los casos puede desarrollar fibrilación en el seguimiento corto96, y en el resto es dudosa la función mecánica de la AI. La ablación de la TMR de AI debe reservarse a indicaciones muy seleccionadas en las que la calidad de vida del paciente esté gravemente afectada por la taquicardia y no se controle con fármacos. La ablación del nodo AV seguida de implantación de un marcapaso sería un tratamiento alternativo en estos casos.
Recientemente se ha reconocido la incidencia de TMR de AI tras la ablación «circunferencial» de las venas pulmonares en pacientes con fibrilación auricular99,100, como consecuencia de las cicatrices no transmurales creadas101. Estas arritmias, cuyo pronóstico a largo plazo es desconocido, son una de las cuestiones pendientes de resolver para conocer el efecto a largo plazo de estos procedimientos agresivos en el tratamiento de la fibrilación auricular102.
FLUTER TIPO II
El término «flutter tipo II» fue acuñado por Wells et al103 para designar un tipo de flúter regular, muy rápido (> 340 lat/min), que no se podía interrumpir por estimulación. Posteriormente, este término se ha utilizado para designar cualquier tipo de flúter atípico, pero no es una denominación apropiada1. En el laboratorio de electrofisiología se observan con frecuencia aceleración y cambio de activación de un flúter tras sobreestimulación, que podrían equivaler a las observaciones de Wells. No disponemos de información que permita valorar la significación clínica del flúter tipo II.
Fibrilo-flúter
Algunos ECG muestran una actividad auricular ondulante que a primera vista sugiere un flúter atípico, pero que en un análisis más detenido tiene irregularidades en la frecuencia y la configuración (fig. 16). Ante la duda, se ha aplicado el término «fibrilo-flúter» a estos casos. El mapeo endocavitario muestra patrones de activación irregulares y cambiantes, que indica la ausencia de un circuito estable dominante. El «fibrilo-flúter» sería una arritmia más afín a la fibrilación que al flúter y las probabilidades de poder controlarla por ablación de un istmo concreto serían escasas.
Fig. 16. «Fibrilo-flúter». A: el electrocardiograma muestra ondas auriculares bien definidas que, a primera vista, son regulares, pero que en realidad varían ligeramente de frecuencia y morfología. B: los registros endocavitarios muestran variación importante de ciclos y de secuencia de activación en AD anterior (Ta a A4, de superior a inferior) y electrogramas fragmentados y cambiantes en el seno coronario (SC1-SC4, en cm de proximal a distal, desde el ostium). Valores en ms.
La Dra. Ana Paula Magalhaes recibe financiación de una beca de la Fundación Miguel Servet, de Medtronic Ibérica, S.A.
Correspondencia: Dr. F. García-Cosío.
Servicio de Cardiología. Hospital Universitario de Getafe.
Carretera de Toledo, km. 12,5. 28905 Getafe. Madrid. España.