La reserva fraccional de flujo o el índice instantáneo en el periodo libre de ondas se han convertido en criterios estándar para la revascularización. Se buscó evaluar la asociación entre las características cuantitativas de placa valoradas por ecocardiografía intravascular (IVUS) o tomografía de coherencia óptima (OCT) y la gravedad de la estenosis fisiológica.
MétodosSe evaluaron un total de 365 estenosis en 330 pacientes. Se exploró la asociación entre los parámetros derivados de la IVUS o la OCT y los índices fisiológicos en reposo (índice instantáneo en el periodo libre de ondas, reposo de ciclo cardiaco completo y relación de presión diastólica) y la reserva fraccional de flujo.
ResultadosEntre el total de lesiones, 50,7% y 58,1% mostraron índice instantáneo en el periodo libre de ondas ≤ 0,89 y reserva fraccional de flujo ≤ 080, respectivamente. Los parámetros derivados de la IVUS o de la OCT mostraron correlaciones significativas con los índices fisiológicos en reposo (p <0,005). Los mejores valores de corte del área luminal mínima (ALM) del IVUS, la carga de placa, el OCT-ALM y el porcentaje de área de la estenosis por OCT para predecir la significación funcional fueron los mismos (IVUS-ALM: 3,4 mm2, carga de placa 72,0%, OCT-ALM: 2,0 mm2, OCT-área de la estenosis: 68,0%) para todos los índices fisiológicos en reposo (índice instantáneo en el periodo libre de ondas, reposo de ciclo cardiaco completo y relación de presión diastólica). Los mejores valores de corte para la reserva fraccional de flujo fueron IVUS-ALM de 3,8 mm2, carga de placa del 70,0%, OCT-ALM de 2,3 mm2, OCT-área de la estenosis de 65,0%. Independientemente de los parámetros derivados del IVUS y OCT, las predicciones generales de diagnóstico de los parámetros fueron inferiores al 70% y los índices de discriminación fueron inferiores a 0,75 para los índices fisiológicos en reposo o reserva fraccional de flujo.
ConclusionesLos índices fisiológicos en reposo mostraron una correlación idéntica con las características cuantitativas de la placa definidas por IVUS u OCT. La reserva fraccional de flujo mostró una correlación más fuerte con los parámetros IVUS u OCT que los índices fisiológicos en reposo. La precisión diagnóstica y la capacidad de discriminación de los parámetros anatómicos fueron modestas para predecir la significación funcional definida por los índices fisiológicos invasivos hiperémicos y de reposo.
Ensayo clínico registrado en ClinicalTrials.gov (Identificador: NCT03795714).
Palabras clave
Dadas las limitaciones inherentes de la coronariografía para mostrar la presencia de una estenosis coronaria epicárdica significativa y la discrepancia existente entre la intensidad de la estenosis angiográfica y la presencia de isquemia miocárdica1,2, los índices fisiológicos invasivos como la reserva fraccional de flujo (RFF) o el índice instantáneo en el periodo libre de ondas (iFR) han pasado a ser un método estándar para orientar la toma de decisiones clínicas respecto a la revascularización3. La ecografía intravascular (IVUS) o la tomografía de coherencia óptica (OCT) son técnicas intracoronarias de diagnóstico por imagen que permiten realizar una evaluación más exacta de las características anatómicas de la placa. En varios estudios previos se ha explorado el valor diagnóstico de los parámetros cuantitativos definidos mediante la IVUS o la OCT para predecir la trascendencia funcional definida por la RFF4–18 y se ha observado una exactitud diagnóstica solo moderada; el mejor valor de corte de los parámetros cuantitativos derivados de la IVUS o la OCT fueron diferentes según la población de pacientes de que se tratara, los vasos sanguíneos evaluados y la localización de las lesiones diana. De todos modos, la frecuencia de uso de la toma de decisiones guiada por la RFF continúa siendo baja, y en un porcentaje sustancial de los pacientes se opta por una toma de decisiones basada en las imágenes intravasculares19.
Desde que se desarrollara el iFR, se han introducido en la práctica clínica cotidiana varios índices fisiológicos derivados de la presión en reposo, como son el ciclo cardíaco completo en reposo (RFR) o la relación de presión diastólica (dPR). Un reciente estudio ha mostrado un rendimiento diagnóstico idéntico20,21 y las consecuencias pronósticas de los valores de iFR, RFR y dPR22. Dado que estos índices derivados de la presión en reposo son fáciles de utilizar durante la práctica clínica diaria, se prevé que la facilidad de uso haga que aumente el porcentaje de adopción de la evaluación fisiológica. Por consiguiente, conocer la asociación existente entre los índices fisiológicos disponibles y las características anatómicas de la placa observadas en las exploraciones por imagen intravascular podría ser importante para la toma de decisiones clínicas en los pacientes con enfermedad coronaria.
El objetivo de ese estudio es evaluar la asociación existente entre las características cuantitativas de la placa determinadas mediante IVUS u OCT y la intensidad de la estenosis fisiológica evaluada mediante índices fisiológicos en reposo e hiperémicos (iFR, RFR, dPR y RFF).
MÉTODOSDiseño del estudio y población de pacientesSe incluyó en el estudio a los pacientes consecutivos a los que se practicó una coronariografía invasiva por indicación clínica y se evaluó también usando índices fisiológicos invasivos y exploraciones de IVUS u OCT de al menos 1 arteria coronaria en 2 hospitales universitarios (Seoul National University Hospital y Samsung Medical Center) entre mayo de 2009 y noviembre de 2018. Se excluyó a los pacientes con inestabilidad hemodinámica, disfunción del ventrículo izquierdo o un vaso culpable del síndrome coronario agudo. Una parte de la población de este estudio ya se había incluido en otro estudio publicado1,2,23,24. No hubo ninguna indicación obligatoria para la exploración por imagen intravascular, que se realizó en función de criterios clínicos, por decisión del operador. El protocolo de estudio específico para el presente análisis fue aprobado por el Consejo de Revisión Interno o el Comité de Ética de cada centro participante, y el protocolo del estudio se atuvo a lo establecido en la Declaración de Helsinki (identificador de clinicaltrials.gov: NCT03795714).
Análisis angiográfico y coronariografía cuantitativaLa coronariografía se llevó a cabo con técnicas estándares. Las imágenes angiográficas se obtuvieron tras administración intracoronaria de nitrato (100 o 200 μg). Todas las coronariografías se analizaron en un laboratorio central, utilizando enmascaramiento. La coronariografía cuantitativa se realizó en proyecciones óptimas con un programa informático validado (CAAS II, Pie Medical Imaging, Maastricht, Países Bajos). Se midió la estenosis mediante el porcentaje del diámetro, el diámetro luminal mínimo, el tamaño del vaso de referencia y la longitud de la lesión. Se determinó la puntuación SYNTAX según lo descrito en publicaciones anteriores25.
Parámetros fisiológicos coronariosTodos los parámetros fisiológicos coronarios se determinaron después de la coronariografía diagnóstica según métodos descritos con anterioridad2,22,23. En resumen, se utilizó un catéter guía de calibre 5-7 Fr para abordar la arteria coronaria. Se calibró a cero la guía con sensor de presión-temperatura (Abbott Vascular, Santa Clara, CA, Estados Unidos) y se igualó a la presión aórtica; a continuación se colocó en el segmento distal de un vaso diana. Se administró nitroglicerina intracoronaria (100 o 200 μg) antes de cada conjunto de determinaciones fisiológicas. Se calculó la Pd/Pa en reposo mediante el cociente de la presión media en la arteria coronaria distal respecto a la presión media aórtica en estado de reposo. El iFR se calculó mediante algoritmos automáticos basados en el periodo libre de ondas, durante un mínimo de 5 latidos, según un método descrito con anterioridad2,26,27. Se analizaron los registros de presión en reposo mediante un script de MatLab específico para ello que utiliza un algoritmo independiente del ECG28. Se utilizó una infusión continua de adenosina (140 μg/kg/min) o de nicorandil (2mg en bolo) para inducir hiperemia29,30. Se determinó la presión aórtica proximal (Pa) y la presión arterial distal (Pd) en hiperemia, y se calculó la RFF mediante el valor medio más bajo de 3 latidos consecutivos durante la infusión de adenosina o después de la administración de nicorandil. Después de las determinaciones, se retiró la guía de presión hasta el catéter guía y se verificó una posible desviación de la presión. Todas las determinaciones de la presión se realizaron y se validaron en el laboratorio central utilizando enmascaramiento.
El RFR se calculó a partir de cada onda con un algoritmo informático offline totalmente automático (Abbott Vascular, Santa Clara, CA, Estados Unidos) tras una estandarización de la frecuencia de muestreo de la presión a 100Hz, según lo descrito en publicaciones anteriores20. De manera resumida, fue necesario un mínimo de 5 ciclos cardiacos consecutivos para determinar el RFR. Para eliminar los artefactos de señal inherentes a la medición de subciclos, se aplicó un filtro de paso bajo a la Pd/Pa fásica. El RFR se definió como el punto en el que el cociente de la Pd respecto a la Pa alcanzaba un valor más bajo durante todo el ciclo cardiaco20. La dPR se calculó también para cada onda mediante el promedio de Pd/Pa a lo largo de todo el periodo de diástole, según lo descrito en publicaciones anteriores21. El cálculo del RFR y la dPR a partir de los datos del registro de presión se llevó a cabo en el laboratorio central utilizando enmascaramiento (Samsung Medical Center). Se consideró que las lesiones con valores ≤ 0,8922,31,32 tenían trascendencia funcional para los parámetros de iFR, RFR y dPR, y las cifras ≤ 0,80 lo tenían para la RFF.
Adquisición y análisis de imágenes de ecografía intravascular o tomografía de coherencia ópticaLa IVUS se realizó de la manera estándar usando un sistema de retirada (pullback) motorizado automático (0,5 mm/s) con catéteres de obtención de imagen comerciales (OptiCross, Boston Scientific, Mineápolis, MN, Estados Unidos) después de la administración intracoronaria de 200 μg de nitroglicerina. Las imágenes se grabaron digitalmente para un análisis offline y se analizaron con un programa informático comercial (Echoplaque 4.0, INDEC Medical System, Santa Clara, CA, Estados Unidos) en un laboratorio central (Seoul National University Hospital) utilizando enmascaramiento. La evaluación de la morfología bidimensional y tridimensional de la lesión y otras mediciones de las imágenes de IVUS se realizaron según lo establecido en el documento de consenso de expertos clínicos sobre las normas de adquisición, medición y notificación de las exploraciones de IVUS del American College of Cardiology33. Los parámetros cuantitativos medios en la IVUS fueron el área de membrana elástica externa (MEE), el área transversal de la luz (AT), el área luminal mínima (ALM) y el área de la placa más la capa media (P + M). La carga de placa (CP) se calculó de la siguiente forma: [(AT de P + M) / (AT de MEE)] × 100.
Las imágenes de OCT se obtuvieron con un catéter comercial (Dragon Fly, Abbott Vascular, Santa Clara, CA, Estados Unidos). Todos los datos de OCT se grabaron digitalmente y se transfirieron a un laboratorio central (Samsung Medical Center), donde fueron analizados por un investigador independiente con enmascaramiento. Las mediciones de la OCT se realizaron con un programa informático propio para un análisis offline (LightLab Imaging). El área luminal se determinó en el corte transversal con el área luminal más pequeña y en el segmento de referencia, que se definió como el fotograma con una luz más grande en los 10mm proximales o distales al ALM antes de cada rama lateral. La estenosis porcentual del área (EA) basada en la exploración de OCT se calculó de la siguiente forma: ([área luminal de referencia – ALM] / área luminal de referencia) × 100. La longitud de la estenosis se definió como la región circundante al ALM en que el área luminal era < 50% del área luminal de referencia. Si había múltiples estenosis en el vaso diana, se elegía la estenosis con un ALM más pequeña como lesión representativa para usarla en el presente análisis. La elección de la modalidad de diagnóstico por imagen se hizo a criterio del operador. No se utilizaron las 2 exploraciones, IVUS y OCT, en ninguno de los pacientes.
Análisis estadísticoLas variables cualitativas se presentan como número y frecuencia relativa (porcentaje) y las variables continuas, como media ± desviación estándar, cuya distribución se verificó con la prueba de Kolmogorov-Smirnov. Los datos se analizaron por pacientes individuales para determinar las características clínicas y por lesiones para los demás análisis. Se utilizó un análisis de regresión lineal para calcular el coeficiente de correlación entre las variables cuantitativas. La asociación entre los parámetros cuantitativos derivados de la IVUS o la OCT y los índices fisiológicos invasivos se representó gráficamente mediante la recta de regresión LOWESS (homogeneización de la gráfica de dispersión ponderada localmente). Para los análisis realizados por lesiones, se utilizó una ecuación de estimación generalizada para un ajuste de la variabilidad intraindividual entre los vasos del mismo paciente. Se presentan los valores estimados de media e intervalo de confianza del 95% (IC95%) en forma de resumen de estadística descriptiva. No se aplicó ningún ajuste post hoc.
El rendimiento diagnóstico de los parámetros cuantitativos basados en la IVUS o la OCT para la predicción de la trascendencia funcional definida por los índices fisiológicos invasivos se presenta mediante los datos de sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razón de verosimilitud positiva, razón de verosimilitud negativa y exactitud diagnóstica. Se evaluó la función de discriminación con un análisis del área bajo la curva de características operativas del receptor, y se comparó el área bajo la curva con el método de DeLong. Todos los valores de probabilidad fueron bilaterales y se consideraron estadísticamente significativos los valores de p < 0,05. Para los análisis estadísticos se utilizó el programa SPSS versión 18.0 (SPSS Inc., Chicago, Illinois, Estados Unidos) y el programa R 3.5.2 (R Corporation, Estados Unidos).
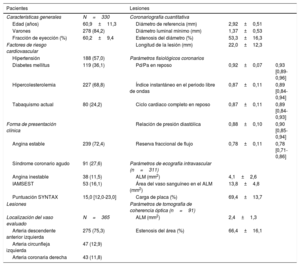
RESULTADOSCaracterísticas de los pacientes y las lesionesEn la tabla 1 se muestran las características de la población del estudio y de las lesiones diana. La mayor parte de los pacientes presentaban una angina estable (72,4%) y una estenosis intermedia, con un valor medio de porcentaje de estenosis angiográfica del 53,3±16,3% (mediana, 54,9% [intervalo intercuartílico, 43,6-65,5%]) y una media de RFF de 0,78±0,11 (mediana, 0,78 [0,71-0,86]). En 311 lesiones evaluadas mediante IVUS, la media de ALM fue de 4,1±2,6mm2 y la CP, 69,4±13,7%. En 91 lesiones evaluadas mediante OCT, la media de ALM fue de 2,4±1,3mm2 y la EA, del 66,4±16,1% (tabla 1).
Características generales de los pacientes y las lesiones
| Pacientes | Lesiones | |||
|---|---|---|---|---|
| Características generales | N=330 | Coronariografía cuantitativa | ||
| Edad (años) | 60,9±11,3 | Diámetro de referencia (mm) | 2,92±0,51 | |
| Varones | 278 (84,2) | Diámetro luminal mínimo (mm) | 1,37±0,53 | |
| Fracción de eyección (%) | 60,2±9,4 | Estenosis del diámetro (%) | 53,3±16,3 | |
| Factores de riesgo cardiovascular | Longitud de la lesión (mm) | 22,0±12,3 | ||
| Hipertensión | 188 (57,0) | Parámetros fisiológicos coronarios | ||
| Diabetes mellitus | 119 (36,1) | Pd/Pa en reposo | 0,92±0,07 | 0,93 [0,89-0,96] |
| Hipercolesterolemia | 227 (68,8) | Índice instantáneo en el periodo libre de ondas | 0,87±0,11 | 0,89 [0,84-0,94] |
| Tabaquismo actual | 80 (24,2) | Ciclo cardiaco completo en reposo | 0,87±0,11 | 0,89 [0,84-0,93] |
| Forma de presentación clínica | Relación de presión diastólica | 0,88±0,10 | 0,90 [0,85-0,94] | |
| Angina estable | 239 (72,4) | Reserva fraccional de flujo | 0,78±0,11 | 0,78 [0,71-0,86] |
| Síndrome coronario agudo | 91 (27,6) | Parámetros de ecografía intravascular (n=311) | ||
| Angina inestable | 38 (11,5) | ALM (mm2) | 4,1±2,6 | |
| IAMSEST | 53 (16,1) | Área del vaso sanguíneo en el ALM (mm2) | 13,8±4,8 | |
| Puntuación SYNTAX | 15,0 [12,0-23,0] | Carga de placa (%) | 69,4±13,7 | |
| Lesiones | Parámetros de tomografía de coherencia óptica (n=91) | |||
| Localización del vaso evaluado | N=365 | ALM (mm2) | 2,4±1,3 | |
| Arteria descendente anterior izquierda | 275 (75,3) | Estenosis del área (%) | 66,4±16,1 | |
| Arteria circunfleja izquierda | 47 (12,9) | |||
| Arteria coronaria derecha | 43 (11,8) | |||
ALM: área luminal mínima; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; Pd/Pa: presión coronaria distal respecto a aórtica en reposo; SYNTAX: puntuación Synergy between percutaneous coronary intervention with Taxus and Cardiac Surgery.
Los valores expresan media ± desviación estándar, mediana [intervalo intercuartílico] o n (%).
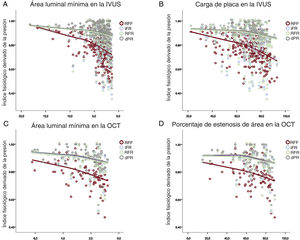
Todos los parámetros anatómicos de gravedad de lesión mostraron correlaciones significativas con los índices fisiológicos invasivos (figura 1). Los valores de RFR, dPR e iFR mostraron un valor similar del coeficiente de correlación con la IVUS-ALM (R=0,253, R = 0,245 y R = 0,244 respectivamente; todos, p < 0,001), la CP (R=−0,243, R = −0,237 y R = −0,236 respectivamente; todos, p < 0,001), la OCT-ALM (R=0,358, R = 0,346 y R = 0,351; todos, p < 0,001) y la OCT-EA (R=0,300, R = −0,295 y R = −0,303; todos, p < 0,001). La RFF mostró una correlación más estrecha con los parámetros antes citados que con los índices fisiológicos en reposo (IVUS-ALM, R=0,410; CP, R=−0,423; OCT-ALM, R=0,434; OCT-EA, R=-0,379; todos, p < 0,001; todas las comparaciones con los índices en reposo, p < 0,001). Además, hubo una correlación significativa entre la longitud de la lesión en la IVUS y todos los índices fisiológicos (R=−0,233, R = −0,220, R = −0,229 y R = −0,260 para los valores de iFR, RFR, dPR y RFF). En el análisis de subgrupos de la longitud de la lesión ≥ 20mm, el diámetro del vaso de referencia ≥ 3,0mm o la descendente anterior izquierda (DAI) como vaso diana, la correlación entre los parámetros de IVUS o de OCT y la RFF fue uniformemente superior a la existente con los índices en reposo ().
Asociación entre los índices derivados de la presión y los parámetros derivados de la IVUS o la OCT. Los gráficos de dispersión de puntos muestran la asociación del área luminal mínima en la IVUS (A), la carga de placa en la IVUS (B), el área luminal mínima en la OCT (C) y el porcentaje de estenosis del área en la OCT (D) con los índices fisiológicos invasivos (iFR, RFR, dPR y RFF). Todos los parámetros mostraron una correlación significativa con los índices fisiológicos invasivos. dPR: relación de presión diastólica; iFR: índice instantáneo en el periodo libre de ondas; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; RFF: reserva fraccional de flujo; RFR: reposo de ciclo cardiaco completo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
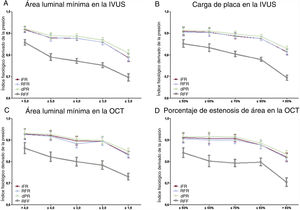
En la figura 2 y la tabla 2 se muestra el valor de los índices fisiológicos invasivos en función de los distintos grados de intensidad de la estenosis evaluados mediante IVUS-ALM, CP, OCT-ALM y EA. Todos los índices fisiológicos en reposo se reducían de manera significativa al disminuir el valor de IVUS-ALM o OCT-ALM y al aumentar la IVUS-CP o la OCT-EA (todos, p < 0,010). Independientemente de cuáles fueran los índices de intensidad de la estenosis anatómica, los puntos de transición significativos de iFR, RFR y dPR fueron idénticos para todos los criterios (IVUS-ALM ≤ 4,0mm2, IVUS-CP > 80%, OCT-ALM ≤ 1,5mm2, OCT-EA > 80%) (tabla 2).
Cambios en los índices fisiológicos invasivos según los parámetros derivados de la IVUS o la OCT. Cambios de los índices fisiológicos invasivos en reposo y en hiperemia según el área luminal mínima en la IVUS (A), la carga de placa en la IVUS (B), el área luminal mínima en la OCT (C) y el porcentaje de estenosis del área en la OCT (D). dPR: relación de presión diastólica; iFR: índice instantáneo en el periodo libre de ondas; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; RFF: reserva fraccional de flujo; RFR: reposo de ciclo cardiaco completo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Comparación de los índices en reposo según el diferente grado de estenosis angiográfica y hemodinámica
| Área luminal mínima en la IVUS (mm2) (N = 311) | pb | |||||
|---|---|---|---|---|---|---|
| > 5,0mm2 | 4,0-5,0mm2 | 3,0-4,0mm2 | 2,0-3,0mm2 | ≤ 2,0mm2 | ||
| Pacientes, n | 67 | 45 | 88 | 76 | 35 | |
| Pd/Pa en reposo | 0,95±0,01 | 0,92±0,01a | 0,92±0,01 | 0,91±0,01 | 0,86±0,02 | <0,001 |
| iFR | 0,92±0,01 | 0,88±0,02a | 0,88±0,01 | 0,86±0,01 | 0,79±0,02 | <0,001 |
| RFR | 0,92±0,01 | 0,88±0,02a | 0,88±0,01 | 0,86±0,01 | 0,79±0,02 | <0,001 |
| dPR | 0,92±0,01 | 0,89±0,01a | 0,89±0,01 | 0,87±0,01 | 0,81±0,02 | <0,001 |
| RFF | 0,86±0,01 | 0,79±0,02a | 0,77±0,01 | 0,75±0,01 | 0,70±0,02 | <0,001 |
| Carga de placa en la IVUS, % (N=311) | pb | |||||
|---|---|---|---|---|---|---|
| ≤ 50% | 50-60% | 60-70% | 70-80% | > 80% | ||
| Pacientes, n | 32 | 34 | 62 | 117 | 66 | |
| Pd/Pa en reposo | 0,95±0,01 | 0,94±0,01 | 0,93±0,01 | 0,93±0,01 | 0,89±0,01a | <0,001 |
| iFR | 0,91±0,01 | 0,91±0,02 | 0,89±0,01 | 0,88±0,01 | 0,81±0,02a | <0,001 |
| RFR | 0,91±0,01 | 0,90±0,01 | 0,89±0,01 | 0,88±0,01 | 0,81±0,02a | <0,001 |
| dPR | 0,91±0,01 | 0,91±0,01 | 0,90±0,01 | 0,88±0,01 | 0,83±0,02a | <0,001 |
| RFF | 0,85±0,02 | 0,83±0,02 | 0,80±0,01 | 0,78±0,01 | 0,69±0,01a | <0,001 |
| Área luminal mínima en la OCT (mm2) (N=91) | pb | |||||
|---|---|---|---|---|---|---|
| > 4,0mm2 | 3,0-4,0mm2 | 2,0-3,0mm2 | 1,5-2,0mm2 | ≤ 1,5mm2 | ||
| Pacientes, n | 11 | 15 | 17 | 18 | 30 | |
| Pd/Pa en reposo | 0,95±0,01 | 0,94±0,01 | 0,93±0,01 | 0,93±0,01 | 0,90±0,01a | 0,004 |
| iFR | 0,93±0,01 | 0,92±0,02 | 0,90±0,02 | 0,89±0,01 | 0,83±0,02a | 0,001 |
| RFR | 0,93±0,01 | 0,92±0,01 | 0,88±0,02 | 0,89±0,02 | 0,83±0,02a | 0,001 |
| dPR | 0,93±0,01 | 0,93±0,01 | 0,90±0,02 | 0,90±0,01 | 0,85±0,02a | 0,002 |
| RFF | 0,86±0,01 | 0,82±0,01 | 0,80±0,03 | 0,78±0,02 | 0,73±0,02a | <0,001 |
| Estenosis del área en la OCT (%) (N=91) | pb | |||||
|---|---|---|---|---|---|---|
| ≤ 50% | 50-60% | 60-70% | 70-80% | > 80% | ||
| Pacientes, n | 14 | 11 | 25 | 22 | 19 | |
| Pd/Pa en reposo | 0,94±0,01 | 0,93±0,02 | 0,93±0,01 | 0,93±0,01 | 0,88±0,01a | 0,012 |
| iFR | 0,91±0,02 | 0,91±0,02 | 0,91±0,02 | 0,88±0,02 | 0,82±0,02a | 0,003 |
| RFR | 0,91±0,02 | 0,90±0,02 | 0,90±0,02 | 0,88±0,02 | 0,82±0,02a | 0,005 |
| dPR | 0,92±0,02 | 0,92±0,02 | 0,91±0,01 | 0,89±0,02 | 0,83±0,02a | 0,003 |
| RFF | 0,84±0,01 | 0,80±0,03 | 0,79±0,02 | 0,80±0,01 | 0,70±0,02a | <0,001 |
dPR: relación de presión diastólica; iFR: índice instantáneo en el periodo libre de ondas; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; Pd/Pa: presión coronaria distal respecto a la aórtica; RFF: reserva fraccional de flujo; RFR: ciclo cardiaco completo en reposo.
Los valores expresan media ± el 95% de error estándar.
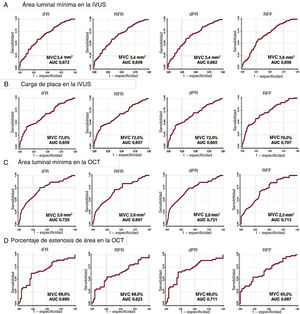
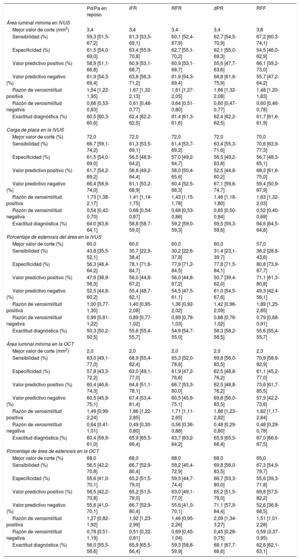
En la figura 3 y la tabla 3 se muestra el mejor valor de corte de los parámetros derivados de la IVUS o la OCT para predecir una estenosis funcionalmente trascendente, definida según los valores de iFR, RFR, dPR o RFF y su correspondiente rendimiento diagnóstico. El mejor valor de corte de la IVUS-ALM, la IVUS-CP, la IVUS-EA, la OCT-ALM y la OCT-EA fue el mismo en los diversos índices fisiológicos en reposo (IVUS-ALM, 3,4mm2; IVUS-CP, 72,0%; IVUS-EA, 60,0%; OCT-ALM, 2,0mm2, y OCT-EA, 68,0%). El mejor valor de corte de los parámetros derivados de la IVUS o la OCT para la RFF se identificó en los casos de estenosis menos intensa (IVUS-ALM, 3,8mm2; IVUS-CP, 70,0%; IVUS-EA, 57,0%; OCT-ALM, 2,3mm2, y OCT-EA, 65,0%) (figura 3).
Rendimiento diagnóstico de los parámetros anatómicos para la identificación de las lesiones funcionalmente trascendentes definidas con los índices fisiológicos invasivos. Mejor valor de corte y área bajo la curva del área luminal mínima en la IVUS (A), la carga de placa en la IVUS (B), el área luminal mínima en la OCT (C) y el porcentaje de estenosis del área en la OCT (D) para los valores de iFR, RFR, dPR y RFF respectivamente. AUC: área bajo la curva; dPR: relación de presión diastólica; iFR: índice instantáneo en el periodo libre de ondas; IVUS: ecografía intravascular; MVC: mejor valor de corte; OCT: tomografía de coherencia óptica; RFF: reserva fraccional de flujo; RFR: ciclo cardiaco completo en reposo.
Rendimiento diagnóstico de los parámetros anatómicos para la identificación de lesiones funcionalmente trascendentes definidas por los índices fisiológicos invasivos
| Pd/Pa en reposo | iFR | RFR | dPR | RFF | |
|---|---|---|---|---|---|
| Área luminal mínima en IVUS | |||||
| Mejor valor de corte (mm2) | 3,4 | 3,4 | 3,4 | 3,4 | 3,8 |
| Sensibilidad (%) | 59,3 [51,5-67,2] | 61,3 [53,5-69,1] | 60,1 [52,4-67,9] | 62,7 [54,5-70,9] | 67,2 [60,3-74,1] |
| Especificidad (%) | 61,5 [54,0-69,0] | 63,4 [55,9-70,8] | 62,7 [55,1-70,2] | 62,1 [55,0-69,3] | 54,5 [46,0-62,9] |
| Valor predictivo positivo (%) | 58,9 [51,1-66,8] | 60,9 [53,1-68,7] | 60,9 [53,1-68,7] | 55,6 [47,7-63,6] | 66,1 [59,2-73,0] |
| Valor predictivo negativo (%) | 61,9 [54,3-69,4] | 63,8 [56,3-71,2] | 61,9 [54,3-69,4] | 68,8 [61,6-75,9] | 55,7 [47,2-64,2] |
| Razón de verosimilitud positiva | 1,54 [1,22-1,95] | 1,67 [1,32-2,13] | 1,61 [1,27-2,05] | 1,66 [1,32-2,08] | 1,48 [1,20-1,83] |
| Razón de verosimilitud negativa | 0,66 [0,53-0,83] | 0,61 [0,48-0,77] | 0,64 [0,51-0,80] | 0,60 [0,47-0,77] | 0,60 [0,46-0,78] |
| Exactitud diagnóstica (%) | 60,5 [60,3-60,6] | 62,4 [62,2-62,5] | 61,4 [61,3-61,6] | 62,4 [62,2-62,5] | 61,7 [61,6-61,9] |
| Carga de placa en la IVUS | |||||
| Mejor valor de corte (%) | 72,0 | 72,0 | 72,0 | 72,0 | 70,0 |
| Sensibilidad (%) | 66,7 [59,1-74,2] | 61,3 [53,5-69,1] | 61,4 [53,7-69,2] | 63,4 [55,3-71,6] | 70,6 [63,9-77,3] |
| Especificidad (%) | 61,5 [54,0-69,0] | 56,5 [48,9-64,2] | 57,0 [49,2-64,7] | 56,5 [49,2-63,8] | 56,7 [48,3-65,1] |
| Valor predictivo positivo (%) | 61,7 [54,2-69,2] | 56,8 [49,2-64,4] | 58,0 [50,4-65,6] | 52,5 [44,8-60,2] | 68,3 [61,6-75,0] |
| Valor predictivo negativo (%) | 66,4 [58,9-74,0] | 61,1 [53,2-68,9] | 60,4 [52,5-68,3] | 67,1 [59,6-74,7] | 59,4 [50,9-67,9] |
| Razón de verosimilitud positiva | 1,73 [1,38-2,17] | 1,41 [1,14-1,75] | 1,43 [1,15-1,78] | 1,46 [1,18-1,80] | 1,63 [1,32-2,03] |
| Razón de verosimilitud negativa | 0,54 [0,42-0,70] | 0,68 [0,54-0,87] | 0,68 [0,53-0,86] | 0,65 [0,50-0,84] | 0,52 [0,40-0,68] |
| Exactitud diagnóstica (%) | 64,0 [63,8-64,1] | 58,8 [58,7-59,0] | 59,2 [59,0-59,3] | 59,5 [59,3-59,6] | 64,6 [64,5-64,8] |
| Porcentaje de estenosis del área en la IVUS | |||||
| Mejor valor de corte (%) | 60,0 | 60,0 | 60,0 | 60,0 | 57,0 |
| Sensibilidad (%) | 43,8 [35,5-52,1] | 30,7 [22,9-38,4] | 30,2 [22,6-37,8] | 31,4 [23,1-39,7] | 36,2 [28,8-43,6] |
| Especificidad (%) | 56,3 [48,4-64,2] | 78,1 [71,6-84,7] | 77,9 [71,2-84,5] | 77,8 [71,5-84,1] | 80,8 [73,9-87,7] |
| Valor predictivo positivo (%) | 47,6 [38,9-56,3] | 56,0 [44,8-67,2] | 56,0 [44,8-67,2] | 50,7 [39,4-62,0] | 71,1 [61,3-80,8] |
| Valor predictivo negativo (%) | 52,5 [44,8-60,2] | 55,4 [48,7-62,1] | 54,5 [47,5-61,1] | 61,0 [54,5-67,6] | 49,3 [42,4-56,1] |
| Razón de verosimilitud positiva | 1,00 [0,77-1,30] | 1,40 [0,95-2,08] | 1,36 [0,92-2,02] | 1,42 [0,96-2,09] | 1,89 [1,25-2,85] |
| Razón de verosimilitud negativa | 0,99 [0,81-1,22] | 0,89 [0,77-1,02] | 0,89 [0,78-1,03] | 0,88 [0,76-1,02] | 0,79 [0,68-0,91] |
| Exactitud diagnóstica (%) | 50,3 [50,2-50,5] | 55,6 [55,4-55,7] | 54,9 [54,7-55,0] | 58,3 [58,2-58,5] | 55,6 [55,4-55,7] |
| Área luminal mínima en la OCT | |||||
| Mejor valor de corte (mm2) | 2,0 | 2,0 | 2,0 | 2,0 | 2,3 |
| Sensibilidad (%) | 63,0 [49,1-77,0] | 68,9 [55,4-82,4] | 65,3 [52,0-78,6] | 69,8 [56,0-83,5] | 70,9 [58,9-82,9] |
| Especificidad (%) | 57,8 [43,3-72,2] | 63,0 [49,1-77,0] | 61,9 [47,2-76,6] | 62,5 [48,8-76,2] | 61,1 [45,2-77,0] |
| Valor predictivo positivo (%) | 60,4 [46,6-74,3] | 64,6 [51,1-78,1] | 66,7 [53,3-80,0] | 62,5 [48,8-76,2] | 73,6 [61,7-85,5] |
| Valor predictivo negativo (%) | 60,5 [45,9-75,1] | 67,4 [53,4-81,4] | 60,5 [45,9-75,1] | 69,8 [56,0-83,5] | 57,9 [42,2-73,6] |
| Razón de verosimilitud positiva | 1,49 [0,99-2,24] | 1,86 [1,22-2,85] | 1,71 [1,11-2,65] | 1,86 [1,23-2,82] | 1,82 [1,17-2,84] |
| Razón de verosimilitud negativa | 0,64 [0,41-1,01] | 0,49 [0,30-0,80] | 0,56 [0,36-0,88] | 0,48 [0,29-0,80] | 0,48 [0,29-0,78] |
| Exactitud diagnóstica (%) | 60,4 [59,9-61,0] | 65,9 [65,5-66,4] | 63,7 [63,2-64,2] | 65,9 [65,5-66,4] | 67,0 [66,6-67,5] |
| Porcentaje de área de estenosis en la OCT | |||||
| Mejor valor de corte (%) | 68,0 | 68,0 | 68,0 | 68,0 | 65,0 |
| Sensibilidad (%) | 56,5 [42,2-70,8] | 66,7 [52,9-80,4] | 59,2 [45,4-72,9] | 69,8 [56,0-83,5] | 67,3 [54,9-79,7] |
| Especificidad (%) | 55,6 [41,0-70,1] | 65,2 [51,5-79,0] | 59,5 [44,7-74,4] | 66,7 [53,3-80,0] | 55,6 [39,3-71,8] |
| Valor predictivo positivo (%) | 56,5 [42,2-70,8] | 65,2 [51,5-79,0] | 63,0 [49,1-77,0] | 65,2 [51,5-79,0] | 69,8 [57,5-82,2] |
| Valor predictivo negativo (%) | 55,6 [41,0-70,1] | 66,7 [52,9-80,4] | 55,6 [41,0-70,1] | 71,1 [57,9-84,4] | 52,6 [36,8-68,5] |
| Razón de verosimilitud positiva | 1,27 [0,82-1,92] | 1,92 [1,23-2,99] | 1,46 [0,95-2,26] | 2,09 [1,34-3,27] | 1,51 [1,01-2,28] |
| Razón de verosimilitud negativa | 0,78 [0,51-1,19] | 0,51 [0,32-0,81] | 0,69 [0,45-1,04] | 0,45 [0,28-0,75] | 0,59 (0,37-0,95) |
| Exactitud diagnóstica (%) | 56,0 [55,5-56,6] | 65,9 [65,5-66,4] | 59,3 [58,8-59,9] | 68,1 [67,7-68,6] | 62,6 [62,1-63,1] |
dPR: relación de presión diastólica; iFR: índice instantáneo en el periodo libre de ondas; IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica; Pd/Pa: presión coronaria distal respecto a aórtica; RFF: reserva fraccional de flujo; RFR: ciclo cardiaco completo en reposo.
Los valores expresan mediana [intervalo intercuartílico].
Independientemente de cuáles fueran los parámetros derivados de la IVUS o la OCT, la exactitud diagnóstica general de los parámetros fue < 70% y el área bajo la curva, < 0,75. Además, las razones de verosimilitud positiva o negativa de los parámetros anatómicos indicaban que dichos parámetros tenían poca capacidad diagnóstica para predecir la trascendencia funcional de las estenosis diana (tabla 3).
DISCUSIÓNEn este estudio se evaluó la asociación entre los parámetros cuantitativos derivados de la IVUS y la OCT con los índices fisiológicos invasivos, incluidos los nuevos índices fisiológicos en reposo. Los principales resultados fueron los siguientes: a) todos los índices fisiológicos en reposo mostraron una correlación significativa con los parámetros cuantitativos, así como un patrón similar de cambios en función de las diferentes bandas de valores de los parámetros cuantitativos derivados de la IVUS o la OCT; b) no hubo diferencias entre los mejores valores de corte de los parámetros cuantitativos derivados de la IVUS o la OCT para identificar la estenosis funcionalmente significativa definida por los valores de iFR, RFR y dPR; c) la RFF mostró una correlación con los parámetros de IVUS u OCT superior a la de los índices fisiológicos en reposo, y d) los mejores valores de corte de la IVUS-ALM y la OCT-ALM para definir una estenosis funcionalmente significativa fueron más altos para la RFF que los utilizados para los índices fisiológicos en reposo. Sin embargo, el rendimiento diagnóstico general y los índices de discriminación de la intensidad de la estenosis anatómica fueron moderados por lo que respecta a la predicción de la trascendencia funcional definida por los índices fisiológicos en reposo y en hiperemia.
Parámetros derivados de la IVUS o la OCT e índices fisiológicos en reposoRecientemente se han introducido en la práctica clínica índices fisiológicos en reposo que están siendo objeto de una activa investigación20–22,31,32. En ensayos controlados y aleatorizados previos, se observó la no inferioridad de las decisiones basadas en el iFR en comparación con las basadas en la RFF por lo que se refiere a los resultados clínicos a 1 año31,32, y en estudios recientes se han observado unas propiedades diagnósticas casi idénticas20–22 y unas consecuencias pronósticas similares22 al comparar el iFR con los nuevos índices en reposo, como el RFR y la dPR. En el presente estudio se evaluó la asociación entre las características anatómicas de la placa evaluadas con IVUS o OCT y la intensidad de la estenosis funcional definida por estos índices fisiológicos en reposo y en hiperemia. En comparación con todos los índices fisiológicos en reposo (iFR, RFR o dPR), los parámetros derivados de la IVUS o la OCT mostraron los mismos valores de corte y un rendimiento diagnóstico casi idéntico. Además, los índices fisiológicos en reposo mostraron similares patrones de cambio según los valores de ALM, CP y EA obtenidos en la IVUS o la OCT. De manera coherente con lo indicado por estudios previos en los que se evaluó el rendimiento diagnóstico y las consecuencias pronósticas de los índices fisiológicos en reposo, los resultados del presente estudio confirman que todos los índices fisiológicos en reposo tienen en común la misma propiedad de ser un indicador sustitutivo de la intensidad de la estenosis evaluada mediante IVUS o OCT. Tiene interés señalar que el mejor valor de corte del OCT-ALM fue inferior al del IVUS-ALM para la predicción de la trascendencia funcional. Este resultado es coherente con los de estudios previos que mostraron unos valores sistemáticamente inferiores en la OCT en comparación con la IVUS34.
Índices fisiológicos en reposo y en hiperemia indicativos de la intensidad de la estenosis anatómicaEn el presente estudio, tanto los índices fisiológicos en reposo como la RFF mostraron una correlación significativa con la intensidad de la estenosis anatómica evaluada mediante IVUS u OCT. Aunque tanto los índices fisiológicos en reposo como la RFF disminuyeron significativamente con el aumento de los valores de IVUS-CP/OCT-EA o la disminución del ALM en la IVUS o la OCT, la RFF mostró un coeficiente de correlación superior con los parámetros derivados de la IVUS o la OCT y cambios más sensibles frente a un diferente grado de intensidad de la estenosis anatómica. Además, los valores de corte de estos parámetros cuantitativos para una RFF baja se observaron en casos de estenosis menos grave en comparación con los índices fisiológicos en reposo. En estudios previos de Lee et al.2 se observaron también tendencias similares por cuanto la RFF disminuyó de manera más temprana que el iFR, en función de diferentes valores del porcentaje de estenosis angiográfica, el flujo sanguíneo miocárdico en hiperemia medido con tomografía por emisión de positrones con 13N-amonio, la resistencia a la estenosis hiperémica y el gradiente de presión transestenótico en hiperemia. Estos resultados explican por qué la estrategia de revascularización basada en el iFR ha dado lugar a menos revascularizaciones que la estrategia basada en la RFF en los ensayos DEFINE-FLAIR e iFR-SWEDEHEART31,32. Teniendo en cuenta que tanto las decisiones basadas en el iFR como las basadas en la RFF mostraron un riesgo similar de los resultados clínicos a 1 año, las decisiones basadas en estos índices fisiológicos en reposo podrían conducir a menos revascularizaciones con similar riesgo de eventos clínicos en los pacientes a los que se practica la revascularización.
Discreto rendimiento diagnóstico de los parámetros derivados de la IVUS o la OCT para definir la estenosis funcionalmente trascendenteEn el presente estudio, tanto los parámetros anatómicos derivados de la IVUS como los derivados de la OCT mostraron escasos rendimiento diagnóstico y capacidad de discriminación por lo que respecta a los índices fisiológicos en reposo y a la RFF. Estos resultados son coherentes con los de estudios previos en los que se ha evaluado el rendimiento diagnóstico de los parámetros de exploraciones de imagen para determinar una RFF baja4–17. En estudios previos en los que se ha evaluado el valor de corte de la IVUS-ALM y su rendimiento diagnóstico para predecir la estenosis funcionalmente trascendente definida mediante la RFF, los valores de corte de la ALM variaron entre 3 y 4mm2 en los diversos estudios4–17 o según el tamaño del vaso de referencia o la ubicación de la lesión8,9. Con independencia de cuáles fueran los valores de corte del ALM, la exactitud diagnóstica fue de alrededor de un 70%. De modo análogo, Gonzalo et al.18 evaluaron la asociación entre la OCT-ALM y la RFF en 61 casos de estenosis intermedia determinada mediante OCT. En dicho estudio, un OCT-ALM ≤ 1,95mm2 mostró unos resultados discretos de exactitud diagnóstica (72%) y de capacidad de discriminación (área bajo la curva, 0,74) y la OCT-EA tuvo también resultados de escasas exactitud diagnóstica (57%) y capacidad de discriminación (área bajo la curva, 0,61). Sin embargo, no ha habido estudios previos en los que se hayan evaluado los valores de corte y el rendimiento diagnóstico de la IVUS o la OCT para predecir la trascendencia funcional definida por los índices fisiológicos en reposo.
Al igual que en el estudio previo, todos los parámetros derivados de las exploraciones de imagen intravascular en el presente estudio mostraron una exactitud diagnóstica <70% y un área bajo la curva <0,75 tanto para los índices fisiológicos en reposo como para la RFF. Estos resultados implican que la trascendencia funcional evaluada mediante índices fisiológicos invasivos no se puede predecir con exactitud usando solo información anatómica2. El presente estudio confirmó que la predecibilidad de la información anatómica basada en las exploraciones de imagen intravascular invasivas es escasa para todos los índices fisiológicos disponibles en reposo o hiperémicos.
LimitacionesEste estudio tiene varias limitaciones. En primer lugar, evaluó la relación entre parámetros derivados de la IVUS y de la OCT e índices fisiológicos invasivos centrándose en los valores obtenidos en reposo. Por consiguiente, el estudio tiene limitaciones por lo que respecta a la repercusión de estas modalidades de diagnóstico por la imagen en los resultados clínicos. En segundo lugar, dado que los índices fisiológicos invasivos son parámetros evaluados por vaso sanguíneo y los parámetros derivados de la IVUS o la OCT corresponden a evaluaciones por placa, el mejor valor de corte de los parámetros derivados de la IVUS o la OCT no puede aplicarse a las lesiones con múltiples estenosis. En tercer lugar, aunque el presente estudio se centró principalmente en parámetros cuantitativos de la gravedad anatómica de la lesión, serán necesarios nuevos estudios para explorar la asociación entre las características cualitativas de la placa definidas por la IVUS o la OCT y los índices fisiológicos invasivos. En cuarto lugar, dado que el presente estudio analizó la estenosis con el ALM más baja en los casos de múltiples estenosis en el vaso diana, los resultados no pueden extrapolarse a esa situación clínica. Sin embargo, al repetir el análisis tras la exclusión de los casos con múltiples estenosis (24/341, 6,6%), los resultados generales no se modificaron. En quinto lugar, dado el carácter retrospectivo de este estudio, existe la posibilidad de un sesgo de selección.
CONCLUSIONESTodos los índices fisiológicos en reposo mostraron una relación idéntica con las características cuantitativas de la placa definidas mediante IVUS u OCT. La RFF mostró una correlación con los parámetros de IVUS u OCT superior a la de los índices fisiológicos en reposo. La exactitud diagnóstica y la capacidad de discriminación de los parámetros anatómicos fueron discretas en la predicción de la trascendencia funcional definida por los índices fisiológicos invasivos en reposo y en hiperemia.
CONFLICTO DE INTERESESJ.M. Lee ha recibido una subvención de investigación de St. Jude Medical (Abbott Vascular) y Philips Volcano. J.-Y. Hahn ha recibido una subvención de investigación de St. Jude Medical (Abbott Vascular) y Boston Scientific. B.-K. Koo ha recibido una subvención de investigación institucional de St. Jude Medical (Abbott Vascular) y Philips Volcano. Todos los demás autores declaran no tener ningún conflicto de intereses relacionado con el trabajo presentado.
- –
Desde que se desarrollara el iFR, se han introducido en la práctica clínica cotidiana varios índices fisiológicos derivados de la presión en reposo, como son el RFR o la dPR. Sin embargo, son escasos los datos existentes respecto a la asociación entre las características cuantitativas de la placa derivadas de la IVUS o la OCT y el grado fisiológico de estenosis evaluado con índices en reposo.
- –
Todos los índices fisiológicos en reposo mostraron una relación idéntica con las características cuantitativas de la placa definidas mediante IVUS u OCT. La exactitud diagnóstica y la capacidad de discriminación de los parámetros anatómicos fueron discretas en la predicción de la trascendencia funcional definida por los índices fisiológicos invasivos en reposo y en hiperemia. Estos resultados implican que todos los tipos de índice en reposo pueden usarse de manera intercambiable en la práctica clínica diaria como guía para la toma de decisiones sobre el tratamiento y aportan también evidencia indicativa de que la trascendencia funcional evaluada mediante índices fisiológicos invasivos no puede predecirse con exactitud empleando información solo anatómica.