Las guías de práctica clínica resumen y evalúan todas las evidencias relevantes, en el momento de su escritura, acerca de un tema particular, con el objeto de ayudar a los médicos a escoger la mejor estrategia de manejo posible para el tratamiento de un paciente individual con una afección concreta, teniendo en cuenta el impacto que va a tener en el resultado clínico y también la relación entre los riesgos y los beneficios de un diagnóstico particular o de un procedimiento terapéutico. Las guías de práctica clínica no son un sustituto de los libros de texto sino un complemento, y se ocupan de todos los temas del Curriculum Nuclear de la Sociedad Europea de Cardiología (ESC). Las guías de práctica clínica y las recomendaciones deberían ayudar al clínico a tomar decisiones en su práctica diaria. No obstante, las decisiones finales sobre un paciente individual las debe tomar el médico responsable.
Tanto la ESC como otras sociedades y organizaciones han elaborado un gran número de guías de práctica clínica en los últimos años. Debido al impacto que tienen en la práctica clínica se han establecido criterios de calidad para el desarrollo de las guías que permitan tomar las decisiones de forma transparente para el usuario. Las recomendaciones para la elaboración de las guías de práctica clínica de la ESC pueden consultarse en la página web de la ESC (http://www.escardio. org/guidelines-surveys/esc-guidelines/about/Pages/rules-writing. aspx). Las guías de práctica clínica de la ESC representan la posición oficial de la ESC sobre un tema determinado y se actualizan regularmente.
Los miembros de este grupo de trabajo fueron seleccionados por la ESC para representar a los profesionales implicados en el cuidado médico de los pacientes con esta patología. Una serie de expertos en el tema realizaron una revisión global de las evidencias publicadas sobre el diagnóstico, manejo o prevención de una enfermedad determinada, de acuerdo con la normativa del Comité de la ESC de guías de práctica clínica (CGPC). Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, incluyendo la evaluación de la relación riesgo/beneficio. Cuando hubo datos disponibles se incluyeron también estimaciones de los resultados esperados sobre la salud para poblaciones más grandes. El nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular fueron sopesados y clasificados de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
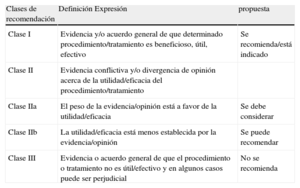
Clases de recomendación
| Clases de recomendación | Definición Expresión | propuesta |
| Clase I | Evidencia y/o acuerdo general de que determinado procedimiento/tratamiento es beneficioso, útil, efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del procedimiento/tratamiento | |
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general de que el procedimiento o tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metaanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo aleatorizado y controlado o de estudios no aleatorizados a gran escala |
| Nivel de evidencia C | Consenso de opinión de expertos y/o estudios a pequeña escala, estudios retrospectivos, registros |
Los expertos de los paneles de redacción y revisión han declarado por escrito, en formularios de conflictos de intereses, cualquier relación que se pueda considerar una fuente de conflicto de intereses real o potencial. Estas declaraciones escritas se han agrupado en un único documento y pueden encontrarse en la página web de la ESC (http://www.escardio.org/guidelines). Cualquier modificación en las declaraciones de conflictos de intereses que surja durante el periodo de redacción tiene que ser notificada a la ESC y actualizada. El Grupo de Trabajo ha sido financiado en su totalidad por la ESC y se ha desarrollado sin ninguna participación de la industria. El CGPC de la ESC supervisa y coordina la preparación de nuevas guías de práctica clínica elaboradas por los grupos de trabajo, grupos de expertos o paneles de consenso. El comité es responsable también de la promoción de estas guías de práctica clínica. Las guías de práctica clínica de la ESC se someten a un extenso proceso de revisión por parte del CGPC y expertos externos. Después de las pertinentes revisiones, se aprueban por todos los expertos involucrados en el grupo de trabajo. El documento final es aprobado por el CGPC para su publicación en European Heart Journal.
El objetivo de la elaboración de las guías de práctica clínica de la ESC no se limita a la integración de la investigación más reciente, sino también a la creación de instrumentos educacionales y programas de implementación para las recomendaciones. Para ayudar a la difusión de las guías se producen versiones reducidas de bolsillo, diapositivas con resúmenes, folletos con los principales mensajes y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Se trata de versiones abreviadas y, por lo tanto, cuando sea necesario hay que acudir al texto íntegro original, que se encuentra disponible de forma gratuita en la página web de la ESC. Se anima a las sociedades nacionales de la ESC a promocionar, traducir e implementar las guías de la ESC. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos de los pacientes pueden verse favorablemente influidos por la plena aplicación de las recomendaciones clínicas.
Los sondeos y registros son necesarios para verificar que la práctica clínica en la vida real se hace de acuerdo con las recomendaciones de las guías, completando el círculo entre la investigación clínica, la redacción de las guías y su implementación en la práctica clínica
Sin embargo, las guías de práctica clínica no pueden anular la responsabilidad individual de los profesionales de la salud a la hora de tomar las decisiones más adecuadas en las circunstancias de cada paciente individual, después de consultarlo con el propio paciente y, cuando sea adecuado o necesario, con la persona que está al cargo del paciente. También es responsabilidad del profesional sanitario comprobar las normativas y regulaciones aplicables a los fármacos y dispositivos en el momento de su prescripción.
INTRODUCCIÓNDefinición de infarto agudo de miocardioEl manejo del infarto agudo de miocardio (IAM) continúa experimentando cambios importantes. La buena práctica debe basarse en evidencias derivadas de estudios clínicos realizados correctamente. Debido al gran número de ensayos clínicos sobre nuevos tratamientos que se han realizado en los últimos años, y a la vista de que hay nuevas pruebas diagnósticas, la ESC ha decidido que es oportuno actualizar las guías previas y ha nombrado un grupo de trabajo. Hay que tener en consideración que incluso cuando se han llevado a cabo estudios clínicos excelentes, sus resultados están abiertos a la interpretación y las opciones terapéuticas pueden estar limitadas por los recursos disponibles. De hecho, el coste-efectividad se ha convertido en un aspecto de importancia creciente a la hora de decidir una estrategia terapéutica.
Debido a que se han producido cambios importantes en la disponibilidad de biomarcadores para el diagnóstico, los criterios de IAM se han revisado. La definición de consenso internacional actual dice que el término «infarto agudo de miocardio» debe usarse cuando haya evidencia de necrosis miocárdica en un contexto clínico consistente con isquemia miocárdica2. En estas condiciones, cualquiera de los criterios descritos en la tabla 3 cumple el diagnóstico de infarto de miocardio espontáneo. Las presentes guías se dirigen a pacientes que tienen síntomas isquémicos y elevación persistente del segmento ST en el electrocardiograma (ECG). La mayoría de estos pacientes mostrará una elevación típica de los biomarcadores de necrosis miocárdica y progresará hacia infarto de miocardio con onda Q. Recientemente se han desarrollado unas guías independientes por otro Grupo de Trabajo de la ESC dirigidas a pacientes con síntomas isquémicos pero sin elevación persistente del segmento ST y a pacientes que se someten a revascularización miocárdica en general3,4.
Definición universal de infarto de miocardio*
| Detección de un aumento o descenso de los valores de biomarcadores cardiacos (preferiblemente troponina), con al menos uno de los valores por encima del percentil 99 del límite de referencia superior, y al menos uno de los siguientes parámetros: |
| • Síntomas de isquemia |
| • Cambios significativos en el segmento ST nuevos o presumiblemente nuevos o bloqueo de rama izquierda nuevo |
| • Desarrollo de ondas Q patológicas en el ECG |
| • Evidencia por imagen de pérdida de miocardio viable de nueva aparición o anomalías regionales en la motilidad de la pared de nueva aparición |
| • Identificación de un trombo intracoronario mediante angiografía o autopsia |
| Muerte cardiaca con síntomas sugestivos de isquemia miocárdica y cambios del ECG presumiblemente nuevos, o bloqueo de rama izquierda nuevo, pero la muerte tiene lugar antes de que se produzca liberación de los biomarcadores cardiacos sanguíneos o antes de que los valores de biomarcadores cardiacos hayan aumentado |
| Trombosis intra-stent asociada a infarto de miocardio cuando se detecta por angiografía coronaria o autopsia en el contexto de una isquemia miocárdica, y con aumento o descenso de los valores de biomarcadores cardiacos, con al menos uno de los valores por encima del percentil 99 del límite de referencia superior |
ECG: electrocardiograma.
*Excluyendo infarto de miocardio asociado a procedimientos de revascularización o criterios de infarto de miocardio previo.
La enfermedad coronaria (EC) es la causa individual más frecuente de muerte en todos los países del mundo. Más de 7 millones de personas mueren cada año como consecuencia de la cardiopatía isquémica, lo que corresponde a un 12,8% de todas las muertes5. Uno de cada 6 varones y una de cada 7 mujeres en Europa morirán de infarto de miocardio. La incidencia de ingresos hospitalarios por IAM con elevación del segmento ST (IAMCEST) varía entre los países que pertenecen a la ESC6. El registro más exhaustivo de IAMCEST es probablemente el que se ha realizado en Suecia, donde la incidencia de IAMCEST es de 66/100.000/año. Se han recogido datos similares en la República Checa7, Bélgica6 y Estados Unidos8: las tasas de incidencia de IAMCEST (por 100.000) disminuyeron entre 1997 y 2005 de 121 a 77, mientras que las tasas de incidencia de IAM sin elevación del segmento ST aumentaron ligeramente de 126 a 132. Por lo tanto, la incidencia de IAMCEST parece ir declinando, mientras que hay un aumento concomitante en la incidencia de IAM sin elevación del segmento ST9. La mortalidad del IAMCEST está influenciada por muchos factores, entre ellos: la edad, la clase Killip, el retraso en la aplicación del tratamiento, el tipo de tratamiento, la historia previa de infarto de miocardio, la diabetes mellitus, la insuficiencia renal, el número de arterias coronarias afectadas, la fracción de eyección y el tratamiento. La mortalidad hospitalaria de pacientes con IAMCEST no seleccionados en los registros nacionales de los países de la ESC varía entre el 6 y el 14%10. Diversos estudios recientes han subrayado un descenso en la mortalidad aguda y a largo plazo después de un IAMCEST, en paralelo con un aumento de la terapia de reperfusión, intervención coronaria percutánea (ICP) primaria, tratamiento antitrombótico moderno y tratamientos de prevención secundaria6,8,11,12. A pesar de esto, la mortalidad sigue siendo importante, con aproximadamente un 12% de mortalidad en 6 meses13 y con tasas más elevadas en pacientes de mayor riesgo14, lo que justifica los esfuerzos continuos por mejorar la calidad de la atención, la adherencia a las guías y la investigación.
ATENCIÓN EN URGENCIASDiagnóstico inicialEl manejo del IAM —incluido el diagnóstico y el tratamiento— empieza en el lugar donde se produce el primer contacto médico (PCM), definido como el punto en el que el personal médico o paramédico, u otro personal médico en el contexto prehospitalario, evalua al paciente incialmente o cuando llega a urgencias (normalmente, en un contexto ambulatorio)15. En primer lugar debe hacerse el diagnóstico de trabajo de infarto de miocardio. Este diagnóstico se suele basar en una historia de dolor torácico de 20min de duración o más que no responde a la nitroglicerina. Algunas claves importantes son una historia de cardiopatía isquémica y la irradiación del dolor hacia el cuello, la mandíbula o el brazo izquierdo. El dolor puede no ser agudo. Algunos pacientes presentan síntomas menos típicos, como náuseas/vómitos, disnea, fatiga, palpitaciones o síncope. Estos pacientes suelen presentarse más tarde, con más frecuencia se trata de mujeres, diabéticos o pacientes ancianos, y reciben con menor frecuencia terapia de reperfusión y otros tratamientos basados en la evidencia que los pacientes con una presentación típica de dolor torácico. Los registros muestran que hasta un 30% de pacientes con IAMCEST se presenta con sínt omas atípicos 16. Te ner conciencia de es tas presentaciones atípicas y el acceso fácil a la angiografía aguda para el diagnóstico precoz puede mejorar el resultado clínico en este grupo de alto riesgo.
Un diagnóstico a tiempo de IAMCEST es la clave para el éxito en su manejo. La monitorización ECG debe iniciarse lo antes posible en todos los pacientes con sospecha de IAMCEST, para detectar arritmias que pongan en riesgo la vida y permitir la desfibrilación inmediata cuando esté indicada. Se debe realizar un ECG de 12 derivaciones e interpretarlo lo antes posible en el punto del PCM (tabla 4)17. Incluso en una fase temprana, el ECG es raramente normal. Típicamente se debe encontrar una elevación del segmento ST en el IAM, medido en el punto J, en 2 derivaciones contiguas y debe ser ≥ 0,25mV en varones de menos de 40 años de edad, ≥ 0,2mV en varones de más de 40 años o ≥ 0,15mV en mujeres en las derivaciones V2-V3 o ≥ 0,1mV en otras derivaciones (en ausencia de hipertrofia del ventrículo izquierdo [VI] o bloqueo de rama)2. En pacientes con infarto de miocardio inferior es recomendable registrar derivaciones precordiales derechas (V3R y V4R) para buscar la elevación ST, con el fin de identificar infarto ventricular derecho concomitante2,18. De forma similar, la depresión del segmento ST en las derivaciones V1-V3 sugiere isquemia miocárdica, sobre todo cuando la onda T terminal es positiva (equivalente a la elevación ST), y se puede confirmar por una elevación ST concomitante ≥ 0,1mV registrada en las derivaciones V7-V92.
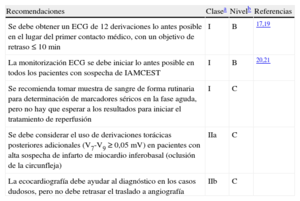
Recomendaciones para el diagnóstico inicial
| Recomendaciones | Clasea | Nivelb | Referencias |
| Se debe obtener un ECG de 12 derivaciones lo antes posible en el lugar del primer contacto médico, con un objetivo de retraso ≤ 10 min | I | B | 17,19 |
| La monitorización ECG se debe iniciar lo antes posible en todos los pacientes con sospecha de IAMCEST | I | B | 20,21 |
| Se recomienda tomar muestra de sangre de forma rutinaria para determinación de marcadores séricos en la fase aguda, pero no hay que esperar a los resultados para iniciar el tratamiento de reperfusión | I | C | |
| Se debe considerar el uso de derivaciones torácicas posteriores adicionales (V7-V9 ≥ 0,05 mV) en pacientes con alta sospecha de infarto de miocardio inferobasal (oclusión de la circunfleja) | IIa | C | |
| La ecocardiografía debe ayudar al diagnóstico en los casos dudosos, pero no debe retrasar el traslado a angiografía | IIb | C |
ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
El diagnóstico ECG puede ser más difícil en algunos casos (tabla 5) que, no obstante, requieren un manejo inmediato.
Presentaciones del electrocardiograma atípicas que requieren un manejo rápido en pacientes con signos y síntomas de isquemia miocárdica en curso
| Bloqueo de rama izquierda |
| Ritmo ventricular estimulado |
| Pacientes sin elevación diagnóstica del segmento ST pero con síntomas isquémicos persistentes |
| Infarto de miocardio posterior aislado |
| Elevación del segmento ST en la derivación aVR |
Entre éstos:
- •
Bloqueo de rama: en presencia de bloqueo de rama, el diagnóstico ECG de IAM es difícil, pero a menudo posible cuando hay anomalías ST importantes. Se han propuesto algunos algoritmos algo complejos para ayudar al diagnóstico22, pero no proporcionan certeza diagnóstica23. La presencia de elevación ST concordante (es decir, en derivaciones con desviaciones QRS positivas) parece ser uno de los mejores indicadores de infarto de miocardio en curso con una arteria ocluida24. Los datos previos de los ensayos sobre trombolisis han demostrado que la terapia de reperfusión es beneficiosa en pacientes con bloqueo de rama y sospecha de infarto de miocardio. Sin embargo, la mayoría de pacientes con bloqueo de rama evaluados en urgencias no tiene una oclusión coronaria aguda, ni requiere angioplastia primaria. Un ECG previo puede ayudar a determinar si el bloqueo de rama es nuevo (y, por lo tanto, la sospecha de infarto de miocardio en curso es alta). Es importante indicar que, en los pacientes con sospecha clínica de isquemia miocárdica con bloqueo de rama nuevo o presuntamente nuevo, se debe considerar la terapia de reperfusión de forma precoz, preferiblemente mediante angiografía coronaria de urgencias con angioplastia primaria o, si no está disponible, trombolisis intravenosa. Un test de troponina positivo en el punto de atención, 1-2 h después del inicio de los síntomas en pacientes con bloqueo de rama de origen incierto, puede ayudar a decidir la conveniencia de realizar una angiografía de urgencias con angioplastia primaria. Los pacientes con infarto de miocardio y bloqueo de rama derecha también tienen un pronóstico pobre25, aunque el bloqueo de rama derecha normalmente no va a interferir en la interpretación de la elevación del segmento ST. El manejo precoz debe considerarse cuando se produzcan síntomas isquémicos persistentes en presencia de bloqueo de rama derecha, independientemente de que su existencia se conociera de antemano.
- •
El ritmo de marcapasos ventricular también puede interferir en la interpretación de los cambios del segmento ST y puede requerir una angiografía urgente para confirmar el diagnóstico e iniciar el tratamiento. Se puede considerar la reprogramación del marcapasos — para permitir la evaluación de los cambios del ECG durante el ritmo cardiaco intrínseco— en pacientes que no son dependientes de la estimulación ventricular, sin retrasar el estudio invasivo.
- •
Pacientes sin ECG diagnóstico: algunos pacientes con oclusión coronaria aguda pueden tener un ECG inicial sin elevación del segmento ST, a veces debido a que se les explora de forma muy precoz después del inicio de los síntomas (en estos casos hay que buscar ondas T hiperagudas, que pueden preceder a la elevación del segmento ST). Es importante repetir el ECG o monitorizar el segmento ST. Además, existe la preocupación de que algunos pacientes con oclusión aguda genuina de una arteria coronaria e infarto de miocardio en curso (como aquellos con arteria circunfleja ocluida26,27, oclusión aguda de un injerto venoso o enfermedad del tronco principal), puedan presentarse sin elevación del segmento ST y se les niegue la terapia de reperfusión, lo que acaba por producir infartos más extensos y un peor resultado clínico. Extender el ECG estándar de 12 derivaciones con derivaciones V7-V9, aunque puede ser útil, no siempre identifica a estos pacientes. En cualquier caso, la sospecha de isquemia miocárdica —a pesar del tratamiento médico— es una indicación para angiografía coronaria de urgencias con revascularización, incluso en pacientes sin elevación diagnóstica del segmento ST3.
- •
Infarto de miocardio posterior aislado: el IAM de la porción inferobasal del corazón, que a menudo corresponde al territorio de la circunfleja, en el que el principal hallazgo es la depresión aislada del segmento ST de ≥ 0,05mV en las derivaciones V1-V3, debe tratarse como un IAMCEST. Está recomendado el uso de derivaciones adicionales torácicas posteriores (V7-V9 ≥ 0,05mV [≥ 0,1mV en varones < 40 años de edad]) para detectar elevación ST consistente con infarto de miocardio inferobasal.
- •
Obstrucción de la descendente anterior-elevación de la derivación aVR ST y depresión ST inferolateral: la presencia de depresión ST > 0,1mV en 8 o más derivaciones de superficie, unido a elevación ST en aVR o V1 en ausencia de otros cambios en el ECG, sugiere isquemia debida a obstrucción de la coronaria izquierda principal o multivaso, especialmente si el paciente presenta compromiso hemodinámico28
En pacientes con sospecha de isquemia miocárdica y elevación del segmento ST o bloqueo de rama izquierda nueva o presuntamente nueva, se debe iniciar terapia de reperfusión lo antes posible. No obstante, el ECG puede ser equívoco en las primeras horas e, incluso cuando hay infarto probado, puede no mostrar nunca las características típicas de la elevación del segmento ST y ondas Q nuevas. Si el ECG es equívoco o no muestra ninguna evidencia que apoye la sospecha clínica de infarto de miocardio, los ECG deben repetirse y, cuando sea posible, el ECG actual debe compararse con los registros previos. Puede ser de ayuda realizar registros de, por ejemplo, las derivaciones V7, V8 y V9 para el diagnóstico de casos seleccionados.
En la fase aguda se realiza de forma rutinaria la extracción de sangre para marcadores séricos, pero no se debe esperar a los resultados para iniciar el tratamiento de reperfusión. La troponina (T o I) es el biomarcador de elección, debido a su alta sensibilidad y especificidad para la necrosis miocárdica. En pacientes que tienen una probabilidad clínica baja o intermedia de isquemia miocárdica en evolución y una duración prolongada de los síntomas previos, un test negativo de troponina puede ayudar a evitar una angiografía de urgencias, innecesaria en algunos pacientes
Si hay dudas sobre la posibilidad de que haya un infarto de miocardio en evolución, la prueba de imagen de urgencias (en lugar de esperar a que los biomarcadores estén elevados) permite la indicación de una terapia de reperfusión a tiempo en estos pacientes. Cuando se encuentra disponible de forma local, la angiografía coronaria de urgencias es la modalidad de elección, ya que puede ir seguida inmediatamente de una angioplastia primaria en caso de que el diagnóstico se confirme. En hospitales o centros en los que la angiografía coronaria no se encuentre disponible de forma inmediata —y siempre que no suponga un retraso en el traslado— la confirmación rápida de las anomalías segmentarias en la motilidad de la pared mediante ecocardiografía de 2 dimensiones (2D) puede ayudar a tomar la decisión de traslado de urgencia a un centro con capacidad para realizar angioplastia, ya que las anomalías regionales de la motilidad de la pared se producen en los primeros minutos después de la oclusión coronaria, bastante antes de la necrosis. Sin embargo, las anomalías de la motilidad de la pared no son específicas del IAM y pueden deberse a otras causas como isquemia, un infarto antiguo o defectos de la conducción ventricular. La ecocardiografía 2D es especialmente útil en el diagnóstico de otras causas de dolor torácico, como el derrame pericárdico, la embolia pulmonar masiva o la disección de la aorta ascendente (tabla 4). La ausencia de anomalías de la motilidad de la pared excluye uninfarto de miocardio importante. En urgencias, el papel de la evaluación por tomografía computarizada debe restringirse a diagnósticos diferenciales de disección aórtica aguda o embolia pulmonar.
La miocardiopatía inducida por estrés (tako-tsubo) es un síndrome recientemente reconocido que puede ser difícil de diferenciar del IAMCEST, ya que los síntomas y los hallazgos clínicos, que varían desde un dolor torácico leve a un shock cardiogénico, puede simular un IAM, pero los cambios electrocardiográficos en la presentación suelen ser modestos y no se correlacionan con la gravedad de la disfunción ventricular. Se suele desencadenar por un estrés físico o emocional, y se caracteriza en su forma típica por una dilatación transitoria del VI apical o medial y disfunción. Debido a que no hay ninguna prueba específica para descartar un infarto de miocardio en este contexto, no se debe retrasar la angiografía de urgencia y, en ausencia de infarto de miocardio, mostrará ausencia de estenosis significativa de la arteria coronaria responsable o trombos intracoronarios. El diagnóstico se confirma por el hallazgo, en la prueba de imagen, de discinesia transitoria apical a medioventricular con hipercinesia compensatoria basal, y por la presencia de valores plasmáticos desproporcionadamente bajos de biomarcadores cardiacos en relación con la gravedad de la disfunción ventricular y, finalmente, por la recuperación de la función VI29.
Alivio del dolor, disnea y ansiedadEl alivio del dolor es de extrema importancia, no sólo por razones humanitarias sino también porque el dolor se asocia a activación simpática que causa vasoconstricción y aumenta el trabajo cardiaco. Los analgésicos más utilizados en este contexto son los opiáceos intravenosos (i.v.) titulados (p. ej., morfina) (tabla 6). Se deben evitar las
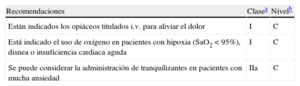
Recomendaciones para el alivio del dolor, la disnea y la ansiedad
| Recomendaciones | Clasea | Nivelb |
| Están indicados los opiáceos titulados i.v. para aliviar el dolor | I | C |
| Está indicado el uso de oxígeno en pacientes con hipoxia (SaO2 < 95%), disnea o insuficiencia cardiaca aguda | I | C |
| Se puede considerar la administración de tranquilizantes en pacientes con mucha ansiedad | IIa | C |
i.v.: intravenoso; SaO2: saturación de oxígeno.
inyecciones intramusculares. Pueden ser necesarias dosis repetidas. Los efectos secundarios incluyen náuseas y vómitos, hipotensión, bradicardia y depresión respiratoria. Se pueden administrar antieméticos simultáneamente para reducir las náuseas. La hipotensión y la bradicardia suelen responder a la atropina y la depresión respiratoria a la naloxona (0,1-0,2mg i.v. cada 15min cuando esté indicado), que deben encontrarse siempre disponibles.
Se debe administrar oxígeno (mediante mascarilla o gafas nasales) a los pacientes que tengan disnea, que estén hipóxicos o a los que tengan insuficiencia cardiaca. Sigue siendo controvertido si es conveniente administrar oxígeno sistemáticamente a los pacientes sin insuficiencia cardiaca o disnea30. Es de gran ayuda la monitorización no invasiva de la saturación de oxígeno a la hora de decidir la necesidad de administrar oxígeno o asistencia respiratoria.
La ansiedad es una respuesta natural al dolor y las circunstancias que envuelven a un ataque cardiaco. Es fundamental dar seguridad a los pacientes y a las personas que se encuentran próximas. Si el paciente se encuentra demasiado trastornado puede ser adecuado administrarle un tranquilizante, aunque los opiáceos suelen ser suficientes.
Paro cardiacoMuchas muertes ocurren precozmente durante las primeras horas después de un IAMCEST debido a fibrilación ventricular (FV). Como esta arritmia ocurre, sobre todo, en una fase temprana, estas muertes suelen tener lugar fuera del hospital. Por lo tanto es crucial que todo el personal médico y paramédico que se ocupa de los casos en los que hay sospecha de infarto de miocardio tengan acceso a desfibriladores y estén entrenados para las medidas de soporte vital cardiaco, y que se realice una monitorización ECG inmediata, en el lugar donde se produce el PCM, en todos los pacientes con sospecha de infarto de miocardio (tabla 7).
Paro cardiaco
| Recomendaciones | Clasea | Nivelb | Referencias |
| Todo el personal médico y paramédico que atienda a un paciente con sospecha de infarto de miocardio debe tener acceso a un desfibrilador y debe estar entrenado en técnicas de soporte vital cardiaco | I | C | – |
| Se recomienda iniciar monitorización ECG en el lugar del primer contacto médico en todos los pacientes con sospecha de infarto de miocardio | I | C | – |
| Está indicada la hipotermia terapéutica de forma precoz después de la reanimación en pacientes con paro cardiaco que estén en coma o profundamente sedados | I | B | 34–36 |
| Se recomienda angiografía inmediata con posibilidad de angioplastia primaria en pacientes reanimados de paro cardiaco en los que el ECG muestre IAMCEST | I | B | 31–33 |
| Se debe considerar angiografía con posibilidad de angioplastia primaria en los supervivientes de un paro cardiaco que no tengan una elevación ECG diagnóstica del segmento ST pero con alta sospecha de infarto en curso | IIa | B | 31–33 |
ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST
En pacientes reanimados de paro cardiaco, en los que el ECG muestra elevación del segmento ST, la estrategia de elección es la angiografía inmediata con posibilidad de angioplastia primaria, siempre que se puedan cumplir los plazos de tiempo indicados en las guías31–33. Debido a la alta prevalencia de oclusiones coronarias y a las dificultades potenciales a la hora de interpretar el ECG en pacientes que han tenido paro cardiaco, se debe considerar la angiografía inmediata en los supervivientes de un paro cardiaco que tengan un índice elevado de sospecha de infarto en curso (presencia de dolor torácico antes del paro cardiaco, historia de cardiopatía isquémica establecida y anomalías en el ECG o resultados del ECG inciertos)31–33. Además, hay evidencias de que los supervivientes de paro cardiaco sufrido fuera del hospital que están en estado comatoso tienen mejores resultados clínicos neurológicos cuando se aplica frío de forma precoz tras la reanimación. Por lo tanto, estos pacientes deben recibir rápidamente hipotermia terapéutica34–36. No está clara cuál debe ser la secuencia óptima de enfriamiento y angioplastia primaria en estos pacientes.
La utilización de protocolos locales/regionales de manejo óptimo del paro cardiaco que tiene lugar fuera del hospital es fundamental para proporcionar una reanimación cardiopulmonar rápida, desfribrilación precoz (si es necesaria) y soporte vital avanzado efectivo. La disponibilidad de desfibriladores automáticos externos es un factor clave para aumentar la supervivencia. La prevención y los tratamientos mejorados del paro cardiaco que ocurre fuera del hospital son esenciales para reducir la mortalidad relacionada con la cardiopatía isquémica. Para una discusión más detallada de estos aspectos véanse las recientes guías para la reanimación del European Resuscitation Council37.
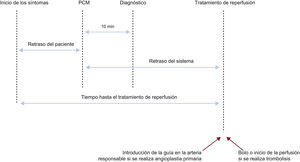
Logística de atención prehospitalariaRetrasosLa prevención de los retrasos es crítica en el IAMCEST por 2 razones: la primera, porque el momento más crítico de un infarto de miocardio es su fase más inicial, durante la cual los pacientes suelen experimentar dolor intenso y pueden sufrir paro cardiaco. Se debe conseguir un desfibrilador para el paciente con sospecha de IAM lo antes posible para poder realizar una desfribrilación inmediata si es necesario. Además, la disponibilidad precoz de un tratamiento, especialmente de la terapia de reperfusión, es crítica para aumentar los beneficios obtenidos38. Por lo tanto, minimizar cualquier retraso se asocia a mejores resultados clí-nicos. Además, los retrasos en el tratamiento representan el índice de calidad asistencial más fácil de cuantificar en el IAMCEST; se deberían registrar en todos los hospitales que atienden a pacientes con IAMCEST y se deben monitorizar regularmente para asegurar el cumplimiento y el mantenimiento a lo largo del tiempo de indicadores simples de calidad asistencial. Aunque este aspecto sigue siendo controvertido, la información pública de los retrasos puede ser una forma útil de estimular la mejoría en la atención de los pacientes con IAMCEST. Cuando no se alcancen los objetivos será necesario aplicar intervenciones para mejorar la actuación. Hay varios componentes en el retraso de la atención en el IAMCEST y diversas formas de registrarlos y hacerlos públicos. Para simplificar se aconseja describir e informar de los retrasos tal como se muestra en la figura 1.
- •
Retraso del paciente: se refiere al retraso entre el inicio de los síntomas y el PCM. Para minimizar el retraso del paciente, el público debe saber cómo reconocer los síntomas comunes de un IAM y cómo llamar al servicio de urgencias, aunque la efectividad de las campañas públicas todavía no se ha establecido claramente38. Los pacientes con historia de cardiopatía isquémica y sus familias deben recibir información acerca de cómo reconocer los síntomas debidos a IAM y los pasos prácticos que deben seguir, en caso de que se produzca sospecha de síndrome coronario agudo (SCA). Puede ser útil proporcionar a los pacientes con cardiopatía isquémica estable unacopia de su ECG basal de rutina para que el personal médico pueda hacer comparaciones.
- •
Retraso entre el primer contacto médico y el diagnóstico: un buen índice de la calidad asistencial es el tiempo transcurrido para registrar el primer ECG. En los hospitales y servicios médicos de urgencias que participan en la atención de los pacientes con IAMCEST, el objetivo debe ser reducir este retraso a 10min o menos.
- •
Retraso entre el primer contacto médico y la terapia de reperfusión: esto se conoce como el «retraso del sistema». Es más susceptible de modificarse a partir de medidas de tipo organizativo que el retraso del paciente. Es un indicador de la calidad asistencial y un predictor del resultado clínico39. Si la terapia de reperfusión es angioplastia primaria, el objetivo debe ser un retraso (desde el PCM hasta la introducción de la guía en la arteria responsable) de ≤ 90min (y, en casos de alto riesgo con infarto anterior extenso que se presentan precozmente dentro de las primeras 2 h debe ser ≤ 60 min)40,41. Si la terapia de reperfusión es fibrinolisis, el objetivo debe ser reducir este retraso (desde el PCM hasta la inyección) a ≤ 30min.
- •
En hospitales con capacidad para realizar ICP, el objetivo debe ser alcanzar un retraso «puerta-balón» de ≤ 60min entre la llegada del paciente al hospital y la angioplastia primaria (definida como la introducción de la guía dentro de la arteria responsable). Este retraso refleja la organización y capacidad de actuación del hospital con capacidad para realizar angioplastias.
- •
Desde la perspectiva del paciente, el retraso entre el inicio de los síntomas y la terapia de reperfusión (ya sea el inicio de la fibrinolisis o la introducción del catéter en la arteria responsable) es, quizá, el aspecto más importante, puesto que refleja el tiempo isquémico total. Debe reducirse todo lo que sea posible.
Es importante disponer de un sistema médico de urgencias con un único número telefónico fácil de recordar y bien publicitado para cubrir las urgencias médicas y evitar los retrasos en el transporte. Sería ideal tener un sistema de teleconsulta entre el servicio de urgencias y un centro cardiológico de referencia, aunque este sistema sólo se encuentra operativo en un número limitado de países. Por lo tanto es muy importante disponer de un servicio de urgencias bien entrenado y un protocolo escrito, actualizado y compartido, sobre manejo del IAMCEST. A pesar de que los servicios de urgencias reducen el retraso y son la forma preferida de atención sanitaria inicial en pacientes con sospecha de IAMCEST, están infrautilizados en muchos países y, a menudo, los pacientes se presentan por sí mismos al servicio de urgencias. El servicio de ambulancias desempeña un papel crítico en el manejo del IAM y debe considerarse no sólo una forma de transporte sino también el lugar donde se produce el diagnóstico inicial, la selección y el tratamiento. Se ha demostrado que el diagnóstico prehospitalario, la selección y el tratamiento de urgencias inicial se asocia a un mayor uso de las terapias de reperfusión, reducción de los retrasos y mejora en los resultados clínicos39,42. Además, el transporte en ambulancia permite el diagnóstico y tratamiento del paro cardiaco. La calidad de la atención depende del entrenamiento del personal responsable. Todo el personal de las ambulancias debe estar entrenado para reconocer los síntomas de un IAM, administrar oxígeno, aliviar el dolor y proporcionar soporte vital básico (tabla 8). Todas las ambulancias de urgencias deben estar equipadas con sistemas de monitorización de ECG, desfibriladores y, por lo menos, una de las personas de la ambulancia debe estar entrenada en técnicas avanzadas de soporte vital. Hay evidencias que indican que el personal paramédico adecuadamente entrenado puede identificar de forma efectiva a los pacientes con IAM y proporcionar reperfusión a tiempo, y que las ambulancias con personal médico —que sólo están disponibles en algunos países— no son necesarias para el manejo prehospitalario efectivo del IAM43. El personal paramédico entrenado para administrar trombolíticos puede hacerlo de forma segura y efectiva. Como la trombolisis prehospitalaria es una opción terapéutica atractiva en pacientes que se presentan de forma precoz tras el inicio de los síntomas, especialmente cuando el tiempo de traslado es largo40,44,45, está recomendado un entrenamiento continuo del personal paramédico para realizar estas funciones, incluso en la era de la angioplastia primaria. En regiones específicas, los sistemas de ambulancia aéreos pueden reducir aún más los retrasos en el transporte y mejorar los resultados clínicos46. El personal de la ambulancia debe ser capaz de registrar un ECG con fines diagnósticos e interpretarlo o transmitirlo para que pueda revisarlo personal con experiencia en la unidad coronaria o en otro sitio. El registro, la interpretación y, en ocasiones, la teletransmisión de un ECG antes del ingreso hospitalario puede acelerar, en gran medida, el manejo hospitalario y aumentar la probabilidad de realizar una terapia de reperfusión a tiempo.
Logística de la atención prehospitalaria
| Recomendaciones | Clasea | Nivelb | Referencias |
| El personal de la ambulancia debe estar entrenado y equipado para identificar un IAMCEST (usando registros ECG y telemetría según sea necesario) y para administrar el tratamiento inicial, incluida la trombolisis cuando sea necesaria | I | B | 43 |
| El manejo prehospitalario de los pacientes con IAMCEST debe basarse en redes regionales diseñadas para proporcionar tratamiento de reperfusión de forma expeditiva y efectiva, y se debe hacer un esfuerzo para que la angioplastia primaria esté disponible en el mayor número posible de pacientes | I | B | 47 |
| Los centros con capacidad para realizar angioplastias primarias deben ofrecer un servicio 24/7 y ser capaces de iniciar una angioplastia primaria lo antes posible, pero siempre dentro de los primeros 60 min después de la llamada inicial | I | B | 6,52,55 |
| Todos los hospitales y servicios de urgencias que participen en la atención de pacientes con IAMCEST deben registrar y monitorizar el tiempo de retraso, y trabajar para alcanzar y mantener los siguientes objetivos de calidad:• Desde el primer contacto médico al primer ECG ≤ 10 min• Desde el primer contacto médico al tratamiento de reperfusión• Para fibrinolisis ≤ 30min• Para angioplastia primaria ≤ 90 min (≤ 60 min si el paciente se presenta en los primeros 120 min desde el inicio de los síntomas o directamente a un centro con capacidad para realizar ICP) | I | B | 56,57 |
| Todos los sistemas médicos de urgencias y las unidades coronarias deben tener un protocolo escrito actualizado de manejo del IAMCEST, preferiblemente compartido dentro de las redes geográficas | I | C | |
| Los pacientes que se presentan en un hospital sin capacidad de ICP y que esperan el traslado a un centro para angioplastia primaria o de rescate, deben ser atendidos en un área adecuadamente monitorizada | I | C | |
| Los pacientes que son trasladados a un centro con capacidad de ICP para angioplastia primaria, deben evitar pasar por el servicio de urgencias y transferirse directamente al laboratorio de hemodinámica | IIa | B | 41,50,58 |
ECG: electrocardiograma; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; 24/7: 24 h al día, 7 días a la semana.
El tratamiento óptimo del IAMCEST debe basarse en la utilización de redes entre hospitales con varios niveles de tecnología conectados por un servicio eficiente de ambulancias. El objetivo de estas redes es proporcionar una atención médica óptima y reducir los retrasos, con el objeto de mejorar los resultados clínicos. Los cardiólogos —y, sobre todo, los médicos de urgencias— deben colaborar activamente con todos los agentes económicos a la hora de establecer estas redes. Sus principales características son:
- •
Definición clara de las áreas geográficas de responsabilidad.
- •
Protocolos compartidos, basados en la estratificación del riesgo y el transporte por personal paramédico entrenado en ambulancias adecuadamente equipadas o helicópteros.
- •
Selección prehospitalaria de los pacientes con IAMCEST para su destino a las instituciones adecuadas, evitando los hospitales sin capacidad para realizar angioplastia, siempre que la angioplastia primaria se pueda realizar dentro de los límites de tiempo recomendados.
- •
A su llegada al hospital de destino, el paciente debe ser trasladado inmediatamente al laboratorio de hemodinámica, sin pasar porel servicio de urgencias.
- •
Los pacientes que se presenten en un hospital sin capacidad para realizar angioplastia y que estén esperando el transporte para angioplastia primaria o de rescate tienen que ser atendidos en un área adecuadamente monitorizada y con el personal apropiado.
- •
Si el diagnóstico de IAMCEST no se ha realizado en la ambulancia y esta llega a un hospital sin capacidad para realizar angioplastia, la ambulancia debe esperar el diagnóstico y, si se confirma el IAMCEST, debe continuar hasta un hospital con capacidad para realizar angioplastia.
Para maximizar la experiencia del personal, los centros con angioplastia primaria deben llevar a cabo los procedimientos de forma sistemática durante las 24 h/7 días a la semana (24/7) para todos los pacientes con IAMCEST. Hay otros modelos, que no son ideales, y que incluyen rotaciones semanales o diarias de centros con angioplastia primaria o múltiples centros con capacidad para angioplastia primaria dentro de la misma región. Se debería permitir que los hospitales que no pueden ofrecer un servicio 24/7 para angioplastia primaria realicen angioplastia primaria en pacientes ingresados por otra causa y que desarrollan IAMCEST durante el ingreso. No obstante, estos hospitales no deberían ofrecer un servicio limitado al horario diurno —o dentro de las primeras horas—, ya que esto genera confusión entre los operadores responsables del servicio de urgencias, y es poco probable que se cumplan los requisitos de tiempo «puerta-balón» y los criterios de calidad en la intervención que se cumplen en los verdaderos centros de angioplastia primaria especializados en el servicio 24/7. La población de referencia actual de los sistemas de redes en los países europeos que ofrecen angioplastia primaria a la mayor parte de su población es de 0,3-1,0 millones6. En áreas de servicios pequeños, la experiencia puede ser subóptima debido a un número insuficiente de pacientes con IAMCEST. Sin embargo, no está claro cuál debe ser el tamaño óptimo del área de referencia. Las áreas geográficas en las que el tiempo esperado de traslado a un centro con angioplastia primaria no permite alcanzar el retraso máximo permitido indicado en las recomendaciones que vienen más abajo (v. sección 3.4.6.) tienen que desarrollar sistemas de trombolisis rápida, preferiblemente en la ambulancia/fuera del hospital, seguido de transferencia inmediata a centros con angioplastia primaria.
Este tipo de redes reduce los retrasos en el tratamiento y aumenta la proporción de pacientes que reciben reperfusión47–49. En cada red se debe cuantificar y comparar a intervalos regulares la calidad de la asistencia, el tiempo que se tarda en recibirla y los resultados clínicos del paciente, y se deben tomar las medidas adecuadas para mejorar estos parámetros. En un gran registro de Estados Unidos, diversas estrategias se asociaron a una reducción del retraso en la angioplastia primaria, como la capacidad para activar el laboratorio de hemodinámica con una sola llamada, preferiblemente mientras el paciente se encuentra de camino hacia el hospital, con la intención de que el personal que va a realizar el cateterismo llegue al laboratorio de hemodinámica dentro de un plazo de 20min tras haber contactado por el busca, teniendo al cardiólogo en su puesto y utilizando un sistema de retroalimentación de datos a tiempo real entre la atención previa que ha recibido el paciente y el laboratorio de hemodinámica50. Las estrategias más efectivas para aumentar la proporción de pacientes que reciben una reperfusión efectiva y reducir los retrasos en la angioplastia primaria pueden ser diferentes en otros sistemas de salud. Con el objeto de abordar la cuestión del acceso a la angioplastia primaria y la utilización efectiva de las redes en toda Europa6, el grupo de trabajo de la ESC sobre atención cardiaca aguda (A cut e Car diac Car e), junto con la Eur opean Association of Percutaneous Cardiovascular Interventions y el EuroPCR, han unido sus fuerzas en la iniciativa Stent for Life para mejorar el acceso a una angioplastia primaria a tiempo y efectiva a través de la implementación de programas específicos, hechos a la medida de cada sistema sanitario e intentando aprender a partir de las estrategias más exitosas51. La experiencia adquirida a través de esta iniciativa en diversos sistemas de atención sanitaria europeos se publica regularmente y proporciona los trucos y recursos necesarios para aumentar y mejorar la implementación de la angioplastia primaria (www.stentforlife.com)52.
Médicos de cabeceraEn algunos países, los médicos de cabecera desempeñan un papel fundamental en la atención precoz del IAM y, a menudo, son los primeros a los que acude el paciente. Si los médicos de cabecera responden rápidamente pueden ser muy efectivos, ya que suelen conocer al paciente y pueden realizar e interpretar el ECG. La primera tarea después del diagnóstico ECG es alertar al servicio de urgencias. Pero también pueden administrar opiáceos y fármacos antitrombóticos (incluidos fibrinolíticos si ésa es la estrategia de manejo) y pueden realizar una desfibrilación cuando sea necesario. En la mayoría de casos, sin embargo, la consulta con un médico de cabecera —en lugar de llamar directamente al servicio de urgencias— aumenta el retraso prehospitalario. Por lo tanto, en general, se debe instruir al público para llamar al servicio de urgencias, antes que al médico de atención primaria, cuando haya síntomas que indiquen un infarto de miocardio.
Procedimientos de admisiónEl manejo de los pacientes cuando llegan al hospital debe ser muy rápido, sobre todo en cuanto al diagnóstico y la administración de un fármaco fibrinolítico, o la realización de una angioplastia primaria, según la indicación. Los candidatos a angioplastia primaria deben ingresar directamente en el laboratorio de hemodinámica siempre que sea posible, sin pasar por el servicio de urgencias o la unidad coronaria, mientras que los candidatos a fibrinolisis tienen que tratarse directamente en el contexto prehospitalario, el servicio de urgencias o la unidad coronaria53,54.
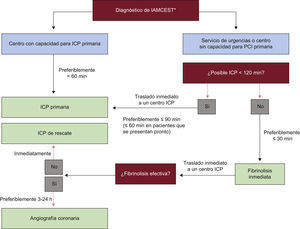
LogísticaEn una situación óptima (fig. 2), el paciente llama a un número central de urgencias para recibir ayuda lo antes posible después del inicio del dolor torácico. El servicio de urgencias envía una ambulancia completamente equipada con personal entrenado para realizar e interpretar un ECG de 12 derivaciones. Una vez que el ECG pone de manifiesto la elevación del segmento ST o un bloqueo de rama nuevo, o presuntamente nuevo, se informa al hospital más cercano con capacidad para realizar angioplastia acerca del tiempo estimado en el que va a llegar el paciente. Durante el traslado en la ambulancia, el laboratorio de hemodinámica se debe preparar y convocar al personal, cuando sea necesario, para que el paciente pueda ir directamente al laboratorio de cateterismo (sin pasar por el servicio de urgencias ni por la unidad coronaria). En los casos en los que el ECG diagnóstico se haya realizado en otro sitio (p. ej., un hospital sin capacidad para realizar angioplastia, un despacho médico, etc.), se debe llamar al servicio de urgencias para el traslado y seguir el procedimiento descrito anteriormente. Todo este proceso se lleva a cabo con más éxito cuando hay una red regional con un centro que realiza un gran volumen de angioplastias, varios hospitales circundantes que no practican angioplastia y un único servicio de urgencias regional. Este tipo de redes regionales debe disponer de protocolos de manejos predefinidos para pacientes con IAMCEST.
Manejo prehospitalario y hospitalario, y estrategias de reperfusión dentro de las primeras 24 h del primer contacto médico. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea. *El momento en que el diagnostico se confirma a partir de la historia clínica y el electrocardiograma, idealmente dentro de los primeros 10 min después del primer contacto médico. Todos los retrasos están relacionados con el primer contacto médico. Adaptada de Wijns et al4.
En pacientes con una presentación clínica de IAMCEST dentro de las primeras 12 h desde el inicio de los síntomas, y con elevación persistente del segmento ST o bloqueo de rama nuevo, o presuntamente nuevo, se debe realizar una reperfusión mecánica precoz o farmacológica lo antes posible (tabla 9).
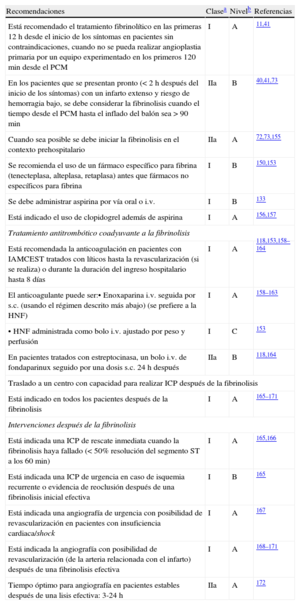
Recomendaciones para el tratamiento de reperfusión
| Recomendaciones | Clasea | Nivelb | Referencias |
| La terapia de reperfusión está indicada en todos los pacientes con síntomas de < 12 h de duración y elevación persistente del segmento ST o bloqueo de rama izquierda (presuntamente) nuevo | I | A | 65,66 |
| La terapia de reperfusión (preferiblemente angioplastia primaria) está indicada cuando hay evidencias de isquemia en curso, incluso cuando los síntomas se hayan iniciado > 12 h antes o cuando el dolor y los cambios del ECG hayan sido intermitentes | I | C | 67 |
| Se puede considerar el tratamiento de reperfusión con angioplastia primaria en pacientes estables que se presentan 12-24 h después del inicio de los síntomas | IIb | B | 60,61 |
| No está recomendado realizar ICP de rutina de una arteria totalmente ocluida > 24 h espués del inicio de los síntomas en pacientes estables que no presenten signos de isquemia (independientemente de que hayan recibido o no fibrinolisis) | III | A | 62–64 |
ECG: electrocardiograma; ICP: intervención coronaria percutánea.
Hay acuerdo general en que se debe considerar la terapia de reperfusión cuando haya evidencia clínica o ECG de isquemia en curso, incluso si, según el paciente, los síntomas se han iniciado > 12 h antes, ya que, a menudo, el inicio exacto de los síntomas no está claro, porque el dolor y los cambios del ECG son oscilantes59.
No obstante, no hay consenso sobre si la angioplastia es también beneficiosa en pacientes que llevan > 12 h de evolución desde el inicio de los síntomas en ausencia de evidencia clínica o ECG de isquemia en curso. Un estudio aleatorizado pequeño (n = 347), realizado en este tipo de pacientes asintomáticos que llegan tarde, ha demostrado que se produce rescate miocárdico y mejoría de la supervivencia a los 4 años después de la angioplastia primaria, comparado con el tratamiento conservador solo, en pacientes con síntomas persistentes de 12-48 h de duración desde su inicio60,61. Sin embargo, en el gran estudio clínico (n = 2.166) OAT no se ha observado beneficio clínico después de una intervención coronaria de rutina y manejo médico en pacientes estables con oclusión persistente de la arteria responsable62,63, más allá del obtenido con manejo médico solamente, cuando la oclusión se identificaba 3-28 días después del IAM, incluyendo el subgrupo de 331 pacientes aleatorizados entre las 24 y 72 h después del inicio del infarto64. Un metaanálisis de los estudios clínicos, que ha probado si la recanalización tardía de una arteria coronaria es beneficiosa, ha demostrado resultados consistentes con los obtenidos en el estudio OAT51.
Selección de una estrategia de reperfusiónLa angioplastia primaria —definida como una ICP urgente en el contexto de un IAMCEST, sin tratamiento fibrinolítico previo— es la estrategia de reperfusión preferida en pacientes con IAMCEST, siempre que se pueda realizar de forma rápida (es decir, dentro de los plazos de tiempo exigidos por las guías), por un equipo experimentado e independientemente de si el paciente se presenta a un hospital con capacidad para realizar angioplastias (fig. 1). Si el PCM se produce a través de un servicio de urgencias o en un centro sin capacidad para realizar angioplastias, se debe implementar de forma inmediata el traslado a través del servicio de urgencias hacia un laboratorio de hemodinámica para realizar la angioplastia. Un equipo experimentado no sólo requiere disponer de cardiólogos intervencionistas sino también de personal de apoyo capacitado. Esto significa que sólo los hospitales con un programa de cardiología intervencionista establecido (disponible las 24 h) deben usar angioplastia primaria como tratamiento de rutina. Se han observado tasas inferiores de mortalidad en pacientes que se someten a angioplastia primaria en centros con un alto volumen de procedimientos de angioplastia. La angioplastia primaria es efectiva para asegurar y mantener la permeabilidad coronaria evitándose algunos de los riesgos hemorrágicos de la fibrinolisis. Los estudios clínicos aleatorizados, que comparan la angioplastia primaria realizada a tiempo en un centro experimentado con un alto volumen de procedimientos con el tratamiento fibrinolítico llevado a cabo en el hospital, han demostrado repetidamente que la angioplastia primaria es superior a la fibrinolisis aplicada en el hospital68–71. (En estos estudios clínicos no hubo angioplastia de rescate en el seguimiento o angiografía de rutina en el seguimiento.) En los contextos clínicos en los que la angioplastia primaria no pueda realizarse dentro de los primeros 120min desde el PCM por un equipo experimentado se debe considerar la fibrinolisis, especialmente cuando pueda administrarse de forma prehospitalaria (p. ej., en la ambulancia)45,72,73 y dentro de los primeros 120min desde el inicio de los síntomas (fig. 2)40,74. La fibrinolisis debería ir seguida de una angioplastia de rescate o angiografía de rutina.
Tanto los estudios clínicos aleatorizados como los registros han indicado que los retrasos importantes en la angioplastia primaria se asocian a peores resultados clínicos. El retraso en el tiempo de aplicación de la reperfusión se ha definido anteriormente en la sección 3.4.1. El «retraso relacionado con la angioplastia» es la diferencia teórica entre el tiempo desde el PCM hasta el inflado del balón, menos el tiempo desde el PCM hasta el inicio del tratamiento fibrinolítico (es decir, «puerta-a-balón» menos «puerta-a-aguja»). El grado en el cual el retraso relacionado con la angioplastia reduce las ventajas de la angioplastia sobre la fibrinolisis ha sido objeto de muchos análisis y debates. Debido a que ningún estudio clínico se ha diseñado específicamente para abordar esta cuestión, hay que tener precaución a la hora de interpretar los resultados de estos análisis post-hoc. A partir de los estudios clínicos aleatorizados, se ha calculado que el retraso relacionado con la angioplastia que puede mitigar el beneficio de la intervención mecánica varía entre 60 y 110min. En otro análisis de estos estudios clínicos se calculó que el beneficio de la angioplastia primaria sobre el tratamiento fibrinolítico se mantenía hasta un retraso relacionado con la angioplastia de 120 min66. En 192.509 pacientes incluidos en el registro norteamericano National Registry of Myocardial Infarction 2-441, el retraso medio relacionado con la angioplastia, en el que las tasas de mortalidad de las 2 estrategias de reperfusión fueron comparables, se calculó en 114min. Este estudio también indicó que este retraso variaba considerablemente según la edad, la duración de los síntomas y la localización del infarto: desde < 1 h para un infarto anterior en un paciente < 65 años de edad que se presentaba < 2 h desde el inicio de los síntomas, hasta casi 3 h para un infarto no anterior en un paciente > 65 años de edad que se presentaba > 2 h después del inicio de los síntomas. Aunque estos resultados fueron obtenidos a partir de un análisis post-hoc de un registro y, algunas veces, los tiempos calculados en los retrasos son poco precisos, este estudio sugiere que un enfoque individualizado para seleccionar la modalidad óptima de reperfusión, en lugar de uno uniforme, es más adecuado cuando la angioplastia primaria no puede realizarse de forma expeditiva. Teniendo en cuenta los estudios clínicos y los registros mencionados anteriormente, un objetivo para la evaluación de la calidad es que la angioplastia primaria (introducción de la guía) es que se realice dentro de los primeros 90min desde el PCM en todos los casos. En los pacientes que se presentan antes y que tienen una gran cantidad de miocardio en riesgo, el retraso debe ser menor (< 60 min). En pacientes que se presentan directamente a un hospital con capacidad para realizar angioplastias, el objetivo debe ser realizar la angioplastia primaria dentro de los primeros 60min desde el PCM. Aunque no se han llevado a cabo estudios específicos, un objetivo que parece razonable es considerar un retraso máximo de sólo 90min después del PCM en estos pacientes. Conviene señalar que estos objetivos en el retraso para la implementación de la angioplastia primaria son indicadores de calidad y que pueden diferir del retraso máximo relacionado con la angioplastia de 120min, que es útil para seleccionar la angioplastia primaria sobre la fibrinolisis inmediata como la estrategia preferida de reperfusión (tabla 10).
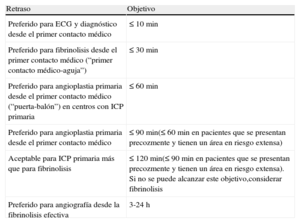
Tiempos importantes de retraso y objetivos del tratamiento en el manejo del infarto agudo de miocardio con elevación del segmento ST
| Retraso | Objetivo |
| Preferido para ECG y diagnóstico desde el primer contacto médico | ≤ 10 min |
| Preferido para fibrinolisis desde el primer contacto médico (“primer contacto médico-aguja”) | ≤ 30 min |
| Preferido para angioplastia primaria desde el primer contacto médico (“puerta-balón”) en centros con ICP primaria | ≤ 60 min |
| Preferido para angioplastia primaria desde el primer contacto médico | ≤ 90 min(≤ 60 min en pacientes que se presentan precozmente y tienen un área en riesgo extensa) |
| Aceptable para ICP primaria más que para fibrinolisis | ≤ 120 min(≤ 90 min en pacientes que se presentan precozmente y tienen un área en riesgo extensa). Si no se puede alcanzar este objetivo,considerar fibrinolisis |
| Preferido para angiografía desde la fibrinolisis efectiva | 3-24 h |
ECG: electrocardiograma; ICP: intervención coronaria percutánea.
Aproximadamente el 50% de los pacientes con IAMCEST tiene enfermedad multivaso significativa. Durante la intervención inicial sólo debe tratarse la arteria relacionada con el infarto (ARI). Actualmente no hay evidencias que apoyen una intervención urgente en las lesiones no relacionadas con el infarto75,76. Las únicas excepciones que justifican la angioplastia en múltiples vasos durante el IAMCEST corresponden a pacientes en shock cardiogénico que presentan múltiples estenosis muy críticas (≥ 90% diámetro) en lesiones altamente inestables (signos angiográficos de posibles trombos o rotura de la lesión) y cuando hay isquemia persistente de la lesión supuestamente responsable tras la angioplastia. No obstante, en pacientes con enfermedad multivaso y shock cardiogénico, no se deben colocar stents deforma rutinaria en las lesiones «no culpables» que no tengan estenosis críticas77 (v. también sección 3.5.4.9.).
Angioplastia primaria: indicaciones y aspectos del procedimiento
| Recomendaciones | Clasea | Nivelb | Referencias |
| Indicaciones para angioplastia primaria | |||
| La angioplastia primaria es el tratamiento de reperfusión recomendado, por encima de la fibrinolisis, si se realiza por un equipo experimentado dentro de los primeros 120 min desde el primer contacto médico | I | A | 69,99 |
| La angioplastia primaria está indicada en pacientes con insuficiencia cardiaca aguda grave o shock cardiogénico, excepto si el retraso previsto para ICP es excesivo y el paciente se presenta precozmente después del inicio de los síntomas | I | B | 100 |
| Aspectos del procedimiento de la ICP primaria | |||
| Se recomienda el uso de stent (por encima de angioplastia con balón únicamente) en la ICP primaria | I | A | 101,102 |
| La ICP primaria debe limitarse al vaso responsable, excepto cuando haya shock cardiogénico e isquemia persistente después de la angioplastia primaria de la lesión supuestamente responsable | IIa | B | 75,103–105 |
| Cuando se realice por un operador con experiencia en acceso radial, es preferible el acceso radial al acceso femoral | IIa | B | 78,79 |
| Cuando el paciente no tenga contraindicaciones para TDAP prolongado (indicación de anticoagulación oral o riesgo elevado estimado de hemorragia a largo plazo), y se prevea un alto grado de cumplimiento, son preferibles los stents farmacoactivos a los convencionales | IIa | A | 80,82,106,107 |
| Se debe considerar la aspiración de rutina del trombo | IIa | B | 83–85 |
| No está recomendado el uso rutinario de dispositivos de protección distal. | III | C | 86–108 |
| No está recomendado el uso rutinario de balón de contrapulsación (en pacientes sin shock) | III | A | 97,98 |
ICP: intervención coronaria percutánea; TDAP: tratamiento de doble antiagregación plaquetaria.
Debido a la necesidad de usar antitrombosis potente y fármacos antiplaquetarios, las hemorragias son mucho más frecuentes cuando la angioplastia se realiza durante un SCA (y, en particular, en el IAMCEST), comparado con la hemorragia que ocurre durante un procedimiento electivo. El uso de fármacos con un efecto antitrombótico más potente se acompaña, a menudo, de un aumento en el riesgo hemorrágico relacionado, sobre todo, con el lugar de la punción arterial. Se ha demostrado que el acceso radial reduce la incidencia de episodios hemorrágicos agudos, especialmente en los síndromes coronarios agudos; en el estudio clínico RIVAL para la intervención coronaria, el acceso radial en lugar del femoral redujo la mortalidad en el subgrupo de pacientes con IAMCEST78. Unos hallazgos similares se observaron en el estudio RIFLE STEACS79. En el estudio RIVAL se produjo, no obstante, una interacción entre el beneficio del acceso radial y la experiencia del operador, lo que sugiere que el beneficio del acceso radial sobre el femoral depende de la experiencia de los operadores en utilizar la vía radial.
En la angioplastia primaria, los stents farmacoactivos (SFA) reducen el riesgo de revascularización repetida del vaso diana, en comparación con los stents convencionales80. Ha habido cierta preocupación sobre el aumento de riesgo de trombosis intra-stent tardía y reinfarto asociados al uso de SFA, comparado con los stents convencionales80. Sin embargo, el uso de SFA no se ha asociado a un aumento del riesgo de muerte, infarto de miocardio o trombosis intra-stent en el seguimiento a largo plazo82. Un aspecto relacionado con el uso rutinario de SFA en este contexto es que, a menudo, es difícil determinar de forma fiable la capacidad de los pacientes para cumplir o tolerar la doble antiagregación plaquetaria. Un problema asociado con el uso de SFA, de forma rutinaria, en este contexto es que muchas veces es difícil determinar de forma fiable la capacidad de los pacientes para cumplir o tolerar durante un tiempo prolongado la doble antiagregación plaquetaria. Actualmente se está probando si las nuevas generaciones de SFA proporcionan mejores resultados clínicos —comparadas con las generaciones más antiguas o con los stents convencionales— tras una angioplastia primaria.
Un único estudio clínico aleatorizado, el TAPAS83, ha demostrado mejores índices de reperfusión miocárdica (resolución del segmento ST y blush miocárdico) a partir del uso rutinario de aspiración manual del trombo antes de introducir un balón o un stent en la arteria coronaria. El seguimiento a 1 año en este estudio ha demostrado una reducción en la mortalidad, con la aspiración del trombo como objetivo secundario84. Se han obtenido resultados similares a partir de un metaanálisis del estudio TAPAS y varios estudios clínicos de menor tamaño85. No se han podido encontrar beneficios similares con la trombectomía mecánica o los dispositivos de protección embólica. No obstante sigue sin conocerse cuál es la diferencia en el impacto clínico entre los distintos modelos86. En el reciente estudio clínico aleatorizado INFUSE-AMI,, la aspiración del trombo no afectó al tamaño de infarto87. Se han iniciado diversos estudios clínicos aleatorizados de gran tamaño para intentar confirmar los resultados del estudio TAPAS88,89.
Los operadores que realizan la angioplastia primaria en el contexto del IAMCEST deben ser conscientes de la importancia de seleccionar un tamaño adecuado de stent. La mayoría de los pacientes con IAMCEST tiene algún grado de espasmo coronario y, por lo tanto, la administración intracoronaria de nitratos está recomendad antes de iniciar la secuencia angiográfica coronaria utilizada para la selección del tamaño de stent. La presencia de un trombo también puede llevar a utilizar un stent demasiado pequeño (que se despliega de forma subóptima), que es una causa frecuente de reestenosis o trombosis intra-stent en la práctica diaria.
Los estudios clínicos preliminares han explorado el valor del pre y poscondicionamiento miocárdico para mejorar el miocardio salvado. Un pequeño estudio aleatorizado ha probado el efecto del condicionamiento a distancia utilizando isquemia intermitente en el brazo mediante 4 ciclos sucesivos de 5min de duración de inflación y deflación de un manguito de presión arterial90. Este procedimiento se asoció a una mejoría en los marcadores subrogados de rescate miocárdico medidos por imagen de perfusión miocárdica a los 30 días. Se desconoce si este efecto se asocia a beneficios clínicos. El papel del poscondicionamiento se ha explorado en estudios pequeños, ya sea utilizando inflaciones repetidas del balón o perfusiones de ciclosporina. Los resultados son controvertidos91–95. Debido a que estos hallazgos son preliminares y al pequeño tamaño de los estudios clínicos que los han probado, es necesario confirmar el beneficio clínico del pre y poscondicionamiento miocárdico a partir de los estudios clínicos aleatorizados que están en marcha y antes de que estos procedimientos puedan recomendarse en la práctica clínica de rutina.
El estudio CRISP AMI no ha demostrado ningún beneficio con el uso rutinario del balón de contrapulsación aórtico (BCPA) en el infarto de miocardio anterior sin shock97 y sí un aumento de la hemorragia, lo que es consistente con los datos disponibles acerca del papel de la BCPA en pacientes con IAM sin shock cardiogénico98.
Farmacoterapia periprocedimiento (tabla 12)Los pacientes que se someten a una angioplastia primaria deben recibir una combinación de doble antiagregación plaquetaria con aspirina y un antagonista del receptor de adenosina difosfato (ADP) lo antes posible, antes de la angiografía, y un anticoagulante parenteral. Hasta la fecha, no hay estudios clínicos que hayan evaluado el inicio de la doble antiagregación plaquetaria antes del ingreso hospitalario, en lugar de su administración en el hospital, ni su uso previo, en lugar de su uso durante la angiografía, en el contexto del IAMCEST, pero es una práctica común en Europa y es consistente con los datos farmacocinéticos de los antitrombóticos orales, que sugieren que la administración más precoz es preferible para alcanzar su eficacia de forma más rápida.
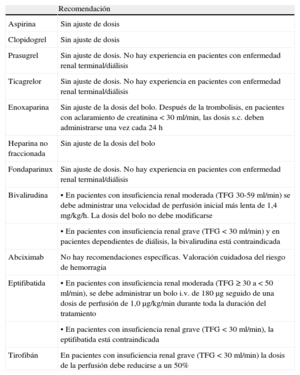
Medicación antitrombótica periprocedimiento en la angioplastia primaria
| Recomendaciones | Clasea | Nivelb | Referencias |
| Tratamiento antiplaquetario | |||
| Se recomienda aspirina por vía oral o i.v. (si no se puede deglutir) | I | B | 133,134 |
| Se recomienda un inhibidor del receptor de ADP además de la aspirina. Las opciones son: | I | A | 135,136 |
| • Prasugrel en pacientes que no han tomado clopidogrel, si no hay historia previa de accidente cerebrovascular/AIT, edad < 75 años | I | B | 109 |
| • Ticagrelor | I | B | 110 |
| • Clopidogrel, preferiblemente cuando el prasugrel o ticagrelor no estén disponibles o estén contraindicados | I | C | – |
| Los inhibidores GP IIb/IIIa se deben considerar para tratamiento de rescate si hay evidencia angiográfica de trombo masivo, flujo lento o no-reflujo o complicación trombótica | IIa | C | – |
| Se puede considerar el uso rutinario de un inhibidor GP IIb/IIIa como tratamiento coadyuvante a la ICP primaria realizada con HNF en pacientes sin contraindicaciones | IIb | B | 137–141 |
| Se puede considerar el uso de un inhibidor GP IIb/IIIa previo al procedimiento (frente al uso en el laboratorio de hemodinámica) en pacientes de alto riesgo que se transfieren a angioplastia primaria | IIb | B | 127,128,137,142 |
| Las opciones para los inhibidores GP IIb/IIIa son (con el nivel de evidencia para cada fármaco): | – | ||
| • Abciximab | A | 137 | |
| • Eptifibatida (con un bolo doble) | B | 138,139 | |
| • Tirofibán (con un bolo de dosis alta) | B | 140,141 | |
| Anticoagulantes | |||
| Se debe utilizar un anticoagulante inyectable en la ICP primaria | I | C | |
| Se recomienda el uso de bivalirudina (restringiendo el uso de inhibidores GP IIb/IIIa a los tratamientos de rescate) con preferencia al uso de HNF o de un inhibidor GP IIb/IIIa | I | B | 124 |
| Se prefiere el uso de enoxaparina (con o sin inhibidor GP IIb/IIIa de rutina) a la HNF | IIb | B | 122 |
| Se debe administrar HNF, con o sin uso rutinario de un inhibidor GP IIb/IIIa, en pacientes que no reciben bivalirudina o enoxaparina | I | C | 1 |
| No está recomendado el uso de fondaparinux en la angioplastia primaria | III | B | 118 |
| No está recomendado el uso de fibrinolisis antes de una ICP primaria programada | III | A | 127,143 |
ADP: adenosina bifosfato; AIT: accidente isquémico transitorio; GP: glucoproteína; HNF: heparina no fracionada; i.v.: intravenoso; ICP: intervención coronaria percutánea.
La aspirina debe administrarse preferiblemente por vía oral (recomendable una dosis de 150-300 mg), incluso en comprimidos masticables, para asegurar una inhibición completa de la agregación plaquetaria dependiente de tromboxano A2, pero puede administrarse por vía i.v. en pacientes que no pueden deglutir. Hay muy pocosdatos clínicos sobre la dosis i.v. óptima, aunque los datos farmacológicos sugieren que una dosis menor que la que se administra oralmente puede evitar la inhibición de la prostaciclina, por lo que es preferible un bolo de aspirina i.v. en el rango de dosis 80-150mg.
Los antagonistas del receptor de ADP preferidos son el prasugrel (dosis de carga de 60mg por vía oral, dosis de mantenimiento de 10 mg) o el ticagrelor (dosis de carga de 180mg por vía oral dosis de mantenimiento de 90mg —2 veces al día—); estos fármacos tienen un inicio de acción más rápido y mayor potencia, y han demostrado ser superiores al clopidogrel en los estudios clínicos de gran tamaño109,110. En el estudio TRITON-TIMI38, el prasugrel redujo la variable principal combinada de muerte cardiovascular, IAM no fatal o accidente cerebrovascular en pacientes que no habían tomado clopidogrel y que se sometían a angioplastia primaria, o angioplastia primaria o secundaria en el contexto del IAMCEST o del SCA sin elevación del segmento ST de riesgo moderado a alto una vez que se había realizado la angiografía coronaria109. En la cohorte entera se produjo un aumento significativo en la tasa de hemorragia mayor TIMI no relacionada con la cirugía coronaria. En el subgrupo de pacientes con IAMCEST que se sometían a angioplastia primaria o secundaria, el beneficio fue consistente, sin que se produjera un aumento significativo del riesgo hemorrágico no relacionado con la cirugía111. El prasugrel está contraindicado en pacientes con accidente cerebrovascular/accidente isquémico transitorio previo. Generalmente, su uso no está recomendado en pacientes ≥ 75 años de edad o en pacientes con bajo peso corporal (< 60 kg), ya que no se ha asociado con un beneficio clínico neto en estos subgrupos de pacientes. Las recomendaciones en Europa indican que, cuando se usa en estos pacientes, se debe considerar una dosis de carga similar pero una dosis de mantenimiento reducida de 5mg, aunque no hay datos disponibles sobre los resultados clínicos con esta dosis y hay antagonistas alternativos del receptor de ADP en este contexto112. En el estudio PLATO, el ticagrelor redujo la variable principal combinada (muerte cardiovascular, IAM no fatal o accidente cerebrovascular) y también redujo la mortalidad cardiovascular en pacientes que no habían tomado clopidogrel o en pacientes pretratados con IAMCEST (programados para angioplastia primaria) o con SCA sin elevación del segmento ST de riesgo moderado a alto (programados para recibir manejo conservador o invasivo)109,110. Aunque no hubo diferencias significativas en las tasas globales de hemorragia mayor definidas en el estudio PLATO entre los grupos de clopidogrel y ticagrelor, las hemorragias mayores no relacionadas con la cirugía coronaria definidas en el estudio PLATO y las hemorragias mayores TIMI estuvieron aumentadas en el grupo de ticagrelor. En el subgrupo de pacientes con IAMCEST, el beneficio fue consistente113. El ticagrelor puede causar disnea transitoria al inicio del tratamiento, que no se asocia a anomalías pulmonares morfológicas o funcionales y que raramente conduce a la interrupción del tratamiento114. En el estudio PLATO, los pacientes que experimentaron disnea presentaron un beneficio sobre la mortalidad con ticagrelor consistente con el observado en el conjunto de la población incluida en el estudio. El ticagrelor también puede asociarse a bradicardia asintomática en la primera semana de tratamiento. Ninguno de los fármacos más potentes (prasugrel o ticagrelor) debe usarse en pacientes con accidente cerebrovascular hemorrágico previo o en pacientes con enfermedad hepática de moderada a grave. Cuando ninguno de estos fármacos esté disponible (o si están contraindicados) se puede administrar en su lugar clopidogrel 600mg p.o.115. El clopidogrel no se ha evaluado frente a placebo en ningún estudio clínico de gran tamaño en el contexto de la angioplastia primaria, pero el régimen de mayor dosis consistente en 600mg dosis de carga/150mg dosis de mantenimiento en la primera semana ha demostrado ser superior al régimen 300/75mg en el subgrupo de pacientes que se sometieron a angioplastia primaria del estudio OASIS 7115, y el uso de una dosis de carga elevada de clopidogrel ha demostrado alcanzar una inhibición más rápida del receptor de ADP. Esto es consistente con la farmacocinética del clopidogrel, un profármaco que requiere un metabolismo importante antes de convertirse en su forma activa y, por lo tanto, que debe administrarse a altas dosis y lo más precozmente posible para ejercer su acción en el contexto de urgencia de la angioplastia primaria. Además, en los estudios observacionales se ha demostrado que el pretratamiento con altas dosis de clopidogrel es superior al tratamiento aplicado en el laboratorio de hemodinámica116,117. Todos los antagonistas del receptor de ADP deben usarse con precaución en pacientes con alto riesgo hemorrágico o con anemia significativa.
Las opciones de anticoagulación para la angioplastia primaria incluyen heparina no fraccionada (HNF), enoxaparina y bivalirudina. El uso de fondaparinux en el contexto de la angioplastia primaria se ha asociado con daño potencial en el estudio OASIS 6 y, por lo tanto, no está recomendado118. No se han llevado a cabo estudios clínicos controlados por placebo que evalúen el uso de HNF en la angioplastia primaria, aunque hay amplia experiencia con este fármaco. La dosis debe seguir las recomendaciones estándar para angioplastia (es decir, un bolo inicial de 70-10 0 U/kg cuando no esté previsto administrar ningún inhibidor de la glucoproteína [GP] IIb/IIIa o 50-60 U/kg cuando esté previsto utilizar inhibidores GP IIb/IIIa). No hay datos sólidos que recomienden utilizar el tiempo de activación de la coagulación para establecer la dosis o monitorizar la HNF y, si se usa el tiempo de activación de la coagulación, éste no debe retrasar la recanalización de la ARI. Varios estudios no aleatorizados han sugerido que la enoxaparina (0,5 mg/kg i.v. seguida por tratamiento subcutáneo) proporciona más beneficio que la HNF en la angioplastia primaria119–121. Se ha comparado la enoxaparina con la HNF en un estudio clínico no ciego, el estudio
ATOLL. La variable principal combinada formada por muerte a los 30 días, complicación del infarto de miocardio, fallo en el procedimiento y hemorragias mayores no se redujo significativamente (un 17% de reducción; p = 0,063), pero hubo reducciones en la principal variable secundaria combinada de muerte, infarto de miocardio recurrente o SCA, o revascularización urgente, y en variables secundarias combinadas como muerte, o reanimación de paro cardiaco y muerte, o complicación del infarto de miocardio. Es importante señalar que no se describió un aumento de las hemorragias asociadas al uso de enoxaparina respecto a la HNF122. Basándose en estas consideraciones y en la experiencia clínica considerable en el uso de enoxaparina en otros contextos de angioplastia109–111 se prefiere el uso de enoxaparina al de la HNF.
Un estudio clínico de gran tamaño no ciego ha demostrado la superioridad de la bivalirudina sobre la combinación de HNF + inhibidor GP IIb/IIIa123, un beneficio que se debió a una reducción marcada en las hemorragias, asociado a un aumento inicial en la trombosis intra-stent, que desapareció después de 30 días124. Es importante remarcar que este estudio describió una reducción en la mortalidad de cualquier causa y mortalidad cardiovascular a los 30 días, que se mantuvo hasta los 3 años82. Una gran proporción de los pacientes del estudio HORIZONS–AMI recibió HNF previamente a la aleatorización, y aproximadamente el 10% recibió inhibidores GP IIb/IIIa como tratamiento de rescate. Este aspecto es importante, ya que la interpretación de los resultados del estudio puede estar ligeramente influida por un elemento de confusión consistente en la interacción entre el uso de HNF prealeatorización, el uso de 600mg de dosis de carga de clopidogrel y el riesgo reducido de trombosis intra-stent125.
Diversos estudios clínicos realizados antes del uso rutinario de la doble antiagregación plaquetaria, que utilizaban principalmente abciximab, habían documentado beneficios clínicos de los inhibidores GP IIb/IIIa como tratamiento adyuvante a la angioplastia primaria realizada con HNF126. El estudio FINESSE127 no ha encontrado que el uso rutinario de abciximab antes de la angioplastia primaria produzca beneficios clínicos, sino más bien un aumento del riesgo hemorrágico, si se compara con su uso de rutina en el laboratorio de hemodinámica, lo que sugiere que, en pacientes que se someten a angioplastia primaria, no parece haber ningún beneficio apreciable y sí un aumento del daño al iniciar el tratamiento con inhibidores GP IIb/IIIa en el contexto prehospitalario. Un análisis post-hoc de un subgrupo de pacientes del estudio FINESSE, que se ha centrado en pacientes que se presentaron en las primeras 4 h desde el inicio de los síntomas a hospitales sin capacidad para realizar angioplastias y que requirieron un traslado, ha sugerido que puede haber un beneficio en la supervivencia asociado al uso de abciximab128. Más recientemente, el estudio ON-TIME 2129ha encontrado una mejoría en los marcadores subrogados de reperfusión asociada al tratamiento de tirofibán iniciado durante la fase prehospitalaria, antes de la angioplastia primaria, y que se continuó hasta las 18 h después del procedimiento (comparado con el uso provisional [es decir, no sistemático] en el laboratorio de hemodinámica). También se produjo una reducción de la variable secundaria combinada de muerte durante el infarto de miocardio recurrente en la revascularización urgente del vaso diana y tratamiento antitrombótico de rescate. Finalmente, en el gran estudio clínico HORIZONS-AMI124, no hubo un claro beneficio a partir del uso combinado de un inhibidor GP IIb/IIIa + HNF, comparado con la bivalirudina (con una fracción considerable de pacientes que recibieron HNF antes de la aleatorización), y el estudio Bavarian Reperfusion Alternatives Evaluation-3 no encontró evidencia de una reducción en el tamaño de infarto a partir del tratamiento con abciximab en pacientes sometidos a angioplastia primaria tratados con 600mg de clopidogrel130. Por lo tanto, no hay una respuesta definitiva sobre el papel actual del uso de rutina de los inhibidores GP IIb/IIIa en la angioplastia primaria en la era de la doble antiagregación plaquetaria potente, especialmente cuando se usa prasugrel o ticagrelor, y sigue siendo dudoso el valor de iniciar el tratamiento antes de entrar en el laboratorio de hemodinámica. Parece razonable el uso de inhibidores GP IIb/IIIa como tratamiento de rescate en caso de evidencia angiográfica de trombo de gran tamaño, flujo lento o no reflujo y otras complicaciones trombóticas, pero no se ha demostrado en un estudio aleatorizado. En conclusión, los datos existentes sugieren que si se elige la bivalirudina como anticoagulante, no hay beneficio en la adición de rutina de inhibidores GP IIb/IIIa, y que una estrategia de bivalirudina sola (con un uso provisional de rescate de inhibidores GP IIb/IIIa) produce menores tasas hemorrágicas y reduce la mortalidad. Si se escoge HNF o enoxaparina como anticoagulante sigue siendo controvertido el papel del uso rutinario —en contraposición al uso «de rescate»— de los inhibidores GP IIb/IIIa.
La administración intracoronaria (i.c.) de los inhibidores GP IIb/IIIa en lugar de la i.v. se ha probado en varios estudios clínicos pequeños y se ha asociado a algunos b eneficios131. El estudio INFUSE-AMI87ha aleatorizado a 452 pacientes que se sometían a una ICP con bivalirudina a recibir una administración local de abciximab frente a no recibir abciximab. El abciximab i.c. redujo el tamaño de infarto a los 30 días, evaluado por imagen de resonancia magnética, pero no mejoró la puntuación que cuantificaba las anomalías en la motilidad de la pared, la resolución del segmento ST, el flujo coronario postangioplastia o la perfusión miocárdica. El gran estudio clínico aleatorizado Abciximab Intracoronary vs intravenously Drug Application 4, que reclutó a 2.065 pacientes (es decir, más que todos los estudios previos combinados), no encontró ningún beneficio clínico (sino más bien daño) en esta ruta de administración en cuanto a la variable combinada de muerte, reinfarto e insuficiencia cardiaca, y se observó una reducción que estaba en el límite de la significación estadística en la variable secundaria de insuficiencia cardiaca132. Por lo tanto, se puede considerar la ruta i.c., pero la i.v. debe seguir siendo la vía estándar para la administración de los inhibidores GP IIb/IIIa.
No está indicado el tratamiento anticoagulante de rutina posprocedimiento tras una angioplastia primaria, excepto cuando haya una indicación independiente para anticoagulación, ya sea a dosis completa (debida, por ejemplo, a fibrilación auricular [FA], válvulas mecánicas o trombo ventricular izquierdo) o a dosis profilácticas para la prevención de la tromboembolia venosa en pacientes que requieran reposo prolongado en la cama.
Prevención y tratamiento de la obstrucción microvascular y el no reflujoLa perfusión miocárdica inadecuada después de una apertura mecánica exitosa de la ARI se suele conocer como «no reflujo». El diagnóstico de no reflujo acostumbra a realizarse el flujo TIMI es < 3 o, en caso de que haya un flujo TIMI de 3, cuando el grado de blush miocárdico sea 0 o 1 o cuando la resolución del segmento ST dentro de las primeras 4 h del procedimiento sea < 70%144. Otras técnicas no invasivas son la ecocardiografía de contraste, la tomografía computarizada por emisión de fotón único. la tomografía por emisión de positrones (PET) y la imagen por resonancia magnética de contraste.
Ha habido muchos intentos de tratar el no reflujo mediante vasodilatadores i.c., perfusión i.v. o adenosina o abciximab, pero no hay pruebas definitivas de que estos tratamientos afecten a los resultados clínicos. De forma parecida, y aunque se usa ampliamente en la práctica clínica, no hay evidencias firmes de que la aspiración manual del trombo reduzca la embolización distal83–86,145.
Fibrinolisis e intervenciones subsiguientesBeneficio de la fibrinolisisLa fibrinolisis es una estrategia importante de reperfusión, especialmente en las situaciones en las que la angioplastia primaria no pueda realizarse en pacientes con IAMCEST dentro de los plazos de tiempo recomendados. Está bien establecido el beneficio del tratamiento fibrinolítico en pacientes con IAMCEST146: en comparación con el placebo, se previenen aproximadamente 30 muertes prematuras por cada 1.000 pacientes tratados en las primeras 6 h desde el inicio de los síntomas. Globalmente, el mayor beneficio absoluto se observa entre los pacientes de mayor riesgo, incluso cuando el beneficio proporcional pueda ser similar. El beneficio también se observa en los pacientes ancianos: en un subgrupo de 3.300 pacientes de más de 75 años que se presentaron dentro de las primeras 12 h del inicio de los síntomas y que tenían elevación del segmento ST o bloqueo de rama, las tasas de mortalidad se redujeron significativamente con el tratamiento fibrinolítico147.
Momento del tratamientoUn análisis de estudios en los que se aleatorizó a 6.000 pacientes a recibir trombolisis prehospitalaria o trombolisis en el hospital, ha demostrado una reducción significativa (17%) de la mortalidad precoz con el tratamiento prehospitalario72. En un metaanálisis de 22 estudios clínicos65 se encontró una reducción mucho mayor de la mortalidad en pacientes tratados en las primeras 2 h que en los tratados más tarde. Estos datos apoyan el inicio prehospitalario del tratamiento fibrinolítico cuando esta estrategia de reperfusión esté indicada. Otros análisis post-hoc más recientes de diversos estudios clínicos aleatorizados y datos obtenidos de registros han confirmado la utilidad de la fibrinolisis prehospitalaria40,44,47,143. La mayoría de estos estudios han demostrado resultados clínicos similares a los de la angioplastia primaria, siempre que la angiografía precoz y la angioplastia se realizaran en los pacientes que necesitaran la intervención (sobre todo aquellos en los que la lisis parecía haber fallado). No obstante, no se ha investigado de forma prospectiva en estudios aleatorizados y de tamaño adecuado si la fibrinolisis prehospitalaria se asocia a resultados clínicos similares o mejores que la angioplastia primaria en pacientes que se presentan de forma precoz. El estudio STREAM, que se encuentra actualmente en marcha, aborda esta cuestión148.
Riesgos de la fibrinolisisEl tratamiento fibrinolítico está asociado a un aumento pequeño, pero significativo, de accidentes cerebrovasculares146, con la característica de que todo el aumento del riesgo se produce en el primer día del tratamiento. Estos accidentes cerebrovasculares tempranos se atribuyen fundamentalmente a hemorragia cerebral; los accidentes cerebrovasculares más tardíos son, con más frecuencia, trombóticos o embólicos. La edad avanzada, el bajo peso corporal, el sexo femenino, la enfermedad cerebral previa y la hipertensión sistólica y diastólica durante el ingreso son predictores significativos de hemorragia intracraneal149. En los últimos estudios clínicos, la hemorragia intracranel ocurrió en un 0,9-1,0% del total de la población estudiada150,151. Las hemorragias mayores no cerebrales (complicaciones hemorrágicas que requieren transfusión sanguínea o que ponen en riesgo la vida) ocurren en un 4-13% de los pacientes tratados150–152. La administración de estreptocinasa puede asociarse a hipotensión, pero las reacciones alérgicas graves son raras. Se debe evitar la readministración de estreptocinasa debido a que los anticuerpos pueden afectar su actividad y al riesgo de reacciones alérgicas.
Comparación de los fármacos fibrinolíticosEn el estudio GUSTO153, el activador del plasminógeno tisular (tPA) alteplasa, junto con la HNF i.v. ajustada por el tiempo de tromboplastina parcial activada resultó en 10 muertes menos por cada 1.000 pacientes tratados, comparada con la estreptocinasa, al coste de 3 accidentes cerebrovasculares adicionales, sólo uno de los cuales responsable de un déficit neurológico residual. Se han estudiado diversas variantes de tPA. El doble bolo de reteplasa no ofrece ninguna ventaja respecto a la pauta acelerada de tPA, excepto por su fácil administración151. El bolo único ajustado por peso de TNK-tPA (tenecteplasa) es equivalente a la pauta acelerada de tPA en cuanto a la mortalidad a 30 días, y se asocia a una disminución significativa en la tasa de hemorragias no cerebrales y menor necesidad de transfusión sanguínea150. El tratamiento fibrinolítico en bolo es más fácil de utilizar en el contexto prehospitalario.
Contraindicaciones del tratamiento fibrinolíticoLas contraindicaciones absolutas y relativas del tratamiento fibrinolítico se enumeran en la tabla 13. La reanimación exitosa no es una contraindicación para el tratamiento fibrinolítico. Sin embargo, el tratamiento lítico no es efectivo, aumenta la hemorragia y no está indicado en pacientes refractarios a la reanimación. La reanimación prolongada o traumática, aunque sea efectiva, aumenta el riesgo hemorrágico y constituye una contraindicación relativa para la fibrinolisis154.
Contraindicaciones para el tratamiento fibrinolítico
| Absolutas |
| Hemorragia intracraneal previa o accidente cerebrovascular de origen desconocido en cualquier momento |
| Accidente cerebrovascular isquémico en los 6 meses precedentes |
| Daño en el sistema nervioso central o neoplasias o malformación auriculoventricular |
| Trauma/cirugía/lesión craneal importante recientes (en las 3 semanas precedentes) |
| Hemorragia gastrointestinal en el último mes |
| Trastorno hemorrágico conocido (excluida la menstruación) |
| Disección aórtica |
| Punciones no compresibles en las últimas 24 h (p. ej., biopsia hepática, punción lumbar) |
| Relativas |
| Accidente isquémico transitorio en los 6 meses precedentes |
| Tratamiento anticoagulante oral |
| Gestación o primera semana posparto |
| Hipertensión refractaria (presión arterial sistólica > 180 mmHg o presión arterial diastólica > 110 mmHg) |
| Enfermedad hepática avanzada |
| Endocarditis infecciosa |
| Úlcera péptica activa |
| Reanimación prolongada o traumática |
El tratamiento fibrinolítico está recomendado en las primeras 12 h del inicio de los síntomas, cuando la angioplastia primaria no pueda realizarse dentro de los primeros 90min desde que se puede administrar la fibrinolisis y en los primeros 120min desde el PCM (v. sección 3.4.6. y fig. 1) y no haya contraindicaciones (tabla 14). Cuanto más tarde se presente el paciente, mayor es la consideración que debe darse a la posibilidad de traslado para angioplastia primaria (con preferencia sobre el tratamiento fibrinolítico), debido a que la eficacia y el beneficio clínico de la fibrinolisis se reducen con el tiempo y, en presentaciones tardías, tiene el efecto de aumentar el retraso de tiempo aceptable antes del traslado para angioplastia primaria74.
Tratamiento fibrinolítico
| Recomendaciones | Clasea | Nivelb | Referencias |
| Está recomendado el tratamiento fibrinolítico en las primeras 12 h desde el inicio de los síntomas en pacientes sin contraindicaciones, cuando no se pueda realizar angioplastia primaria por un equipo experimentado en los primeros 120 min desde el PCM | I | A | 11,41 |
| En los pacientes que se presentan pronto (< 2 h después del inicio de los síntomas) con un infarto extenso y riesgo de hemorragia bajo, se debe considerar la fibrinolisis cuando el tiempo desde el PCM hasta el inflado del balón sea > 90 min | IIa | B | 40,41,73 |
| Cuando sea posible se debe iniciar la fibrinolisis en el contexto prehospitalario | IIa | A | 72,73,155 |
| Se recomienda el uso de un fármaco específico para fibrina (tenecteplasa, alteplasa, retaplasa) antes que fármacos no específicos para fibrina | I | B | 150,153 |
| Se debe administrar aspirina por vía oral o i.v. | I | B | 133 |
| Está indicado el uso de clopidogrel además de aspirina | I | A | 156,157 |
| Tratamiento antitrombótico coadyuvante a la fibrinolisis | |||
| Está recomendada la anticoagulación en pacientes con IAMCEST tratados con líticos hasta la revascularización (si se realiza) o durante la duración del ingreso hospitalario hasta 8 días | I | A | 118,153,158–164 |
| El anticoagulante puede ser:• Enoxaparina i.v. seguida por s.c. (usando el régimen descrito más abajo) (se prefiere a la HNF) | I | A | 158–163 |
| • HNF administrada como bolo i.v. ajustado por peso y perfusión | I | C | 153 |
| En pacientes tratados con estreptocinasa, un bolo i.v. de fondaparinux seguido por una dosis s.c. 24 h después | IIa | B | 118,164 |
| Traslado a un centro con capacidad para realizar ICP después de la fibrinolisis | |||
| Está indicado en todos los pacientes después de la fibrinolisis | I | A | 165–171 |
| Intervenciones después de la fibrinolisis | |||
| Está indicada una ICP de rescate inmediata cuando la fibrinolisis haya fallado (< 50% resolución del segmento ST a los 60 min) | I | A | 165,166 |
| Está indicada una ICP de urgencia en caso de isquemia recurrente o evidencia de reoclusión después de una fibrinolisis inicial efectiva | I | B | 165 |
| Está indicada una angiografía de urgencia con posibilidad de revascularización en pacientes con insuficiencia cardiaca/shock | I | A | 167 |
| Está indicada la angiografía con posibilidad de revascularización (de la arteria relacionada con el infarto) después de una fibrinolisis efectiva | I | A | 168–171 |
| Tiempo óptimo para angiografía en pacientes estables después de una lisis efectiva: 3-24 h | IIa | A | 172 |
HNF: heparina no fraccionada; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; i.v.: intravenoso; PCM: primer contacto médico; s.c.: subcutáneo.
Cuando se disponga de instalaciones adecuadas con personal médico o paramédico entrenado capaz de analizar el ECG en el lugar donde se ha realizado, o de transmitirlo al hospital para su supervisión, se debe iniciar el tratamiento fibrinolítico en el contexto prehospitalario. El objetivo es empezar el tratamiento dentro de los primeros 30min del PCM. En el caso de los pacientes que se presentan directamente al hospital, un objetivo realista es iniciar la fibrinolisis en un plazo de 30min (tiempo puerta-aguja). Es preferible elegir un fármaco específico para fibrina. Las dosis de los fármacos fibrinolíticos se muestran en la tabla 15.
Dosis de fármacos fibrinolíticos
| Tratamiento inicial | Contraindicaciones específicas | |
| Estreptocinasa (SK) | 1,5 millones de unidades i.v. durante 30-60 min | SK previa o anistreplasa |
| Alteplasa (tPA) | Bolo i.v. de 15 mg 0,75 mg/kg durante 30 min (hasta 50 mg) seguidos de 0,5 mg/kg i.v. durante 60 min (hasta 35 mg) | |
| Reteplasa (r-PA) | 10 unidades + bolo i.v. de 10 unidades administrado después de 30 min | |
| Tenecteplasa (TNK-tPA) | Bolo i.v. único: | |
| 30 mg si < 60 kg | ||
| 35 mg si 60 a < 70 kg | ||
| 40 mg si 70 a < 80 kg | ||
| 45 mg si 80 a < 90 kg | ||
| 50 mg si ≥ 90 kg |
i.v.: intravenoso.
Las dosis de tratamientos antiplaquetarios y antitrombóticos coadyuvantes se muestran en la tabla 16.
Dosis de los tratamientos antiplaquetarios y antitrombóticos coadyuvantes
| Dosis del tratamiento antiplaquetario coadyuvante | |
| Con angioplastia primaria | |
| Aspirina | Dosis de carga de 150-300 mg por vía oral o de 80-150 mg i.v. si la ingestión oral no es posible, seguida de una dosis de mantenimiento de 75-100 mg/día |
| Clopidogrel | Dosis de carga de 600 mg por vía oral, seguida de una dosis de mantenimiento de 75 mg/día |
| Prasugrel | Dosis de carga de 60 mg por vía oral, seguida de una dosis de mantenimiento de 10 mg/día En pacientes con un peso corporal < 60 kg, se recomienda una dosis de mantenimiento de 5 mg En pacientes de > 75 años, el prasugrel no se recomienda en general, pero se puede usar una dosis de 5 mg si se considera que el tratamiento es necesario |
| Ticagrelor | Dosis de carga de 180 mg por vía oral, seguida de una dosis de mantenimiento de 90 mg dos veces al día |
| Abciximab | Bolo i.v. de 0,25 mg/kg y perfusión de 0,125 _g/kg/min (máximo 10 _g/min) durante 12 h |
| Eptifibatida | Bolo doble i.v. de 180 _g/kg (administrado con un intervalo de 10 min) seguido de perfusión de 2,0 _g/kg/min durante 18 h |
| Tirofibán | 25 _g/kg i.v. durante 3 min, seguido de perfusión de mantenimiento de 0,15 _g/kg/min durante 18 h |
| Con tratamiento fibrinolítico | |
| Aspirina | Dosis inicial de 150-500 mg por vía oral o 250 mg i.v. si la ingestión oral no es posible |
| Clopidogrel | Dosis de carga de 300 mg por vía oral si el paciente tiene ≤ 75 años de edad, seguida de dosis de mantenimiento de 75 mg/día |
| Sin tratamiento de reperfusión | |
| Aspirina | Dosis inicial de 150-500 mg por vía oral |
| Clopidogrel | 75 mg/día por vía oral |
| Dosis del tratamiento antitrombótico coadyuvante | |
| Con angioplastia primaria | |
| Heparina no fraccionada | Bolo i.v. de 70-100 U/kg cuando no esté prevista la administración de un inhibidor GP IIb/IIIa |
| Bolo i.v. de 50-60 U/kg con inhibidores GP IIb/IIIa | |
| Enoxaparina | Bolo i.v. de 0.5 mg/kg |
| Bivalirudina | Bolo i.v. de 0,75 mg/kg seguido de perfusión i.v. de 1,75 mg/kg/h hasta 4 h después del procedimiento, según la necesidad clínica. Al acabar la perfusión de 1,75 mg/kg/h se puede continuar con una dosis de perfusión reducida de 0,25 mg/kg/h hasta 4-12 h, según la necesidad clínica |
| Con tratamiento fibrinolítico | |
| Heparina no fraccionada | Bolo i.v. de 60 U/kg con un máximo de 4.000 U, seguido de perfusión i.v. de 12 U/kg con un máximo de 1.000 U/h durante 24-4 8 h. El objetivo de TTPA debe ser: 50-70 s o 1,5 a 2 veces el valor control, con monitorización a las 3, 6, 12 y 24 h |
| Enoxaparina | En pacientes de < 75 años de edad: Bolo i.v. de 30 mg seguido, a los 15 min, de 1 mg/kg s.c. cada 12 h hasta el alta durante un máximo de 8 días. Las primeras 2 dosis no deben exceder los 100 mg En pacientes de > 75 años de edad: No se debe administrar bolo i.v.; iniciar el tratamiento con un dosis s.c. de 0,75 mg/kg con un máximo de 75 mg para las primeras dos dosis s.c. En pacientes con aclaramiento de creatinina de < 30 ml/min, independientemente de la edad, las dosis s.c. deben administrarse una vez al día cada 24 h |
| Fondaparinux | Bolo i.v. de 2,5 mg seguido de dosis s.c. de 2,5 mg una vez al día hasta 8 días o hasta el alta |
| Sin tratamiento de reperfusión | |
| Heparina no fraccionada | Mismas dosis que con tratamiento fibrinolítico |
| Enoxaparina | Mismas dosis que con tratamiento fibrinolítico |
| Fondaparinux | Mismas dosis que con tratamiento fibrinolítico |
GP: glucoproteína; i.v.: intravenoso; s.c.: subcutáneo; TTPA: tiempo de tromboplastina parcial activada.
El estudio ISIS-2 (Second International Study of Infarct Survival) ha proporcionado evidencias convincentes que demuestran la eficacia de la aspirina cuando se añade a la fibrinolisis, ya que los beneficios de la aspirina y la estreptocinasa tuvieron efectos aditivos133. La primera dosis de 150-300mg debe masticarse o administrarse de forma i.v. (aunque en un rango de dosis menor) y, posteriormente, se debe administrar una dosis por vía oral menor diaria (75-100 mg). En el estudio CLARITY-TIMI 28, el clopidogrel añadido a la aspirina redujo el riesgo de episodios cardiovasculares en pacientes ≤ 75 años de edad que habían sido tratados con fibrinolisis, y en el estudio COMMIT, el clopidogrel redujo la mortalidad global en estos pacientes156,157. De acuerdo con estos resultados hay razones sólidas para apoyar el uso rutinario de clopidogrel añadido a la aspirina como coadyuvante del tratamiento lítico. El prasugrel y el ticagrelor no se han investigado como coadyuvantes de la fibrinolisis y no deben administrarse.
No está claro el papel de los inhibidores GP IIb/IIIa usados en conjunción con la postrombolisis precoz de rutina durante la angioplastia. En el estudio GRACIA-3173 se aleatorizó a 436 pacientes con IAMCEST, tratados con TNK-tPA, enoxaparina y aspirina, a recibir tirofibán o a no recibir tirofibán. No hubo evidencias de que la administración de tirofibán mejorara la perfusión epicárdica o miocárdica.
La anticoagulación parenteral se ha utilizado ampliamente durante y después de la fibrinolisis y debe administrarse preferiblemente hasta la revascularización (si se va a realizar). En los otros casos debe administrarse durante, por lo menos, 48 h o durante todo el ingreso hospitalario, hasta 8 días. La HNF ha demostrado mejorar la permeabilidad coronaria después del tratamiento con alteplasa, pero no después de la estreptocinasa174,175. Es obligatorio realizar una dosificación cuidadosa y una monitorización estrecha del tratamiento i.v. con HNF; los valores de TTPA de > 70 s se asocian a una probabilidad mayor de hemorragia, reinfarto y muerte. A pesar de un aumento del riesgo de hemorragias mayores, el beneficio clínico neto favorece el uso de enoxaparina sobre la HNF en los estudios clínicos más recientes: en el estudio ASSENT 3 (n = 6.095), una dosis estándar de enoxaparina administrada en asociación con TNK-tPA durante un máximo de 7 días redujo el riesgo de reinfarto durante el ingreso o de isquemia refractaria durante el ingreso cuando se comparó con la HNF158. Sin embargo, en el estudio ASSENT-3 PLUS (n = 1.639)159, la administración prehospitalaria de la misma dosis de enoxaparina produjo un aumento significativo en la tasa de hemorragias intracraneales en los pacientes ancianos. En el gran estudio clínico ExTRACT-TIMI 25 (n = 20.506) se administró a pacientes > 75 años de edad o a los que tenían una función renal disminuida (aclaramiento de creatinina < 30 ml/min) una dosis menor de enoxaparina. La enoxaparina se asoció a una reducción en el riesgo de muerte y reinfarto a los 30 días cuando se comparó con la dosis ajustada por peso de HNF, pero a expensas de un aumento significativo en las complicaciones hemorrágicas no cerebrales. El beneficio clínico neto (ausencia de muerte, infarto no fatal y hemorragia intracraneal) favoreció el uso de enoxaparina160,161. Finalmente, en el gran estudio OASIS-6 se demostró que el fondaparinux es superior al placebo o a la HNF en la prevención de la muerte y reinfarto118,164, sobre todo en pacientes que recibieron estreptocinasa.
En un estudio clínico de gran tamaño con estreptocinasa176 no se observó ninguna reducción de la mortalidad a los 30 días, pero se produjo una reducción significativa de los reinfartos con bivalirudina (un inhibidor directo de la trombina, administrado durante 48 h) comparada con la HNF, aunque a expensas de un aumento modesto y no significativo de las complicaciones hemorrágicas no cerebrales. La bivalirudina no se ha estudiado con fármacos específicos de la fibrina. Así pues, no hay evidencias que apoyen el uso de inhibidores directos de la trombina como tratamiento coadyuvante de la fibrinolisis.
La TNK-tPA, la aspirina, la enoxaparina y el clopidogrel constituyen la combinación antitrombótica más ampliamente estudiada como parte de la estrategia farmacoinvasiva, a sab er TRANSFER168, NORDISTEMI170, GRACIA-2177 y GRACIA-3173.
Angiografía después de la fibrinolisisDespués del inicio del tratamiento lítico, los pacientes deben ser trasladados a un centro con capacidad para realizar angioplastia (v. sección 3.4.6.). En los casos en los que la fibrinolisis haya fallado, o si hay evidencia de reoclusión o reinfarto con elevación recurrente del segmento ST, el paciente debe someterse a una angiografía de urgencia y angioplastia de rescate165. La readministración de la fibrinolisis ha demostrado no ser beneficiosa. Incluso cuando es probable que la fibrinolisis sea efectiva (resolución del segmento ST > 50% a los
60-90 min; arritmia típica de reperfusión; desaparición del dolor torácico) se recomienda una estrategia de angiografía precoz de rutina si no hay contraindicaciones. Diversos estudios clínicos aleatorizados168–171,178,179 y 3 metaanálisis contemporáneos172,180 han demostrado que la angiografía precoz de rutina postrombolisis con angioplastia subsiguiente (si es necesaria) reduce las tasas de reinfarto e isquemia recurrente comparada con la estrategia de «espera en observación», en la que la angiografía y la revascularización estaban indicadas sólo en los pacientes con isquemia grave espontánea o inducida, o disfunción VI. Los beneficios de la angioplastia precoz de rutina tras la trombolisis se han observado en ausencia de un riesgo elevado de episodios adversos (accidente cerebrovascular o hemorragia).
Por lo tanto, el traslado rápido para angiografía seguida de angioplastia (cuando esté indicada) debe ser el estándar de atención después de la tr ombolisis: lo q ue se conoce como es tr at egia «farmacoinvasiva». Un aspecto crítico es el retraso óptimo entre la lisis y la angioplastia: ha habido una gran variación en este tiempo en los estudios clínicos, desde una me diana de 1,3 h en el estudio CAPITAL-AMI hasta 16,7 h en el estudio GRACIA-1171,179. Según los datos de los 3 estudios más recientes, todos ellos con un retraso medio entre el inicio de la lisis y la angiografía de 2-3 h, se recomienda una ventana de tiempo de 3-24 h después de la lisis con éxito168–170. Los estudios STREAM148 y GRACIA-4, que están actualmente en marcha, están explorando si la lisis realizada con los tratamientos coadyuvantes modernos seguida por una angioplastia, puede producir resultados clínicos similares o mejores que la angioplastia primaria.
Tratamiento antitrombótico coadyuvante para la angioplastia tardía después de la lisisEn pacientes que se someten a angioplastia varias horas o días después de la fibrinolisis, la angioplastia debe estar asistida por un tratamiento de doble antiagregación plaquetaria (aspirina y un antagonista ADP) y tratamiento de antitrombina, en dosis similares a las usadas para angioplastia primaria.
Estrategia de revascularización en el infarto de miocardio con elevación ST y enfermedad multivasoAdemás de en los pacientes que están en shock cardiogénico y de los que presentan isquemia continua después de la apertura de la lesión supuestamente responsable, la angioplastia coronaria está generalmente desaconsejada en los vasos no responsables. Todavía no se ha establecido cuál es la mejor estrategia para los pacientes con IAMCEST y enfermedad multivaso que se sometieron a angioplastia primaria de la ARI en la fase aguda y que tienen enfermedad multivaso residual. Entre las posibles estrategias, 2 que se utilizan frecuentemente son, por una parte, un enfoque conservador, que consiste en tratamiento médico tras la angioplastia primaria y revascularización de otras arterias sólo si hay síntomas o evidencia de isquemia en tests de provocación, y, por otra, un enfoque de revascularización por etapas, que consiste en realizar angioplastia o cirugía coronaria de las arterias no relacionadas con el infarto varios días o semanas después de la angioplastia, normalmente después de la confirmación de la gravedad de la estenosis mediante determinaciones de la reserva de flujo fraccional. A menudo se necesita realizar un enfoque multidisciplinar, que incluya un equipo cardiaco y el adecuado consentimiento informado por parte del paciente.
En pacientes con IAMCEST y enfermedad multivaso tratados inicialmente con angioplastia primaria o de rescate de la arteria responsable y en los que se ha confirmado la presencia de isquemia de los territorios no infartados, se puede realizar una revascularización por etapas antes del alta hospitalaria o en los días o semanas posteriores a la angioplastia primaria181. Se está llevando a cabo una comparación de la revascularización completa realizada en el hospital (ARI y no-ARI) frente a enfoque conservador (sólo ARI) en los estudios CVLPRIT y PRAMI. Ambos estudios evalúan el beneficio/riesgo de tratar las lesiones no relacionadas con el infarto. De forma similar, el estudio DANAMI-3 investiga si es conveniente tratar las lesiones no responsables en pacientes sometidos previamente a una angioplastia primaria.
Cirugía coronaria y revascularización multivasoEl número de pacientes que precisa cirugía coronaria en la fase aguda del IAMCEST es pequeño, pero la cirugía puede estar indicada en casos en los que haya una anatomía no apta para angioplastia, pero con una ARI permeable, ya que la permeabilidad de esta arteria permite que haya tiempo suficiente para el traslado al quirófano. La cirugía también puede estar indicada en pacientes en shock cardiogénico cuando la anatomía coronaria no pueda mejorarse con angioplastia, o en pacientes con complicaciones mecánicas en el momento de la reparación. La cirugía coronaria no se acostumbra a realizar —y sus beneficios son dudosos— en los casos en los que la angioplastia haya fallado, la oclusión coronaria no pueda solucionarse con angioplastia o haya síntomas refractarios después de la angioplastia, porque en la mayoría de estos casos, el tiempo para realizar una reperfusión quirúrgica será prolongado y los riesgos asociados a la cirugía son muy elevados.
Interrupción transitoria de los inhibidores de adenosina difosfato para la cirugíaSe debe sopesar el riesgo de hemorragia relacionado con la cirugía frente al riesgo de episodios isquémicos recurrentes relacionados con la interrupción del tratamiento, teniendo presente el tipo de cirugía, el riesgo isquémico y el grado de EC, el tiempo trascurrido desde el episodio agudo, el tiempo transcurrido desde la angioplastia y el riesgo de trombosis intra-stent. El clopidogrel se asocia a un aumento del riesgo hemorrágico cuando el tratamiento se interrumpe menos de 5 días antes de la intervención quirúrgica. El prasugre l también se asocia a un marcado au mento del riesgo hemorrágico109. En cuanto al ticagrelor, los datos disponibles del estudio PLATO110 indican que cuando el tratamiento se interrumpe 3-5 días antes de la cirugía coronaria se producen los mismos episodios de hemorragia y transfusiones relacionados con la cirugía que los del clopidogrel y ticagrelor. Aunque las tasas de infarto de miocardio no fatal y accidentes cerebrovasculares no fueron significativamente distintas en esta cohorte, la mortalidad se redujo a la mitad en el grupo de ticagrelor. En pacientes estabilizados es razonable interrumpir el tratamiento con clopidogrel por lo menos 5 días antes de la cirugía y el prasugrel 7 días antes de la cirugía. Teniendo en cuenta los resultados del estudio PLATO, el ticagrelor puede interrumpirse 3-5 días antes de la cirugía.
Ningún estudio clínico ha abordado la cuestión de si se debe restablecer el tratamiento con inhibidores del receptor de ADP después de la cirugía coronaria y sigue sin conocerse cuál debe ser el momento óptimo para reiniciar el tratamiento en caso de hacerlo. Sin embargo, teniendo en cuenta la reducción de la mortalidad con ticagrelor en el estudio PLATO y el riesgo continuado de episodios isquémicos en pacientes posquirúrgicos, es razonable reiniciar la doble antiagregación plaquetaria lo antes posible dentro de los límites de seguridad en relación con el riesgo de hemorragia.
En pacientes de riesgo muy elevado en los que la interrupción del tratamiento antiplaquetario antes de la cirugía conlleve un riesgo alto (p. ej., dentro de las primeras semanas después de implantar un stent) se ha sugerido la posibilidad de cambiar, antes de la cirugía, a un fármaco antiplaquetario reversible y de vida media corta, por ejemplo, el inhibidor del receptor GP IIb/IIIa tirofibán o eptifibatida182, aunque no hay evidencia clínica que apoye esta estrategia, que se basa únicamente en los estudios farmacocinéticos o farmacodinámicos. En el futuro, el uso de cangrelor, un inhibidor i.v. reversible del receptor de ADP, puede permitir mantener la inhibición plaquetaria hasta el momento de la cirugía en pacientes que han interrumpido el tratamiento antiplaquetario oral183.
Pacientes no reperfundidosAntitrombóticosSe debe administrar aspirina, clopidogrel y un fármaco antitrombótico lo más precozmente posible (HNF, enoxaparina o fondaparinux) en pacientes que se presentan dentro de las primeras 12 h desde el inicio de los síntomas y que no han recibido terapia de reperfusión, o en los que se presentan después de las 12 h (v. sección 3.4.6.)1,156,184. En el estudio OASIS-6, el fondaparinux fue superior a la HNF en un subgrupo de 1.641 pacientes con estas características y puede ser el tratamiento antitrombótico preferido para esta indicación185. Si se tiene que realizar angioplastia primaria en un paciente que recibe fondaparinux se debe administrar HNF i.v. durante el procedimiento en las mismas dosis que se usan para angioplastia primaria, para minimizar el riesgo de trombosis del catéter186. Las dosis recomendadas se muestran en la tabla 16. No se ha estudiado ninguno de los fármacos orales en este subgrupo particular de pacientes, pero en el estudio CURE187, el beneficio del clopidogrel sobre el placebo ha sido consistente en los pacientes con SCA, independientemente de la estrategia de revascularización. El ticagrelor fue superior al clopidogrel en los pacientes con SCA aleatorizados a estrategia precoz no invasiva, con una tendencia similar también en los no revascularizados durante la hospitalización188.
Evaluación invasiva y revascularizaciónEn ocasiones, los pacientes acuden al médico demasiado tarde y, o bien, no reciben tratamiento de reperfusión o se someten a un tratamiento de reperfusión que no es efectivo. Se ha sugerido que conseguir la permeabilidad coronaria de forma tardía en estas situaciones puede tener todavía un efecto beneficioso, al prevenir el remodelado adverso, mejorar la función VI, aumentar la estabilidad eléctrica e inducir la formación de vasos colaterales dirigidos a otros lechos coronarios para la protección de episodios futuros (hipótesis de la «arteria abierta»). Varios estudios clínicos han evaluado esta hipótesis, de los cuales el más grande con diferencia es el estudio OAT (v. anteriormente)62, en el que el 20% de los pacientes recibió tratamiento fibrinolítico durante el episodio principal. La angioplastia no redujo la tasa de muerte, reinfarto o insuficiencia cardiaca, comparada con el tratamiento médico. Además, hubo una tendencia hacia un aumento en el número de reinfartos durante 4 años de seguimiento en el grupo de tratamiento invasivo, comparado con el grupo de tratamiento médico. Un metaanálisis de todos los estudios clínicos en este contexto ha proporcionado resultados similares63. Estos estudios demuestran que, después de un infarto de miocardio en pacientes estables, la angioplastia tardía de una arteria ocluida—responsable del infarto— no tiene un beneficio añadido sobre el tratamiento médico óptimo. Por lo tanto, en los casos de pacientes que se presentan días después del episodio agudo con un infarto de miocardio que ya se ha completado, sólo debe considerarse la revascularización cuando la arteria esté ocluida si hay angina recurrente o isquemia residual documentada y viabilidad tisular probada a partir de una prueba de imagen no invasiva en un territorio miocárdico extenso4.
Subgrupos especiales de pacientesAlgunos subgrupos específicos de pacientes merecen una consideración especial (tabla 17):
- •
Las mujeres tienden a presentarse más tardíamente y pueden tener síntomas más atípicos que los de los varones191. Sin embargo, el infarto de miocardio sigue siendo la principal causa de muerte en mujeres y, por lo tanto, es importante mantener un alto nivel de vigilancia sobre el infarto de miocardio en mujeres que tengan síntomas potenciales de isquemia. Además, varios estudios observacionales han demostrado que las mujeres tienden a recibir menos intervenciones que los varones, incluida la terapia de reperfusión192; y también que esto puede no ser únicamente debido a la diferencia de edad, es decir, al hecho de que las mujeres presenten el infarto de miocardio a edades más tardías que los varones193,194. Cuando las mujeres reciben una terapia de reperfusión efectiva, como la angioplastia primaria, presentan el mismo riesgo de muerte que los varones195. Por lo tanto, es esencial realizar un tratamiento de reperfusión igual de efectivo en mujeres que en varones. Las mujeres suelen tener menor peso corporal y son más susceptibles de hemorragia, por lo que los tratamientos antitrombóticos y la dosis de éstos deben utilizarse prestando especial atención al riesgo hemorrágico.
- •
Los pacientes ancianos suelen tener presentaciones atípicas o con síntomas leves, lo que puede dar lugar a un diagnóstico tardío de infarto de miocardio o una falta de diagnóstico189. Las personas de edad avanzada tienen un riesgo particularmente elevado de hemorragia y otras complicaciones derivadas del tratamiento agudo, porque con la edad el riesgo de hemorragia aumenta, la función renal tiende a disminuir y la prevalencia de comorbilidades es alta. Además, los estudios observacionales han demostrado sobredosis frecuentes en los tratamientos antitrombóticos190. Por lo tanto, es fundamental mantener un alto índice de sospecha de infarto de miocardio en pacientes ancianos que se presentan con molestias atípicas y prestar una atención específica a la dosificación correcta de los tratamientos antitrombóticos, sobre todo en relación con la función renal.
- •
En los pacientes con SCA, la disfunción renal está presente en aproximadamente el 30-40% y se asocia a un peor pronóstico y aumento del riesgo de hemorragia196. Las decisiones sobre la reperfusión en pacientes con IAMCEST se tienen que tomar antes de tener disponible ninguna información acerca de la función renal, pero es importante evaluar la tasa de filtración glomerular lo antes posible después del ingreso. Los pacientes con SCA y enfermedad renal crónica suelen recibir dosis excesivas de antitrombóticos, lo que lleva a un aumento del riesgo de hemorragia190. El beneficio del ticagrelor ha sido consistente o superior en pacientes con disfunción renal: tasa de filtración glomerular < 60 ml/min en el estudio PLATO197. En pacientes con sospecha o confirmación de la existencia de una función renal disminuida se debe interrumpir el tratamiento de ciertos fármacos antitrombóticos o ajustar las dosis convenientemente (tabla 18). Es importante asegurar una hidratación adecuada durante y después de la angioplastia primaria y limitar las dosis de agentes de contraste para reducir el riesgo de nefropatía inducida por contraste4.
Tabla 18.Dosis iniciales de fármacos antitrombóticos en pacientes con enfermedad renal crónica (aclaramiento estimado de creatinina < 60 ml/min)
Recomendación Aspirina Sin ajuste de dosis Clopidogrel Sin ajuste de dosis Prasugrel Sin ajuste de dosis. No hay experiencia en pacientes con enfermedad renal terminal/diálisis Ticagrelor Sin ajuste de dosis. No hay experiencia en pacientes con enfermedad renal terminal/diálisis Enoxaparina Sin ajuste de la dosis del bolo. Después de la trombolisis, en pacientes con aclaramiento de creatinina < 30 ml/min, las dosis s.c. deben administrarse una vez cada 24 h Heparina no fraccionada Sin ajuste de la dosis del bolo Fondaparinux Sin ajuste de dosis. No hay experiencia en pacientes con enfermedad renal terminal/diálisis Bivalirudina • En pacientes con insuficiencia renal moderada (TFG 30-59 ml/min) se debe administrar una velocidad de perfusión inicial más lenta de 1,4 mg/kg/h. La dosis del bolo no debe modificarse • En pacientes con insuficiencia renal grave (TFG < 30 ml/min) y en pacientes dependientes de diálisis, la bivalirudina está contraindicada Abciximab No hay recomendaciones específicas. Valoración cuidadosa del riesgo de hemorragia Eptifibatida • En pacientes con insuficiencia renal moderada (TFG ≥ 30 a < 50 ml/min), se debe administrar un bolo i.v. de 180 μg seguido de una dosis de perfusión de 1,0 μg/kg/min durante toda la duración del tratamiento • En pacientes con insuficiencia renal grave (TFG < 30 ml/min), la eptifibatida está contraindicada Tirofibán En pacientes con insuficiencia renal grave (TFG < 30 ml/min) la dosis de la perfusión debe reducirse a un 50% i.v.: intravenoso; s.c.: subcutáneo; TFG: tasa de filtración glomerular.
- •
Los pacientes diabéticos tienen un riesgo más elevado de muerte y complicaciones, pero la selección del tratamiento antitrombótico y de reperfusión es la misma que la de los no diabéticos. Los beneficios de los potentes inhibidores orales del receptor P2Y12 (prasugrel o ticagrelor) frente a clopidogrel han demostrado ser consistentes o superiores en los pacientes diabéticos198,199.
Subgrupos especiales
| Recomendaciones | Clasea | Nivelb | Referencias |
| Ambos sexos se deben manejar de forma similar | I | C | – |
| Se debe mantener un alto índice de sospecha de infarto de miocardio en mujeres, diabéticos y ancianos con síntomas atípicos | I | B | 189 |
| Se debe prestar atención especial a la correcta dosificación de los fármacos antitrombóticos en ancianos y pacientes con insuficiencia renal | I | B | 190 |
La hiperglucemia en el ingreso es común en pacientes con SCA, y es un predictor potente de la mortalidad y las complicaciones intrahospitalarias. Las concentraciones elevadas de glucosa se han asociado a un pronóstico adverso, tanto en pacientes diabéticos como en no diabéticos. No obstante, las altas concentraciones de glucosa en la sangre pueden ser también un signo de alteraciones a largo plazo del metabolismo glucídico, debido a una diabetes no diagnosticada o a un trastorno de la tolerancia a la glucosa200. Recientemente se ha demostrado en pacientes con IAMCEST no diabéticos que la hiperglucemia y el aumento de la hemoglobina A1c (HbA1c) se asocian a un peor pronóstico por mecanismos diferentes, y la hiperglucemia es la que mejor predice el pronóstico a corto plazo de los infartos de gran tamaño, mientras que la elevación de la HbA1c se asocia a efectos clínicos a largo plazo debido a un aumento del riesgo basal201.
Aunque la corrección de la hiperglucemia con insulina puede tener beneficios, los estudios clínicos que han evaluado el efecto de la intervención metabólica en pacientes con IAMCEST han dado lugar a resultados contradictorios202. En particular, los beneficios del control estricto de la glucosa mediante insulina i.v. mostrados en el estudio DIGAMI no se han confirmado en el estudio posterior DIGAMI-2. Las perfusiones de glucosa-insulina-potasio no han tenido efecto e incluso, en un análisis combinado de 2 grandes estudios clínicos aleatorizados203, han sido perjudiciales. Además, en pacientes críticamente enfermos hay un riesgo elevado de episodios relacionados con la hipoglucemia cuando se usa un tratamiento intensivo de insulina204. No disponemos de una respuesta definitiva sobre cómo debe ser el manejo de glucosa en pacientes con IAMCEST, incluidos el umbral de tratamiento y la concentración de glucosa que se debe alcanzar y, por lo tanto, la estrategia de control «estricto pero no demasiado estricto» de la glucosa en pacientes con IAMCEST es el enfoque más práctico. En la fase aguda es razonable manejar la hiperglucemia (es decir, mantener unas concentraciones de glucosa sanguínea ≤ 11,0 mmol/l), pero evitar totalmente la hipoglucemia205,206. Esto puede requerir en algunos pacientes realizar una perfusión de insulina ajustada por dosis con monitorización de la glucemia.
Debido a la frecuencia de diabetes no diagnosticada y alteraciones del metabolismo de la glucosa en pacientes con IAMCEST, es razonable medir la HbA1c y la glucemia en ayunas en todos los pacientes sin diabetes conocida que han desarrollado hiperglucemia durante la fase aguda (tabla 19). Si los datos no son concluyentes, puede ser necesario realizar una prueba de tolerancia a la glucosa oral después del alta, preferiblemente a los 4 días tras la fase aguda. Sigue sin conocerse cuál es la mejor estrategia terapéutica para reducir de forma específica el riesgo de mortalidad asociado a la HbA1c, aparte de las estrategias de prevención secundaria (tratamiento antiplaquetario, reducción drástica de los lípidos, control de la presión arterial, cambios en el estilo de vida y rehabilitación cardiaca), que deben implementarse en todos los supervivientes de un IAM. No se sabe si un control más intensivo y precoz de la glucemia con fármacos orales proporciona una mayor protección cardiovascular, un aspecto que se debería investigar en estudios futuros207.
Manejo de la hiperglucemia en el infarto de miocardio con elevación del segmento ST
| Recomendaciones | Clasea | Nivelb | Referencias |
| Está indicada la determinación de la glucemia durante la evaluación inicial en todos los pacientes, y debe repetirse en pacientes con diabetes conocida o hiperglucemia | I | C | – |
| Se debe planificar el control óptimo de glucosa y la estrategia de prevención secundaria antes del alta en los pacientes diabéticos | I | C | – |
| Los objetivos del control de glucosa en la fase aguda deben ser el mantenimiento de una concentración de glucosa ≤ 11,0 mmol/l (200 mg/dl), a la vez que se evita la disminución de la glucemia < 5 mmol/l (< 90 mg/dl). En algunos pacientes, esto puede requerir una perfusión de insulina con ajuste de dosis y con monitorización de glucosa para evitar la hipoglucemia | IIa | B | 202,204,207 |
| En pacientes con hiperglucemia pero sin historia de diabetes se debe considerar la determinación de la glucosa y HbA1c en ayunas y, en algunos casos, un test oral de tolerancia a la glucosa después del alta | IIa | B | 208 |
| No está indicada la perfusión de rutina de glucosa-insulina-potasio | III | A | 118,203 |
HbA1c: hemoglobina A1c.
Se debe ingresar a los pacientes con IAMCEST en una unidad de cuidados intensivos, una unidad coronaria (tabla 20) o una unidad monitorizada equivalente, después del tratamiento de reperfusión. La unidad coronaria es una unidad de cuidados intensivos diseñada para ofrecer atención especializada a pacientes con enfermedad cardiovascular que precisan una monitorización continua. El personal debe estar plenamente familiarizado en el manejo del SCA, arritmias, insuficiencia cardiaca, asistencia mecánica circulatoria y monitorización hemodinámica compleja invasiva y no invasiva (presiones arteriales y pulmonares), monitorización respiratoria (presión de aire positiva continua y presión de aire positiva bifásica) y soporte, así como técnicas de enfriamiento corporal. La unidad debe ser capaz de manejar a pacientes con enfermedad arterial y pulmonar grave. La organización deseable de la unidad coronaria, su estructura y criterios de funcionamiento se han descrito en un artículo con las recomendaciones de la ESC209.
Aspectos logísticos del ingreso hospitalario
| Recomendaciones | Clasea | Nivelb | Referencias |
| Todos los hospitales que participen en la asistencia de pacientes con IAMCEST deben tener una unidad coronaria equipada para poder ofrecer todos los aspectos de la atención de los pacientes con IAMCEST, incluido el tratamiento de la isquemia, insuficiencia cardiaca grave, arritmias y comorbilidades habituales | I | C | – |
| Duración del ingreso en la unidad coronaria | |||
| Los pacientes que se sometan a una terapia de reperfusión efectiva y que no hayan presentado complicaciones, deben mantenerse en la unidad coronaria durante un mínimo de 24 h, y posteriormente pueden ser trasladados a una cama monitorizada durante 24-48 h adicionales | I | C | – |
| Traslado de vuelta al hospital inicial sin capacidad para realizar ICP | |||
| En pacientes seleccionados de bajo riesgo se puede considerar un traslado precoz (durante el mismo día) después de una angioplastia primaria efectiva sin arritmias | IIb | C | – |
| Alta | |||
| El alta precoz (después de 72 h aproximadamente) es razonable en pacientes seleccionados de bajo riesgo, cuando se haya organizado una rehabilitación y seguimiento adecuados | IIb | B | 212,215,216 |
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea.
La monitorización ECG de las arritmias y de las desviaciones del segmento ST debe prolongarse, como mínimo, 24 h desde el inicio de los síntomas en todos los pacientes con IAMCEST. La monitorización posterior de las arritmias depende del riesgo percibido y del equipo disponible. Cuando el paciente abandona la unidad coronaria se debe proseguir la monitorización por telemetría.
MovilizaciónLos pacientes con afectación significativa del VI deben permanecer acostados inicialmente antes de que se pueda realizar la primera evaluación de la extensión y gravedad del infarto para detectar insuficiencia cardiaca precoz y arritmias. En los casos no complicados, el paciente puede incorporarse durante el primer día, usar una cuña, realizar cuidados propios y comer por sí mismo. La movilización del paciente suele iniciarse pronto (sobre todo en los pacientes tratados mediante acceso radial). Los pacientes que han experimentado complicaciones deben permanecer en la cama más tiempo, y reiniciar su actividad física dependiendo de la sintomatología y el daño miocárdico.
Duración del ingresoLa duración optima del ingreso en la unidad coronaria y en el hospital debe establecerse en cada caso particular, considerando la situación médica y social del paciente y el estado premórbido de su salud. A lo largo de los años se ha producido una reducción progresiva de la duración del ingreso después de un infarto de miocardio —sobre todo después de la angioplastia primaria efectiva— sin que haya aumentado la mortalidad subsiguiente, lo que sugiere que el alta temprana no se asocia a una mortalidad tardía210,211. Además, el estudio PAMI-II ha demostrado que a los pacientes de bajo riesgo y angioplastia primaria efectiva se les puede dar el alta de forma segura en el día 3 sin realizar pruebas no invasivas212. En conjunto, el alta precoz de pacientes de bajo riesgo (dentro de las primeras 72 h) es factible y segura en pacientes con IAMCEST no complicado y angioplastia primaria efectiva211–213. Para la identificación de estos pacientes de bajo riesgo pueden ser útiles algunos esquemas, como los criterios del PAMI-II o el índice Zwolle de angioplastia primaria212,213. Los criterios del PAMI-II designan como paciente de bajo riesgo a un paciente < 70 años de edad, con fracción de eyección > 45%, enfermedad de 1 o 2 vasos, angioplastia primaria efectiva y ausencia de arritmias persistentes. No obstante, un ingreso hospitalario corto implica poco tiempo para instruir adecuadamente al paciente y aumentar las dosis de los tratamientos de prevención secundaria. Por lo tanto se debe ofrecer a estos pacientes la posibilidad de acudir a la consulta de un cardiólogo o un médico de atención primaria después del alta, y la opción de realizar un programa formal de rehabilitación, ya sea en el hospital o de forma ambulatoria.
La práctica actual incluye también la posibilidad de traslado precoz a un hospital local después de una angioplastia primaria efectiva. En pacientes seleccionados de bajo riesgo —identificados como asintomáticos sin arritmias, hemodinámicamente estables, que no requieren soporte vasoactivo o mecánico y que no están programados para revascularización posterior— se considera seguro y factible realizar un traslado precoz (el mismo día) bajo monitorización y supervisión214.
Evaluación del riesgo y tests de imagenIndicaciones y momento adecuado (tabla 21)Después del tratamiento de reperfusión es importante identificar a los pacientes con riesgo elevado de episodios futuros, como reinfarto o muerte, y tratar de intervenir para prevenir estos episodios. Debido a que el riesgo de episodios futuros se reduce con el tiempo, está indicado hacer una evaluación precoz del riesgo. Se debe evaluar el tamaño de infarto y la función VI en reposo (normalmente por ecocardiografía) antes del alta. El momento adecuado para realizar otras evaluaciones dependerá de las instalaciones locales y de si la angiografía y la angioplastia se han realizado con éxito. Con el aumento de la práctica de la angioplastia primaria, la evaluación del riesgo de isquemia antes del alta se ha vuelto menos importante, ya que se puede asumir que la lesión coronaria responsable del infarto se ha tratado y estabilizado y que se ha valorado la presencia o ausencia de lesiones significativas en otras arterias. Se han desarrollado diversos índices de valoración del riesgo basándose en parámetros que sean fácilmente identificables en la fase aguda antes de la reperfusión217–219. Algunos indicadores clínicos de riesgo elevado en la fase aguda son: edad avanzada, frecuencia cardiaca elevada, hipotensión, clase Killip > I, infarto anterior, infarto previo, creatinina sérica inicial elevada e historia de insuficiencia cardiaca. Las arritmias malignas, el dolor torácico persistente y la angina precoz durante una actividad física menor también se han asociado a un peor resultado clínico.
Resumen de las indicaciones para las pruebas de imagen y estrés
| Recomendaciones | Clasea | Nivelb | Referencias |
| En el momento de presentarse en el hospital | |||
| En la fase aguda, cuando el diagnóstico sea dudoso, puede ser útil la ecocardiografía de urgencia. No obstante, si el diagnóstico sigue siendo no concluyente y persiste la duda, se debe considerar una angiografía de urgencia | I | C | – |
| Después de la fase aguda | |||
| Todos los pacientes deben tener una ecocardiografía para la evaluación del tamaño del infarto y la función ventricular izquierda en reposo | I | B | 220,221 |
| Si la ecocardiografía no es factible se puede usar imagen por resonancia magnética como alternativa | IIb | C | – |
| Antes o después del alta | |||
| En pacientes con enfermedad multivaso, o en aquellos en los que se considere revascularización de otros vasos, están indicadas las pruebas de estrés o de imagen para la isquemia y viabilidad (p. ej., escintrigrafía de estrés de perfusión miocárdica, ecocardiografía de estrés, tomografía por emisión de positrones o imagen por resonancia magnética) | I | A | 4,220,222 |
| La angiografía por tomografía computarizada no tiene ningún papel en el manejo de rutina de los pacientes con IAMCEST | III | C | – |
Ecocardiografía: ecocardiografía transtorácica o transesofágica, según sea necesario; IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
Cuando, a pesar de haber realizado una angiografía en la fase aguda, haya sospecha de isquemia inducible es adecuado realizar una prueba de esfuerzo ambulatoria o un test de estrés con imagen (mediante escintigrafía, ecocardiografía o resonancia magnética) dentro de las primeras 4-6 semanas (tabla 9). Por su alta disponibilidad y bajo coste, habitualmente se utiliza una prueba de esfuerzo con ECG. No obstante, en pacientes con infarto de miocardio previo, su
precisión es limitada. Los tests de estrés con imagen son más precisos y permiten la localización de la isquemia. Los tests mejor validados son la escintigrafía de perfusión y la ecocardiografía de estrés. En pacientes que han tenido un infarto de miocardio previo, la detección de la isquemia residual es complicada, debido a la existencia de anomalías en la motilidad de la pared. La angiografía por tomografía computarizada es una técnica sensible para detectar lesiones pero, como se trata de una prueba anatómica, no valora la isquemia, que es fundamental a la hora de tomar decisiones terapéuticas. Si el problema principal es la arritmia, puede ser necesario realizar pruebas electrofisiológicas adicionales antes del alta y repetir la evaluación de la fracción de eyección después del alta, con el objeto de seleccionar candidatos para implantar un cardioversor-desfibrilador para prevención primaria (v. más adelante).
Todos los pacientes deben tener analizados sus marcadores metabólicos de riesgo durante el ingreso, incluidos colesterol total, colesterol unido a lipoproteínas de baja densidad (LDL), colesterol unido a lipoproteínas de alta densidad, triglicéridos en ayunas y glucosa plasmática, así como la función renal. Debido a que la concentración de LDL tiende a disminuir durante los primeros días después de un infarto de miocardio, es mejor analizarla lo antes posible después del ingreso.
Valoración de la viabilidad miocárdicaLa disfunción VI después de un IAM puede deberse a necrosis, aturdimiento del miocardio viable que permanece en el territorio infartado, hibernación del miocardio viable o una combinación de los 3 factores. El aturdimiento simple debe recuperarse en 2 semanas después del episodio isquémico agudo si la isquemia no es persistente, pero en caso de que lo sea, el aturdimiento recurrente puede convertirse en hibernación y requerir revascularización para la recuperación de la función. Estos conceptos tienen una gran relevancia en pacientes con función ventricular altamente deprimida después de un infarto cuando se considera la necesidad de revascularizar para mejorar su función (p. ej., después de una fibrinolisis efectiva).
Muchas técnicas de imagen —como la PET, la tomografía computarizada por emisión de fotón único y la ecocardiografía de estrés con dobutamina— se han evaluado ampliamente para la valoración de la viabilidad y la predicción del resultado clínico después de la revascularización miocárdica. En general, las técnicas de imagen nuclear tienen una alta sensibilidad, mientras que las técnicas que evalúan la reserva contráctil tienen algo menos de sensibilidad, pero una especificidad más alta. La imagen por resonancia magnética tiene una elevada precisión diagnóstica para evaluar la extensión transmural del tejido miocárdico cicatricial, pero su capacidad para detectar miocardio viable y predecir la recuperación de la motilidad de la pared no es superior a la de otras técnicas de imagen223. Las diferencias en la realización de las diversas técnicas de imagen son pequeñas y la experiencia y disponibilidad suelen ser los factores determinantes para su elección. Las evidencias actuales se basan fundamentalmente en estudios observacionales o metaanálisis, con la excepción de 2 estudios clínicos aleatorizados, ambos relacionados con la imagen por PET222. Los pacientes con una proporción importante de miocardio disfuncional, pero viable, tienen una probabilidad mayor de beneficiarse de la revascularización miocárdica, y pueden mostrar mejorías en la función contráctil regional y global, síntomas, tolerancia al ejercicio y pronóstico a largo plazo220.
Tratamientos a largo plazo para el infarto de miocardio con elevación del segmento STLa cardiopatía isquémica es una enfermedad crónica y los pacientes que se han recuperado de un IAMCEST tienen un riesgo elevado de presentar nuevos episodios y muerte prematura. De hecho, en las cohortes de seguimiento a largo plazo, la mayor parte de las muertes que se producen entre los pacientes con IAMCEST tiene lugar después del alta14. Varias intervenciones basadas en la evidencia pueden mejorar el pronóstico. Aunque el manejo a largo plazo de este gran grupo de pacientes será responsabilidad del médico de cabecera, estas intervenciones van a tener mayor probabilidad de llevarse a cabo si se inician durante el ingreso hospitalario. Además, los cambios en el estilo de vida se deben explicar y proponer a los pacientes antes del alta. Hay que tener en cuenta que no es fácil cambiar los hábitos que se han adquirido a lo largo de la vida y la implementación de estos cambios, así como su seguimiento, deben practicarse a largo plazo. En este sentido, la colaboración estrecha entre el cardiólogo y el médico de cabecera es un aspecto crítico. Con unos ingresos hospitalarios cada vez más cortos en los pacientes con IAMCEST ha dejado de haber una distinción clara entre los tratamientos agudos y crónicos. Este capítulo resume tanto las intervenciones sobre el estilo de vida como los tratamientos farmacológicos que deben considerarse y utilizarse antes del alta (tabla 22).
Tratamientos de rutina en las fases aguda, subaguda y a largo plazo del infarto de miocardio con elevación del segmento ST
| Recomendaciones | Clasea | Nivelb | Referencias |
| Los fumadores activos con IAMCEST deben recibir asesoramiento y derivarse a un programa para dejar de fumar | I | B | 225 |
| Todos los hospitales que participen en la atención de pacientes con IAMCEST deben tener un protocolo para dejar de fumar | I | C | – |
| Se recomienda una rehabilitación basada en el ejercicio | I | B | 232,233 |
| Está indicado el tratamiento antiplaquetario indefinido con dosis bajas de aspirina (75-100 mg) en todos los pacientes con IAMCEST | I | A | 237 |
| En pacientes intolerantes a la aspirina, el clopidogrel está indicado como alternativa | I | B | 243 |
| Se recomienda la doble antiagregación plaquetaria con una combinación de aspirina y prasugrel o aspirina y ticagrelor (más que aspirina y clopidogrel) en pacientes tratados con ICP | I | A | 109,110 |
| La doble antiagregación plaquetaria con aspirina y un inhibidor oral del receptor de ADP debe prolongarse hasta 12 meses después del IAMCEST, con un mínimo estricto de: | I | C | 245–247,283 |
| • 1 mes para pacientes portadores de un stent convencional | I | C | |
| • 6 meses para pacientes portadores de un stent farmacoactivo | IIb | B | |
| En pacientes con un trombo ventricular izquierdo se debe usar anticoagulación durante un mínimo de 3 meses | IIa | B | 344–346 |
| En pacientes con una indicación clara de anticoagulación oral (p. ej., fibrilación auricular con puntuación CHA2DS2-VASc ≥ 2 o válvula mecánica protésica) se debe utilizar anticoagulación oral además del tratamiento antiplaquetario | I | C | – |
| Cuando los pacientes necesiten tratamiento antitrombótico triple con combinación de doble antiagregación plaquetaria y anticoagulación oral (p. ej., debido a la colocación de un stent e indicación obligatoria de anticoagulación oral), la duración de la doble antiagregación plaquetaria debe minimizarse para reducir el riesgo de hemorragia | I | C | – |
| En pacientes seleccionados que toman aspirina y clopidogrel se puede considerar el uso de rivaroxabán a dosis bajas (2,5mg, 2 veces al día) si el riesgo de hemorragia es bajo | IIb | B | 262 |
| La doble antiagregación plaquetaria se debe usar durante 1 año en pacientes con IAMCEST que no han recibido un stent | IIa | C | – |
| Se debe considerar la protección gástrica con un inhibidor de la bomba de protones a lo largo de todo el tratamiento con doble antiagregación plaquetaria en pacientes con alto riesgo de hemorragia | IIa | C | 256 |
| Se debe considerar el tratamiento oral con bloqueadores beta durante la hospitalización y proseguir el tratamiento posteriormente en todos los pacientes con IAMCEST que no tengan contraindicaciones | IIa | B | 1,266 |
| Está indicado el tratamiento oral con bloqueadores beta en pacientes con insuficiencia cardiaca o disfunción ventricular izquierda | I | A | 284–288 |
| Se debe evitar el uso de bloqueadores beta i.v. en pacientes con hipotensión o insuficiencia cardiaca | III | B | 266 |
| Se debe considerar el uso de bloqueadores beta i.v. en el momento de presentarse en el hospital en pacientes sin contraindicaciones, con presión arterial elevada, taquicardia y ausencia de signos de insuficiencia cardiaca | IIa | B | 266 |
| Se debe obtener el perfil lipídico en ayunas en todos los pacientes con IAMCEST lo antes posible después de presentarse al hospital | I | C | – |
| Está recomendado iniciar o continuar el tratamiento con estatinas a dosis altas de forma precoz después del ingreso en todos los pacientes con IAMCEST sin contraindicaciones ni historia de intolerancia, independientemente de los valores iniciales de colesterol | I | A | 267 |
| Se debe considerar la revaluación del colesterol unido a LDL después de 4-6 semanas, para asegurarse de que se ha alcanzado el valor diana de ≤ 1,8 mmol/l (70 mg/dl) | IIa | C | 270 |
| Se puede considerar el verapamilo para la prevención secundaria en pacientes con contraindicaciones absolutas a los bloqueadores beta y que no tengan insuficiencia cardiaca | IIb | B | 276 |
| Está indicada la administración de IECA desde las primeras 24 h de IAMCEST en pacientes con evidencia de insuficiencia cardiaca, disfunción sistólica ventricular izquierda, diabetes o infarto anterior | I | B | 280,281 |
| La administración de un ARA, preferiblemente valsartán, es una alternativa a los IECA en pacientes con insuficiencia cardiaca o disfunción sistólica ventricular izquierda, sobre todo en los que son intolerantes a los IECA | IIa | B | 289,290 |
| Los antagonistas de la aldosterona (p. ej., la eplerenona) están indicados en pacientes con una fracción de eyección ≤ 40% e insuficiencia cardiaca o diabetes, siempre que no haya insuficiencia renal o hiperpotasemia | I | B | 282 |
ADP: adenosina difosfato; ARA: antagonista del receptor de angiotensina; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble), enfermedad vascular, edad de 65-74 años y categoría de sexo (mujeres); IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IECA: inhibidor de la enzima de conversión de la angiotensina; i.v.: intravenoso; LDL: lipoproteínas de baja densidad.
Algunas intervenciones clave sobre el estilo de vida son el abandono del hábito tabáquico, el control estricto de la presión arterial, los consejos sobre la dieta y sobre el control del peso corporal, y animar a practicar actividad física. Las recomendaciones detalladas se encuentran disponibles en las guías de la ESC sobre prevención224. A pesar de que el manejo a largo plazo de este gran grupo de pacientes será responsabilidad del médico de cabecera, estas intervenciones tendrán una mayor probabilidad de ponerse en práctica si se inician durante el ingreso hospitalario. Además, los beneficios y la importancia de los cambios en el estilo de vida se deben explicar y proponer al paciente —que es la pieza clave del éxito de esta estrategia— antes del alta. Sin embargo hay que tener en cuenta que los hábitos de vida no son fáciles de cambiar, y que la puesta en práctica y seguimiento de estos cambios se deben llevar a cabo a largo plazo. Por todo ello, es fundamental que haya una colaboración estrecha entre el cardiólogo y el médico de cabecera, personal de enfermería especializado en rehabilitación, farmacéuticos, dietistas y fisioterapeutas.
Abandono del hábito tabáquicoLos pacientes con SCA no seleccionados que son fumadores tienen el doble de probabilidad de desarrollar un IAMCEST que los no fumadores, lo que sugiere que el tabaco tiene un efecto protrombótico importante. Los estudios observacionales demuestran que los pacientes que dejan de fumar reducen su mortalidad en los años siguientes en relación con los que continúan fumando. Dejar de fumar es la medida potencialmente más efectiva de todas las estrategias de prevención secundaria225 y es preciso dedicar un gran esfuerzo para conseguir este objetivo. Los pacientes no fuman durante la fase aguda del IAMCEST y el periodo de convalecencia es ideal para que los profesionales de la salud ayuden a los fumadores a abandonar el hábito. No obstante, la reanudación del tabaquismo es habitual después del alta por lo que es necesario ofrecer apoyo y consejos continuos durante la rehabilitación. Puede ser de ayuda el uso de parches de nicotina, buproprión y antidepresivos. Los parches de nicotina han demostrado ser seguros en pacientes con SCA226. Un estudio aleatorizado también ha demostrado la efectividad de los programas dirigidos por personal de enfermería227. Cada hospital debe adoptar un protocolo para dejar de fumar.
Dieta y control del pesoLas guías actuales sobre prevención recomiendan224: a) ingerir una gran variedad de alimentos; b) ajustar el aporte calórico para evitar la obesidad; c) aumentar el consumo de frutas y verduras, así como de cereales integrales y pan, pescado (especialmente pescado azul), carne magra y productos lácteos desnatados; d) sustituir las grasas saturadas y de tipo trans por grasas mono o poliinsaturadas de origen vegetal y marino, y reducir las grasas totales (de las cuales menos de un tercio deben ser saturadas) a < 30% del total de la ingesta calórica, y e) reducir el consumo de sal si la presión arterial está elevada. Muchos alimentos procesados y preparados contienen mucha sal y grasas de calidad dudosa. No hay evidencias sobre el uso de suplementos antioxidantes, dietas de bajo índice glucémico o tratamientos de reducción de homocisteína después de un IAMCEST.
La obesidad es un problema creciente en pacientes con IAMCEST. Las guías actuales definen como óptimo un índice de masa corporal (IMC) < 25 kg/m2 y recomiendan una reducción del peso cuando el IMC ≥ 30 kg/m2 y cuando el perímetro abdominal es > 102cm en los varones o > 88cm en las mujeres, porque la pérdida de peso puede mejorar muchos factores de riesgo relacionados con la obesidad. No obstante, no se ha establecido que la reducción del peso per se reduzca la mortalidad.
Actividad físicaEl ejercicio se ha utilizado durante mucho tiempo como tratamiento de rehabilitación después de un IAMCEST, y el beneficio de la práctica regular de ejercicio físico en los pacientes con EC estable también está bien establecido. El ejercicio físico reduce la ansiedad asociada a una enfermedad que pone en riesgo la vida y mejora la autoconfianza del paciente. Hay 4 mecanismos responsables que se consideran mediadores importantes en la reducción de los episodios cardiacos: a) mejoría de la función endotelial; b) reducción de la progresión de las lesiones coronarias; c) reducción del riesgo trombogénico, y d) mejoría de la colateralización. En un gran metaanálisis, el entrenamiento físico, como parte de los programas de rehabilitación coronaria, se asoció a una reducción del 26% en la tasa de mortalidad cardiaca en pacientes con EC228. Es importante señalar que, aparte de su influencia sobre la mortalidad, la rehabilitación física puede tener otros efectos beneficiosos. La resistencia, la forma física y cardiorrespiratoria, y la percepción de bienestar también han demostrado mejorar, al menos durante el periodo de entrenamiento, incluso en pacientes ancianos. Se recomienda realizar 30min de ejercicio aeróbico de intensidad moderada, por lo menos 5 veces por semana224. Cada fase de aumento en la capacidad máxima de ejercicio se asocia a una reducción del riesgo de mortalidad por cualquier causa en el rango del 8-14%229.
Control de la presión arterialEn pacientes hipertensos con IAMCEST se debe controlar la presión arterial. Los resultados de un análisis retrospectivo del estudio PROVE IT -TIMI 22 (Pravastatin Or atorVastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction 22) sugieren que, después de un SCA, el objetivo de presión arterial que se debe alcanzar para la presión arterial sistólica (PAS) es < 140mmHg pero no < 110 mmHg230. La farmacoterapia (bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina [IECA] o antagonistas del receptor de angiotensina [ARA]) que se recomienda después de un IAMCEST, además de los cambios en el estilo de vida (reducción de la ingesta de sal, aumento de la actividad física y pérdida de peso), suele ayudar a alcanzar estos objetivos. Puede ser necesario utilizar un tratamiento farmacológico adicional.
Intervenciones sobre los factores psicosocialesHay evidencias que indican que el manejo del estrés es útil en este contexto: en un estudio clínico reciente, 362 pacientes de 75 años de edad o más jóvenes, con IAM, angioplastia o cirugía coronaria en los últimos 12 meses, se aleatorizaron a recibir una atención tradicional o una atención tradicional junto con un programa de terapia cognitivoconductual centrada en el manejo del estrés. Durante una media de 94 meses de seguimiento, el grupo que recibió la intervención presentó un 41% menos de primeros episodios cardiovasculares recurrentes, fatales y no fatales (un 45% menos de IAM), y un 28% menos, que no fue significativo, de mortalidad de cualquier causa, que el grupo de referencia, después de ajustar por otras variables que afectaban al resultado clínico. También se produjo un fuerte efecto dosisrespuesta entre el grado de asistencia a la terapia en el grupo que recibió las sesiones y los resultados clínicos231.
Programa de rehabilitación basado en el ejercicioLa rehabilitación basada en el ejercicio ha demostrado ser efectiva para reducir la mortalidad de cualquier causa y el riesgo de reinfarto, así como para mejorar los factores de riesgo, la resistencia física y la calidad de vida después de un infarto de miocardio232,233. Algunos de estos beneficios se establecieron en la era previa al tratamiento moderno del IAMCEST, y un estudio británico reciente aleatorizado no ha podido demostrar que se produzcan beneficios asociados a un programa de rehabilitación sobre los resultados clínicos o la calidad de vida234. En otro estudio aleatorizado de mayor tamaño, una intervención a largo plazo multifactorial, educacional y conductual ha demostrado ser factible y sostenible durante un largo periodo después del infarto de miocardio y ha sido capaz de reducir algunos episodios clínicos —sobre todo reinfarto—, así como el riesgo cardiovascular global235. Un beneficio adicional de los programas de rehabilitación es que ayudan a asegurar una correcta titulación y monitorización de tratamientos clave basados en la evidencia en el manejo del IAMCEST. Actualmente, en los casos de pacientes con un curso clínico no complicado, la rehabilitación se puede realizar de forma ambulatoria con una eficacia similar a la que se obtiene en centros especializados de rehabilitación cardiaca236.
Reanudación de las actividadesNo se pueden dar recomendaciones generalizadas sobre el tiempo que debe transcurrir para reiniciar las actividades diarias. Las decisiones se deben tomar de forma individualizada, basándose en la función VI, el grado en el que se ha completado la revascularización y el control del ritmo cardiaco. Una baja prolongada por enfermedad suele ser negativa y se debe animar a practicar actividad física de ligera a moderada después del alta. La actividad sexual puede restablecerse pronto si se ajusta a la capacidad física. Se deben evitar los viajes largos en avión durante 4-6 semanas si hay isquemia residual o disfunción VI.
Tratamiento antitrombóticoAspirinaTeniendo en cuenta los bien establecidos beneficios que tiene en la prevención secundaria237, se debe usar aspirina de forma indefinida en todos los pacientes con IAMCEST. Las dosis de aspirina que deben emplearse es un tema debatido. En los primeros días de tratamiento, el gran estudio clínico aleatorizado CURRENT/OASIS 7 no ha podido demostrar una diferencia en las principales variables clínicas cuando se compararon dosis bajas de aspirina (75-100 mg/día) con dosis relativamente altas de 300-325 mg/día115. Sí que hubo una menor tasa de hemorragias gastrointestinales con las dosis bajas. Para el tratamiento a largo plazo se suelen utilizar las dosis bajas (70-100 mg). Los datos sobre agregación plaquetaria sugieren que la renovación rápida de plaquetas en pacientes diabéticos puede hacer necesario utilizar dosis de aspirina más altas o administraciones más frecuentes para conseguir la inhibición plaquetaria238,239, aunque no hay pruebas clínicas sobre el beneficio de esta estrategia. Los pacientes con historia de hipersensibilidad a la aspirina pueden someterse a una desensibilización y continuar el tratamiento de forma indefinida240–242. Los pacientes que son verdaderamente intolerantes a la aspirina, en su lugar pueden recibir clopidogrel (75 mg/día) como prevención secundaria a largo plazo243.
Duración de la doble antiagregación plaquetaria y de los tratamientos antitrombóticos combinados después de un infarto agudo de miocardio con elevación del segmento STSe recomienda el tratamiento de doble antiagregación plaquetaria, que combina aspirina y un inhibidor del receptor de ADP (clopidogrel, prasugrel o ticagrelor), en pacientes con IAMCEST que se sometan a angioplastia primaria (hasta 12 meses), fibrinolisis (hasta 12 meses, aunque los datos disponibles corresponden sólo a1 mes de doble antiagregación plaquetaria) y en pacientes que no hayan recibido tratamiento de reperfusión (durante, por los menos, 1 mes y hasta 12 meses). La elección del fármaco inhibidor del receptor de ADP se ha discutido anteriormente. Aunque no hay datos procedentes de estudios clínicos que apoyen el uso de la doble antiagregación plaquetaria durante periodos prolongados, el tratamiento durante 12 meses después de colocar un stent y durante 9-12 meses después de un IAMCEST se ha recomendado tradicionalmente por consenso antes de que se publicaran las guías, independientemente del tipo de stent utilizado (convencional o SFA)1,4,244. Algunos estudios han sugerido que no hay beneficio en los tratamientos de doble antiagregación plaquetaria que duran más de 6 o 12 meses después de implantar un stent farmacoactivo en la prevención de episodios isquémicos y trombosis intrastent245–247, pero estos estudios, incluso cuando se agrupan, incluyen un número relativamente bajo de pacientes con IAMCEST. Algunos estudios clínicos de gran tamaño que se encuentran actualmente en marcha, incluido el estudio Dual Antiplatelet Therapy248, estudian si la duración prolongada del tratamiento de doble antiagregación plaquetaria después de un stent tiene beneficios clínicos. Está claro que después de implantar un stent en un SCA, sobre todo en el IAMCEST, el tratamiento prolongado con doble antiagregación plaquetaria reduce el riesgo de trombosis intra-stent, reinfarto y mortalidad cardiovascular249, y la doble antiagregación plaquetaria más potente se asocia a mayores beneficios clínicos post-SCA de cualquier tipo109,110,188. A la espera de tener los resultados clínicos de los estudios en curso se recomienda un tratamiento de doble antiagregación plaquetaria de 9-12 meses de duración, con un mínimo estricto de 1 mes en pacientes portadores de un stent convencional y 6 meses para aquellos con SFA. Es importante informar a los pacientes y a sus médicos de la necesidad de evitar la interrupción prematura de la doble antiagregación plaquetaria.
En pacientes con IAMCEST y FA que tengan necesidad de anticoagulación permanente después de la angioplastia primaria (según una puntuación de riesgo ≥ 2 de acuerdo con los índices CHADS2 (por las siglas en inglés de insuficiencia cardiaca congestiva, hipertensión, edad, diabetes, ictus [doble]) o CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 [doble], diabetes, ictus [doble], enfermedad vascular, edad de 65-74 años y categoría de sexo [mujeres])250,251, se recomienda «el tratamiento triple», que combina aspirina, un inhibidor del receptor de ADP y un anticoagulante, para reducir la carga de complicaciones tromboembólicas asociadas a la FA y minimizar el riesgo de trombosis intra-stent4. Sin embargo, este tratamiento también se asocia a un aumento de las complicaciones hemorrágicas y, por lo tanto, su duración debe ser lo más corta posible252,253. En general se trata de un área que genera controversia, porque no hay suficientes evidencias y diversos documentos de consenso han intentado ofrecer algoritmos para orientar en la toma de decisiones253–255. Además, en pacientes con IAMCEST que tienen indicación de anticoagulación, en los que se precisa colocar un stent, la elección deun stent convencional en lugar de un SFA parece minimizar la duración del tratamiento triple y, por lo tanto, el riesgo de hemorragia. Estos beneficios deben sopesarse frente los beneficios de los SFA para prevenir las reestenosis4,253
Se debe considerar la utilización de protectores gástricos, preferiblemente inhibidores de la bomba de protones, en pacientes con historia de hemorragia gastrointestinal y en pacientes con múltiples factores de riesgo de hemorragia, como la edad avanzada, uso concomitante de anticoagulantes, fármacos antiinflamatorios esteroideos o no esteroideos, incluida la aspirina a altas dosis, y la infección por Helicobacter pylori256. No hay interacción farmacocinética entre los inhibidores de la bomba de protones y los nuevos y potentes inhibidores del receptor P2Y12, ni tampoco hay evidencias claras de que la interacción farmacocinética entre el clopidogrel con algunos inhibidores de la bomba de protones tenga consecuencias clínicas significativa257–261. En cualquier caso, los beneficios de evitar o minimizar la hemorragia en pacientes de alto riesgo superan los problemas derivados de esta interacción farmacocinética.
El reciente estudio clínico ATLAS ACS 2 -TIMI 51ha probado el efecto de la adición de rivaroxabán, un antagonista del factor Xa, a la aspina y clopidogrel después de un SCA262. En este estudio, una dosis baja de rivaroxabán (2.5mg dos veces al día) redujo la variable principal combinada de muerte cardiovascular, infarto de miocardio y accidente cerebrovascular, y también la mortalidad de cualquier causa. Es interesante señalar que la trombosis intra-stent se redujo en un tercio. Este efecto se asoció a un aumento de tres veces en la tasa de hemorragias mayores no relacionadas con la cirugía coronaria y hemorragias intracraneales. Cabe destacar que la dosis alta de rivaroxabán (5mg dos veces al día) no estuvo asociada a estos beneficios, aunque sí a un aumento importante en el riesgo de hemorragia.
El estudio ATLAS ACS 2-TIMI 51 no ha probado la combinación de rivaroxabán con prasugrel o ticagrelor, que puede asociarse a un riesgo de hemorragia aún mayor. Este estudio sugiere que, en pacientes seleccionados que tengan bajo riesgo hemorrágico, puede considerarse la administración de una dosis de 2,5mg de rivaroxabán junto con aspirina y clopidogrel después de un IAMCEST. Sin embargo, un estudio clínico en fase III sobre otro antagonista del factor Xa (el apixabán), el estudio APPRAISE-2263, no ha podido encontrar beneficios similares como resultado de añadir una dosis alta de apixabán a la antiagregación plaquetaria simple o doble en una población de pacientes con SCA de muy alto riesgo. Por último, el darexabán y el dabigatrán se han evaluado en estudios de dosis en fase II en pacientes post-SCA264,265 y, en ambos casos, se ha observado un aumento de las hemorragias mayores dependiente de la dosis sin que aumentara la eficacia como consecuencia de añadir un tratamiento anticoagulante al tratamiento antiplaquetario. En conclusión, sigue siendo discutible el papel de los nuevos anticoagulantes en combinación con la doble antiagregación plaquetaria en la prevención secundaria de los pacientes con IAMCEST. Es intrigante el beneficio sustancial observado sobre la mortalidad con una dosis baja de rivaroxabán en combinación con la aspirina y el clopidogrel, pero la interpretación de la totalidad de la evidencia para esta clase de fármacos es difícil.
Bloqueadores betaEl beneficio del tratamiento a largo plazo con bloqueadores beta tras un IAMCEST está bien establecido, aunque la mayor parte de los datos proceden de estudios previos a la era moderna del tratamiento de reperfusión y la farmacoterapia. Sin embargo, las evidencias sobre el papel de la administración i.v. precoz de rutina son menos firmes. La administración oral de bloqueadores beta parece ser beneficiosa, pero la administración precoz de una dosis i.v. elevada se ha asociado a un riesgo temprano de aumento en la mortalidad en el gran estudio clínico COMMIT266. Por lo tanto, el uso precoz de bloqueadores beta i.v. está contraindicado en pacientes con signos clínicos de hipotensión o insuficiencia cardiaca congestiva. El uso precoz puede asociarse a un beneficio modesto en pacientes de bajo riesgo que están hemodinámicamente estables. Sin embargo, en la mayoría de los casos es prudente esperar a que el paciente se estabilice antes de iniciar un tratamiento con bloqueadores beta y administrarlos por vía oral en lugar de i.v. En los estudios contemporáneos que utilizan angioplastia primaria, los bloqueadores beta todavía no se han investigado; aunque parece razonable extrapolar sus beneficios a este contexto.
Tratamiento hipolipemianteLos beneficios de las estatinas en la prevención secundaria se han demostrado de forma inequívoca267; varios estudios clínicos específicos han establecido el beneficio de iniciar un tratamiento con estatinas de forma precoz e intensiva268,269. Un metaanálisis reciente de varios estudios que comparaban una estrategia intensiva de reducción de colesterol unido a LDL con estatinas frente a una estrategia menos intensiva, ha indicado que el régimen intensivo producía una mayor reducción en el riesgo de muerte cardiovascular, infarto de miocardio no fatal, accidente cerebrovascular y revascularización coronaria, comparado con el régimen menos intensivo. Por cada reducción de 1,0 mmol/l en el colesterol unido a LDL, las reducciones adicionales en el riesgo fueron similares a las reducciones proporcionales de los estudios clínicos de estatinas frente a control. Por lo tanto, las estatinas deben administrarse a todos los pacientes con IAM, independientemente de la concentración de colesterol. Este tratamiento debe iniciarse de forma precoz durante el ingreso, ya que así se aumenta la adherencia del paciente después del alta, y debe administrarse a altas dosis, ya que esto se asocia a beneficios clínicos precoces y sostenidos270. El objetivo del tratamiento es alcanzar una concentración de LDL < 1,8 mmol/l (< 70 mg/dl)
Se debe considerar un tratamiento con estatinas de menor intensidad en los casos de pacientes con riesgo elevado de desarrollar efectos secundarios (p. ej., ancianos, pacientes con alteraciones hepáticas o renales, con efectos secundarios previos derivados del uso de estatinas o en los que haya riesgo de interacción potencial con otros tratamientos concomitantes esenciales)270. Los lípidos deben revaluarse a las 4-6 semanas después del SCA, para determinar si la concentración diana se ha alcanzado y para valorar aspectos relacionados con su seguridad; las dosis de estatinas pueden ajustarse de acuerdo con los resultados obtenidos en la analítica.
Teniendo en cuenta los resultados de los estudios clínicos con dosis elevadas de atorvastatina y simvastatina, y los riesgos asociados a la simvastatina administrada a altas dosis271, los resultados más sólidos disponibles hasta la fecha procedentes de los estudios clínicos favorecen la administración de atorvastatina a dosis de 80mg diarios, excepto cuando el paciente haya tenido problemas previos de tolerancia a altas dosis de estatinas. En pacientes que se sabe que son intolerantes a cualquier dosis de estatinas se debe considerar el tratamiento con ezetimiba.
En un estudio previo, el consumo de ácidos grasos poliinsaturados n-3 redujo la mortalidad en supervivientes de un infarto de miocardio272, aunque no tuvo efecto sobre los resultados clínicos en 2 estudios más recientes que utilizaban tratamientos de prevención más modernos y basados en la evidencia. Por lo tanto, no puede recomendarse en la práctica de rutina273,274
NitratosEl uso rutinario de nitratos en el IAMCEST ha demostrado no ser útil y, por lo tanto, no está recomendado. Los nitratos i.v. pueden ser útiles durante la fase aguda en pacientes con hipertensión o insuficiencia cardiaca, siempre que no haya hipotensión, infarto del ventrículo derec ho o que no se hayan usado inhibidores de la fosfodiesterasa de tipo 5 en las 48 h previas. En la fase aguda y estable, los nitratos siguen siendo fármacos valiosos para el control de los síntomas anginosos.
Antagonistas del calcioUn metaanálisis de varios estudios clínicos con antagonistas del calcio administrados precozmente en el curso de un IAMCEST ha demostrado una tendencia hacia un efecto perjudicial275. No está justificado el uso de antagonistas del calcio de forma profiláctica en la fase aguda. En la fase crónica, el verapamilo puede ser útil para prevenir el reinfarto y la muerte276,277. Por lo tanto, en pacientes con contraindicaciones para el tratamiento con bloqueadores beta, sobre todo en presencia de una enfermedad respiratoria obstructiva, los antagonistas del calcio son una opción razonable si no hay insuficiencia cardiaca, aunque hay que tener precaución en los pacientes con disfunción VI. Por otra parte, el uso rutinario de dihidropiridinas no ha demostrado tener ningún beneficio después de un IAMCEST y sólo debe prescribirse para indicaciones claras, como la hipertensión o la angina278.
Inhibidores de la enzima de conversión de la angiotensina y antagonistas del receptor de angiotensinaEstá bien establecido que los IECA deb en administrarse a pacientes con fracción de eyección deprimida (< 40%) o a los que han tenido insuficiencia cardiaca en la fase inicial. Una revisión sistemática de los estudios que han utilizado IECA de forma precoz en pacientes con IAMCEST ha indicado que este tratamiento es seguro, bien tolerado y se asocia a una reducción pequeña pero significativa de la mortalidad a los 30 días, produciéndose la mayor parte del beneficio en la primera semana279. Las opiniones siguen siendo divergentes sobre si hay que administrar IECA a todos los pacientes o sólo a los de alto riesgo. Los pacientes que no toleran el tratamiento con IECA deben tomar un ARA280. Se debe considerar el uso de IECA en todos los pacientes con aterosclerosis pero, teniendo en cuenta el efecto relativamente modesto que tienen, su uso a largo plazo no puede considerarse obligatorio en pacientes post-IAMCEST normotensos, sin insuficiencia cardiaca o que no tengan disfunción VI o diabetes. Dos estudios clínicos han evaluado los ARA en el contexto del IAMCEST como alternativa a los IECA. El estudio OPTIMAAL no ha podido demostrar ni la superioridad ni la no inferioridad del losartán (50 mg) cuando se comparó con captopril (50mg 3 veces al día)280. El estudio VALIANT ha comparado el efecto del valsartán solo (160mg dos veces al día), la dosis completa de captopril (50mg 3 veces al día) o ambos (80mg dos veces al día y 50mg 3 veces al día)281. Los resultados indican que la mortalidad fue similar en los 3 grupos, pero la interrupción del tratamiento fue más frecuente en los grupos que recibieron captopril. Por lo tanto, el valsartán, a las dosis usadas en el estudio, representa una alternativa a los IECA en pacientes con signos clínicos de insuficiencia cardiaca o fracción de eyección ≤ 40%, especialmente en los que no toleran los IECA.
Antagonistas de la aldosteronaEl estudio EPHESUS ha aleatorizado a 6.642 pacientes postIAMCEST con disfunción VI (fracción de eyección < 40%) e insuficiencia cardiaca o diabetes, a recibir eplerenona, un antagonista selectivo de la aldosterona, o placebo282. Tras un seguimiento medio de 16 meses hubo una reducción relativa del 15% en la mortalidad total y una reducción del 13% en la variable combinada de muerte y hospitalización por episodios cardiovasculares. La hiperpotasemia importante fue más frecuente en el grupo que recibió eplerenona. Los resultados sugieren que la inhibición de la aldosterona puede considerarse en pacientes con IAMCEST que tengan una fracción de eyección ≤ 40% e insuficiencia cardiaca o diabetes, siempre que la concentración de creatinina sea < 221 mmol/l (2,5 mg/dl) en los varones y < 177 mmol/l (2,0 mg/dl) en las mujeres, y que el potasio sea < 5,0 mEq/l. Es necesario realizar una monitorización de rutina del potasio sérico.
Magnesio, glucosa-insulina-potasio, lidocaínaNo hay beneficios asociados a la administración de rutina de magnesio, glucosa–insulina–potasio o lidocaína en pacientes con IAMCEST.
COMPLICACIONES TRAS UN INFARTO DE MIOCARDIO CON ELEVACIÓN DEL SEGMENTO STTrastornos hemodinámicosInsuficiencia cardiacaEs frecuente que durante las fases aguda y subaguda de un IAMCEST se produzca disfunción miocárdica. Normalmente, la revascularización precoz efectiva de la ARI mediante angioplastia o trombolisis se acompaña de una mejoría rápida de la función ventricular. Sin embargo, si el IAMCEST produce lesión transmural u obstrucción microvascular, sobre todo de la pared anterior, el fallo de bomba con remodelado adverso —y los síntomas y signos clínicos de insuficiencia contráctil— puede complicar la fase aguda y conducir a una insuficiencia cardiaca crónica. La insuficiencia cardiaca también puede ser consecuencia de arritmias sostenidas o complicaciones mecánicas del IAMCEST.
El diagnóstico de insuficiencia cardiaca clínica durante las fases aguda y subaguda de un IAMCEST se basa en síntomas típicos como la disnea, signos como la taquicardia sinusal, la presencia de tercer ruido cardiaco o estertores pulmonares y algunas evidencias objetivas de disfunción cardiaca, como dilatación VI y fracción de eyección reducida. Los péptidos natriuréticos (péptido natriurético B [BNP] y la fracción N-terminal del pro-BNP) aumentan en respuesta al incremento del estrés de la pared miocárdica y han demostrado ser biomarcadores útiles en el manejo de los pacientes con insuficiencia cardiaca crónica. Las evidencias han establecido su papel en el diagnóstico, duración del ingreso, decisiones sobre ingreso/alta e identificación de los pacientes que tienen riesgo de desarrollar episodios clínicos adversos. Las concentraciones normales tienen un valor predictivo negativo fuerte. Su valor en la insuficiencia cardiaca aguda después de un infarto de miocardio está menos establecido, debido a los cambios abruptos en la función VI sistólica y diastólica que se producen después de un infarto de miocardio y la vida media relativamente corta de estos péptidos. Es importante señalar que ciertas condiciones, como la hipertrofia VI, taquicardia, isquemia, disfunción renal, edad avanzada, obesidad y tratamiento, pueden influir sobre su concentración. No hay valores definitivos de corte en su concentración en pacientes con signos y síntomas de insuficiencia cardiaca después de un IAM, y las concentraciones deben interpretarse conjuntamente con el estado clínico general del paciente281.
La disfunción VI es el predictor independiente más fuerte de mortalidad después de un IAMCEST. Los mecanismos responsables de la disfunción VI en la fase aguda incluyen la pérdida y remodelado miocárdicos debidos al infarto, disfunción isquémica (aturdimiento), arritmias auriculares y ventriculares y disfunción valvular (preexistente o nueva). A menudo hay evidencia de disfunción sistólica y diastólica. Es frecuente que las comorbilidades como infección, enfermedad pulmonar, disfunción renal, diabetes o anemia contribuyan al cuadro clínico. El grado de insuficiencia cardiaca tras un infarto de miocardio puede clasificarse de acuerdo con la clase Killip: clase I, ausencia de estertores o tercer ruido cardiaco; clase II, congestión pulmonar con estertores que se extienden < 50% de los campos pulmonares, taquicardia sinusal o tercer ruido cardiaco; clase III, edema pulmonar con estertores que se extienden > 50% de los campos pulmonares, y clase IV, shock cardiogénico.
La evaluación hemodinámica se debe basar en una exploración física exhaustiva, ECG continuo por telemetría del corazón y del ritmo, saturación de oxígeno, monitorización de la presión arterial y de la diuresis en cada hora. Los pacientes con sospecha de insuficiencia cardiaca deben evaluarse de forma precoz por ecocardiografía transtorácica/Doppler. La ecocardiografía es la herramienta diagnóstica clave y debe realizarse para valorar la función VI y volúmenes, función valvular, extensión del daño miocárdico y detección de complicaciones mecánicas. La evaluación por Doppler permite evaluar el flujo, los gradientes, la función diastólica y las presiones de llenado. La radiografía torácica permite valorar la extensión de la congestión pulmonar y detectar otras patologías importantes, como infección pulmonar, enfermedad pulmonar crónica y derrame pleural.
Si se produce un deterioro inesperado del estado clínico del paciente, con evidencia de compromiso hemodinámico, se debe iniciar una revaluación y repetir el examen ecocardiográfico, para buscar específicamente evidencias de una disfunción VI progresiva o complicaciones mecánicas.
En pacientes seleccionados que no respondan adecuadamente a las medidas convencionales —y que tengan evidencia de isquemia en curso, elevación persistente del segmento ST o bloqueo de rama izquierda nuevo— se debe considerar la posibilidad de realizar una revascularización posterior.
Los pacientes con daño miocárdico extenso durante la fase aguda pueden desarrollar síntomas y signos de insuficiencia cardiaca crónica. Este diagnóstico requiere un manejo de acuerdo con las guías para el tratamiento de la insuficiencia cardiaca crónica284. Los pacientes seleccionados con insuficiencia cardiaca crónica sintomática y una fracción de eyección reducida o asincronía eléctrica, evidenciada por alargamiento del QRS, pueden satisfacer los criterios para implantación de un cardioversor-desfibrilador, terapia de resincronización cardiaca (TRC) o desfibrilador para TRC. Estos criterios se presentan en una guía reciente centrada en los tratamientos con dispositivos291.
HipotensiónLa hipotensión se define como una PAS persistente de < 90mmHg. Puede deberse a insuficiencia cardiaca, pero también a hipovolemia susceptible de corregirse, trastornos tratables del ritmo cardiaco o complicaciones mecánicas. Cuando es prolongada, la hipotensión puede causar disfunción renal, necrosis tubular aguda y oliguria.
Congestión pulmonarLa congestión pulmonar se caracteriza por disnea con estertores pulmonares basales, saturación arterial de oxígeno reducida, congestión pulmonar en la imagen radiográfica y respuesta clínica al tratamiento diurético o vasodilatador.
Estados de bajo gastoLos estados de bajo gasto combinan signos de perfusión periférica pobre e hipotensión, disfunción renal y baja eliminación de orina. La ecocardiografía puede revelar una función VI deprimida, una complicación mecánica o un infarto ventricular derecho.
Shock cardiogénicoEl shock cardiogénico es una complicación en un 6-10% del total de casos de IAMCEST y sigue siendo la principal causa de muerte, con unas tasas de mortalidad intrahospitalaria próximas al 50%292. Aunque el shock suele aparecer pronto después del inicio del IAM, no acostumbra a diagnosticarse cuando el paciente se presenta al hospital292. Los datos del registro SHOCK293 de pacientes que acaban desarrollando shock durante la hospitalización, indican que éste tiene lugar en las primeras 6 h en un 50% de los casos, aproximadamente, y durante las primeras 24 h en un 75% de los casos. Hay un amplio espectro de síntomas clínicos, signos y hallazgos hemodinámicos que definen la presencia e intensidad del shock cardiogénico y que están relacionados directamente con el resultado clínico a corto plazo294–296. Típicamente, los pacientes presentan hipotensión, evidencia de un gasto cardiaco bajo (taquicardia en reposo, estado mental alterado, oliguria, extremidades frías) y congestión pulmonar. Los criterios hemodinámicos de shock cardiogénico son un índice cardiaco de < 2,2 l/min/m2 y un aumento de la presión capilar pulmonar > 18mmHg. Además, la diuresis suele ser < 20 ml/h. También se considera que hay una situación de shock cuando se necesita administrar inotrópicos i.v. o un BCPA para mantener una PAS > 90mmHg. Suele estar asociado a un daño ventricular izquierdo extenso, pero también puede ocurrir en el infarto ventricular derecho. Tanto la mortalidad a corto plazo como la que se produce a largo plazo parecen estar asociadas a la disfunción sistólica VI inicial y la gravedad de la regurgitación mitral295. La presencia de disfunción ventricular derecha en la ecocardiografía precoz también es un predictor importante de un pronóstico adverso, sobre todo cuando hay disfunción ventricular combinada derecha e izquierda296. El índice de volumen sistólico basal y en el seguimiento, y el índice de trabajo sistólico en el seguimiento son los predictores hemodinámicos más potentes de la mortalidad a los 30 días en pacientes con shock cardiogénico y son más útiles que las variables hemodinámicas tradicionales297. Por lo tanto, no es indispensable realizar una determinación invasiva de la presión de llenado del VI y del gasto cardiaco mediante catéter pulmonar para la caracterización y el manejo del shock cardiogénico, pero la fracción de eyección VI y las complicaciones mecánicas asociadas deben evaluarse con carácter de urgencia mediante ecocardiografía Doppler 2D295–298.
El manejo del shock cardiogénico que complica el curso de un IAM incluye la estabilización hemodinámica, que se consigue con tratamiento médico o soporte circulatorio mecánico, y la revascularización urgente mediante angioplastia o cirugía coronaria. El tratamiento farmacológico del shock cardiogénico que se presenta como consecuencia de un IAMCEST incluye antitrombóticos, fluidos, vasopresores e inotrópicos. Los antitrombóticos deben administrarse de rutina como en los pacientes con IAMCEST, aunque el clopidogrel, prasugrel o ticagrelor deben retrasarse hasta la angiografía, debido a que puede ser necesaria la cirugía coronaria inmediata. La administración de fluidos se suele usar sobre una base fisiopatológica, pero no se ha analizado en estudios clínicos aleatorizados. No obstante, el aporte precoz de fluidos mejora la supervivencia en otras formas de shock. De forma parecida, los vasopresores e inotrópicos se usan debido a sus efectos hemodinámicos favorables, pero ninguno de ellos ha producido una mejoría sintomática consistente y muchos de ellos han reducido la supervivencia, un resultado que puede estar asociado a los efectos celulares deletéreos de estos fármacos299. Un estudio aleatorizado reciente ha comparado la noradrenalina con la dopamina en 1.679 pacientes con shock, de los cuales 280 tenían shock cardiogénico. La dopamina se asoció a una mortalidad más elevada en el subgrupo de shock cardiogénico y mayor tasa de episodios adversos —sobre todo episodios arrítmicos— en la totalidad de la cohorte300. Por lo tanto, cuando la presión arterial es baja, la noradrenalina debe ser el fármaco de primera elección. Debe usarse a la dosis más baja posible y titulada hasta que la PAS aumente hasta, por lo menos, 80mmHg. Posteriormente —debido a su efecto beta-2-adrenérgico—, la dobutamina puede administrarse simultáneamente para mejorar la contractilidad.
Manejo de la insuficiencia cardiaca tras un infarto de miocardio con elevación del segmento ST (tabla 23)Las medidas generales incluyen: historia clínica completa, en la que conste el tratamiento médico previo y una exploración física con evaluación del estado hemodinámico del paciente. Es fundamental detectar y tratar las arritmias auriculares y ventriculares, la disfunción valvular, la isquemia postinfarto y la hipertensión. Es frecuente que las comorbilidades, como infección, enfermedad pulmonar, disfunción renal, diabetes, anemia u otras anomalías de laboratorio contribuyan al cuadro clínico. Los pacientes con insuficiencia cardiaca suelen necesitar oxígeno y monitorización de la saturación de oxígeno mediante un oxímetro, con un valor diana > 95% (90% en los pacientes con enfermedad pulmonar obstructiva crónica) y gasometría periódica. Se tiene que tener precaución en los casos de enfermedad pulmonar obstructiva en evitar la hipercapnia. En pacientes hipotensos se debe intentar aumentar el volumen cuando no haya evidencia de sobrecarga de volumen o congestión. La mayoría de pacientes requiere tratamiento diurético y una mejoría en la disnea apoya el diagnóstico.
Tratamiento de la insuficiencia cardiaca y la disfunción ventricular izquierda
| Recomendaciones | Clasea | Nivelb | Referencias |
| Tratamiento de la insuficiencia cardiaca leve (clase Killip II) | |||
| Está indicado el uso de oxígeno para mantener una saturación > 95% | I | C | – |
| Está recomendado el uso de diuréticos de asa (p. ej., furosemida i.v. 20-40 mg) y deben repetirse a intervalos de 1-4 h si es necesario | I | C | – |
| Se deben considerar los nitratos i.v. o el nitroprusiato en pacientes con presión arterial sistólica elevada | IIa | C | – |
| Está indicado el uso de un IECA en todos los pacientes con signos o síntomas de insuficiencia cardiaca o evidencia de disfunción ventricular izquierda en ausencia de hipotensión, hipovolemia o insuficiencia renal | I | A | 309–312 |
| El uso de un ARA (valsartán) es una alternativa a los IECA, sobre todo cuando los IECA no se toleran | I | B | 281 |
| Se recomienda un antagonista de la aldosterona (eplerenona) en todos los pacientes con signos o síntomas de insuficiencia cardiaca o evidencia de disfunción ventricular izquierda, siempre que no haya insuficiencia renal o hiperpotasemia | I | B | 282 |
| Se debe considerar el uso de hidralazina y dinitrato de isosorbida cuando el paciente sea intolerante a los IECA y ARA | IIa | C | 313 |
| Tratamiento de la insuficiencia cardiaca moderada (clase Killip III) | |||
| Está indicado el uso de oxígeno | I | C | – |
| Se debe instaurar asistencia respiratoria de acuerdo con los gases sanguíneos | I | C | – |
| Está recomendado el uso de diuréticos de asa (p. ej., furosemida i.v. 20-40 mg) y deben repetirse a intervalos de 1-4 h si es necesario | I | C | – |
| Se recomienda la administración de morfina. La respiración debe monitorizarse. Las náuseas son frecuentes y puede ser necesario administrar un antiemético. Se aconseja un tratamiento frecuente a dosis bajas | I | C | – |
| Está recomendado el uso de nitratos si no hay hipotensión | I | C | – |
| Fármacos inotrópicos: | – | ||
| • Dopamina | IIa | C | – |
| • Dobutamina (inotrópico) | IIa | C | – |
| • Levosimendán (inotrópico/vasodilatador) | IIb | C | – |
| Se debe usar un antagonista de la aldosterona, como la espironolactona o la eplerenona, si la fracción de eyección ventricular izquierda es ≤ 40% | I | B | 282,314 |
| Se debe considerar la ultrafiltración | IIa | B | 315 |
| Se debe considerar la revascularización precoz si el paciente no ha sido previamente revascularizado | I | C | – |
| Tratamiento del shock cardiogénico (clase Killip IV) | |||
| Está indicado el uso de asistencia respiratoria/oxígeno de acuerdo con los gases sanguíneos | I | C | – |
| Se tiene que realizar una ecocardiografía/Doppler de urgencia para detectar complicaciones mecánicas, valorar la función sistólica y las condiciones de carga | I | C | – |
| Los pacientes de alto riesgo deben ser trasladados precozmente a centros terciarios | I | C | – |
| Se debe considerar la revascularización de urgencia con ICP o cirugía coronaria en los pacientes adecuados I B 100 Se debe considerar la fibrinolisis cuando no se pueda realizar revascularización | IIa | C | – |
| Se puede considerar el uso de balón de contrapulsación aórtico | IIb | B | 1,98,305 |
| Se puede considerar el uso de dispositivos de asistencia ventricular izquierda para soporte circulatorio en pacientes con shock refractario | IIb | C | – |
| Se puede considerar la evaluación hemodinámica con un catéter con balón | IIb | B | 316 |
| Se debe considerar el uso de fármacos inotrópicos/vasopresores: | |||
| • Dopamina | IIa | C | – |
| • Dobutamina | IIa | C | – |
| • Noradrenalina (se prefiere a la dobutamina cuando la presión arterial es baja) | IIb | B | 300,317 |
ARA: antagonista del receptor de angiotensina; IECA: inhibidor de la enzima de conversión de la angiotensina; ICP: intervención coronaria percutánea; i.v.: intravenoso.
En la insuficiencia cardiaca leve (clase Killip II), los diuréticos de asa i.v. y los nitratos suelen ser efectivos para conseguir una reducción de la precarga y aliviar la congestión y la disnea. La hipertensión, cuando está presente, debe tratarse rápidamente para evitar una descompensación posterior. Los IECA/ARA y los antagonistas de la aldosterona mejoran la disnea, atenúan el proceso de remodelado, mejoran la supervivencia y el tratamiento puede iniciarse precozmente en ausencia de hipotensión, hipovolemia o disfunción renal.
En la insuficiencia cardiaca moderada con edema pulmonar (clase Killip III), la morfina i.v. reduce la disnea y alivia la ansiedad. Los diuréticos de asa i.v. y los vasodilatadores están indicados para el tratamiento de la disnea en pacientes sin hipotensión (presión arterial > 90 mmHg). En pacientes que toleran el aparato, la ventilación no invasiva con tratamiento de presión de aire positiva continua es efectiva para el manejo del edema pulmonar. La intubación endotraqueal y la asistencia respiratoria pueden ser necesarias en pacientes que no alcanzan una oxigenación adecuada, o en aquellos en los que hay evidencia de hipercapnia debida a agotamiento respiratorio. La PAS debe determinar la elección de un fármaco inotrópico o vasopresor. En pacientes hipotensos con signos y síntomas de insuficiencia cardiaca y mala perfusión de los órganos (PAS < 90 mmHg) se debe considerar la administración de dopamina (inotrópico/vasopresor). En pacientes con signos y síntomas de insuficiencia cardiaca y presión arterial adecuada (> 90 mmHg) puede ser preferible el uso de dobutamina (inotrópico) o levosimendán (inotrópico/vasodilator). La noradrenalina (vasopresor) puede ser preferible en pacientes con hipotensión y signos de shock cardiogénico o septicemia. El efecto inotrópico del levosimendán es independiente de la estimulación beta-adrenérgica y representa una alternativa en pacientes que reciben tratamiento crónico con bloqueadores beta. En pacientes con PAS < 100mmHg se recomienda iniciar el tratamiento sin un bolo284. Puede ser útil la ultrafiltración para reducir la sobrecarga de fluidos refractaria a los diuréticos, sobre todo en pacientes con hiponatremia.
En la insuficiencia cardiaca grave con shock cardiogénico (clase Killip IV) es esencial detectar causas alternativas de hipotensión como hipovolemia, hipotensión inducida por fármacos, arritmias, taponamiento, complicaciones mecánicas o infarto ventricular derecho. Normalmente se requiere el uso de inotrópicos/vasopresores i.v. para mantener una PAS > 90mmHg, un gasto cardiaco adecuado y perfusión renal.
La evaluación hemodinámica invasiva con un catéter arterial pulmonar puede permitir el ajuste cuidadoso de las presiones de llenado y la evaluación del gasto cardiaco. En pacientes seleccionados que no responden adecuadamente a las medidas convencionales y que muestran evidencia de isquemia en curso, elevación persistente del segmento ST o bloqueo de rama izquierda nuevo, se debe considerar la revascularización precoz con fibrinolisis, angioplastia o cirugía coronaria. Una estrategia de revascularización precoz —preferiblemente en un centro terciario— ha demostrado beneficios en cuanto a mejoría del estado funcional y supervivencia a largo plazo. El estudio SHOCK ha demostrado que los pacientes con IAMCEST y shock cardiogénico que se someten a revascularización de urgencia con angioplastia o cirugía coronaria presentan una supervivencia a largo plazo significativamente mayor, comparados con los pacientes que reciben tratamiento médico intensivo inicial seguido de revascularización tardía en el hospital o no revascularización: un hallazgo consistente con los datos de los registros100,293. A pesar de tardar más tiempo en recibir el tratamiento, los pacientes que se han trasladado son una población seleccionada con una mortalidad intrahospitalaria ajustada similar, y se benefician de la revascularización urgente de la misma forma que los pacientes ingresados directamente301. Reconocer a los pacientes que tienen mayor riesgo de desarrollar shock puede facilitar el traslado precoz de los pacientes de alto riesgo antes del inicio de la inestabilidad hemodinámica. El shock cardiogénico es una de las circunstancias en las que puede ser aceptable hacer una revascularización de urgencia de la enfermedad multivaso100,302.
La contrapulsación con BBIA es el soporte mecánico más ampliamente utilizado para el tratamiento del shock cardiogénico, se basa en
el efecto beneficioso de la inflación diastólica aórtica y la deflación sistólica rápida, lo que mejora la perfusión miocárdica y periférica, y reduce la poscarga y el consumo miocárdico de oxígeno. Las evidencias sobre su eficacia en el contexto del IAM complicado por shock cardiogénico se han revisado recientemente para los pacientes de las eras prefibrinolítica, fibrinolítica y de angioplastia primaria98. Debido a la ausencia de estudios clínicos aleatorizados, sólo se han evaluado los registros, que han mostrado resultados conflictivos para las 3 eras, con diferencias en el riesgo de mortalidad del 29 y el 18% a favor del BCPA en las eras pretrombolítica y trombolítica, y un aumento del 6% en la mortalidad con el BCPA en la era de la angioplastia primaria. De forma concordante con estos datos, el estudio TACTICS303, que ha investigado la eficacia de la contrapulsación en pacientes con IAMCEST que han recibido trombolisis y que presentan hipotensión, posible shock cardiogénico o insuficiencia cardiaca, no ha demostrado ningún beneficio en cuanto a la mortalidad al añadir el BCPA a la trombolisis, en la totalidad de la cohorte de estudio, pero ha demostrado una reducción favorable en la mortalidad a los 6 meses en pacientes con deterioro hemodinámico más grave aleatorizados a BCPA. De forma similar, otro estudio piloto pequeño con 40 pacientes con shock cardiogénico que recibieron angioplastia primaria, ha demostrado efectos beneficiosos sobre el BNP en el grupo de BCPA, pero ausencia de beneficio en la variable principal de estudio (cambio en la puntuación seriada APACHE-II304. Otro metaanálisis reciente sugiere un beneficio sobre la supervivencia derivado del uso de BCPA en pacientes con shock cardiogénico305. En conjunto, a pesar de su uso habitual en la práctica clínica, las evidencias respecto al beneficio del BCPA en el shock cardiogénico son contradictorias, lo que probablemente se relaciona con la dificultad para realizar estudios clínicos aleatorizados en este contexto.
Los dispositivos de asistencia mecánica del VI se han usado en pacientes que no responden al tratamiento estándar incluidos los inotrópicos, fluidos y BCPA, pero las evidencias sobre sus beneficios son escasas. Un metaanálisis reciente ha examinado 3 estudios clínicos aleatorizados que han comparado los dispositivos de asistencia mecánica del VI frente al BCPA en un total de 100 pacientes. Aunque los dispositivos de asistencia mecánica resultaron ser seguros y demostraron efectos hemodinámicos mejores, no produjeron mejoría en la mortalidad a los 30 días306. Basándose en estos resultados, los dispositivos de asistencia mecánica del VI no pueden recomendarse como tratamiento de primera línea en el shock cardiogénico, pero pueden considerarse en casos particulares, teniendo en cuenta la experiencia del grupo, así como la edad del paciente y las comorbilidades. Igualmente, en otros contextos clínicos que no sean el IAMCEST, como los candidatos para trasplante que no responden al tratamiento estándar, los dispositivos de asistencia mecánica del VI implantables quirúrgicamente307 o el soporte vital extracorpóreo que incluye oxigenadores de membrana308 se han utilizado como estrategias de tratamiento o tratamientos puente hasta el trasplante. Una vez más, las evidencias de sus beneficios son todavía escasas.
Arritmias y trastornos de la conducción en la fase agudaLas arritmias y los trastornos de la conducción son frecuentes en las primeras horas después de un infarto de miocardio. Según los registros de los monitores cardiacos implantados en los primeros 11 ± 5 días de un IAM, la incidencia es del 28% para las fibrilaciones auriculares de nueva aparición, del 13% para la taquicardia ventricular (TV) no sostenida, del 10% para el bloqueo auriculoventricular (AV) de alto grado (≤ 30 lat/min de ≥ 8 s de duración), del 7% para la bradicardia sinusal (≤ 30 lat/min de ≥ 8 s de duración), del 5% para el paro sinusal (≥ 5 s), del 3% para la TV sostenida, y del 3% para la FV318. Sigue siendo controvertido el significado pronóstico a largo plazo de la aparición precoz (< 48 h) de FV o TV sostenida en pacientes con IAM. En pacientes con IAM, la FV/TV precoz ha identificado los casos que presentan un riesgo más elevado de mortalidad a los 30 días comparado con los pacientes sin VF/TV (el 22 frente al 5%)319. Los IECA/ARA han reducido la mortalidad a los 30 días en estos pacientes. Otros estudios han confirmado que el tratamiento con bloqueadores beta, administrados en las primeras 24 h del IAM en pacientes con FV/TV sostenida, se asocia a una reducción de la mortalidad precoz sin empeoramiento de la insuficiencia cardiaca320. Se necesitan más estudios aleatorizados prospectivos para clarificar las implicaciones clínicas del inicio precoz de las arritmias ventriculares en este contexto.
Las arritmias que se presentan después del periodo inicial de reperfusión pueden ser una manifestación de una patología subyacente importante, como isquemia miocárdica persistente, fallo de bomba, alteración del tono autonómo, hipoxia y trastornos electrolíticos (p. ej., hipopotasemia) o del equilibrio ácido-base, en todos los casos se trata de patologías que requieren atención y medidas correctoras. El bloqueo AV de alto grado ha sido un predictor más potente de muerte cardiaca que las taquiarritmias en pacientes con fracción de eyección del VI < 40% después de un infarto de miocardio318.
Arritmias supraventricularesLa FA es una complicación en el 6-28% de los infartos de miocardio y se asocia frecuentemente a daño VI grave e insuficiencia cardiaca318,321. Los episodios pueden durar desde minutos hasta horas y, a menudo, son repetitivos. En muchos casos, la arritmia es bien tolerada y no se precisa un tratamiento específico, más allá de la anticoagulación (tabla 24)250. En algunos casos, la frecuencia ventricular alta contribuye a la insuficiencia cardiaca y requiere tratamiento inmediato. El control adecuado de la frecuencia cardiaca es importante para reducir la demanda miocárdica de oxígeno, y se puede conseguir con la administración de bloqueadores beta o posiblemente antagonistas del calcio, ya sea por vía oral o i.v. (v. recomendaciones más adelante). En pacientes con daño miocárdico extenso o disfunción VI grave, el control de la frecuencia cardiaca se consigue de forma más segura con digoxina i.v., con o sin administración concomitante de amiodarona i.v., debido al efecto inotrópico negativo de los bloqueadores beta o los antagonistas del calcio. Se puede considerar la cardioversión eléctrica de urgencia en pacientes con FA e isquemia resistente al tratamiento o inestabilidad hemodinámica. Varios estudios321,322, aunque no todos318, han sugerido que el desarrollo de FA en el contexto del IAM es un predictor independiente de mortalidad de cualquier causa, independientemente del tratamiento que se administre. La FA no sólo ha demostrado aumentar el riesgo de accidentes isquémicos cerebrovasculares durante la hospitalización sino también en el seguimiento, incluso la FA paroxística que ha revertido a ritmo sinusal en el momento del alta321. Por lo tanto, los pacientes con FA y factores de riesgo de tromboembolia se deben tratar adecuadamente con anticoagulantes orales. Debido a que la FA suele requerir anticoagulación, cuando se elija un stent para estos pacientes se deben sopesar cuidadosamente los beneficios de los SFA sobre la reestenosis frente al riesgo importante de hemorragia asociado a la combinación prolongada del triple tratamiento antitrombótico. Las recientes guías de práctica clínica sobre el manejo de la FA250 proporcionan los consejos específicos para ayudar a seleccionar una estrategia basada en el control del ritmo o basada en el control de la frecuencia cardiaca, así como el tipo de stent y la combinación del tratamiento antiplaquetario y anticoagulante.
Manejo de la fibrilación auricular
| Recomendaciones | Clasea | Nivelb | Referencias | ||
| Se debe considerar el control del ritmo en pacientes con fibrilación auricular secundaria a un desencadenante o sustrato que ya se ha corregido (p. ej., isquemia) | IIa | C | – | ||
| Control agudo de la frecuencia de la fibrilación auricular | |||||
| Está indicado el uso de bloqueadores beta i.v. o antagonistas de los canales del calcio no dihidropiridínicos (p. ej., diltiazem, verapamilo)c si no hay signos clínicos de insuficiencia cardiaca aguda | I | A | 323 | ||
| Está indicado el uso de amiodarona o digitálicos i.v. en caso de respuesta ventricular rápida en presencia de insuficiencia cardiaca aguda concomitante o hipotensión | I | B | 324 | ||
| Cardioversión | |||||
| Está indicada la cardioversión eléctrica inmediata cuando no se pueda conseguir un control adecuado de la frecuencia cardiaca de forma rápida con tratamientos farmacológicos en pacientes con fibrilación auricular e isquemia en curso, compromiso hemodinámico severo o insuficiencia cardiaca | I | C | – | ||
| Está indicada la amiodarona i.v. para la conversión a ritmo sinusal en pacientes estables con fibrilación auricular de aparición reciente y cardiopatía estructural | I | A | 250 | ||
| La digoxina (NdE A), el verapamilo, el sotalol, el metoprolol (NdE B) y otros fármacos bloqueadores beta (NdE C) no son efectivos para la conversión a ritmo sinusal de una fibrilación auricular de aparición reciente y no deben utilizarse para el control del ritmo (aunque los bloqueadores beta y la digoxina pueden usarse para el control de la frecuencia) | III | A | B | C | 250 |
i.v.: intravenoso; NdE: nivel de evidencia.
Las dosis recomendadas de fármacos antiarrítmicos se presentan en las Guías para el manejo de pacientes con fibrilación auricular250.
Otras taquicardias supraventriculares son raras y suelen ser autolimitantes. Pueden responder a maniobras vagales. Se puede considerar la administración de adenosina i.v. en este contexto si se ha descartado el flutter auricular y el estado hemodinámico es estable; se tiene que monitorizar el ECG durante la administración. Pueden ser efectivos los bloqueadores beta cuando no estén contraindicados. La cardioversión eléctrica se debe utilizar si la arritmia está mal tolerada.
Arritmias ventriculares (tabla 25)Las extrasístoles ventriculares son casi universales en el primer día de la fase aguda y las arritmias complejas (complejos multiformes, salvas cortas o fenómeno R sobre T) son habituales. Su valor predictor de FV es cuestionable. No necesitan tratamiento específico.
- •
Taquicardia ventricular. Debe diferenciarse del ritmo idioventricular acelerado —que se produce como consecuencia de la reperfusión y que normalmente no es dañino— en el que la frecuencia cardiaca es < 120 lat/min. Las ráfagas de TV no sostenida (que duran < 30 s) no son marcadores predictores fiables de FV precoz, pueden ser bien toleradas y no requieren tratamiento necesariamente. Los episodios más prolongados pueden causar hipotensión e insuficiencia cardiaca y pueden degenerar en FV. Como no hay evidencias que indiquen que la supresión de TV no sostenida asintomática alargue la vida, no hay indicación para tratar la TV no sostenida, excepto cuando se asocia a inestabilidad hemodinámica. La TV sostenida o hemodinámicamente inestable requiere un tratamiento supresor que se resume más abajo y se subraya en las guías de práctica clínica sobre arritmias ventriculares325. La cardioversión eléctrica (que precisa sedación en pacientes conscientes) está indicada cuando la TV sea persistente y en todos los casos de pacientes hemodinámicamente inestables326. Es el método más seguro para terminar una TV sostenida en el IAMCEST. Cuando el paciente está hemodinámicamente estable, se puede iniciar un tratamiento i.v. con amiodarona, sotalol o lidocaína (si se sospecha que la TV está relacionada con una isquemia miocárdica en curso) para su terminación, pero las tasas de conversión son bajas. La amiodarona es el único fármaco antiarrítmico sin efectos proarrítmicos graves en pacientes con función VI deprimida y, por lo tanto, es el fármaco de elección en este tipo de pacientes. En una cohorte de pacientes (en los que la mayoría tenía EC) con TV sostenida estable (pero sin IAM), tanto la amiodarona i.v. como la procainamida fueron relativamente ineficaces, con unas tasas de conversión del 25 y 30%, respectivamente. Las reacciones hipotensoras clínicamente importantes llevaron a la interrupción de la perfusión con amiodarona y procainamida, o a la cardioversión directa inmediata en un 6 y 19% de los pacientes, respectivamente327.
- •
Fibrilación ventricular. Se debe realizar una desfibrilación inmediata de acuerdo con las recomendaciones indicadas en las guías de reanimación cadiopulmonar y atención cardiovascular de urgencia326,328. A pesar de que se ha demostrado que la lidocaína reduce la incidencia de FV en la fase aguda del infarto de miocardio, este fármaco aumenta el riesgo de asistolia. Un metaanálisis de 14 estudios clínicos ha demostrado una tendencia hacia una mayor mortalidad en los pacientes tratados con lidocaína que en los controles, por lo que el uso profiláctico de rutina de lidocaína no está justificado329. En un análisis retrospectivo de pacientes con IAMCEST que desarrollaron TV/FV sostenida (n = 1.126; 5,9%) de los estudios GUSTO IIB y III, se ha comparado la mortalidad por cualquier causa entre los que recibieron amiodarona (n = 50; 4,4%), lidocaína (n = 664; 59,0%) o ningún fármaco antiarrítmico (n = 302; 26,8%). Entre los pacientes que sobrevivieron 3 h, la amiodarona se asoció a un aumento de la mortalidad a los 30 días y 6 meses pero no la lidocaína, una observación que refuerza la necesidad de realizar estudios aleatorizados en esta población330.
Manejo de las arritmias ventriculares y los trastornos de la conducción en la fase aguda
| Recomendaciones | Clasea | Nivelb | Referencias |
| La cardioversión eléctrica directa está indicada en la TV y FV sostenidas | I | C | – |
| La TV monomórfica sostenida que es recurrente o refractaria a la cardioversión eléctrica directa:• Se debe considerar tratamiento con amiodarona i.v.c | IIa | C | – |
| • Puede tratarse con lidocaína o sotalold i.v. | IIb | C | – |
| Se puede considerar la terminación de la estimulación mediante catéter transvenoso cuando la TV sea refractaria a la cardioversión o frecuentemente recurrente a pesar de la medicación antiarrítmica | IIa | C | – |
| Las salvas sintomáticas repetitivas de TV monomórfica no sostenida se pueden manejar con estrategia conservadora (espera en observación) o se pueden tratar con bloqueadores betad i.v. o sotalold o amiodaronac | IIa | C | – |
| TV polimórfica• Debe tratarse con un bloqueador beta i.v.d | I | B | 320,336 |
| • O amiodarona i.v.c | I | C | – |
| • Se debe realizar una angiografía urgente cuando no pueda excluirse la presencia de isquemia miocárdica | I | C | – |
| • Debe tratarse con lidocaína i.v. | IIb | C | 330 |
| • Se debe realizar una evaluación rápida y corrección de los trastornos electrolíticos y considerar el magnesio | I | C | – |
| • Se debe tratar con sobreestimulación utilizando una sonda marcapaso temporal en el ventrículo derecho o perfusión de isoproterenol | IIa | C | – |
| En los casos de bradicardia sinusal asociada a hipotensión, bloqueo AV II (Mobitz 2) o bloqueo AV III con bradicardia que causa hipotensión o insuficiencia cardiaca: | |||
| • Está indicada la atropina i.v. | I | C | – |
| • Está indicada la estimulación temporal cuando falle la respuesta a la atropina | I | C | – |
| • Está indicada la angiografía urgente con posibilidad de revascularización si el paciente no ha recibido tratamiento de reperfusión previo | I | C | – |
| Manejo de las arritmias ventriculares y evaluación del riesgo de muerte súbita a largo plazo | |||
| Está indicada una evaluación electrofisiológica especializada para implantar un desfibrilador-cardioversor, para la prevención secundaria de muerte cardiaca súbita en pacientes con disfunción ventricular izquierda significativa, que presentan TV sostenida hemodinámicamente inestable o reanimados de una FV ocurrida después de la fase aguda inicial | I | A | 333 |
| Está indicado el tratamiento con desfibrilador-cardioversor implantable para la prevención secundaria de la mortalidad en pacientes con disfunción ventricular izquierda significativa, TV sostenida hemodinámicamente inestable o que han sobrevivido a una FV que no ha ocurrido durante la fase aguda inicial | I | A | 333 |
| Se debe realizar una evaluación del riesgo de muerte cardiaca súbita para valorar la indicación de tratamiento con desfibriladorcardioversor implantable en prevención primaria mediante valoración de la FEVI (con ecocardiografía) por lo menos 40 días después del episodio agudo en pacientes con FEVI ≤ 40% | I | A | 333 |
AV: auriculoventricular; FEVI: fracción de eyección ventricular izquierda; FV: fibrilación ventricular; i.v.: intravenoso; TV: taquicardia ventricular.
Las recomendaciones de las dosis de fármacos antiarrítmicos se presentan en las Guías para el manejo de pacientes con arritmias ventriculares y prevención de muerte cardiaca súbita325.
Es esperable que la TV o FV sostenida que se desarrolla después de la fase aguda inicial (siempre que la taquiarritmia ventricular no se deba a una causa reversible, como un trastorno electrolítico o una isquemia/reinfarto transitorios) sea recurrente, y ambas arritmias se asocian a un riesgo elevado de muerte. Aunque la isquemia miocárdica debe descartarse siempre en caso de arritmias ventriculares, es importante hacer hincapié en que la revascularización no suele prevenir el paro cardiaco recurrente en pacientes con función VI marcadamente anormal o TV monomórfica sostenida, incluso cuando la arritmia original pueda ser consecuencia de una isquemia transitoria331,332. Entre los supervivientes de FV o TV sostenida con síntomas graves, el uso de un desfibrilador automático implantable (DAI) se ha asociado a una reducción significativa en la mortalidad, comparado con el tratamiento farmacológico antiarrítmico (principalmente amiodarona)333. Con la excepción de los bloqueadores beta, los fármacos antiarrítmicos no han demostrado ser eficaces como tratamiento de primera línea en pacientes con arritmias ventriculares que pongan en riesgo la vida y no deben utilizarse para la prevención de la muerte súbita. Por lo tanto, está recomendado el uso de un DAI como tratamiento de prevención secundaria para reducir la mortalidad en pacientes con disfunción VI significativa que se presentan con una TV sostenida hemodinámicamente inestable o reanimados de una FV que no ha tenido lugar dentro de las primeras 24-48 h291. Este tipo de pacientes debe someterse a una evaluación electrofisiológica especializada antes del alta para implantar un DAI para la prevención secundaria de la muerte cardiaca súbita325,333.
El tratamiento de prevención primaria con un DAI ha demostrado reducir la mortalidad por cualquier causa en pacientes con fracción de eyección disminuida (< 40%) como consecuencia de un infarto que ha tenido lugar por lo menos 40 días antes333,334. En general, se debe esperar hasta por lo menos 40 días después del episodio agudo para implantar el DAI. En algunos casos, la evaluación de la necesidad de implantar un DAI para prevención primaria debe posponerse hasta 3 meses después del procedimiento de revascularización, para dar tiempo a que se recupere la función VI. Los pacientes pueden ser evaluados para tratamiento con TRC y DAI siempre que se pueda excluir la existencia de miocardio viable aturdido, en cuyo caso se deben seguir las indicaciones de las guías335.
Bradicardia sinusal y bloqueo cardiacoLa bradicardia sinusal es frecuente en las primeras horas del IAMCEST, sobre todo en los infartos inferiores. En algunos casos, los opiáceos son los responsables. Normalmente no precisa tratamiento. Si se acompaña de hipotensión grave, la bradicardia sinusal debe tratarse con atropina i.v., empezando con una dosis de 0,25-0,5mg, que se repite hasta un total de 1,5-2,0mg. Ocasionalmente puede asociarse a hipotensión en una fase más tardía. Si en estos casos no hay respuesta a la atropina, se recomienda el uso de un marcapasos temporal.
El bloqueo cardiaco de primer grado no necesita tratamiento. El bloqueo AV de segundo grado tipo I (Mobitz I o Wenckebach) se suele asociar a infarto inferior y raramente causa efectos hemodinámicos adversos. En caso de que los cause se debe administrar atropina en primer lugar. Cuando esta estrategia falle se debe usar estimulación. Los fármacos que enlentecen la conducción AV (como bloqueador es b e ta, digitálicos, v e r apamilo o amiodar ona) deb en interrumpirse.
El bloqueo AV de segundo grado tipo II (Mobitz II) y el bloqueo AV completo pueden ser indicaciones para la inserción de un electrodo de marcapasos, sobre todo cuando la bradicardia produzca hipotensión o insuficiencia cardiaca. Si el trastorno hemodinámico es grave se debe considerar la posibilidad de estimulación AV secuencial. La revascularización se debe considerar siempre de forma urgente en pacientes que no hayan recibido todavía tratamiento de reperfusión.
El bloqueo AV asociado a infarto de la pared inferior suele ser suprahisiano, es decir, localizado por encima del fascículo de His, se asocia a bradicardia transitoria con un ritmo de escape con QRS estrecho —por encima de 40 lat/min— y tiene una mortalidad baja. Se resuelve espontáneamente y raramente requiere intervención. El bloqueo AV asociado a infarto de la pared anterior suele ser infrahisiano, es decir, localizado por debajo del nodo AV, se asocia a un QRS inestable y ancho, y ritmo de escape bajo y tiene una mortalidad alta (hasta un 80%) debido a la gran extensión de necrosis miocárdica. El desarrollo de un bloqueo o hemibloqueo de rama nuevo suele indicar la existencia de un infarto anterior extenso. Por lo tanto hay una probabilidad elevada de desarrollo de bloqueo AV completo y fallo de la bomba.
La asistolia puede presentarse después de un bloqueo AV, bloqueo bifascicular o trifascicular o choque eléctrico. Si el electrodo del marcapasos está en su sitio se debe intentar la estimulación. En caso contrario se debe realizar una compresión torácica y ventilación, e iniciar una estimulación transtorácica.
Se debe insertar un electrodo de estimulación transvenosa en presencia de bloqueo AV avanzado con un ritmo de escape bajo, como se describe anteriormente, y considerar su uso en caso de desarrollo de bloqueo bifascicular o trifascicular. La vía subclavia debe evitarse después de la fibrinolisis o si hay anticoagulación. En estos casos se deben elegir vías alternativas. Las indicaciones de estimulación se detallan en las guías de la ESC para estimulación cardiaca y TRC291. La estimulación permanente está indicada en pacientes con bloqueo AV persistente de tercer grado, bloqueo AV persistente de segundo grado asociado con bloqueo de rama y Mobitz II transitorio o bloqueo cardiaco completo asociado con bloqueo de rama de nueva aparición291.
Complicaciones cardiacasAlgunas características demográficas y aspectos del procedimiento definen a grupos de pacientes con un riesgo más elevado de complicaciones, que pueden requerir una monitorización más prolongada. La edad avanzada, síntomas Killip II-IV, enfermedad de 3 vasos, infarto de la pared anterior, tiempo isquémico prolongado o flujo TIMI reducido suelen ser las causas más citadas213. Varias complicaciones mecánicas pueden ocurrir de forma aguda en los primeros días después de un IAMCEST, aunque su incidencia ha bajado con el uso del tratamiento de reperfusión rápido y efectivo. Todas ponen en riesgo la vida y necesitan detectarse y tratarse de forma rápida. La exploración clínica repetida (por lo menos 2 veces al día) puede descubrir un soplo cardiaco nuevo, sugestivo de regurgitación mitral o defecto septal ventricular, que tiene que confirmarse o excluirse de forma inmediata mediante ecocardiografía. En general, se debe realizar la cirugía coronaria cuando sea necesaria en el momento de la intervención de los pacientes que requieren cirugía de urgencia para el tratamiento de las complicaciones mecánicas serias.
Regurgitación mitralLa regurgitación mitral puede ocurrir en la fase subaguda debido a dilatación VI, disfunción del músculo papilar o rotura del extremo del músculo papilar o cuerdas tendinosas. Se suele presentar como un deterioro hemodinámico súbito con disnea aguda, congestión pulmonar y un soplo sistólico nuevo, que puede pasar inadvertido en este contexto. El diagnóstico se sospecha a partir de la exploración clínica y debe confirmarse inmediatamente por ecocardiografía de urgencia. Se puede presentar rápidamente un edema pulmonar y shock cardiogénico. El tratamiento se basa en la reducción de la poscarga para disminuir el volumen de regurgitación y la congestión pulmonar, cuando lo permita la presión arterial. El uso de diuréticos i.v. y soporte vasodilatador/inotrópico, así como de BCPA, pueden estabilizar a los pacientes mientras se preparan para la angiografía y cirugía. Se necesita realizar una reparación quirúrgica de urgencia o un reemplazo valvular337.
Rotura cardiacaLa rotura de la pared libre VI puede ocurrir durante la fase subaguda de un infarto transmural, y aparece como un dolor súbito y colapso cardiovascular con disociación electromecánica. El desarrollo de hemopericardio y taponamiento suelen ser fatales a corto plazo. El diagnóstico se confirma por ecocardiografía. La rotura subaguda de la pared libre, debido al sellado por la formación de un trombo, cuando se reconoce, permite que se practique pericardiocentesis y cirugía inmediata.
Rotura septal ventricularLa rotura septal ventricular se suele presentar como un deterioro clínico de inicio rápido con insuficiencia cardiaca aguda y un soplo sistólico fuerte que tiene lugar durante la fase subaguda. El diagnóstico se confirma por ecocardiografía, que permite diferenciarla de una regurgitación mitral aguda, y localizar y cuantificar la rotura338. El consecuente desarrollo de comunicación izquierda-a-derecha puede producir signos y síntomas de insuficiencia cardiaca aguda derecha de nueva aparición. El uso de un BCPA puede estabilizar a los pacientes mientras se preparan para angiografía y cirugía. Los diuréticos i.v. y los vasodilatadores se tienen que utilizar con precaución en pacientes hipotensos. Se necesita realizar de forma urgente una reparación quirúrgica, pero no hay acuerdo acerca del momento óptimo para la cirugía339. La cirugía precoz se asocia a una alta mortalidad y a un riesgo elevado de rotura ventricular recurrente, mientras que el retraso en la cirugía permite una reparación septal más fácil en el tejido cicatricial, pero aumenta el riesgo de que la rotura se extienda y se produzca taponamiento y muerte durante la espera. La mortalidad se mantiene alta en todos los pacientes y es más elevada en los pacientes con defectos inferobasales frente a los de localización anteroapical.
Infarto ventricular derechoEl infarto ventricular derecho puede ocurrir de forma aislada o, más frecuentemente, junto con un IAMCEST de la pared inferior. A menudo se presenta con la tríada de hipotensión, campos pulmonares claros y aumento de la presión venosa yugular. La elevación del segmento ST ≥ 1mV en V1 y V4 R es sugestiva de infarto ventricular derecho y debe buscarse de forma rutinaria en pacientes con IAMCEST inferior e hipotensión. La ecocardiografía Doppler demuestra típicamente dilatación ventricular derecha, presión arterial pulmonar baja, venas hepáticas dilatadas y varios grados de lesión de la pared inferior. A pesar de la distensión yugular, el tratamiento con fluidos para mantener la presión de llenado del ventrículo derecho es clave para tratar o prevenir la hipotensión. Además, se debe evitar el uso de diuréticos y vasodilatadores, ya que pueden agravar la hipotensión. Es importante el mantenimiento del ritmo sinusal y la sincronía AV, y se deben tratar precozmente la FA o el bloqueo AV.
PericarditisLa incidencia de pericarditis después de un IAMCEST se ha reducido con la terapia de reperfusión efectiva que se aplica actualmente340. La pericarditis se manifiesta como un dolor torácico recurrente, normalmente con una presentación intensa característica y, a diferencia de la isquemia recurrente, relacionada con la postura y la respiración. Puede asociarse a un reelevación del segmento ST. Sin embargo, la reelevación del segmento ST suele ser leve y progresiva, lo que ayuda a distinguirla de la reelevación abrupta del segmento ST observada en los casos de reoclusión coronaria que se producen, por ejemplo, cuando hay trombosis intra-stent. La aparición de roce pericárdico continuo puede confirmar el diagnóstico, pero muchas veces está ausente, sobre todo cuando hay derrame pericárdico importante. La ecocardiografía puede detectar y cuantificar el tamaño del derrame, si está presente, y descartar la presencia de efusión hemorrágica con taponamiento. El dolor suele responder al tratamiento con aspirina, paracetamol o colchicina a altas dosis. Los fármacos esteroideos y los antiinflamatorios no esteroideos a largo plazo se deben evitar debido al riesgo de adelgazamiento de la cicatriz con desarrollo de aneurisma o rotura. Raramente es necesario realizar una pericardiocentesis, aunque se debe practicar cuando haya compromiso hemodinámico con signos de taponamiento. En caso de derrame pericárdico, es necesario interrumpir el tratamiento anticoagulante en caso de que lo hubiera (p. ej., para la profilaxis de la tromboembolia venosa), excepto si está absolutamente indicado.
Aneurisma del ventrículo izquierdoLos pacientes con un infarto transmural extenso —sobre todo de la pared anterolateral— pueden experimentar una expansión del infarto, con un desarrollo posterior de aneurisma del VI. Este proceso de remodelado —de dilatación VI y formación de un aneurisma con sobrecarga de volumen— produce una disfunción sistólica y diastólica combinada y, a menudo, regurgitación mitral. La ecocardiografía Doppler permite valorar el volumen VI, la fracción de eyección, la extensión y grado de anomalía en la motilidad de la pared, y detectar trombos murales que necesitan anticoagulación. Se ha demostrado que los IECA/ARA y los antagonistas de la aldosterona atenúan el proceso de remodelado en el infarto transmural y mejoran la supervivencia, y deb en adminis tr arse de forma pr ecoz después de la estabilización hemodinámica. Es frecuente que los pacientes desarrollen síntomas y signos de insuficiencia cardiaca crónica, por lo que deben tratarse de acuerdo con las guías de insuficiencia cardiaca284.
Trombo ventricular izquierdoLa frecuencia de aparición de un trombo mural ventricular izquierdo ha disminuido, en gran parte gracias a los progresos logrados con la terapia de reperfusión, el uso amplio de múltiples fármacos antitrombóticos en el IAMCEST y la limitación del tamaño de infarto de miocardio debido a una reperfusión miocárdica efectiva y precoz341,342. Aunque algunos estudios sugieren que hasta una cuarta parte de los infartos de miocardio anteriores tienen trombos en el VI detectables343, los trombos VI se asocian a un peor pronóstico debido a que suelen aparecer con los infartos extensos, particularmente infartos anteriores con afectación apical y riesgo de embolia sistémica. Algunos estudios clínicos relativamente antiguos habían demostrado que la anticoagulación en pacientes con grandes anomalías de la motilidad de la pared anterior disminuía la ocurrencia de trombos murales344–346. Por lo tanto, la anticoagulación debe considerarse en pacientes con este tipo de anomalías importantes de la motilidad de la pared anterior, si el riesgo de hemorragia es bajo, para prevenir el desarrollo de trombos. Hay consenso en que los trombos murales, una vez que se diagnostican, requieren tratamiento anticoagulante oral con antagonistas de la vitamina K durante 6 meses. Sin embargo, esta opinión no se ha revisado en la era de los stents y la doble antiagregación plaquetaria. La combinación de anticoagulación y doble antiagregación plaquetaria en una terapia triple aumenta el riesgo hemorrágico. La duración óptima de un tratamiento antitrombótico triple de este tipo no se conoce y deben tenerse en cuenta los riesgos relativos de hemorragia y la trombosis intra-stent. La repetición de las técnicas de imagen del VI después de 3 meses de tratamiento puede permitir la interrupción de la anticoagulación antes de los 6 meses si hay evidencia de que el trombo ha desaparecido, sobre todo si se ha producido recuperación de la motilidad de la pared apical.
ASPECTOS EN LOS QUE LA EVIDENCIA ES INCOMPLETA Y ÁREAS FUTURAS DE INVESTIGACIÓNAún hay importantes áreas de incertidumbre en el manejo del IAMCEST que ofrecen oportunidades para la investigación futura:
- •
El desarrollo de estrategias para minimizar el paro cardiaco precoz puede asociarse a grandes ganancias en la supervivencia.
- •
La mejoría del conocimiento por parte del paciente y de la opinión pública sobre los síntomas que se relacionan potencialmente con el IAMCEST y la necesidad de llamar al servicio médico de urgencias directamente, preferiblemente a través de un número único telefónico centralizado, es una herramienta importante para reducir el retraso en la atención al paciente.
- •
Investigar si la trombolisis prehospitalaria tiene algún papel en el manejo de los pacientes que son vistos rápidamente después del inicio de los síntomas —y que tienen acceso a la angioplastia primaria— es un aspecto importante que se está evaluando en el estudio clínico aleatorizado actualmente en curso, el estudio STREAM.
- •
Mientras que algunos centros seleccionados y áreas geográficas han experimentado un gran progreso para asegurar una atención rápida y de alta calidad a los pacientes con IAMCEST, sigue habiendo una necesidad incuestionable de racionalizar el manejo prehospitalario y hospitalario, con el objeto de acortar el tiempo de diagnóstico y tratamiento de una forma homogénea en todos los países. Es importante diseñar estrategias clínicas optimizadas para asegurar un diagnóstico y manejo del IAMCEST de alta calidad, homogéneo y rápido a nivel nacional.
- •
Reducir o minimizar el daño miocárdico y la disfunción VI después de un IAMCEST sigue siendo un objetivo fundamental. Se están probando diversas estrategias, con una gran variedad de aproximaciones farmacológicas y no farmacológicas.
- •
Definir la estrategia óptima de manejo para los vasos no responsables en pacientes que tratados de forma efectiva con angioplastia primaria de la arteria responsable.
- •
Definir el régimen antitrombótico óptimo a largo plazo en pacientes portadores de stents que tienen indicación de anticoagulación oral (p. ej., debido a un riesgo elevado de FA, válvulas protésicas o trombo ventricular izquierdo).
- •
Los nuevos fármacos antitrombóticos, junto con aspirina o inhibidores del receptor de ADP, reducen la tasa de episodios isquémicos pero aumentan el riesgo hemorrágico. No obstante, la combinación óptima de anticoagulación y tratamientos antiplaquetarios todavía no se ha probado.
- •
Debido al aumento del riesgo de hemorragia relacionado con el potente tratamiento antitrombótico, doble o triple, sería deseable poner a prueba combinaciones más simples y clarificar la duración óptima del tratamiento para la prevención de la repetición de episodios isquémicos/trombóticos.
- •
Sigue sin conocerse cuál es la estrategia óptima de manejo de la glucosa en la fase aguda y después del alta en pacientes con diabetes conocida o hiperglucemia aguda, tanto en relación con la medicación óptima como en los objetivos del tratamiento.
- •
El desarrollo de técnicas percutáneas para el manejo de los defectos septales ventriculares puede permitir evitar o retrasar la reparación quirúrgica, a la vez que se proporciona un tratamiento potencialmente capaz de salvar la vida a estos pacientes de muy alto riesgo.
- •
Establecer la eficacia y seguridad de la terapia celular para reemplazar el tejido miocárdico o minimizar las consecuencias del daño miocárdico.
- •
Sigue sin conocerse completamente la estrategia terapéutica óptima para minimizar el riesgo de muerte súbita en pacientes que desarrollan TV o FV durante o después de un IAMCEST.
- •
Es preciso tener una evidencia más sólida sobre las estrategias efectivas para conseguir y mantener a largo plazo el control efectivo de los factores de riesgo.
El texto del CME (Continuing Medical Education) «Guías de la ESC para el manejo del infarto agudo de miocardio en pacientes con elevación del segmento ST» está acreditado por el European Board for Accreditation in Cardiology (EBAC). El EBAC trabaja de acuerdo con los estándares de calidad del European Accreditation Council for Continuing Medical Education (EACCME), que es una institución de la European Union of Medical Specialists (UEMS). En cumplimiento de las guías del EBAC/EACCME, todos los autores que han participado en este programa han declarado cualquier conflicto de interés que pueda causar un sesgo en el artículo. El comité organizador es responsable de asegurar que todos los potenciales conflictos de interés relevantes al programa sean declarados a los participantes antes de las actividades del CME.
Las preguntas CME para este artículo están disponibles en: European Heart Journal (http://www.oxforde-learning.com/eurheartj) y la Sociedad Europea de Cardiología (http://www.escardio.org/guidelines).
[81].
Department of Medical Sciences / Uppsala Clinical Research Center, Uppsala University and Department of Cardiology Uppsala University Hospital, 75185 Uppsala, Sweden.
Este artículo completo solo se encuentra disponible en versión electrónica: www.revespcardiol.org