Las guías de práctica clínica (GPC) tienen como objetivo reunir y evaluar toda la evidencia disponible para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular, que sufre una enfermedad determinada, no solo teniendo en cuenta el resultado final, sino también sopesando los riesgos y los beneficios de un procedimiento diagnóstico o terapéutico concreto. Las GPC y sus recomendaciones deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto la debe tomar el médico responsable de su salud, en consulta con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido al impacto de las GPC, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
Además de publicar las GPC, la ESC lleva a cabo el EurObservational Research Programme de registros internacionales de enfermedades cardiovasculares e intervenciones que resultan imprescindibles para la evaluación, los diagnósticos/tratamientos, el uso de fuentes y seguimiento de las GPC. El objetivo de estos registros es una mejor comprensión de la práctica clínica en Europa y el mundo basada solo en información de alta calidad recogida durante la práctica clínica habitual.
Más aún, la ESC ha desarrollado e incluido en sus GPC un conjunto de indicadores de calidad como herramientas para la evaluación del nivel de implementación de las GPC y pueden usarse por la ESC, hospitales, profesionales clínicos y sanitarios para medir/evaluar la práctica clínica, así como para programas educativos, junto con mensajes clave de las GPC, para mejorar los cuidados y los desenlaces clínicos.
Los miembros de este Grupo de Trabajo, entre los que se incluyen representantes de los grupos de subespecialidades, fueron seleccionados por la ESC en representación de los profesionales de la salud dedicados a los cuidados médicos de la patología tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre el diagnóstico, el tratamiento y la prevención de esta entidad concreta según las normas establecidas por el Comité de la ESC para la Elaboración de GPC. Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica más adelante.
Los expertos responsables de la redacción y la revisión del documento han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas están archivadas y disponibles en la página web de la ESC (http://www.escardio.org/guidelines). Durante el periodo de redacción, las modificaciones en las relaciones que se pudieran considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de GPC de la ESC supervisó y coordinó la preparación de esta nueva edición. El Comité es responsable también del proceso de aprobación de las GPC. Expertos externos realizaron una revisión exhaustiva del documento, tras lo cual fue aprobado por todos los miembros del Grupo de Trabajo. Por último, el documento final fue aprobado por el Comité de GPC de la ESC para su publicación en European Heart Journal. La guía se desarrolló tras la evaluación exhaustiva de los datos científicos, el conocimiento médico y la evidencia disponible en el momento de su elaboración.
La tarea de desarrollar las GPC de la ESC también incluye la creación de instrumentos educativos y la implementación de las recomendaciones a través de programas, entre los que se incluye la versión de bolsillo de las GPC, resúmenes en diapositivas, folletos con mensajes clave para un público no especialista y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Estas versiones están resumidas y, para obtener información más detallada, el usuario siempre debe acceder al texto completo de las GPC, que está disponible gratuitamente en la página web de la ESC y alojado en la página web de European Heart Journal. Los programas de implementación son necesarios porque se ha comprobado que la aplicación de recomendaciones clínicas puede favorecer el resultado de las enfermedades.
Se anima a los profesionales de la salud a considerar de forma plena las GPC durante el ejercicio profesional según su criterio clínico, así como en la determinación e implantación de estrategias preventivas, diagnósticas o terapéuticas. Sin embargo, las GPC no invalidan de ninguna manera la responsabilidad individual de los profesionales de la salud a la hora de tomar las decisiones apropiadas y precisas teniendo en consideración el estado de salud de cada paciente, en consulta con este o con su tutor o representante legal cuando se apropiado o necesario. También es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
2INTRODUCCIÓNLas recomendaciones sobre el ejercicio y los criterios de aptitud para la práctica deportiva de deportistas de competición con enfermedad cardiovascular (ECV) se publicaron por primera vez en la Sección de Cardiología del Deporte de la ESC en 20051 y algunas secciones se actualizaron posteriormente en 2018 y 20192,3. El ambicioso objetivo de estas recomendaciones era minimizar el riesgo de eventos adversos en deportistas muy entrenados. Sin embargo, es importante reconocer que la mayoría de la población participa en deportes recreativos y ejercicios recreativos individuales y, al contrario que los deportistas de élite, estas personas tienen mayores prevalencias de factores de riesgo de ateroesclerosis y ECV establecida.
La actividad física (AF) regular, como el ejercicio sistemático, es un componente importante del tratamiento para la mayoría de las ECV y se asocia con una reducción de la mortalidad cardiovascular (CV) y la mortalidad total. En una época con un aumento de los estilos de vida sedentarios y de las prevalencias de obesidad y ECV, la promoción de la AF es más importante que nunca y una de las prioridades para todas las sociedades científicas CV. Incluso durante las consultas habituales por otras causas, se anima a los médicos a promocionar el ejercicio entre los pacientes.
Aunque proporcionalmente escaso, paradójicamente, el ejercicio puede desencadenar muerte súbita cardiaca (MSC) en personas con ECV, especialmente entre aquellas con un estilo de vida sedentario previo o con ECV avanzada4,5. Junto con el impulso de promover el ejercicio para todas las personas6, se prevé que todos los médicos se enfrenten a un número creciente de consultas de pacientes con factores de riesgo de enfermedad coronaria (EC) establecidos o ECV establecida relativas a la participación en programas de ejercicio o deportes recreativos. En estas consultas se necesita encontrar el equilibrio entre los diversos beneficios del ejercicio, el bajo riesgo de muerte súbita y los objetivos del paciente para la forma física y la participación continua en ejercicio relativamente vigoroso tras un diagnóstico CV.
La presente GPC sobre ejercicio y práctica deportiva para personas con ECV es la primera de la ESC de este tipo. La cardiología del deporte es una subespecialidad relativamente nueva y emergente, por lo que la evidencia de base empírica para la historia natural de la evolución de las ECV durante el ejercicio intenso y los deportes de competición en pacientes con ECV es relativamente escasa. Esto se ve reflejado en que un número desproporcionadamente grande de recomendaciones dependen del conocimiento y la amplia experiencia de grupos de consenso más que de grandes estudios prospectivos. Reconocemos las dificultades inherentes de formular recomendaciones para todas las situaciones de una población heterogénea con un espectro diverso de ECV considerando la escasa disponibilidad de evidencia. Por ello, estas recomendaciones no deben considerarse legalmente vinculantes y no deben desanimar a los médicos a llevar a cabo su trabajo individualizado más allá de los límites de este documento, basándose en su experiencia clínica en cardiología del deporte.
Donde es posible, la GPC ha incluido las investigaciones más innovadoras para pacientes con ECV que practican deporte. La presente GPC también se basa en GPC de la ESC previas para la investigación, la evaluación del riesgo y el tratamiento de personas con ECV, para ayudar a los médicos a prescribir programas de ejercicio o aconsejar sobre la práctica deportiva. Esperamos que el presente documento sea una guía de práctica clínica útil, pero también un incentivo para que futuros estudios cuestionen el conocimiento establecido.
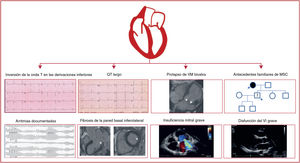
Siguiendo la buena práctica clínica, el presente documento anima a llevar a cabo el proceso de toma de decisiones junto con el paciente deportista y respetar la autonomía personal tras comunicarle información detallada sobre el efecto del deporte y los potenciales riesgos de complicaciones o eventos adversos (ilustración central). Asimismo, toda prescripción de ejercicio y su respectiva discusión entre el paciente y el médico deben documentarse en el parte médico.
3IDENTIFICACIÓN DE ENFERMEDAD CARDIOVASCULAR Y ESTRATIFICACIÓN DEL RIESGO EN PACIENTES QUE PRACTICAN DEPORTES RECREATIVOS Y DE COMPETICIÓN3.1IntroducciónEl aumento de la AF y la mejora de la forma física se asocian con menores tasas de mortalidad total y de ECV y menor prevalencia de diversas enfermedades conocidas7–16. A pesar de los sustanciales beneficios para la salud derivados de la AF frecuente, paradójicamente, el ejercicio intenso puede actuar como un desencadenante de arritmias ventriculares (AV) potencialmente mortales en presencia de ECV subyacente. De hecho, la MSC es la primera causa de mortalidad relacionada con el deporte y el ejercicio entre deportistas17–19. La seguridad CV durante la práctica deportiva para personas de todos los niveles y edades es imprescindible para evitar devastadoras MSC que, en muchas ocasiones, son prevenibles. Además, la seguridad CV se ha convertido en un objetivo común para médicos y organizaciones deportivas20–24.
La revisión cardiovascular preparticipativa con el objetivo de detectar enfermedades asociadas con MSC cuenta con el apoyo universal de las principales sociedades médicas20–22,25,26. Sin embargo, el mejor método para la revisión CV de deportistas de competición jóvenes (< 35 años) sigue siendo controvertido y los datos para guiar las recomendaciones en deportistas veteranos (edas ≥ 35 años) son escasos.
Las estrategias de revisión deben adoptarse a la población diana y las enfermedades específicas con el mayor riesgo. La MSC en deportistas jóvenes está causada por una variedad de cardiopatías estructurales y eléctricas, entre las que se incluyen miocardiopatías, canalopatías iónicas, anomalías coronarias y enfermedades cardiacas adquiridas17,27,28 En deportistas adultos y mayores, la enfermedad coronaria ateroesclerótica es la que más eventos cardiacos graves conlleva28,29.
3.2Definiciones de deportistas recreativos y de competiciónLa ESC define «deportista» como «la persona joven o adulta que, como aficionada o profesional, realiza ejercicio físico de entrenamiento de forma habitual y participa en deportes oficiales de competición»1,30. Asimismo, la American Heart Association (AHA) y otras fuentes definen al deportista de competición como una persona que entrena de manera habitual (y generalmente con intensidad) en deportes individuales organizados o de equipo, con énfasis en la competición y el rendimiento31,32. Los deportistas que participan en deportes de competición pueden abarcar todo el espectro de edades y pueden competir en niveles juveniles, de instituto, de academias, de universidades, semiprofesional o profesional, nacional, internacional y olímpicos. Para diferenciarlos, un deportista recreativo participa en deportes por placer y como actividad de ocio, mientras que un deportista de competición está muy entrenado con mayor énfasis en el rendimiento y en la victoria. En una propuesta de clasificación de deportistas basada en el volumen mínimo de ejercicio, los deportistas de élite (equipos nacionales, olímpicos y deportistas profesionales) entrenan por norma general al menos 10 h/semana; los deportistas «de competición» (p. ej., de instituto, universitario y deportistas veteranos a nivel de clubs) entrenan al menos 6 h/semana, y los deportistas «recreativos» entrenan al menos 4 h/semana33. Esta distinción quizá sea arbitraria, ya que algunos deportistas recreativos, como los ciclistas de larga distancia y los corredores, realizan ejercicio en volúmenes más altos que algunos deportistas profesionales que participan en deportes de habilidad.
3.3Complicaciones cardiacas graves relacionadas con el ejercicioLos eventos cardiacos graves relacionados con el deporte incluyen la parada súbita cardiaca (PSC) y la MSC, síndromes coronarios agudos (SCA) como isquemia miocárdica e infarto de miocardio, el accidente isquémico transitorio (AIT), el accidente cerebrovascular (ACV) y las taquiarritmias supraventriculares (TSV).
La PSC se define, independientemente de la supervivencia, como una pérdida inesperada del conocimiento por causa cardiaca para la que se aplica reanimación cardiopulmonar (RCP) o desfibrilación17,27,32.
La MSC se define como una muerte inesperada por causa cardiaca o la muerte repentina de un corazón estructuralmente normal a la autopsia sin otra explicación ni antecedentes compatibles con muerte cardiaca (p. ej., necesidad de reanimación cardiaca)17,27,32. Para comparar los datos publicados previamente con definiciones de PSC y MSC diversas, el momento del evento debería categorizarse como: durante el episodio, en la primera hora tras el ejercicio o entre 1 y 24 h tras el ejercicio30. La actividad en el momento del evento puede categorizarse más concretamente como: durante entrenamiento o competición, en reposo o durante el sueño30.
Es más probable que el SCA inducido por el ejercicio afecte a deportistas adultos o mayores y, en la mayoría de los casos, sea el resultado de la rotura de una placa ateroesclerótica y una trombosis coronaria35. Más del 50% de los pacientes que sufren infarto agudo de miocardio (IAM) y PSC no tienen síntomas preexistentes o antecedente conocido de EC36,37. En deportistas de resistencia de larga duración, la PSC y la isquemia miocárdica también pueden estar causadas por la «demanda» isquémica debido a un desequilibrio entre el suministro y la demanda de oxígeno como resultado de una placa calcificada y estenosis grave38. En un estudio sobre maratones y medias maratones en Estados Unidos, ninguno de los corredores con PSC y ateroesclerosis coronaria (> 80% de la arteria coronaria en una arteria proximal izquierda o enfermedad de 3 vasos) grave mostró evidencia angiográfica de rotura aguda de placa o trombos38.
3.4Incidencia de muerte súbita cardiaca en deportistasEn la actualidad se estima que la incidencia de la MSC en deportistas de competición varía entre casi 1/millón a 1/5.000 deportistas al año17,39,40. Las diferencias en las estimaciones actuales se deben principalmente a la diversidad de las metodologías de estudio y las comparaciones entre poblaciones heterogéneas.
Debido a que la notificación de MSC en deportistas no es obligatoria en la mayoría de los países, los estudios corren el riesgo de subestimar la verdadera incidencia debido a la comprobación incompleta de casos. Por ejemplo, los estudios que utilizan noticias en los medios de comunicación como su principal fuente para localizar MSC identifican solo el 5-56% de los casos, incluso entre deportistas de competición destacados41–44. De modo similar, el uso de reclamaciones a seguros de salud contra catástrofes como único método para la identificación de casos no identificó el 83% de los casos de MSC y el 92% de todos los casos de PSC entre los deportistas de los institutos de Minnesota40,45.
La población de deportistas objeto de estudio también debe definirse con precisión. Las estadísticas de censos de población, las encuestas transversales y los datos sobre deportistas que informan de su actividad dan como resultado estimaciones muy poco fiables. También deberían considerarse otros detalles en los estudios. ¿El estudio incluye todos los casos de PSC (supervivientes y fallecidos) o solo MSC? ¿Incluye cualquier caso independientemente del momento del evento (p. ej., durante el ejercicio, en reposo o durante el sueño) o solo los que ocurren durante la práctica deportiva? Los estudios indican que el 56-80% de las PSC en deportistas jóvenes tienen lugar durante el ejercicio y, el resto, en contextos sin esfuerzo17,18,46.
La evidencia demuestra que algunos deportistas tienen mayor riesgo de PSC según el sexo, la raza o el deporte practicado17,40,41,45–50. Las tasas de incidencia son siempre mayores en deportistas varones que en las mujeres, con un riesgo relativo que oscila de 3:1 a 9:1 (varones:mujeres)17,45,47–49,51,52. Los deportistas de raza negra y ascendencia afrocaribeña también tienen más riesgo que los deportistas de raza blanca. Entre los deportistas universitarios de Estados Unidos, los varones tenían más riesgo que las mujeres (1/38.000 frente a 1/122.000), y los deportistas de raza negra tenían un riesgo 3,2 veces mayor que los de raza blanca (1/21.000 frente a 1/68.000)17. Los jugadores de baloncesto varones tenían el mayor riesgo anual de MSC (1/9.000) y los baloncestistas varones de raza negra tenían un riesgo de 1/5.30017. Con base en los estudios disponibles y una revisión sistemática de la literatura, la incidencia anual generalmente aceptada de todas las PSC es de aproximadamente 1/80.000 deportistas de instituto y 1/50.000 deportistas universitarios50. Los deportistas varones, los jugadores de baloncesto (Estados Unidos) y fútbol (Europa) representan los grupos con mayor riesgo. Hay pocas estimaciones disponibles sobre deportistas juveniles, profesionales y veteranos.
3.5Etiología de muerte súbita cardiaca durante el ejercicioLa MSC de deportistas jóvenes generalmente tiene causa en una cardiopatía estructural genética o congénita17–19,42,53,54. Sin embargo, la MSC inexplicada con autopsia negativa, también conocida como síndrome de muerte súbita arrítmica, se notifica en autopsias en hasta el 44% de las presuntas MSC dependiendo de la población de estudio17,28,42,53–56. En deportistas jóvenes aparentemente sanos, la prevalencia de cardiopatías asociadas con MSC es aproximadamente del 0,3% y esta cifra se apoya en múltiples estudios con métodos de evaluación no invasivos para la detección de cardiopatías y alto riesgo de MSC20,57–65.
En deportistas mayores de 35 años, más del 80% de todas las MSC se deben a EC ateroesclerótica, y el esfuerzo físico vigoroso se asocia con un aumento del riesgo de IAM y MSC34,66–70. Los deportistas con el mayor riesgo son aquellos sin un pasado de entrenamiento sistemático.
3.6Modalidades de cribado para enfermedades cardiovasculares en deportistas jóvenesLa mayoría de los expertos creen que una detección temprana de enfermedades potencialmente letales en deportistas puede disminuir la morbilidad y la mortalidad CV a través de la estratificación del riesgo, intervenciones específicas para cada enfermedad o modificaciones en el ejercicio22,57,58,71. El cribado CV por antecedentes y la exploración clínica o el electrocardiograma (ECG) presentan retos específicos, así como limitaciones. La baja sensibilidad y la alta tasa de respuestas positivas en cuestionarios sobre antecedentes antes de la participación se han documentado en múltiples estudios64,72–75. En los estudios de cribado CV en los que médicos con experiencia usan los estándares de interpretación electrocardiográfica contemporáneos, el cribado por ECG supera los antecedentes y la exploración clínica en todas las medidas estadísticas de rendimiento46,58,59,62,64,65,74,76.
Mientras que la ecocardiografía puede identificar otras enfermedades estructurales, no hay suficiente evidencia para recomendarla como parte del cribado sistemático77.
3.7Cribado de enfermedades cardiovasculares en deportistas mayoresLas recomendaciones y la base empírica para el cribado CV en deportistas mayores de 35 años son limitadas. El cribado CV en deportistas adultos o mayores debe centrarse en la mayor prevalencia de la EC ateroesclerótica. Sin embargo, los cribados sistemáticos de isquemia con ergometría en adultos asintomáticos tienen un valor de predicción positiva bajo y un alto número de falsos positivos, por lo que no se recomiendan78–80.
Un cribado por ECG aún podría identificar miocardiopatías sin diagnosticar y enfermedades eléctricas primarias en deportistas mayores, y la evaluación por factores de riesgo de ECV puede identificar a los pacientes con más riesgo que necesiten pruebas adicionales. Por lo tanto, siguiendo la declaración de la ESC de 2017 sobre el cribado CV previo a la participación, la ergometría con ECG debería reservarse para deportistas asintomáticos o considerados en alto riesgo de EC según el Systematic Coronary Risk Evaluation (SCORE) de la ESC (secciones 4 y 5).6,81
La ergometría también puede ser útil para evaluar la respuesta de la presión arterial (PA) al ejercicio, la ocurrencia de arritmias inducidas por el ejercicio y síntomas o el rendimiento físico y su relación con el entrenamiento81. En adultos y personas mayores, especialmente aquellos sin experiencia previa con AF de moderada a vigorosa, la ergometría o la prueba de esfuerzo cardiopulmonar (PECP) son útiles para la evaluación de la salud CV general y el rendimiento, lo que permite realizar recomendaciones individuales sobre el deporte y el tipo de ejercicio y la intensidad, como se trata en secciones posteriores82.
4ACTIVIDAD FÍSICA, EJERCICIO RECREATIVO Y PARTICIPACIÓN EN DEPORTES DE COMPETICIÓN4.1Introducción generalLas recomendaciones para la prescripción de ejercicio requieren un conocimiento básico de las respuestas fisiológicas al ejercicio, así como una compresión de todos los conceptos y las características de la actividad física, las intervenciones en el ejercicio y sus implicaciones para la práctica deportiva. Aunque ejercicio y AF se utilizan generalmente de manera indistinta, es importante subrayar que estos términos difieren. La AF se define como cualquier movimiento corporal producido por el músculo esquelético que tiene como resultado el gasto energético. Por el contrario, el ejercicio o el entrenamiento son, por definición, actividades físicas estructuradas, repetitivas y con el propósito de mejorar o mantener uno o más componentes de la forma física83.
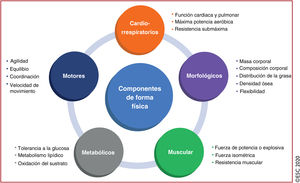
La forma física puede expresarse en 5 grandes componentes83 (figura 1): un componente morfológico (masa corporal respecto a la estatura, composición corporal, distribución de grasa subcutánea, grasa visceral abdominal, densidad ósea y flexibilidad)84, un componente muscular (potencia de fuerza explosiva, fuerza isomética, resistencia muscular)85, un componente motor (agilidad, equilibrio, coordinación, velocidad de movimiento)85, un componente cardiorrespiratorio (resistencia o capacidad de ejercicio submáxima, máxima potencia aeróbica, función cardiaca, función pulmonar, PA) y un componente metabólico (tolerancia a la glucosa, sensibilidad a la insulina, metabolismos lipídico y lipoproteico, características de oxidación del sustrato)86.
Clases de recomendación.
| Clases de recomendación | Definición | Expresiones propuestas |
|---|---|---|
| Clase I | Evidencia y/o acuerdo general en que un determinado tratamiento o procedimiento es beneficioso, útil y efectivo | Se recomienda o está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia de un tratamiento o procedimiento | |
| Clase IIa | El peso de la evidencia/opinión esta a favor de la utilidad/eficacia | Se debe considerar |
| Clase IIb | La utilidad/eficacia esta menos establecida por la evidencia/opinión | Se puede recomendar |
| Clase III | Evidencia o acuerdo general en que un tratamiento o procedimiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
|---|---|
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o de grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Los principios básicos de la recomendación de ejercicio se han descrito utilizando el concepto «FITT» (frecuencia, intensidad, tiempo y tipo). El modo de ejercicio (tabla 3) también es una característica importante. Las siguientes secciones describen cada uno de estos componentes en relación con el ejercicio aeróbico seguidos de los componentes del ejercicio de fuerza.
Características del ejercicio.
| Frecuencia:• Sesiones/semana• Tandas de ejercicio |
|---|
| Intensidad:• Resistencia: %VO2pico o %FCpico o % de reserva cardiaca• Fuerza o potencia: % de 1 RM o %de 5 RM o % de FCpico o % de reserva cardiaca para ejercicio mixto |
| Tiempo:Duración de:• Programa de ejercicio en semanas o meses• Días de entrenamiento por semana• Sesiones de entrenamiento por día• Duración de la sesión de entrenamiento en horas |
| Tipo:• Resistencia (correr, ciclismo, remar, caminar, nadar)• Fuerza• Velocidad y resistencia de velocidad• Flexibilidad• Coordinación y equilibrio |
| Modo de ejercicio y entrenamiento:• Metabólico: aeróbico frente a anaeróbico• Trabajo muscular:–Isométrico-isotónico–Dinámico (concéntrico, excéntrico) frente a estático–Continuo frente a intervalos–Grupos musculares grandes o pequeños |
FC: frecuencia cardiaca; RM: repeticiones máximas; VO2: consumo de oxígeno; VO2pico: consumo de oxígeno pico.
Tradicionalmente, los diferentes tipos de ejercicio se clasifican en términos binarios como ejercicio de resistencia o fuerza. Sin embargo, esta clasificación está simplificada en exceso. Una clasificación adicional del ejercicio se basa en el metabolismo (aeróbico frente a anaeróbico) o en el tipo de contracción muscular: isotónica (contracción contra la fuerza en la que la longitud del músculo se contrae [concéntrico] o aumenta [excéntrico] e isométrica [estático o sin cambio en la longitud del músculo]).
El ejercicio aeróbico hace referencia a la actividad llevada a cabo con una intensidad que permite la activación del metabolismo de energía almacenada a través de la glucolisis aeróbica. Además de la vía glucolítica, el metabolismo lipídico (oxidación beta) también participa en el ejercicio aeróbico. Este tipo de ejercicio involucra grandes grupos musculares que llevan a cabo actividades dinámicas, lo que resulta en un aumento sustancial del ritmo cardiaco y el gasto energético. Algunos ejemplos de ejercicio aeróbico son el ciclismo, la carrera y la natación llevados a cabo a una intensidad de baja a media84. Por el contrario, el ejercicio anaeróbico hace referencia al movimiento de alta intensidad que no puede sostenerse solo con el aporte de oxígeno y requiere que el metabolismo de energía almacenada se procese principalmente por glucolisis anaeróbica. Una acción muscular isométrica que no trabaja al máximo pero no depende necesariamente del oxígeno durante la contracción muscular es un ejemplo de ejercicio anaeróbico. Otro ejemplo es el ejercicio intermitente de alta intensidad85.
4.1.1.2Frecuencia del ejercicioLa frecuencia del ejercicio se expresa generalmente como el número de veces que una persona hace ejercicio cada semana. La guía indica que el ejercicio moderado debe realizarse la mayoría de los días de la semana, hasta acumular un mínimo de 150min/semana.
4.1.1.3Intensidad del ejercicioDe todos los elementos básicos de la recomendación de ejercicio, generalmente se considera que la intensidad es el más crítico para conseguir forma aeróbica y un impacto más favorable en los factores de riesgo86,87. La intensidad absoluta hace referencia a la tasa de gasto energético durante el ejercicio y se expresa generalmente en kcal/min o en equivalentes metabólicos84,88. La intensidad relativa hace referencia a una fracción de la potencia (carga) máxima de una persona que se mantiene durante el ejercicio y normalmente se prescribe como un porcentaje de la capacidad aeróbica máxima (VO2máx) basándose en una PECP. La intensidad del entrenamiento también se puede expresar como porcentaje de la frecuencia cardiaca máxima (FCmáx) documentada durante una ergometría89 o prevista usando la ecuación (FCmáx=220–edad)90. El uso de ecuaciones predictivas de la FCmáx no está recomendado, ya que existe una gran desviación estándar sobre la línea de regresión entre la edad y la FCmáx91. Como alternativa, la intensidad del ejercicio también se puede expresar relativa a un porcentaje de la reserva de FC de una persona, que utiliza un porcentaje de la diferencia entre la FCmáx y la FC en reposo y lo suma a esta (fórmula de Karnoven)92. Deben tomarse precauciones si se emplea la FC para prescribir y evaluar la intensidad del ejercicio de pacientes con bloqueadores beta93. Idealmente, la FC derivada del entrenamiento solo debe usarse si la capacidad funcional se determinó (por ergometría) mientras se administraba la medicación. La intensidad también se puede monitorizar mediante la sensación subjetiva de esfuerzo (p. ej., 12-14 en la escala Borg 6-20) o la «prueba del habla», o sea, la capacidad de hablar mientras se realiza ejericcio91,94. Las zonas generales para varias intensidades de ejercicio se muestran en la tabla 4.
Índices de intensidad de ejercicio para deportes de resistencia desde ergometrías máximas y zonas de entrenamiento.
| Intensidad* | VO2máx (%) | FCmáx (%) | RFC (%) | Escala de esfuerzo subjetiva | Zona de entrenamiento |
|---|---|---|---|---|---|
| Intensidad baja, ejercicio suave | < 40 | < 55 | < 40 | 10-11 | Aeróbico |
| Ejercicio de intensidad moderada | 40-69 | 55-74 | 40-69 | 12-13 | Aeróbico |
| Intensidad alta | 70-85 | 75-90 | 70-85 | 14-16 | Aeróbico+lactato |
| Ejercicio de intensidad muy alta | > 85 | > 90 | > 85 | 17-19 | Aeróbico+lactato+anaeróbico |
FCmáx: frecuencia cardiaca máxima; VO2máx: consumo máximo de oxígeno.
*Adaptado de las referencias84,85 relacionando las zonas de entrenamiento con los umbrales aeróbicos y anaeróbicos. El ejercicio de baja intensidad se sitúa por debajo del umbral aeróbico; el ejercicio moderado se sitúa por encima del umbral aeróbico, pero no llega a la zona anaeróbica; el ejercicio de alta intensidad se sitúa cerca de la zona anaeróbica. La duración del ejercicio tiene una gran influencia en la división por intensidades.
La intensidad del ejercicio está en relación inversa con el tiempo de ejercicio. Su producto (enkcal o kJ) define el volumen de cada unidad de entrenamiento, multiplicado por la frecuencia da una estimación del gasto energético de la tanda de ejercicio o sesión. La frecuencia de las sesiones de entrenamiento y la duración del periodo de entrenamiento proporcionan el gasto energético total de un programa de entrenamiento. Cumplir con las actividades mínimas recomendadas por las guías equivale a aproximadamente 1.000kcal/semana o sobre 10 MET/h/semana (el producto del nivel de equivalente metabólico y la duración en horas por semana). El volumen de entrenamiento debe aumentarse semanalmente un 2,5%95 en intensidad o en 2 min de duración95, aunque la tasa de progresión debe personalizarse de acuerdo con la adaptación biológica de cada persona. La adaptación al entrenamiento también se ve influida por la edad, la genética96, la forma física y factores ambientales como la hidratación, el calor, el frío y la altitud97.
4.1.1.5Tipo de entrenamiento4.1.1.5.1Entrenamiento aeróbicoEl entrenamiento aeróbico puede ser continuo o en intervalos. Hay suficiente evidencia y muchas guías sobre el ejercicio aeróbico continuo, pero la evidencia firme más reciente también subraya los beneficios del entrenamiento en intervalos. El diseño de intervalos conlleva completar pequeñas tandas de ejercicio de alta intensidad intercaladas con periodos de recuperación. Cuando se compara con el entrenamiento continuo, este enfoque conlleva un mayor reto para los sistemas cardiopulmonares, periféricos y metabólicos y tiene como resultado un entrenamiento más efectivo98. Se ha documentado que el entrenamiento en intervalos es motivador, ya que el entrenamiento continuo tradicional puede ser tedioso. El entrenamiento en intervalos solo debe prescribirse a pacientes cardiacos estables porque conlleva más sobrecarga del sistema CV99. Ya que el entrenamiento intermitente expone a las personas a un esfuerzo cercano al máximo, los periodos de recuperación deben tener una duración apropiada y se recomienda especialmente que sean periodos de recuperación activos100. La relación entre ejercicio y reposo varía101. Se utiliza un número diverso de enfoques, que debe personalizarse según la forma física y las comorbilidades.
4.1.1.5.2Entrenamiento de fuerzaIntensidad del ejercicio. La intensidad del ejercicio de fuerza se prescribe en términos de una repetición máxima (1 RM). Una RM se define como la cantidad máxima de peso que una persona puede levantar mediante un movimiento de cierta amplitud con una repetición. Aunque 1 RM parece ser un enfoque seguro para evaluar la fuerza102 y no se ha informado de eventos CV significativos con esta técnica103, se recomienda hacer múltiples (generalmente 5) repeticiones (5 RM) por razones de conveniencia y conformidad. Cinco RM es el máximo peso que se puede levantar 5 veces. Se ha informado que 1 RM puede estimarse de manera precisa a través de múltiples repeticiones y que 5 RM reflejan apropiadamente la fuerza máxima104.
Zonas de entrenamiento. El entrenamiento de fuerza con menos del 20% de 1 RM se considera por norma general entrenamiento aeróbico de resistencia. Con más del 20% de 1 RM, los capilares musculares se comprimen durante la contracción muscular, lo que da lugar al estímulo hipóxico que produce los efectos del entrenamiento. El número de repeticiones debe estar en relación inversa con la intensidad del entrenamiento. Una intensidad de entrenamiento moderada de un 30-50% de 1 RM con 15-30 repeticiones se considera entrenamiento muscular de resistencia. Las intensidades de entrenamiento superiores, de un 50-70% de 1 RM con 8-15 repeticiones, son óptimas para ganar fuerza.
Volumen del entrenamiento. Las ganancias de fuerza óptimas tienen lugar cuando el entrenamiento de resistencia se lleva a cabo 2-3 veces a la semana. La organización del entrenamiento de resistencia generalmente se realiza por estaciones o en circuito. En el primer enfoque, se debe finalizar las repeticiones de ejercicios de cada grupo muscular antes de continuar con otro ejercicio y otro grupo muscular. En el segundo enfoque, se entrena un grupo muscular y se rota a otro ejercicio y otro grupo muscular hasta que se completan todas las tandas de ejercicios para cada grupo muscular. Una de las 3 tandas de 8-15 repeticiones debe llevarse a cabo incluyendo la flexión y extensión de cada grupo muscular. Las tandas múltiples son mejores que las tandas individuales105. Se debe prescribir una variedad de 8-10 ejercicios de resistencia para cubrir la mayoría de los grupos musculares88. La potencia muscular se mantiene mejor cuando se utilizan intervalos de recuperación de 3-5 min en lugar de intervalos de recuperación cortos (< 1 min)106.
Modo de entrenamiento. El ejercicio de fuerza puede ser isométrico (es decir, la longitud muscular no cambia sin movimiento de la articulación) o dinámico (contracción con cambio en la longitud muscular y movimiento de la articulación de cierta amplitud). Las acciones musculares isométricas (estáticas) pueden inducir una maniobra de Valsalva con cargas de moderadas a altas si no se previene activamente con respiración regular, y puede llevar a una fluctuación innecesaria de la PA. El entrenamiento dinámico puede incluir fuerza constante o variable por toda la amplitud del movimiento con pesas libres o máquinas (con pesas). En ambos modos, el tipo de contracción y la velocidad varían a lo largo del movimiento. Este tipo de actividad muscular refleja la carga muscular utilizada en actividades diarias. Los músculos pueden contraerse de forma concéntrica, con el músculo encogiéndose durante el movimiento, o excéntrica, con el músculo extendiéndose. El entrenamiento de fuerza es una aplicación avanzada en la que los participantes llevan a cabo una serie de acciones musculares rápidas concéntricas y excéntricas generalmente con una carga alta.
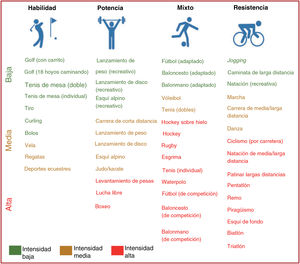
4.1.2Clasificación de los ejercicios y deportesEs difícil clasificar los deportes con precisión mediante los diferentes componentes del FITT debido a las diferencias en el tipo de trabajo muscular y el modo y el volumen y la intensidad del ejercicio. Más aún, la mayoría de los deportes tienen un componente muscular isotónico e isométrico combinado. Por ejemplo, las actividades de fuerza pueden ser predominantemente dinámicos o estáticos. Algunos deportes requieren un gran dominio motor y una gran habilidad, mientras que otros se practican en intensidades bajas, altas o muy altas. Estas intensidades pueden variar dependiendo del tipo de deporte o del nivel al que se practica: profesional, aficionado o recreativo.
Cuando se proporcione asesoramiento sobre un programa de ejercicio o la práctica deportiva, el médico debe indicar: a) el tipo de deporte; b) la frecuencia y la duración del programa de ejercicio, y c) la intensidad que parece más apropiada para cada persona.
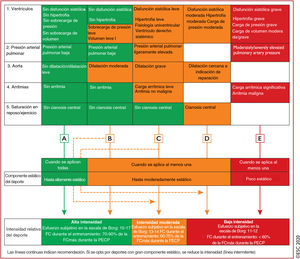
A la hora de elegir el deporte más apropiado, el médico puede indicar el tipo de deporte como se muestra en la figura 2 (habilidad, potencia, mixto o resistencia) especificando frecuencia, duración e intensidad del trabajo muscular que se debe mantener preferentemente durante el programa de ejercicio.
Para prescribir la adecuada intensidad de un deporte de resistencia o el tipo mixto de ejercicio o deporte, se debe realizar una ergometría máxima con un ECG de 12 derivaciones o, preferiblemente si es posible, medición del intercambio de gases respiratorios (PECP) a cada paciente.
Conocer la máxima capacidad de ejercicio de cada persona permitirá a los profesionales de la salud crear un programa de ejercicio a medida que sea seguro y muy probablemente efectivo. La ergometría permite la recomendación de ejercicio apropiada con base en índices reconocidos como la reserva de FC (FCreserva=FCmáx–FCreposo), la reserva de VO2, el umbral de ventilación o el porcentaje de la frecuencia de trabajo para cada persona.
La ergometría también permite una evaluación de cualquier respuesta CV anormal que podría no ser evidente durante las actividades diarias habituales (síntomas, anomalías electrocardiográficas, arritmias o una respuesta anormal de la PA, entre otras). Basándose en los resultados de la ergometría, el médico puede pautar la intensidad, el modo y la duración del ejercicio más adecuados para cada paciente (tabla 4).
Para los deportes de potencia o el entrenamiento de fuerza, se recomiendan pruebas musculares máximas adicionales para determinar 1 o 5 RM. El porcentaje de estas cifras, el número de repeticiones y el número de series permitirán determinar la demanda CV y muscular. Además, las campimetrías facilitarán las prescripciones apropiadas, principalmente para deportes de equipo.
Cuando se prescriban deportes de potencia a pacientes con ECV, se debe considerar el tipo de trabajo muscular: ejercicios de fuerza isométricos (estática) o isotónicos (dinámica). Además, el tipo y la cantidad de entrenamiento, cuando se entrene para un deporte, son muy importantes. La cantidad de ejercicio debe adaptarse gradualmente a la tolerancia real al ejercicio y el nivel anticipado de rendimiento de cada persona.
4.2Recomendaciones de ejercicio para pacientes con factores de riesgo cardiovascular4.2.1Introducción generalEl ejercicio tiene un efecto positivo en diversos factores de riesgo de ateroesclerosis6. El ejercicio regular reduce el riesgo de muchos desenlaces adversos independientemente de la edad, el sexo, la etnia o las posibles comorbilidades. De hecho, existe una relación dosis-efecto entre el ejercicio y la mortalidad CV total, con una reducción del 20-30% de los eventos adversos en comparación con personas sedentarias107,108. Por ello, la guía europea recomienda que las personas sanas de todas las edades realicen 150 min de ejercicio de resistencia moderado distribuidos en 5 días a la semana o 75 min de ejercicio vigoroso distribuidos en 3 días a la semana, con beneficios derivados de duplicar la cantidad a 300 min de intensidad moderada o 150 min/semana de AF aeróbica vigorosa6.
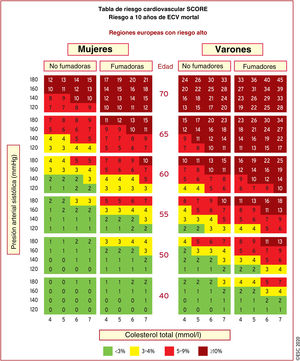
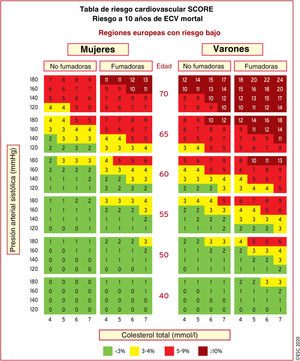
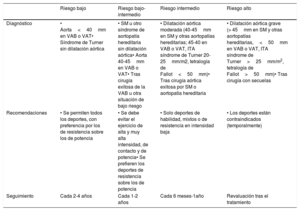
Mientras que el ejercicio también es beneficioso para pacientes con ECV establecida, el riesgo asociado con el ejercicio a los deportes vigorosos en estos pacientes se ve aumentado. Es necesario subrayar que la ECV puede ser subclínica y asintomática, por lo que se deben considerar las evaluaciones preparticipativas para los pacientes con mayor probabilidad de ECV. Es más probable que las personas con múltiples factores de riesgo contraigan una ECV. La probabilidad individual de ECV subclínica puede determinarse calculando el riesgo acumulado mediante índices de riesgo tales como las tablas SCORE (figura 3) y tomando en consideración los factores de riesgo individuales como valores de colesterol total altos y de lipoproteínas de baja densidad (LDL) bajos, diabetes mellitus o importantes antecedentes familiares de ECV6. Con base en esta evaluación, el riesgo CV puede categorizarse de bajo a muy alto (tabla 5).
Categorías de riesgo cardiovascular.
| Riesgo muy alto | Personas con alguna de las siguientes:• ECVA documentada, ya sea clínica o por imagen inequívoca. La ECVA documentada incluye SCA previos (infarto de miocardio o angina inestable), angina estable, revascularización coronaria (ICP, CABG y otros procedimientos de revascularización arterial), ictus y AIT y enfermedad arterial periférica. La ECVA documentada por imagen inequívoca incluye los hallazgos predictivos de eventos clínicos, como placas significativas por coronarioangiografía o TC (enfermedad multivaso con 2 arterias epicárdicas mayores con estenosis > 50%) o por ecografía carotídea• La DM con daño orgánico específico o al menos 3 factores de riesgo mayores o DM1 de inicio temprano y larga duración (> 20 años)• Una puntuación SCORE ≥ 10% para el riesgo a 10 años de ECV mortal• Hipercolesterolemia familiar con ECVA o con otro factor de riesgo mayor |
|---|---|
| Riesgo alto | Personas con:• Factores de riesgo individuales muy marcados, en particular colesterol total > 8mmol/l (> 310mg/dl), cLDL > 4,9mmol/l (> 190mg/dl) o PA ≥ 180/110mmHg• Pacientes con IC sin otros factores de riesgo mayores• Pacientes diabéticos sin daño orgánico específico, con duración de la DM ≥ 10 años u otro factor de riesgo adicional• ERC moderada (TFGe 30-59ml/min/1,73 m2)• Una puntuación SCORE ≥ 5% y<10% para el riesgo de ECV mortal a 10 años |
| Riesgo moderado | Pacientes jóvenes (DM1, edad < 35 años; DM2, < 50 años) con DM de duración < 10 años y sin otros factores de riesgoSCORE calculado ≥ 1% y < 5% para el riesgo de ECV mortal a 10 años |
| Riesgo bajo | SCORE calculado<1% para el riesgo de ECV mortal a 10 años |
AIT: accidente isquémico transitorio; CABG: cirugía de revascularización coronaria; cLDL: colesterol unido a lipoproteínas de baja densidad; DM: diabetes mellitus; ECV: enfermedad cardiovascular; ECVA: enfermedad cardiovascular ateroesclerótica; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; PA: presión arterial; SCA: síndrome coronario agudo; TC: tomografía computarizada; TFGe: tasa de filtrado glomerular estimada.
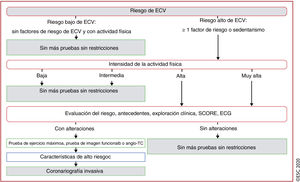
La evaluación preliminar debe consistir en una autoevaluación de los síntomas y el cálculo de la puntuación SCORE. A las personas generalmente activas y con riesgo de bajo a moderado, no se les debería aplicar ninguna restricción al ejercicio, incluidos los deportes de competición. Las personas sedentarias o con alto y muy alto riesgo pueden realizar ejercicio a baja intensidad sin ninguna evaluación adicional. Las personas sedentarias o con riesgo alto o muy alto que planeen un ejercicio de alta intensidad o participar en ejercicio de moderado a intenso deberían someterse a una exploración clínica, un ECG de 12 derivaciones y una ergometría. El objetivo de la ergometría es identificar EC de importancia pronóstica y evaluar la presencia de arritmias inducidas por el ejercicio. A las personas con síntomas o alteraciones durante la exploración clínica, anomalías electrocardiográficas o ergometría anormal, se las debería examinar en mayor profundidad siguiendo la GPC de la ESC para síndromes coronarios crónicos110. Si tales exámenes resultaran normales, no deberían imponerse restricciones a la práctica deportiva. Sin embargo, se debería informar a todas las personas de que la aparición de síntomas durante el ejercicio motivaría una nueva evaluación.
Mientras que una ergometría normal y una alta capacidad para el ejercicio se asocian con un buen pronóstico, esta prueba tiene poca sensibilidad para el diagnóstico de EC obstructiva leve-moderada111,112. Actualmente no hay evidencia para la incorporación sistemática de pruebas de imagen cardiacas en las revisiones preparticipativas de personas asintomáticas mayores de 35 años con una ergometría normal. Sin embargo, para los adultos asintomáticos considerados en alto o muy alto riesgo (diabetes, antecedentes familiares de EC importantes, evaluación anterior que apunta a alto riesgo de EC), se deberían considerar pruebas de imagen funcionales o una angiotomografía computarizada coronaria (ATCC) para la evaluación del riesgo (figura 4)110. La identificación de EC ateroesclerótica debería conllevar un tratamiento agresivo de los factores de riesgo y tratamiento médico preventivo. Están indicados nuevos exámenes y tratamiento para las personas con EC demostrada.
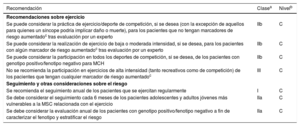
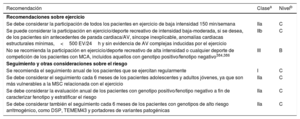
Recomendaciones generales sobre el ejercicio y el deporte para personas sanas
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomiendan al menos 150min/semana de ejercicio de intensidad moderada o 75 min/semana de ejercicio aeróbico de intensidad vigorosa o una combinación equivalente para todos los adultos sanos113–118 | I | A |
| Se recomienda un aumento gradual del ejercicio aeróbico de intensidad moderada hasta 300 min/semana y 150 min/semana de ejercicio aeróbico de intensidad vigorosa o una combinación equivalente de ambos para beneficios adicionales en adultos sanos114,116 | I | A |
| Se recomienda evaluación frecuente y asesoramiento para promocionar la adherencia y, si fuese necesario, apoyar un aumento en el volumen de ejercicio con el paso del tiempo119 | I | B |
| Se recomiendan múltiples sesiones de ejercicio distribuidas a lo largo de la semana, p. ej., 4-5 días/semana y preferiblemente cada día de la semana113,114 | I | B |
aClase de recomendación.
bNivel de evidencia.
Recomendaciones sobre la evaluación cardiovascular y el ejercicio regular para pacientes sanos mayores de 35 años
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la participación en actividades recreativas sin ninguna evaluación CV de las personas con riesgo de ECV de bajo a moderado | IIa | C |
| Se debe considerar el cribado cardiaco en deportistas de competición con antecedentes familiares de síntomas, junto con exploración clínica y ECG de 12 derivaciones en reposo | IIa | C |
| Se debe considerar una evaluación clínica que incluya ergometría de esfuerzo máximo con propósitos pronósticos para las personas sedentarias o con riesgo CV alto o muy alto que quieran participar en programas de ejercicio intensos o deportes de competición | IIa | C |
| Se puede considerar la evaluación del riesgo con pruebas de imagen funcionales, ATCC coronaria o ecografía carotídea o de la arteria femoral para determinadas personas sin EC conocida con riesgo de ECV muy alto (p. ej., SCORE > 10%, antecedentes familiares relevantes o hipercolesterolemia familiar) que quieran participar en ejercicio de alta o muy alta intensidad | IIb | B |
ATCC: angiotomografía computarizada coronaria; CV: cardiovascular; ECV: enfermedad cardiovascular; SCORE: Systematic Coronary Risk Evaluation.
aClase de recomendación.
bNivel de evidencia.
Se considera obesas a las personas con un índice de masa corporal (IMC) > 30 o (preferiblemente) con una circunferencia abdominal > 94cm los varones y > 80cm las mujeres (ambos valores, para europeos de raza blanca)120,121.
La guía europea para personas obesas recomienda un mínimo de 150min/semana de ejercicio de resistencia en combinación con 3 sesiones de ejercicio de fuerza121. Esta intervención conlleva la reducción de la grasa intraabdominal, aumenta la masa muscular y ósea, atenúa el declive del gasto en reposo inducido por la pérdida de peso, reduce la PA y la inflamación crónica y aumenta la tolerancia a la glucosa, la sensibilidad a la insulina, el perfil lipídico y la forma física121,122. También tiene un impacto positivo en mantener la reducción de peso a largo plazo, el bienestar general y la autoestima y la ansiedad y la depresión121. El efecto de una sola intervención de ejercicio en la masa lipídica es moderado123. Según una serie de grandes ensayos aleatorizados controlados, se requiere un alto volumen de ejercicio de resistencia, > 225min/semana, para maximizar la pérdida de tejido graso en obesos124.
Es obligatoria la evaluación CV preparticipativa de los pacientes obesos que quieran realizar ejercicio de alta intensidad (figura 4), debido a comorbilidades como diabetes mellitus tipo 2 (DM2), hipertensión, dislipemia y enfermedades CV y respiratorias121. Los pacientes con obesidad y una evaluación CV normal no deberían tener impedimento para el ejercicio. Hay evidencia de personas sanas, sin obesidad y sin forma atlética a las que correr y los aumentos abruptos del volumen de entrenamiento han causado lesiones osteomusculares125–127. Por lo tanto, parece razonable considerar que las personas obesas limiten el ejercicio de alto volumen con carga(s) sobre una superficie dura (p. ej., < 2h/día) hasta que se consiga una reducción considerable de la masa corporal. Más aún, si desean llevar a cabo un alto volumen de ejercicio (> 2h/día), se debe dejar periodos de recuperación suficientes entre los periodos de ejercicio (idealmente, 48 h). Es importante subrayar que una buena forma física y muscular y una buena coordinación neuromuscular pueden proteger a los pacientes obesos de lesiones osteomusculares, de modo que ejercicios sin carga, como el ciclismo o la natación128, pueden ser beneficiosos. Por último, no hay evidencia concluyente de que el entrenamiento de fuerza, realizado apropiadamente, vaya a aumentar el riesgo de lesiones osteomusculares o cause síntomas osteomusculares en personas obesas129.
4.2.3HipertensiónA una persona se la considera hipertensa con PA sistólica (PAS) persistente ≥ 140mmHg o PA diastólica (PAD) ≥ 90 mmHg130,131. Las personas hipertensas deben realizar al menos 30min de ejercicio aeróbico dinámico de moderado a intenso (caminar, jogging, ciclismo o natación) entre 5 y 8 días a la semana132. Estas intervenciones en el ejercicio se asocian con una reducción media de 7 mmHg en la PAS y 5 mmHg en la PAD133. El entrenamiento de fuerza adicional es muy eficaz para una mayor reducción de la PA, y el entrenamiento de fuerza 2-3 días a la semana también se recomienda132. De hecho, los efectos hipotensores del ejercicio de fuerza e isométrico pueden compararse o ser incluso mejores que los del ejercicio aeróbico134.
Si se desea practicar deportes de alta intensidad, una evaluación CV preparticipativa está indicada para identificar a los deportistas con síntomas inducidos por el ejercicio, una respuesta exagerada de la PA al ejercicio130 y un daño orgánico específico. Las personas con síntomas que indican EC requieren más evaluaciones y la optimización del tratamiento médico antes de la práctica deportiva. Si la hipertensión arterial está mal controlada (PAS en reposo>160mmHg), la ergometría en esfuerzo máximo debe posponerse hasta que la PA esté controlada.
Las medidas no farmacológicas deben considerarse como el primer paso para el control de la hipertensión de los deportistas: restricción de la ingesta de sal y alcohol, reducción del peso si corresponde0, dieta equilibrada (p. ej., dieta mediterránea) y cese de tabaquismo. Los programas de ejercicio aeróbico, por lo tanto, deben complementar el plan de entrenamiento de cada persona131. Si estos cambios en el estilo de vida no han disminuido la PA en 3 meses, se debe comenzar el tratamiento con fármacos antihipertensivos si la PAS persiste > 140mmHg. Los tratamientos antihipertensivos junto con la intervención en el estilo de vida deben considerarse para toda persona de edad > 65 pero < 80 años siempre que la tolerancia sea buena131,132. Es importante recordar que los bloqueadores beta están prohibidos en ciertos deportes de habilidad como el tiro (consúltese la lista completa en la World Anti-Doping Association [WADA]135) y pueden inducir bradicardia o disminuir la capacidad de ejercicio aeróbico131. Los diuréticos están prohibidos en todos los deportes de competición135. Los inhibidores de la enzima de conversión de la angiotensina (IECA), los antagonistas del receptor de la angiotensina II (ARA-II) y los antagonistas del calcio son los fármacos de elección para adultos que realizan ejercicio. Debe señalarse que los fármacos antiinflamatorios no esteroideos no selectivos tomados para el dolor osteomuscular pueden contribuir a un aumento de la PA136.
Cuando la PA está descontrolada, se recomienda la restricción temporal de deportes de competición, con la posible excepción de los deportes de habilidad131. Para las personas con perfil de alto riesgo, como aquellas con daño orgánico específico (hipertrofia ventricular izquierda [HVI]), disfunción diastólica, evidencia ecocardiográfica de engrosamiento de la pared arterial o placas ateroescleróticas, retinopatía hipertensiva, aumento de la creatinina sérica [varones, 1,3-1,5mg/dl; mujeres, 1,2-1,4mg/dl] o microalbuminuria) que tengan controlada la PA, la participación en todos los deportes de competición es posible, con la excepción de las disciplinas deportivas de gran potencia, como lanzamiento de disco/jabalina, lanzamiento de peso y levantamiento de pesas (véase la sección 4.1)131.
Se recomienda un seguimiento regular durante la práctica deportiva dependiendo de la gravedad de la hipertensión y la categoría de riesgo. Para las personas con hipertensión lábil, se debe considerar una evaluación regular de la PA ambulatoria. Para los pacientes con riesgo CV bajo o moderado y PA controlada, no debe haber restricciones para la práctica deportiva, pero la halterofilia con grandes pesos, especialmente cuando incluya trabajo muscular sustancial (isométrico), puede tener un marcado efecto hipertensor y debe evitarse. En este contexto, es imprescindible evitar la maniobra de Valsalva, en particular porque contener la respiración durante la contracción muscular se asocia con mayores aumentos de la PAS y la PAD135. Cuando se ejecuta correctamente, el entrenamiento de fuerza dinámico de alta intensidad (hasta el 80% de 1 RM) con un bajo número de repeticiones (< 10) no produce grandes aumentos en la PA en comparación con el entrenamiento de fuerza dinámico de baja resistencia (< 50% de 1 RM) con un alto número de repeticiones (≥ 20)137–142.
Algunas personas normotensas en reposo tienen una respuesta exagerada de la PA al ejercicio. Una respuesta exagerada de la PA al ejercicio aumenta el riesgo a medio plazo de accidente hipertensivo en deportistas muy entrenados y normotensos143. Si la PAS aumenta a > 200mmHg con una carga de trabajo de 100 W durante la ergometría144, el tratamiento médico antihipertensivo debe optimizarse y debe considerarse una evaluación clínica que incluya ECG y ecocardiografía, incluso si el deportista es normotenso en reposo131. Más aún, en deportistas olímpicos jóvenes, una PAS máxima en el cicloergómetro > 220mmHg en varones y > 200mmHg en mujeres están por encima del percentil 95131.
4.2.4DislipemiasLa actividad física tiene efectos favorables en el metabolismo lipídico al reducir los triglicéridos séricos hasta en un 50% y aumentar el colesterol unido a lipoproteínas de alta densidad (HDL) en un 5-10%85,145. El ejercicio también puede reducir la fracción de colesterol unido a LDL (cLDL) hasta en un 5% y convertir las fracciones de LDL más pequeñas y densas en partículas de LDL de modo dependiente de la dosis146. Estas mejoras metabólicas pueden conseguirse con 3,5-7 h/semana de AF de intensidad moderada o 30-60min de ejercicio la mayoría de los días.
Para los pacientes con hipertrigliceridemia o hipercolesterolemia, se recomienda una intensidad de ejercicio mayor, ya que puede mejorar el perfil lipídico y reducir el riesgo CV. Antes de participar en ejercicio de alta intensidad, se debe llevar a cabo una evaluación clínica que incluya el estado sintomático y una ergometría máxima, pruebas de imagen funcionales o ATCC para la evaluación del riesgo110 (figura 4), especialmente en personas con hipercolesterolemia familiar. Entre los deportistas con hipercolesterolemia, en la mayoría de los casos el ejercicio regular no reducirá el cLDL a cifras normales o limítrofes, por lo que se debe seguir estrictamente las recomendaciones sobre el tratamiento farmacológico para la prevención primaria y secundaria. Las personas con dislipemia deben someterse a evaluaciones al menos cada 2-5 años para prevención primaria y cada año para prevención secundaria.
La intervención farmacológica, particularmente con estatinas, es superior al ejercicio y las intervenciones en el estilo de vida por sí solas para la reducción del cLDL y la mejora del pronóstico147. A pesar de los escasos efectos del ejercicio de fuerza en el cLDL sérico, la beneficiosa relación clínica entre la mejora de la forma física y la reducción de riesgos CV prevalece al efecto de las estatinas147,148.
Los dislipémicos físicamente activos pueden sentir dolor muscular e inflamación o tendinopatías acompañadas de aumento de las enzimas musculares149. En estos casos, se deben considerar medidas como la interrupción temporal de la medicación seguida de exposición a otra estatina con o sin un régimen de día alterno o introducir otros agentes hipolipemiantes como la ezetimiba o los inhibidores de la PCSK-9109. En caso de rabdomiolisis por estatinas, se debe prescribir otros agentes hipolipemiantes.
4.2.5Diabetes mellitusLa inactividad física es la principal causa de DM2150. El riesgo de contraer DM2 es un 50-80% más alto para las personas físicamente inactivas que para las activas. Sin embargo, el ejercicio no compensa totalmente el efecto de la obesidad151–154. La diabetes también se asocia de manera independiente con un declive acelerado de la fuerza muscular y, en parte por la hipoglucemia, puede llevar a una reducción de la movilidad articular.
4.2.5.1Efecto del ejercicio en el control diabético, factores de riesgo y desenlaces clínicosEl ejercicio aeróbico mejora el control glucémico y reduce la grasa visceral y la resistencia a la insulina de los pacientes con DM2. El ejercicio también tiene efectos beneficiosos en la PA y el perfil lipídico y conlleva una pérdida de peso moderada155,156. Tanto el entrenamiento aeróbico como el de fuerza favorecen adaptaciones prolongadas del músculo esquelético, el tejido adiposo y el hígado asociadas con la acción aumentada de la insulina157. Estudios observacionales también han demostrado menor mortalidad con el ejercicio de pacientes con DM1 y DM2158.
En pacientes con prediabetes o síndrome metabólico, el ejercicio aeróbico y el ejercicio de fuerza pueden prevenir la evolución a diabetes159–162. La intensidad del ejercicio parece tener gran importancia en el volumen de ejercicio; las personas que hacen ejercicio de intensidad moderada o alta tienen menos riesgo de deficiencia metabólica que quienes tienen un gasto energético similar a menor intensidad160,163.
Los efectos en la sensibilidad muscular a la insulina se observan con un volumen de ejercicio relativamente bajo (400kcal/semana) en adultos antes sedentarios, pero aumenta a mayores volúmenes de ejercicio164. La combinación óptima de duración e intensidad no está bien establecida. El entrenamiento de intervalos de alta intensidad (HIIT) puede ser superior al entrenamiento aeróbico moderado en la obtención de efectos metabólicos y la mejora de la capacidad de ejercicio. Sin embargo, se desconoce si los resultados a largo plazo son superiores165,166.
La diabetes es una de las causas de disfunción coronaria microvascular, que se asocia con una menor capacidad para el ejercicio y resultados adversos167,168 y puede mejorarse con ejercicios de entranamiento162,169–171. Grandes ensayos aletorizados han confirmado los efectos beneficiosos de las intervenciones con ejercicio en el control glucémico y los factores de riesgo, que no se han traducido en un aumento significativo de la supervivencia, en parte por el deficiente mantenimiento a largo plazo de los cambios en el estilo de vida172.
Durante una sesión de ejercicio intenso, la absorción de glucosa en los músculos aumenta hasta 2 h después de la sesión por mecanismos independientes de la insulina. El efecto hipoglucémico inducido por el ejercicio puede disminuirse con entrenamiento de fuerza o entrenamiento a intervalos en pacientes con DM1173. Existe una relación dosis-respuesta entre la intensidad y el volumen de ejercicio y la duración de la captación de glucosa por el músculo esquelético que puede mantenerse hasta 48 h tras el ejercicio. Estos factores deben considerarse en pacientes diabéticos que participan en ejercicios intensos o deportes de competición para evitar hipoglucemias.
4.2.5.2Recomendaciones sobre la práctica de ejercicio para pacientes con diabetes mellitusTanto el entrenamiento aeróbico como el de fuerza son efectivos para el control glucémico, la reducción de la PA, la pérdida de peso, la capacidad máxima de ejercicio y la dislipemia174. Los programas que combinan entrenamiento aeróbico y de fuerza se han demostrado superiores en control glucémico, mientras que el efecto en otros desenlaces no se ha probado174–176.
El programa de ejercicio ideal para que los pacientes diabéticos consigan los mayores beneficios potenciales es el ejercicio diario de intensidad al menos moderada, como caminar ligero durante al menos 30 min, un entrenamiento de fuerza durante 15 min la mayoría de los días y actividades de menor intensidad (estar de pie, caminar) cada 30 min. Estos se pueden complementar con ejercicios de flexibilidad y equilibrio, especialmente para personas mayores o pacientes con complicaciones microvasculares derivadas de la diabetes.
4.2.5.3Evaluación cardiaca antes de la práctica de ejercicio para pacientes con diabetes mellitusA priori, los pacientes diabéticos tienen una mayor probabilidad de EC subclínica, por lo que toda persona con diabetes debe someterse a evaluaciones CV, como se indica en la figura 4, antes de iniciar programas de ejercicio de alta intensidad. Esto debería complementarse con una evaluación del estado glucémico que incluya factores de riesgo como hipoglucemia, antecedentes de episodios hipoglucémicos, presencia de neuropatías autonómicas y tratamiento antidiabético177.
Los diabéticos asintomáticos con evaluación CV y ergometría máxima normales pueden practicar deportes, pero se les debería advertir sobre el riesgo de hipoglucemia iatrogénica en caso de una ingesta calórica deficiente. Más importante aún, los pacientes diabéticos deben conocer los síntomas de alerta y deben prestar especial atención al dolor torácico o la disena inusual durante el ejercicio, ya que pueden ser indicio de EC.
Consideraciones especiales para pacientes con obesidad, hipertensión, dislipemias o diabetes
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para las personas obesas (IMC ≥ 30 o circunferencia abdominal > 80cm las mujeres o > 94cm los varones), se recomienda el entrenamiento de fuerza al menos 3 veces por semana, además de ejercicio aeróbico de moderado a vigoroso (al menos 30 min 5-7 días por semana) para reducir el riesgo de ECV121 | I | A |
| Para personas con buen control de la hipertensión, se recomienda el entrenamiento de fuerza al menos 3 veces por semana, además de ejercicio aeróbico de moderado a vigoroso (al menos 30 min 5-7 días por semana) para disminuir la presión arterial y el riesgo de ECV132 | I | A |
| Para personas diabéticas, se recomienda el entrenamiento de fuerza al menos 3 veces por semana además de ejercicio aeróbico de moderado a vigoroso (al menos 30 min 5-7 días por semana) para mejorar la sensibilidad a la insulina y el perfil de riesgo de ECV176,178 | I | A |
| Para los adultos con buen control de la hipertensión pero riesgo alto o daño orgánico específico, no se recomienda el ejercicio de fuerza de alta intensidad | III | C |
| Para personas con hipertensión descontrolada (PAS>160mmHg), no se recomienda el ejercicio de alta intensidad hasta que no se controle la presión arterial | III | C |
ECV: enfermedad cardiovascular; PAS: presión arterial sistólica.
aClase de recomendación.
bNivel de evidencia.
Se define como adulto mayor al de edad > 65 años. Al igual que en la población general, una mayor capacidad de ejercicio también se asocia en este grupo de edad con una reducción de la mortalidad179. Un estilo de vida físicamente activo que se mantiene en la mediana y la tercera edad se traduce en mejor salud180 y más longevidad181–185. El inicio de un nuevo programa de ejercicio por adultos mayores sedentarios ha demostrado mejoras significativas en la salud180,186, incluida la capacidad cognitiva187–190. Más aún, el ejercicio regular supera los efectos beneficiosos y reduce el riesgo de ECV y enfermedad metabólica gracias a una mejora del control de los factores de riesgo CV191,192, mientras se conserva la función cognitiva187–190. Además, el ejercicio también ayuda a conservar la competencia neuromuscular193,194, con lo que se mantienen el equilibrio y la coordinación y se reduce el riesgo de caídas195,196.
4.3.2Estratificación del riesgo, criterios de inclusión/exclusiónEl ejercicio de intensidad moderada generalmente es seguro para los adultos mayores sanos y no se suele requerir una consulta médica antes de comenzar o avanzar en el nivel del programa de ejercicio81,197. La recomendación general sobre la implementación de ejercicio para la población general también se aplica al adulto mayor sano.
Sin embargo, debido a los riesgos potenciales del ejercicio para la población mayor (tabla 6), la European Association of Preventive Cardiology (EAPC) recomienda la autoevaluación con un breve cuestionario81 para determinar la necesidad de asesoramiento por parte de profesionales de la salud, pero este enfoque no se ha probado prospectivamente.
Los adultos frágiles en comunidades de mayores o sedentarios pueden tener un riesgo de caídas durante el ejercicio ligeramente aumentado. Sin embargo, no existen evidencias de resultados adversos serios, lesiones o eventos CV195,196,198,199. Las intervenciones con ejercicio para mejorar el equilibrio para pacientes con diagnóstico de demencia tienen numerosos beneficios sin un aumento del riesgo de resultados adversos200. El ejercicio de fuerza en personas mayores raramente se asocia con eventos adversos201,202. No se ha informado de riesgos importantes para los adultos mayores que realizan ejercicio aeróbico de intensidad baja-moderada e incluso actividades aeróbicas más intensas se asocian con un riesgo relativamente bajo203–205. Los eventos CV durante el ejercicio intenso tienen una tasa de aproximadamente 1 evento/100 años de actividad vigorosa206. El riesgo es más alto durante las primeras semanas tras el inicio del ejercicio vigoroso, por lo que la intensidad y la duración del ejercicio deberían aumentar ligeramente (p. ej., cada 4 semanas)81,197,207–210. Para los adultos mayores bien preparados y con experiencia en ejercicio intenso, la práctica intensa de deportes de competición no conlleva mayor riesgo que para los adultos jóvenes38,211.
4.3.3Modalidades de ejercicio y recomendaciones sobre el ejercicio y el deporte para pacientes de edad avanzadaLos ejercicios físicos para personas de edad avanzada deberían diseñarse tomando en consideración la edad biológica, la experiencia ejercitándose, la capacidad funcional, la seguridad, la trayectoria de envejecimiento, las comorbilidades, los hábitos y el estilo de vida y la experiencia previa con el ejercicio.
Las personas de edad avanzada deberían realizar ejercicio de resistencia y fuerza y ejercicios específicos para la flexibilidad y el equilibrio (tabla 7)211,212,213. Los ejercicios de resistencia tienen efectos beneficiosos en el sistema cardiorrespiratorio y los ejercicios de fuerza previenen la disminución de la masa muscular y la sarcopenia.192 El objetivo de más de 150min/semana de ejercicio aeróbico moderado-intenso (p. ej., caminar u otros tipos de ejercicio aeróbico de intensidad moderada) se asocian con una reducción de al menos el 30% en la morbilidad, la mortalidad, la discapacidad, la fragilidad y la demencia en comparación con la inactividad212,214,215. Los ejercicios de fuerza para los mayores grupos musculares deben llevarse a cabo al menos 2 veces a la semana (8-10 ejercicios diferentes, 10-15 repeticiones).
Recomendaciones de ejercicio para personas de edad avanzada.
| Trabajo aeróbico• Frecuencia: ejercicio moderado 5 días a la semana o ejercicio vigoroso 3 días a la semana• Intensidad: 5-6 puntos (de los 10 puntos de la escala Borg modificada) para ejercicio moderado, 7-8 para vigoroso• Duración: 30min al día de ejercicio moderado o al menos 20 min de ejercicio continuo |
|---|
| Entrenamiento de fuerza (todos los grandes grupos musculares)• Frecuencia: al menos 2 veces a la semana• Número de ejercicios: 8-10• Número de repeticiones: 10-15 |
| Ejercicios para la flexibilidad y el equilibrio• Al menos 2 veces a la semana |
Los deportistas mayores acostumbrados al deporte deben continuar el ejercicio y las actividades deportivas sin ningún límite de edad predeterminado38,211,216. Las actividades deportivas para personas mayores según el tipo de ejercicio y la intensidad se reflejan en la tabla 8. Para los deportistas veteranos con un alto nivel deportivo y programas de ejercicio, se recomiendan las evaluaciones clínicas anuales que incluyan ergometría máxima (preferiblemente con PECP simultánea)217.
Actividades para personas mayores según el tipo y la intensidad del ejercicio.
| Actividades de esfuerzo moderado relacionadas con la edad• Caminar• Aeróbic acuático• Baile de salón y baile en línea• Montar en bicicleta por terreno llano o con pocas colinas• Tenis doble• Empujar el cortacésped• Piragüismo• Vóleibol |
|---|
| Actividades de esfuerzo intenso relacionadas con la edad• Jogging o correr• Aeróbic• Nadar rápido• Montar en bicicleta rápido o en terreno con colinas• Tenis individual• Fútbol• Caminar cuesta arriba• Bailar enérgicamente• Artes marciales |
| Actividades de fortalecimiento muscular• Llevar o transportar cargas pesadas• Hacer recados que impliquen subir escaleras y saltar• Baile• Jardinería intensa que implique cavar o el uso de palas• Ejercicios que utilicen el peso corporal como resistencia, como flexión de codos o abdominales• Yoga• Pilates• Levantamiento de pesas |
Recomendaciones sobre ejercicio para adultos mayores
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los adultos mayores de edad ≥ 65 años o en buena forma y sin problemas de salud que limiten su movilidad, se recomienda el ejercicio aeróbico de intensidad moderada al menos 150min/semana212,214,215 | I | A |
| Para los adultos mayores con riesgo de caídas, se recomiendan ejercicios de entrenamiento de fuerza para mejorar el equilibrio y la coordinación al menos 2 días a la semana201,212,214,215 | I | B |
| Se debe considerar una evaluación clínica completa con ergometría máxima para los adultos mayores de 65 años sedentarios que quieran participar en actividades de alta intensidad | IIa | C |
| La continuación de actividades de intensidad alta y muy alta, como los deportes de competición, puede considerarse para los deportistas de edad avanzada asintomáticos (deportistas veteranos) con un riesgo CV bajo o moderado | IIb | C |
CV: cardiovascular.
aClase de recomendación.
bNivel de evidencia.
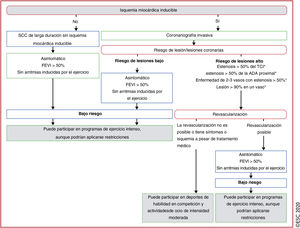
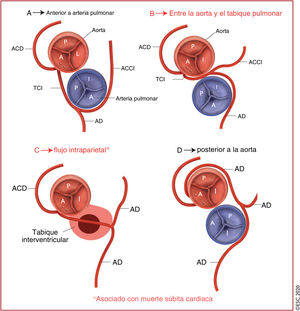
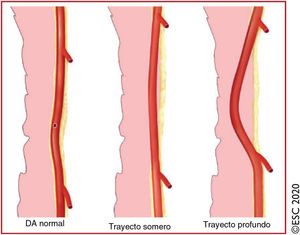
La EC ateroesclerótica es la principal causa de eventos cardiacos relacionados con el ejercicio como el SCA, el infarto de miocardio y la PSC en pacientes con síndrome coronario crónico (SCC) establecido o MSC como principal presentación en personas mayores de 35 años218. Además de la EC ateroesclerótica, otras enfermedades como el origen anómalo de las arterias coronarias (OAAC)219, el trayecto intramiocárdico220 y la disección coronaria espontánea (DCE)221 también se asocian con isquemia miocárdica y, potencialmente, MSC relacionada con el ejercicio.
La inactividad física es un factor de riesgo de EC pero, paradójicamente, el esfuerzo físico vigoroso aumenta transitoriamente el riesgo de IAM66 y MSC216. En general, los beneficios del ejercicio regular superan con creces los riesgos relacionados con el ejercicio, incluso en pacientes con SCC. El ejercicio de intensidad moderada a vigorosa está estrechamente asociado con una reducción en la incidencia de resultados adversos en la EC, pero el ejercicio prolongado de resistencia en alta intensidad se ha asociado con un aumento del calcio arterial coronario (CAC), un marcador de ateroesclerosis58,222, y placas coronarias58, pero sin aumento de la mortalidad112 a medio plazo. Además, el diagnóstico de lesión miocárdica es más complejo en deportistas porque el ejercicio intenso puede aumentar los marcadores séricos de lesión miocárdica, también las troponinas cardiacas I y T223,224.
5.1.1Pacientes con riesgo de enfermedad coronaria ateroesclerótica y pacientes asintomáticos en los que se detecta enfermedad coronaria durante el cribadoLos deportistas o personas que practican deportes o hacen ejercicio regularmente pueden tener factores de riesgo de EC o SCC subclínicos225. Se puede identificar a estas personas durante las revisiones preparticipativas habituales como recomienda la ESC21 o en la preevaluación en caso de deportistas veteranos, como propusieron la European Association for Cardiovascular Prevention and Rehabilitation (EACPR) en 2011207 y la AHA.226
Además de la estratificación del riesgo con SCORE ya descrita (tabla 5), el aumento del uso de técnicas de imagen cardiaca permite la identificación de un mayor número de personas con SCC asíntomático227, incluidos los deportistas de competición veteranos227.
Las medidas de predicción más recientes, tales como la proteína C reactiva de alta sensibilidad y el grosor intimomedial (GIM) carotídeo, no aportan mucho a los factores de riesgo tradicionales110. La excepción es el CAC, que proporciona información adicional predictiva en personas con un perfil de riesgo moderado228 al categorizarlas como de bajo o alto riesgo. El método más prudente y rentable de emplear el CAC puede ser agregarlo a los factores de riesgo tradicionales229 como propone la EAPC230.
La evaluación clínica de personas asintomáticas con posible SCC asintomático debe incluir112 (figura 4):
- 1.
- 2.
Considerar la intensidad del programa de ejercicio deseado.
- 3.
Evaluación clínica, incluida ergometría.
- 4.
Pruebas diagnósticas adicionales para pacientes seleccionados.
Se puede esperar que muchas personas de mediana edad de la población general muestren algún grado de SCC asintomático durante la evaluación con técnicas de imagen. Las imágenes de anatomía coronaria por sí solas no proveen información relacionada con el flujo coronario y la reserva, que son importantes en la evaluación del riesgo de isquemia relacionada con el ejercicio o PSC/MSC, por lo que la evaluación funcional es necesaria. Diversos métodos de pruebas de esfuerzo (p. ej., bicicleta y cinta ergométrica), ecocardiografía de estrés, resonancia magnética cardiaca (RMC) con adenosina o dobutamina o tomografía por emisión de positrones (PET)/tomografía computarizada por emisión monofotónica (SPECT) se pueden utilizar para detectar isquemia miocárdica inducible231. La ecografía durante ergometría se prefiere para los deportistas porque no conlleva radiación ni administración de sustancias.
La ergometría es la prueba funcional con mayor disponibilidad y aporta información sobre la capacidad de ejercicio, la FC y la respuesta de la PA y detecta arritmias inducidas por el ejercicio2, pero tiene menos especificidad de isquemia miocárdica que otras pruebas funcionales, especialmente en personas asintomáticas y con bajo riesgo. Se recomienda llevar a cabo una ergometría máxima real232 (con o sin PECP) en la evaluación de pacientes con posible SCC asintomático que quieran participar o estén participando en ejercicio sistemático ya sea en deportes recreativos o de competición. La decisión de incluir pruebas de imagen en la primera ergometría depende de factores tales como el ECG basal (tabla 9) y la posibilidad de llevar a cabo pruebas de imagen funcionales en ciertos centros.
- •
Si la evaluación clínica con ergometría máxima es normal, una «EC relevante» se asume como poco probable (figura 4).
- •
En caso de resultados limítrofes o de difícil interpretación en la ergometría, se recomiendan pruebas de esfuerzo con imagen más específicas como la ecocardiografía de estrés, la RMC de perfusión o la SPECT. Dependiendo de la disponibilidad y la experiencia del equipo, se puede preferir la ergometría con SPECT y ecocardiografía o técnicas de imagen de perfusión nuclear que utilicen el ejercicio en lugar de estrés farmacológico.
- •
Si la ergometría es positiva, se debe llevar a cabo un angiograma coronario invasivo para confirmar la afección y la extensión y la gravedad de la EC (figura 4).
Las personas con riesgo de EC y los pacientes asintomáticos en quienes se detecte EC durante el cribado deben recibir un tratamiento intensivo de los factores de riesgo de ateroesclerosis6,131,132,202. Tomando en consideración los beneficios del ejercicio en la prevención primaria y secundaria del SCC6,234, se debería prohibir a las personas con factores de riesgo participar en deportes de competición solo cuando las pruebas funcionales indiquen que existe un riesgo importante de eventos adversos o cuando haya evidencia de evolución de la enfermedad durante las evaluaciones habituales233. Las recomendaciones de ejercicio deben personalizarse teniendo en cuenta la intensidad del ejercicio y la disciplina deportiva. La participación en disciplinas de resistencia, potencia y mixtas (véase las secciones 4.2 y 5.13) requiere por normal general un esfuerzo vigoroso que es más probable que induzca isquemia miocárdica, mientras que los deportes recreativos o el ejercicio deliberado recreativo permiten un mayor control del esfuerzo. Las personas con alto riesgo de EC aterosclerótica y los asintomáticos en quienes se detecte EC durante el cribado que participan en ejercicio intenso deben ser evaluadas anualmente con una ergometría máxima o con pruebas de imagen.
Recomendaciones sobre ejercicio para personas con riesgo de enfermedad coronaria ateroesclerótica o asintomáticas con detección de enfermedad coronaria durante el cribado
| Clasea | Nivelb | |
|---|---|---|
| Se debe evaluar individualizadamente la participación en todos los tipos de ejercicio, incluidos los deportes de competición, de los sujetos con SCC asintomático, definido como EC sin isquemia miocárdica inducible en las pruebas de imagen funcionales o ergometrías de estrés233 | IIa | C |
EC: enfermedad coronaria; SCC: síndrome coronario crónico.
aClase de recomendación.
bNivel de evidencia.
Se debe animar a todas las personas con SCC establecido (de larga duración) a seguir las recomendaciones mínimas de actividad física para la salud general y CV235. Esto se aplica a pacientes con angina estable, asintomáticos y sintomáticos estabilizados menos de 1 año tras el SCA o pacientes con revascularización reciente y sujetos asintomáticos y sintomáticos más de 1 año tras el diagnóstico inicial o la revascularización110. Las recomendaciones sobre el ejercicio intenso y la participación en la mayoría de los deportes de competición para personas asintomáticas con SCC de larga duración deben basarse en diversos factores determinados por la anamnesis, la ergometría o las pruebas funcionales por imagen y ecocardiografía (tabla10).
Factores que determinan el riesgo de eventos adversos durante el ejercicio intenso y los deportes de competición en pacientes asintomáticos con enfermedad coronaria crónica establecida.
| Tipo y nivel del deporte de competición |
|---|
| Estado de forma de cada paciente |
| Perfil de factores de riesgo cardiovascular |
| Presencia de isquemia miocárdica inducida por el ejercicio |
| Arritmias inducidas por el ejercicio |
| Evidencia de disfunción miocárdica |
Las personas con SCC establecida (de larga duración) sin anomalías en la ergometría máxima o las pruebas funcionales por imagen o sin función del VI reducida pueden considerarse en riesgo bajo de eventos adversos inducidos por ejercicio236–238 (tabla 11). Estas personas pueden participar en todos los deportes de competición individual (figura 5). Pueden aplicarse algunas restricciones a los deportes de alta intensidad, alta potencia o mixtos y para deportes de resistencia (véase la figura 2 y la sección 4.1.2) para adultos mayores (> 60 años) con SCC. Esto se debe a que la edad es un factor adicional predictivo de eventos adversos durante el ejercicio. No existen restricciones a los deportes de habilidad para los pacientes con bajo riesgo, independientemente de su edad (figura 2).
Características de alto riesgo de eventos cardiacos adversos inducidos por el ejercicio en pacientes con enfermedad coronaria ateroesclerótica233
| • Estenosis coronaria crítica,>70% en una gran arteria coronaria o>50% en la rama izquierda principal por coronariografía o RFF<0,8 o cociente diastólico instantáneo sin ondas<0,9 |
|---|
| • Fracción de eyección del ventrículo izquierdo basal ≤ 50% y anomalías en el movimiento de la pared |
| • Isquemia miocárdica inducible durante ergometría |
| • TVNS, extrasístoles polimórficas o muy frecuentes, en reposo o durante ergometría |
| • SCA±ICP o revascularización quirúrgica recientes (< 12 meses) |
ICP: intervención coronaria percutánea; RFF: reserva fraccional de flujo; SCA: síndrome coronario agudo; TVNS: taquicardia ventricular no sostenida.
Los pacientes con isquemia inducible en las pruebas funcionales a pesar de un tratamiento adecuado deben someterse a coronariografía; aquellas con alto riesgo de lesiones durante la coronariografía (tabla 11) deben someterse a revascularización antes de considerar programas de ejercicio de alta intensidad o deportes de competición (figura 5). Los pacientes con características de alto riesgo pueden retomar gradualmente la práctica deportiva a los 3-6 meses de una revascularización con éxito y con una ergometría máxima o pruebas funcionales por imagen normales.
Cuando la isquemia se resista al tratamiento adecuado, incluida la revascularización, se debe prohibir la participación en deportes de competición, con la posible excepción de recomendaciones caso a caso sobre deportes de baja intensidad y de habilidad. Estos pacientes pueden realizar habitualmente ejercicio recreativo de intensidad baja y media siempre que los factores de riesgo y los síntomas se traten adecuadamente y haya seguimiento clínico regular. Estas personas también pueden participar en deportes de ocio, 2-3 veces/semana en ciertos casos, si la actividad está por debajo (aproximadamente 10 latidos) del umbral isquémico y el umbral arrítmico231.
5.1.2.1Tratamiento antitrombóticoLas personas con EC deben recibir tratamiento antitrombótico convencional para la prevención secundaria, según las guías publicadas para la población general233,239,240. Los pacientes en tratamiento antiagregante plaquetario doble deben evitar todos los deportes con colisiones corporales, especialmente si es en combinación con anticoagulantes orales, debido al riesgo de hemorragia241.
Recomendaciones sobre ejercicio para pacientes con síndromes coronarios crónicos de larga duración
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Antes de la práctica de ejercicio, se recomienda la estratificación del riesgo de los eventos adversos inducidos por el ejercicio para pacientes con SCC establecido (de larga duración)233 | I | C |
| Se recomienda el seguimiento regular y la estratificación del riesgo de los pacientes con SCC establecido233 | I | B |
| Se recomienda tratar a las personas con alto riesgo de eventos adversos por EC siguiendo la guía sobre SCC establecido233 | I | C |
| Se deben considerar los deportes o actividades competitivas o de ocio (con algunas excepciones como deportistas mayores y deportes con demandas CV extremas) para los sujetos con bajo riesgo de eventos adversos inducidos por el ejercicio (tabla 11)233 | IIa | C |
| Se puede considerar el ejercicio de tiempo libre bajo los umbrales isquémicos y anginosos para los pacientes con alto riesgo de eventos adversos inducidos por el ejercicio (tabla11), incluidos aquellos con isquemia persistente233 | IIb | C |
| No se recomiendan los deportes de competición para pacientes con alto riesgo de eventos adversos inducidos por el ejercicio o con isquemia residual, con la excepción de deportes de habilidad recomendados de manera individualizada233 | IIc | C |
CV: cardiovascular; EC: enfermedad coronaria; SCC: síndrome coronario crónico.
aClase de recomendación.
bNivel de evidencia.
La isquemia y la enfermedad coronaria (EC) no obstructiva son una entidad infradiagnosticada que se asocia con un aumento de los efectos adversos242 y se detecta generalmente durante la evaluación de signos anginosos. La RMC de estrés y la PET pueden detectar la reserva de flujo coronario anormal e indicar disfunción coronaria microvascluar con lesiones no críticas. No existe tratamiento establecido para la angina microvascular. Sin embargo, el grupo de trabajo propone adherirse a las mismas recomendaciones de ejercicio que para la SCC establecido (de larga duración).
5.1.4Vuelta al ejercicio tras síndrome coronario agudoLa rehabilitación cardiaca basada en el ejercicio reduce la mortalidad cardiaca, las rehospitalizaciones234 y la ansiedad243. Se debería derivar lo más pronto posible a quienes hayan sufrido SCA, cirugía cardiaca o intervención percutánea a un programa de rehabilitación cardiaca basada en ejercicio poco después del alta6,235,244 8-12 semanas tras el evento cardiaco235,244. Cada semana de retraso en el ejercicio requerirá 1 mes más de ejercicio para conseguir el mismo nivel de beneficio245.
Las personas con EC que realizan ejercicio pueden participar en actividades deportivas recreativas de intensidad baja a moderada en paralelo con la participación en un programa de ejercicio progresivo estructurado. Se pueden considerar todos los tipos de deporte a una intensidad apropiada, pero se debe prestar especial atención a la aparición de nuevos síntomas218.
En general, los programas externos de ejercicio estructurado, durante 3-6 meses, son necesarios para que los pacientes con EC consigan el nivel apropiado de actividad para la práctica deportiva. Para las personas con IAMCEST o SCC con revascularización completa sin isquemia residual, el entrenamiento puede progresar a un ritmo más rápido hasta que se consiga el nivel de ejercicio recomendado.
5.1.4.1Deportistas de competiciónSe requiere una evaluación en profundidad antes de empezar la práctica de deportes de competición de alta intensidad. Para los deportistas de competición, se recomiendan un ecocardiograma, una ergometría máxima con ECG de 12 derivaciones o una PECP para la estratificación del riesgo antes de la vuelta a la práctica deportiva (véase la sección 5.1.2). La PECP específicamente añade información sobre los umbrales aeróbicos y anaeróbicos y guía la prescripción de la intensidad del ejercicio y su progresión (véase la sección 4.2).
5.1.4.2Deportistas recreativosPara las personas que deseen participar en deportes no competitivos y recreativos, así como actividades de ocio, se aplican principios similares sobre estratificación del riesgo. Una ergometría máxima/limitada por síntomas debería preceder a la práctica deportiva. Los pacientes en mayor riesgo con SCC (tabla11) no son aptos para los deportes de competición (véase la sección 5.1.2). Sin embargo, los deportes de habilidad de baja intensidad como el golf pueden ser una opción en niveles por debajo del umbral anginoso. Si el ejercicio aeróbico no se tolera, se recomiendan los deportes predominantemente de fuerza con poco trabajo muscular (figura 2 y sección 4.1.2).
Recomendaciones sobre la vuelta al ejercicio tras síndrome coronario agudo
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Se recomienda la rehabilitación cardiaca basada en el ejercicio para todas las personas con EC para reducir la mortalidad cardiaca y las rehospitalizaciones234 | I | A |
| Para los pacientes con EC, deben considerarse en las primeras etapas el apoyo motivacional y psicológico y las recomendaciones individualizadas sobre cómo aumentar la intensidad de las actividades deportivas | IIa | B |
| Deben considerarse todas las actividades deportivas con un nivel de intensidad individualizado para pacientes con bajo riesgo y SCC | IIa | C |
EC: enfermedad coronaria; SCC: síndrome coronario agudo.
aClase de recomendación.
bNivel de evidencia.
La prevalencia del OAAC (arterias coronarias izquierda y derecha) es del 0,44% de la población general adolescente246. El OAAC se considera una causa frecuente de MSC en deportistas jóvenes17,18,247,248, pero raramente se da en mayores de 40 años249,250.
Dolor torácico, episodios sincopales de esfuerzo y MSC pueden ser las primeras manifestaciones de un OAAC251; sin embargo, más de 2/3 pacientes están asintomáticos252. Los mecanismos que llevan a la MSC probablemente incluyen episodios de isquemia recurrentes, con la consiguiente progresión a fibrosis miocárdica y una proclividad a desarrollar AV durante el ejercicio. La isquemia puede ser el resultado de la compresión del flujo del vaso anómalo entre la aorta y la arteria pulmonar o de la salida con ángulo agudo de la aorta o del flujo proximal intraparietal del vaso anómalo (figura 6)253. Los OAAC izquierda y derecha están implicados en la MSC relacionada con el ejercicio, aunque tradicionalmente el riesgo se ha considerado más alto con un OAAC izquierda252. La ergometría raramente muestra isquemia miocárdica y la TC multicorte con contraste, la ATCC y la RMC son la base del diagnóstico.
5.1.5.2Aptitud para el deporteLa aptitud para los deportes de competición se basa en el tipo anatómico del OAAC y la presencia de isquemia. Una ergometría con gran positividad inotrópica y una ergometría cronotrópica positiva son las mejores pruebas para demostrar o descartar la isquemia. El OAAC con salida de la aorta con ángulo agudo que tiene como resultado un orificio con forma de hendidura con reducción de la luz y flujo anómalo entre la aorta y la arteria pulmonar se asocia con el mayor riesgo de PSC/MSC independientemente de si el OAAC está en el seno de Valsalva izquierdo o derecho, y se debe prestar especial atención a la corrección quirúrgica de esta anomalía en pacientes sintomáticos. Se desaconseja la práctica deportiva, más allá de los deportes de habilidad de baja intensidad, antes de una corrección con éxito e independientemente de los síntomas. No es posible aportar recomendaciones sobre ejercicio o deporte para pacientes mayores (> 40 años) con OAAC debido a la escasez de estudios. Sin embargo, el ejercicio recreativo de intensidad moderada parece razonable, aunque el ejercicio más vigoroso se debe abordar con más cautela.
Recomendaciones sobre ejercicio para pacientes/deportistas jóvenes con origen anómalo de las arterias coronarias
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la evaluación con pruebas de imagen para identificar los patrones de alto riesgo, así como una ergometría máxima para buscar isquemia cuando un paciente con OAAC considere participar en actividades deportivas | IIa | C |
| Se puede considerar la competición de los pacientes asintomáticos con OAAC que no afecte a los grandes vasos, sin orificio en forma de hendidura con reducción de la luz o flujo intraparietal tras un asesoramiento sobre los riesgos, siempre en ausencia de isquemia | IIb | C |
| Se puede considerar la participación en todos los deportes como mínimo a los 3 meses de la reparación quirúrgica de la OAAC si el paciente está asintomático y no hay evidencia de isquemia miocárdica inducible o de arritmias cardiacas complejas durante la ergometría máxima | IIb | C |
| No se recomienda la participación de los pacientes con OAAC con una salida en ángulo recto o un flujo anómalo entre los grandes vasos en la mayoría de los deportes de competición con una demanda cardiovascular de moderada a altac | III | C |
OAAC: origen anómalo de las arterias coronarias.
aClase de recomendación.
bNivel de evidencia.
cThis recommendation applies whether the anomaly is identified as a consequence of symptoms or discovered incidentally, and in individuals <40 years of age.
El trayecto intramiocárdico hace referencia a un cuadro clínico en el que parte del miocardio cubre un segmento de la arteria coronaria epicárdica (llamada arteria tunelizada) y afecta generalmente a la arteria descendente anterior izquierda (figura 7). La prevalencia del trayecto intramiocárdico varía del 0,5-0,12% hasta el 5-75% según los angiogramas diagnósticos o las series de escáneres TC.254 Los trayectos intramiocárdicos se han considerado tradicionalmente como benignos, sin embargo, la asociación entre isquemia miocárdica y trayecto intramiocárdico ha aumentado su relevancia clínica. El trayecto intramiocárdico se pueden descubrir durante pruebas de imagen tras una ergometría con ECG anómala y se debe sospechar en pacientes con angina de esfuerzo o síncope. La compresión de la arteria coronaria junto con un efecto Venturi (succión) son posibles mecanismos subyacentes a la isquemia inducida por el ejercicio248.
El estudio de personas con trayecto intramiocárdico tiene como objetivo primario la evaluación de las características morfológicas de las anomalías anatómicas (p. ej., número de trayectos intramiocárdicos, profundidad y tamaño general de los vasos tunelizados) y la presencia de isquemia inducible. Una ergometría inotrópica y cronotrópica positiva es la mejor forma de demostrar isquemia miocárdica. El trayecto intramiocárdico sin comorbilidades subyacentes (p. ej., miocardiopatía hipertrófica [MCH] sin evidencia de isquemia miocárdica inducible) tiene un buen pronóstico255. Sin embargo, en personas adultas/mayores se ha demostrado que la compresión arterial en el trayecto intramiocárdico puede estar directamente relacionada con la carga ateroesclerótica proximal al PM256. Estas personas deben considerarse en la misma categoría que el paciente con EC y se debe tratarlas apropiadamente si fuese necesario, aunque la gran mayoría de los trayectos intramiocárdicos son silentes. Se debe administrar bloqueadores beta cuando los pacientes estén sintomáticos o cuando la isquemia miocárdica esté establecida. La reparación quirúrgica puede considerarse, mientras que el implante de stent coronario no se recomienda255.
5.1.6.2AptitudA los pacientes con trayecto intramiocárdico y evidencia de isquemia se les debe restringir la práctica deportiva de competición y deben recibir el asesoramiento adecuado sobre la participación en actividades de tiempo libre.
Recomendaciones sobre ejercicio/deportes para pacientes con trayecto intramiocárdico
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la práctica deportiva de competición y de tiempo libre de los pacientes asintomáticos con trayecto intramiocárdico sin isquemia inducible o arritmia ventricular durante la ergometría máxima | IIa | C |
| No se recomiendan los deportes de competición para los pacientes con trayecto intramiocárdico e isquemia persistente o arritmias cardiacas complejas durante la ergometría máxima | III | C |
aClase de recomendación.
bNivel de evidencia.
La mayoría de la evidencia sobre el ejercicio en la insuficiencia cardiaca (IC) crónica proviene de estudios en que se implementan programas de entrenamiento de ejercicio considerados seguros y muy recomendables para pacientes estables con un tratamiento médico óptimo257–260. Los metanálisis de estos estudios han demostrado una mejora significativa en la tolerancia al ejercicio y la calidad de vida y un efecto moderado en la mortalidad total específica de la IC y la hospitalización261–267.
5.2.2Estratificación del riesgo y evaluación preliminarLas intervenciones con ejercicio solo deberían comenzarlas los pacientes clínicamente estables una vez se ha optimizado el tratamiento médico para la IC. Los principales componentes antes del inicio de un programa de ejercicio y práctica deportiva son:
Exclusión de contraindicaciones al ejercicio. Las contraindicaciones para que los pacientes con IC crónica comiencen un programa de ejercicio incluyen hipotensión e hipertensión en reposo y durante el ejercicio, cardiopatía inestable, síntomas de deterioro de la IC, isquemia miocárdica resistente al tratamiento (el ejercicio se puede permitir por debajo del umbral isquémico) o neumopatía grave con tratamiento subótimo258.
Evaluación basal. Se requiere una evaluación cardiológica completa que incluya la evaluación de comorbilidades y la gravedad de la IC (p. ej., determinación de los péptidos natriuréticos en sangre y ecocardiografía). Una ergometría máxima (preferiblemente con PECP) es importante para evaluar la capacidad funcional, las arritmias inducidas por el ejercicio o las anomalías hemodinámicas y para la prescripción de la intensidad del ejercicio basada en el VO2pico o en la FCmáx durante el ejercicio (p. ej., reserva de FC o escala de Borg de sensación de esfuerzo subjetiva)265,266.
Optimización del tratamiento médico. Se debe tratar a todos los pacientes con IC siguiendo las guía vigente257, incluida la recomendación de implante de dispositivos cuando sea necesario267.
Cada sesión de ejercicio debe personalizarse durante varias semanas según los síntomas y los hallazgos objetivos en la ergometría, como la capacidad máxima de ejercicio, la FC o las arritmias. En la fibrilación auricular (FA), el ejercicio solo se puede monitorizar por potencia o utilizando la sensación de esfuerzo subjetiva de la Escala Borg.
Idealmente, el ejercicio se debe supervisar a través de un programa de rehabilitación cardiaca mientras se añaden gradualmente sesiones en el domicilio sin supervisión260. Cuando se cumplen todas estas medidas, el riesgo general del ejercicio es bajo, incluso con los ejercicios de más alta intensidad y para los pacientes con IC grave268,269.
Los exámenes de seguimiento de las recomendaciones sobre el ejercicio se deben programar al menos cada 3-6 meses. Los intervalos entre los exámenes deben depender de la gravedad de la enfermedad y las comorbilidades, el lugar de las sesiones (supervisadas frente a domiciliarias), la edad del paciente y la adherencia.
5.2.3Modalidades de ejercicio y participación deportiva en la insuficiencia cardiacaSiguiendo la optimización del control de factores de riesgo y el tratamiento, se debe animar a las personas con IC a comenzar programas de ejercicio sin demora242,244,270. En las primeras etapas también se pueden prescribir y monitorizar programas de ejercicio domiciliarios270,271.
En casos sin apenas complicaciones, las actividades deportivas recreativas de intensidad baja a moderada pueden considerarse en paralelo con el programa de ejercicio estructurado. Cuando se prescriban ejercicios de intensidades máximas, se necesita, por ejemplo, monitorización del pulso. Si esta monitorización no revela arritmias inducidas por el ejercicio u otras anomalías, se pueden permitir todos los tipos de actividades deportivas recreativas (véase la figura 2 y la sección 4.1.2).
5.2.3.1Ejercicio aeróbicoEl ejercicio aeróbico se recomienda para pacientes estables (clase funcional de la New York Heart Association [NYHA] I-III) por sus demostradas eficacia y seguridad260. Las recomendaciones sobre la dosis óptima de ejercicio se han descrito anteriormente en las guías de la ESC y la AHA242,270–272. El modo de ejercicio más comúnmente evaluado es el ejercicio continuo moderado242,270–272. Los pacientes en NYHA III deben mantener una intensidad de ejercicio baja (< 40% del VO2pico), según los síntomas percibidos y el estado clínico durante las primeras 1-2 semanas. Debe continuarse con un aumento gradual en la intensidad hasta un 50-70% del VO2pico y, si se tolera, hasta el 85% como objetivo principal270,271.
Recientemente, los programas de entrenamiento a intervalos de alta intensidad (HIIT) se han considerado como alternativa a las modalidades de ejercicio para pacientes con bajo riesgo269. Los metanálisis más recientes muestran que el entrenamiento a HITT es superior al ejercicio continuo moderado en la mejora del VO2pico de los pacientes con IC y fracción de eyección (FE) reducida (< 40%) (IC-FEr) a corto plazo273. Sin embargo, esta superioridad desaparece en el análisis de subgrupos por protocolos isocalóricos. Los programas de HIIT pueden ser recomendables al inicio para preparar a los pacientes con bajo riesgo e IC estable que quieran retomar el ejercicio aeróbico de alta intensidad y los deportes de resistencia mixtos (figura 2 y sección 4.1.2).
5.2.3.2Ejercicio de fuerzaEl entrenamiento con ejercicios de fuerza puede complementar, pero no sustituir, el entrenamiento con ejercicio aeróbico porque revierte la pérdida de masa esquelética y de forma física sin excesiva carga para el corazón270,274. La intensidad del entrenamiento se ajusta preferiblemente al nivel de resistencia con que el paciente pueda realizar 10-15 repeticiones con sensación subjetiva de esfuerzo de la escala de Borg de 15 puntos (tabla 12)242,270. En pacientes con alteraciones de la función del músculo esquelético y atrofia muscular, el ejercicio debe centrarse inicialmente en el aumento de la masa muscular a través de programas de fuerza275,276.
Dosis de ejercicios de entrenamiento óptimo para pacientes con insuficiencia cardiaca crónica.
| Ejercicio aeróbico | Ejercicio de fuerza | |
|---|---|---|
| Frecuencia | 3-5 días/semana, preferiblemente a diario | 2-3 días/semana, entrenamiento diario del equilibrio |
| Intensidad | 40-80% del VO2pico | Esfuerzo subjetivo en la escala de Borg < 15 (40-60% de 1 RM) |
| Duración | 20-60min | 10-15 repeticiones en al menos 1 tanda de 8-10 ejercicios diferentes de las partes superior e inferior del cuerpo |
| Modalidad | Continuo o intervalos | |
| Progresión | Debe prescribirse un aumento progresivo del entrenamiento con seguimientos regulares (al menos cada 3-6 meses) para ajustar la duración o el nivel de ejercicio al de la tolerancia alcanzada | Debe prescribirse un aumento progresivo del entrenamiento con seguimientos regulares (al menos cada 3-6 meses) para ajustar la duración o el nivel de ejercicio al de la tolerancia alcanzada |
RM: repetición máxima; VO2pico: consumo pico de O2.
Los programas de fuerza pueden considerarse específicamente para pacientes en bajo riesgo que quieran retomar el entrenamiento deportivo de fuerza y potencia, p. ej., halterofilia (figura 2 y sección 4.1.2). Un metanálisis mostró que los ejercicios de fuerza como única intervención tienen la capacidad de aumentar la fuerza muscular, la capacidad aeróbica y la calidad de vida de los pacientes con IC-FEr que no pueden participar en programas de ejercicio aeróbico277. Además, en la IC avanzada o pacientes con baja tolerancia al ejercicio, los ejercicios de fuerza pueden aplicarse de forma segura si se entrenan pequeños grupos musculares270,272,278.
5.2.3.3Ejercicio respiratorioEn entrenamiento de los músculos inspiratorios aumenta el VO2pico, la disnea y la fuerza muscular279–282 y por normal general se lleva a cabo en varias sesiones a la semana con una intensidad que varía del 30 al 60% de la presión inspiratoria máxima y en tandas de 15-30 min durante una media de 10-12 semanas279. Esta modalidad de entrenamiento debe recomendarse a los pacientes con peor forma física como primera alternativa para una posterior transición al entrenamiento de ejercicio convencional y la participación deportiva para mejorar los beneficios cardiopulmonares280.
5.2.3.4Ejercicio acuáticoNo se recomienda el ejercicio acuático para pacientes con IC, pues preocupa que no toleren aumentos del volumen sanguíneo central y la precarga cardiaca como consecuencia de la presión hidrostática283. Sin embargo, un reciente metanálisis ha demostrado que el entrenamiento acuático puede ser seguro y clínicamente efectivo284.
5.2.4Participación deportiva y vuelta al deporteAdemás de la estratificación del riesgo (sección 5.2.3), la evaluación de la participación deportiva incluye la intensidad y el tipo de deportes (competitivo o recreativo) y la determinación del nivel de forma física del paciente.
5.2.4.1Deportes de competiciónLa práctica deportiva de competición puede considerarse para un tipo específico de pacientes con bajo riesgo. Se recomienda una profunda evaluación individual con ergometría máxima (o preferiblemente PECP) antes de la vuelta al deporte, especialmente antes de comenzar deportes de intensidad de moderada a alta y deportes mixtos y de potencia (figura 2, sección 4.1.2).
Los pacientes asintomáticos con IC-FEc (≥ 50%) o IC-FEm (≥ 40-59%) en tratamiento óptimo podrían participar en algunos deportes de competición en ausencia de arritmias o hipotensión inducidas por el ejercicio. En estos casos, se recomienda un aumento progresivo de la dosis de ejercicio. La duración del proceso depende de la capacidad funcional y los síntomas percibidos. Pueden aplicarse algunas restricciones a los deportes de alta resistencia, deportes mixtos y de potencia con alta exigencia, especialmente para los pacientes mayores. No se aplican restricciones a los deportes de habilidad.
Recomendaciones sobre la recomendación de ejercicio en la insuficiencia cardiaca con fracción de eyección reducida o media
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda hablar regularmente sobre la participación en ejercicio y la provisión de un plan de ejercicio individualizado con todos los pacientes con insuficiencia cardiaca260,261,285 | I | A |
| Se recomienda la rehabilitación cardiaca basada en el ejercicio para todos los pacientes estables para aumentar la capacidad de ejercicio y la calidad de vida y reducir la frecuencia de los reingresos hospitalarios260,261,285 | I | A |
| Se deben considerar las revaluaciones clínicas más allá de las evaluaciones anuales cuando se aumente la intensidad del ejercicio | IIa | C |
| Se debe considerar el apoyo motivacional y psicológico, así como las recomendaciones individuales sobre cómo aumentar la cantidad y la intensidad de las actividades deportivas | IIa | C |
| Se pueden considerar las actividades deportivas recreativas de intensidad baja a media y la participación en programas de ejercicio estructurados en pacientes estables | IIb | C |
| Se pueden considerar los programas de entrenamiento a intervalos de alta intensidad (HIIT) para pacientes con bajo riesgo que deseen retomar el ejercicio aeróbico de alta intensidad y los deportes mixtos de resistencia | IIb | C |
aClase de recomendación.
bNivel de evidencia.
Para los pacientes que quieran participar en deportes recreativos y en actividades de tiempo libre, se aplican principios similares sobre la estratificación del riesgo. Se recomienda un aumento progresivo en la dosis de ejercicio. Los deportes de habilidad e intensidad de baja a moderada, los deportes de potencia, mixtos y de resistencia se pueden considerar para todos los pacientes asintomáticos.
Igual que los deportes de competición, solo se debería considerar los deportes recreativos de alta intensidad para pacientes con IC-FEm (40-49%) asintomáticos y sin arritmias o hipotensión inducidas por el ejercicio. Los pacientes asintomáticos con IC-FEr y tratamiento óptimo pueden participar en deportes recreativos de habilidad de intensidad baja a moderada y, de forma selectiva, en deportes de resistencia de baja intensidad (figura 2).
Para los pacientes con IC-FEr, muy baja tolerancia al ejercicio y descompensación frecuente o con dispositivos de asistencia ventricular izquierda (DAVI) (véase el material adicional), la práctica de deportes de habilidad de baja intensidad es posible si la toleran. Las actividades comunes de resistencia de baja intensidad (p. ej., caminar o ciclismo) se deben recomendar por norma general para mejorar la capacidad de ejercicio.
Recomendaciones sobre la práctica deportiva en la insuficiencia cardiaca
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una optimización preliminar del control y el tratamiento de los factores de riesgo de insuficiencia cardiaca, incluido el implante de un dispositivo (si es apropiado) antes de considerar cualquier actividad deportiva | I | C |
| Se debe considerar la participación deportiva de los pacientes con insuficiencia cardiaca y bajo riesgo tras evaluación completa y exclusión de todas las contraindicaciones, estabilidad al menos 4 semanas con tratamiento óptimo y en NYHA I | IIa | C |
| Se pueden considerar los deportes no competitivos (recreativos de intensidad de baja a moderada), de habilidad, de potencia, mixtos o de resistencia para todos los pacientes con IC-FEm estables, asintomáticos y con tratamiento óptimo | IIb | C |
| Se pueden considerar los deportes recreativos de alta intensidad adaptados a las capacidades individuales de los pacientes con IC-FEm estables, asintomáticos, con tratamiento óptimo y una capacidad de ejercicio ajustada por edad mayor que la media | IIb | C |
| Se pueden considerar (si se toleran) los deportes no competitivos (deportes recreativos de habilidad y baja intensidad) para pacientes estables con tratamiento óptimo de la IC-FEr | IIb | C |
| No se recomiendan los deportes de alta intensidad de potencia y de resistencia para pacientes con IC-FEr independientemente de sus síntomas | III | C |
IC-FEm: insuficiencia cardiaca con fracción de eyección en rango medio; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
Los programas de rehabilitación cardiaca basada en el ejercicio son la piedra angular de la prevención holística y el tratamiento de la IC-FEc260,285. La intervención con ejercicio durante 12-24 semanas aumenta la capacidad funcional y la calidad de vida286–292. Los efectos beneficiosos parecen estar mediados por una mejora del metabolismo oxidativo muscular y la función vascular293. En pacientes obesos, la pérdida de peso ha demostrado efectos similares al ejercicio solo288, por lo que se recomienda una reducción estable del peso del 10% a lo largo de 2-4 años294.
5.2.5.1Modalidades de ejercicio y de participación deportivaLas intensidades de mayor resistencia como el HITT (4×4min al 85-90% de la frecuencia cardiaca pico con 3 min de recuperación) han mostrado efectos positivos en la función miocárdica, pero los datos se limitan a un pequeño grupo de pacientes diabéticos.295 La práctica de HITT durante 4 semanas aumentó significativamente el VO2 pico y la función diastólica del VI296. Los ejercicios de más alta intensidad deberían limitarse a pacientes estables y se pueden introducir gradualmente tras 4 semanas de ejercicio moderado continuo.
Las sesiones de ejercicio deben comenzar con fases cortas de 10 min de resistencia y 10 min de ejercicios de fuerza, que se deben extender de forma gradual durante un periodo de 4 semanas. El objetivo final debe ser al menos 30-45min al menos 3 días a la semana. Dependiendo del estado sintomático del paciente y su capacidad funcional, se pueden introducir intervalos de intensidad más alta.
La duración de la intervención parece ser importante en los cambios funcionales y estructurales CV en la IC-FEc. Las intervenciones de más de 2 años en personas sanas revirtieron los primeros signos de disfunción diastólica297,298. Para la práctica deportiva, véase la sección 5.2.3.
Recomendaciones sobre el ejercicio y la participación en deportes para pacientes con insuficiencia cardiaca y fracción de eyección conservada
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Se recomiendan ejercicios de resistencia moderados y ejercicios dinámicos de resistencia dinámica, junto con intervenciones en el estilo de vida y tratamiento óptimo de los factores de riesgo cardiovascular (p. ej., hipertensión arterial y diabetes tipo 2)287,289–292,299 | I | C |
| Se pueden considerar los deportes de competición para pacientes estables sin anomalías en la ergometría máxima | IIb | C |
aClase de recomendación.
bNivel de evidencia.
Véase también la recomendación en la sección 5.2.5.
5.2.6Ejercicio para pacientes tras trasplante cardiacoPor diversos factores, la capacidad de ejercicio de los receptores de trasplante cardiaco está reducida en un 50-60% en comparación con la población general sana de iguales edad y sexo300–303 (tabla13). El ejercicio reduce el riesgo CV inducido por el tratamiento inmunosupresor postrasplante304 y aumenta el rendimiento físico305, lo que permite a los pacientes trasplantados conseguir niveles comparables a los de los controles emparejados por edad306. Los pacientes trasplantados que participan en programas de rehabilitación cardiaca basada en el ejercicio muestran unos resultados favorables en cuanto a reingreso hospitalario y supervivencia a largo plazo305,307,308.
Factores que influyen en la capacidad de ejercicio (VO2pico) disminuida y el gasto cardiaco en pacientes con trasplante cardiaco.
| La disminución de la capacidad de ejercicio (VO2pico) y la reducción del gasto cardiaco en pacientes trasplantados están determinadas por:• Reinervación del injerto cardiaco• Disfunción diastólica del ventrículo izquierdo trasplantado• Disminución del pico de ejercicio y volumen telesistólico del 20%• Aumento del cociente presión pulmonar capilar/presión de enclavamiento pulmonar durante ergometría• Isquemia miocárdica debida a vasculopatía del injerto cardiaco• Función endotelial vascular periférica disminuida/alteraciones de la función endotelial vascular periférica• Aumento de la resistencia del sistema vascular del 50%• Disminución de las fibras oxidativas del músculo esquelético, el volumen mitocondrial y la densidad capilar• Reducción del oxígeno arteriovenoso del 25%• Activación simpática elevada |
Las mejoras en la capacidad de ejercicio dependen principalmente del volumen de ejercicio. La capacidad de ejercicio aumentada se debe principalmente a las adaptaciones periféricas en el músculo esquelético, incluyendo un aumento de la capacidad oxidativa y de la conductancia de los capilares. La reinervación postrasplante también contribuye a la mejora funcional de la capacidad durante el primer año304,309,310. Si se consiguen, el entrenamiento puede llevarse a cabo en niveles altos y permite a ciertos pacientes trasplantados correr maratones o triatlones304,309,310.
5.2.6.1Modalidades de ejercicio y participación deportivaLa combinación de ejercicios de resistencia y de fuerza es el programa de ejercicio preferido. La intensidad media del ejercicio de resistencia debería comenzar siendo moderada (el 60% del VO2pico), que más tarde se puede aumentar al 80% del VO2pico, un nivel aplicado en la mayoría de los estudios de intervenciones con ejercicio en pacientes trasplantados305. En casos sin complicaciones, estas intensidades se pueden aumentar a los niveles máximos.
Se recomienda que los pacientes realicen hasta 5 sesiones de ejercicio de 30min cada semana. Sin embargo, la duración y la frecuencia del ejercicio varían de 30 a 90 min de 2 a 5 veces por semana en estudios anteriores con pacientes trasplantados305,311. Se deben incluir ejercicios tanto de resistencia como de fuerza en estas sesiones. Sin embargo, se pueden llevar a cabo 2-3 sesiones de fuerza adicionales cada semana.
El ejercicio de fuerza se debe centrar en los grandes grupos musculares con ejercicios que utilicen el propio peso corporal o ejercicios con máquinas de pesas. La resistencia de la parte alta del cuerpo debe comenzar al menos 3 meses tras la cirugía y la intensidad debe aumentar gradualmente de baja a moderada, pero también son posibles intensidades submáximas en casos de enfermedad sin complicaciones (véase la sección 4.1.1.).
Una gran limitación del ejercicio de resistencia es la respuesta cronotrópica reducida al ejercicio derivada de la denervación del aloinjerto. Además de la incompetencia cronotrópica, otros cambios patofisiológicos presentes tras un trasplante cardiaco también se deberían considerar en la prescripción e implementación de un programa de ejercicio (tabla 13). Se debe considerar la isquemia inducida por ejercicio de una vasculopatía del aloinjerto cardiaco, especialmente en la práctica de ejercicios de mayor intensidad, que se ha argumentado tiene efectos superiores en la mejora de la capacidad de ejercicio en estos pacientes311,312.
Se ha informado de la viabilidad y la seguridad en la práctica deportiva de pacientes trasplantados cardiacos estables y asintomáticos tras la optimización del tratamiento. Por lo tanto, se puede considerar la práctica deportiva de competición para ciertos pacientes, siempre que se eviten disciplinas de potencia y resistencia de alta intensidad.
Recomendaciones sobre ejercicio y participación en deportes para pacientes trasplantados cardiacos
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Se recomienda el ejercicio regular a través de programas de rehabilitación cardiaca que combinen ejercicio aeróbico de intensidad moderada y ejercicio de fuerza para revertir la fisiopatología a la previa al trasplante, reducir el riesgo vascular inducido por el tratamiento médico postrasplante y mejorar los desenlaces clínicos305–312 | I | B |
| Se debe animar a la práctica de deportes recreativos (de baja intensidad) a los pacientes estables asintomáticos tras la optimización del tratamiento | IIa | C |
| Se puede considerar la aptitud para los deportes de competición de intensidad baja y media de ciertos pacientes asintomáticos sin complicaciones durante el seguimiento304,309,310 | IIb | C |
aClase de recomendación.
bNivel de evidencia.
Las valvulopatías afectan aproximadamente al 1-2% de la población general joven que practica ejercicio. Los informes sobre la historia natural de las valvulopatías son escasos. Sin embargo, existe la posibilidad teórica de que un alto volumen sistólico, junto con contracciones mecánicas vigorosas del corazón y un aumento del cronotropismo inducido por el ejercicio, aceleren la disfunción valvular. Los consiguientes efectos en lesiones estenóticas crónicas o regurgitantes pueden causar hipertrofia cardiaca compensatoria, disfunción ventricular izquierda, isquemia miocárdica, arritmias cardiacas y posiblemente MSC.
5.3.1.1Principios generales para la evaluación y la estratificación del riesgo de pacientes con valvulopatías antes del ejercicio recreativo o deportes de competiciónNo existen estudios prospectivos que examinen el impacto del ejercicio en la evolución de las valvulopatías. Por tanto, las recomendaciones generales presentadas en esta sección se basan en consenso de opiniones y estudios de seguimiento a largo plazo de poblaciones no deportistas. La mayoría de las personas con valvulopatías son asintomáticas o tienen síntomas leves y algunas desean participar en programas de ejercicio regular, como deportes de ocio y de competición. El tratamiento de estos pacientes requiere la evaluación del estado sintomático, la capacidad funcional, la naturaleza de la lesión valvular y el impacto de las condiciones de carga derivadas en la estructura y la función cardiacas. Todos los pacientes deben ser evaluados con anamnesis, exploración física, ECG, ecocardiografía y ergometría. La anamnesis debe investigar todos los síntomas cardiacos y la capacidad funcional. La ecocardiografía debe centrarse en la morfología y la función valvular prestando especial atención a la gravedad del impacto en el tamaño y la función de las cavidades cardiacas. La ergometría debe imitar la intensidad del deporte en el que participa el paciente y se debe centrar en los síntomas inducibles, arritmias, isquemia miocárdica y la respuesta hemodinámica (PA) al ejercicio. Algunos pacientes pueden requerir una ecocardiografía de esfuerzo para evaluar la gravedad del defecto valvular.
Se considera en bajo riesgo a los pacientes asintomáticos con disfunción valvular de leve a moderada, función ventricular conservada y buena capacidad funcional sin isquemia miocárdica inducible por el ejercicio, respuesta hemodinámica anormal o arritmias, y pueden participar en todos los deportes. De hecho, la insuficiencia valvular leve (en su mayoría tricuspídea y pulmonar) es común entre deportistas entrenados y es probable que sea una característica de la cardiomegalia de los deportistas. Por el contrario, se considera en riesgo a los pacientes con síntomas de esfuerzo, disfunción valvular moderada o grave, disfunción ventricular izquierda o derecha, hipertensión pulmonar y arritmias cardiacas inducidas por el ejercicio o respuesta hemodinámica anormal, para quienes se debe considerar una intervención invasiva.
5.3.1.2VigilanciaSe debe evaluar regularmente a todos los pacientes con valvulopatías. La frecuencia de las revisiones puede variar de 6 meses a 2 años dependiendo de los síntomas y la gravedad de la disfunción valvular.
5.3.2Estenosis de la válvula aórticaLa estenosis de la válvula aórtica es más comúnmente el resultado de un proceso degenerativo dependiente de la edad que causa engrosamiento progresivo, calcificación y reducción de la movilidad de las valvas313. La estenosis de la válvula aórtica causa un aumento en el gradiente de presión transvalvular y en la carga de trabajo del VI, con las consiguientes HVI, fibrosis y aumento de la demanda miocárdica de oxígeno. Generalmente, la fracción de eyección del ventrículo izquierdo (FEVI) está conservada. Los pacientes afectados pueden tener un gasto cardiaco normal en reposo e incluso en ejercicio, por lo que algunas personas con estenosis de la válvula aórtica tienen una buena capacidad para el ejercicio. Sin embargo, la estenosis de la válvula aórtica grave se asocia con un aumento del riesgo de IC y MSC por obstrucción mecánica del flujo, AV malignas o hipoperfusión coronaria18,314.
El diagnóstico de estenosis de la válvula aórtica y su grado durante la ecocardiografía se basan en criterios bien establecidos315. La estenosis grave de la válvula aórtica se define específicamente como315: a) una velocidad Doppler transvalvular ≥ 4,0m/s; b) un gradiente medio ≥ 40mmHg, y c) un área valvular < 1,0 cm2 o un área indexada (recomendado en deportistas) < 0,6 cm2/m2. En casos con un gradiente bajo (< 40mmHg) y una área valvular<1,0 cm2 con FE<50% y volumen sistólico<35ml/m2, se recomienda la ecocardiografía de estrés con una dosis baja de dobutamina para identificar estenosis de la válvula aórtica seudograve o grave paradójica315,316. La evaluación del calcio de la válvula aórtica con TC puede ser útil en casos inciertos en los que la gravedad de la estenosis de la válvula aórtica no esté clara313,316.
La ergometría es de especial importancia para evaluar la respuesta hemodinámica en la estenosis de la válvula aórtica y para guiar la recomendación de ejercicio en casos asintomáticos de estenosis de la válvula aórtica moderada y grave. Un descenso progresivo en la PAS en ejercicio o la incapacidad de aumentar la PAS al menos 20 mmHg sirven para identificar a los pacientes con mayor riesgo317. La taquicardia ventricular inducida por el ejercicio también se debe considerar como un criterio para las restricciones al ejercicio.
Los pacientes asintomáticos con leve estenosis de la válvula aórtica pueden participar en todos los deportes. Los deportistas asintomáticos con estenosis grave de la válvula aórtica no deben participar en deportes de competición o recreativos con la excepción de deportes de habilidad de intensidad baja. Sin embargo, el ejercicio aeróbico de intensidad baja podría recomendarse a los pacientes asintomáticos para mejorar la capacidad funcional y el bienestar general.
Los pacientes con estenosis de la válvula aórtica sintomática no deben participar en ningún deporte/ejercicio de competición o recreativo y se recomienda la sustitución valvular. El ejercicio suave, que no provoque síntomas, se puede considerar para estos pacientes por los beneficios generales para la salud.
Recomendaciones sobre ejercicio y participación en deportes recreativos/de ocio para pacientes asintomáticos con estenosis aórtica
| Estenosis aórticaa | |||
|---|---|---|---|
| Recomendación | Claseb | Nivelc | |
| Leve | Se recomienda la práctica deportiva recreativa si el paciente lo desea | I | C |
| Moderada | Se debe considerar la participación en todos los deportes recreativos de intensidad baja a moderada. Si se desea, se puede considerar para pacientes con FEVI ≥ 50%, buena capacidad funcional y ergometría normal | IIa | C |
| Grave | Se puede considerar la práctica deportiva/ejercicios recreativos de baja intensidad de los pacientes con FEVI ≥ 50% y respuesta normal de la PA en ejercicio | IIb | C |
| No se recomienda la práctica deportiva de competición o recreativos de intensidad media/alta | III | C |
FEVI: fracción de eyección del ventrículo izquierdo; PA: presión arterial.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bClase de recomendación.
cNivel de evidencia.
Recomendaciones sobre la participación en deportes de competición para pacientes asintomáticos con estenosis aórtica
| Estenosis aórticaa | |||
|---|---|---|---|
| Recomendación | Claseb | Nivelc | |
| Leve | Se recomienda la práctica deportiva de competición si el paciente lo desea | I | C |
| Moderada | Se debe considerar la participación en todos los deportes de competición de intensidad baja a moderada. Si se desea, se puede considerar para pacientes con FEVI ≥ 50%, buena capacidad funcional y buena respuesta de la PA en ejercicio | IIb | C |
| Grave | Se puede considerar la práctica deportiva de habilidad de baja intensidad para grupo de pacientes con FEVI ≥ 50% seleccionados | IIb | C |
| No se recomienda la práctica deportiva o ejercicio de intensidad media/alta | III | C |
FEVI: fracción de eyección del ventrículo izquierdo; PA: presión arterial.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bClase de recomendación.
cNivel de evidencia.
La insuficiencia de la válvula aórtica está causada generalmente por una válvula anómala congénita (p. ej., válvula bicúspide), degeneración de la válvula tricúspide o pérdida de la coaptación por ensanchamiento de la raíz aórtica313,318. Otras causas menos frecuentes de insuficiencia de la válvula aórtica son la endocarditis infecciosa y la disección aórtica.
Las consecuencias hemodinámicas de la insuficiencia crónica de la válvula aórtica se caracterizan por sobrecarga de presión y volumen, que generalmente tiene como resultado un VI dilatado e hipertrófico. Para acomodar el flujo anterógrado concomitante de la válvula mitral y el flujo retrógrado de la válvula aórtica durante la diástole, el VI aumenta progresivamente su tamaño y su masa. Esta remodelación, en ciertas ocasiones, puede ser difícil de distinguir de la adaptación cardiovascular del deportista, especialmente en varones con una gran talla corporal que participan en actividades de fuerza, de modo que el tamaño del VI se debe interpretar en el contexto del deporte que el paciente practica y tomando en consideración el sexo y el área de superficie corporal del paciente319. Se debe considerar un agrandamiento patológico del VI en los varones con diámetro telediastólico del VI > 35mm/m2 o un diámetro telesistólico del VI > 50mm, y las mujeres con un diámetro telediastólico del VI > 40mm/m2 o un diámetro telesistólico > 40mm independientemente del nivel de entrenamiento físico. Se debe monitorizar estrechamente a estos pacientes por un aumento progresivo del diámetro telesistólico del VI.
En pacientes con imágenes ecocardiográficas poco claras, la RMC tiene la ventaja de proporcionar una evaluación detallada del volumen del VI y la FE, cálculos de flujo y la detección de cicatrización miocárdica319 en pacientes con estenosis grave de la válvula aórtica. Además, la aorta torácica al completo se puede visualizar durante este examen.
Los pacientes asintomáticos con estenosis de la válvula aórtica leve o moderada pueden participar en todos los deportes. Los pacientes asintomáticos con estenosis grave de la válvula aórtica, VI moderadamente dilatado y buena función sistólica del VI pueden participar en deportes de intensidad baja y media y se pueden considerar ejercicios más intensos de forma individual. Estos pacientes requieren una vigilancia más estrecha cada 6 meses para evaluar la función del VI. Se recomienda la sustitución/reparación quirúrgica de la válvula de pacientes asintomáticos con estenosis grave y FEVI reducida, y no deben participar en deportes de competición, aunque sí deportes de ocio a intensidad baja. Se recomienda la cirugía para los pacientes sintomáticos con estenosis grave de la válvula aórtica. Estos pacientes no deben participar en deportes de competición u ocio. Sin embargo, el ejercicio aeróbico de baja intensidad está recomendado para mejorar la capacidad funcional y el bienestar general.
5.3.4Válvula aórtica bicúspideLa válvula aórtica bicúspide (VAB) es una anomalía congénita común con una prevalencia del 1-2% entre la población general320. La VAB puede estar asociada con estenosis de la válvula aórtica o insuficiencia de la válvula aórtica y un aumento del riesgo de aneurisma aórtico ascendente o disección y MSC28,321. En comparación con el síndrome de Marfan, el riesgo de aortopatía es menor. Sin embargo, la VAB es mucho más frecuente y se ha informado de que el riesgo relativo de disección aórtica es 8 veces mayor que con una válvula aórtica tricúspide321. La VAB puede no identificarse durante la exploración física en ausencia de disfunción valvular58,322, aunque el desenlace clínico en pacientes jóvenes sin disfunción valvular es bueno323,324.
No está claro si el ejercicio intenso acelera la dilatación aórtica a largo plazo. En un estudio anterior en el que se comparó a deportistas con VAB, no deportistas con VAB y deportistas con una válvula aórtica normal, los deportistas con VAB mostraron un aumento de 0,11±0,59mm/año en el tamaño aórtico en los senos de Valsalva y 0,21±0,44mm/año en la aorta ascendente proximal, resultados no muy diferentes de los de los no deportistas con VAB325. Actualmente, los paneles de consenso de expertos recomiendan un abordaje cauto de las actividades deportivas cuando el tamaño de la aorta ascendente esté por encima de los límites normales (véase la sección 5.4). En ausencia de aortopatía, las recomendaciones de ejercicio para pacientes con VAB son idénticas a aquellas para pacientes con disfunción de la válvula tricúspide.
Recomendaciones sobre la participación en deportes recreativos/de ocio para pacientes asintomáticos con insuficiencia aórtica
| Insuficiencia aórticaa | |||
|---|---|---|---|
| Recomendación | Claseb | Nivelc | |
| Leve | Se recomienda la práctica de deportes recreativos si el paciente lo desea | I | C |
| Moderada | Se puede considerar la práctica de deportes recreativos para pacientes asintomáticos con VI no dilatado, FEVI>50% y ergometría normal | IIa | C |
| Grave | Se puede considerar la práctica de deportes recreativos de intensidad baja y media para pacientes con dilatación del VI leve o moderada, FEVI>50% y ergometría normal que lo deseen | IIb | C |
| No se recomienda la participación en cualquier ejercicio recreativo de intensidad de moderada a alta de los pacientes con FEVI ≤ 50% o arritmias inducidas por el ejercicio | III | C |
FEVI: fracción de eyección del ventrículo izquierdo; VI: ventrículo izquierdo.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bClase de recomendación.
cNivel de evidencia.
Recomendaciones sobre la participación en deportes de competición para pacientes asintomáticos con insuficiencia aórtica
| Insuficiencia aórticaa | |||
|---|---|---|---|
| Recomendación | Claseb | Nivelc | |
| Leve | Se recomienda la práctica deportiva de competición si el paciente lo desea | I | C |
| Moderada | Se puede considerar la práctica deportiva de competición para pacientes asintomáticos con FEVI > 50% y ergometría normal | IIa | C |
| Grave | Se puede considerar la práctica deportiva de competición de intensidad baja y media para pacientes, con dilatación del VI leve o moderada, FEVI>50% y ergometría normal que lo deseen | IIb | C |
| No se recomienda la participación en ningún deporte de competición de intensidad de moderada a alta de los pacientes con FEVI ≤ 50% o arritmias inducidas por el ejercicio | III | C |
FEVI: fracción de eyección del ventrículo izquierdo; VI: ventrículo izquierdo.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bClase de recomendación.
cNivel de evidencia.
La mayoría de las personas con valvulopatía mitral tienen insuficiencia mitral (IM) primaria por enfermedad mixomatosa326. La IM se confirma y cuantifica con ecocardiografía. Las recomendaciones generales sobre el ejercicio y el deporte se basan en el estado asintomático, la gravedad de la IM, la función del VI, la PA pulmonar (PAP) sistólica (PAPS) y la presencia o ausencia de arritmias durante el ejercicio. Tanto el entrenamiento deportivo como la IM se han asociado con cavidades del VI dilatadas. Sin embargo, un VI dilatado que es desproporcionado para el nivel de ejercicio puede indicar IM grave y ser un signo de alerta para evitar deportes de competición u ocio de intensidad moderada o alta.
Los pacientes asintomáticos con IM leve o moderada pueden competir en todos los deportes si tienen buena capacidad funcional, función del VI conservada, PAPS<50mmHg y ausencia de arritmias complejas durante el ejercicio. Los pacientes con IM sintomática y capacidad de ejercicio reducida o con IM y arritmias complejas no deben participar en deportes de competición u ocio. Sin embargo, se debe animar al ejercicio aeróbico de baja intensidad para mejorar la capacidad funcional y el bienestar general. Los pacientes con anticoagulación a largo plazo para la FA no deben participar en deportes de contacto/colisión.
Recomendaciones sobre la participación en deportes recreativos/de ocio para pacientes asintomáticos con insuficiencia mitral
| Estenosis aórticaa | |||
|---|---|---|---|
| Recomendación | Claseb | Nivelc | |
| Leve | Se recomienda la práctica deportiva recreativa si el paciente lo desea | I | C |
| Moderada | Se debe considerar la participación en todos los deportes recreativos de intensidad baja a moderada. Si se desea, se puede considerar para pacientes con FEVI ≥ 50%, buena capacidad funcional y ergometría normal | IIa | C |
| Grave | Se puede considerar la práctica deportiva/ejercicios recreativos de baja intensidad de los pacientes con FEVI ≥ 50% y respuesta normal de la PA en ejercicio | IIb | C |
| No se recomienda la práctica deportiva de competición o recreativos de intensidad media/alta | III | C |
DdVI: diámetro telediastólico del VI; FEVI: fracción de eyección del VI; PAPS: presión arterial pulmonar sistólica; VI: ventrículo izquierdo.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bProhibición de deportes de colisión o contacto en caso de anticoagulantes o fibrilación auricular.
cClase de recomendación.
dNivel de evidencia.
Recomendaciones sobre la práctica deportiva de competición para pacientes asintomáticos con insuficiencia mitral
| Insuficiencia mitrala,b | |||
|---|---|---|---|
| Recomendación | Clased | Niveld | |
| Leve | Se recomienda la práctica deportiva de competición si el paciente lo desea | I | C |
| Moderada | Se puede considerar la práctica de deportes recreativos para todos los pacientes que lo deseen y cumplan lo siguiente:• DdVI<60 mm327 o<35,3mm/m2 los varones y<40mm/m2 las mujeres• FEVI ≥ 60%• PAPS en reposo<50mmHg• Ergometría normal | IIa | C |
| Grave | Se puede considerar la práctica de deportes recreativos de intensidad baja y moderada para todos los pacientes que lo deseen y cumplan lo siguiente:• DdVI<60 mm327 o<35,3mm/m2 los varones y<40mm/m2 las mujeres• FEVI ≥ 60%• PAPS en reposo<50mmHg• Ergometría normal | IIb | C |
DdVI: diámetro telediastólico del VI; FEVI: fracción de eyección del VI; PAPS: presión arterial pulmonar sistólica; VI: ventrículo izquierdo.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante (estenótica o regurgitante).
bProhibición de deportes de colisión o contacto en caso de anticoagulantes o fibrilación auricular.
cClase de recomendación.
dNivel de evidencia.
El prolapso de la válvula mitral (PVM) se caracteriza por cambios fibromixomatosos en las valvas mitrales y tiene una prevalencia del 1-2,4%328,329. El diagnóstico de PVM se define como un desplazamiento > 2mm de una o ambas valvas mitrales más allá del anillo dentro de la aurícula izquierda en telesístole330. El PVM es generalmente benigno, con un riesgo de muerte a 10 años del 5%331. Se identifica a la mayoría de los pacientes de manera fortuita durante la auscultación cardiaca o la ecocardiografía.
La complicación más común es la evolución a IM grave crónica en un 5-10% de los pacientes con PVM. Otras complicaciones incluyen IC derivada de la IM crónica, hipertensión pulmonar, endocarditis infecciosa, arritmias supraventriculares y ventriculares y, en algunas ocasiones, MSC313. En un registro italiano de enfermedades cardiacas, de 650 MSC de personas jóvenes, el 7% se atribuyó a PVM332. La mayoría de los fallecidos mostraban cicatrización en la pared inferobasal y músculos papilares y prolapso bivalvar. La cicatrización miocárdica, la disyunción del anillo mitral (p. ej., un desplazamiento auricular anormal del punto de bisagra de la válvula mitral durante la sístole)333, inversión de la onda T en las derivaciones inferiores y AV con origen en el VI (morfología de bloqueo de la rama derecha del haz de His [BRDHH]) fueron características de alto riesgo de MSC334. Se cree que la sobrecarga mecánica del PVM en los músculos papilares y el miocardio adyacente son la causa de la cicatrización miocárdica, que también puede ser un posible mecanismo para arritmias potencialmente letales en algunas personas335,336.
En general, las personas con PVM que practican ejercicio tienen un pronóstico excelente. En un estudio reciente en Italia. de 7.449 deportistas de competición, se identificó PVM en el 2,9%. Tras una media de seguimiento de 8±2 años, no hubo fallecimientos337. La tasa de eventos adversos, incluida la IM progresiva con dilatación del VI, ictus isquémico y FA, fue del 0,5% al año, con mayor frecuencia entre los deportistas mayores con IM basal o AV.
Se debe evaluar a los pacientes con PVM con una ergometría y un ECG de 24 horas. Los pacientes con inversión inferior de la onda T o extrasístoles ventriculares izquierdas deben someterse a una RMC para buscar específicamente fibrosis miocárdica que afecte a la pared inferobasal. Otros marcadores de potencial alto riesgo incluyen evidencias de dispersión mecánica detectada con ecografía de speckle tracking338, prolongación concomitante del intervalo QT y disyunción del anillo mitral333.
Dada la naturaleza relativamente benigna del PVM, los pacientes asintomáticos y con IM leve o moderada pueden participar en todos los deportes de competición u ocio en ausencia de los factores de riesgo anteriormente mencionados (figura 8). Los pacientes asintomáticos con IM grave sin ninguno de los marcadores de alto riesgo mencionados anteriormente pueden competir en deportes de intensidad de baja a moderada tras una consideración en profundidad con el médico especialista en caso de diámetro telediastólico del VI < 60mm (o<35mm/m2 los varones y < 40mm/m2 las mujeres) con FEVI ≥ 60%, PAPS < 50mmHg y ergometría normal.
Los pacientes sintomáticos con PVM y alguna de las características de alto riesgo mencionadas anteriormente figura 8) no deben participar en deportes recreativos o de competición. Sin embargo, el ejercicio aeróbico de intensidad baja podría recomendarse a los pacientes asintomáticos para mejorar la capacidad funcional y el bienestar general.
5.3.6Estenosis mitralAunque la valvulopatía reumática no es común en los países occidentales, el aumento en los patrones de inmigración tiene como consecuencia que los cardiólogos se puedan encontrar con personas con estenosis mitral (EM) reumática que quieran hacer ejercicio. Los pacientes con EM avanzada generalmente están sintomáticos y no son capaces de participar en programas de ejercicio de gran exigencia CV. La estratificación del riesgo de pacientes con EM que practican ejercicio se basa principalmente en un ecocardiograma detallado con especial atención a la gravedad de la lesión y la PAPS. Además, la evaluación debe incluir una ergometría máxima para identificar síntomas enmascarados y capacidad funcional.
Los pacientes asintomáticos con EM leve (área de la válvula mitral [AVM], 1,5-2,0 cm2) y moderada (AVM, 1,0-1,5 cm2) en ritmo sinusal que puedan demostrar una buena capacidad funcional en la ergometría y una PAPS normal pueden participar en todos los deportes de competición y de ocio. Los pacientes con síntomas leves y EM grave (AVM < 1,0 cm2) solo pueden participar en actividades de ocio con esfuerzo físico de baja intensidad. Se debe referir a los pacientes con EM sintomática para intervención y se les debe recomendar abstenerse de la participación deportiva y el ejercicio recreativo de intensidad moderada o alta. Los pacientes con FA deben estar anticoagulados y evitar los deportes de contacto/colisión. En casos de valvuloplastias mitrales por catéter con balón con buenos resultados (p. ej., AVM>2,0 cm2) en pacientes asintomáticos con buena capacidad funcional, se puede considerar el deporte regular y de competición.
Recomendaciones sobre la participación en deportes recreativos/de ocio para pacientes con estenosis mitral
| Estenosis mitrala,b | |||
|---|---|---|---|
| Recomendación | Clasec | Niveld | |
| Leve (AVM, 1,5-2,0 cm2) | Se recomienda la participación en todos los deportes recreativos de los pacientes con PAPS<40mmHg y ergometría normal que lo deseen | I | C |
| Moderada (AVM, 1,0-1,5 cm2) | Se puede considerar la participación en todos los deportes recreativos de baja intensidad de los pacientes con PAPS en reposo < 40mmHg y ergometría normal que lo deseen | IIb | C |
| Grave (AVM>1 cm2) | No se recomiendan los deportes de ocio de intensidad moderada o alta | III | C |
AVM: área de la válvula mitral; PAPS: presión arterial pulmonar sistólica.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante.
bVedados los deportes de colisión o contacto corporal en caso de anticoagulación para la fibrilación auricular.
cClase de recomendación.
dNivel de evidencia.
Recomendaciones sobre la participación en deportes de competición para pacientes asintomáticos con estenosis mitral
| Estenosis mitrala,b | |||
|---|---|---|---|
| Recomendación | Clasec | Niveld | |
| Leve (AVM, 1,5-2,0 cm2) | Se recomienda la participación en todos los deportes de competición para los pacientes con PAPS en reposo < 40mmHg y ergometría normal que lo deseen | I | C |
| Moderada (AVM, 1,0-1,5 cm2) | Se puede considerar la participación en todos los deportes de competición de baja intensidad de los pacientes con PAPS en reposo < 40mmHg y ergometría normal | IIb | C |
| Grave (AVM<1,0 cm2) | No se recomienda la práctica deportiva de competición | III | C |
AVM: área de la válvula mitral; PAPS: presión arterial pulmonar sistólica.
aPara valvulopatías mixtas, se debe seguir la recomendación para la lesión predominante.
bVedados los deportes de colisión o contacto corporal en caso de anticoagulación para la fibrilación auricular.
cClase de recomendación.
dNivel de evidencia.
La insuficiencia tricuspídea (IT) generalmente es secundaria a cardiopatías, hipertensión pulmonar o disfunción del ventrículo derecho (VD). En la mayoría de los pacientes con IT secundaria, las limitaciones sobre el ejercicio se relacionan con la enfermedad subyacente.
La IT es común en deportistas y se acompaña de la dilatación fisiológica de la vena cava inferior, que se colapsa fácilmente durante la inspiración. La IT grave se caracteriza por una dilatación del anillo tricuspídeo y remodelación del VD que con el tiempo tiene como resultado disfunción del VD y una vena cava inferior «no reactiva». Los pacientes con IT grave también pueden tener una capacidad de ejercicio reducida debido a una respuesta cardiaca disminuida durante el ejercicio339. Más aún, pueden sufrir presiones de llenado izquierdas y derechas aumentadas durante el ejercicio, esto último debido a la interacción diastólica ventricular340.
En general, los pacientes con IT asintomáticos y con buena capacidad funcional, VD no dilatado, función ventricular conservada, PAPS < 40mmHg y ausencia de arritmias complejas pueden participar en todos los deportes de competición y recreativos.
5.4Recomendaciones de ejercicio para pacientes con aortopatías5.4.1IntroducciónLos aneurismas de la aorta torácica son generalmente asintomáticos hasta que ocurre un evento repentino y extremadamente grave como rotura o disección aórticas, que pueden tornarse mortales rápidamente. La edad avanzada, el sexo masculino, hipertensión arterial de larga evolución y la presencia de aneurismas aórticos caracterizan la mayor población con riesgo de disección aórtica. Sin embargo, en pacientes con enfermedades del tejido conectivo como los síndromes de Marfan (SM), Loeys Dietz o Ehlers Danlos (SED) y pacientes con VAB tienen un riesgo mayor a una edad mucho más temprana. La VAB tiene una prevalencia del 1-2% en la población general. Estos pacientes tienen un riesgo relativamente bajo de disección aórtica en comparación con pacientes con enfermedad aórtica familiar. Los antecedentes familiares de disección aórtica o muerte súbita son un factor de riesgo y un diámetro aórtico mayor conlleva un riesgo mayor, aunque la disección puede ocurrir con cualquier diámetro, especialmente en pacientes con SED en los que no hay una relación clara con el diámetro aórtico341–343.
La raíz aórtica dilatada (> 40mm) no es una característica de la cardiomegalia de los deportistas, ya que solo una pequeña proporción de los deportistas jóvenes (0,3%) tienen dilatación de la raíz aórtica344–347. No se observó ninguna dilatación progresiva durante el seguimiento de estos deportistas y no hubo eventos aórticos durante un periodo de 5 años347.
5.4.2Riesgo de disecciónDebido al aumento de la PA y el estrés parietal asociado con el ejercicio intenso y los deportes, estas actividades podrían asociarse con un aumento del riesgo de dilatación aórtica y disección aórtica aguda. Sin embargo, el ejercicio diario es importante para mantener buenos PA, frecuencia cardiaca y peso corporal y el estilo de vida sedentario es un importante factor de riesgo de ECV y mortalidad modificable. La actividad física se recomienda a todos los pacientes con enfermedad de la aorta, incluso cuando la aorta está dilatada.
No existen ensayos controlados aleatorizados sobre los deportes de competición y en pacientes con enfermedad de la aorta torácica, ni tampoco información prospectiva sobre los riesgos de los deportes de competición en pacientes tras reparación quirúrgica. Sin embargo, tras el reemplazo de la raíz aórtica, los pacientes con SMF y otras aortopatías hereditarias mantienen el riesgo de complicaciones aórticas. Un pequeño estudio prospectivo de cohortes evaluó la posibilidad y los efectos de un programa de rehabilitación de entrenamiento de 3 semanas en pacientes con SMF con una edad media de 47 años. Durante el seguimiento de 1 año no hubo efectos adversos, aunque sí una mejora en la forma física y una reducción del malestar psíquico. Estos efectos se observaron hasta 3 semanas durante la rehabilitación y se mantuvieron durante el primer año de seguimiento. Lamentablemente, no se incluyó información sobre los diámetros aórticos.348
5.4.3Disciplinas deportivasEn la literatura se describen 49 informes de casos de disecciones aórticas agudas relacionadas con el ejercicio. De estos, 42 pacientes sufrieron disecciones aórticas tipo A de Stanford. En la mayoría (26/49), la halterofilia se asoció con disección aórtica349. Además, en un estudio retrospectivo de cohortes publicado recientemente con 615 pacientes con disección aórtica aguda de tipo A, se descubrió que el 4,1% de los casos estaban relacionados con actividades deportivas. El deporte más citado fue el golf (32%), pero este dato no se corrigió por el porcentaje de participantes en el deporte y probablemente está relacionado con que los golfistas son, en general, mayores y tienen mayor riesgo de hipertensión, de ahí el potencial de disección350.
5.4.4Efectos en el diámetro aórtico y la tensión parietalEn un estudio transversal que incluyó a 58 deportistas de competición con VAB, no se mostró correlación entre las dimensiones aórticas y la duración del entrenamiento351. Dos estudios compararon a deportistas y personas sedentarias con VAB, y no se informó de diferencias en la tasa de crecimiento aórtico entre ambos grupos.
Dos modelos murinos con SMF en los que se investigaron los efectos del ejercicio suave dinámico en la pared aórtica mostraron una reducción en la tasa de crecimiento del diámetro aórtico en los ratones con SMF que realizaban ejercicio dinámico de suave a moderado en comparación con los ratones con SMF sedentarios352,353. Entre los ratones que realizaban ejercicio, la pared aórtica se reforzó y se necesitó más estrés mecánico para inducir la rotura aórtica. Se observó un efecto protector óptimo en las intensidades de entrenamiento al 55-65% del consumo máximo de O2 (VO2máx).
5.4.5RecomendacionesSe ha documentado perfectamente el beneficio del ejercicio regular en la forma física, el bienestar psicológico y las interacciones sociales, así como los efectos positivos en la hipertensión y el futuro riesgo de disección concomitante. La mayoría de los pacientes con enfermedad de la aorta se benefician de ciertos programas de ejercicio mínimo y al menos pueden participar en deportes recreativos (tabla14). Algunas lesiones no son compatibles con el entrenamiento de resistencia y los deportes atléticos debido al alto riesgo de disección o rotura. Las recomendaciones para el ejercicio y el deporte deben individualizarse y basarse en el diagnóstico de base, el diámetro aórtico, los antecedentes familiares de disección o muerte súbita (factor de riesgo) y la forma física y la experiencia preexistentes. Se recomienda una ergometría para evaluar la respuesta de la presión sanguínea antes de la práctica deportiva.
Clasificación del riesgo de practicar deporte de los pacientes con enfermedad de la aorta.
| Riesgo bajo | Riesgo bajo-intermedio | Riesgo intermedio | Riesgo alto | |
|---|---|---|---|---|
| Diagnóstico | • Aorta<40mm en VAB o VAT• Síndrome de Turner sin dilatación aórtica | • SM u otro síndrome de aortopatía hereditaria sin dilatación aórtica• Aorta 40-45mm en VAB o VAT• Tras cirugía exitosa de la VAB u otra situación de bajo riesgo | • Dilatación aórtica moderada (40-45mm en SM y otras aortopatías hereditarias; 45-40 en VAB o VAT, ITA síndrome de Turner 20-25mm/m2, tetralogía de Fallot<50mm)• Tras cirugía aórtica exitosa por SM o aortopatía hereditaria | • Dilatación aórtica grave (> 45mm en SM y otras aortopatías hereditarias,<50mm en VAB o VAT, ITA síndrome de Turner>25mm/m2, tetralogía de Fallot>50mm)• Tras cirugía con secuelas |
| Recomendaciones | • Se permiten todos los deportes, con preferencia por los de resistencia sobre los de potencia | • Se debe evitar el ejercicio de alta y muy alta intensidad, de contacto y de potencia• Se prefieren los deportes de resistencia sobre los de potencia | • Solo deportes de habilidad, mixtos o de resistencia en intensidad baja | • Los deportes están contraindicados (temporalmente) |
| Seguimiento | Cada 2-4 años | Cada 1-2 años | Cada 6 meses-1año | Revaluación tras el tratamiento |
ITA: índice de tamaño aórtico; SM: síndrome de Marfan; VAB: válvula aórtica bicúspide; VAT: válvula aórtica tricúspide.
Recomendaciones sobre el ejercicio y la participación en deportes para pacientes con enfermedad de la aorta
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Antes de empezar el ejercicio, se recomienda la estratificación del riesgo, con una evaluación exhaustiva que incluya imágenes avanzadas de la aorta (TC/RMC) y ergometría con evaluación de la presión arterial | I | C |
| Se recomienda el seguimiento regular con evaluación del riesgo | I | C |
| Se debe considerar el ejercicio dinámico como más apropiado que el estático | IIa | C |
| Se debe considerar la práctica deportiva de competición o de ocio (excepto deportes de potencia) para los pacientes con bajo riesgo | IIa | C |
| Se puede considerar la participación en programas de ejercicio de ocio individualizados para pacientes con alto riesgo (tabla14) | IIb | C |
| No se recomiendan los deportes de competición para pacientes con alto riesgo (tabla14) | III | C |
RMC: resonancia magnética cardiaca; TC: tomografía computarizada.
aClase de recomendación.
bNivel de evidencia.
Las miocardiopatías son una causa importante de PSC/MSC en personas jóvenes y el ejercicio está implicado como un desencadenante de arritmias letales17–19,28. La detección de miocardiopatías tiene implicaciones importantes relacionadas con la práctica continua de ejercicio. La llegada de estrategias preventivas para la MSC ha llevado a un significativo aumento del número de pacientes jóvenes predominantemente asintomáticos con miocardiopatías que quieren ejercitarse. En el asesoramiento de estos pacientes, es esencial encontrar el equilibrio entre protegerles de los efectos potencialmente adversos del ejercicio y privarles de sus múltiples beneficios.
5.5.1Miocardiopatía hipertróficaEl diagnóstico de MCH se basa en la presencia de HVI definida como un grosor parietal telediastólico máximo ≥ 15mm en cualquier segmento miocárdico o en la ecocardiografía, RMC o TC355. La MCH también se puede considerar en pacientes con menos HVI (grosor parietal ≥ 13mm) en el contexto de antecedentes familiares de MCH comprobados o una prueba genética positiva355.
5.5.1.1Estratificación del riesgo en la miocardiopatía hipertróficaLas evidencias circunstanciales y una gran colección sistemática de datos de MSC de jóvenes durante el deporte en Estados Unidos indican que el ejercicio aumenta el riesgo de PSC/MSC en pacientes con MCH18. Por ello, las recomendaciones de consenso previas restringían la participación de todos los pacientes con MCH en deportes de competición1,356,357.
Más recientemente, pequeños ensayos clínicos longitudinales indican que el riesgo de MSC durante el ejercicio puede ser considerablemente menor que lo que se creía inicialmente. Lampert et al. informaron de que los pacientes con MCH que continuaron su práctica deportiva tras el implante de desfibriladores automáticos implantables (DAI) no mostraron un aumento en el número de choques cardiovasculares durante el ejercicio358,359. En un estudio transversal de 187 pacientes con MCH el ejercicio vigoroso no se asoció con la aparición de AV358. Pellicia et al. informaron de resultados clínicos en una cohorte de 35 deportistas con MCH que participaron en entrenamiento y competición de 5 a 31 años (media, 15±8 años). El seguimiento de 9 años no mostró diferencias en la incidencia de síntomas o los eventos mayores entre los deportistas que abandonaron el ejercicio (n=20) y los que continuaron participando en deportes de competición (n=15)360. En una serie necrópsica, solo el 23% de las 194 muertes por MCH tuvieron lugar durante la práctica deportiva, y afectaron a los varones con una media de edad de 30 años361. Por último, los pacientes con MCH que participaron en programas de rehabilitación demostraron un aumento significativo en la capacidad funcional sin eventos adversos362,363.
En conclusión, existen pocas evidencias que indiquen que los pacientes con MCH son vulnerables a arritmias letales durante el ejercicio y la participación deportiva. Sobre esto, la restricción sistemática de deportes de competición para todos los pacientes afectados probablemente no esté justificada y es razonable un enfoque más liberal sobre la práctica deportiva de algunos pacientes tras una evaluación cuidadosa3. Esto es especialmente importante para la mayoría de los pacientes con MCH que quieren participar en deportes amateur o actividades de ocio para mantener su bienestar físico y mental.
5.5.1.2Evaluación basal de los pacientes con MCHLa evaluación de los pacientes con MCH que soliciten asesoramiento sobre el ejercicio requiere un abordaje sistemático. La evaluación basal debe incluir los antecedentes familiares y personales con consideración de las edades y los años de ejercicio antes del diagnóstico, la evaluación de la gravedad de la forma clínica de MCH y la presencia de factores de riesgo de MSC/PSC convencionales. En pacientes mayores con MCH, se debe revisar la presencia de comorbilidades cardiacas tales como hipertensión y cardiopatía isquémica, que pueden contribuir a un peor pronóstico de la MCH364,365.
5.5.1.3HistoriaLa presencia de síntomas atribuidos a la MCH debe motivar recomendaciones sobre el ejercicio más conservadoras. Se debe recomendar a los pacientes con antecedentes de parada cardiaca o síncope sin pródromos con síntomas inducidos por el ejercicio que solo participen en deportes recreativos de baja intensidad.
5.5.1.4ECG en reposo y ambulatorioUn ECG de 12 derivaciones tiene poco valor para la estratificación del riesgo. La monitorización electrocardiográfica ambulatoria, preferiblemente de 48 h, es importante para detectar arritmias ventriculares y supraventriculares. El periodo de monitorización debe incluir una sesión de ejercicio. Las taquicardias ventriculares no sostenidas (TVNS) asintomáticas confieren un considerable riesgo de MSC a los pacientes más jóvenes (≤ 35 años)355. Las arritmias supraventriculares paroxísticas pueden tener serias implicaciones para la capacidad funcional y, en caso de FA, para la prevención de accidentes cerebrovasculares (ACV)366.
5.5.1.5EcocardiografíaEn relación con la estratificación del riesgo de MSC, se debe evaluar los siguientes indicadores: a) grosor de la pared del VI; b) gradiente del infundíbulo del VI, y c) diámetro de la aurícula izquierda355. El gradiente del infundíbulo del VI se debe evaluar en todos los pacientes en reposo, durante la maniobra de Valsalva, con bipedestación repentina y tras ejercicio estático ligero, como sentadillas repetidas. Por convención, la obstrucción del infundíbulo del VI se define como un gradiente de presión pico ≥ 30mmHg en reposo o durante la provocación física. Un gradiente ≥ 50mmHg se considera hemodinámicamente importante. La ecocardiografía de estrés se debe considerar para todos los pacientes con síntomas de esfuerzo que tengan movimiento sistólico anterior de la válvula mitral en reposo, pero no muestren obstrucción del infundíbulo del VI o muestren solo una obstrucción leve-moderada con las maniobras mencionadas.
5.5.1.6Resonancia magnética cardiacaLa RMC es cada vez más una herramienta necesaria para confirmar el diagnóstico y evaluar la estratificación del riesgo en pacientes con MCH. El RTG, que indica fibrosis miocárdica, puede hallarse en hasta el 75% de los pacientes con MCH y por sí solo no basta para discriminar desenlaces. Sin embargo, un RTG extenso (≥ 15% del miocardio del VI) puede identificar a pacientes con riesgo aumentado de taquiarritmias ventriculares y MSC367–370.
5.5.1.7ErgometríaLa ergometría (o PECP) debe ser parte de la evaluación sistemática para evaluar la capacidad funcional de los pacientes con MCH que quieran ejercitarse. Además, una repuesta anormal de la PA al ejercicio (definida como un aumento de la PAS basal < 20mmHg o hipotensión inducida por el ejercicio)371,372 y la presencia de síntomas inducidos por el ejercicio o arritmias son marcadores de alto riesgo y deben conllevar unas recomendaciones sobre el ejercicio más conservadoras.
5.5.1.8Pruebas genéticasLas pruebas genéticas actuales están reservadas para el cribado en cascada de familiares. Estas pruebas no pueden fundamentar decisiones relacionadas con el riesgo de MSC/PSA y no deben llevarse a cabo para la estratificación relacionada con el ejercicio.
5.5.1.9Escala de riesgo de miocardiopatía hipertrófica de la ESCLa escala de riesgo de la ESC se sirve de 7 variables (edad, síncope, antecedentes familiares de MSC por MCH, grosor máximo de la pared del VI, diámetro de la aurícula izquierda, obstrucción del flujo del VI y TVNS) para evaluar el riesgo de MSC en pacientes con MCH355,373. Esta información se puede introducir en una calculadora en línea (https://doc2do.com/hcm/webHCM.html) para estimar el riesgo individual a 5 años y orientar sobre si está indicado un DAI profiláctico. Para el propósito de esta guía, el riesgo de MSC se define como bajo si es < 4%, moderado entre ≥ 4% y < 6% y alto si es ≥ 6% a 5 años.
5.5.1.10Recomendaciones de ejercicioTras completar la evaluación basal y antes de recomendar la forma y la intensidad de ejercicio apropiadas, se deben considerar: a) la presencia de síntomas; b) la puntuación en la escala de riesgo de la ESC; c) la presencia de obstrucción del TSVI en reposo o inducible en ejercicio; d) la respuesta hemodinámica (PA) al ejercicio, y e) la presencia de arritmias en reposo o inducidas por el ejercicio.
Aunque esta guía apoyan un abordaje más liberal de la práctica deportiva, es indudable que incluso la ausencia de todos los grandes factores de riesgo no proporciona inmunidad contra la MSC374. Además, la escala de riesgo de la ESC se basa en evidencias derivadas de cohortes predominantemente no deportistas373. Puesto que no hay datos que indiquen que este abordaje para la estimación del riesgo es menos válido en deportistas, se debe tener en cuenta que no refleja con precisión el riesgo de MSC de las personas expuestas al estrés hemodinámico y metabólico de los deportes de alta intensidad. Por lo tanto, cuando se aconseje a pacientes con MCH sobre la participación en programas de ejercicio de alta intensidad y deportes de competición, esta consideración debe ser una parte integral de la discusión durante la toma de decisiones conjunta.
5.5.1.11Consideraciones especialesLa edad del paciente puede influir en el riesgo. La media de edad de los fallecidos de la mayor serie de MSC de Estados Unidos fue 18 años, y el 65% de las muertes fueron de deportistas de edad ≤ 17 años354. Aunque la juventud no debe excluir a una persona del ejercicio de alta intensidad en ausencia de factores de riesgo adicionales, se debe considerar en la discusión con el propio paciente y sus padres o tutores legales. Además, ciertos deportes pueden suponer más riesgo de MSC, como los deportes muy dinámicos con parada-arranque como el baloncesto o el fútbol.
Los pacientes con genotipo positivo en los que no se encuentre ninguna característica fenotípica o arrítmica de MCH pueden participar en todos los deportes. En estos pacientes se debe evaluar los rasgos fenotípicos y estratificar el riesgo anualmente.
5.5.1.12SeguimientoSe recomienda el seguimiento anual para la mayoría de los pacientes con MCH que se ejerciten regularmente. Los seguimientos más frecuentes (6 meses) se deben considerar en pacientes adolescentes y adultos jóvenes cuya forma clínica y, por tanto, su riesgo de MSC todavía estén en evolución y que sean más vulnerables a MSC relacionada con el ejercicio58,239. La evaluación durante los seguimientos se debe centrar en la evolución de la enfermedad y la estratificación del riesgo. La aparición de nuevos síntomas debe forzar la interrupción del ejercicio y una revaluación.
Recomendaciones sobre el ejercicio y la participación en deportes para pacientes con miocardiopatía hipertrófica
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Recomendaciones sobre ejercicio | ||
| Se puede considerar la práctica de ejercicio/deporte de competición, si se desea (con la excepción de aquellos para quienes un síncope podría implicar daño o muerte), para los pacientes que no tengan marcadores de riesgo aumentadoc tras evaluación por un experto | IIb | C |
| Se puede considerar la realización de ejercicio de baja o moderada intensidad, si se desea, para los pacientes con algún marcador de riesgo aumentadoc tras evaluación por un experto | IIb | C |
| Se puede considerar la participación en todos los deportes de competición, si se desea, de los pacientes con genotipo positivo/fenotipo negativo para MCH | IIb | C |
| No se recomienda la participación en ejercicios de alta intensidad (tanto recreativos como de competición) de los pacientes que tengan cualquier marcador de riesgo aumentadoc | III | C |
| Seguimiento y otras consideraciones sobre el riesgo | ||
| Se recomienda el seguimiento anual de los pacientes que se ejercitan regularmente | I | C |
| Se debe considerar el seguimiento cada 6 meses de los pacientes adolescentes y adultos jóvenes más vulnerables a la MSC relacionada con el ejercicio | IIa | C |
| Se debe considerar la evaluación anual de los pacientes con genotipo positivo/fenotipo negativo a fin de caracterizar el fenotipo y estratificar el riesgo | IIa | C |
ESC: Sociedad Europea de Cardiología; MCH: miocardiopatía hipertrófica; MSC: muerte súbita cardiaca; PA: presión arterial; TSVI: tracto de salida del ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cLos marcadores de riesgo aumentado incluyen: a) síntomas cardiacos o antecedentes de parada cardiaca o síncope de origen desconocido; b) riesgo ESC moderado (≥ 4%) a los 5 años; c) gradiente en el TSVI en reposo>30mmHg; d) respuesta anormal de la PA al ejercicio, y e) arritmias inducidas por el ejercicio.
Véase en la tabla4 los diferentes índices de intensidad del ejercicio y zonas de entrenamiento.
5.5.2Miocardiopatía arritmogénicaLa miocardiopatía arritmogénica del ventrículo derecho (MAVD) se define patológicamente como el reemplazo del tejido del VD por tejido fibroadiposo y clínicamente por AV potencialmente letales. Al principio, se la definió como una enfermedad que afectaba predominantemente al VD, y el diagnóstico se basa actualmente en los criterios de probabilidad del Grupo de Trabajo que incluyen características electrofisiológicas, anatómicas, funcionales y clínicas de la enfermedad375. Desde su primera descripción, el concepto de MAVD ha evolucionado para incluir formas clínicas asintomáticas o subclínicas y cardiopatía de ambos ventrículos. Actualmente se sabe que ambos ventrículos están afectados en la mayoría de los casos376–378. Esto ha llevado a acuñar un nuevo término, miocardiopatía arritmogénica (MCA), que incluye una variedad de términos diagnósticos para diferentes enfermedades (genéticas y adquiridas). Aunque todavía se debe consensuar la definición de «cardiopatía arritmogénica», se lo puede considerar un término general para una familia de enfermedades que se caracterizan por anomalías en ambos ventrículos miocárdicos, incluida la infiltración fibroadiposa y la cicatrización, identificadas durante la exploración patológica o técnicas de imagen cardiaca y AV.
El término MCA se utiliza en esta guía; sin embargo, es importante reconocer que la mayoría de la literatura sobre la influencia del ejercicio en la evolución de la enfermedad y el riesgo de MSC se extraen de cohortes con MAVD tradicional. Esto se ve reflejado en las recomendaciones que se proporcionan en esta guía. Por lo tanto, es posible que las recomendaciones no reflejen con precisión la enfermedad predominante del VI, que constituye una pequeña proporción del espectro de la enfermedad en la que el impacto del ejercicio en la forma clínica de la enfermedad y el riesgo están menos claros que en la variante del VD. Donde sea apropiado, se proporcionan recomendaciones para otras enfermedades que se pueden agrupar razonablemente bajo el término general de MCA (incluidos subtipos de miocardiopatía dilatada).
5.5.2.1Estratificación del riesgo en la miocardiopatía arritmogénicaLa MCA representa una proporción significativa de las MSC de pacientes jóvenes y deportistas28. Los factores de riesgo de MSC establecidos para los que se debe considerar un DAI incluyen MSC recuperada, síncope sin pródromos, taquicardia ventricular y disfunción sistólica derecha/izquierda379. Se ha propuesto recientemente un nuevo modelo de predicción del riesgo de AV, pero todavía no está validado380. Los programas de ejercicio regular y de alta intensidad se asocian con una aceleración de la evolución de la enfermedad y peores desenlaces clínicos381–389.
En un modelo experimental murino con ratones heterocigotos con deficiencia de catenina gamma, el entrenamiento aceleró la disfunción del VD y las arritmias382. Se han confirmado resultados similares en humanos portadores de mutaciones en genes desmosómicos que participan en deportes de resistencia vigorosa (> 70% VO2máx)384. Se ha informado de resultados similares en pacientes con MCA y familiares asintomáticos con mutaciones genéticas positivas, a pesar de una definición conservadora de la forma atlética (ejercicio con intensidad ≥ 6 MET ≥ 4h/semana durante al menos 6 años)386. Recientemente, los resultados de un estudio multidisciplinario norteamericano mostraron que los pacientes que participan en deportes de competición tenían aumentado al doble el riesgo de taquiarritmias ventriculares o muerte y presentación temprana de los síntomas, en comparación con los pacientes que participaban en deportes recreativos y personas sedentarias385. Entre los pacientes que participaban en deportes de competición, el inicio de la práctica deportiva a una edad temprana se asoció con una presentación prematura de los síntomas y un perfil clínico adverso. La reducción de la intensidad del ejercicio se asoció con una disminución sustancial del riesgo de taquiarritmias ventriculares o muerte al mismo nivel que los pacientes inactivos385. Por último, en un registro multinacional de 393 deportistas de competición con un DAI implantado que continuaron participando regularmente en competiciones, el 20% de los deportistas con MCA recibieron una descarga durante el esfuerzo en comparación con el 10% en reposo, durante un seguimiento medio de 44 meses. El diagnóstico de MCA fue la única variable asociada con las descargas apropiadas durante la competición359–389.
5.5.2.2Evaluación basal en pacientes con miocardiopatía arritmogénicaSe requiere un abordaje sistemático en la evaluación de pacientes con MCA que soliciten asesoramiento sobre el ejercicio. La evaluación basal debe incluir antecedentes de síntomas y antecedentes familiares de MCA o MSC, evaluación de la gravedad de la forma clínica de MCA y la presencia de cualquier factor convencional de riesgo de MSC/PSC.
5.5.2.3HistoriaEl síncope por sospecha de arritmia es un importante factor de riesgo de MSC/PSC y un predictor de futuros tratamientos con DAI390–394. La presencia de síntomas atribuidos a la MCA debe reforzar unas recomendaciones sobre el ejercicio conservadoras. A las personas con antecedentes de parada cardiaca o síncope sin pródromos o con síntomas inducidos por el ejercicio, se les debe recomendar que participen solo en programas de ejercicio recreativo de baja intensidad.
5.5.2.4ECG en reposo y ambulatorioAdemás de su valor diagnóstico, un ECG de 12 derivaciones puede aportar información útil relacionada con la estratificación del riesgo en la MA. La presencia de una inversión extensa de la onda T en 3 o más derivaciones precordiales o la inversión de la onda T en 2 de las 3 derivaciones inferiores confiere más riesgo de MSC/PSC395,396.
La monitorización ambulatoria con ECG es importante para detectar AV. Se deben realizar todos los esfuerzos posibles para que el periodo de monitorización incluya una sesión de ejercicio. La presencia de TVNS o una carga importante de extrasístoles ventriculares (≥ 1.000/24h), incluso en pacientes asintomáticos, confiere un riesgo aumentado de arritmias letales392,393,397.
5.5.2.5Ecocardiografía y resonancia magnética cardiacaEn relación con la estratificación del riesgo de MSC, se debe evaluar la gravedad de la afección del VD y el VI en cuanto dilatación ventricular y disfunción sistólica. La RMC es más útil que la ecocardiografía en la evaluación de anomalías del movimiento de la pared del VD y también puede cuantificar el grado de infiltración adiposa del miocardio o cicatrización. Cuanto más extendida esté la enfermedad, mayor es el riego de arritmias389,399.
5.5.2.6ErgometríaLa ergometría debe ser parte de la evaluación sistemática de todos los pacientes con MCA que quieran hacer ejercicio, ya que puede proporcionar información sobre la capacidad funcional y la estratificación del riesgo. La ergometría de los pacientes con MCA no debe realizarse durante «fases calientes». La presencia de síntomas inducidos por el ejercicio o arritmias debe conllevar recomendaciones más conservadoras.
5.5.2.7Pruebas genéticasEl genotipo también puede tener valor pronóstico. En la variante MAVD, diversos estudios han informado de que los portadores de múltiples variantes patogénicas en el mismo gen desmosómico o mutaciones en 2 o más genes pueden tener un riesgo arrítmico hasta 4 veces mayor que aquellos con una única mutación400. Ciertos genotipos como DSP y TMEM43, aunque también LMNA y FLNC, asociados con otras formas clínicas de MCA (véase la sección 5.5.4) son propensos a un alto riesgo arrítmico que puede preceder a la enfermedad estructural401,402.
5.5.2.8Recomendaciones de ejercicioLa evidencia científica en general respalda desaconsejar la práctica deportiva de alta intensidad a los pacientes con MCA, ya que se asocia con una evolución acelerada de la enfermedad y mayor riesgo de AV y eventos mayores. Esta recomendación también se aplica a los portadores genéticos de variantes de MCA incluso en ausencia de la forma clínica sintomática.
5.5.2.9Consideraciones especialesLa presentación a edades tempranas y el sexo masculino se asocian con un riesgo aumentado de arritmias malignas en la MCA379. Aunque la juventud no debe excluir a ningún paciente de realizar ejercicio de intensidad moderada en ausencia de características de alto riesgo, la edad se debe tener en consideración en las conversaciones con el paciente y sus padres o tutores legales. Además, se debe considerar que específicamente los deportes altamente dinámicos con parada-arranque, como el baloncesto y el fútbol, pueden suponer mayor riesgo de MSC, especialmente para los deportistas que compiten a alto nivel17,365.
5.5.2.10SeguimientoSe recomienda el seguimiento anual de la mayoría de los pacientes con MCA que se ejerciten regularmente. Los seguimientos más frecuentes (cada 6 meses) se deben considerar para adolescentes y adultos jóvenes cuya forma clínica de MCA y, por lo tanto, el riesgo de MSC todavía estén en evolución, especialmente si realizan ejercicio de intensidad moderada-alta. Los seguimientos más frecuentes también se deben considerar para los pacientes con genotipos arrítmicos de alto riesgo tales como DSP, TMEM43 y portadores de múltiples variantes patogénicas. La aparición de nuevos síntomas debe forzar la interrupción del ejercicio y una revaluación.
Recomendaciones sobre el ejercicio y la participación en deportes para pacientes con miocardiopatía arritmogénica
| Recomendación | Clasea | Nivelb |
|---|---|---|
| Recomendaciones sobre ejercicio | ||
| Se debe considerar la participación de todos los pacientes en ejercicio de baja intensidad 150 min/semana | IIa | C |
| Se puede considerar la participación en ejercicio/deporte recreativo de intensidad baja-moderada, si se desea, de los pacientes sin antecedentes de parada cardiaca/AV, síncope inexplicable, anomalías cardiacas estructurales mínimas,<500 EV/24h y sin evidencia de AV complejas inducidas por el ejercicio | IIb | C |
| No se recomienda la participación en ejercicio/deporte recreativo de alta intensidad o cualquier deporte de competición de los pacientes con MCA, incluidos aquellos con genotipo positivo/fenotipo negativo384,386 | III | B |
| Seguimiento y otras consideraciones sobre el riesgo | ||
| Se recomienda el seguimiento anual de los pacientes que se ejercitan regularmente | I | C |
| Se debe considerar el seguimiento cada 6 meses de los pacientes adolescentes y adultos jóvenes, ya que son más vulnerables a la MSC relacionada con el ejercicio | IIa | C |
| Se debe considerar la evaluación anual de los pacientes con genotipo positivo/fenotipo negativo a fin de caracterizar fenotipo y estratificar el riesgo | IIa | C |
| Se debe considerar también el seguimiento cada 6 meses de los pacientes con genotipos de alto riesgo arritmogénico, como DSP, TEMEM43 y portadores de variantes patogénicas | IIa | C |
AV: arritmia ventricular; EV: extrasístole ventricular; MCA: miocardiopatía arritmogénica; MSC: muerte súbita cardiaca.
aClase de recomendación.
bNivel de evidencia.
Véase en la tabla4 los diferentes índices de intensidad del ejercicio y zonas de entrenamiento.
5.5.3Recomendaciones de ejercicio para pacientes con miocardiopatía no compactadaLa miocardiopatía no compactada del ventrículo izquierdo (MNCVI) es una miocardiopatía sin clasificación caracterizada por la trabeculación y los recesos profundos que comunican con la cavidad del VI403,404. La presentación clínica de la MNCVI incluye disfunción ventricular izquierda progresiva, taquiarritmias ventriculares y eventos tromboembólicos404.
Los deportistas a menudo muestran hipertrabeculación del VI y hasta el 8% cumple criterios ecocardiográficos para el diagnóstico de MCNC405. La hipótesis es que un aumento de la precarga cardiaca puede mostrar trabeculaciones406. Por lo tanto, la sospecha de MNCVI en deportistas solo se debe considerar si se cumplen los criterios ecocardiográficos de MNCVI y también muestran disfunción ventricular izquierda (FE<50%), síntomas sugestivos de cardiopatía o antecedentes familiares de MNCVI407–409. Los criterios ecocardiográficos adicionales incluyen una capa epicárdica compactada muy fina (en la RMC, 5 mm en telediástole o < 8mm en sístole) y relajación miocárdica deteriorada (E’<9cm/s en Doppler tisular)404,405,410,411. Estos deportistas necesitarán más evaluaciones con RMC, ecocardiografía de esfuerzo y monitorización Holter para evaluar la presencia de fibrosis del VI, trombos cardiacos, reserva contráctil y arritmias complejas inducidas por el ejercicio405,406.
5.5.3.1Estratificación del riesgoLos desenlaces clínicos de MNCVI están determinados por la presencia de síntomas, la gravedad de la disfunción del VI y la naturaleza de las AV. No se ha informado de eventos cardiacos adversos en ausencia de disfunción del VI independientemente de la gravedad de la trabeculación del VI405–409.
5.5.3.2SeguimientoSe recomienda el seguimiento regular para pacientes con MNCVI. La aparición de nuevos síntomas debe forzar la interrupción del ejercicio y una revaluación.
Recomendaciones sobre ejercicio para pacientes con miocardiopatía no compactada del ventrículo izquierdo
| Recomendaciones sobre el diagnóstico | Clasea | Nivelb |
|---|---|---|
| Se debe considerar el diagnóstico de MNCVI en deportistas si cumplen los criterios de imagen junto con síntomas cardiacos, antecedentes familiares de MNCVI o miocardiopatía, disfunción sistólica (FE<50%) o diastólica (E’< 9cm/s) del VI, una capa epicárdica fina compactada (< 5mm en telediástole por RMC o<8mm en sístole por ecocardiografía) o ECG de 12 derivaciones anormal404,405,410,411 | IIa | B |
| Recomendaciones sobre ejercicio | ||
| Se puede considerar el ejercicio/la práctica deportiva de competición de alta intensidad, si se desea (con la excepción de aquellos para quienes el síncope podría implicar daño o muerte), de los pacientes asintomáticos con MNCVI y FEVI ≥ 50% y ausencia de AV frecuentes o complejas | IIb | C |
| Se puede considerar la participación en programas de ejercicio recreativo de intensidad de baja a moderada, si se desea, de los pacientes con FEVI 40-49% en ausencia de síncope o AV frecuentes o complejas durante la monitorización ambulatoria con Holter o la ergometría | IIb | C |
| Se puede considerar la práctica deportiva de intensidad alta o muy alta, incluidos los deportes de competición, de los pacientes con genotipo positivo/fenotipo negativo para MNCVI (con la excepción de portadores de LMNA A/C o filamin C) que lo deseen | IIb | C |
| No se recomienda el ejercicio o los deportes de competición de alta intensidad de los pacientes con alguno de los siguientes: síntomas, FEVI<40% o AV frecuentes o complejas durante la monitorización Holter ambulatoria o la ergometría | III | C |
| Seguimiento y otras consideraciones | ||
| Se recomienda una evaluación anual para la estratificación del riesgo de los pacientes con MNCVI o con genotipo positivo/fenotipo negativo que se ejercitan regularmente | I | C |
AV: arritmia ventricular; ECG: electrocardiograma; FEVI: fracción de eyección del VI; MNCVI: miocardiopatía no compactada del VI; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
La miocardiopatía dilatada (MD) se caracteriza por disfunción del VI o biventricular con o sin dilatación que no se explica por condiciones de carga alteradas o EC. Entre las posibles causas, se incluyen predisposición genética, miocarditis, fármacos, toxinas, miocardiopatía periparto y, en algunos casos, el efecto acumulativo de más de un factor412.
El espectro clínico de la enfermedad puede variar de expresión fenotípica leve caracterizada por la ausencia de síntomas, dilatación aislada del VI y función sistólica de baja a baja-normal, a la forma clínica sintomática con síntomas limitantes y disfunción sistólica significativa. Las arritmias ventriculares son comunes en la MD, particularmente en pacientes con antecedentes de miocarditis o con mutaciones de la lamina A/C o la filamina C413,414. El riesgo de MSC en la MD es de un 2-3% por año y aumenta a menor FE y peor clase NYHA415. El entrenamiento mejora la capacidad funcional, la función ventricular y la calidad de vida de los pacientes con MD, por lo que debe considerarse como una parte integral del tratamiento de los pacientes afectados416,417. Sin embargo, se ha informado del ejercicio intenso y los deportes de competición como causa de MSC en la MD28,46,58,413,418.
La hipertrofia de la cavidad del VI en personas entrenadas no se asocia con disfunción sistólica y, fuera del contexto de enfermedad familiar, representa una adaptación fisiológica benigna si concuerda con el tipo de deporte practicado (por norma general, deportes de resistencia) y la talla corporal del deportista. Por el contrario, no se debería considerar una adaptación normal una FE ligeramente reducida (45-50%) en un deportista con hipertrofia de la cavidad del VI. En estos casos, la evaluación de la función del VI durante el ejercicio puede proporcionar datos diagnósticos importantes319. Que no se logre aumentar la FE durante el pico de ejercicio más de un 10% respecto al valor basal puede indicar un proceso patológico319,419,420. La presencia de disfunción diastólica o la reducción del consumo de oxígeno pico en la PECP también pueden proporcionar información de apoyo para el diagnóstico diferencial. La RMC se ha convertido en una herramienta importante para el diagnóstico y la estratificación del riesgo de MD.
Específicamente, la presencia de RTG, con distribución típica a media pared, se ha asociado con un riesgo aumentado de AV y MSC319,419,421–424.
5.5.4.1Evaluación basal para pacientes con miocardiopatía dilatadaLa evaluación clínica de los pacientes que soliciten asesoramiento sobre el ejercicio debe tener como objetivo: a) determinar la posible etiología; b) evaluar el estado clínico, incluyendo la historia de ejercicio y la capacidad funcional; c) revisar el grado de dilatación y disfunción del VI; d) evaluar la respuesta hemodinámica al ejercicio, y e) evaluar la presencia de síntomas inducidos por el ejercicio o arritmias.
En general, los pacientes con MD asintomáticos deben abstenerse de participar en los deportes más competitivos y en los recreativos o de ocio que impliquen intensidades moderadas o altas. Un grupo de pacientes seleccionados con MD y disfunción del VI (FEVI 45-50%) sin arritmias inducidas por el ejercicio o fibrosis miocárdica significativa pueden participar en la mayoría de los deportes de competición.
5.5.4.2Consideraciones especialesAunque se desconoce la historia natural de la mayoría de las variantes patogénicas, sería razonable permitir el ejercicio intenso y los deportes de competición a la mayoría de los pacientes con variantes patogénicas implicadas en la MD en ausencia de síntomas de MD observables. Sin embargo, se debe prestar especial atención a los pacientes con variables patogénicas asociadas con un aumento del riesgo o con arritmias potencialmente letales, como mutaciones de la lamina A/C o la filamina C. Existen nuevas evidencias de que el ejercicio puede tener un efecto adverso en la función cardiaca y el riesgo de arritmias potencialmente letales en pacientes con variantes patogénicas de la lamina A/C425–427. Estos pacientes no deben participar en ningún deporte de competición o ejercicio recreativo de alta o muy alta intensidad independientemente de la gravedad de la disfunción y la dilatación del VI428,429.
5.5.4.3SeguimientoSe recomienda el seguimiento regular de la mayoría de los pacientes con MD. La aparición de síntomas nuevos debe forzar la interrupción del ejercicio y una revaluación.
Recomendaciones sobre ejercicio para pacientes con miocardiopatía dilatada
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la participación en ejercicio recreativo de intensidad baja a moderada delos pacientes con MD independientemente de su FE, en ausencia de síntomas limitantes y AV inducidas por el ejercicio | IIa | C |
| Se puede considerar la participación en ejercicio de alta o muy alta intensidad, incluidos los deportes de competición (con la excepción de aquellos para quienes un síncope podría implicar daño o muerte), de los pacientes asintomáticos que cumplan todas las siguientes condiciones: a) función sistólica del VI ligeramente reducida (FE 45-50%); b) ausencia de AV frecuentes o complejas durante la monitorización Holter ambulatoria o durante la ergometría; c) ausencia de RTG en la RMC; d) se logra incrementar la FE un 10-55% con el ejercicio, y e) sin evidencias de genotipo de alto riesgo (lamina A/C o filamina C) | IIb | C |
| Se puede considerar la participación en todos los deportes de competición de los pacientes con MD y genotipo positivo/fenotipo negativo, con la excepción de portadores de mutaciones de alto riesgo (lamina A/C o filamina C) | IIb | C |
| No se recomienda la práctica deportiva de competición de alta o muy alta intensidad de los pacientes con MD y cualquiera de las siguientes: a) síntomas o antecedentes de parada cardiaca o síncope inexplicable; b) FEVI < 45%; c) AV frecuentes o complejas en el Holter ambulatorio o la ergometría; d) RTG extenso (> 20%) en la RMC, o d) genotipo de alto riesgo (lamina A/C o filamina C) | III | C |
| Recomendaciones de seguimiento | ||
| Se recomienda el seguimiento anual de los pacientes con MD que se ejerciten regularmente | I | C |
| Se debe considerar el seguimiento semestral de los pacientes con mutaciones de alto riesgo y adolescentes y adultos jóvenes cuya forma clínica de MD todavía esté evolucionando y sean más vulnerables a la MSC relacionada con el ejercicio | IIa | C |
| Se debe considerar la evaluación anual de los pacientes con genotipo positivo/fenotipo negativo a fin de caracterizar fenotipo y estratificar el riesgo | IIa | C |
AV: arritmia ventricular; MD: miocardiopatía dilatada; MSC: muerte súbita cardiaca; RMC: resonancia magnética cardiaca.
aClase de recomendación.
bNivel de evidencia.
La miocarditis es una enfermedad inflamatoria no isquémica del miocardio que puede causar disfunción cardiaca y arritmias. La miopericarditis se define como una pericarditis primaria con inflamación miocárdica y evidencia de biomarcadores de necrosis del miocito430,431. La etiología de la miocarditis es heterogénea, pero la infección viral es la causa más común en el mundo desarrollado. Los virus que causan las infecciones con más frecuencia son: enterovirus, virus Coxsackie B, parvovirus humano B-19, y herpesvirus humano tipo 6432,433. En adultos jóvenes, las drogas como la cocaína y los suplementos con anfetaminas también deben incluirse en la anamnesis430.
La presentación clínica es muy variable y el diagnóstico puede ser un reto. La enfermedad puede estar precedida por rinitis y los pacientes deportistas pueden presentar características inespecíficas de malestar general, fatiga o diarrea430,431. Por el contrario, en casos extremos la miocarditis puede semejar una IM o producir AV supraventriculares sintomáticas e inexplicadas por otras causas, IC, shock cardiogénico o MSC.
Aproximadamente el 50% de los pacientes muestran recuperación de la función del VI en 30 días; el 25%, disfunción cardiaca persistente y un 12-24% evolucionan a IC fulminante. La disfunción del VI es un importante factor pronóstico a largo plazo28,434.
5.5.5.2DiagnósticoLas concentraciones séricas de troponina cardiaca, por norma general, están elevadas en la miopericarditis y es un sensible marcador de necrosis del miocito inducida por inflamación cardiaca435.
El ECG tiene baja sensibilidad y las anomalías eléctricas no son específicas. Los patrones electrocardiográficos varían de no específicos en onda T y cambios en el segmento ST que semejan infarto de miocardio, bloqueo de la rama izquierda del haz de His (BRIHH) y arritmias supraventriculares y ventriculares frecuentes o complejas o bloqueo auriculoventricular o voltaje QRS bajo en presencia de efusión pericárdica436.
Las características electrocardiográficas reconocidas de miocarditis sintomática incluyen una cavidad del VI no dilatada con aumento del grosor parietal (con presencia de edema) o ligera dilatación de la cavidad del VI con debilitación de la pared miocárdica, generalmente con anomalías del movimiento de la pared localizadas437. La función sistólica global del VI puede variar de casi normal a gravemente reducida. Puede haber anomalías parietales localizadas438.
La RMC es la herramienta diagnóstica más útil y tiene una excelente sensibilidad para detectar hiperemia miocárdica, inflamación, edema o cicatrices localizadas439,440. Los criterios de Lake-Louise y la RTG se complementa actualmente con técnicas de RMC con mapeo T1/T2 y fracción de volumen extracelular (VEC)440–442. La extensión y la distribución del RTG con patrón no isquémico son predictores independientes de eventos CV durante el seguimiento439,440,443–447. Más concretamente, un aumento del volumen de RTG del 10% conlleva un aumento del 79% del riesgo de eventos CV mayores448,449.
La biopsia endomiocárdica es el método de referencia para el diagnóstico de miocarditis450,451. Un diagnóstico histológico permite distinguir entre los diferentes tipos de procesos inflamatorios (p. ej., miocarditis de células gigantes) y determina el tratamiento en presentaciones potencialmente letales430,445,452. El rendimiento diagnóstico de la biopsia endomiocárdica puede mejorarse analizando el genoma viral a través de la extracción de ADN-ARN y prueba de reacción en cadena de la polimerasa por transcriptasa inversa (RT-PCR), que ofrece la ventaja de identificar el microorganismo causante de la enfermedad445.
5.5.5.3Estratificación del riesgoLas series de casos han definido la miocarditis como un factor de riesgo de MSC, que representa hasta un 2-20% de las muertes súbitas de deportistas17,18,28,430,453,454. Los modelos murinos han mostrado en ratones infectados con el virus de Coxsackie que el ejercicio diario se asocia con un aumento de la carga viral, miocarditis fulminante y muerte súbita455. Estos modelos animales proporcionan cierta comprensión sobre el mecanismo de la MSC en el ejercicio, que parece provocar una respuesta inflamatoria acelerada y progresiva455–458.
5.5.5.4Recomendaciones de ejercicio para pacientes con miocarditisSe debe aconsejar a los deportistas con miocarditis sospechada o diagnosticada reciente que se abstengan de participar en deportes de competición u ocio mientras dure la activación inflamatoria, independientemente de la edad, el sexo o el grado de disfunción sistólica del VI459,460.
La duración de la inflamación miocárdica es altamente variable y la resolución completa puede llevar varios meses. Tanto la ESC como la AHA recomiendan abstenerse de practicar ejercicio de intensidad de moderada a alta durante un periodo de 3-6 meses459,460, aunque el tiempo preciso para retomar los deportes de competición o recreativos de intensidad moderada-alta puede basarse en la presencia de inflamación en las imágenes T2 y en el RTG en la RMC3,461.
Se debe evaluar exhaustivamente a los pacientes con miocarditis tras una recuperación completa para evaluar el riesgo de MSC relacionada con el ejercicio. Los estudios por imagen, la ergometría y la monitorización Holter proporcionan información esencial para la estratificación del riesgo. La función del VI reducida, la presencia de RTG y las AV complejas durante el ejercicio o en la monitorización Holter son reconocidos marcadores de riesgo de eventos adversos455,462,463.
La evaluación repetida debe consistir en la medición de la troponina y los biomarcadores de inflamación, ecocardiografía y monitorización electrocardiográfica prolongada. Los pacientes sin evidencia de inflamación persistente deben someterse a una ergometría. La RMC se debe repetir si se detectó edema miocárdico y RTG durante la fase aguda de la enfermedad. Se debe considerar la vuelta a las actividades deportivas de los pacientes asintomáticos con troponinas y biomarcadores de inflamación normales, función sistólica del VI normal en la ecocardiografía y la RMC, sin evidencias de inflamación persistente o fibrosis miocárdica en la RMC, buena capacidad funcional y ausencia de arritmias complejas durante el ejercicio o la monitorización electrocardiográfica prolongada430,434,453,459,460,464.
Los pacientes con antecedentes de miocarditis tienen riesgo de recidiva y evolución clínica asintomática, y el RTG durante la presentación aguda se asocia con un aumento en la incidencia de eventos cardiacos adverso mayores s. Por lo tanto, se recomienda la revaluación periódica anual443,445,454,463.
Entre los pacientes con miocarditis curada y persistencia de RTG en la RMC pero sin edema miocárdico a los 3-6 meses, los que están asintomáticos con niveles de troponinas y biomarcadores de inflamación normales, función sistólica del VI normal, sin evidencia de inflamación persistente en la RMC y ausencia de arritmias complejas durante el ejercicio y la monitorización electrocardiográfica (Holter de 48 h y ergometría) deben ser evaluados caso a caso, y la decisión de retomar los deportes de competición debe tomarse individualizadamente. Por el contrario, los pacientes con cicatrización miocárdica importante (RTG > 20%) y disfunción del VI persistente deben abstenerse de participar en programas de ejercicio y actividades deportivas de intensidad moderada a alta.
5.5.6PericarditisLa pericarditis se define como una inflamación del pericardio430,465, que puede estar precedida por síntomas de las vías respiratorias altas o gastrointestinales. Como en la miocarditis, los virus son los microorganismos patógenos que suelen causar esta enfermedad en el mundo desarrollado.
5.5.6.1DiagnósticoEl ECG no es específico, pero puede revelar elevación cóncava del segmento ST en la mayoría de las derivaciones o depresión de PQ en la fase aguda. La ecocardiografía puede revelar efusión pericárdica. Se debe considerar la RMC para los pacientes con aumento de troponina cardiaca para evaluar inflamación miocárdica concomitante. Además, la RMC identificará la inflamación activa del pericardio, engrosamiento de las capas pericárdicas y cualquier signo de constricción pericárdica.
5.5.6.2Estratificación del riesgoPor norma general la pericarditis se asocia con un buen pronóstico430,465,466. Sin embargo, ciertos pacientes pueden presentar un mayor riesgo de recidiva, entre ellos los pacientes con una temperatura > 38°C en la primera consulta, gran efusión pericárdica y resistencia al tratamiento con antiinflamatorios no esteroideos465,466.
5.5.6.3Recomendaciones de ejercicio para pacientes con pericarditisLos pacientes con pericarditis activa deben evitar el ejercicio y solo pueden retomar la práctica deportiva tras la resolución completa de la enfermedad activa467. Los pacientes con una evolución clínica más leve y resolución rápida pueden volver a practicar deporte en 30 días. Sin embargo, en los casos más graves puede ser necesario esperar hasta 3 meses para la resolución completa, seguida de una revaluación antes de la vuelta a la práctica deportiva.
Se debe monitorizar periódicamente a los pacientes asintomáticos con pequeña efusión pericárdica que se encuentra ocasionalmente en la ecocardiografía en ausencia de correlación clínica, pero se les debe prohibir la práctica deportiva. Los pacientes con pericarditis constrictiva deben evitar los deportes de competición y las actividades de ocio de intensidad moderada-alta. Se debe tratar a los pacientes con miopericarditis siguiendo las recomendaciones para la miocarditis.
Recomendaciones sobre ejercicio para pacientes con miocarditis
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la evaluación exhaustiva, con pruebas de imagen, ergometría y monitorización Holter, tras la recuperación de miocarditis aguda para evaluar el riesgo de MSC asociada con el ejercicio455,462,463 | I | B |
| Se debe considerar la vuelta a todas las formas de deportes de competición tras 3-6 meses sin síntomas para los pacientes con troponinas y biomarcadores de inflamación normales, función sistólica del VI normal en ecocardiografía y RMC, sin evidencias de inflamación persistente o fibrosis miocárdica en la RMC, buena capacidad funcional y ausencia de AV frecuentes o complejas en la monitorización Holter ambulatoria o en la ergometría430,434,453,459,460,464 | IIa | C |
| No se recomienda la práctica deportiva de ocio o competición para pacientes con diagnóstico probable o confirmado de miocarditis mientras haya inflamación459,460 | III | C |
| No se recomienda el ejercicio de intensidad moderada-alta durante un periodo de 3-6 meses tras miocarditis aguda459–461,467 | III | B |
| No se recomienda el ejercicio de ocio o los deportes de competición de alta intensidad para pacientes con cicatrización miocárdica residual y disfunción del VI persistente | III | C |
AV: arritmia ventricular; MSC: muerte súbita cardiaca; RMC: resonancia magnética cardiaca; VI: ventrículo ziquierdo.
aClase de recomendación.
bNivel de evidencia.
Recomendaciones sobre ejercicio para pacientes con pericarditis
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la vuelta al ejercicio, incluidos los deportes de competición, entre 30 días y 3 meses tras la recuperación completa de pericarditis aguda, dependiendo de la gravedad clínica459,460 | I | C |
| No se recomienda la práctica deportiva de ocio o de competición para pacientes con diagnóstico probable o confirmado de pericaridits reciente mientras la inflamación esté activa, independientemente de la edad, el sexo o el grado de disfunción sistólica del VI459,460 | III | C |
| No se recomienda la participación en ejercicio de intensidad moderada-alta, incluidos los deportes de competición, para pacientes con pericarditis constrictiva | III | C |
VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
Cuando los pacientes con arritmias conocidas o con una enfermedad potencialmente arritmogénica deseen participar en actividades deportivas, son 3 las preguntas que deben guiar el tratamiento: a) ¿hay riesgo aumentado de arritmias potencialmente letales?; b) ¿cómo se controlan los síntomas derivados de arritmias durante la práctica deportiva, pero también en reposo?, y c) ¿cuál es el impacto del deporte en la evolución de la enfermedad arritmogénica? La opinión general sobre la asociación entre los deportes y las arritmias es que el ejercicio sienta las bases para la arritmia en el contexto de enfermedad subyacente y preexistente, ya sea eléctrica, heredada o adquirida. Más aún, los programas de ejercicio regular pueden inducir o acelerar la evolución de la MCAVD38,384 incluso en pacientes con mutaciones subyacentes383,387,468. Conceptualmente, todas las adaptaciones estructurales y funcionales cardiovasculares debidas al ejercicio regular e intenso pueden contribuir a la aparición de arritmias auriculares, nodulares y ventriculares469. Así se explica que las recomendaciones sobre la práctica deportiva para personas con enfermedades arritmogénicas sean tan complejas.
5.6.2Fibrilación auricular5.6.2.1Pacientes sin fibrilación auricularLa AF moderada y regular es la piedra angular en la prevención de FA a través de la modificación de muchos de los factores predisponentes297,470–473. Por tanto, se debe animar a los pacientes con riesgo de FA a realizar ejercicio (véase la sección 4.2). Por el contrario, la FA tiene más prevalencia en deportistas activos y veteranos y quienes participan en deportes de resistencia de alta intensidad, lo que indica una relación con forma de U entre el ejercicio regular y la FA471,474–481. Esta asociación no se ha confirmado en mujeres478.
5.6.2.2Pronóstico y relevancia sintomática de la FA durante la práctica deportivaSiempre hay que descartar una cardiopatía estructural subyacente o preexcitación antes de aconsejar a pacientes con FA diagnosticada sobre la práctica deportiva. También es importante excluir el hipotiroidismo, el alcoholismo y el consumo de drogas. La práctica deportiva intensa debe interrumpirse temporalmente hasta que se identifique y se corrija la causa subyacente.
La FA de conducción rápida a través del nódulo auriculoventricular durante el ejercicio puede provocar síntomas como mareos, síncope, fatiga o deterioro de la forma física. Por lo tanto, se debe indicar a los pacientes que abandonen la AF con la aparición de síntomas y se debe optimizar el control de la frecuencia. La conducción 1:1 puede ocurrir, especialmente durante la taquicardia auricular o aleteo auricular (AA); por lo tanto, si se ha documentado AA, se debe considerar la ablación profiláctica del istmo cavotricuspídeo. Se permite la práctica de todos los deportes a los pacientes asintomáticos si hay evidencia de control de la frecuencia durante la FA en la ergometría o la monitorización electrocardiográfica en entrenamiento o competición.
Sin embargo, conseguir un control adecuado de la frecuencia puede ser difícil. Los bloqueadores beta son la elección lógica, pero pueden no tolerarse bien debido a su impacto en el rendimiento físico. Los bloqueadores de los canales del calcio y la digital no son, por norma general, lo bastante potentes por sí solos. Por lo general se necesita una combinación de fármacos bradicardizantes disminuidos progresivamente, al mismo tiempo que se evita la taquicardia sinusal en reposo o la incompetencia cronotrópica durante el ejercicio.
El control del ritmo es igualmente complicado. Los fármacos antiarrítmicos de clase III suelen no bastar para el control (sotalol) o están relativamente contraindicados para la población joven (amiodarona). Aunque los fármacos de clase I pueden prevenir la recidiva de FA, no deben utilizarse en monoterapia, ya que pueden aumentar la predisposición al AA («de clase I»), que en ausencia de un control adecuado de la frecuencia puede llevar a conducción auriculoventricular 1:1, frecuencias ventriculares altas y retardo de la conducción intraventricular, con deterioro hemodinámico482,483. Por lo tanto, se debe considerar la ablación profiláctica del istmo cavotricuspídeo en la prescripción de fármacos de clase I en monoterapia a deportistas.
Para los pacientes con FA esporádica, los fármacos de clase I se pueden considerar solo para la cardioversión aguda, p. ej., enfoque pill in the pocket. Estos pacientes deben evitar los deportes mientras la FA persista y hasta que haya pasado el tiempo correspondiente a 2 vidas medias del fármaco antiarrítmico484.
La prescripción de fármacos anticoagulantes depende del perfil clínico de riesgo (principalmente puntuación CHA2-DS2-VASc)485. Los pacientes con anticoagulantes deben evitar los deportes con contacto corporal directo o propensos a los traumatismos486.
Se debe considerar la ablación con catéter con aislamiento de las venas pulmonares (AVP) si el tratamiento farmacológico fracasa o si el tratamiento de primera línea no se desea487. Varias pequeñas series de casos han demostrado que el desenlace del AVP en deportistas con FA paroxística es similar al de pacientes no deportistas488,489.
5.6.2.3Impacto de la práctica deportiva continua en la historia natural de la fibrilación auricular tras ablaciónSi no hay recidivas de FA durante 1 mes tras una ablación con éxito, se puede retomar la actividad deportiva. Se desconoce si la vuelta al deporte tras una AVP puede hacer que la enfermedad evolucione y lleve a recidivas de FA no dependientes de la vena pulmonar en el futuro. Por lo tanto, no se puede hacer recomendaciones firmes sobre la dosis «segura» de práctica deportiva tras ablación.
Recomendaciones sobre ejercicio para pacientes con fibrilación auricular
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el ejercicio físico regular para prevenir la FA97,470–473 | I | A |
| Se recomienda la evaluación y el tratamiento de la cardiopatía estructural, la disfunción tiroidea, el alcoholismo o el consumo de drogas y otras causas primarias de FA antes de la práctica deportiva485 | I | A |
| Se recomienda asesorar a los pacientes con FA que practican ejercicio vigoroso durante largos periodos, especialmente varones de mediana edad, sobre los efectos crónicos del deporte intenso en la recidiva de FA471,475,481,490 | I | B |
| Se recomienda la ablación de la FA para personas que realicen ejercicio con síntomas recurrentes de FA o no deseen tratamiento farmacológico por su impacto en el rendimiento deportivo488,489 | I | B |
| Se debe considerar la frecuencia ventricular durante el ejercicio con FA de todos los pacientes que se ejerciten (por síntomas o monitorización electrocardiográfica) y se debe implementar un ajuste del control de la frecuencia | IIa | C |
| Se debe considerar la práctica deportiva sin tratamiento antiarrítmico de todos los pacientes sin cardiopatía estructural cuya FA esté bien tolerada | IIa | C |
| Se debe considerar la ablación del istmo cavotricuspídeo de todos los pacientes con aleteo documentado que quieran practicar ejercicio intenso para prevenir el aleteo 1:1 con conducción auriculoventricular | IIa | C |
| Se debe considerar la ablación profiláctica del istmo cavotricuspídeo para prevenir el aleteo para todos los pacientes con FA que quieran hacer ejercicio intenso o hayan iniciado tratamiento con fármacos de clase I | IIa | C |
| No se recomienda el uso de antiarrítmicos de clase I en monoterapia sin pruebas de control de la frecuencia de FA/AA durante el ejercicio vigoroso482,483 | III | C |
| No se recomienda la práctica deportiva tras la toma de flecainida o propafenona como pill in the pocket hasta que haya transcurrido el tiempo correspondiente a 2 vidas medias del fármaco antiarrítmico (p. ej., hasta 2 días)484 | III | C |
| No se recomiendan los deportes de contacto físico o propensos a los traumatismos para pacientes con FA que hagan ejercicio y estén en tratamiento con anticoagulantes | III | A |
AA: aleteo auricular; ECG: electrocardiograma; FA: fibrilación auricular.
aClase de recomendación.
bNivel de evidencia.
El término taquicardia supraventricular paroxística (TSVP) incluye la taquicardia por reentrada intranodular (TRIN), la más común, la taquicardia auriculoventricular por reentrada con vías accesorias y la taquicardia auricular.
La preexcitación ventricular en el ECG en reposo se debe a una vía accesoria (VA) con conducción anterógrada. La prevalencia de preexcitación en la población general varía del 0,1 al 0,3%491,492. El síndrome Wolff-Parkinson-White (WPW) se define como la presencia de arritmias paroxísticas en un paciente con preexcitación.
5.6.3.1Pronóstico y relevancia sintomática de la taquicardia supraventricular paroxística sin preexcitaciónLa TSVP sin preexcitación y sin cardiopatía estructural asociada no es letal, aunque la arritmia puede causar mareos y cansancio que requieran el abandono del ejercicio. El síncope no es común. Sin embargo, la preexcitación se puede asociar con muerte súbita (véase más adelante), por lo que es importante excluir la preexcitación latente mediante masaje del seno carotídeo o una prueba de adenosina en ritmo sinusal493.
Los deportistas con TSVP deben abandonar el ejercicio si aparecen palpitaciones, ya que la frecuencia cardiaca alta puede causar (pre)síncope. Se debe informar a los pacientes con diagnóstico de TSVP sin preexcitación sobre cómo realizar maniobras vagales de manera segura (como masaje del seno carotídeo o, preferiblemente, maniobra de Valsalva) para facilitar la terminación de la arritmia494. El ejercicio se puede retomar tras la terminación de las arritmias. Se puede considerar el tratamiento farmacológico profiláctico con bloqueadores beta o antagonistas del calcio con propiedades de bloqueo del nódulo auriculoventricular, aunque tienen una eficacia limitada. Los fármacos de clase I no tienen cabida en el tratamiento de la TSVP, ya que pueden causar arritmias letales (véase más atrás).
Si se desea participar en actividades deportivas de competición, se debe considerar el tratamiento curativo con ablación. El resultado de la ablación es igualmente seguro y tiene altas tasas de éxito tanto en deportistas como en no deporitstas495. Si la TSVP es solo esporádica y transitoria y no se asocia con consecuencias hemodinámicas, incluso cuando aparece durante el ejercicio o en los casos en que no se desee ablación o esta no tenga éxito, se pueden permitir las actividades deportivas cuando no haya un aumento de riesgo de muerte derivado de una potencial pérdida de conciencia (como para los conductores de deportes de motor, paracaidistas, buzos y demás).
5.6.3.2Pronóstico y relevancia sintomática de la preexcitaciónSe ha estimado que un tercio de los pacientes con síndrome de WPW pueden desarrollar FA y, en estos casos, con conducción rápida a través de las VA puede llevar a fibrilación ventricular (FV) y muerte súbita. Considerando que la FA es más común en deportistas, la preexcitación es un problema para el pronóstico de deportistas. El riesgo de muerte súbita de los pacientes con preexcitación varía en estudios poblacionales del 0,15 al 0,20% y generalmente aparece durante el ejercicio o el estrés psicológico496.
La evaluación del deportista con preexcitación ventricular debe excluir cardiopatía estructural asociada, como MCH o anomalía de Ebstein. La preexcitación mínima o «latente» puede estar enmascarada en un ECG de 12 derivaciones durante el ritmo sinusal por las maniobras vagales o la administración intravenosa de adenosina. La prolongación del intervalo PR sin cambios en la morfología en el intervalo QRS o bloqueo auriculoventricular transitorio excluyen la preexcitación no intermitente latente. La preexcitación puede ser intermitente, lo que suele indicar las propiedades de bajo riesgo de la vía. Sin embargo, algunas VA pueden estar potenciadas por estímulos adrenérgicos. Por lo tanto, se recomienda una ergometría para excluir la preexcitación en el pico de ejercicio antes de autorizar la AF.
Se recomienda la ablación de las VA para los deportistas de competición y recreativos con preexcitación y arritmias documentadas. En caso de arritmias transitorias, infrecuentes y bien toleradas (incluso durante el ejercicio), cuando se prevea un procedimiento de ablación con aumento del riesgo (p. ej., VA anteroseptal) o el paciente sea reacio a someterse a la ablación, el tratamiento debe estar guiado por la evaluación de las características de conducción anterógradas de las VA a través de pruebas invasivas o estudio electrofisiológico invasivo.
Las pruebas no invasivas examinan la preexcitación intermitente con ECG o Holter, la desaparición abrupta de la preexcitación tras la administración de una dosis baja de fármacos de clase I o la desaparición abrupta durante la ergometría497. En los casos de periodos refractarios largos y, por tanto, bajo riesgo de muerte súbita, se permite continuar las actividades deportivas sin ablación con el acuerdo de que la actividad deportiva se debe abandonar si aparecen palpitaciones.
En los deportistas de competición con preexcitación asintomática, se necesita un estudio electrofisiológico para evaluar el riesgo de muerte súbita. En el caso de un hallazgo de alto riesgo (tabla15), se recomienda la ablación de la VA. Para los deportistas que rechacen la ablación o si el procedimiento se asocia con alto riesgo, como una VA anteroseptal, la práctica deportiva de competición se puede tratar con el paciente caso a caso incluyendo el uso de tratamientos farmacológicos, aunque aún no hay datos sobre su eficacia. Se deben desaconsejar los deportes en los que la potencial pérdida de la conciencia pueda ser mortal.
Hallazgos del estudio electrofisiológico invasivo que indican vía accesoria con aumento del riesgo de muerte súbita cardiaca.
| Hallazgos |
|---|
| Taquicardia auriculoventricular por reentrada o FA inducibles499 |
| RR preexcitado durante FA ≤ 250 ms498 |
| Periodo refractario anterógrado ≤ 250 ms498 |
| Presencia de múltiples vías accesorias493 |
| Localización septal de la vía accesoria (principalmente posteroseptal y medioseptal)493,497 |
FA: fibrilación auricular.
En los deportistas recreativos con preexcitación asintomática, la evaluación del riesgo puede llevarse a cabo inicialmente con pruebas no invasivas497. La sensibilidad de los cribados no invasivos para propiedades de las VA que faciliten una respuesta ventricular rápida a FA/AA es buena, pero su especificidad es baja498.
En niños menores de 12 años, el riesgo de FV y muerte súbita inducidas por FA es muy bajo. Generalmente, se recomienda un enfoque conservador para este grupo de edad, aunque un estudio indicó499 que la evaluación profiláctica y la ablación reducen el riesgo de muerte súbita. Existe una laguna de conocimiento en el balance riesgo-beneficio de este enfoque y se requieren estudios a gran escala para evaluar este problema.
Por norma general, se pueden retomar las actividades de ocio y los programas de ejercicio de intensidad baja-media 1 semana tras la ablación si no hay ningún riesgo particular de recidiva de la arritmia.
La vuelta a los deportes de competición puede ser en 1-3 meses, con ECG de seguimiento a los 6 meses y 1 año (dado el escaso riesgo de recidiva tardía de la preexcitación).
Aunque puede haber relación entre (tipos de) TRIN y antecedentes deportivos, no existen datos sobre una tasa de recidiva más alta tras la ablación cuando se retoman los deportes, por lo que no hay motivos para limitar los programas de ejercicio por esta misma razón.
Recomendaciones sobre el ejercicio y la participación en deportes para pacientes con taquicardia supraventricular paroxística y preexcitación
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una evaluación exhaustiva de los pacientes con palpitaciones para excluir preexcitación (latente), cardiopatía estructural y AV500 | I | B |
| Se recomienda la participación en todas las actividades deportivas de los pacientes con TSVP sin preexcitación500 | I | C |
| Se recomienda la ablación de las vías accesorias de los deportistas de competición y recreativos con preexcitación y arritmias documentadas500 | I | C |
| Se recomienda un estudio electrofisiológico de los deportistas de competición/profesionales con preexcitación asintomática para evaluar el riesgo de muerte súbita497,500 | I | B |
| Se debe considerar el tratamiento curativo con ablación en todos los deportistas de competición con TSVP sin preexcitación | IIa | C |
AV: arritmia ventricular; TSVP: taquicardia supraventricular paroxística.
aClase de recomendación.
bNivel de evidencia.
Solo un pequeño número de deportistas muestran AV frecuentes o complejas con una prevalencia similar a la de sus homólogos sedentarios502–505. Las extrasístoles ventriculares (EV) pueden ser un marcador de cardiopatía subyacente, y su presencia conferiría un mal pronóstico incluso en pacientes asintomáticos. Las características específicas de las EV, como morfología (origen apical o en la pared libre del VI o el VD), alta carga, complejidad (p. ej., doblete, triplete o salvas no sostenidas, origen multifocal o aumento de la frecuencia con el ejercicio), deben alertar sobre la posibilidad de cardiopatía eléctrica, isquémica o estructural505,506.
No existe un umbral absoluto para el número de EV que se pueda usar como límite para enfermedad subyacente. Un estudio mostró que, en deportistas asintomáticos con más de 2.000 EV por día, había un 30% de posibilidades de encontrar una cardiopatía estructural o genética subyacente.
5.6.4.2Morfología de las extrasístoles ventricularesLa morfología de las EV puede aportar información pronóstica importante, ya que muchos focos de origen son benignos. La entidad más prevalente en este aspecto son las EV con origen en el infundíbulo del VI o el VD, que muestran un tronco inferior claro con altos voltajes en las derivaciones de las extremidades. La transición temprana en precordiales (en V2 y claramente en V1 muestran una morfología de rama derecha del haz de His) indican un origen izquierdo507. Se cree que las EV del infundíbulo del VI y el VD son el resultado de actividad desencadenada, p. ej., causa celular local, que no tiene implicaciones pronósticas negativas. Aunque estas arritmias de los infundíbulos del VI y el VD suelen ocurrir en corazones estructuralmente normales, pueden ser la expresión de miocardiopatías arritmogénicas subclínicas. Las pruebas de imagen cardiaca pueden excluir enfermedades estructurales en estos deportistas.
Otras localizaciones menos comunes de los orígenes de las EV se sitúan alrededor de los anillos mitral y tricuspídeo, comúnmente en localización posteroseptal. Estas tienen una punta superior con morfología de BRIHH o BRDHH. Las EV con origen en el sistema His-Purkinje tienen complejos QRS relativamente estrechos con morfología de BRDHH y hemibloqueo anterior izquierdo o posterior izquierdo. Por último, el origen puede ser intramiocárdico, generalmente relacionado con los músculos papilares o la trabécula septomarginal508.
Las EV con morfologías distintas del VD (p. ej., BRIHH ancho y eje superior) en pacientes con función del VI normal deben investigarse para excluir miocardiopatías arritmogénicas o sarcoidosis. De la misma forma, un patrón de BRDHH ancho, con eje superior y EV multifocales de origen en VI deben investigarse como miocardiopatía no isquémica.
Raramente otras EV «benignas» con origen en el sistema Purkinje pueden dar lugar a taquicardia ventricular polimórfica o FV debido a su corto intervalo de acoplamiento509,510. En estos pacientes, la actividad eléctrica anormal requiere un tratamiento agresivo. Por último, las EV frecuentes pero por lo demás benignas (generalmente definidas como > 10-15% del número total de latidos en 24h) pueden deteriorar la función del VI con el tiempo (miocardiopatía inducida por EV), que puede ser reversible con tratamiento médico o ablación con catéter511,512.
5.6.4.3Extrasístoles ventriculares: respuesta al ejercicioLa reducción o la resolución de las EV al aumentar la carga de ejercicio es típica de AV idiopáticas y benignas, especialmente de aquellas con morfología del tracto de salida513,514. Las EV inducidas por el ejercicio se deben considerar como un signo de alerta porque las VA asociadas con cardiopatías generalmente empeoran con la estimulación adrenérgica19,502,511,512,515–520. Se encontró una mayor prevalencia de cardiopatías de base (principalmente en la parte medial de la pared o en cicatrices epicárdicas del VI no isquémicas) en un estudio con RMC de deportistas con EV inducidas por el ejercicio en comparación con aquellos con VA suprimidas por el ejercicio (el 56 frente al 21%)516.
Se debe subrayar que las EV aisladas inducidas por el ejercicio o repetitivas con múltiples morfologías, especialmente con morfologías alternas latido a latido (el llamado «patrón bidireccional») pueden ser el signo de TV polimórfica catecolaminérgica, que puede degenerar en FV518,521.
5.6.4.4Abordaje práctico de pacientes cardiacos con extrasístoles ventriculares o taquicardia ventricular no sostenida que deseen practicar deporteLa tarea más importante a la hora de tratar a pacientes con EV o TVNS que quieran hacer deporte es excluir enfermedades estructurales o arritmias familiares subyacentes, ya que la actividad deportiva puede desencadenar TV sostenida. Se ha señalado que la presencia de 2 o más EV en un ECG basal (o incluso 1 o más EV en el caso de deportistas de alta resistencia) debe instigar una evaluación más exhasutiva522. Las pruebas complementarias incluyen antecedentes familiares, evaluación del número, la morfología y la complejidad de las EV con Holter y ECG de 12 derivaciones, inducibilidad con el esfuerzo (con ergometría o ECG de larga duración durante las actividades deportivas) y pruebas de imagen personalizadas1. Una evaluación en mayor profundidad con pruebas genéticas moleculares puede estar indicada en ciertos casos si hay alta sospecha de enfermedad familiar. Por último, puede ser necesario repetir la evaluación a los 6 meses-2 años. Las recomendaciones para la práctica deportiva de deportistas con EV deben estar personalizadas según la evaluación de las enfermedades cardiacas subyacentes descritas anteriormente y, por norma general, se requiere una toma de decisiones compartida.
Recomendaciones sobre ejercicio para pacientes con extrasístoles ventriculares o taquicardia ventricular no sostenida
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda una evaluación exhaustiva (incluidos los antecedentes familiares) de los deportistas con al menos 2 EV en el ECG basal (o al menos 1 EV en el caso de deportistas de resistencia) para excluir enfermedades estructurales o arritmogénicas subyacentes503,522 | I | C |
| Se recomienda estudio más en profundidad con monitorización Holter, ECG de 12 derivaciones, ergometría y pruebas de imagen a discreción para pacientes con EV frecuentes y TVNS503 | I | C |
| Se recomienda permitir todas las actividades de ocio y los deportes de competición, con revaluación periódica, a los pacientes sin enfermedades familiares o estructurales subyacentes503 | I | C |
ECG: electrocardiograma; EV: extrasístole ventricular; TV: taquicardia ventricular; TVNS: taquicardia ventricular no sostenida.
aClase de recomendación.
bNivel de evidencia.
El intervalo QT y el intervalo QT corregido (QTc) pueden variar según el sexo y el entrenamiento físico. El síndrome de QT largo (SQTL) congénito debe distinguirse de las formas adquiridas, como las debidas a circunstancias reversibles y evitables. Una vez el SQTL está establecido, las actividades deportivas deben prohibirse hasta que la causa subyacente se haya corregido.
El diagnóstico definitivo de SQTL congénito suele ser difícil523. Se debe sospechar SQTL congénito en un ECG habitual o a los 4 min de recuperación de una ergometría524 si el intervalo QTc según la fórmula de Bazett de deportistas asintomáticos varones o mujeres es ≥ 470 o ≥ 480ms respectivamente525. Un QTc ≥ 500ms es diagnóstico526. En el caso de QTc largos en el límite de la normalidad y sin antecedentes personales o familiares, hay que excluir arritmias subclínicas con ergometría y monitorización electrocardiográfica a largo plazo.
Ya que el riesgo de eventos cardiacos durante las actividades deportivas es en gran medida genético, tras un diagnóstico de SQTL deben hacerse pruebas genéticas y cribado en cascada de los familiares. Los pacientes con QTL1 tienen el mayor riesgo durante el ejercicio con estrés527,528.
Los deportistas sintomáticos no deben participar en deportes de competición. Los pacientes con QTL1 no deben participar en deportes que impliquen sumergirse en agua fría, ya que se asocia con un aumento del riesgo de arritmias. Las precauciones generales incluyen evitar los fármacos que prolonguen el intervalo QT, la deshidratación y el desequilibrio electrolítico. El tratamiento con bloqueadores beta es extremadamente efectivo para el QTL1 y los tratamientos adicionales solo se necesitan para controlar los casos más graves o genotipos específicios529.
Se debe derivar a los supervivientes de PSC (especialmente mientras estén en tratamiento con bloqueadores beta) para implante de DAI. Asimismo se debe derivar a los pacientes que hayan sufrido un síncope repentino a pesar del tratamiento con bloqueadores beta para implante de DAI o denervación cardiaca530. El implante de un DAI no implica el alta para practicar deportes intensos o de competición. Continuar la práctica deportiva con un DAI es posible, pero se aplican recomendaciones específicas (véase la sección 5.5.6). La guía estadounidense es más permisiva con la práctica deportiva de competición (excepto para QTL1) siempre que las precauciones incluyan un desfibrilador externo automático (DEA) «como parte del equipo de seguridad personal del deportista»531. Consideramos que esta obligación no es práctica (p. ej., en deportes de invierno o acuáticos) y asigna una responsabilidad a los clubs y las personas que no puede justificarse por la recomendación médica para un solo deportista. Más aún, aunque las paradas cardiacas relacionadas con el SQTL no son comunes, incluso en deportes de competición, los DEA no son 100% eficaces en estos casos532.
Para los portadores de la mutación en SQTL asintomáticos sin intervalo QT prolongado —p. ej., < 470ms en varones y<480ms en mujeres («genotipo positivo/fenotipo negativo»)—, se requiere una toma de decisiones conjunta que encuentre el equilibrio entre el riesgo de arritmias y el bienestar psicológico. Una ergometría negativa no tiene valor predictivo.
Recomendaciones sobre ejercicio en el síndrome de QT largo
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda tratar con bloqueadores beta en dosis diana a todos los pacientes con SQTL y antecedentes de síntomas o QTc prolongado529 | I | B |
| Se recomienda para los pacientes con SQTL que se ejerciten evitar los fármacos que prolonguen el QT (www.crediblemeds.org) y los desequilibrios electrolíticos como hipopotasemia o hipomagnesemia529 | I | B |
| Se debe considerar la toma de decisiones conjunta sobre la práctica deportiva de pacientes con genotipo positivo/fenotipo negativo de SQTL (p. ej.,<470 y<480ms en varones y mujeres). En este contexto se deben considerar el tipo y el contexto de los deportes (individual o en equipo), el tipo de mutación y el alcance de las medidas cautelares | IIa | C |
| No se recomienda la práctica deportiva recreativa y de competición de alta intensidad, incluso con bloqueadores beta, para los pacientes con QTc>500ms o SQTL confirmado con pruebas genéticas con un QTc ≥ 470 ms en varones y ≥ 480 en mujeres | III | B |
| No se recomiendan los deportes de competición (con o sin DAI) a los pacientes con SQTL y antecedentes de parada cardiaca o síncope arrítmico | III | C |
DAI: desfibrilador automático implantable; STQL: síndrome de QT largo.
aClase de recomendación.
bNivel de evidencia.
El síndrome de Brugada (SB) es una enfermedad hereditaria de los canales iónicos cardiacos con un riesgo elevado de FV y MSC en pacientes con un corazón estructuralmente normal533,534. Aunque el SB se describió inicialmente como una enfermedad puramente eléctrica, se han descrito pequeñas anomalías en el VD535–538 que indican que la enfermedad es resultado de una repolarización temprana o una despolarización tardía509. El diagnóstico se basa en la presencia de patrón de Brugada tipo 1 en el ECG de 12 derivaciones (elevación coved-type del segmento ST ≥ 2 mm seguida de una onda T negativa ≥ 1mm en las derivaciones precordiales derechas posicionadas en el cuarto, el tercero o el segundo espacio intercostal), ya sea espontáneamente o tras una provocación con bloqueadores de los canales de sodio523,539,540.
La mayoría de las personas con SB están asintomáticas toda su vida. En la mayoría de los casos, los eventos ocurren durante el sueño o el reposo, durante estados febriles y, ocasionalmente, como consecuencia de golpes de calor541–549. Los pacientes que han sufrido PSC o un síncope arrítmico deben someterse a implante de un DAI275–511. La estratificación del riesgo en la población general con patrón electrocardiográfico tipo 1 espontáneo es un reto importante345,511. Hay controversia sobre la evidencia de que la ergometría que presente una forma clínica que empeora durante el ejercicio o en las primeras etapas de la recuperación o un estudio electrofisiológico son pruebas eficientes para identificar a los pacientes con riesgo de MSC. Para los pacientes asintomáticos con solo patrón electrocardiográfico de Brugada tipo 1, se recomiendan medidas preventivas como evitar los fármacos desencadenantes (www.brugadadrugs.org), el desequilibrio electrolítico y que la temperatura central no sea > 39°C (p. ej., minimizando la inmersión en bañeras de hidromasaje, saunas y salas de vapor, evitando deportes en condiciones calurosas/húmedas o absteniéndose de eventos de resistencia prolongada, como triatlones y maratones). Durante las enfermedades febriles, la fiebre debe tratarse de manera agresiva247,511.
Se podría especular que un aumento de las reacciones vagales durante la recuperación550 y un tono vagal en reposo551 puedan aumentar la susceptibilidad de personas muy entrenadas a sufrir arritmias durante la recuperación o el reposo. Sin embargo, no existen informes que establezcan un vínculo directo entre el entrenamiento deportivo y los eventos cardiacos y no existen grandes estudios prospectivos que evalúen el efecto del ejercicio y el deporte en el SB.
Los pacientes asintomáticos con patrón electrocardiográfico de SB tipo 1 espontáneo pueden competir en todos los deportes excepto los de resistencia asociados con un aumento de la temperatura central > 39°C (p. ej., maratones y triatlones). Reglas similares se aplican a los pacientes con genotipo positivo/fenotipo negativo y a aquellos con formas silentes de SB.
Si se trata con un DAI, considerando que se tomen medidas cautelares y que el paciente haya permanecido asintomático durante al menos 3 meses, se puede considerar que retome la práctica deportiva, incluidos los de competición, tras la toma de decisiones conjunta y considerando los registros del DAI (véase más adelante).
Recomendaciones sobre ejercicio en el síndrome de Brugada
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el implante de un DAI para los pacientes con SB y episodios de síncope arrítmico o MSC recuperada247 | I | C |
| Se debe considerar la vuelta a las actividades de ocio o los deportes de competición tras el implante de un DAI y una toma de decisiones conjunta para los pacientes que no hayan sufrido arritmias recurrentes a los 3 meses del implante del DAI | IIa | C |
| Se puede considerar la participación en actividades deportivas que no estén asociadas con un aumento de la temperatura central > 39°C (p. ej., eventos de resistencia en condiciones extremadamente cálidas o húmedas) de los pacientes con SB asintomáticos, portadores de mutaciones asintomáticos y deportistas asintomáticos con únicamente inducción de patrón electrocardiográfico | IIb | C |
| No se recomiendan la prescripción de fármacos que puedan agravar el SBc y el desequilibrio electrolítico y la práctica deportiva que aumente la temperatura central > 39°C para los pacientes con SB sintomáticos o portadores de mutación fenotípica negativa | III | C |
BS: síndrome de Brugada; DAI: desfibrilador automático implantable; ECG: electrocardiograma; MSC: muerte súbita cardiaca.
aClase de recomendación.
bNivel de evidencia.
cPor ejemplo, www.brugadadrugs.org.
El implante de marcapasos es habitual. Por norma general, los pacientes con marcapasos tienen enfermedades y comorbilidades menos graves que los pacientes con DAI. Más aún, hay menos riesgo de mal funcionamiento durante el deporte con un marcapasos que con un DAI552. Por tales motivos, las recomendaciones para la práctica deportiva son menos conservadoras para los pacientes con marcapasos que para los pacientes con DAI. Los pacientes con marcapasos pueden participar en deportes de competición o recreativos en ausencia de cardiopatía estructural u otras enfermedades cardiacas por las que se prohíbe el ejercicio.
En las primeras semanas tras el implante del dispositivo, se deben evitar las actividades deportivas que aumenten el riesgo de desplazamiento de los electrodos (p. ej., movimientos fuertes de las extremidades superiores). La ergometría o la monitorización Holter durante el deporte puede mejorar la programación individual de la frecuencia superior y la frecuencia de seguimiento y excluir aceleraciones del ritmo en otras circunstancias (p. ej., equitación)553.
Todos los pacientes con dispositivos cardiacos (marcapasos, tratamiento de resincronización y DAI) deben evitar las actividades deportivas asociadas con traumatismos torácicos554–557. Algunos deportes como el fútbol, el baloncesto y el béisbol se pueden practicar si se lleva la protección amortiguadora adecuada. Es necesario señalar que los deportes con movimientos de brazo pronunciados, como el vóleibol, el baloncesto, el tenis, el golf y la escalada, pueden aumentar el riesgo de daño tardío de los electrodos debido a aplastamiento subclavio (con aislamiento o fallo de conducción)554,558,559. El implante en el lado contrario al brazo dominante, la fijación dentro del bosillo o el implante submusclar pueden mejorar la duración del dispositivo. No se conoce si las técnicas de implante subcostal o epicárdico tienen beneficios a largo plazo. La interferencia electromagnética no es común en los dispositivos modernos y no se ha informado de ningún caso, pero siempre debería sospecharse y comprobarse en entornos deportivos donde se utilicen equipos electrónicos (p. ej., esgrima). La inhibición de interferencias miopotenciales puede tener como resultado una inhibición de la electroestimulación, un problema más común con electrodos unipolares, pero que suele corregirse con una reprogramación apropiada del dispositivo560,561. Los electrodos bipolares son menos sensibles a este problema, pero pueden tener menor longevidad.
5.6.7.2Desfibrilador automático implantableEl ICD Sports Safety Registry no registró muertes, arritmias o daños físicos relacionados con descargas durante un seguimiento medio de 44 meses de 440 deportistas que continuaron participando en deportes de competición de alto riesgo tras el implante de un DAI359,389. Un análisis adicional de 82 deportistas recreativos no profesionales confirmó estos resultados alentadores562, que son importantes para los muchos pacientes con DAI que desean continuar con las actividades deportivas tras el implante. Por lo tanto, se recomienda la toma de decisiones conjunta para decidir si continuar la práctica deportiva y a qué nivel tras el implante de un DAI.
Sin embargo, deben tenerse en cuenta 3 consideraciones importantes. La primera, si los deportes están contraindicados porque pueden contribuir a la evolución de la enfermedad subyacente (como miocardiopatías arritmogénicas o mutaciones de la lamina A/C)384,425 un DAI no sustituye la restricción para los deportes y se debe disuadir a los pacientes de participar en deportes de intensidad moderada-alta. Las recomendaciones en estas circunstancias deben tomarse con una perspectiva vitalicia y basarse en la conservación óptima de la integridad estructural del corazón. Sin embargo, el DAI puede permitir el ejercicio de suave a moderado sin preocupaciones sobre el riesgo de arritmia o descargas y puede ayudar a los pacientes a recobrar su autonomía y superar miedos relacionados con hacer ejercicio sin supervisión.
La segunda consideración es que las descargas del DAI, en general e incluso cuando son apropiadas y seguras, tendrán un impacto psicológico en el deportista; el 30-40% de los deportistas que experimentaron descargas en el ICD Sports Safety Registry abandonaron la participación deportiva, al menos temporalmente, por miedo a descargas repetidas389. Más aún, la proporción de deportistas con descargas apropiadas e inapropiadas durante el ejercicio fue mayor entre los de competición que entre los recreativos, lo que subraya el conocido efecto desencadenante de los deportes de alta intensidad562. Considerando que el tratamiento con DAI es vitalicio y la calidad de vida no solo depende de la capacidad para las actividades deportivas, sino también, y de manera más continua, de la confianza en el dispositivo, se debe tener en cuenta que la efectividad del DAI durante el deporte no debe presionar de ninguna forma al deportista para que continúe practicando deporte. De nuevo, un proceso de toma de decisiones informado requiere evaluar todas las opciones del deportista tras las descargas, lo que incluye la continuación, la reducción o el abandono de la práctica deportiva563,564.
La tercera consideración es que deben evitarse las situaciones en que una pérdida de la alerta o la conciencia pueda causar daño a un tercero o al propio deportista (como en deportes de motor, buceo, alpinismo o incluso ciclismo).
El deportista debe conocer la frecuencia programada para detectar la frecuencia máxima y evitar llegar a ella durante el ejercicio. Por el contrario, las zonas de diferenciación deben programarse lo bastante altas para permitir frecuencias cardiacas altas durante los niveles de ejercicio deseados. Esta práctica se demostró segura y redujo la ocurrencia de descargas en la ICD Sports Safety Database565. La causa más común de descargas inapropiadas en pacientes con DAI fueron la taquicardia sinusal y las arritmias supraventriculares566,567. Las cardiopatías subyacentes y los deportes de resistencia implican mayor riesgo de FA474,480,568. El implante de un DAI dual con el único objetivo de detectar y descartar arritmias auriculares no está recomendado porque en general no es efectivo565,569–572. Dado que muchos de estos deportistas son jóvenes, hay más riesgo de complicaciones a largo plazo con los electrodos cuando se implantan más electrodos. Por tanto, el implante de DAI más complejos y su indicación deben evaluarse cuidadosamente en todos los pacientes. Se recomienda encarecidamente la inclusión sistemática de los deportistas en programas de monitorización a distancia.
Recomendaciones sobre ejercicio para pacientes con marcapasos y desfibriladores automáticos implantables
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda que los pacientes con dispositivos implantados con/sin resincronización y enfermedad subyacente sigan las recomendaciones pertinentes a la enfermedad subyacente384,425 | I | B |
| Se debe considerar la práctica deportiva y ejercicio (excepto deportes de colisión) para los pacientes con marcapasos que no tengan sustratos patológicos para arritmias letales | IIa | C |
| Se debe considerar la prevención de impactos directos en el dispositivo implantado adaptando el lugar de implante del dispositivo y los electrodos y restringiendo los deportes de impacto directo | IIa | C |
| Se debe considerar la monitorización Holter y la interrogación del dispositivo durante y tras la vuelta al deporte para permitir la personalización apropiada de los parámetros de respuesta a la frecuencia, exclusión de frecuencias miopotenciales o inhibición electromagnética y detección de AV | IIa | C |
| Se debe considerar la toma de decisiones conjunta sobre la continuación de la práctica deportiva intensa o de competición de los pacientes con DAI, teniendo en cuenta el efecto de estos deportes en la enfermedad subyacente, el hecho de que los deportes intensos desencadenarán más descargas apropiadas e inapropiadas, el efecto psicológico de las descargas en el deportista/paciente y el riesgo potencial para terceros | IIa | C |
| No se recomienda un DAI como sustituto de recomendaciones específicas de cada enfermedad si estas prohíben la práctica deportiva | III | C |
AV: arritmia ventricular; DAI: desfibrilador automático implantable.
aClase de recomendación.
bNivel de evidencia.
Las cardiopatías congénitas (CC) tienen una prevalencia de 8-9/1.000 recién nacidos vivos y es el defecto de nacimiento más común573. La mayoría de los niños con CC llegan a la edad adulta, incluido el 85% con enfermedades complejas. El ejercicio regular es importante para adultos con CC y la práctica de ejercicio se debe tratar en todas las citas con el paciente574. Sin embargo, las CC representan un espectro muy amplio de enfermedades con una gran variedad de consecuencias fisiológicas. La evaluación individual es esencial antes de aconsejar sobre la práctica deportiva. Esto requiere una comprensión minuciosa del defecto congénito, sus consecuencias fisiológicas y las consecuencias de la intervención quirúrgica o percutánea.
5.7.2Aumento en el número de deportistas con cardiopatías congénitasEntre los deportistas con CC se incluye a aquellos con pequeñas lesiones no intervenidas y CC paliadas y reparadas. En algunos deportistas el diagnóstico de CC se descubrirá durante la revisión preparticipativa. Aproximadamente 1 de cada 150 adultos tiene un defecto cardiaco congénito. Esto representa un aumento de más del 50% en los últimos 10 años y refleja una mejora en el diagnóstico y la supervivencia a largo plazo575. Más del 90% de los adultos con CC se categorizan en NYHA I o II576. Se desconoce el número de deportistas profesionales y recreativos con CC, pero entre la población de deportistas de élite la cifra probablemente sea pequeña. En un estudio de 2.352 deportistas olímpicos, solo 9 (0,4%) tenían un defecto cardiaco congénito577. Sin embargo, muchos más pacientes con CC compiten a nivel amateur. Es probable que el número de deportistas con CC esté aumentando debido a la mejora en la supervivencia, una mejor comprensión de los beneficios del ejercicio y el aumento del número de deportistas profesionales en países con sistemas de salud poco desarrollados, que se asocian con un infradiagnóstico de las CC573,574.
5.7.3Anomalías no cardiacas en la cardiopatía congénita y en los deportes paralímpicosLas CC tienen una etiología multifactorial, pero el componente genético es significativo y hay un riesgo de recidiva del 2,5%578. El origen genético puede deberse a una anomalía cromosómica, un síndrome con herencia mendeliana o esporádico con penetrancia variable578. Aproximadamente el 14% de los pacientes con CC tienen anomalías cardiacas adicionales579. Por lo tanto, el 44% de los pacientes tienen anomalías pulmonares580. Esto puede complicar las recomendaciones sobre la práctica deportiva para el deportista con CC. No existe una clasificación específica para CC en los deportes paralímpicos.
5.7.4Consideraciones generales para los deportistas con cardiopatía congénitaLas consecuencias hemodinámicas y el pronóstico de diferentes lesiones de CC varían considerablemente. Más aún, las consecuencias de cualquier lesión individual pueden variar enormemente entre pacientes. Por ejemplo, la anomalía de Ebstein puede presentarse en la infancia con hipoplasia pulmonar debido a la compresión por una aurícula derecha gigante o puede presentarse en los últimos años de la mediana edad con taquicardia supraventricular y consecuencias hemodinámicas mínimas. Del mismo modo, un defecto del tabique ventricular puede ser pequeño y asintomático o grande y causar IC en la infancia o incluso cianosis extrema, capacidad reducida de ejercicio y síndrome de Eisenmenger en el adulto. Por lo tanto, estas recomendaciones se basan en la evaluación fisiológica más que en el diagnóstico anatómico subyacente. Es imprescindible entender el grado de gravedad y conocer las potenciales complicaciones típicas de cada lesión, y el cardiólogo debe trabajar junto con un especialista en CC. Los deportistas con CC que se entrenan regularmente y participan en deportes de competición deben someterse a una evaluación anual exhaustiva que incluya una exploración clínica, ECG, ecocardiograma, ergometría y, de ser posible, con PECP.
Muchos deportistas con CC ya se han sometido a cirugía paliativa o correctiva. En adultos jóvenes con CC posquirúrgicas, la disfunción valvular y las arritmias son problemas comunes, pero según aumenta la edad, predominan las arritmias y la IC. En deportistas veteranos son frecuentes los problemas relacionados con cirugías correctivas o paliativas anteriores. Entre ellos se incluyen arritmias cardiacas, disfunción ventricular sistémica, disfunción valvular y obstrucciones de conductos protésicos. La repetición de intervenciones valvulares o con conductos y la ablación de arritmias por reentrada (secundarias a cicatriz quirúrgica) son frecuentes en este grupo de edad. Además, las ECV adquiridas pueden desarrollarse con el aumento de la edad581,582. Esto es especialmente relevante en la evaluación de deportistas veteranos con CC.
5.7.5Muerte súbita durante la práctica deportivaLa MSC en las CC es rara (< 0,1% por año)583 y solo el 8% de las muertes ocurren durante el ejercicio584. Muchos pacientes con las CC complejas de mayor riesgo de MSC tienen una tolerancia al ejercicio reducida y no pueden realizar actividades deportivas importantes. Sin embargo, algunos grupos diagnósticos, p. ej., reparación de la tetralogía de Fallot, conllevan riesgo de MSC, pero aun así pueden competir en deportes de élite585. Otras lesiones congénitas de alto riesgo, como el origen coronario anómalo, el prolapso de la válvula mitral y las aortopatías, se describen en las secciones 5.1, 5.3 y 5.4 respectivamente. En un gran estudio de base poblacional de MSC de pacientes con CC menores de 35 años, el 87% de las MSC se debieron a supuestas arritmias y el 41% ocurrieron a pacientes con CC sin diagnosticar586. Las MSC relacionadas con el ejercicio fueron más comunes en los grupos sin diagnosticar (el 18 frente al 4%), lo que respalda la decisión de realizar revisiones previas a la participación deportiva586. Se desconoce si la intensidad del ejercicio es un factor de riesgo de MSC en las CC. Hay razonable evidencia sobre la seguridad del ejercicio de moderado a vigoroso para la mayoría de los pacientes adultos con CC incluso cuando están sintomáticos (NYHA II-III)576,587,588. Sin embargo, las arritmias cardiacas son una causa común de ingreso hospitalario de los adultos con CC, y el ejercicio extremo puede exponer una enfermedad arrítmica latente589,590.
5.7.6Ejercicio para deportistas con cardiopatía congénita: guías y recomendaciones actualesEl ejercicio regular estructurado es un tratamiento seguro y efectivo para la mayoría de los pacientes con CC. Esto es así para la mayoría de los grupos diagnósticos, también los pacientes sintomáticos, e incluye ejercicio aeróbico y basado en la fuerza588,591,596. La intolerancia al ejercicio en las CC es un gran predictor de desenlace clínico y MSC576. Se deben tomar las medidas necesarias en entornos extremos como los deportes subacuáticos, como se considera más adelante (véase el material adicional, sección 4). Esto es especialmente relevante si existe el riesgo de shunt derecha-izquierda (ShDI). Está disponible la guía sobre la evaluación y la prescripción de ejercicio para niños y adultos con CC, pero no está diseñada específicamente para deportistas597,598. Las recomendaciones pediátricas se basan principalmente en diagnósticos anatómicos subyacentes, pero la guía para adolescentes y adultos jóvenes con CC tiene un enfoque funcional basado en el riesgo hemodinámico y de arritmia subyacente. Este último enfoque se adapta mejor a la evaluación del deportista adulto con CC (figura 9).
5.7.7Evaluación del deportista con cardiopatía congénitaLa guía para la recomendación/prescripción de ejercicio a adolescentes y adultos con CC utiliza una metodología estructurada descrita en Budts et al.597. Esta se puede modificar para aplicarlas a la evaluación de deportistas con CC.
Fase 1. Se lleva a cabo la exploración física y la anamnesis. Se deben incluir detalles de diagnóstico de CC subyacente, cualquier intervención quirúrgica o percutánea, medicación actual y síntomas CV (en reposo o durante el ejercicio). Se debe prestar atención a cualquier diagnóstico no cardiaco relacionado, como disfunción pulmonar. Se debe llevar a cabo una historia completa de la práctica deportiva y la realización del ejercicio, incluyendo los detalles precisos del entrenamiento actual y cualquier suplemento alimenticio. Se deben establecer los detalles de las actividades deportivas actuales o futuras, incluyendo una evaluación del componente estático y de la intensidad como se describe en la sección 4.1 (figura 2). Si fuese necesario, se debe solicitar asesoramiento de un entrenador deportivo o un especialista en medicina deportiva.
Fase 2. Se deben evaluar los siguientes 5 parámetros basales597 (tabla16):
Parámetros basales para la evaluación de cardiopatías congénitas.
| Parámetro | Comentarios |
|---|---|
| Función ventricular | Generalmente por ecocardiograma. En enfermedades complejas, la RMC puede ser más adecuada597,599,600 |
| Presión pulmonar | Se utiliza la velocidad de regurgitación triscuspídea y la velocidad de regurgitación pulmonar. Se puede necesitar la cateterización cardiaca para mediciones más precisas599,604 |
| Tamaño aórtico | Generalmente con ecocardiografía o RMC. Se debe descartar coartación609,618 |
| Evaluación de la arritmia | ECG de 12 derivaciones con umbral bajo para ECG ambulatorio de 24 h. Se pueden necesitar pruebas adicionales si el paciente está sintomático611,612 |
| Evaluación de la saturación | Oximetría de pulso en reposo/durante el ejercicio602,614 |
ECG: electrocardiograma; RMC: resonancia magnética cardiaca.
Función ventricular. La evaluación de la función ventricular se puede realizar generalmente con ecocardiografía. El objetivo es comprobar si la función está reducida (FE<55%) y, si lo está, si es leve (45-55%), moderada (30-45%) o grave (< 30%). Esta se utiliza como evaluación basal y para la monitorización posterior de los efectos del entrenamiento. La ecocardiografía también se puede utilizar para evaluar alteraciones en el flujo de entrada y de salida, que pueden empeorar con el ejercicio brusco (p. ej., obstrucción del flujo del VI o insuficiencia sistémica de la válvula auriculoventricular). La RMC puede ser preferible en enfermedades complejas, ya que proporcionan el beneficio adicional de evaluar las cicatrices intracardiacas, lo que puede servir como base para la evaluación del riesgo arrítmico599,600.
Presión arterial pulmonar. La hipertensión pulmonar (HP) se diagnostica cuando la PAP es>20 mmHg601. La HP puede ocurrir en el contexto de ShDI (p. ej., comunicación interauricular, comunicación interventricular, conducto arterioso) que permite la sobrecarga de volumen/presión sin restricciones. Con el tiempo, esto tiene como resultado PAP por encima de los límites normales con shunt invertido y un aumento de la resistencia vascular pulmonar (síndrome de Eisenmenger). Un aumento de la poscarga del VD limita la capacidad de aumentar el gasto cardiaco al aumentar el volumen sistólico y puede afectar a la función del VI a través de la alteración de la interacción VD-VI normal. Pocos pacientes con CC y HP significativa participan en deportes de competición debido a la capacidad de ejercicio reducida. Sin embargo, algunos deportistas con CC tienen una leve elevación de la resistencia vascular pulmonar que puede exacerbarse por otros factores, como el entrenamiento en altura602. La PAP aumenta durante el ejercicio. Este aumento se acentúa con la edad y puede ser extremo en deportistas con CC debido a la resistencia vascular pulmonar elevada603. Además, la estenosis de la válvula pulmonar o la estenosis distal en las arterias de la rama pulmonar pueden causar hipertensión del VD relacionada con el ejercicio. La evaluación no invasiva de la HP puede ser difícil y se han publicado guías específicas604,605. Se puede obtener más información con una PECP, y un VO2>25,2ml/min/kg hace que la HP sea poco probable606. Como la HP también puede ser una complicación posquirúrgica tras corrección de una CC607, la evaluación de la PAP debe formar parte de todo examen ecocardiográfico de deportistas con CC. Aunque los ejercicios de entrenamiento se consideran seguros para pacientes con HP, no se recomiendan los deportes de competición1,608.
Evaluación aórtica. Muchos pacientes con CC tienen riesgo de dilatación aórtica, en especial los pacientes con tetralogía de Fallot, coartación de la aorta y ciertos síndromes como el de microdeleción 22q11.2 y el de Turner. Sin embargo, la disección aórtica es muy rara en las CC609. Los deportistas tienen unas dimensiones aórticas ligeramente aumentadas en comparación con los controles sedentarios, pero no se sabe si este hecho tiene un efecto acumulativo en los deportistas con CC con dilatación aórtica345. La presencia de dilatación de la aorta ascendente debe instigar una evaluación por coartación de la aorta, ya que se puede asociar con coartación grave, que puede no detectarse en la evaluación clínica, pero puede causar hipertensión grave relacionada con el ejericcio610. Los riesgos del ejercicio en las aortopatías se describen en detalle en la sección 5.4. Los pacientes con dilataciones aórticas > 5cm deben evitar los deportes de contacto.
Evaluación de las arritmias. Las arritmias son la causa del 25% de los ingresos hospitalarios por CC. Más del 80% son auriculares, pero las AV potencialmente letales también pueden ocurrir611. Entre los factores de riesgo independientes se incluyen: edad avanzada, sexo masculino, doble salida del VD, comunicación auriculoventricular, IC, apnea obstructiva del sueño, transposición de grandes arterias, transposición congénitamente corregida y tetralogía de Fallot599. La evaluación del deportista con CC debe incluir antecedentes de síntomas con evaluación de las palpitaciones, presíncope y síncope, especialmente durante el ejercicio. Las arritmias pueden ser el primer signo de deterioro hemodinámico subyacente y la aparición de nuevas arritmias debe conllevar una evaluación hemodinámica completa. Ya está disponible la guía detallada para la evaluación y el tratamiento de arritmias en las CC612. En el deportista, el tratamiento arrítmico puede complicarse por la necesidad de minimizar los efectos cronotrópicos negativos del tratamiento antiarrítmico, que pueden afectar al rendimiento. Si hay arritmias sintomáticas, se puede requerir una ergometría con ECG, implante de un Holter insertable e incluso pruebas electrofisiológicas en coordinación con un electrofisiólogo experto en CC.
Evaluación de la saturación/función pulmonar. Se debe evaluar a los deportistas con CC por posible ShDI. Esta evaluación se puede llevar a cabo con pulsioximetría, pero una saturación en reposo > 95% no descarta cianosis central relacionada con el ejercicio, por lo que la evaluación durante el ejercicio es imprescindible. Se debe considerar una posible causa pulmonar de la cianosis, y la función pulmonar se debe evaluar como parte de la PECP. Incluso tras la corrección quirúrgica del defecto cardiaco puede quedar un shunt intracardiaco residual.
Fase 3. Prueba de esfuerzo cardiopulmonar/PECP: la PECP tiene un valor incalculable en la estratificación del riesgo en el adulto con CC y puede predecir el desenlace clínico613,614. También es extremadamente útil en la evaluación del deportista con CC, ya que permite la evaluación de la PAP, los problemas respiratorios, el gasto cardiaco, la hemodinámica relacionada con el ejercicio y las arritmias. Esto se debería usar en conjunción con una evaluación del esfuerzo, como la escala de Borg615. Los valores de la PECP normales están disponibles para pacientes CC no deportistas616. La PECP se debe llevar a cabo con un ECG de 12 derivaciones para poder detectar arritmias y evaluar la incompetencia cronotrópica. Un VO2máx reducido y el pulso de oxígeno pico pueden reflejar un volumen sistólico reducido y se observan en CC complejas, así como en otras formas de CC como tetralogía de Fallot reparada, insuficiencia aórtica y coartación aórtica. En las CC, el umbral anaeróbico ventilatorio puede estar reducido y afectar a la eficiencia del intercambio de gases en ejercicios dinámicos y de resistencia. Esto también puede estar relacionado con una toracotomía previa o enfermedad pulmonar. De la misma forma, puede haber un alto gradiente ventilación minuto/producción de dióxido de carbono (VE/CO2)601, lo que indica un lecho vascular pulmonar anormal610,611,613–616. La reducción del músculo esquelético es común en adultos con CC y puede contribuir a una disminución del consumo de oxígeno en los tejidos. No se ha evaluado hasta qué grado esto cambia en deportistas con CC. Sin embargo, incluso en enfermedades complejas, la práctica regular de ejercicio de fuerza aumenta la masa muscular y el ejercicio regular es un factor dominante en la determinación de los desenlaces a largo plazo593,617.
Fase 4. Intensidad y prescripción de ejercicio: como ya se ha descrito en la introducción (tabla16) se debe evaluar la participación del deportista en deportes y ejercicio. Se debe incluir una evaluación de la intensidad y de los componentes aeróbicos y de fuerza (isómetricos y dinámicos) y el volumen total de ejercicio, que debe sumar el entrenamiento y la competición. Las consecuencias hemodinámicas deben considerarse teniendo en cuenta las específicas de lesiones conocidas y los cambios específicos relacionados con la práctica deportiva identificados durante la evaluación.
Fase 5. Seguimiento y revaluación. Se deben llevar a cabo evaluaciones sucesivas, por lo general anuales, mientras el deportista con CC siga practicando deporte. Así se toman en consideración los cambios relacionados con la edad que tienen lugar en el deportista con CC y la posible aparición de ECV degenerativas.
Recomendaciones sobre ejercicio para pacientes con cardiopatías congénitas
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda la práctica regular de ejercicio moderado para todos los pacientes con CC588,591–594,619 | I | B |
| Se recomienda hablar de la participación deportiva y las recomendaciones individualizadas sobre la práctica deporta en todas las consultas con el paciente con CC574,597,598,617 | I | B |
| Se recomienda evaluar la función ventricular, la presión arterial pulmonar, el tamaño de la aorta y el riesgo arrítmico de todos los pacientes con CC342,348,573,597 | I | C |
| Se debe considerar la práctica deportiva de los pacientes con CC en NHYA I o II que no tengan riesgo de arritmias potencialmente graves tras una evaluación individual y un proceso de toma de decisiones conjunto573,595,597,598 | IIa | C |
| No se recomiendan los deportes de competición para los pacientes con CC en NYHA III-V con riesgo de arritmias potencialmente graves605,608 | III | C |
CC: cardiopatías congénitas; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
El cribado CV previo a la participación en deportes recreativos y de competición tiene como objetivo detectar enfermedades asociadas con MSC y el potencial de reducir el riesgo CV gracias al tratamiento individualizado del paciente, específico para su enfermedad.
El cribado CV de deportistas adultos y mayores debería centrarse en la mayor prevalencia de la EC ateroesclerótica e incluir una evaluación de los factores de riesgo de ECV y una ergometría. La determinación del CAC puede llevarse a cabo en deportistas asintomáticos con un perfil de riesgo ateroesclerótico moderado.
Los adultos sanos de cualquier edad con cardiopatías diagnosticadas deben hacer ejercicio la mayoría de los días, llegando a un total de 150min/semana de ejercicio de intensidad moderada.
Los pacientes con EC y bajo riesgo de eventos adversos inducidos por el ejercicio deben considerarse aptos para las actividades de ocio y los deportes de competición, con alguna que otra excepción.
No se recomiendan los deportes de competición, con la excepción de deportes individuales de baja intensidad, para los pacientes con EC y riesgo alto de eventos adversos inducidos por el ejercicio o que tengan isquemia residual.
Los programas de ejercicio para la IC mejoran la tolerancia al ejercicio y la calidad de vida y tienen un efecto moderado en la mortalidad total y la IC y en la hospitalización total y la hospitalización por IC.
Los pacientes asintomáticos con valvulopatías leves pueden participar en todas las actividades deportivas, incluidos los deportes de competición.
Se puede considerar la práctica deportiva de competición para ciertos pacientes asintomáticos con valvulopatías leves y buena capacidad funcional sin evidencia de isquemia miocárdica, arritmias complejas o deterioro hemodinámico en ergometría máxima tras consultarlo con un cardiólogo experto.
La implementación de conductas sanas, como la participación deportiva, disminuye el riesgo de eventos CV y la mortalidad de los pacientes con aortopatías.
Los pacientes con miocarditis aguda o pericarditis deben abstenerse de la práctica deportiva mientras haya inflamación.
Los pacientes con miocardiopatía o miocarditis/pericarditis resuelta que deseen ejercitarse regularmente deben someterse a una evaluación exhaustiva, con ergometría incluida, para evaluar el riesgo de arritmias inducidas por el ejercicio.
Los pacientes con genotipo positivo/fenotipo negativo o con una forma clínica de miocardiopatía leve y ausencia de síntomas o factores de riesgo pueden participar en deportes de competición. Una excepción importante son los pacientes con miocardiopatía arritmogénica, a quienes se debe desalentar de realizar ejercicio de alta intensidad y de participar en deportes de competición.
El abordaje de la práctica deportiva de los pacientes con enfermedades arritmogénicas se guía por los siguientes 3 principios: a) prevenir arritmias potencialmente letales durante el ejercicio; b) tratamiento de los síntomas para permitir la práctica deportiva, y c) prevenir la evolución de la enfermedad arritmogénica inducida por el ejercicio. Estas 3 cuestiones se deben tratar en todos los casos.
Se debe descartar la preexcitación en todos los pacientes con TSVP y se recomienda la ablación de las VA, si las hay.
Se deben excluir las enfermedades arritmogénicas estructurales o familiares en todos los pacientes con EV que deseen participar en deportes ya que, si estas enfermedades están presentes, la actividad deportiva puede desencadenar arritmias malignas.
Los pacientes con anomalías eléctricas de origen genético, como las canalopatías iónicas heredadas, necesitan evaluación y toma de decisiones conjunta con cardiogenetistas, dada la compleja interacción de genotipo, forma clínica, modificadores potenciales y ejercicio.
No se debe disuadir a los pacientes con marcapasos de la práctica deportiva debido al dispositivo, pero deben adaptar la participación deportiva a su enfermedad de base.
Se puede considerar la participación de pacientes con DAI en actividades de ocio o deportes de competición, pero requiere un proceso de toma decisiones conjunto caso por caso basado en la probabilidad de descargas apropiadas e inapropiadas durante el deporte y las potenciales consecuencias de episodios cortos de pérdida de la conciencia.
Se debe animar a los pacientes con CC a hacer ejercicio y se les debería dar recomendaciones personalizadas sobre este.
7LAGUNAS EN LA EVIDENCIADesenlaces de pacientes con ECV que se ejercitan. Se desconocen la historia natural y el riesgo absoluto de enfermedades asociadas con MSC en pacientes identificados por cribado CV, por lo que es difícil cuantificar el riesgo a corto y medio plazo. Se necesitan más datos de estudios prospectivos sobre desenlaces, como la ocurrencia de eventos CV mayores y otras morbilidades CV, para mejorar la estratificación del riesgo, el tratamiento y las recomendaciones sobre aptitud para deportistas con ECV diagnosticada.
Evaluación cardiovascular en deportistas veteranos. Los métodos actuales de cribado de EC ateroesclerótica se basan en los síntomas y en ergometría máxima. Sin embargo, no sirven para identificar a pacientes con placas ateroescleróticas de leves a moderadas. Se requieren más datos para optimizar los algoritmos durante el cribado preparticipativo para identificar a los pacientes con riesgo de eventos cardiacos adversos durante el ejercicio.
Seguridad durante el ejercicio de alta intensidad y enfermedad cardiovascular. Hay pocos datos sobre la seguridad de los ejercicios de entrenamiento de alta intensidad y la práctica deportiva en pacientes sanos con una carga alta de factores de riesgo. En el futuro, se podrá obtener más información de alta calidad a través de estudios prospectivos.
Riesgo del origen anómalo de las arterias coronarias en pacientes mayores. Aunque el OAAC del seno opuesto al seno de Valsalva se reconoce como una causa de mortalidad en deportistas jóvenes, se necesita más conocimiento sobre el riesgo del ejercicio de alta intensidad en pacientes mayores (> 40 años) con esta anomalía congénita.
Riesgo del trayecto intramiocárdico. Se desconoce la importancia específica del trayecto intramiocárdico en el infarto de miocardio o la muerte súbita durante el ejercicio.
Beneficio del ejercicio regular en la supervivencia a la insuficiencia cardiaca crónica. Aunque el ejercicio mejora la capacidad funcional de los pacientes con IC, no hay evidencias firme sobre el beneficio del ejercicio regular en la supervivencia.
Efecto del ejercicio de alta de intensidad en la insuficiencia cardiaca crónica. Se desconoce el impacto del ejercicio de alta intensidad en los pacientes asintomáticos con IC y función sistólica reducida y conservada, y se necesitan grandes estudios multicéntricos para facilitar la recomendación de ejercicio en el futuro.
Inicio de un programa de ejercicio tras insuficiencia cardiaca descompensada. Se desconoce el tiempo necesario para comenzar un programa de ejercicio de intensidad moderada-alta y retomar la actividad deportiva tras un evento agudo en la IC.
Ejercicio acuático e insuficiencia cardiaca. La seguridad del ejercicio acuático en la IC debe confirmarse en ensayos más grandes.
Efecto del ejercicio en la historia natural de las valvulopatías. Hay pocos datos sobre los efectos del ejercicio regular e intenso en pacientes con valvulopatías. Se necesitan estudios longitudinales a gran escala para desarrollar recomendaciones basadas en la evidencia sobre el ejercicio para pacientes con valvulopatías.
Efecto del ejercicio en la historia natural de las aortopatías. Existen lagunas sobre el impacto del deporte en la evolución de las aortopatías y el riesgo de disección o rotura aórtica en pacientes con aortopatías. Se desconoce el impacto de los bloqueadores beta en la evolución de las aortopatías en pacientes que se ejercitan regularmente y se debería investigar en un ensayo controlado aleatorizado.
Dosis óptima segura en las miocardiopatías. Con la excepción de la miocardiopatía arritmogénica, la práctica actual sobre las recomendaciones de ejercicio para pacientes con miocardiopatías o tras miopericarditis se basa en gran parte en evidencias circunstanciales. Se necesitan ensayos grandes, aleatorizados y con los recursos necesarios para desarrollar recomendaciones basadas en la evidencia sobre la dosis óptima de ejercicio que no comprometa la seguridad. Estos estudios también podrían ser útiles para validar los actuales protocolos de estratificación del riesgo derivados de la población sedentaria.
Ejercicio y fibrilación auricular. Se desconoce el umbral de actividad deportiva vitalicia total para el aumento del riesgo de FA. También se desconoce si la participación continua en ejercicio vigoroso a la misma intensidad tras la ablación de la FA se asocia con un riesgo de recidiva de la FA.
Beneficio de los estudios electrofisiológicos invasivos en adolescentes con vías accesorias. El cociente beneficio/riesgo de la evaluación electrofisiológica invasiva de las propiedades de conducción de las vías accesorias en deportistas jóvenes con preexcitación asintomática (< 12-14 años) y la ablación profiláctica no está claro y requiere ensayos a gran escala.
Ejercicio con un desfibrilador automático implantable. Aunque los registros internacionales han demostrado la ausencia de muerte súbita o lesión en pacientes con DAI que realizan deportes de competición, recreativos de alta intensidad o de alto riesgo, los datos son dispersos y no se ha examinado específicamente a la población deportista con función del VI reducida o TV polimórfica catecolaminérgica. Más aún, se desconoce el impacto físico a largo plazo y el impacto psicológico de las descargas inapropiadas, que se vuelven más frecuentes con la intensidad del deporte.
Riesgo arrítmico del ejercicio en adultos con cardiopatías congénitas. Se desconoce la relación entre la intensidad del ejercicio y el riesgo de arritmias en adultos con CC y se necesitan más estudios. Aunque se recomienda hacer ejercicio a los pacientes con CC, se necesitan más estudios para identificar el método óptimo para mejorar la adherencia a la recomendación de ejercicio.
8DIFERENCIAS RELACIONADAS CON EL SEXODurante muchos años, la práctica deportiva, especialmente en los escalones más altos, ha estado dominada por varones, pero en las últimas 4 décadas hemos sido testigos de un aumento en el número de mujeres que participan en una gran variedad de disciplinas deportas a nivel de élite. Las mujeres constituyeron el 45% de todos los deportistas en los Juegos Olímpicos de Río de Janeiro de 2016 en 26 de las 28 disciplinas deportivas, también las que tradicionalmente se habían considerado «deportes masculinos», como el fútbol, el rugby y el boxeo. Aunque las recomendaciones de este documento pueden aplicarse a ambos sexos, existen algunas diferencias por sexo pertinentes en relación con el ejercicio y el deporte, entre ellas: a) la incidencia de MSC durante el ejercicio; b) las diferencias cuantitativas en la adaptación CV al ejercicio regular intenso y el solapamiento con miocardiopatías; c) la predominio de los eventos adversos de ECV concretas en las mujeres, y d) los efectos hemodinámicos añadidos del ejercicio en mujeres embarazadas con corazones estructuralmente anormales.
La evidencia actual indica una prevalencia menor de la MSC relacionada con el ejercicio en mujeres, que representan una minoría de los deportistas que mueren súbitamente, con una proporción varones-mujeres que varía de 3 a 10:117,18,46,49,52,620. Esta incidencia desproporcionadamente más baja de MSC entre mujeres deportistas jóvenes también se observa en deportistas recreativos mayores, entre los que las muertes de varones son 20 veces más que las de mujeres.
Además de una menor incidencia de MSC relacionada con el ejercicio, también parece que haya diferencias por sexo relacionadas con las enfermedades que predisponen a la MSC. A diferencia de los varones, las mujeres deportistas con MCH raramente fallecen de MSC. En el US National Registry, las mujeres constituían solo el 3% de los 302 pacientes que sufrieron MCH621. Un posible determinante de esta desproporcionada prevalencia de muerte de varones puede ser un menor volumen absoluto y una menor intensidad en la carga de entrenamiento en las mujeres, lo que puede hacerlas menos susceptibles a las taquiarritmias ventriculares. Sin embargo, también es posible que ciertos mecanismos metabólicos u hormonales sean protectores y puedan reducir el riesgo arrítmico durante el esfuerzo físico intenso en las mujeres con MCH. Esta observación es importante a la hora de realizar recomendaciones sobre la intensidad del ejercicio o los deportes de competición en la MCH, aunque estas recomendaciones ya son relativamente conservadoras, pero podrían ser una fuente menor de preocupación y ofrecer más libertad a las mujeres deportistas en el futuro. El diagnóstico de MCH en el deportista también es relevante en este aspecto porque los deportistas varones, en especial si compiten en deportes de resistencia, muestran cuantitativamente mayores cambios estructurales en el corazón, como HVI. Aproximadamente el 2% de los deportistas de raza blanca y el 13% de los de raza negra muestran un grosor parietal del VI de 12-15mm, que coincide morfológicamente con la MCH leve y puede generar un dilema diagnóstico. Por el contrario, las mujeres deportistas raramente muestran un grosor parietal del VI>12mm o remodelación concéntrica del VI, por lo que el diagnóstico de MCH está muy claro3.
Por el contrario, para las mujeres con PVM, la recomendación sobre ejercicio intenso requiere una estratificación del riesgo mucho más detallada. En el Italian Patholgoy Registry de 650 MSC, el 7% se atribuyó a PVM. De estas, la mayoría (60%) eran mujeres que presentaban un alargamiento importante de ambas valvas debido a una degeneración mixomatosa332.
También se debe prestar atención a que la mayoría de las MSC relacionadas con el ejercicio en mujeres deportistas jóvenes se asocian con un corazón estructuralmente normal a la autopsia. Esta observación viene de diversos registros que indican que las enfermedades eléctricas genéticas (como SQTL, SB o TV polimórfica catecolaminérgica) probablemente sean la causa de una proporción significativa de estas muertes. Se ha informado de las diferencias en la repolarización cardiaca entre varones y mujeres sanos y pacientes con SQTL622. Las mujeres sanas también tienen un intervalo QTc más largo que los varones. Por lo tanto, el síndrome les afecta más que a los varones, a pesar de la distribución equitativa por sexos del genotipo en esta enfermedad. Las mujeres también tienen un mayor riesgo que los varones de sufrir arritmias en respuesta a los fármacos que alargan el intervalo QT, así como desequilibrios electrolíticos. Más aún, el sexo femenino es un factor independiente de riesgo de eventos cardiacos en el SQTL623. Por desgracia, hay poca información sobre la influencia de las hormonas sexuales en la repolarización cardiaca, a excepción de que los andrógenos pueden disminuir el intervalo QTc. Según estas consideraciones, se recomienda especial cuidado en el asesoramiento sobre deportes de competición a mujeres con STQL sospechado o confirmado.
El embarazo se asocia con un aumento del 50% del volumen plasmático y el gasto cardiaco. El estrés del ejercicio en las mujeres embarazadas con cardiopatía estructural podría causar deterioro hemodinámico. El ejercicio aeróbico moderado es seguro para todas las mujeres en general y se asocia con una menor prevalencia de sobrepeso, obesidad posparto, diabetes gestacional y preeclampsia. Las deportistas pueden continuar la intensidad del entrenamiento durante el embarazo, aunque se recomienda que la frecuencia cardiaca de la mujer no exceda el>90% de la máxima predicha por edad para reducir el riesgo de bradicardia fetal. Las embarazadas con diagnóstico de cardiopatía estructural requieren una evaluación antes de participar en programas de ejercicio intenso. No se recomiendan el ejercicio o los deportes que conlleven un fuerte contacto físico, riesgo de caída o traumatismo abdominal, levantamiento de mucho peso, submarinismo y ejercicio en altitud en un entorno climatizado.
Por último, las mujeres representan la mayor población obesa del mundo y las mujeres con DM2 tienen una mayor prevalencia de complicaciones cardiovasculares y muerte que los varones. En este sentido, se debe animar a todas las mujeres a mantener AF regular y participar en programas de ejercicio independientemente de la edad, la etnia y las morbilidades CV.
9MENSAJES CLAVE DE LA GUÍA SOBRE QUÉ HACER Y QUÉ NO| Recomendaciones: qué hacer y qué no sobre el ejercicio y el deporte de personas sanas | ||
|---|---|---|
| Recomendaciones | Clasea | Nivelb |
| Se recomiendan al menos 150min/semana de ejercicio de intensidad moderada o 75 min/semana de ejercicio aeróbico de intensidad vigorosa o una combinación equivalente para todos los adultos sanos | I | A |
| Se recomienda la evaluación frecuente y el asesoramiento para promocionar la adherencia y, si fuese necesario, apoyar un aumento en el volumen de ejercicio con el correr del tiempo | I | B |
| Se recomiendan múltiples sesiones de ejercicio distribuidas a lo largo de la semana, p. ej., 4-5 días a la semana o, preferiblemente, cada día | I | B |
| Consideraciones especiales para personas con obesidad, hipertensión, dislipemia o diabetes | ||
| Para las personas obesas (IMC ≥ 30 o circunferencia abdominal > 80cm las mujeres o > 94cm los varones), se recomienda el entrenamiento de fuerza al menos 3 veces por semana, además de ejercicio aeróbico de moderado a vigoroso (≥ 30 min, 5-7 días por semana) para reducir el riesgo de ECV | I | A |
| Para personas con buen control de la hipertensión, se recomienda el entrenamiento de fuerza al menos 3 veces por semana, además de ejercicio aeróbico de moderado a vigoroso (≥ 30 min, 5-7 días por semana) para disminuir la presión arterial y el riesgo de ECV | I | A |
| Para los pacientes diabéticos, se recomienda el entrenamiento de fuerza al menos 3 veces por semana, además de ejercicio aeróbico de moderado a vigoroso (≥ 30min, 5-7 días por semana) para mejorar la sensibilidad a la insulina y el perfil de riesgo de ECV | I | A |
| Para las personas con hipertensión descontrolada (PAS>160mmHg), no se recomienda el ejercicio de alta intensidad hasta que no se controle la presión arterial | III | C |
| Recomendaciones sobre ejercicio para adultos mayores | ||
| Para los adultos mayores de 65 años en buena forma y sin problemas de salud que limiten su movilidad, se recomienda el ejercicio aeróbico de intensidad moderada al menos 150min/semana | I | A |
| Para los adultos mayores con riesgo de caídas, se recomiendan ejercicios de entrenamiento de fuerza al menos 2 días a la semana para mejorar el equilibrio y la coordinación | I | B |
| Recomendaciones sobre ejercicio para pacientes con enfermedad coronaria | ||
| Recomendaciones sobre ejercicio para pacientes con síndrome coronario crónico de larga duración | ||
| Se recomienda la estratificación del riesgo de eventos adversos inducidos por el ejercicio para personas con síndrome coronario crónico de larga duración antes de realizar ejercicio | I | C |
| No se recomiendan los deportes de competición para pacientes con alto riesgo de eventos adversos inducidos por el ejercicio o con isquemia residual, a excepción de deportes de habilidad recomendados individualizadamente | III | C |
| Recomendaciones sobre la vuelta al ejercicio tras síndrome coronario agudo | ||
| Se recomienda la rehabilitación cardiaca basada en el ejercicio para todas las personas con EC para reducir la mortalidad cardiaca y los reingresos hospitalarios | I | A |
| Recomendaciones sobre el ejercicio para pacientes/deportistas jóvenes con anomalía congénita de las arterias coronarias | ||
| No se recomienda la participación en la mayoría de los deportes de competición con una demanda cardiovascular de moderada a alta a los pacientes con OAAC con una salida en ángulo recto o un flujo anómalo entre los grandes vasos | III | C |
| Recomendaciones sobre el ejercicio/deporte para pacientes con trayecto intramiocárdico | ||
| No se recomiendan los deportes de competición a los pacientes con puente miocárdico e isquemia persistente o arritmias cardiacas complejas durante la ergometría máxima | III | C |
| Recomendaciones sobre el ejercicio para pacientes con insuficiencia cardiaca crónica | ||
| Recomendaciones sobre la prescripción de ejercicio a pacientes con insuficiencia cardiaca y fracción de eyección en rango medio | ||
| Se recomienda hablar con regularidad sobre la participación en ejercicio y la provisión de un plan de ejercicio individualizado con todos los pacientes con IC | I | A |
| Se recomienda la rehabilitación cardiaca basada en el ejercicio de todos los pacientes estables para aumentar la capacidad de ejercicio y la calidad de vida y reducir la frecuencia de reingresos hospitalarios | I | A |
| Recomendaciones sobre la práctica deportiva para pacientes con insuficiencia cardiaca | ||
| Se recomienda una optimización preliminar de los factores de riesgo de insuficiencia cardiaca y su tratamiento, incluido el implante de un dispositivo (si es apropiado) antes de considerar cualquier actividad deportiva | I | C |
| No se recomiendan los deportes de alta intensidad de potencia y de resistencia para pacientes con IC-FEr independientemente de sus síntomas | III | C |
| Recomendaciones sobre ejercicio y práctica deportiva para pacientes con insuficiencia cardiaca y fracción de eyección conservada | ||
| Se recomiendan ejercicios de resistencia moderados y ejercicios dinámicos de resistencia dinámica, junto con intervenciones en el estilo de vida y tratamiento óptimo de los factores de riesgo cardiovascular (p. ej., HTA y DM2) | I | C |
| Recomendaciones sobre ejercicio y práctica deportiva para pacientes con trasplante cardiaco | ||
| Se recomienda el ejercicio regular con un programa de rehabilitación cardiaca que combine ejercicio aeróbico y ejercicio de fuerza de intensidad moderada para revertir la fisiopatología a la previa al trasplante, reducir el riesgo CV inducido por el tratamiento postrasplante y mejorar los desenlaces clínicos | I | B |
| Recomendaciones sobre ejercicio para pacientes asintomáticos con valvulopatías | ||
| No se recomiendan los deportes o ejercicios de competición o recreativos de intensidad moderada y alta para pacientes con estenosis aórtica grave | III | C |
| No se recomiendan los deportes o ejercicios de competición o recreativos de intensidad moderada y alta para pacientes con insuficiencia aórtica grave y FEVI ≤ 50% o arritmias inducidas por el ejercicio | III | C |
| No se recomiendan los deportes de competición para los pacientes con IM grave y FEVI < 60% | III | C |
| No se recomiendan los deportes de competición o ejercicios de ocio de intensidad leve a moderada para pacientes con estenosis mitral grave (AVM < 1 cm2) | III | C |
| Recomendaciones sobre ejercicio para pacientes con enfermedad aórtica | ||
| Se recomienda una estratificación del riesgo antes de la práctica de ejercicio, con una evaluación exhaustiva que incluya imágenes avanzadas de la aorta (TC/RMC) y ergometría con determinación de la PA | I | A |
| No se recomiendan los deportes de competición para pacientes con alto riesgo (tabla 14) | III | C |
| Recomendaciones sobre el ejercicio para pacientes con miocardiopatías | ||
| Recomendación general | ||
| Se recomienda la evaluación anual para la estratificación del riesgo de todos los pacientes con miocardiopatías que se ejerciten regularmente | I | C |
| Recomendaciones sobre el ejercicio y la práctica deportiva para pacientes con miocardiopatía hipertrófica | ||
| No se recomienda la práctica deportiva de alta intensidad (incluidos deportes recreativos y de competición) para pacientes que tengan alguno de los marcadores de riesgo cardiaco aumentado: a) síntomas cardiacos o antecedentes de parada cardiaca o síncope de origen desconocido; b) riesgo ESC a 5 años moderado (≥ 4%); c) gradiente del TSVI en reposo > 30mmHg; d) respuesta anormal de la PA al ejercicio, e) arritmias inducidas por el ejercicio | III | C |
| Recomendaciones sobre ejercicio y práctica deportiva para pacientes con miocardiopatía arritmogénica | ||
| No se recomiendan el ejercicio o los deportes recreativos de alta intensidad o cualquier deporte de competición para los pacientes con MCA, incluidos aquellos con genotipo positivo/fenotipo negativo | III | C |
| Recomendaciones sobre el ejercicio y la práctica deportiva para pacientes con miocardiopatía no compactada del ventrículo izquierdo | ||
| No se recomiendan los deportes de alta intensidad o de competición para los pacientes sintomáticos con FEVI < 40% o AV complejas o frecuentes en la monitorización Holter ambulatoria o la ergometría | III | C |
| Recomendaciones sobre el ejercicio y la práctica deportiva para pacientes con miocardiopatía dilatada | ||
| No se recomienda la práctica deportiva de alta o muy alta intensidad, incluidos los deportes de competición, para pacientes con MCH y cualquiera de los siguientes: a) síntomas o antecedentes de parada cardiaca o síncope de origen desconocido; b) FEVI < 45%; c) AV complejas o frecuentes en la monitorización Holter ambulatoria o la ergometría; d) RTG extenso (> 20%) en la RMC, o e) genotipo de alto riesgo (lamina A/C o filamina C) | III | C |
| Recomendaciones sobre ejercicio para personas con miocarditis o pericarditis | ||
| Se recomienda un examen exhaustivo, con estudio de imágenes, ergometría y monitorización Holter, tras la recuperación de miocarditis aguda para evaluar el riesgo de MSC relacionada con el ejercicio | I | B |
| Se recomienda la vuelta al ejercicio, incluidos los deportes de competición, entre 30 días y 3 meses tras la recuperación completa de pericarditis aguda, dependiendo de la gravedad clínica | I | C |
| No se recomiendan las actividades de ocio o los deportes de competición para los pacientes con diagnóstico probable o definitivo reciente de miocarditis o pericarditis mientras haya inflamación | III | C |
| No se recomienda el ejercicio de intensidad moderada-alta durante un periodo de 3-6 meses tras una miocarditis aguda | III | B |
| No se recomienda el ejercicio de intensidad moderada-alta, incluidos los deportes de competición, para pacientes con pericarditis constrictiva | III | C |
| Recomendaciones sobre el ejercicio para pacientes con arritmias y desfibrilador automático implantable | ||
| Recomendaciones sobre ejercicio para pacientes con fibrilación auricular | ||
| Se recomienda el ejercicio físico regular para prevenir la FA | I | A |
| Se recomienda la evaluación y el tratamiento de cardiopatía estructural, disfunción tiroidea, alcoholismo o consumo de drogas y otras causas primarias de FA antes de participar en cualquier deporte | I | A |
| Se recomienda la ablación de la FA para las personas que hagan ejercicio con FA recurrente sintomática o que no deseen tratamiento farmacológico por su impacto en el rendimiento deportivo | I | B |
| No se recomiendan los deportes de contacto físico o propensos a los traumatismos para pacientes con FA que realicen ejercicio y estén en tratamiento con anticoagulantes | III | C |
| Recomendaciones sobre ejercicio y práctica deportiva para pacientes con taquicardia supraventricular paroxística y preexitación | ||
| Para los pacientes con palpitaciones, se recomienda una evaluación completa para excluir preexcitación (latente), enfermedades estructurales y AV | I | B |
| Se recomienda la ablación de las vías accesorias para los deportistas de competición y recreativos con preexcitación y arritmias documentadas | I | C |
| Se recomienda el estudio electrofisiológico de los deportistas de competición/profesionales con preexcitación asintomática para evaluar el riesgo de muerte súbita | I | B |
| Recomendaciones sobre ejercicio para pacientes con extrasístoles ventriculares y taquicardia ventricular no sostenida | ||
| Se recomienda una evaluación completa (que incluya antecedentes familiares detallados) para pacientes que practican ejercicio con al menos 2 EV en el ECG basal (≥ 1EV en caso de deportistas de alta resistencia), con el fin de descartar enfermedades estructurales o arritmogénicas subyacentes | I | C |
| Se recomienda una investigación completa con monitorización Holter, ECG de 12 derivaciones, ergometría y las pruebas de imagen apropiadas si procede para pacientes con EV frecuentes y TVNS | I | C |
| Recomendaciones sobre el ejercicio para pacientes con síndrome de QT largo | ||
| Se recomienda que todos los pacientes con SQTL y síntomas anteriores o QTc prolongado reciban tratamiento con bloqueadores beta con dosis diana | I | B |
| Se recomienda que los pacientes con SQTL que realicen ejercicio eviten los fármacos que prolonguen el QT (www.crediblemeds.org) y desequilibrios electrolíticos como hipopotasemia o hipomagnesemia | I | B |
| No se recomiendan los deportes recreativos y de competición de alta intensidad, incluso con bloqueadores beta para pacientes con QTc > 500 ms o SQTL confirmado por pruebas genéticas con un QTc ≥ 470 ms los varones y ≥ 480 las mujeres | III | B |
| No se recomienda la práctica deportiva de competición (con o sin DAI) para pacientes con SQTL y antecedentes de parada cardiaca o síncope arrítmico | III | C |
| Recomendaciones sobre ejercicio para pacientes con síndrome de Brugada | ||
| Se recomienda el implante de un DAI para pacientes con SB y episodios de síncope arrítmico o MSC recuperada | I | C |
| No se recomienda la prescripción de fármacos que puedan agravar el SB o el desequilibrio electrolítico ni la práctica deportiva que aumente la temperatura central > 39°C para pacientes con SB o portadores de mutación fenotípica negativa | III | C |
| Recomendaciones sobre ejercicio para pacientes con dispositivos electrónicos cardiacos implantables | ||
| Se recomienda que los pacientes con dispositivos implantados con/sin resincronización y enfermedad subyacente sigan las recomendaciones pertinentes sobre la enfermedad subyacente | I | B |
| No se recomienda un DAI como sustituto de recomendaciones específicas de cada enfermedad si estas prohíben la práctica deportiva | III | C |
| Recomendaciones para pacientes con cardiopatías congénitas | ||
| Se recomienda el ejercicio moderado regular para todos los pacientes con CC | I | B |
| Se recomienda hablar de la participación deportiva y las recomendaciones individualizadas sobre la práctica deportiva en todas las consultas con el paciente con CC | I | B |
| No se recomiendan los deportes de competición para pacientes con CC en NYHA III-V con riesgo de arritmias potencialmente graves | III | C |
| Recomendaciones sobre ejercicio durante el embarazo | ||
| Se recomienda a las embarazadas sin contraindicaciones médicas u obstétricas la práctica de al menos 150min/semana de ejercicio aeróbico de intensidad moderada antes, durante y tras el embarazo | I | B |
| Se recomienda la revaluación antes de continuar el ejercicio o el entrenamiento si la embarazada sufre disnea excesiva, dolor torácico intenso, mareos o síncope, contracciones regulares dolorosas, sangrado vaginal o pérdida de líquido amniótico | I | A |
| Se recomienda que las mujeres con ECV que participan habitualmente en entrenamientos de fuerza o disciplinas deportivas de potencia antes del embarazo compartan esta información con el equipo médico antes de continuar la actividad y que eviten la maniobra de Valsalva | I | A |
| No se recomienda el ejercicio o los deportes que impliquen contacto físico de fuerza, riesgo de caída o traumatismo abdominal, levantamiento de mucho peso, buceo o ejercicio en altitud sin climatización | III | C |
| No se recomienda durante el embarazo el ejercicio vigoroso que implique una frecuencia cardiaca máxima > 90% de la frecuencia cardiaca máxima predicha | III | B |
| No se recomienda el ejercicio en decúbito supino sobre una superficie dura tras el primer trimestre debido al riesgo de disminución del retorno venoso y el flujo sanguíneo uterino | III | B |
| Recomendaciones sobre ejercicio para pacientes con enfermedad renal crónica | ||
| Se recomiendan el entrenamiento aeróbico de intensidad de baja a moderada (hasta 150min/semana) y el entrenamiento de fuerza de intensidad de baja a moderada (2 días/semana, 8-12 ejercicios, 12-15 repeticiones) y los ejercicios de flexibilidad para todos los pacientes con ERC | I | A |
| No se recomienda la práctica deportiva de contacto para los pacientes con osteodistrofia/osteoporosis establecidas o coagulopatías | III | C |
| No se recomienda la práctica deportiva en las siguientes circunstancias: anomalías electrolíticas, cambios recientes en el ECG, aumento de peso excesivo entre diálisis, cambios o ajustes en el tratamiento médico, congestión pulmonar y aumento de edema periférico | III | C |
| Recomendaciones sobre el ejercicio para pacientes oncológicos | ||
| Se recomienda el ejercicio regular durante y tras el tratamiento del cáncer para reducir la fatiga oncológica y mejorar la calidad de vida, la forma física y el pronóstico | I | A |
| Para los pacientes con tratamientos cardiotóxicos, se recomienda una ecocardiografía antes de la participación en ejercicio de alta intensidad | I | A |
| Recomendaciones sobre el ejercicio para pacientes con lesiones de médula ósea | ||
| Para pacientes adultos con lesiones de médula ósea, se recomienda la práctica de 20 min de ejercicio aeróbico de intensidad moderada a vigorosa al menos 3 veces a la semana, junto con entrenamiento de fuerza 2-3 veces a la semana para obtener beneficios en la forma cardiorrespiratoria, la salud cardiometabólica y la fuerza muscular | I | A |
| No se recomiendan los métodos de inducción de disreflexia autonómica provocando dolor intencionadamente a la mitad inferior del cuerpo («boosting») con obstrucción de una sonda permanente, correas demasiado tensas en las piernas y descargas eléctricas u otros métodos que causen dolor en los genitales o las extremidades inferiores, ya que pueden ser letales | III | C |
| Recomendaciones sobre el ejercicio para pacientes con dispositivos de asistencia ventricular | ||
| Para los pacientes con dispositivos de asistencia ventricular (DAV), se recomienda el ejercicio regular en un programa de rehabilitación cardiaca que combine ejercicio aeróbico de intensidad moderada y ejercicio de fuerza | I | A |
| No se recomiendan los deportes con posibles impactos en los componentes del DAV (p. ej., los de contacto) | III | C |
| Recomendaciones de actividad física y deportiva para pacientes y deportistas con enfermedad arterial periférica | ||
| Se recomienda que los pacientes con EC ateroesclerótica hagan ejercicio regularmente (al menos 150min/semana de ejercicio aeróbico moderado o 75 min/semana de ejercicio vigoroso aeróbico o una combinación de ambos) como parte de la estrategia de prevención secundaria | I | A |
| Para pacientes con EAEI sintomática, se recomiendan los programas de ejercicio supervisado que incluyan caminar hasta la distancia máxima o submáxima durante la menos 3 h/semana | I | A |
| Para los deportistas con EAP traumática o no traumática tras la recuperación de una cirugía abierta o revascularización percutánea, se recomienda la continuación de los deportes de competición | I | C |
AV: arritmia ventricular; AVM: área de la válvula mitral; CC: cardiopatías congénitas; DAI: desfibrilador automático implantable; DAV: dispositivo de asistencia ventricular; EAEI: enfermedad arterial de las extremidades inferiores; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECG: electrocardiograma; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; ESC: European Society of Cardiology; EV: extrasístoles ventriculares; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IMC: índice de masa corporal; MCA: miocardiopatía arritmogénica; MSC: muerte súbita cardiaca; NYHA: clase funcional de la New York Heart Association; OAAC: origen anómalo de las arterias coronarias; PA: presión arterial; PAS: presión arterial sistólica; RMC: resonancia magnética cardiaca; SB: síndrome de Brugada; SCC: síndrome coronario crónico; SQTL: síndrome de QT largo; TC: tomografía computarizada; TSVI: tracto de salida del ventrículo izquierdo; TV: taquicardia ventricular.
aClase de recomendación.
bNivel de evidencia.
El material adicional con tablas, figuras y texto que complementan el texto principal están disponibles en la página web de European Heart Journal y a través de la página web de la ESC en: www.escardio.org/guidelines.
11ANEXO11.1Filiaciones de los autores/miembros del grupo de trabajoSabiha Gati, Faculty of Medicine, National Heart & Lung Institute, Imperial College, Londres, Reino Unido, y Cardiology, Royal Brompton & Harefield Hospital NHS Foundation Trust, Londres, Reino Unido; Maria Bäck, Unit of Physiotherapy, Department of Health, Medicine and Caring Sciences, Linköping University, Linköping, Suecia, y Department of Molecular and Clinical Medicine, Institute of Medicine, Sahlgrenska Academy, University of Gothenburg y Sahlgrenska University Hospital, Gotemburgo, Suecia; Mats Börjesson, Department of Molecular and Clinical Medicine, Institute of Medicine, Sahlgrenska Academy, University of Gothenburg y Sahlgrenska University Hospital, Gotemburgo, Suecia, y Center for Health and Performance, Department of Food, Nutrition and Sports Science, Gothenburg University, Gotemburgo, Suecia; Stefano Caselli, Cardiovascular Center Zurich, Hirslanden Klinik im Park, Zúrich, Suiza; Jean- Philippe Collet, Sorbonne Université, Institut de Cardiologie, Hôpital Pitié-Salpêtrière (APHP), París, Francia; Domenico Corrado, Cardiac, Thoracic and Vascular Sciences, University of Padova, Padua, Italia; Jonathan A. Drezner, University of Washington, Seattle, Estados Unidos; Martin Halle, Prevention and Sports Medicine, Klinikum rechts der Isar, Technical University of Munich, Múnich, Alemania; Dominique Hansen, Hasselt University, BIOMED/REVAL/Heart Centre Hasselt, Jessa Hospital, Hasselt, Bélgica; Hein Heidbuchel, Cardiology, University Hospital Antwerp, y Antwerp University, Amberes, Bélgica; Jonathan Myers, Cardiology Division, VA Palo Alto Health Care System, Palo Alto, California, Estados Unidos, y Cardiology Division, Stanford University, Palo Alto, California, Estados Unidos; Josef Niebauer, University Institute of Sports Medicine, Prevention and Rehabilitation, Paracelsus Medical University, Salzburgo, Austria, y Ludwig Boltzmann Institute for Digital Health and Prevention, Salzburgo, Austria; Michael Papadakis, Cardiology Clinical Academic Group, St George's, University of London, Londres, Reino Unido; Massimo Francesco Piepoli, Heart Failure Unit, Cardiology, Guglielmo da Saliceto Hospital, y University of Parma, Plasencia, Italia; Eva Prescott, Department of Cardiology, Bispebjerg University Hospital, Copenhague, Dinamarca; Jolien W. Roos-Hesselink, Department of Cardiology, Erasmus MC, Rotterdam, Países Bajos; A. Graham Stuart, Congenital Heart Unit, Bristol Heart Institute, Brístol, Reino Unido; Rod S. Taylor, University of Glasgow, Glasgow, Reino Unido; Paul D. Thompson, Division of Cardiology, Hartford Hospital, Hartford, Connecticut, Estados Unidos; Monica Tiberi, Department of Health-Sport Medicine, Azienda Unica Regionale Marche, Area Vasta 1, Pésaro, Italia; Luc Vanhees, Rehabilitation Sciences, Kuleuven, Lovania, Bélgica; y Matthias Wilhelm, Department of Cardiology, Inselspital, University Hospital Bern, University of Bern, Berna, Suiza.
11.2Comité de la ESC para las Guías de Práctica Clínica (GPC)Stephan Windecker (coordinador) (Suiza), Victor Aboyans (Francia), Colin Baigent (Reino Unido), Jean-Philippe Collet (Francia), Veronica Dean (Francia), Victoria Delgado (Países Bajos), Donna Fitzsimons (Reino Unido), Chris P. Gale (Reino Unido), Diederick E. Grobbee (Países Bajos), Sigrun Halvorsen (Noruega), Gerhard Hindricks (Alemania), Bernard Iung (Francia), Peter Jüni (Canadá), Hugo A. Katus (Alemania), Ulf Landmesser (Alemania), Christophe Leclercq (Francia), Maddalena Lettino (Italia), Basil S. Lewis (Israel), Béla Merkely (Hungría), Christian Mueller (Suiza), Steffen E. Petersen (Reino Unido), Anna Sonia Petronio (Italia), Dimitrios J. Richter (Grecia), Marco Roffi (Suiza), Evgeny Shlyakhto (Federación Rusa), Iain A. Simpson (Reino Unido), Miguel Sousa-Uva (Portugal) y Rhian M. Touyz (Reino Unido).
11.3Sociedades nacionales de la ESC que han colaborado activamente en el proceso de revisión de la GPC ESC 2020 sobre cardiología del deporte y ejercicio físico en pacientes con enfermedad cardiovascularAlgeria:Algerian Society of Cardiology, Mohamed Tahmi; Armenia:Armenian Cardiologists Association, Parounak H. Zelveian; Austria:Austrian Society of Cardiology, Thomas Berger; Azerbaiyán:Azerbaijan Society of Cardiology, Rahima Gabulova; Bielorrusia:Belorussian Scientific Society of Cardiologists, Svetlana Sudzhaeva; Bélgica:Belgian Society of Cardiology, Patrizio Lancellotti; Bosnia y Herzegovina:Association of Cardiologists of Bosnia and Herzegovina, Sekib Sokolović; Bulgaria:Bulgarian Society of Cardiology, Ivan Gruev; Croacia:Croatian Cardiac Society, Vedran Velagic; Chipre:Cyprus Society of Cardiology, Evagoras Nicolaides; República Checa:Czech Society of Cardiology, Vladimir Tuka; Dinamarca:Danish Society of Cardiology, Hanne Rasmusen; Egipto:Egyptian Society of Cardiology, Hazem Khamis; Estonia:Estonian Society of Cardiology, Margus Viigimaa; Finlandia:Finnish Cardiac Society, Jari A. Laukkanen; Francia:French Society of Cardiology, Gilles Bosser; Alemania:German Cardiac Society, Rainer Hambrecht; Grecia:Hellenic Society of Cardiology, Alexandros Kasiakogias; Hungría:Hungarian Society of Cardiology, Béla Merkely; Islandia:Icelandic Society of Cardiology, Gunnar Thor Gunnarsson; Irlanda:Irish Cardiac Society, Brendan McAdam; Israel:Israel Heart Society, Andre Keren; Italia:Italian Federation of Cardiology, Pasquale Perrone-Filardi; Kosovo (República de):Kosovo Society of Cardiology, Gani Bajraktari; Kirguistán:Kyrgyz Society of Cardiology, Erkin Mirrakhimov; Letonia:Latvian Society of Cardiology, Sandra Rozenštoka; Lituania:Lithuanian Society of Cardiology, Germanas Marinskis; Luxemburgo:Luxembourg Society of Cardiology, Cristiana Banu; Malta:Maltese Cardiac Society, Mark Abela; Moldavia (República de): Moldavian Society of Cardiology, Eleonora Vataman; Montenegro:Montenegro Society of Cardiology, Natasa Belada; Marruecos:Moroccan Society of Cardiology, Hasnaa Belghiti; Países Bajos:Netherlands Society of Cardiology, Harald Thune Jorstad; Macedonia del Norte:North Macedonian Society of Cardiology, Elizabeta Srbinovska Kostovska; Noruega:Norwegian Society of Cardiology, Kristina Haugaa; Polonia:Polish Cardiac Society, Renata Glówczyńska; Portugal:Portuguese Society of Cardiology, Helder Dores; Rumanía:Romanian Society of Cardiology, Florin Mitu; Federación Rusa:Russian Society of Cardiology, Andrey Smolensky; San Marino:San Marino Society of Cardiology, Marina Foscoli; Serbia:Cardiology Society of Serbia, Ivana Nedeljkovic; Eslovaquia:Slovak Society of Cardiology, Stefan Farsky; Eslovenia:Slovenian Society of Cardiology, Zlatko Fras; España: Sociedad Española de Cardiología, Araceli Boraita; Suecia:Swedish Society of Cardiology, Peder Sörenssen; Suiza:Swiss Society of Cardiology, Christian Schmied; República Árabe Siria:Syrian Cardiovascular Association, Walid Bsata; Túnez:Tunisian Society of Cardiology and Cardio-Vascular Surgery, Lilia Zakhama; Turquía:Turkish Society of Cardiology, Mehmet Uzun; Ucrania:Ukrainian Association of Cardiology, Elena Nesukay; Reino Unido:British Cardiovascular Society, Dhrubo Rakhit.
Nos gustaría rendir tributo al Prof. Galderisi, fallecido en marzo de 2020.El Comité para las Guías de Práctica Clínica (GPC) de la ESC, los revisores de las Sociedades Nacionales Cardiacas y las afiliaciones de los autores/miembros del Grupo de Trabajo se listan en el apéndice.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association of Cardiovascular Nursing & Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Preventive Cardiology (EAPC), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Grupos de Trabajo: Adult Congenital Heart Disease.El contenido de esta guía de práctica clínica (GPC) de la ESC se publica exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal, o a los representantes autorizados de la ESC (journals.permissions@oxfordjournals.org).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso del conocimiento científico y médico y la evidencia disponible hasta la fecha. La ESC no es responsable en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias medicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.© The European Society of Cardiology 2019. Reservados todos los derechos. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Las declaraciones de conflicto de intereses de todos los expertos que han participado en el desarrollo de esta guía están disponibles en la página web de la ESC: www.escardio.org/guidelines.Palabras clave:Guías de práctica clínica • Cardiopatía congénita del adulto • Aortopatías • Arritmias • Cáncer • Miocardiopatía • Factores de riesgo cardiovascular • Síndromes coronarios crónicos • Ejercicio • Insuficiencia cardiaca • Embarazo • Enfermedad vascular periférica • Recomendaciones • Estratificación del riesgo • Entornos deportivos especiales • Valvulopatías