riesgo de ictus y gravedad de los síntomas, de la carga y del sustrato
ácido acetilsalicílico
Atrial fibrillation Better Care: includes A (avoid stroke), B (better symptom control), and C (cardiovascular risk factors and comorbid conditions management)
aclaramiento de creatinina
anticoagulación oral
episodios de frecuencia auricular rápida
aurícula izquierda
antiinflamatorios no esteroideos
accidente isquémico transitorio
apnea obstructiva del sueño
aplicación electrónica para la fibrilación auricular
aspartato aminotransferasa
antagonistas de la vitamina K
aislamiento de vena pulmonar
bloqueadores de los canales del calcio
escala, EC/EPOC (1 punto cada una), hipertensión (1 punto), edad ≥ 75 años (2 puntos), insuficiencia cardiaca sistólica (2 puntos) y enfermedad tiroidea (hipertiroidismo, 1 punto)
calidad de vida
presión positiva continua en la vía aérea
insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65–74 años y sexo (mujer)
insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años, diabetes mellitus, síntomas previos de ictus o AIT
dispositivo electrónico cardiaco implantable
dihidropiridinas
enfermedad arterial periférica
enfermedad coronaria
ensayo controlado y aleatorizado
electrocardiograma
enfermedad pulmonar obstructiva crónica
enfermedad renal crónica
Sociedad Europea de Cardiología
ecocardiografía transesofágica
fibrilación auricular
fármaco antiarrítmico
fracción de eyección del ventrículo izquierdo
factor de diferenciación de crecimiento 15
hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol
heparina de bajo peso molecular
hemorragia intracraneal
heparina no fraccionada
hazard ratio
troponina cardiaca T de alta sensibilidad
hipertrofia ventricular izquierda
intravenoso
infarto agudo de miocardio con elevación del segmento ST
insuficiencia cardiaca
insuficiencia cardiaca congestiva
insuficiencia cardiaca con fracción de eyección conservada
insuficiencia cardiaca con fracción de eyección reducida
intervención coronaria percutánea
istmo cavotricuspídeo
edad, biomarcadores e historia clínica (escala de riesgo de ictus)
razón internacional normalizada
miocardiopatía hipertrófica
nuevos anticoagulantes orales no dependientes de la vitamina K
New York Heart Association
orejuela izquierda
presión arterial
presión arterial sistólica
intervalo QT corregido
resonancia magnética
resultado referido por el paciente
escala: sexo (mujer), edad (< 60 años), historia médica, tratamiento, tabaquismo, raza (no caucásica)
Edad, biomarcadores (hemoglobina, cTnT hs T, GDF-15) e historia clínica (hemorragia previa)
síndrome coronario agudo
síndrome coronario crónico
tratamiento antiagregante plaquetario doble
tomografía computarizada
terapia de resincronización cardiaca
tiempo en rango terapéutico
ventrículo izquierdo
Las guías de práctica clínica (GPC) tienen como objetivo reunir y evaluar toda la evidencia relevante disponible durante el proceso de elaboración sobre un tema particular para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular, que sufre una enfermedad determinada, no solo teniendo en cuenta el resultado final, sino también sopesando los riesgos y los beneficios de un procedimiento diagnóstico o terapéutico concreto. Las GPC deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto la debe tomar el médico responsable de su salud, en consulta con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido al impacto de las GPC, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/ Guidelines/Clinical-Practice-Guidelines/Guidelines-development/Writing-ESC-Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
Además de la publicación de las GPC, la ESC lleva a cabo el EurObservational Research Programme de registros internacionales sobre enfermedades e intervenciones cardiovasculares que son esenciales para evaluar los procesos diagnósticos y terapéuticos, el uso de recursos y la adherencia a las recomendaciones de las guías. El objetivo de estos registros es comprender mejor la práctica clínica en Europa y en el mundo con base en los datos recogidos en la práctica clínica cotidiana.
En algunas guías la ESC ha desarrollado e integrado un paquete de indicadores de calidad (IdC) que sirven para evaluar el nivel de implementación y pueden usar la ESC, los hospitales y los proveedores y profesionales de la salud, y en programas de educación, junto con los mensajes clave para medir y mejorar la calidad de la atención y los resultados clínicos.
Los miembros de este grupo de trabajo, entre los que se incluyen representantes de los grupos de subespecialidades, fueron seleccionados por la ESC en representación de los profesionales de la salud dedicados a los cuidados médicos de la afección tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre el diagnóstico, el tratamiento y la prevención de esta entidad concreta según las normas establecidas por el Comité de la ESC para la Elaboración de GPC. Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Clases de recomendaciones.
| Definición | Expresiones propuestas | ||
|---|---|---|---|
| Clases de recomendaciones | Clase I | Evidencia y/o acuerdo general de que determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | ||
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar | |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar | |
| Clase III | Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda |
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Los expertos responsables de la redacción y la revisión del documento han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas están archivadas y disponibles en la página web de la ESC (http://www.escardio.org/guidelines). Durante el periodo de redacción, las modificaciones en las relaciones que se pudiera considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de trabajo fue financiado en su totalidad por la ESC y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de GPC de la ESC supervisó y coordinó la preparación de esta nueva edición. El Comité es responsable también del proceso de aprobación de las GPC. Expertos externos realizaron una revisión exhaustiva del documento, tras lo cual fue aprobado por todos los miembros del grupo de trabajo. Por último, el documento final fue aprobado por el Comité de GPC de la ESC para su publicación en European Heart Journal. La guía se desarrolló tras la evaluación exhaustiva de los datos científicos, el conocimiento médico y la evidencia disponible en el momento de su elaboración.
La tarea de elaboración de GPC incluye no solo la integración de la investigación más reciente, sino también la creación de herramientas educativas y programas de implementación de las recomendaciones. Para su implementación, se desarrollan ediciones de bolsillo, resúmenes en diapositivas, folletos con mensajes clave y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Estas versiones son resumidas y, por lo tanto, en caso de necesidad, debe consultarse la versión completa que se encuentra disponible gratuitamente en la página web de la ESC y EHJ. Se recomienda a las sociedades nacionales que forman parte de la ESC suscribir, traducir e implementar las GPC de la ESC. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos se ven favorablemente influidos por la aplicación de las recomendaciones clínicas.
Se recomienda a los profesionales de la salud que tengan en consideración la presente guía de la ESC en la toma de decisiones clínicas en su ejercicio diario, así como en la determinación y la implementación de estrategias preventivas, diagnósticas y terapéuticas; no obstante, la decisión final sobre el cuidado de un paciente concreto, en consulta con dicho paciente y, si fuera necesario, con su representante legal, debe tomarla el médico responsable de su cuidado. Además, es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
2INTRODUCCIÓNLa fibrilación auricular (FA) implica una carga significativa para los pacientes, los médicos y los sistemas de salud en todo el mundo. Se dedican grandes esfuerzos y recursos para obtener información sobre los mecanismos subyacentes a la FA, su curso natural y los tratamientos efectivos (véase también ESC Textbook of Cardiovascular Medicine: CardioMed) y continuamente se genera y publica nueva evidencia científica.
La complejidad de la FA exige un abordaje multifacético, holístico y multidisciplinario de la atención de los pacientes, con su participación activa en colaboración con los médicos. Optimizar en la práctica clínica los cuidados de los pacientes con FA es un requisito difícil pero esencial para lograr un tratamiento efectivo. En los últimos años se han realizado progresos importantes en la detección de la FA y su tratamiento; toda la evidencia generada se ha integrado en la presente edición. En la edición de la guía de 2016 se introdujo el concepto de los 5 dominios que abarcaban una estrategia integral estructurada para la atención de la FA con el objetivo de promover el cumplimiento de las guías de práctica clínica y ofrecer tratamientos consistentes a todos los pacientes con FA. La estrategia Atrial Fibrillation Better Care, estrategia ABC, que se presenta en esta nueva edición, es una continuación de la anterior y tiene como objetivo avanzar en la atención médica estructurada de los pacientes con FA, promover los valores de los pacientes y, por último, lograr la mejoría de su estado de salud.
Como reflejo de la aportación multidisciplinaria para el diagnóstico y el tratamiento de los pacientes con FA y la interpretación de la nueva evidencia, el grupo de trabajo cuenta entre sus miembros con cardiólogos expertos en distintas subespecialidades, cirujanos cardiacos, especialistas en metodología y personal especializado de enfermería.
Además de seguir el procedimiento estándar para la generación de recomendaciones que son comunes a todas las guías de la ESC (véase el preámbulo), este grupo de trabajo discutió cada propuesta de recomendación en reuniones realizadas por internet, seguidas de un acuerdo de consenso y el voto de cada recomendación. Solo se incluyeron en la guía las recomendaciones que alcanzaron un apoyo de al menos el 75% de los miembros del grupo de trabajo.
2.1Qué novedad hay en la edición de 2020?Nuevas recomendaciones
| Recomendaciones | Clasea |
|---|---|
| Recomendaciones sobre el diagnóstico de la FA | |
| El ECG es imprescindible para establecer el diagnóstico de la FA | |
| El ECG estándar de 12 derivaciones o un trazado de ECG de una derivación ≥ 30 s que muestren un ritmo cardiaco con ondas P repetidas no discernibles e intervalos RR irregulares (siempre que no haya trastorno de la conducción auriculoventricular) es diagnóstico de FA | I |
| Recomendaciones para la caracterización estructurada de la FA | |
| Se debe considerar la caracterización estructurada de la FA, que incluye la evaluación del riesgo de ictus, el estado sintomático, la carga de la FA y la evaluación del sustrato para optimizar la evaluación de todos los pacientes con FA en distintos niveles de atención sanitaria, informar las decisiones sobre tratamiento y optimizar la atención de los pacientes con FA | IIa |
| Recomendaciones para la detección de la FA | |
| Durante el cribado de la FA se recomienda: | |
| • Informar a los individuos objeto de cribado sobre la importancia de la detección de la FA y sus implicaciones terapéuticas | |
| • Organizar una plataforma estructurada de referencia para los casos de cribado positivos para la posterior evaluación clínica y la confirmación del diagnóstico por personal médico y para proporcionar atención médica óptima a los pacientes con FA confirmada | |
| • El diagnóstico definitivo de FA en los casos de cribado positivos solo se establece cuando el médico revise el ECG de 12 derivaciones o de una derivación (≥ 30 s) y confirme la FA | I |
| Recomendaciones sobre la atención integral de la FA | |
| Se recomienda recoger regularmente los resultados referidos por los pacientes (RRP) para medir la eficacia del tratamiento y mejorar el cuidado de los pacientes | I |
| Recomendaciones para la prevención de eventos tromboembólicos en la FA | |
| Para la evaluación formal del riesgo hemorrágico, se debe considerar el uso de la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED, que puede ayudar a mejorar los factores de riesgo modificables e identificar a los pacientes con riesgo hemorrágico alto (puntuación INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED ≥ 3) para realizar revisiones clínicas y seguimiento más tempranos y frecuentes | IIa |
| Se recomienda revaluar el riesgo de ictus y sangrado a intervalos regulares para informar las decisiones sobre el tratamiento (p. ej., inicio de ACO en pacientes cuyo riesgo de ictus aumenta de bajo a moderado o alto) y tratar factores de riesgo hemorrágico potencialmente modificables | I |
| En pacientes con FA inicialmente con riesgo de ictus bajo, la primera revaluación del riesgo de ictus debe realizarse a los 4-6 meses de la evaluación índice | IIa |
| En ausencia de contraindicaciones absolutas a la ACO, el riesgo hemorrágico estimado no debe por sí solo guiar las decisiones sobre el uso de ACO para la prevención del ictus | III |
| El patrón clínico de la FA (diagnosticada por primera vez, paroxística, persistente, persistente de larga duración, permanente) no debe condicionar la indicación de tromboprofilaxis | III |
| Recomendaciones sobre la cardioversión | |
| La cardioversión farmacológica de la FA solo está indicada para pacientes hemodinámicamente estables tras considerar el riesgo tromboembólico | I |
| En pacientes con síndrome del seno enfermo, alteraciones de la conducción auriculoventricular o QTc prolongado (> 500 ms), no se debe intentar la cardioversión farmacológica, excepto cuando se haya valorado el riesgo de proarritmia y bradicardia | III |
| Recomendaciones para el control del ritmo y la ablación con catéter de la FA | |
| Recomendaciones generales | |
| Para tomar decisiones sobre la ablación con catéter de la FA, se recomienda considerar los riesgos del procedimiento y los principales factores de riesgo de recurrencia de la FA tras el procedimiento. Se debe discutir estos riesgos con el paciente | I |
| Se debe considerar el procedimiento repetido de AVP en pacientes con FA recurrente, siempre que los síntomas hayan mejorado después del procedimiento inicial | IIa |
| Ablación con catéter de la FA tras el fracaso del tratamiento farmacológico antiarrítmico | |
| La ablación con catéter de la FA por AVP debe considerarse para el control del ritmo cardiaco en caso de fracaso o intolerancia al tratamiento con BB para mejorar los síntomas de recurrencia en pacientes con FA paroxística o persistente | IIa |
| Tratamiento de primera línea | |
| La ablación con catéter de la FA por AVP debe/puede considerarse como primera línea de tratamiento para el control del ritmo cardiaco y mejorar los síntomas de pacientes seleccionados con: | |
| • Episodios sintomáticos de FA paroxística, o | IIa |
| • FA persistente sin factores importantes de riesgo de recurrencia de la FA como alternativa al tratamiento con fármacos antiarrítmicos de clase I o III, teniendo en cuenta la elección del paciente, los riesgos y los beneficios | IIb |
| Técnicas y tecnologías | |
| Puede considerarse la ablación de lesiones adicional a la AVP (áreas de bajo voltaje, lesiones lineales, actividad fragmentada, focos ectópicos y rotores, entre otros), aunque estas técnicas no están bien establecidas | IIb |
| Modificación del estilo de vida y otras estrategias para mejorar los resultados de la ablación | |
| Se recomienda el control estricto de los factores de riesgo y evitar los factores desencadenantes como parte de la estrategia para el control del ritmo cardiaco | I |
| Recomendaciones sobre el control del riesgo de ictus antes, durante y después de la cardioversión | |
| Se recomienda instruir a los pacientes sobre la importancia de la adherencia y persistencia del tratamiento con NACO tanto antes como después de la cardioversión | I |
| Para pacientes con FA de duración > 24 h sometidos a cardioversión, la anticoagulación terapéutica debe continuar durante al menos 4 semanas, incluso después del éxito de la cardioversión a ritmo sinusal; la decisión de mantener el tratamiento con ACO a largo plazo (más de 4 semanas) depende de la presencia de factores de riesgo de ictus | IIa |
| Para pacientes con una duración definitiva de la FA ≤ 24 h y riesgo muy bajo de ictus (CHA2DS2-VASc de 0 para varones o 1 para mujeres) puede omitirse la anticoagulación durante 4 semanas tras la cardioversión | IIb |
| Recomendaciones para el control del riesgo de ictus antes, durante y después de la ablación con catéter | |
| Para pacientes con factores de riesgo de ictus no tratados con ACO antes de la ablación se recomienda que el control de los factores de riesgo de ictus incluya el inicio de ACO preprocedimiento y: | |
| • Preferiblemente, tratamiento con ACO durante al menos las 3 semanas previas a la ablación, o | I |
| • Como alternativa, estudio con ETE para descartar trombos en la AI antes de la ablación | IIa |
| Para pacientes programados para ablación con catéter de la FA que han recibido anticoagulación terapéutica con warfarina, dabigatrán, rivaroxabán, apixabán o edoxabán, se recomienda realizar el procedimiento de ablación sin interrumpir la ACO | I |
| Recomendaciones sobre el tratamiento a largo plazo con fármacos antiarrítmicos | |
| Para pacientes tratados con sotalol se recomienda la monitorización estricta del intervalo QT, concentraciones de potasio sérico, AclCr y otros factores de riesgo de proarritmia | I |
| Para pacientes tratados con flecainida para el control a largo plazo del ritmo cardiaco, debe considerarse un bloqueador del nódulo auriculoventricular, siempre que se tolere | IIa |
| Puede considerarse el sotalol para el control a largo plazo del ritmo cardiaco de pacientes con función del VI normal o con cardiopatía isquémica, siempre que puedan monitorizarse estrictamente el intervalo QT, las concentraciones séricas de potasio, el AclCr y otros factores de riesgo de proarritmia | IIb |
| Recomendaciones sobre las intervenciones en el estilo de vida y el tratamiento de los factores de riesgo y las enfermedades concomitantes a la FA | |
| Se recomienda identificar y tratar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento de los pacientes con FA | I |
| Se recomienda la modificación de los estilos de vida poco saludables y el tratamiento de las enfermedades concomitantes para reducir la carga de la FA y la gravedad de los síntomas | I |
| Se recomienda el cribado oportunista de la FA en pacientes hipertensos | I |
| Se recomienda el cribado oportunista de la FA con apnea obstructiva del sueño | IIa |
| Recomendaciones para pacientes con FA y SCA, ICP o SCC | |
| Recomendaciones para pacientes con FA y SCA | |
| Para pacientes con FA y SCA sometidos a una ICP sin complicaciones, se recomienda la suspensión temprana (1 semana o menos) del AAS y la continuación del tratamiento antiagregante plaquetario doble con un ACO y un inhibidor del P2Y12 (preferiblemente clopidogrel) hasta 12 meses, si el riesgo de trombosis del stent es bajo o se estima que el riesgo hemorrágico es superior al riesgo de trombosis del stent, independientemente del tipo de stent implantado | I |
| Recomendaciones para pacientes con FA y SCC sometidos a ICP | |
| Tras una ICP sin complicaciones, se recomienda la suspensión temprana (1 semana o menos) del AAS y la continuación del tratamiento antiagregante plaquetario doble con un ACO y clopidogrel hasta 6 meses si el riesgo de trombosis del stent es bajo o se estima que el riesgo hemorrágico es superior al riesgo de trombosis del stent, independientemente del tipo de stent implantado | I |
| Recomendaciones sobre el tratamiento de las hemorragias activas en pacientes que toman ACO | |
| Se debe considerar la administración de concentrados de complejo de protrombina de 4 factores a pacientes con FA que toman AVK y sufren una complicación hemorrágica grave | IIa |
| Recomendaciones sobre el tratamiento de la FA durante la gestación | |
| Tratamiento agudo | |
| Para las embarazadas con MCH, se debe considerar la cardioversión en caso de FA persistente | IIa |
| Se debe considerar la administración i.v. de ibutilida o flecainida para la terminación de la FA de pacientes estables sin cardiopatía estructural | IIb |
| Tratamiento a largo plazo (tratamiento farmacológico oral) | |
| Se debe considerar el uso de flecainida, propafenona o sotalol para prevenir la FA si el tratamiento con bloqueadores del nódulo auriculoventricular no es efectivo | IIa |
| Se debe considerar el uso de digoxina o verapamilo para el control de la frecuencia cardiaca cuando fracase el tratamiento con BB | IIa |
| Recomendaciones sobre la FA posoperatoria | |
| Se debe considerar el tratamiento anticoagulante oral a largo plazo para prevenir eventos tromboembólicos en pacientes con riesgo de ictus y FA posoperatoria tras cirugía no cardiaca, valorando el beneficio clínico neto estimado del tratamiento con ACO y las preferencias del paciente informado | IIa |
| No se debe usar sistemáticamente BB para la prevención de la FA posoperatoria en pacientes sometidos a cirugía no cardiaca | III |
| Recomendaciones relativas a las diferencias de sexo en la FA | |
| Las mujeres con FA sintomática paroxística o persistente deben tener acceso sin demora a tratamientos para el control del ritmo cardiaco, incluida la ablación con catéter de la FA, siempre que haya razones médicas | IIa |
| Recomendaciones sobre medidas de calidad en la FA | |
| Los profesionales médicos y las instituciones deben considerar la introducción de instrumentos para medir la calidad de la atención sanitaria e identificar oportunidades para mejorar la calidad y los resultados de los tratamientos de los pacientes con FA | IIa |
AAS: ácido acetilsalicílico; AclCr: aclaramiento de creatinina; ACO: anticoagulantes orales; AI: aurícula izquierda; AVK: antagonistas de la vitamina K; AVP: aislamiento de vena pulmonar; BB: bloqueadores beta; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); ECG: electrocardiograma; ETE: ecocardiografía transesofágica; FA: fibrilación auricular; INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED: hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol; i.v.: intravenoso; ICP: intervención coronaria percutánea; MCH: miocardiopatía hipertrófica; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; QTc: intervalo QT corregido; RRP: resultado referido por el paciente; SCA: síndrome coronario agudo; SCC: síndrome coronario crónico.
Cambios en las recomendaciones
| Recomendaciones sobre el abordaje integral de la FA | |||
|---|---|---|---|
| 2020 | Clasea | 2016 | Clasea |
| Para optimizar la toma compartida de decisiones sobre opciones específicas para el tratamiento de la FA, se recomienda: | |||
| • Informar al paciente sobre las ventajas/limitaciones y riesgos/beneficios asociados con las opciones de tratamiento que se están valorando y | |||
| • Discutir con el paciente la carga potencial del tratamiento e incluir la percepción del paciente sobre ello en la toma de decisiones | I | Se debe considerar que el paciente adopte un papel central en la toma de decisiones para adaptar el tratamiento a las preferencias del paciente y mejorar la adherencia al tratamiento a largo plazo | IIa |
| Recomendaciones para la prevención de eventos tromboembólicos en la FA | |||
| Se recomienda una evaluación estructurada del riesgo hemorrágico mediante una escala formal de riesgo para identificar los factores de riesgo hemorrágico modificables y no modificables en todos los pacientes con FA e identificar a los pacientes con un riesgo potencialmente alto para planificar con prontitud y mayor frecuencia las revisiones clínicas y el seguimiento | I | Se debe considerar el uso de escalas de riesgo hemorrágico para los pacientes con FA que toman anticoagulación oral para identificar los factores de riesgo de sangrado mayor modificables | IIa |
| Para pacientes tratados con AVK y con un tiempo en rango terapéutico corto (p. ej., TRT < 70%) las opciones recomendadas son: | |||
| • Cambiar a un NACO, siempre que se asegure una buena adherencia y la continuidad del tratamiento o | I | Para pacientes con FA, se puede considerar el cambio de AVK a NACO cuando no se controle adecuadamente el TRT a pesar de una buena adherencia al tratamiento y teniendo en cuenta las preferencias del paciente, siempre que no haya contraindicaciones (p. ej., válvula protésica) | IIb |
| • Esforzarse enmejorar el TRT (p. ej., instrucción/asesoramiento del paciente, controles de la INR más frecuentes) | IIa | ||
| Recomendaciones para el control del ritmo cardiaco/ablación con catéter de la FA | |||
| Ablación con catéter tras el fracaso del tratamiento farmacológico | |||
| Se recomienda la ablación con catéter de las venas pulmonares para el control del ritmo cardiaco en caso de fracaso o intolerancia al tratamiento con FAA de clase I o III para mejorar los síntomas de recurrencia de los pacientes con: | |||
| • FA paroxística o | |||
| • FA persistente sin factores de riesgo de recurrencia de la FA importantes o | |||
| • FA persistente con factores de riesgo de recurrencia de la FA importantes | I | Se debe considerar la ablación con catéter o quirúrgica para pacientes con FA sintomática persistente o persistente de larga duración refractaria a tratamiento con FAA para mejorar la carga sintomática, teniendo en cuenta las preferencias del paciente y la opinión de un equipo cardiológico de FA | IIa |
| Tratamiento de primera línea | |||
| Ablación con catéter de la FA: | |||
| • Se recomienda revertir la disfunción del VI de los pacientes con FA cuando haya un riesgo alto de miocardiopatía inducida por taquicardia, independientemente de su estado sintomático | I | Se debe considerar la ablación para algunos pacientes sintomáticos con FA e IC-FEr para mejorar los síntomas y la función cardiaca cuando se sospeche taquimiocardiopatía | IIa |
| • Se debe considerar la ablación para algunos pacientes con FA e IC-FEr para mejorar la supervivencia y reducir la hospitalización por IC | IIa | ||
| Técnicas y tecnologías | |||
| Se recomienda el aislamiento eléctrico completo de venas pulmonares durante los procedimientos de ablación con catéter de la FA | I | La ablación con catéter debe aislar las venas pulmonares y se puede realizar con radiofrecuencia o criobalón | IIa |
| En pacientes con historia de flutter auricular dependiente del ITC o si la ablación de la FA induce flutter auricular típico, se puede considerar la ablación del ITC | IIb | Durante un procedimiento de ablación de la FA, se debe considerar la ablación del flutter auricular común para prevenir su recurrencia si está documentado u ocurre durante el procedimiento de ablación de la FA | IIa |
| Cambios en el estilo de vida y otras estrategias para mejorar los resultados de la ablación | |||
| Para pacientes obesos con FA, se recomienda la pérdida de peso, especialmente en el caso de pacientes evaluados para ablación de la FA | I | Para pacientes obesos con FA, se debe considerar la pérdida de peso junto con el control de otros factores de riesgo para reducir la carga y los síntomas de FA | IIa |
| Recomendaciones para el control del riesgo de ictus antes, durante y después de la cardioversión | |||
| Para pacientes con FA sometidos a cardioversión, se recomienda la administración de un NACO con un perfil de eficacia y seguridad al menos similar al de la warfarina | I | Se debe instaurar lo antes posible tratamiento anticoagulante con heparina o un NACO antes de la cardioversión de la FA o el flutter auricular | IIa |
| Recomendaciones para el control del riesgo de ictus antes, durante y después de la ablación con catéter | |||
| Tras la ablación con catéter de la FA se recomienda: | |||
| • Mantener la anticoagulación sistémica con warfarina o un NACO durante al menos 2 meses tras la ablación, y | |||
| • La decisión de mantener o suspender el tratamiento anticoagulante durante más de 2 meses tras la ablación debe estar basada en el perfil de riesgo de ictus del paciente y no en el éxito o el fracaso aparente del procedimiento de ablación | I | Todos los pacientes deben recibir tratamiento anticoagulante oral durante al menos 8 semanas tras la ablación con catéter | IIa |
| Recomendaciones sobre el uso a largo plazo de fármacos antiarrítmicos | |||
| Se recomienda la administración de amiodarona a todos los pacientes con FA, incluidos aquellos con IC-FEr, para el control del ritmo cardiaco a largo plazo. No obstante, dada su toxicidad extracardiaca, se debe considerar primero el uso de otros FAA siempre que sea posible | I | La amiodarona es más efectiva para prevenir la recurrencia de la FA que otros FAA, pero su efecto tóxico extracardiaco es frecuente y aumenta con el tiempo. Por ello, se debe considerar primero el uso de otros FAA | IIa |
| Recomendaciones sobre intervenciones en el estilo de vida y control de los factores de riesgo y enfermedades concomitantes de los pacientes con FA | |||
| Se recomienda un buen control de la PA de todos los pacientes con FA e hipertensión para reducir las recurrencias de la FA y los riesgos de ictus y sangrado | I | Se debe considerar el control de la PA en pacientes con hipertensión que reciben tratamiento anticoagulante para reducir el riesgo de sangrado | IIa |
| Se debe considerar la actividad física para ayudar a prevenir la incidencia o recurrencia de la FA, a excepción del ejercicio excesivamente intenso, ya que podría desencadenar episodios de FA | IIa | Se recomienda la actividad física regular de intensidad moderada para prevenir la FA. Se debe asesorar a los atletas acerca de que la práctica prolongada de deportes intensos puede favorecer la aparición de FA | I |
| Se puede considerar el tratamiento óptimo de la AOS para reducir la incidencia de FA, su progresión, sus recurrencias y sus síntomas | IIb | Se debe optimizar el tratamiento de la AOS para reducir las recurrencias de la FA y mejorar los resultados del tratamiento de la FA | IIa |
| Recomendaciones para la prevención del ictus en pacientes con FA tras HIC | |||
| Para pacientes con FA y riesgo alto de ictus isquémico, se debe considerar la (re)instauración de tratamiento anticoagulante, preferiblemente con un NACO en lugar de un AVK siempre que el paciente sea apto para los NACO y en consulta con un neurólogo/especialista en ictus, después de: | |||
| • HIC relacionada con traumatismo | |||
| • HIC espontánea aguda (que incluye hemorragia subdural, subaracnoidea o intracerebral), tras considerar detenidamente los riesgos y los beneficios | IIa | Tras una HIC en pacientes con FA, se puede reiniciar la anticoagulación oral después de 4-8 semanas siempre que la causa del sangrado o el factor de riesgo relevante se hayan tratado o controlado | IIb |
| Recomendaciones sobre la FA posoperatoria | |||
| Se puede considerar la administración de ACO a largo plazo para prevenir eventos tromboembólicos en pacientes con riesgo de ictus y FA posoperatoria tras cirugía cardiaca, teniendo en cuenta el beneficio clínico neto estimado de los ACO y las preferencias del paciente informado | IIb | Se debe considerar la administración de ACO a largo plazo en pacientes con FA tras cirugía cardiaca y riesgo de ictus, teniendo en cuenta el riesgo individual de ictus y sangrado | IIa |
ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; AVP: aislamiento de vena pulmonar; FA: fibrilación auricular; FAA: fármacos antiarrítmicos; FEVI: fracción de eyección del ventrículo izquierdo; HIC: hemorragia intracraneal; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; ICT: istmo cavotricuspídeo; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PA: presión arterial; TRT: tiempo en rango terapéutico; VI: ventrículo izquierdo.
Definición de la FA.
| Definición | |
|---|---|
| FA | Taquiarritmia supraventricular con activación eléctrica auricular descoordinada y consecuentemente contracción auricular ineficienteCaracterísticas electrocardiográficas de la FA:• Intervalos R-R completamente irregulares (cuando la conducción auriculoventricular no está afectada)• Ausencia de ondas P identificables y repetidas, y• Activación auricular irregular |
| Términos usados actualmente | |
| FA clínica | FA sintomática o asintomática documentada por ECG de superficieEl registro de ECG mínimo requerido para establecer el diagnóstico de FA clínica es ≥ 30 s o el trazado completo del ECG de 12 derivaciones1,2 |
| AHRE, FA subclínica | Se refiere a individuos sin síntomas atribuibles a FA, cuya FA clínica NO se ha detectado previamente (es decir, no hay trazado de ECG de superficie de FA); véase también la sección 3.3AHRE: episodios que cumplen los criterios programados o preespecificados de AHRE, detectados por un dispositivo implantado con un electrodo auricular que permite monitorizar de forma automática y continua el ritmo auricular y almacenar los trazados. Es necesario inspeccionar visualmente estos trazados de AHRE, ya que algunos pueden ser artefactos eléctricos o falsos positivosFA subclínica: incluye AHRE confirmado como FA, flutter auricular o taquicardia auricular o episodios de FA detectados por un dispositivo cardiaco insertado o portátil y confirmados por la inspección visual de los electrocardiogramas intracardiacos o los registros de ritmo en el ECG |
| El criterio de frecuencia cardiaca programado para la detección de AHRE es ≥ 175 lpm, mientras que no hay un límite específico para la FA subclínicaEl criterio para la duración de los AHRE se suele programar en ≥ 5 min (para evitar la inclusión de artefactos), mientras que en estudios sobre la asociación entre la FA subclínica y la tromboembolia se aplica una amplia gama de puntos de corte para la duración de la FA (desde 10-20 s hasta > 24 h). La duración reportada se refiere al episodio único de mayor duración o, más frecuentemente, la duración total del AHRE/FA subclínica durante el periodo de monitorización especificadoAunque no son completamente idénticos, los términos AHRE y FA subclínica se usan indistintamente a menudo; por cuestiones prácticas, en este documento se emplea el término combinado AHRE/FA subclínica3–5. Mientras que la evidencia obtenida en ECA sobre el tratamiento de la FA es abundante y rigurosa, esta se refiere exclusivamente a los pacientes con FA «clínica» (la FA documentada en el ECG era un criterio de inclusión obligatorio); sin embargo, los datos sobre el tratamiento óptimo de los AHRE y la FA subclínica son muy escasos. Por esta razón, actualmente la FA se describe como «FA clínica» o como «AHRE/FA subclínica» hasta que se disponga de los resultados de varios ECA en curso sobre el tratamiento de estas dos entidades |
AHRE: episodios de frecuencia auricular rápida; ECG: electrocardiograma; ECA: ensayo controlado y aleatorizado; FA: fibrilación auricular.
Para el diagnóstico de FA, es preciso documentar el ritmo cardiaco con un ECG que confirme la presencia de FA. Por convención, un episodio de duración ≥ 30 s confirma el diagnóstico de FA clínica6.
Recomendaciones para el diagnóstico de FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se requiere documentación electrocardiográfica (ECG) para establecer el diagnóstico de FA | ||
| • Un ECG estándar de 12 derivaciones o un trazado de ECG de 1 derivación ≥ 30 s que muestren un ritmo cardiaco con ondas P repetidas no discernibles e intervalos RR irregulares (siempre que no haya trastorno de la conducción auriculoventricular) son diagnósticos de FA clínica6 | I | B |
ECG: electrocardiograma; FA: fibrilación auricular.
Existen varios dispositivos implantables y monitores portátiles que permiten detectar episodios de frecuencia auricular rápida (AHRE)/FA subclínica (figura 1)3. Debido a su corta monitorización, es menos probable que el ECG externo detecte estas entidades7.
Diagnóstico de AHRE/FA subclínica. Un DECI con un electrodo auricular permite monitorizar el ritmo auricular y almacenar los trazados. Los MCI no tienen electrodos intracardiacos, pero monitorizan continuamente la actividad eléctrica cardiaca mediante el registro y el análisis de un ECG de superficie bipolar de 1 derivación aplicando un logaritmo específico. Imagen inferior izquierda: marcapasos con un electrodo en la aurícula derecha y en la región apical del ventrículo derecho; además de la estimulación eléctrica de ambas zonas, estos electrodos pueden detectar la actividad en las cámaras correspondientes; el dispositivo también puede detectar eventos programados previamente, como los AHRE. Imagen inferior derecha: MCI subcutáneo; estos dispositivos no tienen electrodos intracardiacos y fundamentalmente registran el ECG de superficie, bipolar y de una derivación, y disponen de algoritmos integrados para la detección de AHRE o FA. AHRE: episodios de frecuencia auricular rápida; DAI: desfibrilador automático implantable; DECI: dispositivo electrónico cardiaco implantable; ECA: ensayo controlado aleatorizado; ECG: electrocardiograma; FA: fibrilación auricular; MCI: monitor cardiaco insertable.
Cuando se detecte AHRE/FA subclínica mediante dispositivos implantables o portátiles, se recomienda revisar los registros electrocardiográficos o tiras de ritmo de ECG para descartar la presencia de artefactos u otras causas de detección inapropiada8,9.
4EpidemiologíaEn todo el mundo la FA es la arritmia cardiaca sostenida más frecuente en adultos10 (figura 2, panel superior). La FA se asocia con una morbimortalidad signific ativa, lo cual implica una carga importante tanto para los pacientes como para la salud y la economía de la sociedad (figura 2, panel inferior, y sección 1 del material adicional).
Epidemiología de la FA: prevalencia (panel superior)10–20; riesgo a lo largo de la vida e incremento proyectado de la incidencia y la prevalencia (panel inferior)21–34. IC95%: intervalo de confianza del 95%; FA: fibrilación auricular; PA: presión arterial; UE: Unión Europea.
aTabaquismo, consumo de alcohol, índice de masa corporal, diabetes mellitus (tipos 1 o 2) y antecedente de infarto de miocardio o insuficiencia cardiaca.
bPerfil de riesgo: óptimo (todos los factores de riesgo son negativos o están dentro de la normalidad; limítrofe (sin factores de riesgo elevados pero con más de 1 factor de riesgo en el límite); elevado (más de 1 factor de riesgo importante).
Actualmente, la prevalencia estimada de la FA en adultos es de un 2−4%10 y se anticipa que aumente 2,3 veces11,12,13 debido a la mayor longevidad de la población general y la intensificación de la búsqueda de FA no diagnosticada15.
El envejecimiento es un riesgo sustancial de FA, pero también es importante el aumento de la carga de otras comorbilidades, como la hipertensión, la diabetes mellitus, la insuficiencia cardiaca (IC), la enfermedad coronaria (EC), la enfermedad renal crónica (ERC)21, la obesidad y la apnea obstructiva del sueño (AOS)22–26; los factores de riesgo modificables contribuyen significativamente a la aparición y la progresión de la FA27,28 (figura 3). Las tasas de incidencia, prevalencia y riesgo a lo largo de la vida de la FA ajustadas por edad son menores en mujeres que en varones y en cohortes no caucásicas frente a cohortes caucásicas10,14–20. El riesgo de FA a lo largo de la vida se había estimado en 1 de cada 4 individuos29,30, pero en una revisión reciente se ha estimado en 1 de cada 3 individuos de origen europeo a una edad índice de 55 años31,32. El riesgo de FA a lo largo de la vida depende de la edad y factores genéticos y clínicos o subclínicos10,33,34. El impacto observado de la carga de factores clínicos de riesgo y las múltiples comorbilidades en el riesgo de FA (figura 3, panel inferior)31 indica que una intervención temprana y el control de los factores de riesgo modificables podrían reducir la incidencia de FA.
Resumen de los factores de riesgo para la aparición de FA10,22,33,35–72 (véase la lista completa en la tabla 1 del material adicional). EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular.
La identificación de individuos con mayor riesgo de contraer FA podría facilitar la implementación de intervenciones preventivas y programas de cribado para la detección temprana de la FA, por ejemplo en subgrupos con riesgo alto como los pacientes con antecedente de ictus73. Se han propuesto distintas escalas para la predicción de la FA de nueva aparición (tabla 2 del material adicional), pero ninguna de ellas se ha generalizado en la práctica clínica.
4.2Fisiopatología de la fibrilación auricularLa figura 1 del material adicional ilustra la compleja interacción entre factores desencadenantes, factores de perpetuación y desarrollo de sustratos que favorecen la aparición de FA.
5Características clínicas de la fibrilación auricularLa presentación clínica de la FA y los resultados relacionados con ella se muestran en lafigura 4 (véase también la sección 2 y el cuadro 1 del material adicional).
Presentación clínica de la FA y resultados relacionados con la FA10,31,74–140. CdV: calidad de vida; FA: fibrilación auricular; HR: hazard ratio; IC: insuficiencia cardiaca; IM: infarto de miocardio; VI: ventrículo izquierdo.
Los pacientes con FA pueden presentar distintos síntomas92,108,109,128,131, pero un 50-87% están asintomáticos al principio75,82,88,111,117,120,125,127, con un pronóstico posiblemente menos favorable79,82,87,88,117,119,127,134,139. Los síntomas de FA de nueva aparición están menos estudiados92,105,108,109,127 y pueden cambiar con el tratamiento119, y las recurrencias de la FA suelen ser asintomáticas113.
Ictus/embolia sistólica: el riesgo anual de ictus relacionado con FA depende de las comorbilidades78,84,85,91,106,112. El ictus cardioembólico asociado con la FA generalmente es grave, muy recurrente y a menudo es mortal o produce discapacidad permanente10,83,115. En un registro poblacional, los pacientes con FA de nueva aparición también tuvieron tasas más altas de embolia sistémica89.
Disfunción del ventrículo izquierdo e insuficiencia cardiaca: múltiples mecanismos o alteraciones miocárdicas pueden llevar a la disfunción del VI102,138, lo cual se asocia con altas prevalencia e incidencia de IC en pacientes con FA. Al compartir factores de riesgo comunes, la FA y la IC normalmente coexisten o pueden precipitarse/exacerbarse la una a la otra, lo cual resulta en una mortalidad significativamente mayor que la de cada una de estas enfermedades por separado140.
Hospitalización: aproximadamente el 30% de los pacientes con FA ingresan en el hospital como mínimo 1 vez al año y el 10%, al menos 2 veces99,110,129, lo cual representa el doble de probabilidades de hospitalización que para la población sin FA ajustada por edad y sexo (el 37,5 frente al 17,5% respectivamente)98. En una cohorte nacional, la FA fue la causa principal de hospitalización del 14% de los pacientes hospitalizados, pero su tasa de mortalidad hospitalaria fue < 1%101. Las causas más comunes para la hospitalización de los pacientes con FA fueron alteraciones cardiovasculares (49%), causas no cardiovasculares (43%) y hemorragias (8%)129.
Calidad de vida y estado funcional: más del 60% de los pacientes con FA tienen un deterioro significativo de la CdV y de la tolerancia al ejercicio81,88,136, pero solo el 17% sufre síntomas discapacitantes88. La CdV es significativamente peor para las mujeres81,107,114,124, los jóvenes y los pacientes con comorbilidades118. La carga de la FA100 también puede afectar a la CdV, pero solo la función psicológica fue predictiva de los síntomas y la CdV136. Los pacientes con FA mostraron más frecuentemente trastornos de ansiedad126 y tuvieron mayor carga de síntomas depresivos123 y peor CdV, con trastornos de la personalidad de tipo D103. La identificación de los síntomas clave y los condicionantes de la CdV es importante para establecer el tratamiento óptimo de la FA. Es importante también confirmar que los síntomas están relacionados con la FA o, en su ausencia, excluir la adaptación subconsciente a la vida con una capacidad física reducida preguntando a los pacientes si sienten falta de aire o fatiga de esfuerzo y documentando posibles mejorías tras la cardioversión.
Deterioro cognitivo/demencia: la FA puede producir deterioro cognitivo, que abarca desde la disfunción leve a la demencia97,104,141, causado por ictus asintomático o clínicamente aparente u otras causas independientes del ictus no bien comprendidas94,96,97,122. Varios estudios de resonancia magnética (RM) mostraron que la FA se asocia con el doble de riesgo de isquemia cerebral asintomática90,121,142. En un reciente documento de consenso de expertos se han resumido los datos disponibles86.
Mortalidad: la FA se asocia independientemente con el doble de riesgo de muerte por todas las causas en mujeres y un aumento de 1,5 veces en varones77,80,130,137, con un aumento total de 3,5 veces del riesgo de muerte31. Si bien la explicación mecanicista de esta asociación tiene múltiples facetas, las comorbilidades asociadas tienen un papel muy importante95. En un estudio reciente, las causas de muerte más comunes para pacientes con FA fueron la IC (14,5%), neoplasias malignas (23,1%) e infección /sepsis (17,3%), mientras que la mortalidad relacionada con el ictus fue de tan solo el 6,5%76. Estos datos y otros más recientes indican que, además de la anticoagulación y el tratamiento de la IC, es necesario tratar activamente otras comorbilidades asociadas en un esfuerzo para reducir la mortalidad relacionada con la FA77,93,116,1.
Se han propuesto diferentes clasificaciones de la FA, pero tradicionalmente se distinguen 5 patrones basados en la presentación, la duración y la resolución espontánea de los episodios de FA (tabla 4)143.
Clasificación de la FA.
| Patrón de FA | Definición |
|---|---|
| FA diagnosticada por primera vez | La FA no ha sido diagnosticada antes, independientemente de la duración de la arritmia o la presencia y la gravedad de los síntomas relacionados con ella |
| FA paroxística | La FA se revierte espontáneamente o con una intervención en los primeros 7 días |
| FA persistente | La FA se mantiene durante más de 7 días, incluidos los episodios que se terminan por cardioversión farmacológica o eléctrica tras más de 7 días |
| FA persistente de larga duración | FA continua más de 1 año tras adoptar una estrategia para el control del ritmo cardiaco |
| FA permanente | El paciente y el médico asumen la FA y no se adoptan nuevas medidas para restaurar o mantener el ritmo sinusal. La FA permanente representa más una actitud terapéutica del paciente y el médico que un atributo fisiopatológico inherente a la FA. Este término no debe emplearse en el contexto de una estrategia para el control del ritmo con fármacos antiarrítmicos o ablación con catéter. En caso de aplicarse medidas para el control del ritmo, la arritmia se reclasificaría como «FA persistente de larga duración» |
| Terminología que no se debe emplear | |
| FA aislada | Los avances en el conocimiento de la fisiopatología de la FA muestran que en cada paciente existe una causa para la FA. Por lo tanto, este término histórico puede producir confusión y no se debe emplear147 |
| FA valvular/no valvular | Diferencia a los pacientes con estenosis mitral moderada/grave o válvulas cardiacas mecánicas de otros pacientes con FA, pero puede ser confuso148 y no se debe emplear |
| FA crónica | Tiene varias definiciones y no se debe emplear para describir a poblaciones de pacientes con FA |
FA: fibrilación auricular.
Para los pacientes que sufren episodios de FA paroxística y persistente, se debe usar el patrón más común para su clasificación. No obstante, los patrones de FA definidos clínicamente no se corresponden bien con la carga de la FA monitorizada con ECG a largo plazo144–146.
Otras clasificaciones de la FA reflejan la presencia de síntomas (la FA asintomática se diagnostica con un oportuno ECG de 12 derivaciones o tira de ritmo en pacientes asintomáticos) o una causa subyacente para la FA (p. ej., FA posoperatoria; véase la sección 11.19). La clasificación de la FA basada en factores desencadenantes subyacentes podría aportar información para el tratamiento, pero no hay evidencia que respalde la utilidad clínica de esta clasificación (tabla 3 del material adicional). En la tabla 4 se encuentra la lista de términos que no se debe emplear para describir la FA.
Las recomendaciones sobre el tratamiento de la FA no se basan en los patrones temporales de la FA, excepto cuando se trata de restaurar el ritmo sinusal143,149,150. Es muy poco probable que se proponga una clasificación simple pero integral de la FA, dados los múltiples factores que influyen en su tratamiento, los avances en la monitorización de la FA, la variedad de instrumentos de evaluación del riesgo, la evolución de los tratamientos y la complejidad de la FA en sí misma. De hecho, recientemente se ha propuesto un cambio de paradigma en el que se sustituye la clasificación de la FA por una caracterización estructurada en la que se examinan áreas específicas que tienen implicaciones en el tratamiento y el pronóstico151. Este esquema de actuación podría mejorar la evaluación de los pacientes con FA en todos los niveles de atención sanitaria, facilitar la comunicación entre los facultativos y la toma de decisiones sobre el tratamiento, con lo que se optimiza el tratamiento de los pacientes con FA, por lo que debería convertirse en el estándar de actuación clínica cuando se informa sobre un caso de FA.
El esquema 4S-AF (del inglés Stroke risk, Symptom severity, Severity of AF burden, Substrate severity: riesgo de ictus y gravedad de los síntomas, de la carga y del sustrato) incluye 4 áreas relacionadas con la FA (figura 5)151. Los actuales instrumentos de evaluación o clasificación de áreas específicas relativas a la FA (p. ej., escalas de riesgo de ictus, escalas de síntomas, factores clínicos, modalidades de imagen, etc.) se pueden integrar fácilmente, pero el esquema 4S-AF tiene todavía un gran potencial para futuras mejoras basadas en avances tecnológicos y en el hecho de que los descriptores más adecuados de las áreas relacionadas con la FA aún están por definir. Gracias a los descriptores de FA incluidos en el esquema, la caracterización estructurada de pacientes con FA mediante el esquema 4S-AF también puede proporcionar información pronóstica, aunque es necesario validar ampliamente su utilidad clínica y su valor pronóstico en diferentes cohortes de pacientes con FA y distintos contextos clínicos.
Esquema 4S-AF: un ejemplo de caracterización estructurada de la FA (del inglés stroke risk, symptom severity, severity of AF burden, substrate severity). AI: aurícula izquierda; CdV: calidad de vida; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65–74 años y sexo (mujer); EHRA: European Heart Rhythm Association; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; RM: resonancia magnética; TC: tomografía computarizada.
Recomendaciones para la caracterización estructurada de la FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la caracterización estructurada de la FA mediante la evaluación del riesgo de ictus, el estado sintomático, la carga de la FA y la evaluación del sustrato para optimizar la evaluación de todos los pacientes con FA en distintos niveles de atención sanitaria, informar las decisiones sobre tratamiento y optimizar la atención de los pacientes con FA151 | IIa | C |
FA: fibrilación auricular.
El término «carga» se refiere a varios aspectos de la FA (p. ej., aspectos epidemiológicos, económicos, etc.)144. En relación con la monitorización continua basada en dispositivos, la «carga de FA» se define como el tiempo total de AHRE/FA subclínica durante un periodo específico de monitorización (p. ej., 1 día). Tanto el tiempo en FA como el periodo de monitorización se deben documentar al informar sobre la carga de FA (la mayoría de los estudios comunican el tiempo máximo en FA durante un periodo de 24 h), aunque de momento no se ha determinado cuáles son las mediciones más adecuadas152. El término «carga de FA» es diferente de «carga asociada con la FA», ya que esta se refiere a las consecuencias de la FA.
La carga clínica de la FA se determina normalmente por el patrón temporal de la FA146 (tabla 4) y la monitorización mediante ECG intermitente153, pero ninguno de los dos se corresponde bien con la monitorización electrocardiográfica a largo plazo. La relación entre la carga clínica de la FA y resultados específicos no está bien establecida154, pero podría asociarse con un mayor riesgo de incidencia de IC155 y mortalidad por todas las causas156, mientras que la asociación con la calidad de vida (CdV) es compleja y los datos sobre deterioro cognitivo o demencia son insuficientes86. Datos de ECA recientes coinciden en mostrar un riesgo tromboembólico residual significativamente más bajo en los pacientes anticoagulados con FA paroxística, comparada con FA persistente156–159, mientras que los datos de ECA160 y estudios observacionales161,162 realizados antes son contradictorios. Entre los pacientes que no recibían anticoagulación, el riesgo de ictus fue más bajo en la FA paroxística que en la FA no paroxística156, y una mayor carga total de FA (pero no el episodio de FA más largo) se asoció de manera independiente con tasas más altas de complicaciones tromboembólicas163. La carga clínica de la FA puede influir en la respuesta al tratamiento para el control del ritmo cardiaco164,165. La presencia de FA durante más de 6 h a la semana (especialmente si aumenta a más de 24 h semanales) se asoció con un aumento de la mortalidad, especialmente entre las mujeres166.
La evidencia disponible sobre la asociación entre la carga de la FA y los resultados relacionados con ella no son suficientes para guiar el tratamiento y no deben ser un factor importante a la hora de tomar decisiones médicas. El abordaje integral de todos los factores de riesgo cardiovascular modificables y las comorbilidades reduce la carga de la FA (sección 10.3).
6.3Progresión de la fibrilación auricularLa transición de FA paroxística a FA no paroxística (o de FA subclínica a FA clínica)154,167–169 se caracteriza generalmente por el avance del remodelado estructural auricular o el empeoramiento de la miocardiopatía auricular170,171.
La evaluación de la progresión de la FA depende de la duración de la monitorización del ritmo y del sustrato172,173. Las tasas anuales de la progresión de la FA paroxística publicadas varían de < 1% al 15% (hasta el 27-36% en estudios con seguimiento ≥ 10 años)169,174. Entre los factores de riesgo de progresión de la FA se incluyen la edad, la insuficiencia cardiaca, la hipertensión, la ERC, las enfermedades pulmonares crónicas, la diabetes mellitus, el antecedente de ictus y las dimensiones de la aurícula izquierda (AI)167, mientras que el valor predictivo añadido de biomarcadores no está claramente definido. La edad avanzada se asocia con FA permanente82,117,154 y otros factores desencadenantes también pueden tener algún papel, con distintos patrones de progresión que resultan de su interacción con el remodelado del sustrato171. La progresión a FA persistente o permanente se asocia con eventos cardiovasculares adversos, hospitalizaciones y muerte166, pero no está claro si la progresión de la FA es un factor determinante de un pronóstico adverso o si es un marcador de la progresión de una enfermedad o un sustrato175,176. El impacto real de diferentes intervenciones terapéuticas en diferentes momentos de la progresión de la FA y los resultados asociados con ellas tampoco están bien definidos.
6.4Miocardiopatía auricular: definición, clasificación, implicaciones clínicas y evaluación diagnósticaProgresos importantes en el conocimiento de los mecanismos y la trombogenicidad de la FA obligan a reconsiderar el papel de la miocardiopatía auricular (es decir, cambios en la estructura, la arquitectura, la contractilidad y la electrofisiología de la aurícula que tienen manifestaciones clínicas potencialmente relevantes)170.
La clasificación clínica de la miocardiopatía auricular debe basarse en la estructura, la morfología y la función eléctrica y mecánica de la aurícula, y su diagnóstico se podría realizar con base en parámetros fácilmente disponibles (p. ej., la etiología, el estado protrombótico177 y las alteraciones del volumen y la función de la AI)178. Algunos aspectos clínicos fundamentales en la FA (como la prevención de complicaciones tromboembólicas y la progresión de la FA) están relacionados con el remodelado auricular y, lo que es muy importante, la FA no es solo un factor de riesgo, sino también un marcador de miocardiopatía auricular, lo cual podría explicar la falta de una relación temporal entre la detección de la FA y el ictus179.
El algoritmo diagnóstico para la miocardiopatía auricular debe seguir una estrategia paso a paso, en la que se identifiquen los factores de riesgo de miocardiopatía auricular170, disfunción auricular eléctrica y mecánica180 y el incremento del riesgo trombótico181. Son necesarios más datos para definir las implicaciones pronósticas y terapéuticas de distintas formas morfológicas y funcionales de la miocardiopatía auricular.
7Cribado de la fibrilación auricularMúltiples factores —como el aumento de la prevalencia de la FA, la detección de FA desconocida previamente en alrededor del 10% de los ictus isquémicos4,182, la alta prevalencia de la FA asintomática117, la posibilidad de prevenir el ictus relacionado con la FA con el tratamiento adecuado y el uso creciente de instrumentos para la detección de la FA— han impulsado iniciativas internacionales para implementar el cribado de la FA en la práctica clínica172.
La FA asintomática se ha asociado independientemente con un aumento del riesgo de ictus y de la mortalidad, comparada con la FA sintomática82,117,127,183. Los datos derivados de estudios sobre FA asintomática detectada de manera incidental constituyen la aproximación más cercana posible a la estimación del riesgo de ictus y muerte de sujetos con FA detectada por cribado, ya que retrasar el tratamiento para discernir la historia natural de la FA no sería ético. Datos de estudios observacionales indican que la FA detectada por cribado responde al tratamiento del mismo modo que la FA detectada en exámenes médicos de rutina183, por lo que favorecen el cribado de la FA.
Aunque la FA cumple muchos de los criterios establecidos para el cribado de enfermedades184 (figura 5 del material adicional), son escasos los datos de ECA que confirmen los beneficios del cribado de la FA y proporcionen información sobre la elección de programas y estrategias óptimas para su implementación185,186. En un futuro cercano, los avances en la tecnología de dispositivos móviles permitirán disponer de opciones económicas y prácticas para la detección de la FA y la evaluación de la carga de la FA.
7.1Instrumentos de cribadoLos sistemas empleados para el cribado de la FA se muestran en la tabla 5 y la figura 6173,187.
Métodos de cribado de la FA: palpación del pulso, monitores automáticos de PA, dispositivos de ECG de una derivación, dispositivos de FPG y otros sensores (que usan seismocardiografía, acelerómetros, giroscopios, etc.) que se emplean en aplicaciones para teléfonos inteligentes, bandas de muñeca y relojes. La detección intermitente de la FA mediante relojes inteligentes es posible gracias a los registros de FPG o ECG. Los relojes inteligentes y otros dispositivos portátiles pueden medir pasivamente la frecuencia del pulso en la muñeca mediante un sensor óptico de FPG y alertar al usuario en caso de irregularidad del pulso; estos sistemas integran un algoritmo específico para la detección de FA que analiza la irregularidad o la variabilidad del pulso172,173,188–196. ECG: electrocardiograma; FA: fibrilación auricular; PA: presión arterial; FPG: fotopletismografía.
La tecnología de dispositivos móviles para la salud se está desarrollando rápidamente, como los dispositivos para la detección de FA y otros propósitos (actualmente están disponibles más de 100.000 aplicaciones relacionadas con la salud y al menos 400 monitores de actividad portátiles)197. Es preciso tener cuidado al utilizar estos dispositivos en la práctica clínica, ya que muchos de ellos no están validados clínicamente. Varios estudios han evaluado la detección de la FA mediante relojes inteligentes198,199, con lo que se abren nuevas perspectivas para la detección de FA en poblaciones en riesgo concretas. Mediante el aprendizaje automático y la inteligencia artificial, se podría identificar a individuos con episodios de FA previos a partir de un registro de ECG de ritmo sinusal200, lo que supondría un gran avance tecnológico en la detección de la FA200.
El estudio Apple Heart201 incluyó a 419.297 usuarios de aplicaciones para relojes inteligentes (media de edad, 40 años) en Estados Unidos; el 0,5% de ellos recibieron una notificación de pulso irregular (el 0,15% de los menores 40 años y el 3,2% de los mayores de 65). A partir de esta notificación, la monitorización con parche de ECG durante 1 semana reveló FA en el 34% de los participantes monitorizados. El estudio Huawei Heart202 incluyó a 187.912 individuos (media de edad, 35 años; el 86,7% varones), de los que el 0,23% recibió una notificación de «sospecha de FA». De los individuos que recibieron seguimiento, el 87,0% tuvo FA confirmada, con el valor predictivo positivo de señales de fotopletismografía del 91,6% (intervalo de confianza del 95% [IC95%], 91,5%-91,8%). De los individuos con FA confirmada, el 95,1% participaba en un programa de atención integral de la FA mediante una aplicación móvil para la FA (mAFA).
Cuando la FA se detecta mediante un instrumento de cribado, incluidos los dispositivos móviles o portátiles, es necesario que un médico con experiencia en la interpretación del ritmo analice un trazado de ECG de una derivación ≥ 30 s o un ECG de 12 derivaciones que muestre FA para establecer el diagnóstico definitivo de FA (los dispositivos que pueden registrar trazados de ECG permiten el análisis directo de dichos trazados). Cuando la detección de la FA no está basada en un trazado de ECG (p. ej., con dispositivos de fotopletismografía) o en caso de duda en la interpretación del ECG proporcionado por un dispositivo, es preciso obtener un ECG adicional que confirme el diagnóstico (p. ej., ECG de 12 derivaciones, monitorización con Holter, etc.).
Sensibilidad y especificidad de varios instrumentos de cribado de la FA, considerando el ECG de 12 derivaciones como técnica estándar173.
| Sensibilidad | Especificidad | |
| Toma del pulso203 | 87-97% | 70-81% |
| Monitores de PA automatizados204–207 | 93-100% | 86-92% |
| ECG de una derivación208–211 | 94-98% | 76-95% |
| Aplicaciones para móviles188,189,191,195,212,213 | 91,5-98,5% | 91,4-100% |
| Relojes196,198,213,214 | 97-99% | 83-94% |
ECG: electrocardiograma; FA: fibrilación auricular; PA: presión arterial.
Escala de síntomas de la EHRA.
| Escala | Síntomas | Descripción |
|---|---|---|
| 1 | Ninguno | La FA no causa síntomas |
| 2a | Leves | La actividad diaria normal no está afectada por síntomas de FA |
| 2b | Moderados | La actividad diaria normal no está afectada por los síntomas de la FA, pero los síntomas suponen un problema para el paciente |
| 3 | Graves | La actividad diaria normal está afectada por los síntomas de la FA |
| 4 | Discapacitantes | Se interrumpe la actividad diaria normal |
Los datos de la tabla 5 se deben interpretar con cuidado, ya que en muchos estudios la evaluación de la sensibilidad y la especificidad se basa en pequeñas cohortes observacionales, con un riesgo sustancial de sesgos debido a la selección de las señales. Además, los algoritmos y las tecnologías aplicadas a dispositivos comercializados están en constante evolución.
Dos metanálisis recientes indican que el cribado de la FA mediante ECG no permite detectar más casos de FA que el cribado tomando el pulso215.
7.2Tipos y estrategias de cribadoLos tipos y estrategias de cribado de la FA usados más frecuentemente son el cribado oportunista y el cribado sistemático172,173,216 de individuos que superan cierta edad (normalmente ≥ 65 años) o con otras características que se asocian con un aumento del riesgo de ictus, mediante trazados de ECG intermitente o trazados de 30 s repetidos durante 2 semanas. No se ha definido la frecuencia más apropiada de la monitorización mediante teléfonos o relojes inteligentes. El cribado en atención primaria, farmacias o durante eventos comunitarios especiales son buenas ocasiones para la detección de la FA172,173. En un metanálisis no se observó, en términos generales, una diferencia significativa entre el cribado sistemático y el oportunista ni entre la atención primaria y el cribado comunitario, pero la eficacia de las evaluaciones repetidas fue significativamente mayor que una única evaluación215. Por otra parte, es muy importante organizar y estructurar la derivación de los casos de FA o de sospecha de FA detectados durante el cribado para su evaluación clínica posterior y para proporcionar a estos pacientes una atención médica adecuada.
7.3Beneficios y riesgos del cribado de la fibrilación auricularLas ventajas y las desventajas de la detección de la FA no diagnosticada previamente se muestran en la figura 7173.
El cribado también puede identificar casos de FA conocida que no reciben tratamiento óptimo217. Los registros de ECG intermitente multiplicaron por 4 la detección de FA no diagnosticada previamente217. En el estudio REHEARSE-AF, en el que se comparó el uso de un sistema de ECG de 1 derivación basado en teléfonos inteligentes/tabletas 2 veces a la semana durante 12 meses frente a la atención médica habitual, se observó un aumento de 3,9 veces en la detección de FA en pacientes de 65 o más años218. La información adecuada para el paciente y la organización de programas de cribado con interpretación rápida del ECG pueden reducir la ansiedad producida por la incertidumbre de que haya alguna anomalía.
7.4Relación coste-eficacia del cribado de la fibrilación auricularLos costes médicos relacionados con la FA justifican la implementación de estrategias para identificar y tratar la FA no diagnosticada219. El cribado oportunista de la FA se asocia con menores costes que el cribado sistemático173. Es importante seleccionar los instrumentos y los contextos más apropiados para el cribado de la FA220; en este sentido, se ha estimado que los programas de cribado basados en palpación del pulso, dispositivos portátiles de ECG y teléfonos inteligentes con algoritmos de fotopletismografía tienen un perfil favorable de coste-eficacia172. Tanto el cribado sistemático como el oportunista son más coste-efectivos que la práctica clínica habitual para pacientes de edad ≥ 65 años, aunque el cribado oportunista posiblemente sea más coste-efectivo que el cribado sistemático de la población1491.
7.5Cribado de poblaciones con alto riesgo7.5.1El paciente ancianoEl riesgo de FA (generalmente asintomática) e ictus aumenta con la edad82,127,221, lo cual justifica el cribado de FA en las personas de edad avanzada. El cribado oportunista de la FA parece ser coste-efectivo en esta población (≥ 65 años)222 y en individuos de 75-76 años monitorizados con ECG intermitente durante 2 semanas223.
Mediante la palpación del pulso o ECG a corto plazo, se calculó una prevalencia de FA del 4,4% de las personas de edad avanzada, con un 1,4% de FA no diagnosticada previamente, lo que indica un número necesario para el cribado igual a 70 individuos224. Los registros de ECG portátil repetido durante 2 semanas en una población no seleccionada de 75-76 años aumentó la detección de la FA asintomática hasta un 7,4% en sujetos con al menos 2 factores de riesgo de ictus225.
Recomendaciones sobre el cribado de la FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el cribado oportunista de la FA mediante la palpación del pulso o tiras de ritmo de ECG para pacientes mayores de 65 años188,211,223,225 | I | B |
| Se recomienda revisar regularme el marcapasos o DAI en busca de AHREc,224,226 | I | B |
| Durante el cribado de FA, se recomienda217,218: | ||
| • Informar a los individuos objeto de cribado sobre la importancia de la detección de la FA y sus implicaciones terapéuticas | ||
| • Organizar una plataforma estructurada de referencia para los casos de cribado positivos para una posterior evaluación clínica y confirmación del diagnóstico por personal médico y para proporcionar atención médica óptima a los pacientes con FA confirmada | ||
| • El diagnóstico definitivo de FA en los casos de cribado positivos solo se establece cuando el médico revise el ECG de 12 derivaciones o 1 derivación (≥ 30 s) y confirme la presencia de FA | I | B |
| Se debe considerar el cribado sistemático mediante ECG para la detección de FA en pacientes mayores de 75 años o con alto riesgo de ictus212,224,227 | IIa | B |
AHRE: episodios de frecuencia auricular rápida; ECG: electrocardiograma; FA: fibrilación auricular.
Debido a que la FA frecuentemente ocurre en pacientes con factores de riesgo cardiovascular o comorbilidades, en algunas ocasiones la FA puede ser indicio de una enfermedad no diagnosticada. De ahí que todos los pacientes con FA se pueden beneficiar de una evaluación cardiovascular completa (figura 8).
Proceso diagnóstico y seguimiento de los pacientes con FA. BNP: péptido natriurético cerebral; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); EC: enfermedad coronaria; ECG: electrocardiograma; FA: fibrilación auricular; Hs-cTnT: troponina cardiaca T de alta sensibilidad; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; OI: orejuela izquierda; PCR: proteína C reactiva; RM: resonancia magnética; RMC-RTG: resonancia magnética cardiaca con realce tardío de gadolinio; TC: tomografía computarizada.
El «paquete básico» para la evaluación diagnóstica de los pacientes con FA debe incluir la historia médica completa y la evaluación de enfermedades concomitantes, el patrón de FA, el riesgo de ictus, los síntomas relacionados con la FA, tromboembolia y disfunción del VI143. Para todos los pacientes con FA, se recomienda realizar ECG de 12 derivaciones para establecer el diagnóstico de FA, evaluar la frecuencia ventricular durante la FA y comprobar la presencia de alteraciones de la conducción, isquemia o signos de cardiopatía estructural. Los análisis de laboratorio (función tiroidea y renal, electrolitos séricos y recuento sanguíneo completo) y la ecocardiografía transtorácica (función y dimensiones del VI, dimensiones de la AI, valvulopatía, dimensiones del corazón derecho y función sistólica) son necesarios para guiar el tratamiento. Dependiendo de las características específicas de los pacientes, se podría obtener información específica adicional. La mayoría de los pacientes con FA requieren seguimiento regular (atención primaria) para garantizar un tratamiento óptimo continuo.
8.1Síntomas y calidad de vidaPuesto que la FA puede cursar sin síntomas o llegar a producir síntomas discapacitantes y que la gravedad de los síntomas influye en las decisiones sobre el tratamiento para el control del ritmo (incluida la ablación con catéter), se debe caracterizar el estado sintomático mediante la escala de la European Heart Rhythm Association (EHRA)228 (tabla 6) y esclarecer la relación de los síntomas con la FA (especialmente cuando son inespecíficos, como falta de aire, fatiga, malestar en el pecho, etc.), ya que los síntomas pueden producirse por factores de riesgo cardiovascular no diagnosticados o tratados inadecuadamente o por otras entidades patológicas229.
Para algunos pacientes con FA, se recomienda la monitorización con ECG a largo plazo para evaluar el control de la frecuencia cardiaca y relacionar los síntomas con los episodios de FA. En ocasiones, la asociación entre los síntomas y la FA solo se puede establecer retrospectivamente tras el éxito de una intervención para el control del ritmo. En casos seleccionados, el intento de reversión a ritmo sinusal mediante cardioversión y la cuantificación de la percepción del paciente sobre los síntomas con un instrumento de evaluación validado (tabla 4 del material adicional) puede aportar información esencial para tomar decisiones sobre la ablación con catéter de la FA (sección 10.2).
La mejoría sintomática y funcional gracias a los tratamientos para el control del ritmo (cardioversión232–234, fármacos antiarrítmicos [FAA] y procedimientos de ablación con catéter de la FA235–242) depende en gran medida del mantenimiento del ritmo sinusal243; sin embargo, la CdV podría mejorar pese a las recurrencias de la FA, excepto cuando la carga de FA sea alta244 (p. ej., > 2 h al día)100, debido a la optimización del control de los factores de riesgo cardiovascular y las comorbilidades245 o al efecto esperado del tratamiento. Los efectos del tratamiento246,247 se apoyan en informes que confirman la mejoría de la CdV a los 10 años de la ablación con catéter de la FA paroxística en pacientes con una tasa de progresión de la FA baja248.
8.2SustratoEl sustrato de la FA se relaciona con la dilatación y la fibrosis de la AI, que después son causa de la disfunción de la AI y el retraso de la conducción electromecánica.
Las técnicas de imagen multimodal no invasiva pueden proporcionar toda la información necesaria (figura 9)249,250.
Técnicas de imagen en la FA. La imagen anatómica proporciona información sobre el tamaño y la forma de la AI y sobre la presencia de fibrosis. La evaluación más precisa de la dilatación de la AI se obtiene mediante RMC o TC. Para la evaluación sistemática, se emplea la ecocardiografía transtorácica bidimensional (2D) o, preferiblemente, tridimensional (3D). Los valores de volumen normales en la ecocardiografía 3D son de 15-42ml/m2 en varones y 15-39ml/m2 en mujeres250. Se ha descrito la evaluación de la fibrosis de la AI con RMC-RTG, pero rara vez se hace en la práctica clínica251. La imagen funcional incluye el Doppler tisular (TDI) y la técnica de strain rate; el primero mide las velocidades del miocardio tanto en sístole como en diástole, mientras que la segunda refleja la contracción activa de la AI. El intervalo PA-TDI refleja el retraso electromecánico de la aurícula (el tiempo total de conducción de la AI, el intervalo de tiempo entre la onda P en ECG y la A’ [pico de velocidad auricular] en TDI) y refleja también el strain rate de la AI252. La infiltración de grasa epicárdica en la pared de la AI puede ser un marcador temprano de inflamación y se puede detectar mediante TC cardiaca o RMC253. Antes de la ablación de la FA, la TC o la RMC permiten visualizar la anatomía de las venas pulmonares. AI: aurícula izquierda; ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; FA: fibrilación auricular; OI: orejuela izquierda; RM: resonancia magnética; RMC-RTG: resonancia magnética cardiaca con realce tardío de gadolinio; TC: tomografía computarizada; TDI: Doppler tisular; VI: ventrículo izquierdo.
La ecocardiografía transesofágica (ETE) se puede usar en pacientes seleccionados para evaluar la presencia de valvulopatía o trombos en la orejuela de la aurícula izquierda (OI); se puede realizar una angiografía por tomografía computarizada (angio-TC) coronaria para la evaluación de EC; se puede usar la TC/resonancia magnética (RM) cerebral cuando se sospeche ictus. Se han descrito varios predictores específicos del ictus: dilatación de la AI, contraste espontáneo en la AI, strain reducido en la AI, trombo en la OI, velocidad pico baja en la OI (<20cm/s) y anatomía de la OI en forma de «ala de pollo» (en la TC)250.
Recomendaciones para la evaluación diagnóstica de los pacientes con FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con FA se recomienda: | ||
| • Evaluar los síntomas relacionados con la FA (como fatiga, cansancio, disnea relacionada con el esfuerzo, palpitaciones y dolor torácico) y cuantificar el estado sintomático de los pacientes mediante la escala EHRA modificada antes y después de instaurar el tratamiento230,232 | ||
| • Evaluar los síntomas relacionados con la FA antes y después de la cardioversión de la FA persistente para guiar las decisiones sobre el tratamiento antiarrítmico230,232 | I | C |
EHRA: European Heart Rhythm Association; FA: fibrilación auricular.
La atención integrada de los pacientes con FA requiere una vía de atención individualizada, coordinada y acordada por un equipo multidisciplinario para proporcionar un tratamiento óptimo(figura 10). La figura central de este enfoque es el paciente; se debe discutir las opciones terapéuticas y acordar un plan de tratamiento en consulta con profesionales de la salud. El tratamiento puede cambiar con el paso del tiempo debido a la aparición de nuevos factores de riesgo y síntomas, progresión de la enfermedad y nuevos tratamientos disponibles.
9.2Equipo multidisciplinario de fibrilación auricularLa atención integrada de la FA requiere la coordinación de un equipo multidisciplinario(figura 11) formado según las necesidades individuales de los pacientes y la disponibilidad local de servicios. Los pacientes complejos pueden beneficiarse de la atención de un equipo multidisciplinario que incluya a especialistas relevantes, a su médico de atención primaria (para la atención médica después del alta hospitalaria) y a su familia/cuidadores. La participación del paciente y su familia/cuidadores es esencial para el éxito del tratamiento de la FA.
Equipo para la atención integral de pacientes con FA (un ejemplo). La figura muestra la composición de un posible equipo de FA que incluye a diferentes especialistas para el cuidado de pacientes individuales según sus necesidades. FA: fibrilación auricular; IC: insuficiencia cardiaca.
*Dependiendo de la práctica local, podría tratarse de un cardiólogo general con un interés especial en arritmias/FA o un electrofisiólogo.
El tratamiento óptimo de la FA requiere un sistema de salud adecuadamente estructurado y recursos económicos considerables254. La asignación de recursos varía según las distintas estructuras de los sistemas de salud y las restricciones presupuestarias en diversas zonas geográficas. Las importantes desigualdades en el acceso a recursos para la atención médica relacionada con la FA aparecen documentadas en el ESC Atlas on Cardiovascular Disease, recientemente publicado255. Es preciso optimizar el uso de los recursos disponibles para reducir los ictus, mejorar los síntomas y tratar las comorbilidades.
9.3Participación de los pacientes y la toma de decisiones compartida9.3.1Valores y preferencias de los pacientesObtener información sobre los valores, objetivos y preferencias de los pacientes debe ser el primer paso de la toma de decisiones compartida256,257. Estudios cualitativos demuestran que hay una discordancia recurrente entre los proveedores de asistencia sanitaria, que creen compartir la toma de decisiones, y los pacientes, que se sienten objeto de un modelo paternalista109,258–261, y la percepción errónea de que numerosos pacientes prefieren no participar en este proceso y dejan las decisiones al criterio de su médico259,262–266. En la toma de decisiones compartida261, se debe valorar detenidamente y respetar la importancia que el paciente concede a la prevención del ictus y el control del ritmo, y los respectivos riesgos de muerte, ictus y sangrado mayor, además de la carga del tratamiento257,264,266.
9.3.2Formación de los pacientesEl conocimiento de los pacientes sobre la FA y su tratamiento suele ser escaso257,269–272, especialmente cuando se diagnostica por primera vez, momento en el que se discuten y se toman la mayoría de las decisiones sobre el tratamiento.
En el ESC Textbook of Cardiovascular Medicine hay información sobre recursos útiles que pueden ayudar a la formación de los pacientes con FA273, aunque por sí sola la formación suele ser insuficiente para generar y mantener la adherencia a la medicación y las modificaciones del estilo de vida.
9.4Formación de los profesionales de la saludSe han desarrollado métodos combinados dirigidos a profesionales de la salud en los que se adaptaron la formación y el entrenamiento a las necesidades individuales; estos métodos incluyen tecnología inteligente, recursos en la red o cursos presenciales de actualización, o una combinación de todos ellos274. El sistema mAFA (aplicaciones móviles para la FA), que integra herramientas para la toma de decisiones y la formación de profesionales médicos, se desarrolló con éxito y posteriormente se probó en un ECA de resultados275. La formación por sí sola no basta para cambiar la actitud de los profesionales médicos276. En el estudio IMPACT-AF277, una intervención educativa multidimensional, que incluía la formación de profesionales médicos y retroalimentación, resultó en un aumento significativo del porcentaje de pacientes tratados con anticoagulación oral.
9.5Adherencia al tratamientoLos factores que afectan a la adherencia al tratamiento pueden agruparse en: factores relacionados con el paciente (p. ej., características demográficas, comorbilidades, deterioro cognitivo, polifarmacia, efectos secundarios del tratamiento, salud mental, comprensión del régimen de tratamiento), factores relacionados con el médico (conocimientos, concienciación sobre las guías, experiencia, enfoque multidisciplinario) y factores relacionados con el sistema de salud (contexto de trabajo, acceso a tratamientos, costes)278.
Para promover la adherencia al tratamiento, es esencial informar adecuadamente al paciente sobre las opciones de tratamiento, cómo mantener la adherencia y las consecuencias de no mantenerla, además de abordar las expectativas que el paciente tiene en cuanto a los objetivos del tratamiento. Las revisiones regulares con algún miembro del equipo multidisciplinario son importantes para identificar la falta de adherencia e implementar estrategias para mejorarla si fuera preciso.
9.6Herramientas tecnológicas para el tratamiento de la fibrilación auricularLos sistemas de apoyo para la toma de decisiones clínicas son sistemas inteligentes que digitalizan y proporcionan recomendaciones basadas en la evidencia, vías de actuación clínica y algoritmos para facilitar la administración de tratamientos individualizados, a tiempo y basados en la evidencia.
El proyecto MobiGuide279 y diversas aplicaciones280–283 (tablas 5 y 6 del material adicional) se han llevado a la práctica para promover la formación de los pacientes, mejorar la comunicación entre los pacientes y los profesionales de la salud y fomentar la participación activa de los pacientes. El consorcio ESC/CATCH-ME desarrolló una aplicación para teléfonos inteligentes/tablets281 para pacientes con FA, pero aún no se ha probado prospectivamente. Una revisión Cochrane284 demostró que la ayuda al paciente para tomar decisiones reduce los conflictos en la toma de decisiones285–288. Sin embargo, resultados contradictorios277,289,290 ponen de manifiesto la necesidad de llevar a cabo estudios adicionales con un diseño riguroso, que incluya la evaluación del efecto de las intervenciones en los eventos clínicos.
9.7Ventajas de la atención integrada de los pacientes con fibrilación auricularNo se dispone de suficientes datos sobre la eficacia de la atención integrada de la FA. Los estudios de intervención realizados varían ampliamente en número y contenido de la «atención integrada» que se empleó. En 6 estudios —1 análisis por grupos291, 4 ECA277,292–295 y 1 estudio de tipo «antes y después»294— sobre la atención integrada de la FA, se observaron resultados contradictorios (tabla 7 del material adicional). Dos estudios292,294 y 1 metanálisis296 comunicaron tasas significativamente más bajas de hospitalización y muerte cardiovascular con atención integrada basada en personal de enfermería, mientras que en otros estudios no se observó efecto de la atención integrada en estas variables. Un estudio multidimensional277 demostró mejores tasas de anticoagulación oral en el grupo de intervención a los 12 meses. En el estudio IMPACT-AF277 no se encontró ninguna diferencia significativa en la variable compuesta de eficacia (consulta no planificada en el servicio de urgencias o la hospitalización cardiovascular) ni en la variable principal de seguridad (sangrado mayor), entre el grupo de intervención y el grupo asignado a cuidados médicos habituales.
9.8Medidas o estrategias para implementar la atención integradaLa atención integrada de la FA requiere un cambio en el enfoque de la atención que ahora reciben los pacientes, para avanzar desde un modelo de equipo multidisciplinario a un proceso de trabajo interdisciplinario, que incluya el cambio de comportamiento de los miembros del equipo de FA y otros actores clave, incluidos los pacientes y sus familias297,298 (figura 3 del material adicional).
Para saber si se ha implementado la atención integrada en la práctica clínica y evaluar su impacto en los resultados más relevantes (mortalidad, ictus, hospitalización, CdV, reducción de los síntomas, etc.), es preciso documentar una serie específica de medidas estándares internacionales establecidas (figura 4 del material adicional)299. De este modo, también se podría identificar las áreas que requieren un mayor desarrollo.
9.9Carga del tratamientoLa carga del tratamiento percibida por el paciente300 se define como la carga de trabajo que impone el servicio de salud al paciente y su efecto en el funcionamiento y el bienestar del paciente, aparte de los efectos secundarios específicos del tratamiento301,302. Incluye todo lo que los pacientes hacen por su salud (gestión de la medicación, automonitorización, consultas con el médico, análisis de laboratorio, cambios en el estilo de vida) y el impacto de la atención médica en sus relaciones sociales, lo cual podría afectar a la adherencia al tratamiento303,304, la CdV y los resultados (p. ej., hospitalización y supervivencia)305,306. La carga del tratamiento percibida por el paciente depende de su conocimiento de la enfermedad302. Pacientes con regímenes de tratamiento similares pueden percibir cargas del tratamiento muy diferentes307, y también hay diferencias entre la evaluación de la carga del tratamiento realizada por el médico y la percepción del paciente, lo cual indica que la experiencia del paciente no se comparte en profundidad durante las consultas302,308,309.
La carga del tratamiento puede ser abrumadora para los pacientes con múltiples enfermedades crónicas301 (como ejemplo, los pacientes con 3 enfermedades crónicas tienen que tomar unos 6-12 medicamentos al día, asistir a consultas médicas 1,2-5,9 veces al mes y pasar 49,6-71,0 h al mes en actividades relacionadas con la salud) 310. Aún se desconoce en gran medida la carga del tratamiento para los pacientes con FA. En un estudio prospectivo de un centro, la carga total del tratamiento percibida por los pacientes con FA fue mayor que la de los pacientes con otras enfermedades crónicas (el 27,6 frente al 24,3%; p = 0,011), y 1 de cada 5 pacientes con FA refirió una carga del tratamiento tan alta que podría poner en cuestión la sostenibilidad de su tratamiento. Cabe destacar que los pacientes atribuyeron la carga más alta del tratamiento a aspectos relacionados con el sistema de salud (p. ej., asistir a citas médicas, etc.) y a las exigencias de los cambios en el estilo de vida. Las mujeres y los pacientes más jóvenes se asociaron de manera independiente y significativa con una carga del tratamiento más alta, mientras que los anticoagulantes orales no dependientes de la vitamina K (NACO) y el control del ritmo redujeron las probabilidades de una carga alta del tratamiento en más del 50%311.
La discusión sobre la carga del tratamiento debe formar parte integral de la toma de decisiones compartida con el paciente informado, y la carga del tratamiento se puede evaluar mediante cuestionarios validados312.
9.10Resultados referidos por los pacientesActualmente está en aumento el interés por incluir los resultados referidos por los pacientes (RRP) como criterios de valoración en estudios clínicos313 y documentarlos sistemáticamente314–316 para mejorar la atención médica y evaluar el éxito del tratamiento desde la perspectiva de los pacientes. La experiencia de los pacientes de la FA y su tratamiento es muy subjetiva; el tratamiento de la FA se ha vuelto cada vez más complejo y esto podría resultar en una significativa carga del tratamiento y una peor CdV relacionada con la salud.
Medir los resultados que son importantes para los pacientes, además de las variables clínicas objetivas (muerte, ictus, sangrado mayor, etc.) puede aportar información útil para el tratamiento de la FA. Un consorcio internacional formado por pacientes con FA y profesionales sanitarios ha identificado los siguientes RRP como medidas importantes para la FA: CdV relacionada con la salud, funcionamiento físico y emocional, función cognitiva, gravedad de los síntomas, tolerancia al ejercicio y capacidad para trabajar (figura 4 del material adicional)299; las medidas de los RRP pueden servir para evaluar estos factores, y el ICHOM ha desarrollado una serie de medidas estándar para la FA y propone algunos instrumentos para la evaluación de los RRP299. Los sistemas informáticos de salud pueden ayudar a captar los datos de los RRP. A pesar del creciente interés por el papel de la medición de RRP en la atención sanitaria, pocos estudios y registros han empleado instrumentos validados para recoger estos datos313. La implementación de las medidas de RRP en la atención de los pacientes con FA se aborda en un documento de consenso de expertos elaborado por la EHRA en colaboración con representantes de los pacientes317.
Recomendaciones sobre una estrategia terapéutica integral para la FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para optimizar la toma de decisiones compartida sobre opciones específicas de tratamiento de la FA, se recomienda: | ||
| • Informar al paciente sobre las ventajas/limitaciones y los riesgos/beneficios asociados con las opciones de tratamiento que se están valorando y | ||
| • Discutir con el paciente la potencial carga del tratamiento e incluir en la toma de decisiones la percepción del paciente sobre ello | I | C |
| Se recomienda recoger regularmente los RRP para medir la eficacia del tratamiento y mejorar el cuidado de los pacientes | I | C |
| Para mejorar los resultados clínicos, se debe estructurar una estrategia multidisciplinaria integral que incluya a los profesionales de la salud, los pacientes con FA y sus familiares o cuidadores277,292–294,296,297 | IIa | B |
FA: fibrilación auricular; RRP: resultado referido por el paciente.
La estrategia Atrial fibrillation Better Care de atención integral de la FA (denominada la vía ABC: «A», anticoagulación/prevención del ictus; «B», buen control de los síntomas; «C», control de los factores de riesgo cardiovascular y las comorbilidades)318 permite optimizar la atención de los pacientes con FA en todos los niveles de atención sanitaria y entre diferentes especialidades. Comparada con la atención estándar, la implementación de la vía ABC se ha asociado con menor riesgo de muerte por cualquier causa, menor incidencia de la variable compuesta de ictus/sangrado mayor/muerte cardiovascular y primera hospitalización319, tasas más bajas de eventos cardiovasculares320,321 y menos costes relacionados con la salud322. En el estudio prospectivo y aleatorizado mAFA-II, la variable compuesta se redujo significativamente con las intervenciones de la vía ABC, comparada con la atención estándar (el 1,9 frente al 6,0%; hazard ratio [HR] = 0,39; IC95%, 0,22-0,67; p < 0,001]323.
10.1«A»: anticoagulación/prevención del ictusEsta sección aborda la FA en ausencia de estenosis mitral grave o prótesis valvular cardiaca (para la FA con enfermedad valvular, véase la sección 11.7)148.
10.1.1Evaluación del riesgo de ictusEn términos generales, la FA aumenta en 5 veces el riesgo de ictus, pero este riesgo no es homogéneo, ya que depende de la presencia de factores o modificadores específicos del riesgo de ictus. Los factores clínicos más importantes del riesgo de ictus se identificaron a partir de los grupos de pacientes no anticoagulados de ECA históricos que se realizaron hace más de 20 años, a pesar de que estos estudios solo aleatorizaron a menos del 10% de los pacientes cribados y muchos de los factores de riesgo comunes no se registraron o no se definieron de manera homogénea324. Estos datos se complementaron con datos de grandes cohortes de estudios observacionales que estudiaron a pacientes que no estarían incluidos en dichos ECA. Posteriormente, varios marcadores biológicos de imagen, sangre y orina (biomarcadores) se han asociado con el riesgo de ictus (tabla 7)324,325. Además, la FA no paroxística se ha asociado con un aumento de las tromboembolias (HR ajustado multivariable = 1,38; IC95%, 1,19-1,61; p < 0,001), comparada con la FA paroxística156. Cabe destacar que muchos de los factores de riesgo de complicaciones relacionadas con la FA son también factores de riesgo de FA33.
Factores de riesgo de ictus en pacientes con FA.
| Factores de riesgo clínicos más estudiados (revisión sistemática)324 | Estudios positivos/todos los estudios | Otros factores de riesgo clínicos325 | Biomarcadores en técnicas de imagen291,326–328 | Biomarcadores en sangre/orina329–332 |
|---|---|---|---|---|
| Ictus/AIT/embolia sistémica | 15/16 | Función renal afectada/ERC | Ecocardiografía | Troponinas cardiacas T o IPéptidos natriuréticosCistatina CProteinuriaAclCr/TFGePCRIL-6Gdf-15Factor von WillebrandDímero D |
| Hipertensión | 11/20 | AOS | Dilatación de la AIContraste ecocardiográfico espontáneo o trombos en la AIVelocidades bajas en la OIPlaca aórtica compleja | |
| Envejecimiento (por década) | 9/13 | MCH | ||
| Cardiopatía estructural | 9/13 | Amiloidosis en enfermedades degenerativas cerebrales y cardiacas | ||
| Diabetes mellitus | 9/14 | Hiperlipemia | ||
| Valvulopatía | 6/17 | Tabaquismo | ||
| ICC/disfunción del VI | 7/18 | Síndrome metabólico333 | Imagen cerebral | |
| Sexo (mujer) | 8/22 | Malignidad | Enfermedad de vasos pequeños |
AclCr: aclaramiento de creatinina; AI: aurícula izquierda; AIT: accidente isquémico transitorio; AOS: apnea obstructiva del sueño; ERC: enfermedad renal crónica; GDF-15: factor de diferenciación de crecimiento 15; ICC: insuficiencia cardiaca congestiva; IL-6: interleucina 6; OI: orejuela izquierda; PCR: proteína C reactiva; TFGe: tasa de filtrado glomerular estimada; VI: ventrículo izquierdo.
Escala CHA2DS2-VASc334.
| Escala CHA2DS2-VAScFactores de riesgo y definiciones | Puntos | Comentarios | |
|---|---|---|---|
| C | Insuficiencia cardiaca congestivaIC clínica o evidencia objetiva de disfunción del VI moderada-grave o MCH | 1 | Descompensación de la IC reciente, independientemente de la FEVI (por lo tanto, incorpora la IC-FEr y la IC-FEc) o disfunción del VI moderada-grave (aunque sea asintomática) en imagen cardiaca335; la MCH confiere alto riesgo de ictus336 y los ACO son beneficiosos para reducir el riesgo de ictus337 |
| H | Hipertensióno tratamiento antihipertensivo | 1 | El antecedente de hipertensión puede producir cambios vasculares que predisponen al ictus, y una PA bien controlada hoy puede no estarlo con el paso del tiempo324. PA no controlada: el objetivo óptimo para la PA que se asocia con el menor riesgo de ictus isquémico, muerte y otras complicaciones cardiovasculares es 120-129/< 80 mmHg338 |
| A | Edad ≥ 75 años | 2 | La edad es un potente factor de riesgo de ictus, que aumenta en la mayoría de las cohortes de población a partir de los 65 años339. Aunque el riesgo relacionado con la edad aumenta continuamente, por cuestiones prácticas se otorga 1 punto a los pacientes de 65-74 años y 2 puntos a los mayores de 75 |
| D | Diabetes mellitusTratamiento hipoglucemiante oral o insulina o glucosa en ayunas > 125 mg/dl (7 mmol/l) | 1 | La DM es un factor de riesgo de ictus bien establecido; recientemente se han relacionado el riesgo de ictus con la duración de la DM (a mayor duración, mayor riesgo de tromboembolia)340 y la presencia de daño orgánico relacionado con la DM (p. ej., retinopatía)341. En términos generales, la DM1 y la DM2 confieren un riesgo tromboembólico similar en pacientes con FA, aunque el riesgo puede aumentar ligeramente en los menores de 65 años con DM2, comparados con los pacientes con DM1342 |
| S | IctusAntecedente de ictus, AIT o tromboembolia | 2 | El antecedente de ictus, embolia sistémica o AIT confiere un riesgo particularmente alto de ictus isquémico, y por ello se le otorgan 2 puntos. Normalmente excluidos de los ECA, los pacientes con FA y HIC (incluido el ictus hemorrágico) tienen después un riesgo de ictus isquémico muy alto. Estudios observacionales recientes indican que estos pacientes podrían beneficiarse de los ACO343–345 |
| V | Enfermedad vascularEC angiográficamente significativa, IM previo, EAP o placa aórtica | 1 | La enfermedad vascular (EAP o IM) confiere un exceso de riesgo del 17-22%, especialmente en pacientes asiáticos346–348. La EC angiográficamente significativa también es un factor independiente de riesgo de ictus isquémico en pacientes con FA (tasa ajustada de incidencia, 1,29; IC95%, 1,08-1,53)349. La presencia de placa compleja en la aorta descendente, como un indicador de enfermedad vascular significativa, también es un importante predictor de riesgo de ictus isquémico350 |
| A | Edad 65-74 años | 1 | Véase «Edad ≥ 75 años» más arriba. Datos recientes recabados en países asiáticos indican que el riesgo de ictus puede aumentar a partir de los 50-55 años de edad y que en pacientes asiáticos se puede emplear la escala CHA2DS2-VASc modificada351,352 |
| Sc | Sexo (mujer) | 1 | Es un modificador del riesgo, más que un factor de riesgo de ictus353 |
| Puntuación máxima | 9 |
ACO: anticoagulantes orales; AIT: accidente isquémico transitorio; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); DM: diabetes mellitus; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ECA: ensayo controlado aleatorizado; FA: fibrilación auricular; FE: fracción de eyección; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; HIC: hemorragia intracraneal; IM: infarto de miocardio; MCH: miocardiopatía hipertrófica; PA: presión arterial; FEVI: fracción de eyección del ventrículo izquierdo; VI: ventrículo izquierdo.
Los factores de riesgo de ictus habituales se resumen en la escala clínica de riesgo CHA2DS2-VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo femenino) (tabla 8)334. Las escalas de riesgo tienen que buscar un equilibrio entre la simplicidad y el pragmatismo frente a la precisión354–356. Como cualquier otra escala basada en factores de riesgo clínicos, el rendimiento de la escala CHA2DS2-VASc es discreto a la hora de identificar a los pacientes con riesgo alto que pueden sufrir complicaciones tromboembólicas, pero los pacientes identificados como en riesgo bajo —CHA2DS2-VASc de 0 puntos (los varones) o 1 punto (las mujeres)— coinciden en tasas bajas de ictus isquémico o mortalidad (< 1%/año) y no requieren tratamiento para la prevención del ictus.
El sexo femenino es un modificador del riesgo de ictus dependiente de la edad, más que un factor de riesgo en sí mismo357,358. Estudios observacionales mostraron que las mujeres sin otros factores de riesgo (CHA2DS2-VASc de 1 punto) tienen un riesgo de ictus bajo, similar al de los varones con CHA2DS2-VASc de 0 puntos359. La escala simplificada CHA2DS2-VA puede guiar la decisión inicial sobre la anticoagulación oral para pacientes con FA, pero como no tiene en cuenta el componente sexo, podría subestimar el riesgo de ictus de las mujeres con FA360,361. En presencia de más de 1 factor de riesgo no relacionado con el sexo, las mujeres con FA tienen un riesgo de ictus constante y significativamente mayor que los varones353,362.
Muchos factores clínicos de riesgo de ictus (como la insuficiencia renal, la AOS y la dilatación de la AI)291,326,363–365 tienen una estrecha relación con los componentes de la escala CHA2DS2-VASc, pero su evaluación no mejora su valor predictivo (p. ej., la relación del tabaquismo o la obesidad con el riesgo de ictus en la FA es controvertida)366. Varios biomarcadores (como troponinas, péptidos natriuréticos, GDF-15 o factor de von Willebrand) han mostrado un buen rendimiento en las escalas de riesgo basadas en biomarcadores, comparadas con las escalas clínicas, para evaluar el riesgo residual de ictus de los pacientes con FA no anticoagulados329,367; sin embargo, muchos de estos biomarcadores (así como algunos factores de riesgo clínicos) son predictivos tanto de ictus como de hemorragia329 o de enfermedades no cardiovasculares o no relacionadas con la FA, y a menudo reflejan de manera inespecífica simplemente un corazón o un paciente enfermo.
Algunas escalas de riesgo clínicas más complejas —como la escala GARFIELD-AF (Global Anticoagulant Registry in the FIELD-Atrial Fibrillation)368— y las escalas que incluyen biomarcadores —como ATRIA (Anticoagulation and Risk Factors in Atrial Fibrillation)369,370, la Intermountain Risk Score371 y ABC-Stroke (Age, Biomarkers, Clinical history)372— mejoran discretamente la predicción del riesgo de ictus, pero de manera estadísticamente significativa. La escala ABC-Stroke, basada en la edad, el antecedente de ictus/accidente isquémico transitorio (AIT), troponina T de alta sensibilidad (hs-cTnT) y péptidos natriuréticos (NT-proBNP), se validó en las cohortes de los estudios más importantes sobre los NACO373–375. Está en estudio una estrategia de tratamiento guiada por una escala de riesgo basada en biomarcadores (ABC-AF Study, NCT03753490) para reducir los ictus y la mortalidad en pacientes con FA.
Mientras que, de momento, el uso sistemático de escalas de riesgo basadas en biomarcadores tiene poca utilidad en la toma de decisiones sobre el tratamiento preventivo inicial del ictus para pacientes que ya son candidatos a tratamiento basándose en la escala CHA2DS2-VASc (escasa practicidad que además se acompañaría de un aumento de gastos sanitarios)355,376,377, los biomarcadores podrían refinar adicionalmente la diferenciación del riesgo de ictus en pacientes inicialmente en bajo riesgo y aquellos con solo 1 factor de riesgo no relacionado con el sexo de la escala CHA2DS2-VASc378.
Los estudios sobre el uso de la escala CHA2DS2-VASc comunicaron una amplia variedad de tasas de ictus que dependían del contexto del estudio (atención comunitaria frente a hospitalaria), metodología (p. ej., la exclusión de pacientes tratados después con ACO produciría un sesgo hacia tasas de ictus más bajas), origen étnico y prevalencia de factores de riesgo de ictus específicos en la población del estudio (diferentes factores de riesgo conllevan un peso diferente, y los umbrales de edad para iniciar el tratamiento con NACO son diferentes para pacientes con solo 1 factor de riesgo de ictus no relacionado con el sexo, como sigue: edad, 35 años para la IC, 50 años para la hipertensión o la diabetes y 55 años para la enfermedad vascular)379,380. Ningún ECA ha investigado específicamente la necesidad de anticoagulación oral para los pacientes con solo 1 factor de riesgo no relacionado con el sexo de la escala CHA2DS2-VASc (los estudios sobre anticoagulación han incluido preferentemente a pacientes con riesgo alto para obtener tasas elevadas de eventos y completar el estudio a tiempo), pero la revisión del análisis de subgrupos y datos de estudios observacionales indica que la administración de ACO a estos pacientes confiere un beneficio neto clínico positivo si se sopesa la reducción del riesgo de ictus frente al riesgo potencial de complicaciones hemorrágicas graves339,381.
Varios factores de riesgo de ictus (como la edad) evolucionan constantemente y no se corresponden con una categoría convencional de riesgo bajo, moderado o alto. Los factores de riesgo son dinámicos y, teniendo en cuenta a la población de edad avanzada con FA y otras comorbilidades (que cambian frecuentemente), es preciso revaluar el riesgo de ictus en cada revisión médica. Estudios recientes muestran que los pacientes que presentan cambios en su perfil de riesgo tienen más probabilidades de sufrir un ictus382,383. Muchos pacientes que inicialmente tienen riesgo bajo (> 15%) tendrán ≥ 1 factor de riesgo no relacionado con el sexo de la escala CHA2DS2-VASc al año de aparecer la FA384–386 y el 90% de las nuevas comorbilidades fueron evidentes a los 4,4 meses del diagnóstico de FA387.
En una revisión sistemática de 61 estudios auspiciada por el Patient-Centred Outcomes Research Institute (PCORI), se comparó la precisión diagnóstica y el impacto en las decisiones clínicas de utilizar medios clínicos y de imagen y factores de riesgo asociados en la predicción de los riesgos tromboembólico y hemorrágico en pacientes con FA388. Los autores concluyeron que las escalas CHADS2 (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años, diabetes mellitus, síntomas previos de ictus o AIT), CHA2DS2-VASc y ABC tuvieron los mejores resultados en cuanto a la predicción del riesgo tromboembólico (aunque la evidencia fue moderada para cada escala por sus limitaciones en la capacidad de predicción).
10.1.2Evaluación del riesgo hemorrágicoCuando se inicia tratamiento antitrombótico, también es necesario evaluar el potencial riesgo hemorrágico. Los factores de riesgo no modificables o parcialmente modificables (tabla 9) son importantes desencadenantes de complicaciones hemorrágicas que actúan en sinergia con los factores de riesgo modificables389. Destaca, por ejemplo, que el antecedente de caídas no sea un predictor independiente del riesgo hemorrágico en pacientes tratados con ACO (un estudio de modelos estimó que un paciente tendría que sufrir 295 caídas al año para que el beneficio del tratamiento con ACO para reducir el riesgo de ictus isquémico fuese superado por el riesgo potencial de complicaciones hemorrágicas graves)390.
Se han usado factores de riesgo hemorrágico modificables y no modificables para formular distintas escalas de riesgo hemorrágico368,391–395, generalmente con una capacidad moderada de predicción de complicaciones hemorrágicas396,397. Los estudios que compararon escalas de sangrado concretas obtuvieron resultados contradictorios393,394,398. Se han propuesto varios biomarcadores como predictores del riesgo hemorrágico, pero muchos de ellos se investigaron en las cohortes de pacientes anticoagulados de los estudios, mientras que la evaluación del riesgo hemorrágico es necesaria en todos los momentos de la atención al paciente (inicialmente cuando no toma ACO, si toma ácido acetilsalicílico [AAS] y, después, cuando toma ACO). Además, los biomarcadores son predictores no específicos de ictus, muerte, IC, etc.399,400, o incluso de enfermedades no cardiovasculares (como el glaucoma)401, y en la práctica clínica la disponibilidad de algunos biomarcadores es escasa.
La escala de riesgo hemorrágico ABC basada en biomarcadores —edad, biomarcadores (GDF-15, hs-cTnT, hemoglobina) e historia clínica (hemorragia previa)375,402— se demostró superior a las escalas clínicas, pero en otro estudio no se observó una ventaja a largo plazo de la escala ABC sobre la INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED
(tabla 10), la cual se demostró mejor para la identificación de pacientes con riesgo hemorrágico bajo (INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED 0-2 puntos)403. En la revisión sistemática comisionada por el instituto PCORI388, que incluyó 38 estudios sobre la predicción del riesgo hemorrágico, la escala con mayor evidencia para la predicción del riesgo hemorrágico fue la INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED (fuerza de la evidencia moderada), en concordancia con otros estudios y metanálisis sobre la predicción del riesgo hemorrágico404–406.Una puntuación alta de riesgo hemorrágico no se debe considerar contraindicación para la anticoagulación oral, ya que el beneficio clínico neto de la anticoagulación es incluso mayor en esta población de pacientes. No obstante, la evaluación formal del riesgo hemorrágico proporciona información útil para el tratamiento de los pacientes en anticoagulación oral, centrando la atención en los factores de riesgo modificables, que se debe tratar y revaluar en cada contacto con el paciente, e identificando a los pacientes en riesgo alto con factores de riesgo hemorrágico no modificables que deben asistir antes (p. ej., a las 4 semanas en lugar de a los 4-6 meses) y más frecuentemente a revisión médica389,407. La identificación de los pacientes con «riesgo hemorrágico alto» también es necesaria para determinar la estrategia antitrombótica para grupos específicos de pacientes con FA, como los pacientes que se van a someter a una intervención coronaria percutánea (ICP).
En general, la evaluación del riesgo hemorrágico basada únicamente en factores de riesgo modificables es una estrategia inferior a la evaluación formal del riesgo mediante una escala de riesgo hemorrágico408–410, en la que también se tendría en cuenta la interacción entre los factores de riesgo modificables y no modificables. El riesgo hemorrágico es dinámico, y prestar atención a los cambios en el perfil de riesgo hemorrágico tiene mayor capacidad de predicción de complicaciones hemorrágicas serias que confiarse únicamente en el riesgo basal. En un estudio reciente se observó un incremento de 3,5 veces del riesgo de sangrado mayor durante los primeros 3 meses en los pacientes que tuvieron cambios en el perfil de riesgo hemorrágico389.
En el estudio mAFA-II, el uso de monitorización dinámica y prospectiva y la revaluación del riesgo mediante la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED
(además de aplicaciones informáticas para el tratamiento de la FA) se asociaron con menos complicaciones de sangrado mayor, un control más adecuado de los factores de riesgo hemorrágico modificables y un aumento de la administración de ACO; por el contrario, las tasas de hemorragias fueron más altas y el uso de ACO disminuyó en un 25% en el grupo de pacientes asignados a «atención habitual», al comparar los datos basales con los del seguimiento a los 12 meses411.10.1.3Contraindicaciones absolutas para la anticoagulación oralEntre las escasas contraindicaciones absolutas para los ACO se incluyen una hemorragia activa grave (se debe identificar y tratar la causa), las comorbilidades asociadas (p. ej., trombocitopenia grave < 50 plaquetas/μl, anemia grave en estudio, etc.) o un acontecimiento reciente con riesgo hemorrágico alto, como la hemorragia intracraneal (HIC). En estos casos se deben considerar opciones de tratamiento no farmacológico (sección 11.4.3).
10.1.4Tratamientos para la prevención del ictus10.1.4.1Antagonistas de la vitamina KComparado con controles o placebo, el tratamiento con AVK (fundamentalmente warfarina) reduce el riesgo de ictus en un 64% y la mortalidad en un 26%412 y se sigue empleando en todo el mundo para pacientes con FA. Actualmente, los AVK son el único tratamiento cuya seguridad está confirmada para los pacientes con estenosis mitral reumática o válvula cardiaca mecánica. El uso de AVK está limitado por su estrecho intervalo terapéutico, que requiere la monitorización frecuente de la INR y el ajuste de las dosis413. A intervalos de tiempo en rango terapéutico (TRT) adecuados (> 70%), los AVK son fármacos eficaces y relativamente seguros. La calidad del tratamiento con AVK (cuantificada mediante el método de Rosendaal basado en los TRT o el porcentaje de INR en rango terapéutico) se correlaciona con las tasas de eventos hemorrágicos y tromboembólicos414. A valores altos de TRT, la eficacia de los AVK para la prevención del ictus podría ser similar a la de los NAC), mientras que el beneficio relativo a la seguridad de los NACO depende menos de los TRT, y se observan constantemente menores tasas de hemorragias graves (p. ej., HIC) con NACO que con warfarina, a pesar de que la diferencia absoluta es pequeña415,416.
Numerosos factores (incluidos factores genéticos, medicación concomitante, etc.) influyen en la intensidad del efecto anticoagulante de los AVK. Los factores más comunes se usaron para formular y validar la escala SAMe-TT2R2 —sexo (mujer), edad (< 60 años), antecedente de al menos 2 comorbilidades (hipertensión, diabetes mellitus, EC/infarto de miocardio, EAP, IC, ictus previo, enfermedad pulmonar y enfermedad hepática o renal), tratamiento (interacción de fármacos como la amiodarona), tabaquismo, etnia (no caucásica)417—, que puede ayudar a identificar a los pacientes con menos probabilidades de alcanzar un buen TRT con el tratamiento con AVK (puntuación > 2) y se beneficiarían del tratamiento con NACO. Si se prescribe tratamiento con AVK a pacientes con una puntuación SAMe-TT2R2 > 2, es preciso realizar esfuerzos para mejorar el TRT, como intensificar las revisiones médicas regulares, proporcionar formación y asesoramiento y monitorizar frecuentemente la INR, o, lo que sería más conveniente, reconsiderar el uso de un NACO418.
Factores de riesgo hemorrágico en pacientes que toman ACO y tratamiento antiagregante plaquetario.
| No modificables | Potencialmente modificables | Modificables | Biomarcadores |
|---|---|---|---|
| Edad > 65 añosSangrado mayor previoInsuficiencia renal grave (diálisis o trasplante renal)Disfunción hepática grave (cirrosis)MalignidadFactores genéticos (p. ej., polimorfismos del CYP 2C9)Ictus previo, enfermedad de vasos pequeños, etc.Diabetes mellitusDeterioro cognitivo/demencia | Fragilidad extrema ± riesgo excesivo de caídasaAnemiaRecuento o función plaquetaria reducidaInsuficiencia renal con AclCr < 60 ml/minEstrategia de tratamiento con AVKb | Hipertensión/PAS elevadaTratamiento concomitante con antiagregantes plaquetarios y AINEIngesta excesiva de alcoholFalta de adherencia a los ACOProfesiones o aficiones de riesgoTratamiento puente con heparinaControl de la INR (objetivo, 2,0-3,0), objetivo de TRT > 70%cElección y dosis adecuadas de ACOd | GDF-15Cistatina C/CKD-EPIcTnT-hsFactor de von Willebrand (más otros marcadores de coagulación) |
AclCr: aclaramiento de creatinina; ACO: anticoagulantes orales; AINE: antiinflamatorios no esteroideos; AVK: antagonistas de la vitamina K; CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; cTnT-hs: troponina cardiaca T de alta sensibilidad; CYP: citocromo P; GDF-15: factor de diferenciación de crecimiento 15; INR: razón internacional normalizada; PAS: presión arterial sistólica; TRT: tiempo en rango terapéutico.
Dispositivos de ayuda para caminar; calzado adecuado; retirar de la casa objetos que representen peligro de tropiezos; evaluación neurológica cuando se estime necesario.
Factores clínicos de riesgo en la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED395.
| Factores de riesgo y definiciones | ||
|---|---|---|
| H | Hipertensión no controladaPAS > 160 mmHg | 1 |
| A | Función renal o hepática anormalDiálisis, trasplante, creatinina sérica > 200 mmol/l, cirrosis, bilirrubina > 2 veces el LSN, AST/ALT/ALP > 3 veces el LSN | 1 punto cada uno |
| S | IctusIctus isquémico o hemorrágicoa previo | 1 |
| B | Antecedente o predisposición al sangradoHemorragia mayor previa o anemia o trombocitopenia grave | 1 |
| L | INR lábilbTRT < 60% en pacientes que toman AVK | 1 |
| E | Pacientes mayoresEdad > 65 años o fragilidad extrema | 1 |
| D | Consumo de drogas o ingesta excesiva de alcoholUso concomitante de antiagregantes plaquetarios y AINE; consumo semanal de alcohol excesivoc | 1 punto cada uno |
| Puntuación máxima | 9 |
AINE: antiinflamatorios no esteroideos; ALP: fosfatasa alcalina; ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; AVK: antagonistas de la vitamina K; INR: razón internacional normalizada; LSN: límite superior de la normalidad; PAS: presión arterial sistólica; TRT: tiempo en rango terapéutico.
En 4 grandes estudios, el apixabán, el dabigatrán, el edoxabán y el rivaroxabán se demostraron no inferiores a la warfarina para la prevención de ictus/embolia sistémica419–422. En un metanálisis de estos estudios, los NACO se asociaron con reducciones significativas del 19% del riesgo de ictus/embolia sistémica, del 51% del riesgo de ictus hemorrágico423 y una reducción similar que con los AVK del riesgo de ictus isquémico, pero los NACO se asociaron con una reducción significativa del 10% de la mortalidad por todas las causas (tabla 8 del material adicional). Hubo una reducción no significativa del 14% del riesgo de sangrado mayor, una reducción significativa del 52% de HIC y un aumento del 25% de las hemorragias gastrointestinales asociadas con el tratamiento con NACO, comparados con warfarina423.
La reducción del riesgo relativo de sangrado mayor con NACO fue significativamente mayor cuando el control de la INR era inadecuado (TRT < 66% controlado en un centro de atención). Un metanálisis de 5 estudios sobre NACO (RE-LY, ROCKET-AF, J-ROCKET AF, ARISTOTLE y ENGAGE AF TIMI 48) mostró que, comparadas con warfarina, las dosis estándar de NACO fueron más efectivas y seguras en pacientes asiáticos que en no asiáticos424. En el estudio AVERROES, que incluyó a pacientes que rechazaron o no eran aptos para el tratamiento con AVK, el apixabán (5 mg/12 h) redujo significativamente el riesgo de ictus/embolia sistémica, sin una diferencia significativa en la incidencia de sangrado mayor o HIC, comparado con el AAS425.
Los datos observacionales tras la comercialización sobre la eficacia y la seguridad del dabigatrán426,427, el rivaroxabán428,429, el apixabán430 y el edoxabán431, comparados con warfarina, muestran una concordancia general con los respectivos estudios. Dada la evidencia indiscutible sobre el uso de NACO, se debe informar a los pacientes sobre esta opción de tratamiento.
La persistencia del tratamiento con NACO generalmente es mayor que la del tratamiento con AVK, debido al mejor perfil farmacocinético de los NACO432 (tabla 9 del material adicional) y al perfil favorable de seguridad y eficacia, especialmente para los pacientes vulnerables, como los de edad avanzada, con disfunción renal o ictus previo, entre otros433. Aunque se excluyó de los estudios más importantes a los pacientes con insuficiencia renal avanzada, el tratamiento con dosis reducidas de rivaroxabán, edoxabán o apixabán es una opción viable para pacientes con ERC grave (AclCr 15-30ml/min mediante la ecuación Cockcroft-Gault)434,435. Teniendo en cuenta que en la práctica clínica frecuentemente se reducen las dosis de manera inadecuada436, por lo que aumenta el riesgo de ictus/embolia sistémica, hospitalización y muerte pero no disminuye el riesgo hemorrágico437, se debe optimizar el tratamiento con NACO según el perfil de eficacia y seguridad de cada fármaco para diferentes subgrupos de pacientes (tabla 11).
Criterios para la selección de la dosis de NACO.
| Dabigatrán | Rivaroxabán | Apixabán | Edoxabán | |
|---|---|---|---|---|
| Dosis estándar | 150 mg/12 h | 20 mg/24 h | 5 mg/12 h | 60 mg/24 h |
| Dosis baja | 110 mg/12 h | 30 mg/24 h | ||
| Dosis reducida | 15 mg/24 h | 2,5 mg/12 h | 30 mg/24 h o 15 mg/24 h | |
| Criterios para reducir la dosis | Dabigratán 110 mg/12 h en pacientes con:• Edad ≥ 80 años• Toma concomitante de verapamilo o• Riesgo hemorrágico aumentado | AclCr 15-49 ml/min | Al menos 2 de estos 3 criterios:• Edad ≥ 80 años• Peso corporal ≤ 60 kg o• Creatinina sérica ≥ 1,5 mg/dl (133 μmol/l) | En presencia de alguno de los siguientes:• AclCr 30-50 ml/min• Peso corporal ≤ 60 kg• Toma concomitante de verapamilo, quinidina o dronedarona |
AclCr: aclaramiento de creatinina.
Tratamiento antitrombótico tras la oclusión de la orejuela izquierda.
| Dispositivo/paciente | AAS | ACO | Clopidogrel | Comentarios |
|---|---|---|---|---|
| Watchman/riesgo hemorrágico bajo | 75-325 mg/día indefinidamente | Instaure warfarina tras el procedimiento (con INR 2-3) durante 48 días o hasta que el cierre de la OI se confirme mediante ETE. El uso de un NACO es una alternativa posible | Comience con 75 mg/día cuando se interrumpan los ACO y continúe durante 6 meses tras el procedimiento | En algunos centros no se retiran los ACO en el momento del procedimiento, pero no hay datos que justifiquen o desaconsejen esta estrategia |
| Watchman/riesgo hemorrágico alto | 75-325 mg/día indefinidamente | No | 75 mg/día durante 1-6 meses mientras se asegura el cierre de la OI* | En situaciones de riesgo alto se suele administrar clopidogrel durante periodos más cortos |
| ACP/Amulet | 75-325 mg/día indefinidamente | No | 75 mg/día durante 1-6 meses mientras se asegura el cierre de la OI* | El clopidogrel puede sustituir al AAS si se tolera mejor |
AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; ACP: AmplatzerTM Cardiac Plug; ETE: ecocardiografía transesofágica; INR: razón internacional normalizada; HBPM: heparina de bajo peso molecular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; OI: orejuela izquierda.
*Fuga < 5 mm.
En el estudio ACTIVE-W, el tratamiento antiagregante plaquetario doble (TAPD) con AAS y clopidogrel fue menos efectivo que la warfarina para la prevención del ictus, la embolia sistémica, el infarto de miocardio y la muerte vascular (el riesgo anual de eventos adversos fue del 5,6 frente al 3,9%; p = 0,0003), con una tasa similar de sangrado mayor438. En el estudio ACTIVE-A, los pacientes no aptos para tratamiento anticoagulante tuvieron una tasa de complicaciones tromboembólicas menor cuando se añadió clopidogrel al AAS, comparado con el AAS solo, pero tuvieron un aumento significativo de la tasa de sangrado mayor439. El AAS en monoterapia no fue eficaz para la prevención del ictus, comparado con la ausencia de tratamiento antitrombótico, y se asoció con un mayor riesgo de ictus isquémico en pacientes de edad avanzada440.
En general, los antiagregantes plaquetarios en monoterapia no son eficaces para la prevención del ictus y pueden ser perjudiciales (especialmente para pacientes mayores con FA)441,442, mientras que el TAPD se asocia con un riesgo hemorrágico similar al del tratamiento con ACO. Por esta razón, el tratamiento antiagregante plaquetario no se debe emplear para la prevención del ictus en pacientes con FA.
10.1.4.4Tratamiento combinado con anticoagulantes orales y antiagregantes plaquetariosLa utilización del tratamiento antiagregante plaquetario sigue siendo frecuente en la práctica clínica, a menudo para pacientes sin una indicación (p. ej., EAP, EC o enfermedad cerebral) aparte de la FA443. Los datos que respaldan el tratamiento combinado solo para la prevención del ictus en la FA son escasos y no se ha observado un efecto en la reducción de ictus, infarto de miocardio o muerte, pero sí un aumento sustancial del riesgo de sangrado mayor441,442.
10.1.4.5Oclusión y exclusión de la orejuela izquierda10.1.4.5.1.Dispositivos de oclusión de la orejuela izquierda. Solo se ha comparado el dispositivo Watchman frente al tratamiento con AVK en estudios clínicos (estudio PROTECT AF y PREVAIL)444–446, en los que la oclusión de la OI no fue inferior al tratamiento de prevención del ictus con AVK para pacientes con FA y riesgo moderado de ictus, posiblemente con una tasa de hemorragias más baja en el seguimiento a largo plazo447. La oclusión de la OI también podría reducir el riesgo de ictus en pacientes con contraindicaciones para los ACO448,449.
En un registro europeo a gran escala, se comunicaron altas tasas de éxito del implante (98%), con una tasa aceptable (4%) de complicaciones relacionadas con el procedimiento a los 30 días450. No obstante, el procedimiento de implante puede ocasionar complicaciones graves (se han comunicado tasas más altas de complicaciones en análisis de datos de la práctica clínica real, comparados con estudios promocionados por la industria, lo cual indica que podría haber sesgos en la comunicación de resultados) y la trombosis relacionada con el dispositivo no es un hallazgo benigno451–454. El tratamiento antitrombótico después de la oclusión de la OI nunca se ha investigado en estudios aleatorizados y se basa en estudios históricos que incluían como mínimo el tratamiento con AAS (tabla 12). Para pacientes que no toleran ningún tratamiento antiagregante plaquetario, el cierre percutáneo (p. ej., con el sistema Lariat) o la ligadura de la OI mediante toracoscopia podrían ser una opción455,456.
Hay que señalar que la no inferioridad de la oclusión de la OI frente al tratamiento con AVK se basó fundamentalmente en la prevención del ictus hemorrágico, aunque la tendencia al ictus isquémico fue mayor. Las limitaciones de la oclusión de la OI como estrategia para reducir el riesgo de ictus asociado con la FA incluyen también el hecho de que la FA actúa como un marcador de riesgo de ictus. La ausencia de tratamiento anticoagulante oral tras la oclusión de la OI puede resultar en el tratamiento insuficiente de otros factores de riesgo de ictus relacionados con la miocardiopatía auricular.
10.1.4.5.2. Oclusión o exclusión quirúrgica de la orejuela izquierda. Los datos de varios estudios observacionales indican que la oclusión/exclusión quirúrgica de la OI es viable y segura, aunque apenas se dispone de un escaso número de ECA457–459. El flujo residual o la oclusión incompleta de la OI pueden aumentar el riesgo de ictus460. En la mayoría de los estudios, la oclusión/exclusión de la OI se realizó durante cirugía cardiaca a corazón abierto y, más recientemente, también durante la ablación quirúrgica de la FA459,461 o como procedimiento de toracoscopia. Actualmente está en curso un ECA con pacientes que se someten a un procedimiento quirúrgico cardiaco combinado462.
En la práctica clínica, la justificación más común para la oclusión/exclusión de la OI es el alto riesgo hemorrágico percibido o, menos frecuentemente, las contraindicaciones para los ACO450. Sin embargo, los dispositivos de oclusión de la OI no se han probado de manera aleatorizada en estas poblaciones. La mayoría de los pacientes que hace años no eran candidatos a tratamiento anticoagulante con AVK, hoy parecen estar relativamente bien con el tratamiento con NACO433,463,464; además, los dispositivos de oclusión de la AI no se han comparado con el tratamiento con NACO para pacientes con riesgo hemorrágico, ni con la oclusión/exclusión quirúrgica de la OI. El tratamiento a largo plazo con AAS es una estrategia común para estos pacientes465, y si se tolera el AAS, podría cuestionarse si el uso de NACO no sería una estrategia mejor. Son necesarios estudios con suficiente potencia estadística para definir las indicaciones más adecuadas de la oclusión/exclusión de la OI, comparadas con el tratamiento con NACO, para pacientes con contraindicaciones relativas o absolutas para la anticoagulación o pacientes anticoagulados que sufren un ictus isquémico y para evaluar el tratamiento antitrombótico más adecuado después de la oclusión de la OI.
10.1.4.6Anticoagulación oral a largo plazo para la fibrilación auricularAunque el riesgo de ictus isquémico/embolia sistémica es mayor en la FA no paroxística que en la FA paroxística y la progresión de la FA se asocia con un exceso de eventos adversos169,466, el patrón clínico temporal de la FA no debe afectar a las decisiones sobre anticoagulación oral a largo plazo, la cual está determinada por la presencia de factores de riesgo de ictus156. El tratamiento de los pacientes con AHRE/FA subclínica se trata en la sección 16. El riesgo de ictus de los pacientes con AHRE puede ser menor que para los pacientes con FA diagnosticada467, y el ictus a menudo ocurre sin una relación temporal clara con los AHRE/FA subclínica179,226, por lo que se podría subestimar su papel como marcador de riesgo más que como un factor de riesgo de ictus4,172. Actualmente no está claro si los AHRE/FA subclínica tienen las mismas necesidades terapéuticas que la FA clínica7 y el beneficio clínico neto de la ACO para los AHRE/FA subclínica > 24 h se está estudiando en varios ECA4.
Los pacientes con FA subclínica/AHRE pueden sufrir taquiarritmias auriculares de más de 24 h468, por lo que se recomienda el seguimiento estrecho de estos pacientes, incluso con monitorización a distancia, especialmente en los casos de AHRE más largos y perfil de riesgo alto469. Debido a la naturaleza dinámica de la FA y el riesgo de ictus, la duración de los registros en un periodo de monitorización no tiene que ser exactamente la misma en el siguiente periodo.
10.1.4.7Anticoagulación oral a largo plazo para el control de los síntomasEl control de los síntomas se centra en estrategias para el control de la frecuencia y el ritmo cardiaco centradas en el paciente y dirigidas a los síntomas. De nuevo, la estrategia para el control de los síntomas no debe influir en las decisiones sobre la anticoagulación a largo plazo, que está determinada fundamentalmente por la presencia de factores de riesgo de ictus, y no en la previsión de mantener el ritmo sinusal.
10.1.5Control del riesgo hemorrágico relacionado con la anticoagulación10.1.5.1Estrategias para minimizar el riesgo hemorrágicoAsegurar una buena calidad del tratamiento con AVK (TRT > 70%) y seleccionar la dosis apropiada de NACO (según los criterios de reducción de dosis especificados en el prospecto de cada fármaco) son consideraciones importantes para minimizar el riesgo hemorrágico. Como se trata en la sección 10.1.2, se debe prestar atención a los factores de riesgo hemorrágico modificables en cada contacto con el paciente, y es necesario realizar una evaluación formal del riesgo para identificar a los pacientes con riesgo hemorrágico alto que deben tener un seguimiento más estrecho y asistir antes a revisiones médicas (p. ej., a las 4 semanas en lugar de a los 4-6 meses)407. En pacientes anticoagulados, se debe evitar la administración concomitante de antiagregantes plaquetarios o antiinflamatorios no esteroideos (AINE). El riesgo hemorrágico es dinámico, por lo que prestar atención a los cambios en el perfil del riesgo hemorrágico tiene mayor capacidad de predicción de complicaciones hemorrágicas graves, especialmente durante los primeros 3 meses389.
10.1.5.2Grupos con riesgo altoAlgunas poblaciones de pacientes con FA y riesgo alto han estado insuficientemente representadas en los ECA, como los pacientes muy ancianos (edad ≥ 90 años), con deterioro cognitivo/demencia, sangrado reciente o HIC previa, insuficiencia renal avanzada, insuficiencia hepática y cáncer, entre otros. Los datos de estudios observacionales indican que estos grupos de pacientes tienen un riesgo alto de ictus y muerte y podrían beneficiarse del tratamiento con ACO.
Los pacientes con la función hepática deteriorada pueden tener un riesgo hemorrágico más alto si se los trata con AVK, y posiblemente este riesgo sea menor con NACO. Datos observacionales de pacientes con cirrosis indican que la reducción del riesgo de ictus isquémico podría compensar el riesgo hemorrágico470–472.
En pacientes con un evento hemorrágico reciente, se debe prestar atención al tratamiento de la afección que predispone al sangrado (p. ej., úlcera o pólipo sangrante en pacientes con hemorragia gastrointestinal), y reinstaurar la anticoagulación oral lo antes posible de acuerdo con la decisión de un equipo multidisciplinario. Se debe considerar la administración de ciertos fármacos, como apixabán o dabigatrán (110mg/12h), que no están asociados con un exceso de hemorragias gastrointestinales comparados con la warfarina. Cuando no se reinstaura la anticoagulación oral, el riesgo de ictus y muerte es mayor que con la reinstauración de los ACO, aunque en este caso el riesgo de recidiva hemorrágica es mayor473. De igual modo, la tromboprofilaxis en el cáncer debe ser valorada por un equipo multidisciplinario que sopese la reducción del riesgo de ictus frente al riesgo de sangrado importante, que podría depender del tipo de cáncer, la localización, la fase y el tratamiento oncológico, entre otros. La tromboprofilaxis para grupos específicos con riesgo alto se discute en profundidad en la sección 11.
10.1.6Toma de decisiones para la prevención del ictusEn cohortes poblacionales de estudios observacionales tanto el ictus como la muerte son criterios de valoración relevantes, ya que algunas muertes podrían estar causadas por ictus (dado que los criterios de valoración no se adjudican en cohortes de población y la imagen cerebral o los estudios post mórtem no son obligatorios). Dado que la anticoagulación oral reduce significativamente el riesgo de ictus (en un 64%) y la mortalidad (en un 26%) comparada con controles o placebo412, los criterios de valoración del ictus y la mortalidad son relevantes para la toma de decisiones sobre tromboprofilaxis.
El umbral para iniciar la anticoagulación oral para la prevención del ictus, sopesando la reducción del ictus isquémico frente al riesgo de HIC y CdV, se ha estimado en un 1,7%/año para la warfarina y 0,9%/año para los NACO (los datos sobre el dabigatrán se usaron para el análisis de modelos)474. El umbral para la warfarina podría ser incluso más bajo, siempre que se controle adecuadamente la anticoagulación, con un TRT medio > 70%475.
Teniendo en cuenta las limitaciones de las escalas de riesgo clínicas, la naturaleza dinámica del riesgo de ictus, el mayor riesgo de ictus y muerte de los pacientes con FA y al menos 1 factor de riesgo no relacionado con el sexo y el beneficio clínico neto de la anticoagulación oral para estos pacientes, se recomienda seguir una estrategia basada en los factores de riesgo para la prevención del ictus, más que un enfoque basado en la definición artificial de «pacientes con riesgo alto». Ya que sistemáticamente se ofrece tratamiento para la prevención del ictus, a excepción de los pacientes con riesgo bajo, se debe aplicar la escala CHA2DS2-VASc de un modo reduccionista para decidir sobre la administración de ACO476.
Por lo tanto, el primer paso en la toma de decisiones («A»: anticoagulación/prevención del ictus) es identificar a los pacientes con riesgo bajo que no requieren tratamiento antitrombótico. El segundo paso consiste en ofrecer tratamiento para la prevención del ictus (ACO) a los pacientes con al menos 1 factor de riesgo no relacionado con el sexo (la fuerza de la evidencia varía, con múltiples estudios sobre pacientes con 2 o más factores de riesgo de ictus y datos de subgrupos de pacientes de estudios clínicos/observacionales con 1 factor de riesgo de ictus no relacionado con el sexo). El paso 3 es la elección de la anticoagulación oral: un NACO (dada sus relativas eficacia, seguridad y conveniencia, estos fármacos son generalmente la primera elección de anticoagulación oral para la prevención del ictus en la FA) o un AVK (con un TRT adecuado > 70%). La estrategia en 3 pasos para la estratificación del riesgo de ictus y la toma de decisiones para la atención de pacientes con FA se ilustra en la figura 12182,477.
«A»: anticoagulación/prevención del ictus; la vía ABC de atención integrada.
ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); FA: fibrilación auricular; INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED: hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; SAMe-TT2R2: sexo (mujer), edad (< 60 años), historia médica, tratamiento, tabaquismo, raza (no caucásica) (escala); TRT: tiempo en rango terapéutico.
*Cuando se considere la administración de AVK, calcule la puntuación SAMe-TT2R2: si la puntuación es de 0-2, se puede considerar el tratamiento con AVK (p. ej., warfarina) o NACO; si la puntuación es > 2, deben planificarse revisiones periódicas, controles frecuentes de la INR y asesoramiento de los tratados con AVK con el objetivo de lograr un buen control de la anticoagulación o reconsiderar el uso de NACO en su lugar; el TRT ideal es > 70%.
Recomendaciones para la prevención de eventos tromboembólicos en la FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para la prevención del ictus en pacientes con FA que son elegibles para ACO, se recomienda el uso de un NACO en lugar de un AVK (excepto para pacientes con válvulas mecánicas o estenosis mitral de moderada a grave)423,424 | I | A |
| Para la evaluación del riesgo de ictus, se recomienda una estrategia basada en la evaluación de los factores de riesgo mediante la escala clínica CHA2DS2-VASc para identificar inicialmente a los pacientes con «riesgo de ictus bajo» (CHA2DS2-VASc de 0 puntos los varones y 1 punto las mujeres), a los que no se debe ofrecer tratamiento antitrombótico334,388 | I | A |
| Se recomienda la administración de ACO para la prevención del ictus en pacientes con FA y una puntuación CHA2DS2-VASc ≥ 2 los varones o ≥ 3 las mujeres412 | I | A |
| Se debe considerar la administración de ACO para la prevención del ictus en pacientes con FA y CHA2DS2-VASc de 1 punto los varones o 2 puntos las mujeres | ||
| El tratamiento debe ser individualizado teniendo en cuenta el beneficio clínico neto y los valores y las preferencias de los pacientes338,378,380 | IIa | B |
| Se recomienda evaluar el riesgo hemorrágico de manera estructurada mediante una escala formal de riesgo para identificar los factores de riesgo hemorrágico no modificables y tratar los factores de riesgo modificables de todos los pacientes con FA e identificar a los pacientes con un riesgo potencialmente alto para planificar con prontitud y mayor frecuencia las revisiones clínicas y el seguimiento388,395,404,406 | I | B |
| Para la evaluación formal del riesgo hemorrágico, se debe considerar el uso de la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED, que puede ayudar a mejorar los factores de riesgo modificables e identificar a los pacientes con riesgo hemorrágico alto (INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED ≥ 3) para realizar revisiones clínicas y seguimiento más tempranos y frecuentes388,395,404,406 | IIa | B |
| Se recomienda revaluar los riesgos de ictus y sangrado a intervalos regulares para informar las decisiones sobre el tratamiento (p. ej., inicio de ACO en pacientes cuyo riesgo de ictus aumenta de bajo a moderado o alto) y tratar factores de riesgo hemorrágico potencialmente modificablesc,389,478,479 | I | B |
| En pacientes con FA y riesgo de ictus inicialmente bajo, la primera reevaluación del riesgo de ictus debe realizarse a los 4-6 meses de la evaluación índice385–387 | IIa | B |
| Cuando se administre un AVK, se recomienda un INR de 2,0-3,0, con un TRT individual ≥ 70%414 | I | B |
| Para pacientes tratados con AVK y con un TRT corto (p. ej., TRT < 70%), las opciones recomendadas son: | ||
| • Cambiar a un NACO, siempre que se asegure una buena adherencia y continuidad del tratamiento415,416 o | I | B |
| • Realizar esfuerzos para mejorar el TRT (p. ej., instruyendo y asesorando al paciente, con controles más frecuentes de la INR)480 | IIa | B |
| El tratamiento antiagregante plaquetario solo (monoterapia o AAS combinado con clopidogrel) no está recomendado para la prevención del ictus en la FA440,441,480,481 | III | A |
| En ausencia de contraindicaciones absolutas para los ACO, el riesgo hemorrágico estimado no debe guiar por sí solo las decisiones sobre el uso de ACO para la prevención del ictus | III | A |
| El patrón clínico de la FA (diagnosticada por primera vez, paroxística, persistente, persistente de larga duración o permanente) no debe condicionar la indicación de tromboprofilaxis160 | III | |
| Recomendaciones para la oclusión o exclusión de la OI | ||
| Puede considerarse la oclusión de la OI para la prevención del ictus en pacientes con FA y contraindicaciones a la anticoagulación oral indefinidamente (p. ej., HIC sin una causa reversible)448,449,481,482 | IIb | B |
| Puede considerarse la oclusión o exclusión quirúrgica de la OI para la prevención del ictus en pacientes con FA programados para cirugía cardiaca459,483 | IIb | C |
AAS: ácido acetilsalicílico; ACO: anticoagulantes orales; AINE: antiinflamatorios no esteroideos; AVK: antagonistas de la vitamina K; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); FA: fibrilación auricular; INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedente o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; OI: orejuela izquierda; PA: presión arterial; TRT: tiempo en rango terapéutico.
Se incluye la PA no controlada, la INR lábil (en pacientes tratados con AVK), el consumo excesivo de alcohol, la toma concomitante de AINE o AAS por pacientes anticoagulados, la tendencia o predisposición a las hemorragias (p. ej., tratar la úlcera gástrica, optimizar la función renal o hepática, etc.).
El control de la frecuencia cardiaca forma parte del tratamiento integral de la FA y a menudo es suficiente para mejorar los síntomas relacionados con esta enfermedad. Son escasos los datos que permitan establecer el tipo y la intensidad del tratamiento más adecuados para el control de la frecuencia cardiaca484–486.
10.2.1.1Intervalo óptimo (o deseable) de la frecuencia ventricularNo está claro el objetivo óptimo para la frecuencia cardiaca en pacientes con FA. En el estudio RACE II, que incluyó a pacientes con FA permanente, no se observó ninguna diferencia en la variable principal compuesta por eventos clínicos, clase funcional de la New York Heart Association (NYHA) o ingresos hospitalarios entre el grupo asignado a control estricto de la frecuencia cardiaca (objetivo < 80 lpm en reposo y < 110 lpm durante ejercicio moderado) y el grupo asignado a un control más permisivo (objetivo < 110 lpm)487,488; estos hallazgos son similares a los de un análisis de los estudios AFFIRM y RACE489. Por lo tanto, el control menos estricto de la frecuencia cardiaca es una estrategia inicial aceptable, independientemente del estado de la IC (a excepción de la miocardiopatía inducida por taquicardia), siempre que los síntomas no requieran un control más estricto de la frecuencia cardiaca (figura 13).
Estrategia general para el control de la frecuencia cardiaca490. BV: biventricular; ECG: electrocardiograma; FA: fibrilación auricular; NAV: nódulo auriculoventricular; RS: ritmo sinusal; TRC: terapia de resincronización cardiaca; TRC-D: terapia de resincronización cardiaca con desfibrilador; TRC-MP: terapia de resincronización cardiaca con marcapasos; VI: ventrículo izquierdo.
El control farmacológico de la frecuencia cardiaca se puede lograr con bloqueadores beta, digoxina, diltiazem y verapamilo, o con tratamiento combinado (tabla 13). Algunos FAA también pueden limitar la frecuencia (p. ej., amiodarona, dronedarona, sotalol), pero generalmente solo se deben emplear para el control del ritmo. La elección de fármacos para controlar la frecuencia cardiaca depende de los síntomas, las comorbilidades y los efectos secundarios potenciales (tabla 13).
Bloqueadores beta. Suelen ser fármacos de primera línea para el control de la frecuencia cardiaca, en gran medida por su efecto de control inmediato. Curiosamente, el beneficio pronóstico de los bloqueadores beta observado en pacientes con IC y fracción de eyección reducida (IC-FEr) y ritmo sinusal se ha cuestionado en pacientes con FA491.
Bloqueadores de los canales del calcio no dihidropiridínicos (BCC no DHP). El verapamilo y el diltiazem proporcionan un control razonable de la frecuencia cardiaca492 y pueden mejorar los síntomas relacionados con la FA486 comparados con los bloqueadores beta. En un pequeño estudio de pacientes con FEVI conservada, los BCC no DHP mantuvieron la capacidad de ejercicio y redujeron las concentraciones de péptido natriurético cerebral493,494.
Digoxina y digitoxina. No son efectivas para pacientes con un aumento de la actividad simpática. Estudios observacionales asociaron el uso de digoxina con un exceso de mortalidad en pacientes con FA495–497. Este hallazgo probablemente se deba a sesgos en la selección y la prescripción del tratamiento, más que a un efecto perjudicial de la digoxina498–501, especialmente si se tiene en cuenta que a menudo la digoxina se administra a pacientes más enfermos502. Las dosis bajas de digoxina se podrían asociar con un mejor pronóstico502. Actualmente está en desarrollo un ECA sobre el uso de digoxina en pacientes con IC-FEr503.
Amiodarona. Puede ser útil como último recurso cuando no se pueda controlar la frecuencia cardiaca con tratamiento combinado en pacientes que no son aptos para un tratamiento no farmacológico, es decir, ablación del nódulo auriculoventricular (NAV) e implante de marcapasos, y a pesar de los efectos adversos extracardiacos de este fármaco (tabla 13)504.
10.2.1.3Control agudo de la frecuencia cardiacaEn el contexto de un evento agudo, el médico debe evaluar las posibles causas subyacentes, como infección o anemia. Es preferible emplear bloqueadores beta y diltiazem o verapamilo, en lugar de digoxina, por su rápida acción y su eficacia en estados de intensa actividad simpática507–511. La elección del fármaco (tabla 13 y figura 14) y el objetivo para la frecuencia cardiaca dependerán de las características del paciente, los síntomas, la FEVI y el estado hemodinámico, aunque inicialmente un control menos intenso de la frecuencia cardiaca puede ser una opción aceptable (figura 13). En algunos casos es necesario el tratamiento combinado. Para pacientes con IC-FEr se debe emplear bloqueadores beta y digital o una combinación de ambos512,513. A los pacientes en estado crítico o con la función del VI muy deteriorada, se les puede administrar amiodarona por vía intravenosa504,514,515. Para los pacientes inestables, se debe considerar la cardioversión urgente (véase la sección 11.1).
Elección de fármacos para el control de la frecuencia cardiaca490. BCC: bloqueadores de los canales del calcio; DHP: dihidropiridinas; EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; TRC-D: terapia de resincronización cardiaca con desfibrilador; TRC-MP: terapia de resincronización cardiaca con marcapasos.
aLa revaluación clínica debe centrarse en la frecuencia cardiaca en reposo, los síntomas relacionados con la FA o el flutter auricular y la calidad de vida. En caso de control inadecuado de la frecuencia cardiaca (> 110 lpm en reposo), empeoramiento de los síntomas o de la calidad de vida, considere la administración de tratamiento de segunda línea o, si fuera preciso, de tercera línea.
bTome precauciones al iniciar el tratamiento con bloqueadores beta y BCC no dihidropiridínicos y utilice el Holter de 24h para vigilar la aparición de bradicardia.
La ablación del NAV y el implante de un marcapasos pueden controlar la frecuencia ventricular cuando fracase la medicación. El procedimiento es relativamente simple, con una tasa de complicaciones y un riesgo de muerte a largo plazo bajos516,517, especialmente cuando el marcapasos se implanta unas semanas antes de la ablación del NAV y se programa inicialmente una frecuencia de 70-90 lpm tras la ablación518,519. El procedimiento no empeora la función del VI520 e incluso podría mejorar la FEVI de algunos pacientes521–523. La mayoría de los estudios incluyeron a pacientes mayores con una esperanza de vida corta. Para pacientes más jóvenes solo se debe considerar la ablación del NAV cuando sea urgente controlar la frecuencia cardiaca y se haya valorado detenidamente todas las opciones de tratamiento farmacológico y no farmacológico. La elección de marcapasos (ventricular derecho o biventricular) dependerá de las características individuales del paciente524,525. La estimulación del haz de His tras la ablación del NAV podría llegar a ser un modo alternativo de marcapasos526, como se está probado en estudios clínicos (NCT02805465, NCT02700425).
Para pacientes muy sintomáticos con FA permanente y al menos 1 hospitalización por IC, la ablación del NAV combinada con terapia de resincronización cardiaca (TRC) puede ser una opción preferible. En un ECA de pequeñas dimensiones, la variable principal compuesta (muerte u hospitalización por IC, o empeoramiento de la IC) fue significativamente menos frecuente en el grupo asignado a ablación + TRC, comparado con el grupo de tratamiento farmacológico (p = 0,013), y los pacientes tratados con ablación + TRC mostraron una disminución del 36% de los síntomas y las limitaciones físicas al año de seguimiento (p = 0,004)527. Nueva evidencia indica que la estimulación del haz de His podría ser una alternativa para estos pacientes528.
Recomendaciones para el control de la frecuencia ventricular en pacientes con FAa
| Recomendaciones | Claseb | Nivelc |
|---|---|---|
| Se recomienda el uso de BB, diltiazem o verapamilo como fármacos de primera línea para el control de la frecuencia cardiaca de pacientes con FA y FEVI ≥ 40%492,507,511,529 | I | B |
| Los BB y la digoxina están recomendados para el control de la frecuencia cardiaca de pacientes con FA y FEVI < 40%486,491,502,512,530–532 | I | B |
| Se debe considerar el tratamiento combinado con varios fármacosd para el control de la frecuencia cardiaca si un solo fármaco no logra alcanzar el objetivo necesario533,534 | IIa | B |
| Se debe considerar una frecuencia cardiaca en reposo < 110 lpm como objetivo inicial del tratamiento de control de la frecuencia cardiaca (control menos estricto)488 | IIa | B |
| Se debe considerar la ablación del nódulo auriculoventricular para el control de la frecuencia cardiaca de los pacientes que no responden o no toleran el tratamiento intensivo para el control del ritmo y la frecuencia ni son candidatos para el control del ritmo mediante ablación de la OI, aceptando que dichos pacientes dependerán del marcapasos durante el resto de su vida516,523,535,536 | IIa | B |
| Para pacientes con inestabilidad hemodinámica o FEVI muy reducida, se puede considerar la administración intravenosa de amiodarona para el control agudo de la frecuencia cardiaca504,514,515 | IIb | B |
AI: aurícula izquierda; BB: bloqueadores beta; ECG: electrocardiograma; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo.
Véase la sección 11 sobre el control de la frecuencia ventricular en presencia de enfermedades concomitantes y diferentes poblaciones con FA.
La combinación de un BB con verapamilo o diltiazem debe realizarse con una vigilancia estricta de la frecuencia cardiaca mediante ECG de 24h para comprobar la aparición de bradicardia488.
La «estrategia para el control del ritmo» se refiere a los intentos para restaurar y mantener el ritmo sinusal y puede requerir la combinación de tratamientos, incluida la cardioversión164,234, FAA233,537,538 y ablación con catéter539–541, además de un control adecuado de la frecuencia cardiaca, tratamiento anticoagulante (sección 10.2.2.6) y profilaxis cardiovascular completa (tratamiento previo que incluya la apnea del sueño e intervenciones en el estilo de vida) (figura 15).
Estrategia para el control del ritmo. AVP: aislamiento de vena pulmonar; CdV: calidad de vida; FA: fibrilación auricular; FAA: fármaco antiarrítmico; FAP: fibrilación auricular paroxística; IVAI: índice de volumen de la aurícula izquierda; MCP: miocardiopatía; RS: ritmo sinusal.
*Considere la cardioversión para confirmar que la ausencia de síntomas no se debe a una adaptación subconsciente a una reducción de la capacidad física y mental.
Según la evidencia disponible de ECA, la indicación principal para el control del ritmo es reducir los síntomas relacionados con la FA y mejorar la CdV (figura 15). En caso de duda, un intento de restaurar el ritmo sinusal para evaluar la respuesta al tratamiento podría ser un primer paso razonable. Se debe considerar los factores que aconsejen este primer intento (figura 15)542,543.
Diagrama de flujo para la toma de decisiones sobre la cardioversión de la FA dependiendo de la presentación clínica, la aparición de FA, el tratamiento anticoagulante oral y los factores de riesgo de ictus. ACO: anticoagulante oral; AI: aurícula izquierda; AVK: antagonistas de la vitamina K; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); CVE: cardioversión eléctrica; ETE: ecocardiografía transesofágica; FA: fibrilación auricular; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; OI: orejuela izquierda; TE: tromboembolia.
Debido a que la progresión de la FA se asocia con una disminución de la CdV544 y, con el paso del tiempo, se vuelve irreversible o menos susceptible de tratamiento176, el control del ritmo puede ser una opción importante, aunque actualmente no hay evidencia firme de que con esta opción se pueda obtener un resultado diferente. Los datos publicados indican que las tasas de progresión de la FA fueron significativamente más bajas con el control del ritmo que con el control de la frecuencia cardiaca545. La edad avanzada, la FA persistente y el antecedente de ictus/AIT fueron predictores independientes de la progresión de la FA545, por lo que deben valorarse a la hora de tomar decisiones sobre la estrategia de tratamiento. Para muchos pacientes podría ser útil considerar una intervención temprana para prevenir la progresión de la FA546, además de controlar adecuadamente los factores de riesgo245. Estudios en curso con pacientes con FA sintomática de nuevo diagnóstico podrán evaluar si las intervenciones tempranas para el control del ritmo, como la ablación con catéter, pueden detener los cambios anatomopatológicos progresivos que se asocian con la FA547. Sin embargo, hay pruebas de que, al menos en algunos pacientes, una estrategia eficaz para el control del ritmo con ablación con catéter de la FA podría no tener efecto en el desarrollo de un sustrato auricular548. En 2020 se esperan los resultados del estudio EAST sobre el efecto del tratamiento precoz para el control del ritmo en las variables de valoración clínicas549.
En las estrategias para el control del ritmo, deben aplicarse las recomendaciones generales sobre la participación de los pacientes informados en la toma de decisiones conjunta (sección 9). Deben aplicarse los mismos principios para mujeres y varones con FA cuando se consideren las estrategias para el control del ritmo550.
Recomendaciones sobre el control del ritmo cardiaco
10.2.2.2Cardioversión10.2.2.2.1Cardioversión inmediata o electivaEl control agudo del ritmo se puede realizar como cardioversión urgente para pacientes hemodinámicamente inestable con FA o en situaciones no urgentes. La cardioversión eléctrica directa sincronizada es el método preferido para pacientes con FA y deterioro hemodinámico, ya que es más efectiva que la cardioversión farmacológica y revierte inmediatamente la FA a ritmo sinusal554,555. Para pacientes estables, se puede intentar tanto la cardioversión farmacológica como la eléctrica; la cardioversión farmacológica es menos efectiva pero no requiere sedación. El pretratamiento con FAA puede mejorar la eficacia de la cardioversión eléctrica electiva556. Un ECA mostró que la cardioversión con energía máxima fija fue más efectiva que la estrategia de aumento gradual de la energía557.
En un ECA, la estrategia de espera y vigilancia solo con medicación para el control de la frecuencia y cardioversión si es necesaria en las primeras 48 h de la aparición de los síntomas fue segura y no inferior a la cardioversión inmediata de la FA paroxística, que a menudo se resuelve espontáneamente en las primeras 24 h558.
La cardioversión electiva es la que se puede planificar una vez transcurridas las primeras horas. Datos observacionales243 muestran que la cardioversión no mejoró la CdV relacionada con la FA ni logró detener la progresión de la FA, aunque muchos de estos pacientes no recibieron tratamiento adyuvantes para el control del ritmo243. En otros estudios se observó una mejoría significativa de la CdV de los pacientes que se mantuvieron en ritmo sinusal después de la cardioversión eléctrica, y la única variable que se asoció de manera independiente con un efecto moderado o alto fue el ritmo sinusal a los 3 meses232.
Los factores que se asocian con un aumento del riesgo de recurrencia de la FA tras la cardioversión electiva son la edad avanzada, el sexo femenino, la cardioversión previa, la enfermedad pulmonar obstructiva crónica (EPOC), la insuficiencia renal, la cardiopatía estructural, un mayor índice de volumen de la AI e IC164,559,560. Antes de la cardioversión, se debe considerar el tratamiento de entidades potencialmente modificables para facilitar el mantenimiento del ritmo sinusal (figura 15)245. En caso de recurrencia de la FA tras la cardioversión en pacientes con FA persistente, se podría repetir precozmente el procedimiento de cardioversión para prolongar el mantenimiento del ritmo sinusal561.
La cardioversión no urgente está contraindicada en caso de presencia confirmada de trombos en la AI. Se debe evaluar el riesgo tromboembólico periprocedimiento y considerar la administración de ACO periprocedimiento y a largo plazo independientemente del modo de cardioversión (farmacológica o eléctrica) (sección 10.2.2.6). La figura 16 muestra un diagrama de flujo para la toma de decisiones sobre la cardioversión.
10.2.2.2.2Cardioversión eléctricaLa cardioversión eléctrica se puede realizar con seguridad en pacientes sedados en tratamiento con midazolam o propofol o etomidato intravenosos562. Durante el procedimiento se debe monitorizar la presión arterial y usar oximetría sistemáticamente. En algunas ocasiones se producen quemaduras cutáneas. Se debe disponer de atropina o isoproterenol intravenosos, o marcapasos transcutáneo temporal, en caso de que aparezca bradicardia después de la cardioversión. Los desfibriladores bifásicos son los más empleados porque son más eficaces que los monofásicos563,564. La posición anteroposterior del electrodo restaura más eficazmente el ritmo sinusal554,555, aunque otros informes indican que su posición específica no es importante para el éxito de la cardioversión565.
10.2.2.2.3Cardioversión farmacológica (incluida la estrategia de «pastilla en el bolsillo»)La cardioversión farmacológica a ritmo sinusal es un procedimiento electivo indicado para pacientes hemodinámicamente estables. Su verdadera eficacia está influida por la restauración espontánea a ritmo sinusal en las primeras 48 h de la hospitalización en el 76-83% de los pacientes con FA de reciente aparición (un 10-18% en las primeras 3 h, un 55-66% en las primeras 24 h y un 69% en las primeras 48 h)566–568. Por lo tanto, la estrategia de «esperar y vigilar» (normalmente menos de 24 h) se puede considerar una alternativa a la cardioversión temprana para pacientes con FA de nueva aparición558.
La elección de un fármaco específico se basa en el tipo y la gravedad de las cardiopatías asociadas (tabla 14), y la cardioversión farmacológica es más efectiva en la FA de reciente aparición. La flecainida y otros fármacos de clase Ic, indicados para pacientes sin hipertrofia del VI (HVI) significativa, disfunción sistólica del VI o cardiopatía isquémica, restaura el ritmo sinusal de inmediato (3-5 h) y con seguridad569 en más del 50% de los pacientes570–574, mientras que la amiodarona intravenosa, indicada fundamentalmente para pacientes con IC, tiene un efecto limitado y más tardío, aunque puede reducir la frecuencia cardiaca en las primeras 12 h570,575–577. El vernakalant intravenoso es el fármaco con un efecto de cardioversión más rápido, incluso para pacientes con IC leve o cardiopatía isquémica, y es más efectivo que la amiodarona578–583 o la flecainida584. La dofetilida no se usa en Europa y escasamente fuera de ella. La ibutilida es efectiva para revertir el flutter auricular a ritmo sinusal585.
Fármacos para el control de la frecuencia cardiaca en la FAa
| Administración intravenosa | Dosis oral normal de mantenimiento | Contraindicaciones | |
|---|---|---|---|
| Bloqueadores betab | |||
| Metoprolol tartrato | 2,5-5 mg en bolo intravenoso; hasta 4 dosis | 25-100 mg/12 h | En caso de asma, use un BB-1 selectivoContraindicados en caso de ICA y antecedente de broncoespasmo grave |
| Metoprolol XL (succinato) | No disponible | 50-400 mg/24 h | |
| Bisoprolol | No disponible | 1,25-20 mg/24 h | |
| Atenololc | No disponible | 25-100 mg/24 h | |
| Esmolol | 500μg/kg en bolo intravenoso durante 1 min, seguido de 50-300μg/kg/min | No disponible | |
| Landiolol | 100μg/kg en bolo intravenoso durante 1 min, seguido de 10-40μg/kg/min505 | No disponible | |
| Nebivolol | No disponible | 2,5-10 mg/24 h | |
| Carvedilol | No disponible | 3,125-50 mg/12 h | |
| Bloqueadores de los canales del calcio no dihidropiridínicos | |||
| Verapamilo | 2,5-10 mg en bolo intravenoso durante 5 min | 40 mg/12 h o 480 mg/24 h (preparados de liberación lenta) | Contraindicados en la IC-FErAdapte la dosis en caso de insuficiencia renal o hepática |
| Diltiazem | 0,25 mg/kg en bolo intravenoso durante 5 min, seguido de 5-15 mg/h | 60 mg/8 h o 360 mg/24 h (preparados de liberación lenta) | |
| Glucósidos cardiacos | |||
| Digoxina | 0,5 mg en bolo intravenoso (0,75-1,5 mg en dosis divididas en 24 h) | 0,0625-0,25 mg/24 h | Las concentraciones plasmáticas elevadas se asocian con un aumento de la mortalidadCompruebe la función renal antes de iniciar el tratamiento y adapte la dosis de los pacientes con ERC |
| Digitoxina | 0,4-0,6 mg | 0,05-0,1 mg/24 h | Las concentraciones plasmáticas elevadas se asocian con un aumento de la mortalidad |
| Otros | |||
| Amiodarona | 300 mg por vía intravenosa diluida en 250 ml de solución con dextrosa al 5% durante 30-60 min (preferiblemente mediante cánula venosa central), seguida de 900-1.200 mg por vía intravenosa durante 24 h diluida en 500-1.000 ml, mediante cánula venosa central | 200 mg/24 h tras la dosis de carga3 × 200 mg/día durante 4 semanas; después, 200 mg al día536,d (si fuera necesario, reduzca la dosis de otros fármacos para el control de la frecuencia cardiaca) | En caso de enfermedad tiroidea, solo se debe emplear si no hay otras opciones |
BB: bloqueador beta; ERC: enfermedad renal crónica; FA: fibrilación auricular; ICA: insuficiencia cardiaca aguda; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida.
Todos los fármacos para el control de la frecuencia cardiaca están contraindicados en el síndrome de Wolff-Parkinson-White, incluida la amiodarona intravenosa.
Fármacos antiarrítmicos para restaurar el ritmo sinusal.
| Fármacos antiarrítmicos empleados para restaurar el ritmo sinusal (cardioversión farmacológica) | |||||
|---|---|---|---|---|---|
| Fármaco | Vía de administración | Dosis inicial para la cardioversión | Dosis adicionales para la cardioversión | Tasa de éxito agudo y tiempo estimado hasta ritmo sinusal | Contraindicaciones, precauciones y comentarios |
| Flecainidaa | OralbIntravenosa | 200-300 mg2 mg/kg durante 10 min | - | Total: 59-78% (el 51% a las 3 h, el 72% a las 8 h) | No debe emplearse en la cardiopatía isquémica ni en la cardiopatía estructural significativaPuede inducir hipotensión, flutter auricular con conducción 1:1 (en el 3,5-5,0% de los pacientes)La flecainida puede inducir una leve prolongación del complejo QRSNO debe emplearse para la cardioversión farmacológica del flutter auricular |
| Propafenonaa | OralbIntravenosa | 450-600 mg1,5-2 mg/kg durante 10 min | - | Oral: un 45-55% a las 3 h, un 69-78% a las 8 h;Intravenosa: un 43-89% hasta 6 h | |
| Vernakalantc | Intravenosa | 3 mg/kg durante 10 min | 2 mg/kg durante 10 min (10-15 min después de la dosis inicial) | < 1 h (conversión del 50% durante los primeros 10 min) | No debe emplearse en pacientes con hipotensión arterial (PAS < 100 mmHg), SCA reciente (hasta 1 mes), insuficiencia cardiaca en NYHA III-IV, prolongación del intervalo QT o estenosis aórtica gravePuede causar hipotensión arterial, prolongación del intervalo QT y del complejo QRS o taquicardias ventriculares no sostenidas |
| Amiodaronaa | Intravenosa | 5-7 mg/kg durante 1-2 h | 50 mg/h (máximo, 1,2 g en 24 h) | 44% (de 8-12 h a varios días) | Puede causar flebitis (use una vena periférica grande, evite la administración intravenosa > 24 h y use preferiblemente una bomba de infusión volumétrica)Puede causar hipotensión, bradicardia o bloqueo auriculoventricular y prolongación del intervalo QTEn pacientes con hipertiroidismo, solo debe emplearse si no hay otras opciones (riesgo de tirotoxicosis) |
| Ibutilidac | Intravenosa | 1 mg durante 10 min0,01 mg/kg para peso corporal < 60 kg | 1 mg durante 10 min (10-20 min después de la dosis inicial) | 31-51% (FA)63-73% (flutter auricular)≈ 1 h | Efectiva para la conversión del flutter auricularNo debe emplearse para pacientes con prolongación del intervalo QT, hipertrofia del VI o FEVI bajaDebe emplearse en el contexto de unidades de cuidados cardiacos, ya que puede causar prolongación del intervalo QT, taquicardias ventriculares polimórficas (torsades de pointes)Monitorización electrocardiográfica durante al menos 4 h tras su administración para detectar posibles complicaciones proarrítmicas |
AclCr: aclaramiento de creatinina; AVK: antagonistas de la vitamina K; CYP2D6: citocromo P450 2D6; ECG: electrocardiograma; EHRA: European Heart Rhythm Association; FA: fibrilación auricular; FAA: fármaco antiarrítmico; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; MCH: miocardiopatía hipertrófica; NYHA: New York Heart Association; PAS: presión arterial sistólica; SA: sinoauricular; SCA: síndrome coronario agudo; VI: ventrículo izquierdo.
En casos seleccionados de pacientes ambulatorios, se puede autoadministrar como parte de la estrategia de «pastilla en el bolsillo».
No está disponible en algunos países.
Para más información sobre las propiedades farmacocinéticas o farmacodinámicas, consulte el documento EHRA AADs-clinical use and clinical decision making: a consensus document568.
Para algunos pacientes ambulatorios con escasos episodios de FA paroxística, la autoadministración de una dosis oral de flecainida o propafenona es ligeramente menos efectiva que la cardioversión farmacológica en el hospital, pero puede ser una opción preferible (permite la cardioversión precoz), siempre que la seguridad y la eficacia del fármaco se hayan evaluado en un contexto hospitalario586. Se debe administrar un bloqueador del NAV a los pacientes tratados con FAA de clase Ic (especialmente flecainida) para evitar la conversión a flutter auricular con conducción 1:1587.
10.2.2.2.4Seguimiento después de la cardioversiónLos objetivos del seguimiento después de la cardioversión se resumen en la tabla 15. Es importante buscar un equilibrio entre los síntomas y los efectos secundarios de los FAA cuando se evalúa la eficacia de la estrategia para el control del ritmo. Tras la cardioversión, los pacientes deben acudir a revisión médica para que se valore la necesidad de un tratamiento alternativo para el control del ritmo, incluida la ablación con catéter de la FA, o una estrategia para el control de la frecuencia cardiaca, en lugar del tratamiento en curso.
Objetivos del seguimiento tras la cardioversión de la FA.
| Objetivos |
|---|
| Detección temprana de recurrencias de la FA mediante registros de ECG tras la cardioversión |
| Evaluación de la eficacia del control del ritmo mediante la evaluación de los síntomas |
| Monitorización del riesgo de proarritmia mediante el control regular de los intervalos PR, QRS y QTc de los pacientes tratados con FAA de clase I o III |
| Evaluación del balance entre síntomas y efectos secundarios del tratamiento teniendo en cuenta la CdV y los síntomas |
| Evaluación de la morbilidad relacionada con la FA y los efectos secundarios de los FAA en enfermedades cardiovasculares concomitantes y la función del VI |
| Optimización de las condiciones para mantener el ritmo sinusal, entre las que se incluye el control del riesgo cardiovascular (control de la PA, tratamiento de la IC, aumento de la capacidad cardiorrespiratoria y otras medidas; véase la sección 11) |
CdV: calidad de vida; ECG: electrocardiograma; FA: fibrilación auricular; FAA: fármacos antiarrítmicos; IC: insuficiencia cardiaca; PA: presión arterial; VI: ventrículo izquierdo.
Complicaciones relacionadas con el procedimiento de ablación con catéter o ablación toracoscópica de la FA771.
| Gravedad de la complicación | Tipo de complicación | Tasa de complicaciones | |
|---|---|---|---|
| Ablación con catéter | Ablación toracoscópica | ||
| Complicaciones con riesgo vital | Muerte periprocedimiento | < 0,1% | < 0,1% |
| Perforación o fístula esofágica | < 0,5% | N/D | |
| Evento tromboembólico periprocedimiento | < 1,0% | < 1,5% | |
| Taponamiento cardiaco | ≈ 1% | < 1,0% | |
| Complicaciones graves | Estenosis de venas pulmonares | < 1,0% | N/D |
| Parálisis permanente del nervio frénico | < 1,0% | N/D | |
| Complicaciones vasculares | 2-4% | N/D | |
| Conversión a esternotomía | N/D | < 1,7% | |
| Neumotórax | N/D | < 6,5% | |
| Complicaciones moderadas o leves | Varias | 1-2% | 1-3% |
| Complicaciones de relevancia desconocida | Embolia cerebral asintomática | 5-15% | N/D |
N/D: no disponible.
Recomendaciones sobre cardioversión
| Recomendaciones | Clasea | Nivelb |
| Para la cardioversión farmacológica de la FA de reciente aparición, se recomienda el vernakalant intravenoso (excluidos los pacientes con SCA reciente o insuficiencia cardiaca grave) o flecainida o propafenona (excluidos los pacientes con cardiopatía estructural grave)569,573,579,582,588–590 | I | A |
| Se recomienda la amiodarona intravenosa para la cardioversión de la FA de pacientes con insuficiencia cardiaca o cardiopatía estructural si el retraso de la cardioversión está justificado por la situación clínica515,591,592 | I | A |
| Se recomienda la cardioversión de la FA (eléctrica o farmacológica) como parte del tratamiento de control del ritmo cardiaco para pacientes sintomáticos con FA persistente232,233,593,594 | I | B |
| La cardioversión farmacológica de la FA está indicada solo para pacientes hemodinámicamente estables tras considerar el riesgo tromboembólico595 | I | B |
| Debe considerarse el pretratamiento con amiodarona, flecainida, ibutilida o propafenona para facilitar el éxito de la cardioversión eléctrica556,596–599 | IIa | B |
| Para pacientes seleccionados con FA poco frecuente o de nueva aparición, sin enfermedad estructural o cardiopatía isquémica significativas, se debe considerar la autoadministración de una sola dosis oral de flecainida o propafenona (estrategia «pastilla en el bolsillo») para la cardioversión aplicada por el paciente, tras haber evaluado su eficacia y su seguridad574,586,600,601 | IIa | B |
| En pacientes con síndrome de seno enfermo, alteraciones de la conducción auriculoventricular o prolongación del intervalo QTc (> 500 ms), no se debe intentar la cardioversión farmacológica a no ser que se haya considerado el riesgo de proarritmia y bradicardia | III | C |
FA: fibrilación auricular; QTc: intervalo QT corregido; SCA: síndrome coronario agudo.
Nota: para la cardioversión en distintas entidades y poblaciones con FA, consulte la sección 11.
La ablación con catéter de la FA es un tratamiento bien establecido para la prevención de las recurrencias de la FA1,602–604. Cuando la realizan operadores adecuadamente entrenados, la ablación con catéter de la FA es un procedimiento seguro y una alternativa superior al tratamiento con FAA para mantener el ritmo sinusal y mejorar los síntomas165,235–242,246,247,605–618. Se aconseja discutir la eficacia y las tasas de complicaciones de la ablación con catéter de la FA y del tratamiento con FAA con los pacientes cuando se haya seleccionado el tratamiento para el control del ritmo a largo plazo.
10.2.2.3.1IndicacionesEn esta sección se presentan las indicaciones para la ablación con catéter de la FA paroxística y persistente en pacientes con o sin factores de riesgo de recurrencia de la FA después de la ablación. Se ha omitido la diferenciación entre FA persistente y persistente de larga duración, ya que esta última solo expresa una duración de la FA persistente superior a un punto de corte arbitrario y artificial de 12 meses. La importancia de este punto de corte como medida aislada no se ha probado nunca.
Se han identificado factores de riesgo de recurrencia de la FA tras la ablación con catéter, entre los que se incluyen el tamaño de la AI, la duración de la FA, la edad del paciente, la disfunción renal y la visualización del sustrato mediante RM619–625. Recientemente, varias revisiones sistemáticas de modelos de predicción de recurrencia de la FA tras la ablación con catéter mostraron los beneficios potenciales de la predicción del riesgo, aunque sería deseable una evaluación más profunda de dichos modelos167,626. Las variables del modelo pueden medirse antes de la ablación y utilizarlas para predecir la probabilidad de recurrencias627–635. Sin embargo, ninguna escala se ha demostrado de manera constante superior a otras. Por lo tanto, para mejorar y refinar la indicación de ablación para pacientes con FA persistente y factores de riesgo de recurrencia, deben tenerse en cuenta los factores de riesgo más ampliamente evaluados (incluida la duración de la FA), ajustándolos a la situación individual de los pacientes y sus preferencias. Además, los pacientes deben recibir información explícita sobre la importancia del tratamiento de los factores de riesgo modificables para reducir el riesgo de recurrencias de la FA621,636–652.
Las indicaciones para la ablación con catéter de la FA se resumen en la figura 17. La ablación con catéter de la FA es efectiva para mantener el ritmo sinusal en pacientes con FA paroxística o persistente165,235–242,605–616. El beneficio clínico más importante de la ablación con catéter de la FA es la reducción de los síntomas relacionados con la arritmia246,247,603,604,607,617,653,654. Esto se ha confirmado en un ECA reciente que muestra que la mejora de la CdV fue significativamente superior en el grupo de ablación que en el grupo de tratamiento farmacológico, al igual que la reducción de la carga que conlleva la FA246. La mejoría de los síntomas también se observó recientemente en otro ECA, el estudio CABANA655, pero la ablación con catéter no redujo significativamente la variable principal compuesta de muerte, ictus discapacitante, sangrado mayor o parada cardiaca, comparada con el tratamiento farmacológico617. Debido a que hasta el momento ningún ECA ha demostrado que la ablación con catéter se asocie con una reducción significativa de la mortalidad por todas las causas, ictus o sangrado mayor en la población «general» con FA, las indicaciones del procedimiento no van más allá del alivio de los síntomas617, y generalmente no está indicada para pacientes asintomáticos. Se espera que el estudio EAST aporte información importante sobre el impacto de la ablación con catéter en los eventos cardiovasculares656.
Indicaciones para la ablación con catéter de la FA sintomática. Las flechas que van desde los FAA a la ablación indican que fracasó el tratamiento farmacológico. AI: aurícula izquierda; FA: fibrilación auricular; FAA: fármaco antiarrítmico; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida.
aAumento significativo del volumen de la AI, edad avanzada, FA de larga duración, disfunción renal y otros riesgos cardiovasculares.
bEn algunas circunstancias individuales excepcionales, se puede valorar con precaución la ablación con catéter como primera línea de tratamiento.
cRecomendada para revertir la disfunción del VI cuando la taquimiocardiopatía sea altamente probable.
dPara mejorar la supervivencia y reducir las hospitalizaciones.
Dos ECA mostraron una reducción de la mortalidad por todas las causas y las hospitalizaciones con la ablación con catéter en pacientes con IC-FEr611,657, aunque la combinación de mortalidad y hospitalización por IC solo fue la variable principal de valoración en el estudio CASTLE-AF657. La generalización de los resultados del estudio se ha evaluado recientemente en una gran población de pacientes con IC658. El análisis mostró que solo unos pocos pacientes (< 10%) cumplían los criterios de inclusión y que los pacientes que los cumplían en el CASTLE-AF obtuvieron un beneficio significativo por el tratamiento, como se demostró en el estudio658. En el estudio AMICA, de menor dimensión y que incluyó a pacientes con IC-FEr más avanzada, no se observó un beneficio con la ablación con catéter de la FA al año de seguimiento659, mientras que un análisis de subgrupos del estudio CABANA confirma los beneficios de la ablación con catéter de la FA para pacientes con IC-FEr, con una reducción significativa de la variable principal combinada (muerte, ictus, hemorragia, parada cardiaca) y de la mortalidad en el grupo asignado a ablación617,660. En general, la ablación con catéter en pacientes con IC-FEr se asocia con tasas más altas de mantenimiento del ritmo sinusal y mejoría de la FEVI, la capacidad de ejercicio y la CdV, comparada con el tratamiento con FAA y el control de la frecuencia cardiaca611,657,661–671. Por todo ello, se debe considerar la ablación para pacientes con IC-FEr candidatos a tratamiento para el control del ritmo para mejorar la CdV y la función del VI, reducir las hospitalizaciones por IC y, potencialmente, la mortalidad.
Cuando se sospecha miocardiopatía inducida por taquicardia mediada por FA (disfunción ventricular secundaria a la contracción miocárdica rápida, asíncrona o irregular revertida total o parcialmente tras el tratamiento de la arritmia causante), la ablación con catéter de la FA está recomendada para restaurar la función del VI672–676.
En general, la ablación está recomendada como tratamiento de segunda línea tras el fracaso del tratamiento con FAA de clase I o III (o intolerancia). Esta recomendación se basa en los resultados de múltiples ECA que muestran la superioridad de la ablación con catéter de la FA frente a los FAA en cuanto a la ausencia de recurrencias de la arritmia y mejoría de los síntomas, la capacidad de ejercicio y la CdV tras el fracaso de la medicación235–239,246,247,605–607,609,611,613–617.
Los estudios que evalúan la indicación de ablación con catéter de la FA antes de la administración de FAA señalan que la ablación es más efectiva para mantener el ritmo sinusal, con tasas de complicaciones comparables si se realiza en centros con experiencia240–242,614. El seguimiento a los 5 años del estudio MANTRA-PAF mostró una carga de FA significativamente menor en el grupo de ablación que, sin embargo, no se tradujo en una mejora de la CdV comparada con el tratamiento con FAA615, mientras que el estudio CAPTAF mostró que, en pacientes con FA que no tomaron FAA de clase I o III, la mayor mejora de la CdV en el grupo de ablación se asoció directamente con una mayor reducción de la carga de la FA respecto al grupo asignado a FAA246. Con base en los resultados de estos estudios y en las preferencias de los pacientes, se debe considerar la ablación con catéter de la FA antes de intentar el tratamiento con FAA para pacientes con episodios de FA paroxística (clase IIa) o podría considerarse para pacientes con FA persistente sin factores de riesgo de recurrencia (clase IIb).
10.2.2.3.2Técnicas y tecnologíaLa piedra angular de la ablación con catéter de la FA es el aislamiento completo de las venas pulmonares mediante la ablación secuencial con radiofrecuencia («punto por punto») alrededor de la unión venoauricular (antro) o con dispositivos de una sola descarga235,237,239,607–609,612,613,654,677–686. Por desgracia, es difícil lograr que persista el aislamiento eléctrico de las venas pulmonares (las tasas de reconexión de las venas pulmonares que se han publicado son > 70%683,687–697, pero podrían ser significativamente más bajas con los nuevos catéteres de última generación)698–700.
Se ha defendido la ablación más extensa, particularmente para pacientes con FA persistente o persistente de larga duración. Estos procedimientos pueden incluir la creación de lesiones lineales en las aurículas, el aislamiento de la OI o de la vena cava superior, la ablación de electrogramas fraccionados complejos, rotores, focos no pulmonares o plexos ganglionares, el voltaje guiado por fibrosis o mapeo mediante RM, o la ablación de zonas de frecuencia dominante alta701–710. Sin embargo, no se ha confirmado todavía su beneficio adicional, que justificaría su uso en el primer procedimiento, comparado con el aislamiento de venas pulmonares (AVP)677,680,711–730. Los datos de un ECA muestran mejores resultados con la ablación de focos extrapulmonares (particularmente la OI) y la ablación selectiva de áreas de bajo voltaje como complemento al AVP708,725. Para pacientes con flutter documentado dependiente del istmo cavotricuspídeo (ICT) que se van a someter a ablación con catéter de la FA, se puede considerar la ablación del istmo derecho731–734. En caso de taquicardia auricular no dependiente del ICT, la técnica de ablación depende del mecanismo subyacente y del foco o circuito de la taquicardia1,614.
Varios ECA y estudios observacionales compararon la ablación «punto por punto» con radiofrecuencia y la ablación con criobalón, mayoritariamente en el primer procedimiento para la FA paroxística612,681,735–755. La supervivencia libre de arritmias y la tasa de complicaciones fueron similares con ambas técnicas, con una duración ligeramente más corta pero más tiempo de fluoroscopia en los procedimientos de ablación con criobalón612,681,735–755. No obstante, algunos estudios mostraron tasas más bajas de hospitalización y complicaciones con la ablación con criobalón746,756,757. La elección de la fuente de energía depende de la disponibilidad en el centro, la preferencia o la experiencia del operador y la preferencia del paciente. Se han desarrollado nuevos diseños de catéter y fuentes de energía para simplificar los procedimientos de ablación y mejorar los resultados613,755,758–761, pero son necesarios más datos para cambiar las recomendaciones actuales.
10.2.2.3.3ComplicacionesDatos de registros prospectivos muestran que aproximadamente el 4-14% de los pacientes sometidos a ablación con catéter tienen complicaciones, de las que el 2-3% son potencialmente mortales602–604,762–765. En el reciente estudio CABANA, que se desarrolló fundamentalmente en centros con alto volumen y experiencia, las complicaciones ocurrieron en la banda inferior de estas tasas617. Generalmente las complicaciones aparecen en las primeras 24 h tras el procedimiento, pero algunas pueden ocurrir hasta 1-2 meses después de la ablación1,602–604 (tabla 16 de este documento y tabla 10 del material adicional). La muerte periprocedimiento es muy infrecuente (< 0,2%) y suele estar relacionada con taponamiento cardiaco603,604,766–770.
10.2.2.3.4Resultado de la ablación con catéter e impacto de los factores de riesgo modificablesNumerosos ECA que compararon el tratamiento con FAA frente a la ablación con catéter mediante distintas técnicas y fuentes de energía, como tratamiento de primera línea o tras el fracaso del tratamiento con FAA, mostraron la superioridad de la ablación con catéter para la supervivencia libre de arritmias165,235–242,605–616. Sin embargo, muchos pacientes tienen que someterse a varios procedimientos y las recurrencias tardías no son raras248,639,772–780.
Los resultados clave son la CdV, la IC, el ictus y la mortalidad539–541,608,781,782. En varios estudios y metanálisis, la ablación con catéter de la FA comparada con el tratamiento con FAA se asoció con una mejoría significativa y persistente de la CdV1,235,239–242,246,247,539–541,783,784. Hasta la fecha, no se ha realizado ningún estudio lo bastante grande para evaluar adecuadamente la reducción del ictus mediante la ablación con catéter.
Varios factores, incluidos el tipo y la duración de la FA235–237,239,607,609,612,613,654,680,682,785 y las comorbilidades como hipertensión621,639–641, obesidad638,639,643,646,772,786–791, síndrome metabólico792–794 y apnea del sueño643–645,647–652, pueden influir en los resultados de la ablación con catéter (figura 18de este documento y cuadro 2 del material adicional). Estudios prospectivos de cohortes indican que el control intensivo de los factores de riesgo modificables podría mejorar la supervivencia libre de arritmias después de la ablación con catéter636.
Factores de riesgo de FA que contribuyen al desarrollo de un sustrato anormal que se asocia con peores resultados de la estrategia para el control del ritmo cardiaco. Varios factores de riesgo de FA pueden contribuir al desarrollo de sustratos de la AI que influyen en el resultado de la ablación con catéter y se relacionan con una tasa más alta de recurrencias. El tratamiento intensivo de los factores de riesgo modificables puede reducir la tasa de recurrencias. AOS: apnea obstructiva del sueño; FA: fibrilación auricular; GPC: guías de práctica clínica; HbA1c: glucohemoglobina; IMC: índice de masa corporal.
La ablación con catéter de la FA es un procedimiento complejo que puede asociarse con complicaciones después del procedimiento (sección 10.2.2.3.3)603,604,766–770. Aunque no son frecuentes, algunas complicaciones potencialmente catastróficas pueden presentarse al inicio con signos y síntomas inespecíficos a los que el médico responsable debe estar atento. Los aspectos clave del seguimiento se resumen en la tabla 17.
Aspectos clave del seguimiento tras la ablación con catéter de la FA.
| Aspectos clave |
|---|
| Reconocimiento y manejo de las complicacionesLos pacientes deben ser informados adecuadamente sobre los signos y síntomas clínicos de complicaciones raras, pero potencialmente peligrosas, relacionadas con la ablación que podrían ocurrir tras el alta hospitalaria (p. ej., fístula auriculoesofágica o estenosis de venas pulmonares) |
| Monitorización durante el seguimientoEs útil para evaluar el éxito del procedimiento y correlacionar el estado sintomático con el ritmo cardiaco795,796. Por lo general, las recurrencias después del primer mes tras la ablación son predictivas de recurrencias tardías797,798, pero los síntomas recurrentes pueden producirse por latidos ectópicos u otras arritmias no sostenidas640,799,800; por el contrario, la presencia de FA asintomática tras la ablación está ampliamente descrita801–803La monitorización puede realizarse mediante ECG intermitente, Holter, registros con parches, grabadoras en bucle externas o implantadas o aplicaciones para teléfonos inteligentes (aunque esta opción no está validada para este uso). Los pacientes deben asistir a la primera revisión en un mínimo de 3 meses y anualmente después1 |
| Control de la medicación antiarrítmica y tratamiento de las recurrencias de la FAMantener el tratamiento con FAA de 6 semanas a 3 meses puede reducir la recurrencia de la FA, las rehospitalizaciones y las cardioversiones durante este periodo797,804. En la práctica clínica, el tratamiento sistemático con FAA tras la ablación varía y no existen datos convincentes de que dicho tratamiento sea necesario sistemáticamenteDespués el tratamiento con FAA se puede abandonar gradualmente, suspenderlo o mantenerlo, dependiendo de los síntomas y del estado del ritmo. Hallazgos recientes indican que en pacientes tratados con FAA que no sufren FA en los primeros 3 meses de la ablación, la continuación del tratamiento con FAA después de este periodo reduce las recurrencias de la arritmia805 |
| Control del tratamiento anticoagulanteEn general, los ACO se continúan durante 2 meses tras la ablación para todos los pacientes1,806. Tras este periodo, la decisión de continuar con los ACO está determinada fundamentalmente por la presencia de factores de riesgo de ictus, según la escala CHA2DS2-VASc, más que por el estado del ritmo (sección 10.2.2.6) |
ACO: anticoagulantes orales; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65–74 años y sexo (mujer); ECG: electrocardiograma; FA: fibrilación auricular; FAA: fármaco antiarrítmico.
La recurrencia de la FA tras la ablación se produce por la interacción compleja de varios factores. Entre ellos están el aumento de la duración de la FA, la edad y el tamaño de la AI619–624 y factores estructurales, como la abundancia de tejido epicárdico graso807–810 y un sustrato auricular evidenciado por marcadores eléctricos o morfológicos811. Se han evaluado varias escalas de predicción del riesgo (para una descripción más detallada, consulte la tabla 11 y el cuadro 2 del material adicional). Estas escalas solo tienen una capacidad moderada para la predicción de recurrencias de la FA, y uno de los predictores más fuertes es la recurrencia temprana, lo cual indica que es necesario un mayor refinamiento de estos sistemas de predicción629.
Recomendaciones sobre el control del ritmo cardiaco/ablación con catéter de la FA
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones generales | ||
| Para tomar decisiones sobre la ablación con catéter de la FA se recomienda valorar los riesgos del procedimiento y los principales factores de riesgo de recurrencia de la FA tras el procedimiento, y discutir estos aspectos con el paciente235–237,239,607,609,612,613,636,638,652,654,680,682,785,789 | I | B |
| Se debe considerar la repetición de procedimientos de AVP en pacientes con FA recurrente siempre que los síntomas del paciente hayan mejorado tras el procedimiento inicial812–814 | IIa | B |
| Ablación con catéter de la FA tras el fracaso del tratamiento farmacológico | ||
| Se recomienda la ablación con catéter de las venas pulmonares para el control del ritmo cardiaco en caso de fracaso o intolerancia al tratamiento con FAA de clase I o III para mejorar los síntomas de recurrencia de los pacientes con235–238,247,605–609,612,613,615–617,654,677,678,680,682,685,758,779,780,815: | I | |
| • FA paroxística o | A | |
| • FA persistente sin factores de riesgo de recurrencia de la FA importantes o | A | |
| • FA persistente con factores de riesgo de recurrencia de la FA importantes | B | |
| Se debe considerar la ablación con catéter de la FA por AVP para el control del ritmo cardiaco en caso de fracaso o intolerancia al tratamiento con BB para mejorar los síntomas de recurrencia de los pacientes con FA paroxística o persistente246 | IIa | B |
| Tratamiento de primera línea | ||
| Se puede o se debe considerar la ablación con catéter de la FA por AVP como tratamiento de primera línea para el control del ritmo cardiaco y mejorar los síntomas de algunos pacientes seleccionados con: | ||
| • Episodios sintomáticos de FA paroxística240–242,614,615 o | IIa | B |
| • FA persistente sintomática sin factores de riesgo de recurrencia de la FA importantes253–255,264,598–601,609,610,633,636,641,724,745,746,832 como alternativa al tratamiento con FAA de clase I o III y teniendo en cuenta las preferencias del paciente, los riesgos y los beneficios | IIb | C |
| Ablación con catéter de la FA: | ||
| • Se recomienda revertir la disfunción del VI en pacientes con FA cuando la miocardiopatía inducida por taquicardia sea muy probable, independientemente del estado sintomático666,675,676 | I | B |
| • Se debe considerar para pacientes seleccionados con FA e IC-FEr para mejorar la supervivencia y reducir las hospitalizaciones por IC612,659,662–666,668–671,817–826 | IIa | B |
| Se debe considerar la ablación con catéter de la FA por AVP como una estrategia para evitar el implante de marcapasos en pacientes con bradicardia relacionada con FA o pausa sintomática tras la conversión de la FA, dependiendo de la situación clínica816–818 | IIa | C |
| Técnicas y tecnologías | ||
| Se recomienda el aislamiento eléctrico completo de las venas pulmonares en todos los procedimientos de ablación con catéter de la FA235–237,239,606,608–610,613,614,678,679,681,683,684,686,713,731,759,780 | I | A |
| Para pacientes con antecedente de flutter auricular dependiente del ICV o si el flutter auricular típico se induce durante la ablación de la FA, se puede considerar la ablación adicional del ICV731–733,819–821 | IIb | B |
| Puede considerarse la ablación de otras lesiones aparte del AVP (áreas de bajo voltaje, lesiones lineares, actividad fragmentada, focos ectópicos y rotores, entre otros), aunque estas técnicas no están bien establecidas677,680,708,711–730 | IIb | B |
| Modificación del estilo de vida y otras estrategias para mejorar los resultados de la ablación | ||
| Se recomienda la pérdida de peso a los pacientes obesos con FA, especialmente si están siendo evaluados para ablación con catéter de la FA636,638,639,643,646,772,786–791 | I | B |
| Se recomienda el control estricto de los factores de riesgo y evitar los factores desencadenantes como parte de la estrategia para el control del ritmo cardiaco636,637 | I | B |
AVP: aislamiento de vena pulmonar; FA: fibrilación auricular; FAA: fármaco antiarrítmico; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEr: IC con FEVI reducida; ICT: istmo cavotricuspídeo; VI: ventrículo izquierdo.
Con el desarrollo del procedimiento del laberinto para el tratamiento quirúrgico de la FA, Cox et al. abrieron un nuevo campo de oportunidades terapéuticas para los pacientes con FA822. Desde entonces, el procedimiento clásico de «cortar y suturar» sufrió diversas modificaciones y se desarrollaron distintos procedimientos basados en dispositivos para la ablación quirúrgica823,824. La aplicación de estas técnicas y tecnología en distintas situaciones clínicas está documentada en más de 200 publicaciones825. La mayoría de los estudios son retrospectivos u observacionales, pero también se han publicado algunos ECA y metanálisis771,826–828. Mientras que los efectos de la ablación quirúrgica en el control del ritmo (restauración del ritmo sinusal, ausencia de FA) están claramente demostrados, los efectos en variables como la CdV, las hospitalizaciones, los ictus y la mortalidad no están bien establecidos461,827,829,830. El único ECA con seguimiento a largo plazo mostró una reducción significativa del riesgo de ictus a los 5 años y una mayor probabilidad de mantenimiento del ritmo sinusal, aunque este estudio no tenía suficiente potencia para evaluar el riesgo de ictus828. El registro más grande publicado hasta ahora, del Servicio Nacional de Salud de Polonia, describe una mayor supervivencia cuando la ablación se realiza durante cirugía mitral o coronaria831,832. Es aconsejable la colaboración estrecha entre cirujanos cardiacos y electrofisiólogos (equipo cardiológico) para la selección adecuada de los pacientes y la atención posoperatoria, especialmente el tratamiento de recurrencias de la arritmia, para ofrecer una atención médica de calidad.
10.2.2.4.1Cirugía concomitante de la fibrilación auricular: indicaciones, resultados y complicacionesLa mayoría de los estudios sobre ablación concomitante de la FA se basan más que nada en pacientes sometidos a reparación o remplazo de la válvula mitral. Mientras que se ha demostrado que el aislamiento quirúrgico de venas pulmonares es efectivo para mantener el ritmo sinusal833, el tratamiento de ablación de la FA más efectivo aísla las venas pulmonares y la pared posterior de la AI, crea líneas de ablación que impiden los impulsos eléctricos alrededor de las estructuras más importantes (anillos mitral y tricuspídeo, venas cavas y apéndices) y excluye la OI. La mayoría de los datos apoyan la ablación con radiofrecuencia bipolar o criotermia para crear un laberinto834. Para la FA no paroxística, es más efectivo crear un patrón de lesiones biauriculares, en lugar de solo en la AI, realizado por esternotomía o con técnicas mínimamente invasivas826.
En general, se han identificado los mismos factores preoperatorios de riesgo de recurrencia de la FA para la cirugía de la FA y la ablación con catéter. Estos riesgos incluyen el tamaño de la AI, la edad del paciente, la duración de la FA, la IC-FEr y la disfunción renal379,636,835–841. Los efectos positivos de la ablación quirúrgica concomitante en la ausencia de arritmias auriculares están claramente documentados. En la mayoría de los ECA con 1 año de seguimiento no se observó ningún efecto en la CdV, los ictus y la mortalidad842–845, pero algunos mostraron tasas reducidas de eventos828,830,846. La ablación quirúrgica de la FA concomitante con otra cirugía cardiaca se asocia con un aumento significativo de la necesidad de marcapasos (un 6,8%-21,5%, según datos publicados) cuando se crean lesiones biauriculares (pero no con lesiones solo en la AI)827, mientras que no se observa un aumento de otras complicaciones827–830,846,847.
10.2.2.4.2Cirugía aislada de la fibrilación auricular: indicaciones, resultados y complicacionesLa ablación toracoscópica con radiofrecuencia tiene como objetivo las venas pulmonares, la pared posterior de la AI y la oclusión de la OI para pacientes con FA sin cardiopatía estructural. La ausencia de FA tras el procedimiento está bien documentada, pero solo unos pocos estudios comunicaron una mejora en la CdV844,845,848–850. Un reciente metanálisis de 3 ECA mostró una ausencia significativamente mayor de taquiarritmia auricular y menos necesidad de repetir la ablación tras la ablación toracoscópica, comparada con la ablación con catéter de la FA paroxística o persistente851. En el estudio FAST, que incluyó a pacientes susceptibles de fracaso de la ablación con catéter de la FA (ablación fallida previamente o dilatación de la AI e hipertensión), se observó una recurrencia frecuente pero sustancialmente menor tras la ablación toracoscópica, comparada con la ablación con catéter (el 56 frente al 87%) en el seguimiento a largo plazo (media, 7 años)849. La estancia hospitalaria fue más larga y las tasas de complicaciones de la ablación quirúrgica, más altas que con la ablación con catéter (tabla 16)771. Un análisis sistemático de seguridad mostró una tasa de complicaciones a los 30 días del 11,3%, principalmente autolimitadas, mientras que en un registro multicéntrico esta tasa fue significativamente más baja (3,6%)456. En varios ECA, la ablación toracoscópica se demostró más efectiva que la ablación con catéter para el control del ritmo; sin embargo, la ablación quirúrgica es más invasiva, tiene tasas más altas de complicaciones y hospitalizaciones más largas461,852. Debido a esta relación de riesgo-beneficio entre la ablación quirúrgica y la ablación con catéter, parece razonable considerar preferiblemente la cirugía toracoscópica para pacientes en los que ya falló la ablación con catéter o que tienen un riesgo alto de fracaso de este procedimiento. No hay datos convincentes sobre los efectos de la ablación quirúrgica aislada o combinada con la oclusión/exclusión de la OI en la incidencia del ictus. Por ello, los pacientes con factores de riesgo de ictus deben continuar el tratamiento anticoagulante oral después de la ablación, independientemente de los resultados relativos al ritmo cardiaco.
10.2.2.5Procedimientos híbridos: cirugía y ablación con catéterLos procedimientos híbridos para el tratamiento de la FA combinan la ablación quirúrgica epicárdica mínimamente invasiva, sin esternotomía ni derivación cardiopulmonar, con una estrategia percutánea endocárdica. Estos procedimientos se pueden realizar en una sola intervención o en secuencia con mapeo endocárdico y, si fuera necesario, ablaciones adicionales en los 6 meses posteriores al procedimiento epicárdico853. No hay estudios que comparen estas 2 estrategias.
Una revisión sistemática de los efectos en el control del ritmo de un procedimiento híbrido o de la ablación con catéter en pacientes con FA persistente o persistente de larga duración mostró que el procedimiento híbrido se asoció con una tasa significativamente más alta de ausencia de arritmias auriculares con o sin administración de FAA a los 12 meses o más tarde, comparado con la ablación con catéter. Aunque la tasa total de complicaciones fue baja con ambas estrategias, los procedimientos híbridos tuvieron más complicaciones (el 13,8 frente al 5,9%)854. La diferencia de los resultados podría explicarse por el aislamiento más duradero de las venas pulmonares después de la ablación con radiofrecuencia bipolar, el cierre epicárdico de la OI (clipping) y la posibilidad añadida de realizar un «retoque» endocárdico855,856.
Recomendaciones sobre la ablación quirúrgica de la FA
| Recomendaciones | Clasea | Nivelb |
| Debe considerarse la ablación concomitante de la FA para pacientes que van a someterse a cirugía cardiaca, valorando los beneficios de la ausencia de arritmias auriculares y los factores de riesgo de recurrencia (dilatación de la aurícula derecha, años en FA, edad, disfunción renal y otros riesgos cardiovasculares)461,843,857–859 | IIa | A |
| Se deben considerar los procedimientos toracoscópicos, incluidos los procedimientos híbridos de ablación, para mantener el ritmo sinusal a largo plazo de los pacientes con FA sintomática paroxística o persistente refractaria a tratamiento con FAA en los que la ablación percutánea haya fracasado o cuando haya factores evidentes de riesgo de fracaso del procedimiento,. La decisión debe estar respaldada por un equipo experto formado por electrofisiólogos y cirujanos860,861 | IIa | B |
| Se deben considerar los procedimientos toracoscópicos, incluidos los procedimientos híbridos de ablación, para pacientes con FA persistente y factores de riesgo de recurrencia que siguen sintomáticos durante la FA en los que haya fracasado al menos un tratamiento con FAA y que prefieren recibir tratamiento adicional para el control del ritmo cardiaco | IIb | C |
FA: fibrilación auricular; FAA: fármaco antiarrítmico.
Los pacientes que se someten a cardioversión de la FA tienen un riesgo aumentado de ictus y tromboembolia, especialmente en ausencia de tratamiento anticoagulante y cuando la duración del episodio de FA es ≥ 12 h860–862. Suele ser difícil estimar la duración exacta del episodio de FA antes de la cardioversión, ya que muchos pacientes están inicialmente asintomáticos y solo buscan ayuda médica cuando se presentan los síntomas o las complicaciones. En caso de duda sobre la duración exacta de la FA (es decir, FA de duración desconocida), el tratamiento anticoagulante antes y después de la cardioversión es similar al administrado para la FA > 12-24 h. La mayor tendencia a complicaciones tromboembólicas antes y después de la cardioversión se debe a mecanismos subyacentes, como la preexistencia de trombos (especialmente en pacientes no anticoagulados), cambios en la función mecánica auricular tras la restauración del ritmo sinusal, aturdimiento auricular tras la cardioversión y un estado protrombótico transitorio863.
Ningún ECA ha comparado la administración de ACO con la ausencia de esta para pacientes con una duración confirmada de la FA < 48 h que se someten a cardioversión. Datos de estudios observacionales indican que el riesgo de ictus/tromboembolia es muy bajo (0-0,2%) para los pacientes con una duración confirmada de la FA < 12 h y riesgo muy bajo de ictus (CHA2DS2-VASc de 0 puntos los varones y 1 punto las mujeres) 860,864,865, para los que no se ha establecido el beneficio de la anticoagulación durante 4 semanas tras la cardioversión y la prescripción de anticoagulantes es opcional y se basa en la evaluación individualizada.
La anticoagulación con AVK periprocedimiento reduce significativamente la incidencia de ictus y tromboembolia863, pero puede ser difícil mantener la anticoagulación terapéutica necesaria (INR 2,0-3,0) durante un mínimo de 3 semanas antes de la cardioversión. Este periodo de 3 semanas es arbitrario y se basa en el tiempo presumiblemente necesario para la endotelización o resolución de trombos preexistentes. La cardioversión guiada por ETE se introdujo para acortar este periodo. Si no se confirma la presencia de trombo auricular mediante ETE, la cardioversión se puede realizar tras la administración de heparina y la anticoagulación oral continúa después del procedimiento866,867.
Debido a la rápida acción de los NACO, se puede programar la cardioversión 3 semanas después de la instauración del tratamiento, siempre que se conciencie a los pacientes sobre la importancia de cumplir con el tratamiento868–870; los NACO tienen un perfil de eficacia y seguridad como mínimo comparable al de la warfarina para los pacientes que se someten a cardioversión871–874. Una revisión de los 3 estudios prospectivos más grandes (n = 5.203) mostró una reducción significativa de la variable principal combinada (ictus/embolia sistémica, infarto de miocardio o muerte cardiovascular) con el tratamiento con NACO, comparado con AVK873.
El tratamiento con ACO a largo plazo no debe basarse en el éxito de la restauración del ritmo sinusal, sino en el perfil de riesgo de ictus (calculado mediante la escala CHA2DS2-VASc), buscando un equilibrio con el riesgo hemorrágico (p. ej., la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED
).En caso de detectarse un trombo en la ETE, se recomienda anticoagulación terapéutica durante al menos 3 semanas antes de volver a evaluar al paciente para cardioversión. Se debe considerar la repetición de la ETE para confirmar la resolución del trombo antes de la cardioversión875. El tratamiento antitrombótico de estos pacientes es complejo y debe decidirse de manera individualizada, teniendo en cuenta la eficacia (o ineficacia) de los tratamientos previos.
Recomendaciones sobre el control del riesgo de ictus antes, durante y después de la cardioversión
| Recomendaciones | Clasea | Nivelb |
| Para pacientes con FA que van a someterse a cardioversión, se recomienda la administración de NACO con un perfil de eficacia y seguridad al menos similar al de la warfarina868–873 | I | A |
| Para la cardioversión de la FA/flutter auricular, se recomienda la anticoagulación efectiva durante un mínimo de 3 semanas antes de la cardioversión866–870 | I | B |
| Se recomienda la ETE para excluir trombos cardiacos como alternativa a la anticoagulación durante las 3 semanas previas al procedimiento cuando se planifica una cardioversión precoz866,868–870,875 | I | B |
| Para pacientes con riesgo de ictus, se recomienda mantener el tratamiento anticoagulante a largo plazo después de la cardioversión según las recomendaciones específicas sobre anticoagulación por tiempo indefinido, independientemente del método empleado para la cardioversión, el mantenimiento aparente del ritmo sinusal o la caracterización de la FA como un «episodio diagnosticado por primera vez»412,872,876 | I | B |
| Para pacientes con trombos identificados por ETE, se recomienda la anticoagulación efectiva durante al menos 3 semanas antes de la cardioversión de la FA875 | I | B |
| Se recomienda advertir seriamente a los pacientes sobre la importancia de la adherencia y la continuidad del tratamiento con NACO antes y después de la cardioversión | I | C |
| Se debe iniciar la anticoagulación efectiva tan pronto sea posible antes de cada cardioversión de la FA o flutter auricular866–870 | IIa | B |
| La cardioversión precoz se puede realizar sin ETE en pacientes con una duración de la FA < 48 h866 | IIa | B |
| Para pacientes con una duración de la FA > 24 h que se someten a cardioversión, se debe continuar la anticoagulación terapéutica durante al menos 4 semanas, aunque se haya logrado la cardioversión a ritmo sinusal (la decisión de mantener los ACO a largo plazo está determinada por la presencia de factores de riesgo de ictus)860,861 | IIa | B |
| Para pacientes con trombos identificados por ETE, se debe considerar la repetición del estudio ecocardiográfico para confirmar la resolución del trombo antes de la cardioversión875 | IIa | C |
| Para pacientes con una duración evidente de la FA ≤ 24 h y riesgo muy bajo de ictus (CHA2DS2-VASc de 0 puntos los varones y 1 punto las mujeres), se podría omitir la anticoagulación durante las 4 semanas posteriores a la cardioversión871,876 | IIb | C |
ACO: anticoagulantes orales; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); ETE: ecocardiografía transesofágica; FA: fibrilación auricular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Aunque el tratamiento anticoagulante oral periprocedimiento puede presentar algunas variaciones, recientemente los operadores siguen una estrategia de proceder con la ablación sin interrumpir el tratamiento con AVK o NACO, siempre que la INR se mantenga en rango terapéutico. Para pacientes no anticoagulados, se puede considerar el inicio de la anticoagulación terapéutica 3-4 semanas antes de la ablación1.
En un metanálisis de 12 estudios877, la anticoagulación ininterrumpida con NACO comparada con AVK se asoció con tasas bajas de ictus/AIT (NACO, 0,08%; AVK, 0,16%) y con tasas similares de eventos embólicos cerebrales asintomáticos (el 8,0 frente al 9,6%), mientras que el sangrado mayor se redujo significativamente sin la interrupción de los NACO (0,9%) comparado con los AVK (2%).
En el estudio más grande que comparó el tratamiento periprocedimiento con NACO frente a la warfarina, el estudio RE-CIRCUIT878, la incidencia de complicaciones hemorrágicas graves hasta 8 semanas después de la ablación fue significativamente más baja con el dabigatrán que con la warfarina (el 1,6 frente al 6,9%). Otros estudios clínicos (VENTURE-AF con rivaroxabán879, AXAFA-AF NET 5 con apixabán880 y ELIMINATE-AF con edoxabán881) también mostraron tasas similares de eventos con el tratamiento ininterrumpido con NACO comparado con AVK. En términos generales, el tratamiento ininterrumpido periprocedimiento con NACO se asoció con una baja incidencia de ictus/AIT y con una reducción significativa del sangrado mayor, comparado con el tratamiento ininterrumpido con AVK para pacientes sometidos a ablación con catéter de la FA. Por el contrario, el tratamiento puente con heparina aumenta el riesgo hemorrágico y debe evitarse.
Frecuentemente el término «ininterrumpido» se usa en la práctica clínica para describir un régimen de tratamiento en el que se omiten 1 o 2 dosis de NACO antes de la ablación; sin embargo, en los ECA que compararon el tratamiento ininterrumpido con NACO frente a warfarina, la administración de NACO antes de la ablación realmente no se interrumpió869,878. Por ello, no hay ninguna razón para recomendar la omisión de 1 o 2 dosis de NACO antes de la ablación. Tras el procedimiento, parece seguro administrar la primera dosis la misma noche o a la mañana siguiente (dependiendo de a qué hora corresponda la siguiente dosis según el régimen de ACO del paciente)878,881.
10.2.2.6.3Anticoagulación posoperatoria tras la cirugía de la fibrilación auricularDebido al daño endotelial que se produce durante la ablación es aconsejable administrar lo antes posible ACO a todos los pacientes tras la cirugía de la FA (valorando también el riesgo hemorrágico posoperatorio). No hay datos de ECA sobre la interrupción de la anticoagulación oral a largo plazo. Estudios no aleatorizados y con seguimiento más largo mostraron mayor ausencia de ictus a largo plazo en pacientes con ritmo sinusal mantenido, pero no en pacientes con FA a pesar de la exclusión de la OI824. Por lo tanto, se recomienda la anticoagulación oral a largo plazo para todos los pacientes con riesgo de ictus, aunque la cirugía de laberinto y el cierre de la OI hayan sido efectivos.
Recomendaciones sobre anticoagulación posoperatoria tras la cirugía de la FA
| Recomendaciones | Clasea | Nivelb |
| Se recomienda el tratamiento anticoagulante oral a largo plazo para pacientes sometidos a cirugía de la FA y cierre de la OI, según el riesgo tromboembólico del paciente evaluado mediante la escala CHA2DS2-VASc | I | C |
CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); FA: fibrilación auricular.
El objetivo del tratamiento con FAA es mejorar los síntomas relacionados con la FA484,882,883. Por ello, para decidir si se inicia el tratamiento con FAA a largo plazo hay que sopesar la carga sintomática, las posibles reacciones adversas al fármaco y las preferencias del paciente. Los principios del tratamiento con FAA se resumen en las tablas 18 y 19.
Principios del tratamiento antiarrítmico143.
| Principios |
|---|
| El objetivo del tratamiento con FAA es reducir los síntomas relacionados con la FA |
| La eficacia de los FAA para mantener el ritmo sinusal es discreta |
| El tratamiento con FAA clínicamente efectivo puede reducir las recurrencias de la FA, pero no eliminarlas |
| Si un FAA «fracasa», se podría obtener una respuesta clínicamente aceptable con otro fármaco |
| Las proarritmias inducidas por fármacos y los efectos secundarios extracardiacos son frecuentes |
| Las consideraciones sobre seguridad, más que la eficacia, deben guiar la elección del FAA |
FA: fibrilación auricular; FAA: fármaco antiarrítmico.
Reglas para iniciar el tratamiento antiarrítmico para el control a largo plazo del ritmo cardiaco en la FA.
| Consideración | Criterios |
|---|---|
| Indicación de FAA | ¿El paciente está sintomático?¿Los síntomas son suficientemente intensos (clase EHRA) para justificar el uso de FAA?¿Existen otras entidades asociadas que predigan una mala tolerancia a los episodios de FA? |
| Cuándo iniciar el tratamiento con FAA | Normalmente no se inicia para el primer episodio, pero podría aumentar la eficacia de la cardioversión |
| Cómo elegir un FAA | Minimice el riesgo de proarritmia y toxicidad orgánicaEvalúe:• Anomalías electrocardiográficas basales (duración de los intervalos QRS, PR, QTc) y su posible interferencia con los FAA• El impacto en la función del VI• Interacciones farmacocinéticas y farmacodinámicas importantes (p. ej., con fármacos antitrombóticos)Los factores de riesgo de proarritmia pueden ser dinámicos y cambiar con el tiempo |
| Cómo minimizar el riesgo de proarritmia | Evalúe el ECG tras el tratamiento, como se indica en esta guíaEvalúe periódicamente la posible aparición de toxicidad orgánica (amiodarona)En casos seleccionados, realice prueba de esfuerzo y monitorización continua con HolterEvite combinar FAA |
| Cómo verificar la eficacia | Evalúe la carga de la FA durante el tratamiento (pregunte al paciente si ha notado episodios de FA)Si el paciente toma FAA y el tratamiento es efectivo pero se interrumpe por intolerancia, elija preferiblemente un FAA de la misma clase |
| Intervenciones coadyuvantes y terapia híbrida | Para pacientes con alteraciones de la conducción auriculoventricular o disfunción del nódulo sinusal, se debe considerar el implante de marcapasos si el tratamiento con FAA se considera necesarioEl tratamiento a corto plazo con FAA puede prevenir recurrencias tempranas tras la ablación de la FA |
ECG: electrocardiograma; EHRA: European Heart Rhythm Association; FA: fibrilación auricular; FAA: fármaco antiarrítmico; QTc: intervalo QT corregido; VI: ventrículo izquierdo.
Recomendaciones para el control del riesgo de ictus antes, durante y después de la ablación con catéter
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para pacientes con FA y factores de riesgo de ictus que no reciben tratamiento anticoagulante oral antes de la ablación, se recomienda que el control del riesgo de ictus incluya la instauración de anticoagulación periprocedimiento y: | ||
| • Preferiblemente, anticoagulación terapéutica al menos las 3 semanas previas a la ablación o | ||
| • Como alternativa, una ETE para descartar trombos en la aurícula izquierda antes de la ablación | I | C |
| IIa | C | |
| Para pacientes que van a someterse a ablación con catéter de la FA y han recibido anticoagulación terapéutica con warfarina, dabigatrán, rivaroxabán, apixabán o edoxabán, se recomienda realizar el procedimiento de ablación sin interrumpir los ACO878,879,881 | I | A |
| Después de la ablación con catéter de la FA, se recomienda que: | ||
| • La anticoagulación sistémica con warfarina o un NACO se mantenga durante al menos 2 meses y | ||
| • La anticoagulación sistémica a largo plazo (≥ 2 meses tras la ablación) se base en el perfil de riesgo de ictus del paciente y no en el éxito o el fracaso aparente del procedimiento de ablación | I | C |
ACO: anticoagulantes orales; ETE: ecocardiografía transesofágica; FA: fibrilación auricular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
La administración de FAA, comparada con la ausencia de tratamiento, aproximadamente duplica el mantenimiento en ritmo sinusal883, pero resulta difícil llegar a conclusiones firmes a partir de los datos de estudios que compararon su eficacia884. En general, el tratamiento con FAA es menos efectivo que la ablación con catéter114,611,615, y aunque previamente ineficaz, el tratamiento con FAA se puede continuar después del AVP para reducir la recurrencia de la FA805. Una menor duración del tratamiento con FAA seguramente reduce sus efectos secundarios883,885, pero podrían aparecen recurrencias tardías595. El tratamiento con FAA a corto plazo también sirve para prevenir las recurrencias tempranas de la FA tras la ablación con catéter886, aunque se sigue debatiendo sobre sus posibles beneficios797,887; esta estrategia puede ser razonable para pacientes con riesgo alto de sufrir los efectos secundarios del tratamiento con FAA o para los que tienen bajo riesgo percibido de FA recurrente. El tratamiento concomitante de enfermedades cardiovasculares subyacentes es fundamental para reducir la carga sintomática de la FA y facilitar el mantenimiento del ritmo sinusal245,636,888,889.
10.2.2.7.2Fármacos antiarrítmicos disponiblesSe ha demostrado la capacidad de varios FAA para reducir las recurrencias de la FA (tabla 20)890. Los FAA de clase Ia (quinidina y disopiramida) y sotalol se han asociado con un aumento de la mortalidad total884. Como siempre, la seguridad debe dictar el inicio y la continuación del tratamiento con FAA.
La figura 19 muestra un diagrama de flujo sobre el tratamiento con FAA a largo plazo para el control del ritmo dependiendo de la enfermedad subyacente.
Tratamiento a largo plazo para el control del ritmo cardiaco. ARA-II: antagonistas del receptores de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; EC: enfermedad coronaria; FA: fibrilación auricular; HVI: hipertrofia ventricular izquierda; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima de conversión de la angiotensina; VI: ventrículo izquierdo.
Ya sea que resulte del remodelado auricular estructural o que sea un marcador de este, la FA tiene una relación estrecha con la miocardiopatía auricular. Los fármacos que afectan al proceso de remodelado auricular pueden prevenir la FA de nueva aparición actuando como un FAA no convencional (tratamiento previo; tabla 21).
Fármacos antiarrítmicos empleados para mantener el ritmo sinusal a largo plazo en pacientes con FA890.
| Fármaco | Vía de adminis-tración | Dosis | Contraindicaciones, precauciones y comentarios |
|---|---|---|---|
| Amiodarona233,506,891–896 | Oral | 3 × 200 mg/día durante 4 semanas, después 200 mg/día506 | • Es el FAA más efectivo890,897• Menor recurrencia de FA, comparada con el sotalol y la dronedarona, según datos de la ECDA884• También ralentiza la frecuencia ventricular (en 10-12 lpm); es segura para pacientes con IC898–900• Precaución en caso de concomitancia con otros fármacos que prolongan el intervalo QT• Toma simultánea con AVK o digital: se debe reducir la dosis de estos• Aumento del riesgo de miopatía cuando se combina con estatinas• Requiere supervisar regularmente la posible aparición de toxicidad hepática, pulmonar y tiroidea• Puede ralentizar la conducción en el NAV, pero no debe emplearse para el control de la frecuencia cardiaca como primer objetivo• La prolongación del intervalo QT es frecuente, pero rara vez se asocia con torsades de pointes (< 0,5%)901• Las torsades de pointes son poco frecuentes durante el tratamiento con amiodarona (para prevenir proarritmias, es preciso monitorizar el intervalo QT y la onda TU)902• Se debe interrumpir en caso de prolongación excesiva del intervalo QT (> 500 ms)• ECG basal y a las 4 semanas• Contraindicada en caso de hipertiroidismo manifiesto• Los numerosos y frecuentes efectos secundarios extracardiacos pueden requerir la interrupción de la amiodarona, por lo que se considera un tratamiento de segunda línea cuando existen otras opciones903–907 |
| FlecainidaFlecainida de liberación lenta896,908,909 | Oral | 100-200 mg/12 h o200 mg/24 h (flecainida de liberación lenta) | • Efectiva para la prevención de recurrencias de la FA891,908,910• No debe emplearse para pacientes con un AclCr < 35 ml/min/1,73 m2 y enfermedad hepática significativa• Ambas están contraindicadas para pacientes con cardiopatía isquémica o FEVI reducida911–913• Se debe interrumpir en caso de prolongación del complejo QRS > 25% del valor basal y en pacientes con bloqueo completo de rama u otro bloqueo de conducción > 120 ms• Precaución en caso de alteraciones de la conducción sinoauricular/AVa• Los inhibidores del CYP2D6 aumentan su concentración en plasma• Puede aumentar la duración del ciclo del flutter auricular, con lo que promueve la conducción AV 1:1 y aumenta la frecuencia ventricular914. Este riesgo se puede reducir con la administración concomitante de un bloqueador del NAV, como un BB o un BCC no dihidropiridínico• Para pacientes adecuadamente seleccionados según su propensión a las proarritmias, tanto la flecainida como la propafenona se asocian con un riesgo proarrítmico bajo915• ECG basal y después de 1-2 semanas |
| PropafenonaPropafenona de liberación lenta895,896,916–922 | Oral | 150-300 mg/8 h o225-425/12 h (propafenona de liberación lenta) | • No debe administrarse a pacientes con enfermedad renal o hepática significativa, cardiopatía isquémica, función del VI reducida o asma• Se debe interrumpir en caso de prolongación del complejo QRS > 25% del valor basal y en pacientes con bloqueo completo de rama u otro bloqueo de conducción > 120 ms• Precaución en caso de alteraciones de la conducción sinoauricular/AV*• Aumenta la concentración en plasma de warfarina/acenocumarol y digoxina cuando se usan combinadas• Puede aumentar la duración del ciclo del flutter auricular, con lo que se promueve la conducción AV 1:1 y aumenta la frecuencia ventricular• ECG basal y después de 1-2 semanas |
| Dronedarona923–927 | Oral | 400 mg/12 h | • Menos efectiva que la amiodarona para el control del ritmo, pero tiene muy pocos efectos secundarios extracardiacos925,928–930• Reduce las hospitalizaciones y la mortalidad de los pacientes con FA paroxística o persistente o flutter auricular y comorbilidad cardiovascular923,931• Se asocia con un aumento de la mortalidad de los pacientes con IC reciente descompensada927 o con FA permanente932• La dronedarona tiene los datos más firmes sobre seguridad y, por lo tanto, puede ser un fármaco de primera elección933,934, pero no está indicada para pacientes con IC o FA permanente935,936• No debe emplearse para pacientes en clase NYHA III-IV o con IC inestable, en combinación con fármacos que prolongan el intervalo QT ni con inhibidores potentes del CYP3A4 (como verapamilo, diltiazem), ni para pacientes con un AclCr < 30 ml/min• El uso concomitante con dabigatrán está contraindicado• Combinada con digoxina, puede aumentar significativamente la concentración sérica de esta• Cuando se usa con digital o BB, deben reducirse sus dosis• Se debe interrumpir en caso de prolongación excesiva del intervalo QT (> 500 ms o un aumento > 60 ms)• Es normal un discreto aumento de la creatinina sérica, que refleja una reducción del AclCr más que un deterioro de la función renal937• Puede ralentizar la conducción en el NAV• ECG basal y a las 4 semanas |
| Sotalol (mezcla racémica d,l)233,891,894,895,920,938–940 | Oral | 80-160 mg/12 h | • Solo tiene efectos secundarios de clase III si se administran dosis diarias > 160 mg• Teniendo en cuenta su seguridad y su eficacia y la posibilidad de administrar otros fármacos alternativos, el sotalol debe emplearse con precaución• No debe administrarse a pacientes con IC-FEr, HVI significativa, prolongación del intervalo QT, asma, hipopotasemia o AclCr < 30 ml/min• Las torsades de pointes relacionadas con la dosis pueden ocurrir en más del 2% de los pacientes941• Se debe interrumpir en caso de prolongación excesiva del intervalo QT (> 500 ms o un aumento > 60 ms)• No debe emplearse si el AclCr es < 50 ml/min• El efecto bloqueador de los canales de potasio aumenta con el aumento de la dosis, por lo que incrementa el riesgo de proarritmia ventricular (torsades de pointes)• Datos de estudios observacionales y un metanálisis reciente mostraron una correlación con un aumento de la mortalidad por todas las causas890,897,934, mientras que en un registro nacional y 2 ECA no se observaron problemas de seguridad relativos al sotalol233,933,942,943• ECG basal, después de 1 día y a las 1-2 semanas |
| Disopiramida944–946 | Oral | 100-400 mg 2-3 veces al día (dosis máxima, 800 mg/24 h) | • Se asocia con un aumento significativo de la mortalidad890,947 y no se suele prescribir para el control del ritmo en la FA948,949. No debe administrarse a pacientes con enfermedad estructural. Rara vez se emplea para el control del ritmo en la FA debido al aumento de la mortalidad y la frecuente intolerancia a sus efectos secundarios• Puede ser útil en la FA «vagal» que ocurre a atletas o durante el sueño901• Reduce la obstrucción del tracto de salida del VI y los síntomas de los pacientes con MCH950 |
AclCr: aclaramiento de creatinina; AV: auriculoventricular; AVK: antagonistas de la vitamina K; BB: bloqueadores beta; BCC: bloqueadores de los canales del calcio; CYP2D6: citocromo P450 2D6; CYP34A: citocromo 34A; ECA: ensayo controlado aleatorizado; ECG: electrocardiograma; FA: fibrilación auricular; FAA: fármaco antiarrítmico; FEVI: fracción de eyección del ventrículo izquierdo; HVI: hipertrofia del VI; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; MCH: miocardiopatía hipertrófica; NAV: nódulo auriculoventricular; NYHA: New York Heart Association; PAS: presión arterial sistólica; VI: ventrículo izquierdo.
*Es necesario tomar precauciones cuando se administre cualquier FAA a pacientes con enfermedad del sistema de conducción (p. ej., enfermedad del nódulo sinoauricular o el NAV).
Fármacos no antiarrítmicos con propiedades antiarrítmicas (tratamiento previo).
| Fármaco | Comentarios |
|---|---|
| IECA, ARA-II | La activación del sistema renina-angiotensina-aldosterona se incrementa en la FA951,952. Los IECA y ARA-II mostraron resultados prometedores para prevenir la FA en estudios preclínicos953 |
| Como indican algunos análisis y estudios retrospectivos en los que la FA fue un ojetivo secundario, los IECA/ARA-II pueden prevenir la FA de nueva aparición en pacientes con disfunción del VI, HVI o hipertensión954–961 | |
| Como tratamiento inicial, los IECA y ARA-II parecen ser superiores a otros regímenes antihipertensivos962, aunque los ARA-II no redujeron la carga de la FA en pacientes sin enfermedad estructural963. A pesar de los datos positivos de pequeños estudios prospectivos y análisis retrospectivos, en ECA más grandes se obtuvieron resultados controvertidos y no se logró confirmar la utilidad de los IECA o ARA-II para la prevención secundaria de la FA (después de la cardioversión)964. Las vías multifactoriales que actúan en la FA y el diseño de los estudios podrían explicar estos resultados negativos, aunque no se debe descartar la administración concomitante de IECA o ARA-II y FAA para pacientes con cardiopatía estructural | |
| ARM | La aldosterona está implicada en la inducción y perpetuación de la FA965–967. Datos de ECA muestran que los ARM reducen las arritmias auriculares de nueva aparición en pacientes con IC-FEr, además de mejorar otros resultados cardiovasculares968,969 |
| Recientemente se ha observado el impacto positivo de los ARM en pacientes con IC-FEc970, independientemente del estado basal de la FA. Con respecto a otros inhibidores del sistema renina-angiotensina-aldosterona, la utilidad de los ARM como tratamiento previo para el control del ritmo de pacientes con IC y FA no está clara. Debido a que la FA es un marcador de la gravedad de la IC, el efecto antiarrítmico beneficioso podría ser un efecto indirecto producido por la mejora de la IC. Un metanálisis reciente ha mostrado que los ARM reducen significativamente la FA de nueva aparición y la FA recurrente, pero no la FA posoperatoria971 | |
| BB | Varios estudios pequeños mostraron una tasa más baja de recurrencia de la FA con los BB, y una eficacia comparable a la del sotalol939,972,973. No obstante, la mayoría de los datos disponibles no respaldan que los BB tengan un papel importante en la prevención de la FA890. El efecto beneficioso observado podría ser el resultado de la transformación de la FA clínicamente manifiesta en FA asintomática debido al control de la frecuencia cardiaca por los BB |
| Estatinas | Las estatinas son buenas candidatas para el tratamiento previo, ya que el papel de la inflamación en la FA está bien establecido. Sin embargo, en un estudio con diseño adecuado974, las estatinas no mostraron un efecto beneficioso y su efecto preventivo tampoco se demostró en otros contextos975,976. Aún no se han identificado grupos específicos de pacientes en los que las estatinas podrían inducir un remodelado inverso, pero los hallazgos del registro CARAF indican que los pacientes con FA en tratamiento con BB podrían beneficiarse del tratamiento con estatinas977. Los ácidos grasos poliinsaturados tampoco mostraron un efecto beneficioso convincente para la prevención de la FA978–982 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; BB: bloqueadores beta; CARAF: Canadian Registry of Atrial Fibrillation; ECA: ensayo controlado aleatorizado; FA: fibrilación auricular; FAA: fármaco antiarrítmico; HVI: hipertrofia del VI; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidores de la enzima de conversión de la angiotensina; VI: ventrículo izquierdo.
El reciente estudio RACE 3245 confirmó la importancia de evaluar las enfermedades subyacentes y administrar tratamiento con objetivos para el control intensivo de los factores de riesgo de los pacientes con FA e IC leve o moderada para optimizar el control del ritmo. Los resultados mostraron que el tratamiento por objetivos de las enfermedades subyacentes mejora el mantenimiento del ritmo sinusal de los pacientes con FA persistente.
El cuadro 3 del material adicional presenta una lista de nuevos FAA en estudio.
Recomendaciones sobre el uso a largo plazo de fármacos antiarrítmicos
| Recomendaciones | Clasea | Nivelb |
| La amiodarona está recomendada para el control del ritmo a largo plazo de todos los pacientes con FA, incluidos aquellos con IC-FEr. Sin embargo, debido a su toxicidad extracardiaca, deben considerarse primero otros FAA siempre que sea posible233,570,884,942,983,985 | I | A |
| La dronedarona está recomendada para el control del ritmo a largo plazo de los pacientes con FA y: | ||
| • Función del VI normal o con deterioro leve (pero estable) o | ||
| • IC-FEc, cardiopatía isquémica o HVI884,923,925,985 | I | A |
| La flecainida o la propafenona están recomendadas para el control del ritmo a largo plazo de los pacientes con FA y función del VI normal y sin enfermedad estructural, incluidas la HVI y la isquemia miocárdica significativas594,884,910,942,983,984 | I | A |
| Para pacientes tratados con sotalol, se recomienda un control adecuado del intervalo QT, las concentraciones séricas de potasio, el AclCr y otros factores de riesgo de proarritmia884,942 | I | B |
| Para pacientes con FA tratados con flecainida para el control del ritmo a largo plazo, se debe considerar la administración concomitante de un bloqueador del NAV (si se tolera) | IIa | C |
| Se puede considerar la administración de sotalol para el control del ritmo a largo plazo de los pacientes con función del VI normal o con cardiopatía isquémica siempre que se garantice una monitorización adecuada del intervalo QT, las concentraciones séricas de potasio, el AclCr y otros factores de riesgo de proarritmia233,983 | IIb | A |
| El tratamiento con FAA no está recomendado para pacientes con FA permanente o con alteraciones de la conducción avanzadas, excepto cuando se disponga de marcapasos para prevenir la bradicardia | III | C |
AclCr: aclaramiento de creatinina; FA: fibrilación auricular; FAA: fármaco antiarrítmico; HVI: hipertrofia del VI; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NAV: nódulo auriculoventricular; VI: ventrículo izquierdo.
Distintos criterios clínicos, ecocardiográficos y electrocardiográficos se han asociado con un mayor riesgo de proarritmia986–989. El envejecimiento, el sexo femenino, la insuficiencia renal o hepática y la EC conocida se han identificado por distintos medios con mayor riesgo890,990–992, así como el uso concomitante de FAA, la hipopotasemia o la historia familiar de muerte súbita990. Los eventos proarrítmicos tienden a agruparse poco después de iniciarse la administración del fármaco, especialmente cuando se prescribe una dosis de carga o se cambia la dosis habitual568. En el caso de la quinidina, el riesgo es idiosincrásico y no depende de la dosis. El deterioro de la función del VI y la HVI son marcadores ecocardiográficos de un riesgo proarrítmico aumentado. El sotalol tiene riesgo proarrítmico incluso en ausencia de cardiopatía estructural. En el ECG de 12 derivaciones, la prolongación del intervalo QT corregido (QTc), del complejo QRS y del intervalo PR se asocia con proarritmia993–995. Las mutaciones en los canales iónicos solo se han detectado en una minoría de casos de torsades de pointes inducidas por fármacos996. Los análisis periódicos del ECG en busca de signos de proarritmia han sido eficaces en recientes estudios sobre el tratamiento con FAA594,997. Más concretamente, se monitorizó con ECG sistemáticamente los días 1-3 a los pacientes tratados con flecainida, propafenona o sotalol para identificar a los pacientes con riesgo de proarritmia233,594,998. Sigue siendo discutible la utilidad de las pruebas de esfuerzo sistemáticas para los pacientes que inician el tratamiento con fármacos de clase Ic y no tienen evidencia de cardiopatía estructural915,999.
10.3«C»: control de factores de riesgo cardiovascular y enfermedades concomitantes: detección y tratamientoLa carga del riesgo cardiovascular y las comorbilidades, incluidos también factores relacionados con el estilo de vida y entidades marginales, afectan de modo importante al riesgo de sufrir FA a lo largo de la vida (figura 5 del material adicional). El estilo de vida poco saludable, los factores de riesgo y las enfermedades cardiovasculares pueden contribuir al remodelado/miocardiopatía auricular y la aparición de FA, que suele ser el resultado de la interacción de múltiples factores (frecuentemente sin valores umbral específicos).
La «C» de la vía ABC se refiere al control (identificación y tratamiento) de las enfermedades concomitantes, los factores de riesgo cardiometabólicos y los factores de un estilo de vida poco saludable. El tratamiento de los factores de riesgo y la enfermedad cardiovascular se complementa con el tratamiento para la prevención del ictus y reduce la carga de la FA y la intensidad de los síntomas. En un ECA reciente, por ejemplo, el tratamiento por objetivos de enfermedades subyacentes mejoró de manera significativa el mantenimiento del ritmo sinusal en pacientes con FA persistente e IC245.
Mientras que las estrategias de control integral para la modificación de factores de riesgo e intervenciones destinadas al tratamiento de enfermedades subyacentes mostraron una reducción de la carga y la recurrencia de la FA, los estudios que evaluaron el control individual de entidades específicas (p. ej., la hipertensión) obtuvieron resultados discrepantes1000, probablemente debido a que la entidad estudiada no era el único factor que contribuía a la FA.
10.3.1Intervenciones en el estilo de vida10.3.1.1Obesidad y pérdida de pesoLa obesidad aumenta el riesgo de FA, con un incremento progresivo según el índice de masa corporal366,1001–1005. También puede aumentar el riesgo de ictus isquémico, tromboembolia y muerte en pacientes con FA366, a pesar de la paradoja de la obesidad en la FA, particularmente en lo que se refiere a muerte cardiovascular y por todas las causas, con una relación inversa entre el sobrepeso/obesidad y un pronóstico cardiovascular más favorable en el seguimiento a largo plazo1006.
La pérdida de peso intensiva, además del control de otros factores de riesgo cardiovascular, llevó a menos recurrencias y síntomas de la FA que una estrategia basada en el asesoramiento general de pacientes obesos con FA636,888,889. Alcanzar un peso saludable puede reducir la presión arterial, la dislipemia y el riesgo de contraer diabetes mellitus tipo 2, con lo cual mejora el perfil de riesgo cardiovascular1007. La obesidad puede aumentar la tasa de recurrencia de la FA tras la ablación con catéter (con la AOS como potencial factor de confusión)638,643,789,1008. La obesidad también se ha relacionado con mayores dosis de radiación y con tasas más altas de complicaciones durante la ablación de la FA1009,1010, mientras que la mejoría de los síntomas después del procedimiento parece comparable en los pacientes obesos o con peso normal1008. Dado que mediante la reducción de peso se pueden reducir los episodios de FA, se debe proponer a los pacientes obesos la ablación con catéter junto con intervenciones para la pérdida de peso (figura 18).
10.3.1.2Consumo de alcohol y cafeínaEl consumo excesivo de alcohol es un factor de riesgo de FA1011–1014 y hemorragias395 en pacientes anticoagulados (mediado por una mala adherencia, enfermedad hepática, sangrado varicoso y riesgo de traumatismo grave), y además se podría asociar con riesgo de tromboembolia y muerte1015. En un estudio reciente, la abstinencia redujo la recurrencia de la arritmia en pacientes con FA consumidores habituales de alcohol1016.
Por el contrario, es poco probable que el consumo de cafeína cause o contribuya a la aparición de FA47. El consumo habitual de cafeína se podría asociar con menos riesgo de FA, pero su ingestión puede aumentar la aparición de palpitaciones no relacionadas con la FA.
10.3.1.3Actividad físicaNumerosos estudios han demostrado el efecto beneficioso del ejercicio moderado y la actividad física en la salud cardiovascular1017–1019. No obstante, parece haber un incremento de la incidencia de FA entre los atletas de élite, y en muchos estudios pequeños se observó una relación entre la FA y la actividad física intensa, principalmente la participación en deportes de resistencia o de larga duración1020–1023. Es probable que haya una relación no lineal entre la actividad física y la FA. Con base en estos datos, se debe animar a los pacientes a practicar ejercicio físico de intensidad moderada y mantenerse físicamente activos para prevenir la incidencia o la recurrencia de FA, y quizá evitar el ejercicio de resistencia excesivo (como maratones, triatlones, etc.), especialmente después de los 50 años de edad. Debido a la falta de datos de estudios aleatorizados, no se puede determinar el efecto de la rehabilitación cardiaca a base de ejercicio en la mortalidad y los eventos adversos graves1024.
10.3.2Factores de riesgo cardiovascular específicos y comorbilidades10.3.2.1HipertensiónLa hipertensión (HTA) es el factor etiológico que se asocia más frecuentemente con la FA y los pacientes con HTA tienen un riesgo 1,7 veces mayor que los pacientes normotensos26,1025. La HTA también aumenta las complicaciones de la FA, especialmente el ictus, la IC y el riesgo hemorrágico. Se debe clasificar a los pacientes con FA e HTA de mayor duración o con cifras de presión arterial sistólica (PAS) no controladas como pacientes con «riesgo alto» que requieren un control estricto de la PA además del tratamiento anticoagulante para reducir el riesgo de ictus isquémico y HIC.
Dada la importancia de la hipertensión como factor desencadenante de la FA (que debe considerarse una manifestación de daño sistémico de la HTA), es indispensable el tratamiento de la HTA según las guías de práctica clínica vigentes1026 para los pacientes con FA, con el objetivo de alcanzar una PA ≤ 130/80mmHg para reducir los eventos adversos338,1027,1028. Un reciente estudio aleatorizado sobre pacientes con FA paroxística e HTA mostró menos recurrencias en los pacientes tratados con denervación de la arteria renal además de AVP, comparados con los tratados solamente con AVP1029. No se debe administrar sotalol en caso de HVI hipertensiva o insuficiencia renal debido al riesgo de proarritmia. Algunos datos indican que los IECA/ARA-II pueden mejorar los resultados en la FA o reducir la progresión de la arritmia26,1025. Los cambios en el estilo de vida, como el control de la obesidad, la reducción del consumo de alcohol y la atención a la AOS, también pueden ayudar al tratamiento de los pacientes con FA e HTA.
10.3.2.2Insuficiencia cardiacaLas interacciones entre la FA y la IC y el tratamiento óptimo de los pacientes con ambas enfermedades se tratan en la sección 11.6.
10.3.2.3Enfermedad coronariaLas interacciones entre la FA y la EC y el tratamiento óptimo de los pacientes con ambas enfermedades se discuten en la sección 11.3.
10.3.2.4Diabetes mellitusAdemás de compartir factores de riesgo (como la hipertensión y la obesidad)1004,1030, la diabetes es un factor independiente de riesgo de FA, especialmente en pacientes más jóvenes1031. Los episodios asintomáticos de FA están favorecidos por la presencia de disfunción autonómica1032, lo que hace pensar que el cribado sistemático de la FA entre pacientes con diabetes mellitus sería oportuno. La prevalencia de la FA es 2 veces mayor en pacientes con diabetes que en individuos sin diabetes1033 y la incidencia de la FA aumenta al tiempo que aumenta la gravedad de las complicaciones microvasculares (retinopatía, enfermedad renal)1034. Tanto la diabetes mellitus tipo 1 como la tipo 2 son factores de riesgo de ictus342,1035.
El control glucémico intensivo no influye en la tasa de FA de nueva aparición1036, pero el tratamiento con metformina y pioglitazona parece asociado con una disminución del riesgo a largo plazo de FA de los pacientes diabéticos1037, mientras que este beneficio no se confirmó con rosiglitazona1038. Actualmente no hay evidencia de que el tratamiento con agonistas del receptor del péptido similar al glucagón tipo 1, inhibidores del cotransportador de sodio-glucosa tipo 2 o inhibidores de la dipeptidil peptidasa 4 influyan en la aparición de FA1039.
Dos metanálisis no mostraron una interacción significativa entre la diabetes mellitus y el tratamiento con NACO en pacientes con FA423,1040, pero en uno la mortalidad vascular fue menor en los pacientes diabéticos tratados con NACO que en los tratados con warfarina1040. La reducción del riesgo fue similar en pacientes diabéticos y no diabéticos tratados con NACO, excepto con el apixabán, que se asoció con una reducción de las complicaciones hemorrágicas menor en los pacientes con FA y diabetes que en aquellos con FA sin diabetes1041. En cuanto a los efectos secundarios potenciales del tratamiento anticoagulante, no hay evidencia de que el riesgo hemorrágico aumente en pacientes con diabetes y retinopatía341.
El control glucémico óptimo durante los 12 meses previos a la ablación con catéter de la FA se asoció con una reducción significativa de la FA recurrente tras la ablación1042.
10.3.2.5Apnea del sueñoLa forma más común de trastorno respiratorio durante el sueño, la AOS, tiene una prevalencia alta en los pacientes con FA, IC e HTA y se asocia con un aumento del riesgo de mortalidad o eventos cardiovasculares1043. En un análisis prospectivo, aproximadamente el 50% de los pacientes con FA tenían AOS, frente al 32% de los controles1044. Entre los mecanismos que favorecen la aparición de FA están la hipoxemia/hipercapnia nocturna, los cambios en la presión intratorácica, el desequilibrio simpaticovagal, el estrés oxidativo, la inflamación y la activación neurohumoral1045. Se ha observado que la AOS reduce la tasa de éxito del tratamiento con FAA, de la cardioversión eléctrica y de la ablación con catéter de la FA1045.
La presión positiva continua en la vía aérea (CPAP) es el tratamiento de elección para la AOS, y podría disminuir los efectos de esta en las recurrencias de la FA1046,1047. Estudios observacionales y metanálisis mostraron que el tratamiento adecuado de la AOS con CPAP podría mejorar el control del ritmo cardiaco de los pacientes con FA648,649,1047–1051.
La detección de la AOS en pacientes con FA sintomáticos parece una estrategia razonable antes de instaurar el tratamiento para el control del ritmo, con el objetivo de reducir la recurrencia de FA sintomática (figura 18). En los estudios ARREST-AF y LEGACY, un programa intensivo de reducción de los factores de riesgo centrado en el control del peso, la hiperlipemia, la AOS, la HTA y la diabetes, el abandono del tabaquismo y la reducción del consumo de alcohol redujo significativamente la carga de la FA después del AVP636,1052. No obstante, no está claro cómo y cuándo implementar la detección y el tratamiento de la AOS en la atención estándar de los pacientes con FA.
Recomendaciones sobre intervenciones en el estilo de vida, control de factores de riesgo y tratamiento de enfermedades concomitantes de los pacientes con FA
| Recomendaciones | Clasea | Nivelb |
| Se recomienda identificar y controlar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento de los pacientes con FA888 | I | B |
| Se recomienda modificar hábitos de vida poco saludables y el tratamiento por objetivos de las enfermedades concomitantes para reducir la carga de la FA y la intensidad de los síntomas245,636,887,889,1016,1052 | I | B |
| Se recomienda el cribado oportunista de la FA en pacientes hipertensos26,172,222 | I | B |
| Se recomienda un buen control de la PA de los pacientes con FA e hipertensión para reducir la recurrencia de la FA y el riesgo de ictus y hemorragias26,1035 | I | B |
| Para pacientes obesos con FA, se debe considerar la pérdida de peso y el control de otros factores de riesgo para reducir la incidencia, la progresión, las recurrencias y los síntomas de la FA898,899,1011 | IIa | B |
| Se debe considerar ofrecer asesoramiento y ayuda para evitar el consumo excesivo de alcohol como medida preventiva de la FA y para los pacientes con FA evaluados para tratamiento con ACO324,1012,1014,1016 | IIa | B |
| Se debe considerar la actividad física para ayudar a prevenir la incidencia o recurrencia de la FA, a excepción del ejercicio físico intenso, ya que puede promover la FA1027–1033,1063 | IIa | C |
| Se debe considerar el cribado oportunista de la FA en pacientes con AOS172 | IIa | C |
| Puede considerarse el tratamiento óptimo de la AOS para reducir la incidencia, la progresión, las recurrencias y los síntomas de la FA650,651,1057–1061,1064,1065 | IIb | C |
ACO: anticoagulantes orales; AOS: apnea obstructiva del sueño; FA: fibrilación auricular; PA: presión arterial.
Esta sección describe el tratamiento de la FA para pacientes en situaciones específicas. En estos contextos deben aplicarse los principios de la vía ABC. Además se incluyen consideraciones específicas para cada grupo de población y cada enfermedad.
11.1Fibrilación auricular e inestabilidad hemodinámicaLa inestabilidad hemodinámica aguda (síncope, edema pulmonar agudo, isquemia miocárdica en desarrollo, hipotensión sintomática o shock cardiogénico) en pacientes con FA que se presentan con frecuencia ventricular rápida requiere una intervención urgente. En los pacientes con deterioro hemodinámico grave, se debe intentar sin demora la cardioversión eléctrica urgente e iniciar lo antes posible el tratamiento anticoagulante.
En pacientes críticos o con disfunción sistólica del VI grave, el aumento de la actividad simpática, los agentes inotrópicos y los vasopresores a menudo precipitan o exacerban la FA, lo que frecuentemente lleva al fracaso del control del ritmo. Es importante identificar y corregir los factores precipitantes y las causas secundarias, y optimizar el tratamiento de base. Debido a su efecto en el control de la frecuencia durante el esfuerzo (y no solo en reposo) y el aumento del tono simpático, se prefiere la administración de bloqueadores beta a los digitálicos para controlar la frecuencia ventricular en la FA490. Los bloqueadores beta y los BCC no DHP pueden ejercer un efecto inotrópico negativo (los últimos están contraindicados en la IC-FEr). La digoxina no suele ser efectiva en estos pacientes por el aumento del tono simpático.
Dado que el tratamiento convencional suele ser ineficaz o no se tolera bien490, siempre se debe considerar la cardioversión eléctrica, incluso como tratamiento inicial, mientras que la amiodarona intravenosa puede estar indicada para el control de la frecuencia (o para una posible reversión a ritmo sinusal), con o sin cardioversión eléctrica504,514,515. La administración intravenosa de amiodarona puede llevar a una disminución adicional de la presión arterial.
Recomendaciones sobre el tratamiento de la FA con inestabilidad hemodinámica
| Recomendaciones | Clasea | Nivelb |
| Se recomienda la cardioversión eléctrica urgente para pacientes con FA e inestabilidad hemodinámica aguda o que empeora1053,1054 | I | B |
| Se puede considerar la administración de amiodarona a pacientes con FA e inestabilidad hemodinámica para el control inmediato de la frecuencia cardiaca503,511,512° | IIb | B |
FA: fibrilación auricular.
El término FA de nueva aparición o diagnosticada por primera vez corresponde a un diagnóstico de trabajo para pacientes sin antecedentes de FA hasta que se pueda definir con más precisión el patrón de FA. Aunque en registros de FA el perfil clínico y los resultados de los pacientes con FA de nueva aparición fueron menos favorables que los de pacientes con FA paroxística, más parecidos a los de la FA permanente1055,1056, los pacientes con FA de nueva aparición tuvieron las tasas más bajas de prescripción de ACO1057. Para los pacientes con FA de nueva aparición, se deben seguir los pasos de la vía ABC que se resumen en la ilustración central.
11.3Síndrome coronario agudo, intervención coronaria percutánea y síndrome coronario crónico en pacientes con fibrilación auricularLa incidencia de la FA en los SCA se sitúa en el 2-23%1058, el riesgo de FA de nueva aparición aumenta en un 60-77%1059 en pacientes con infarto de miocardio y la FA por sí misma se podría asociar con un aumento del riesgo de infarto agudo de miocardio con (IAMCEST) o sin elevación del segmento ST (IAMSEST)381,1060–1063. En total, un 10-15% de los pacientes con FA se someten a ICP por EC1064. En estudios observacionales, los pacientes con FA y SCA tuvieron menos probabilidades de recibir el tratamiento antitrombótico adecuado1065 y más probabilidades de sufrir eventos adversos1066 que los pacientes con SCA sin FA.
El tratamiento periprocedimiento de los pacientes con SCA o que se van a someter a una ICP se describe en las respectivas guías de la ESC sobre revascularización miocárdica1067 y síndromes coronarios crónicos (SCC)1068.
Tratamiento posprocedimiento de los pacientes con fibrilación auricular y síndrome coronario agudo o intervención coronaria percutánea
Para pacientes con SCA o sometidos a ICP, es preciso sopesar detenidamente el riesgo de ictus isquémico/embolia sistémica, eventos isquémicos coronarios y el riesgo hemorrágico relacionado con el tratamiento antitrombótico cuando se considere la administración del tratamiento antitrombótico combinado y su duración1069. En general, el tratamiento antitrombótico doble, que incluye anticoagulación oral (preferiblemente con NACO) y un inhibidor del P2Y12 (preferiblemente clopidogrel), se asocia con una tasa significativamente menor de sangrado mayor (y HIC) que el tratamiento triple. Sin embargo, los datos disponibles indican que es deseable al menos 1 ciclo corto (p. ej., ≤ 1 semana) de tratamiento triple para algunos pacientes con FA y SCA reciente o que se van a someter a ICP, especialmente para aquellos con riesgo aumentado de eventos isquémicos1070,1071 (figura 20).
Los ciclos cortos de tratamiento triple (ACO + TAPD) pueden ser seguros para pacientes que requieren ACO después de un SCA/ICP1076. Datos observacionales1077 y del estudio WOEST sobre la warfarina (un ECA de seguridad sin suficiente potencia para evaluar eventos isquémicos)1078 muestran un mejor perfil de seguridad y una eficacia similar con el tratamiento doble (ACO + clopidogrel) que con tratamiento triple
ECA sobre el uso de NACO para pacientes con FA tras un SCA/ICP reciente
Cuatro ECA compararon el tratamiento doble con un inhibidor del P2Y12 (iP2Y12) (principalmente clopidogrel) más un NACO —dabigatrán 110 o 150 mg 23 veces al día (REDUAL PCI)1079, rivaroxabán 15 mg/día (PIONEER AF-PCI)1080, apixabán 5 mg 2 veces al día (AUGUSTUS)1081 o edoxabán 60 mg/día (ENTRUST-AF PCI)1082— frente al tratamiento triple con un AVK en pacientes con FA y SCA reciente o sometidos a ICP. El diseño factorial 2×2 del estudio AUGUSTUS permitió la comparación entre AAS y placebo (véase la tabla 12 del material adicional para más información sobre estos estudios). Los 4 estudios tuvieron la misma variable principal de seguridad (hemorragia) y no tenían suficiente potencia para evaluar los eventos isquémicos.
- A pesar de algunas diferencias entre ellos, estos 4 estudios:
- •
Incluyeron un porcentaje de pacientes con SCA/ICP (37-52%), aunque los pacientes de mayor riesgo (p. ej., trombosis del stent previa o ICP compleja con implante stent-en-stent) estuvieron en gran medida infrarrepresentados
- •
Administraron tratamiento triple durante la ICP y hasta la aleatorización (1-14 días después de la ICP)
- •
Administraron mayoritariamente el iP2Y12 clopidogrel (en conjunto, más del 90%) y
- •
Comunicaron una reducción significativa de sangrado mayor/clínicamente significativo, tasas comparables de ictus isquémico, tasas similares o no significativamente más altas de infarto de miocardio y trombosis del stent y un efecto neutro en los eventos adversos cardiovasculares mayores (MACE) y la mortalidad por todas las causas con el tratamiento doble (NACO + iP2Y12) comparado con tratamiento triple (VKA + iP2Y12 + AAS).
En el estudio AUGUSTUS1081, tanto el placebo (frente al AAS) como el apixabán (frente a los AVK) se asociaron con una reducción significativa de las hemorragias y el apixabán (frente a los AVK) se asoció con tasas significativamente más bajas de ictus, muerte u hospitalización.
- Metanálisis de ECA
- •
Hemorragias: varios metanálisis1070,1071,1083,1084 han coincidido en mostrar una reducción significativamente mayor de las tasas de hemorragia con el tratamiento doble frente al triple y con NACO frente a AVK (los tratamientos basados en NACO también se asociaron con una reducción significativa de HIC).
- •
Eventos isquémicos: las tasas de ictus fueron similares en todos los brazos de tratamiento, pero las tasas de infarto de miocardio y trombosis del stent fueron numéricamente más altas con el tratamiento doble que con el triple. En 2 metanálisis1070,1071, la trombosis del stent tuvo un aumento estadísticamente significativo con el tratamiento doble (sin AAS) comparado con el tratamiento triple. Además, el riesgo de infarto de miocardio o trombosis del stent fue ligeramente más alto con dosis de dabigatrán de 110 mg, pero no con las de 150 mg.
- •
Las tasas de MACE (definidos por los estudios) y mortalidad fueron similares en todos los brazos de tratamiento, lo cual indica que el beneficio de la reducción del sangrado mayor y la HIC se contrarresta con el mayor riesgo de eventos isquémicos coronarios (principalmente relacionados con el stent) con el tratamiento doble.
ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; ECA: ensayo controlado aleatorizado; HIC: hemorragia intracraneal; ICP: intervención coronaria percutánea; iP2Y12: inhibidores del receptor P2Y12; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble.
Tratamiento posprocedimiento de los pacientes con FA y SCA/ICP (las flechas de color uniforme representan la estrategia estándar; las flechas de color degradado o con bordes discontinuos muestran modificaciones del tratamiento que dependen de los riesgos individuales isquémico y hemorrágico). Está recomendado el pretratamiento con un inhibidor del P2Y12 para pacientes con IAMCEST o cuando se conozca la anatomía coronaria; se debe retirar el tratamiento a los pacientes con SCASEST hasta el momento de la coronariografía en caso de estrategia invasiva en las primeras 24h. Estudios observacionales indican que, por lo general, la ICP sin interrupción del tratamiento con AVK es segura, comparada con la interrupción de la anticoagulación oral y el tratamiento puente con heparina1073, especialmente en caso de acceso radial; por el contrario, los datos de estudios sobre NACO son conflictivos, aunque la mayoría desaconseja la realización de ICP sin la interrupción total del tratamiento con NACO1074,1075. Cuando sea necesario realizar una ICP urgente, se propone la administración de anticoagulación parenteral (HNF, HBPM o bivalirudina), y la suspensión temporal del tratamiento con NACO, como mínimo durante el periodo inicial tras el procedimiento (p. ej., 24 h), dependiendo de los riesgos trombótico y hemorrágico de los pacientes. Cuando se considera la trombolisis para pacientes con IAMCEST, se debe evaluar en primer lugar el estado de anticoagulación (p. ej., la INR de pacientes tratados con AVK; en caso de tratamiento con un NACO, evalúe el tiempo de tromboplastina parcial activado de los pacientes tratados con dabigratán o la actividad antifactor Xa si se trata con inhibidores del factor Xa). El tratamiento trombolítico puede conllevar un aumento del riesgo hemorrágico de los pacientes anticoagulados sistemáticamente, sobre todo cuando se administran simultáneamente heparina parenteral y fármacos antiagregantes plaquetarios. Es preciso buscar un equilibrio entre los beneficios potenciales (p. ej., en caso de infarto de miocardio anterior extenso) y los riesgos (p. ej., HIC) y, además, considerar el traslado urgente del paciente a un centro de ICP. Si en pacientes supuestamente anticoagulados no se encuentra evidencia de anticoagulación terapéutica (p. ej., INR < 2,0 con warfarina) o no se detecta el efecto anticoagulante de los NACO, se puede considerar la trombolisis sistémica cuando el acceso a ICP primaria no sea posible. AAS: ácido acetilsalicílico; ACO: anticoagulante oral; AINE: antiinflamatorios no esteroideos; AVK: antagonistas de la vitamina K; EAP: enfermedad arterial periférica; EC: enfermedad coronaria; ERC: enfermedad renal crónica; HBPM: heparina de bajo peso molecular; HIC: hemorragia intracraneal; HNF: heparina no fraccionada; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IBP: inhibidor de la bomba de protones; ICP: intervención coronaria percutánea; IM: infarto de miocardio; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimada.
Cualquiera que sea el plan inicial de tratamiento, se recomienda el tratamiento doble con ACO y un antiagregante plaquetario (preferiblemente clopidogrel) durante los primeros 12 meses tras la ICP de un SCA o durante 6 meses para los pacientes con SCC1067. A partir de entonces, se debe continuar la anticoagulación en monoterapia (independientemente del tipo de stent) siempre que no haya eventos isquémicos recurrentes en ese periodo de tiempo. Para los pacientes con FA sin eventos en 1 año (es decir, pacientes estables) se recomiendan también los ACO en monoterapia1072.
La administración de prasugrel o ticagrelor se ha asociado con más riesgo de sangrado mayor que con el clopidogrel1085–1089, y debe evitarse en pacientes con SCA y FA. En el estudio RE-DUAL PCI, el 12% de los pacientes recibieron ticagrelor con dabigatrán, pero la experiencia con ticagrelor o prasugrel fue mínima en los estudios PIONEER-AF, AUGUSTUS y ENTRUST-AF PCI. Para pacientes con posible riesgo de hemorragia gastrointestinal, la toma concomitante de un inhibidor de la bomba de protones es apropiada1084.
Para pacientes sometidos a cirugía de revascularización coronaria, los ACO deben reiniciarse tan pronto como se controle el riesgo hemorrágico, posiblemente en combinación con clopidogrel, y debe evitarse el tratamiento triple.
El control inadecuado de la frecuencia ventricular durante la FA podría exacerbar los síntomas de isquemia miocárdica y precipitar o empeorar la IC. El tratamiento puede incluir bloqueadores beta o antagonistas del calcio limitadores de la frecuencia. En caso de inestabilidad hemodinámica, podría estar indicada la cardioversión inmediata. No se debe administrar vernakalant, flecainida o propafenona para el control del ritmo de los pacientes con EC conocida (sección 10.2.2.2).
Para todos los pacientes con SCA/SCC es necesario optimizar el control de los factores de riesgo e implementar estrategias preventivas, como un buen control de la presión arterial338, control lipídico y otras intervenciones cardiovasculares preventivas1007 según proceda, cuando se haya estabilizado la presentación aguda.
Recomendaciones para pacientes con FA y SCA, ICP o SCC1068
| Recomendaciones generales para pacientes con FA y una indicación de tratamiento antiagregante plaquetario | Clasea | Nivelb |
|---|---|---|
| Para pacientes con FA aptos para tratamiento con un NACOc, estos son preferibles a los AVK en combinación con tratamiento antiagregante plaquetario1079,1081 | I | A |
| Para pacientes con riesgo hemorrágico alto (INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED ≥ 3), se debe considerar dosis de rivaroxabán de 15 mg/24 h en lugar de 20 mg/24 h mientras dure el tratamiento antiagregante plaquetario con 1 o 2 fármacos (TAPD) para mitigar el riesgo hemorrágico1080 | IIa | B |
| Para pacientes con riesgo hemorrágico alto (INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED ≥ 3), se debe considerar dosis de dabigatrán de 110 mg/12 h en lugar de 150 mg/12 h mientras dure el tratamiento antiagregante plaquetario con 1 o 2 fármacos (TAPD) para mitigar el riesgo hemorrágico1079 | IIa | B |
| Para pacientes con FA y una indicación de AVK en combinación con tratamiento antiagregante plaquetario, se debe regular adecuadamente la dosis de AVK con una INR de 2,0-2,5 y un TRT > 70%1094,1095,1104,1105 | IIa | B |
| Recomendaciones para pacientes con FA y SCA | ||
| Para pacientes con FA y SCA que se van a someter una ICP no compleja, se recomienda la suspensión temprana (≤ 1 semana) del AAS y continuar con tratamiento doble con un ACO y un iP2Y12 (preferiblemente clopidogrel) por un periodo de hasta 12 meses si el riesgo de trombosis del stentd es bajo o si prevalece el riesgo hemorrágicoe sobre el de trombosis del stentd, independientemente del tipo de stent implantado1090,1092–1095 | I | B |
| Se debe considerar el tratamiento triple con AAS, clopidogrel y un ACOf durante más de 1 semana tras el SCA cuando el riesgo de trombosis del stentd sea superior al hemorrágicoe; se debe decidir la duración total (≤ 1 mes) según la evaluación de estos riesgos y especificar claramente el plan de tratamiento antes del alta hospitalaria | IIa | C |
| Recomendaciones para pacientes con FA y SCC que se van a someter a una ICP | ||
| Tras una ICP sin complicaciones, se recomienda la suspensión temprana (≤ 1 semana) del AAS y continuar con tratamiento doble con un ACO y clopidogrel hasta 6 meses si el riesgo de trombosis del stentd es bajo o si prevalece el riesgo hemorrágicoe sobre el de trombosis del stentd, independientemente del tipo de stent implantado1076,1078–1081 | I | B |
| Se debe considerar el tratamiento triple con AAS, clopidogrel y un ACOf durante más de 1 semana cuando el riesgo de trombosis del stentd sea superior al hemorrágicoe; se debe decidir la duración total (≤ 1 mes) según la evaluación de estos riesgos y especificar claramente el plan de tratamiento antes del alta hospitalaria | IIa | C |
ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; ERC: enfermedad renal crónica; FA: fibrilación auricular; INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED: hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; iP2Y12: inhibidores de P2Y12; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; TAPD: tratamiento antiagregante plaquetario doble; TRT: tiempo en rango terapéutico.
Consulte las características del producto sobre uso de dosis reducidas o contraindicaciones para cada NACO en pacientes con ERC, peso corporal < 60 kg, edad > 75-80 años e interacciones entre fármacos.
El riesgo de trombosis del stent engloba: a) el riesgo de que ocurra la trombosis, y b) el riesgo de muerte en caso de que ocurra la trombosis del stent, y ambos riesgos se relacionan con características anatómicas, clínicas y del procedimiento. Los factores de riesgo de los pacientes con SCC incluyen: el implante de stents en el tronco común izquierdo o en la última arteria permeable; implante no óptimo del stent; longitud del stent > 60 mm; diabetes mellitus; ERC; bifurcación con 2 stents implantados; tratamiento de oclusión total crónica; trombosis previa del stent en pacientes que reciben tratamiento antitrombótico adecuado.
Se debe evaluar el riesgo hemorrágico de los pacientes con FA mediante la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED (véase la sección 10.1.2), con la que se identifican factores de riesgo modificables; los pacientes con riesgo alto (puntuación ≥ 3) deben tener revisiones tempranas y seguimiento más frecuente. El riesgo hemorrágico es muy dinámico, no permanece estático, y confiar únicamente en los factores de riesgo modificables es una estrategia menos eficaz que la evaluación del riesgo hemorrágico389.
El tratamiento del ictus agudo para pacientes con FA queda fuera de los propósitos de este documento. Para pacientes con FA que toman anticoagulantes y se presentan con ictus agudo, el tratamiento agudo depende del régimen y la intensidad de la anticoagulación. Los pacientes tratados con AVK con una INR < 1,7 son candidatos para la trombolisis según la indicación neurológica (si presentan déficit neurológico clínicamente relevante en una ventana de tiempo apropiada y se excluye la HIC mediante imagen cerebral). Para pacientes que toman NACO, la determinación del tiempo de tromboplastina parcial activado o el tiempo de trombina (para el dabigatrán) o de la concentración de antifactor Xa (para los inhibidores del factor Xa) proporciona información útil sobre el estado de anticoagulación sistémica del paciente. Siempre que sea posible, se debe obtener información sobre la hora de la última dosis de NACO (generalmente, la trombolisis se considera segura cuando han transcurrido al menos 48 h desde la última dosis de NACO, siempre que la función renal sea normal)1090.
En pacientes con anticoagulación sistémica no se debe realizar trombolisis por el riesgo hemorrágico y se debe considerar el tratamiento endovascular. A los pacientes que toman dabigatrán, se les puede realizar la trombolisis sistémica tras revertir la acción del dabigatrán con la administración de idarucizumab1091.
La prevención secundaria del ictus/embolia sistémica para pacientes que han sufrido ictus isquémico/AIT relacionado con FA aguda incluye la prevención temprana del ictus isquémico recurrente durante las 2 semanas posteriores al evento inicial y, a partir de ahí, la prevención a largo plazo.
Aunque el tamaño del infarto o la gravedad del ictus se emplean en la práctica clínica para guiar el momento de inicio de los ACO1090, la utilidad de este enfoque para estimar el beneficio neto del tratamiento temprano es escasa. No hay evidencia firme para establecer el momento óptimo de inicio o reinicio de los ACO después de un ictus agudo. Desde el punto de vista cardiológico, los ACO deben (re)iniciarse tan pronto como sea posible según el punto de vista neurológico (en la mayoría de los casos, en las primeras 2 semanas). Se considera apropiado un enfoque multidisciplinario en el que participen especialistas en ictus, cardiólogos y pacientes.
Para los pacientes que sufren un ictus isquémico a pesar de los ACO, es de suma importancia optimizar el tratamiento anticoagulante —en caso de AVK, optimizar la INR (idealmente > 70%) o cambiar a NACO; en caso de NACO, comprobar la dosis y la adherencia al tratamiento. El uso inapropiado de dosis bajas o reducidas de NACO específicos se ha asociado con un aumento del riesgo de ictus/embolia sistémica, hospitalización y muerte sin una reducción apreciable del sangrado mayor1107.
11.4.2Ictus criptogénico/ictus embólico por causas indeterminadasLa evidencia disponible actualmente, incluidos los datos de 2 ECA finalizados recientemente1108,1109, no respaldan la prescripción sistemática de ACO para los pacientes con ictus isquémico agudo de etiología desconocida (ictus criptogénico) o ictus embólico agudo de causa indeterminada sin FA documentada (cuadro 4 del material adicional). Sin embargo, el análisis de subgrupos de estos estudios indica que algunos subgrupos (edad ≥ 75 años, función renal deteriorada1109 o dilatación de la AI1110) podrían beneficiarse del tratamiento anticoagulante, aunque son necesarios más datos para establecer el uso óptimo de los NACO para pacientes con ictus criptogénico. Se están desarrollando 2 estudios sobre el empleo del apixabán en este contexto (ATTICUS1111 y ARCADIA [NCT03192215]).
El ictus isquémico relacionado con la FA suele ser mortal o discapacitante106 y se asocia con un aumento de riesgo de recurrencia durante las primeras 48 h1092 hasta 2 semanas1092–1095 o de transformación hemorrágica1096, especialmente durante los primeros días del desarrollo de lesiones cardioembólicas grandes y del tratamiento agudo de recanalización1097,1098. Hay que señalar que la HIC se asocia generalmente con mayor mortalidad y morbilidad que el ictus isquémico recurrente
- Momento ideal para (re)iniciar los ACO tras el ictus isquémico agudo
- •
La anticoagulación temprana tras el ictus isquémico agudo puede causar hemorragia parenquimal, con consecuencias clínicas potencialmente graves1097,1099. El uso de HNF, HBPM, heparinoides o AVK menos de 48 h después de un ictus isquémico agudo se asoció con un aumento del riesgo de HIC sintomática, sin una reducción significativa del ictus isquémico recurrente1095
- •
Se ha confirmado que el riesgo de ictus isquémico recurrente a los 90 días supera al riesgo de HIC sintomática de los pacientes tratados con un NACO 4-14 días después del evento agudo1100–1102 (las tasas de recurrencia de ictus isquémico después de un ictus leve/moderado aumentaron significativamente con la administración más tardía del NACO1101, p. ej., > 14 días)1100. En un estudio pequeño, la administración de rivaroxabán a pacientes con FA en los primeros 5 días tras un ictus isquémico leve se asoció con tasas de eventos similares que con AVK1103.
Debido a que aún no se dispone de evidencia firme derivada de ECA sobre el momento más adecuado para iniciar la anticoagulación tras el ictus isquémico agudo, la administración de ACO en el periodo inmediatamente posterior al evento agudo se basa en el consenso de expertos505. Están en desarrollo varios estudios (ELAN [NCT03148457], OPTIMAS [EudraCT, 2018-003859-3], TIMING [NCT02961348] y START [NCT03021928]) sobre el inicio temprano (< 1 semana) comparado con el inicio tardío del tratamiento con NACO para pacientes con ictus isquémico relacionado con FA (los primeros resultados no se esperan antes de 2021).
- Prevención secundaria del ictus a largo plazo
- •
No hay evidencia de que la adición de AAS al ACO o valores supraterapéuticos de INR mejoren los resultados de la prevención secundaria del ictus
- •
Comparados con los AVK, los NACO son más efectivos para la prevención secundaria del ictus y tienen un perfil de seguridad mejor en relación con la HIC, según los resultados de un metanálisis del estudio más importante sobre el uso de NACO en la FA1104
- •
La buena adherencia al tratamiento con NACO es fundamental para la eficacia de la prevención secundaria del ictus
Hay evidencia de que el ictus puede inducir FA a través de mecanismos neurogénicos1105,1106. El primer estudio mostró que el daño en el córtex insular aumenta las probabilidades de detección de FA tras el ictus isquémico y es más prevalente en pacientes con FA diagnosticada después de un ictus que en pacientes sin FA1105. El segundo estudio explicó la razón por la que la FA detectada poco después del ictus isquémico se asocia con un riesgo menor de recurrencia del ictus1106.
ACO: anticoagulación oral; AVK: antagonistas de la vitamina K; ECA: ensayo controlado aleatorizado; HBPM: heparina de bajo peso molecular; HIC: hemorragia intracraneal; HNF: heparina no fraccionada; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Es necesario esforzarse en detectar la FA en estos pacientes (véase también la sección 8). Se ha propuesto el empleo de escalas como C2HEST (EAC/EPOC [1 punto cada una], HTA [1 punto], edad avanzada [≥ 75 años, 2 puntos], IC sistólica [2 puntos] y enfermedad tiroidea [hipertiroidismo, 1 punto]) con el objetivo de identificar a los pacientes con «riesgo alto» para proceder al diagnóstico de la FA1112 y facilitar la monitorización prolongada.
Recomendaciones sobre la detección de FA en pacientes con ictus criptogénico
| Recomendaciones | Clasea | Nivelb |
| Para pacientes con ictus isquémico agudo o AIT y sin FA conocida previamente, se recomienda monitorizar la FA con registro de ECG durante al menos las primeras 24 h, seguido de ECG continuo durante al menos 72 h, siempre que sea posible1113–1116 | I | B |
| Para algunos pacientes seleccionados con ictus y sin FA conocida previamente, se debe considerar la monitorización a largo plazo con sistemas de monitorización electrocardiográfica externos o implantables para detectar FA1112 | IIa | B |
AI: aurícula izquierda; AIT: accidente isquémico transitorio; C2HEST: EAC/EPOC (1 punto cada una), hipertensión (1 punto), edad ≥ 75 años (2 puntos), insuficiencia cardiaca sistólica (2 puntos) y enfermedad tiroidea (hipertiroidismo, 1 punto) (escala); ECG: electrocardiograma; FA: fibrilación auricular.
No todos los pacientes con ictus se benefician de la monitorización electrocardiográfica prolongada; esta se debe programar para los pacientes en los que prevea riesgo de FA (p. ej., pacientes mayores, con factores de riesgo o comorbilidad cardiovascular, indicios de remodelado de la AI, puntuación C2HEST alta, etc.) o para pacientes con ictus criptogénico o cuando se sospeche un ictus embólico.
La detección de FA previamente no diagnosticada tras el ictus tiene implicaciones importantes para la prevención secundaria. Varios ECA han establecido la eficacia de la monitorización electrocardiográfica para la detección de la FA tras el ictus, con números necesarios de cribado de 8-141117,1118.
La vigilancia más estricta y prolongada mediante métodos más sofisticados de monitorización generalmente mejora la detección de FA. En un metanálisis de 50 estudios1118, la tasa de pacientes con FA detectada después del ictus en el servicio de urgencias mediante ECG al ingreso fue del 7,7%; la de FA detectada en planta mediante ECG seriado o ECG continuo/telemetría cardiaca y monitorización con Holter fue del 5,1%, del 10,7% en el primer periodo ambulatorio mediante Holter ambulatorio y del 16,9% después del alta mediante telemetría cardiaca móvil y grabadoras en bucle externas o implantables. El total de FA detectada tras el ictus después de todas las fases de monitorización cardiaca alcanzó el 23,7%1118.
Para pacientes con ictus isquémico/AIT, se recomienda la monitorización con ECG a corto plazo para detectar FA, seguida de ECG continuo durante al menos 72 h, además de considerar también una estrategia escalonada de monitorización con ECG a largo plazo1113 y el implante de un monitor intracardiaco en caso de ictus criptogénico1114,1119. La monitorización con ECG tras el ictus posiblemente es coste-efectiva1120,1121, aunque los estudios realizados no tuvieron la potencia para evaluar el efecto de la monitorización prolongada con ECG y la posterior prescripción de ACO en el ictus o la mortalidad de los pacientes en los que se detectó FA.
11.4.4Tratamiento de los pacientes con fibrilación auricular tras una hemorragia intracranealLa HIC es la complicación más temida, y a menudo mortal, del tratamiento anticoagulante y antiagregante plaquetario, por lo que hay reticencia en cuanto al inicio o reinicio de la anticoagulación en pacientes que sobreviven a una HIC, a pesar de que su riesgo estimado de ictus relacionado con la FA es alto.
A los pacientes con antecedente de HIC reciente se los excluyó de los estudios clínicos sobre la prevención del ictus en la FA, pero datos de estudios observacionales indican que muchos pacientes con FA se beneficiarían de la (re)instauración de los ACO, dependiendo de las causas de la HIC y de los hallazgos en los estudios de TC/RM cerebral (cuadro 5 del material adicional).
La decisión de iniciar o reiniciar el tratamiento anticoagulante oral para los pacientes con FA tras un HIC requiere la participación de un equipo multidisciplinario formado por cardiólogos, especialistas en ictus, neurocirujanos, pacientes y sus familias o cuidadores. Tras una HIC (que incluye las hemorragias epidural, subdural, subaracnoidea o intracerebral), se debe considerar la anticoagulación después de evaluar detenidamente los riesgos y los beneficios, para lo cual la imagen cerebral podría ser de utilidad. El riesgo de HIC recurrente puede aumentar en presencia de los factores de riesgo específicos que se muestran en la figura 21. Hay que destacar que el riesgo de HIC relacionada con la anticoagulación aumenta especialmente en los pacientes asiáticos1122.
(Re)inicio de la anticoagulación tras una hemorragia intracraneal. Un análisis conjunto de los datos de pacientes individuales de estudios de cohortes (n = 20.322 pacientes; 38 cohortes; > 35.225 pacientes-años) mostró que, aunque las microhemorragias cerebrales pueden proveer información sobre el riesgo de HIC de los pacientes con ictus isquémico/AIT reciente tratados con antitrombóticos, el riesgo absoluto de ictus isquémico es sustancialmente superior al riesgo de HIC, independientemente de la presencia, la carga o la localización de las microhemorragias cerebrales505,1123. ACO: anticoagulantes orales; AIT: accidente isquémico transitorio; ECA: ensayo controlado aleatorizado; HIC: hemorragia intracraneal; ICP: intervención coronaria percutánea; LDL: lipoproteínas de baja densidad; MHC: microhemorragia cerebral; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; NdE: nivel de evidencia; OI: orejuela izquierda; SCA: síndrome coronario agudo.
Comparados con los AVK, la administración de NACO a pacientes sin HIC previa se asocia con una reducción del riesgo de HIC de aproximadamente el 50%423, mientras que el tamaño y los resultados de la HIC relacionada con la FA son similares para los NACO y los AVK1124. Por ello, es preferible el uso de NACO para pacientes con FA elegibles para este tratamiento que hayan sobrevivido a una HIC, aunque su beneficio no se ha demostrado en ningún ECA.
Se desconoce el momento óptimo para iniciar el tratamiento anticoagulante oral tras una HIC, pero debe retrasarse hasta que finalice la fase aguda, probablemente durante al menos 4 semanas; para los pacientes con FA y riesgo muy alto de HIC recurrente, se puede considerar el cierre de la OI. Los resultados de varios ECA en desarrollo sobre el empleo de NACO y el cierre de la OI serán útiles para tomar decisiones en el futuro.
| Recomendaciones sobre prevención secundaria del ictus en pacientes con FA e ictus isquémico agudo | Clasea | Nivelb |
|---|---|---|
| Para pacientes con ictus isquémico o AIT, se recomienda la prevención secundaria del ictus con la administración a largo plazo de un ACO siempre que no haya contraindicaciones estrictas; para pacientes candidatos a tratamiento con un NACO, este es preferible a un AVK1125–1130 | I | A |
| Para pacientes que ingresan con ictus isquémico agudo, no se recomienda la anticoagulación con HNF, HBPM o AVK en las primeras 48 h1095 | III | B |
| Recomendaciones sobre prevención del ictus en pacientes con FA tras una hemorragia intracraneal | ||
| Se debe considerar, en consulta con un neurólogo o un especialista en ictus, la (re)instauración de tratamiento anticoagulante (preferiblemente con un NACO en lugar de AVK si el paciente es apto) para pacientes con FA y riesgo alto de ictus isquémico después de: | ||
| • HIC relacionada con traumatismo | ||
| • HIC espontánea aguda (incluida las hemorragias intracerebral, subdural o subaracnoidea), después de valorar detenidamente los riesgos y los beneficiosc | IIa | C |
ACO: anticoante oral; AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; FA: fibrilación auricular; HBPM: heparina de bajo peso molecular; HIC: hemorragia intracraneal; HNF: heparina no fraccionada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
El tratamiento de los pacientes con hemorragia activa durante el tratamiento anticoagulante oral se resume en la figura 22. La evaluación general debe incluir la detección de la zona de sangrado, la gravedad de la hemorragia y el momento de la última dosis del ACO; también se debe explorar el tratamiento antitrombótico concomitante y otros factores que influyen en el riesgo hemorrágico, como el consumo excesivo de alcohol y la función renal. Las pruebas de laboratorio, como la INR, son útiles en caso de tratamiento con AVK. Los análisis más específicos para los NACO incluyen el tiempo de trombina diluida, el tiempo de coagulación de ecarina o el test cromogénico de la ecarina para el dabigratán, y el test cromogénico del antifactor Xa para el rivaroxabán, el apixabán y el edoxabán1131. Sin embargo, los análisis para determinar la concentración plasmática de NACO no siempre están disponibles y a menudo son innecesarios para el tratamiento de las hemorragias1132. En la tabla 13 y la figura 6 del material adicional se presenta una visión general de los fármacos para la reversión de los NACO.
Tratamiento de las hemorragias activas en pacientes que anticoagulados (los centros deben disponer de un procedimiento acordado con antelación)143. ACO: anticoagulantes orales; AVK: antagonistas de la vitamina K; CCP: concentrados de complejo de protrombina; i.v.: intravenoso; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PFC: plasma fresco congelado.
En la mayoría de los casos, el momento de la última dosis combinado con la determinación de la función renal, la hemoglobina, el hematocrito y el recuento plaquetario permite tomar una decisión clínica apropiada. Los sangrados menores deben tratarse con medidas de apoyo, como la compresión mecánica o la cirugía menor para lograr la hemostasis. La interrupción de los AVK no se asocia con una pronta reducción del efecto anticoagulante, mientras que los NACO tienen una vida media plasmática corta y se puede esperar la hemostasis en las primeras 12-24 h tras la omisión de la dosis.
El tratamiento de los eventos hemorrágicos moderados podría requerir transfusiones sanguíneas y reemplazo de fluidos. Si la última toma de un NACO ocurrió menos de 2-4h antes de la evaluación de la hemorragia, la administración de carbón activado o el lavado gástrico reducirán la exposición al fármaco. Deben tomarse medidas diagnósticas y terapéuticas con prontitud (p. ej., gastroscopia) para identificar y tratar la causa de la hemorragia. La diálisis es efectiva para reducir la concentración de dabigatrán y se asocia con una reducción de la duración y la gravedad del sangrado1133.
Las complicaciones hemorrágicas graves o potencialmente mortales requieren la reversión inmediata del efecto antitrombótico de los anticoagulantes. Para los AVK, la administración de plasma fresco congelado restaura la coagulación más rápidamente que la vitamina K, pero los concentrados de complejo de protrombina actúan aún más rápidamente en la coagulación de la sangre1134 y son el tratamiento de primera línea para la reversión de los AVK1135. Hay fármacos para revertir el efecto de los NACO: el idarucizumab (para dabigatrán) y el andexanet alfa (para los inhibidores del factor Xa) revierten de forma efectiva la acción anticoagulante de los NACO y restauran la hemostasis fisiológica1136,1137. Sin embargo, su empleo se asocia a menudo con la retirada de la anticoagulación indefinidamente y con tasas aumentadas de eventos trombóticos. Estos fármacos son efectivos en los casos de hemorragia potencialmente mortal o cirugía urgente, pero en la práctica clínica diaria rara vez son necesarios. El ciraparantag es un fármaco sintético experimental que une e inhibe los inhibidores del factor Xa, dabigatrán y heparina. Se puede considerar la administración de concentrados de complejo de protrombina de 4 factores como tratamiento alternativo para revertir el efecto anticoagulante del rivaroxabán, el apixabán y el edoxabán, aunque la evidencia científica es muy escasa en este contexto y procede frecuentemente de voluntarios sanos1138–1140.
Recomendaciones para el tratamiento de las hemorragias activas de pacientes que toman ACO
| Recomendaciones | Clasea | Nivelb |
| Para pacientes con FA y hemorragia activa grave, se recomienda: | ||
| • Interrumpir el ACO hasta que se identifique la causa del sangrado y se resuelva la hemorragi activa y | ||
| • Realizar con prontitud un diagnóstico específico e intervenciones terapéuticas para identificar y tratar la causa y el origen de la hemorragia | I | C |
| Se debe considerar la administración de concentrados de complejo de protrombina de 4 factores a pacientes con FA que toman AVK y sufren complicaciones hemorrágicas graves | IIa | C |
ACO: anticoagulante oral; AVK: antagonistas de la vitamina K; FA: fibrilación auricular.
La FA y la IC se pueden causar y agravar el pronóstico la una a la otra, y frecuentemente coexisten (véase las secciones 4.2 y 5.3); la IC es también un factor de riesgo tromboembólico en la FA. La eficacia y la seguridad de los NACO no parece ser diferente en pacientes con/sin IC y FA1141,1142. El tratamiento de los pacientes con FA e IC suele ser un reto (sección 10.2). No está claro el objetivo óptimo para la frecuencia cardiaca en pacientes con FA e IC, pero se suele recomendar una frecuencia < 100-110 lpm1143–1145. La estrategia farmacológica para el control de la frecuencia es diferente para pacientes con IC-FEc y con IC-FEr. Los bloqueadores beta, diltiazem, verapamilo y digoxina son opciones viables en la IC-FEc, mientras que los bloqueadores beta y la digoxina se pueden usar en la IC-FEr. Se puede considerar la administración de amiodarona para el control de la frecuencia en ambas formas de IC, pero solo en contextos agudos. La ablación del nódulo auriculoventricular y el implante de marcapasos pueden controlar la frecuencia ventricular cuando fracase la medicación (sección 10.2.1.). Sin embargo, en un pequeño estudio observacional, las estrategias para el control del ritmo se asociaron con una tasa de muerte por todas las causas al año menor que la de la estrategia de control de la frecuencia en pacientes mayores (≥ 65 años) con IC-FEc1146.
La inestabilidad hemodinámica o el empeoramiento de la IC pueden requerir cardioversión eléctrica urgente o inmediata de la FA, mientras que se puede intentar la cardioversión farmacológica con amiodarona intravenosa si la situación clínica permite retrasar la cardioversión (sección 10.2.2.2.2). Se ha demostrado que la ablación con catéter de la FA mejora los síntomas, la capacidad de ejercicio, la CdV y la FEVI de pacientes con FA e IC661, y el reciente estudio CASTLE-AF ha mostrado una reducción de la mortalidad por todas las causas y la hospitalización por empeoramiento de la IC tras la ablación con catéter de los pacientes con IC-FEr657 (sección 10.2.2.3).
Todos los pacientes con IC y FA deben recibir tratamiento para la IC de acuerdo con las guías de práctica clínica1145. Algunos metanálisis han cuestionado el beneficio del tratamiento con bloqueadores beta sobre la reducción de la mortalidad de los pacientes con FA e IC-FEr491, aunque este hallazgo no es universal y algunos estudios en la práctica clínica real muestran un mejor pronóstico1147,1148.
11.7Fibrilación auricular y valvulopatía cardiacaLa valvulopatía se asocia de manera independiente con la FA1149 y más de un tercio de los pacientes con FA tienen alguna forma de valvulopatía512.
En los pacientes con valvulopatía grave, incluidos los que se someten cirugía o intervención percutánea por una valvulopatía aórtica o mitral, la FA se asocia con resultados clínicos menos favorables1150–1155. Comparados con los pacientes sin valvulopatía, y a excepción de la estenosis mitral y las válvulas cardiacas mecánicas, los pacientes con FA y valvulopatía tienen más riesgo de tromboembolia e ictus, principalmente debido a la edad más avanzada y la mayor frecuencia de comorbilidades1156,1157. Mientras que los pacientes con estenosis mitral de moderada a grave o válvula cardiaca mecánica requieren anticoagulación con AVK1158, no hay evidencia de que se deba modificar la elección del ACO por la presencia de otras valvulopatías, incluidas la estenosis/insuficiencia aórtica, insuficiencia mitral, bioprótesis o reparación valvular1156,1159. En un metanálisis de 4 importantes estudios que compararon los NACO con los AVK, los efectos de los NACO en el riesgo de ictus/embolia sistémica y sangrado de los pacientes con valvulopatía, a excepción de la estenosis mitral y prótesis mecánicas cardiacas, fueron similares a los observados en los ECA analizados1160. En un estudio observacional, los NACO se asociaron con mejores resultados, comparados con warfarina, con tasas reducidas de ictus isquémico y sangrado mayor en pacientes con FA y estenosis mitral1161.
Recientemente se ha introducido una categorización funcional de las valvulopatías en relación con el empleo de NACO que clasifica como tipo 1 a los pacientes con estenosis mitral reumática de moderada a grave y de tipo 2 las demás valvulopatías148,1157,1162. Existen lagunas en la evidencia sobre los NACO para pacientes con FA y valvulopatía mitral reumática y durante los primeros 3 meses tras el implante quirúrgico o percutáneo de una bioprótesis; además, los datos de estudios observacionales sobre los NACO tras el implante percutáneo de válvula aórtica (TAVI) son contradictorios1163. Un ECA que comparó el tratamiento con rivaroxabán 10mg/día frente a AAS tras el TAVI en pacientes sin FA fue interrumpido prematuramente por el aumento del riesgo de muerte o complicaciones tromboembólicas y hemorragias en el grupo asignado a tratamiento con rivaroxabán1164.
Recomendaciones para pacientes con valvulopatía cardiaca y FA
| Recomendaciones | Clasea | Nivelb |
| Los NACO están contraindicados para pacientes con válvula cardiaca mecánica1165 | III | B |
| Los NACO no están recomendados para pacientes con FA y estenosis mitral de moderada a grave | III | C |
FA: fibrilación auricular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
Independientemente de la FA, la ERC es una entidad protrombótica y prohemorrágica (figura 7 del material adicional)1166,1167,1168 y la FA puede acelerar la progresión de la ERC. Tienen FA un 15-20% de los pacientes con ERC1169 y esto asocia con un aumento de la mortalidad1170, aunque otros autores indican que podrían tener ERC hasta el 40-50% de los pacientes con FA1171. La función renal de los pacientes con FA se puede deteriorar con el tiempo1172 y el empeoramiento del AclCr predice mejor los riesgos de ictus isquémico/embolia sistémica y hemorrágico que la insuficiencia renal por sí misma1172. En varios estudios sobre el uso de ACO para la prevención del ictus en la FA, la función renal se estimó normalmente calculando el AclCr con la fórmula Cockcroft-Gault y se empleó un punto de corte del AclCr < 50ml/min para ajustar el tratamiento con NACO.
Para pacientes con ERC leve o moderada (AclCr 30-49ml/min), la seguridad y la eficacia de los NACO frente a warfarina fue similar a la observada en pacientes sin ERC de los estudios más importantes sobre los NACO1173–1176, por lo que se deben aplicar las mismas consideraciones para la evaluación del riesgo de ictus y la elección del tratamiento anticoagulante.
No hay datos sobre el efecto de los AVK o NACO en los pacientes con un AclCr de 15-29ml/min, ya que se los excluyó de la mayoría de los estudios aleatorizados más importantes. La evidencia de los beneficios de la ACO para los pacientes con enfermedad renal muy avanzada con un AclCr ≤ 15ml/min o en diálisis es incluso más escasa y, hasta cierto punto, controvertida. Por una parte, no hay estudios aleatorizados y, por otra, los datos de estudios observacionales cuestionan el beneficio de la ACO para este grupo de pacientes. Los datos de estudios observacionales indican una posible reducción del riesgo hemorrágico para los pacientes con enfermedad renal avanzada tratados con NACO frente a AVK435,1177, pero no hay evidencia sobre la reducción de eventos embólicos con NACO o AVK, como se observó en una reciente revisión sistemática1178. Hay que recordar que en Europa no se ha aprobado el tratamiento con NACO para los pacientes con un AclCr ≤ 15ml/min o en diálisis.
Varios ECA investigan actualmente el tratamiento con ACO y comparan NACO frente a AVK en pacientes con enfermedad renal avanzada (NCT02933697, NCT03987711). El estudio RENAL-AF, que comparó la administración de apixabán frente a warfarina para el tratamiento de pacientes con FA en hemodiálisis, se terminó prematuramente sin obtener datos concluyentes sobre las tasas relativas de ictus y hemorragias1179.
No hay datos de ECA sobre el empleo de ACO para pacientes con FA sometidos a trasplante renal. La prescripción y las dosis de NACO deben estar guiadas por la tasa de filtrado glomerular estimada (TFGe) del riñón trasplantado, teniendo en cuenta además las posibles interacciones de la medicación concomitante.
Se debe prestar una atención especial a las dosis de NACO para los pacientes con ERC (tabla 9 del material adicional).
11.9Fibrilación auricular y enfermedad arterial periféricaLos pacientes con FA suelen presentar enfermedad vascular ateroesclerótica. Con la inclusión del índice tobillo-brazo ≤ 0,90 en paciente asintomático en la definición de la EAP, la prevalencia de la enfermedad vascular aumentó significativamente1180. En una revisión sistemática y metanálisis, la EAP tuvo una asociación significativa con un aumento de 1,3-2,5 veces del riesgo de ictus347. La presencia de placa aórtica compleja en la aorta descendente, identificada por ETE, también es un significativo factor vascular de riesgo de ictus (sección 10.1.1).
En pacientes con EAP asintomática, el riesgo de eventos cardiovasculares aumenta progresivamente con el aumento de la carga de la enfermedad vascular470. Por ello, se debe realizar el cribado oportunista de la FA en los pacientes con EAP. Se debe prescribir ACO a los pacientes con FA y EAP, excepto en caso de contraindicaciones. Los pacientes con enfermedad vascular estable (definida arbitrariamente como la ausencia de un nuevo evento vascular en los últimos 12 meses) deben recibir ACO solos (sección 11,3), ya que no se ha demostrado que el uso concomitante de antiagregantes plaquetarios reduzca los ictus u otros eventos cardiovasculares, pero podría aumentar las hemorragias graves como la HIC.
Para los pacientes con EAP, deben aplicarse los principios para el control de la frecuencia y el ritmo descritos en la sección 10.2. Además, hay que tener consideraciones especiales con estos pacientes, como la capacidad de ejercicio limitada por la claudicación intermitente. Los bloqueadores beta pueden exacerbar los síntomas de la EAP en algunos pacientes, para los que puede ser más apropiada la administración de BCC no DHP para el control de la frecuencia.
11.10Fibrilación auricular y trastornos endocrinosLas alteraciones electrolíticas y las concentraciones alteradas de glucosa y hormonas típicas de trastornos endocrinos, como trastornos tiroideos, acromegalia, feocromocitoma, enfermedades de la corteza suprarrenal, enfermedad paratiroidea o disfunción pancreática, incluida la diabetes mellitus, pueden contribuir a la aparición de FA. Los datos sobre el tratamiento de la FA en estos contextos son escasos3. En la sección 10.3.2.4 se trata de la diabetes. La prevención del ictus debe seguir los mismos principios que para otros pacientes con FA, según la estratificación del riesgo estimada mediante la escala CHA2DS2-VASc3,1181. En los pacientes con FA e hipertiroidismo, la conversión espontánea de la FA suele ocurrir cuando se alcanza un estado eutiroideo1182. La retirada de la amiodarona es obligatoria en el hipertiroidismo. La ablación con catéter se debe realizar en condiciones de estabilidad electrolítica y metabólica y no se debe intentar durante el hipertiroidismo activo.
11.11Fibrilación auricular y trastornos gastrointestinalesMientras que las lesiones gastrointestinales pueden llevar a eventos hemorrágicos en pacientes anticoagulados, algunas enfermedades gastrointestinales, como la inflamación intestinal activa, aumentan el riesgo de FA e ictus1183. La hemorragia gastrointestinal es una complicación bien conocida de la anticoagulación oral. En general, el empleo de NACO se asoció con un aumento del riesgo de hemorragia gastrointestinal1184,1185, pero para los pacientes tratados con apixabán o dabigatrán 110mg el riesgo es similar que con warfarina419,421. Se pueden identificar lesiones hemorrágicas en más del 50% de los casos de hemorragia gastrointestinal grave1186. Tras la corrección de la causa de sangrado, se debe reiniciar los ACO, ya que esta estrategia se asoció con una disminución de los riesgos de tromboembolia y muerte1187.
Los pacientes tratados con dabigatrán pueden sufrir dispepsia (alrededor del 11% en el estudio RE-LY, y el 2% de los pacientes abandonaron el tratamiento por síntomas gastrointestinales)419. La toma de dabigatrán después de la comida o la adición de un inhibidor de la bomba de protones mejoran los síntomas1188.
El tratamiento de los pacientes con FA y enfermedad hepática es complejo debido al aumento del riesgo hemorrágico (relacionado con el deterioro de la función de síntesis hepática en la enfermedad hepática avanzada, trombocitopenia y lesiones gastrointestinales varicosas), además del aumento del riesgo de ictus isquémico1189,1190. Generalmente se excluyó de los ECA a los pacientes con disfunción hepática1191, en especial aquellos con pruebas de coagulación anormales, porque pueden tener un riesgo hemorrágico más alto con el tratamiento con AVK, y posiblemente el riesgo sea menor con NACO. A pesar de la escasez de datos, los resultados de estudios observacionales no plantean dudas sobre el empleo de NACO en la enfermedad hepática avanzada1192. En un estudio reciente, los pacientes con FA y fibrosis hepática no tuvieron un aumento de hemorragias con los NACO comparados con AVK470. Otros datos que respaldan el empleo de NACO derivan de una gran cohorte nacional472. El tratamiento con NACO se podría haber iniciado en algunos pacientes con daño hepático significativo pero no diagnosticado; en pacientes con cirrosis, la reducción del riesgo de ictus podría ser superior al riesgo hemorrágico471. Los NACO están contraindicados para los pacientes clasificación de disfunción hepática C de Child-Turcotte-Pugh y el rivaroxabán no está recomendado para las categorías B o C de esta clasificación1193.
11.12Fibrilación auricular y trastornos hematológicosLa anemia es un predictor independiente de sangrado mayor relacionado con los ACO393,402. En una cohorte poblacional de pacientes con FA, la anemia se asoció con mayores tasas de hemorragias y menos TRT, y los ACO en pacientes con FA y anemia moderada o grave se asociaron con más sangrados mayores sin una reducción del riesgo tromboembólico1194. La trombocitopenia también se relacionó con un riesgo hemorrágico aumentado. Siempre que sea posible, deben investigarse y corregirse la anemia y la trombocitopenia antes y durante el tratamiento anticoagulante. La decisión de administrar ACO a pacientes con un recuento plaquetario < 100/μl requiere un enfoque multidisciplinario que incluya a hematólogos, en el que se busque un equilibrio entre los riesgos trombótico y hemorrágico y se traten los factores de riesgo hemorrágico modificables. Algunos fármacos quimioterapéuticos pueden aumentar el riesgo de FA (p. ej., ibrutinib, melfalán, antraciclinas)1195–1197 o deteriorar la función plaquetaria y aumentar, por lo tanto, el riesgo hemorrágico (p. ej., ibrutinib)1198,1199.
11.13Pacientes ancianos y frágiles con fibrilación auricularLa prevalencia de la FA aumenta progresivamente con la edad67,1200–1206, y la edad es un factor independiente de riesgo de resultados adversos en la FA372,1200,1207,1208. Las personas de edad avanzada tienen menos probabilidades de recibir tratamiento anticoagulante1209–1216, a pesar de la evidencia que respalda su empleo en esta población. La fragilidad, las comorbilidades y el aumento del riesgo de caídas1217–1219 no superan a los beneficios de los ACO, dado que los pacientes ancianos anticoagulados tienen un riesgo hemorrágico absoluto bajo339,390,391,1220–1223. La evidencia de ECA441,1224, metanálisis423,1225 y grandes registros339,433,1209,1226 respalda la anticoagulación para este grupo de edad. Los antiagregantes plaquetarios no son más efectivos ni más seguros que la warfarina e incluso podrían ser perjudiciales433, mientras que los NACO parecen tener un mejor perfil de riesgo-beneficio comparados con la warfarina423,433,441,1035,1225,1227–1236. La administración de dosis reducidas de ACO es menos efectiva para la prevención de los resultados adversos en la FA1107,1211,1237,1238.
Tradicionalmente, el control de la frecuencia es la estrategia preferida, pero los datos sobre la elección entre el control de la frecuencia o el control del ritmo para pacientes mayores no son suficientes1239–1242. La escasa evidencia sobre otros tratamientos de la FA respalda el empleo de todas las opciones terapéuticas para el control de la frecuencia y el ritmo, incluidos la cardioversión, el implante de marcapasos y la ablación con catéter de la FA, sin ninguna discriminación por edad. La ablación con catéter de la FA puede ser una opción efectiva y segura para pacientes mayores, ya que tiene tasas de éxito comparables a las de los pacientes más jóvenes1243–1255 y tasas aceptables de complicaciones1243,1245–1247,1249–1260. No obstante, en algunos estudios la edad fue un predictor de complicaciones de la ablación con catéter de la FA1261–1263 y los estudios con un seguimiento más largo mostraron un aumento del riesgo ajustado por múltiples variables de recurrencia de la FA/flutter auricular, muerte y MACE1257.
11.14Pacientes con trastornos cognitivos o demenciaLa evidencia sobre la prevención efectiva del deterioro cognitivo en los pacientes con FA procede principalmente de estudios observacionales que indican que los ACO pueden tener un papel protector para los pacientes con FA y factores de riesgo de ictus, no solo para la prevención del ictus, sino también para la prevención del deterioro cognitivo1264. La calidad de la anticoagulación con AVK (es decir, TRT) parece tener importancia adicional: el TRT bajo y los valores supraterapéuticos de INR se asociaron con un mayor riesgo de demencia1265,1266. Aunque la evidencia es escasa, algunos estudios, pero no todos1267,1268, indican que los NACO son superiores a los AVK para la prevención del deterioro cognitivo1269. Los resultados de un estudio observacional reciente indican que los ACO pueden tener un efecto protector, incluso para pacientes con FA de riesgo bajo que no requieren anticoagulación oral para la prevención del ictus1270. Se están desarrollando varios ECA, que incluyen la función cognitiva como criterio de valoración, que proporcionarán información sobre el papel de la anticoagulación (NACO o AVK) para la prevención del deterioro cognitivo en la FA86.
Por otra parte, el deterioro cognitivo puede influir en la adherencia al tratamiento1271,1272, lo cual afecta a los resultados de los pacientes con FA. En el estudio AXAFA-AFNET 5, tras la ablación con catéter de la FA se detectaron mediante RM lesiones cerebrales silentes que no causaban deterioro cognitivo, pero el estudio no tenía suficiente potencia estadística880.
11.15Fibrilación auricular y cardiopatía congénitaLa supervivencia de los pacientes con cardiopatía congénita ha aumentado a lo largo del tiempo, pero no hay datos firmes sobre el tratamiento de la FA para estos pacientes y la evidencia disponible deriva mayormente de estudios observacionales o de la extrapolación de los resultados de grandes estudios.
Para pacientes con FA (o flutter auricular o taquicardia intraauricular de reentrada) y cardiopatía congénita, está recomendado el tratamiento anticoagulante oral en todos los casos de reparación intracardiaca, cardiopatía congénita cianótica, paliación de Fontan o ventrículo derecho sistémico1273. Los pacientes con FA y otras cardiopatías congénitas deben seguir la estratificación general del riesgo para el empleo de ACO en la FA. Hay que señalar que los NACO están contraindicados para los pacientes con válvula cardiaca mecánica1165, mientras que parecen seguros para los pacientes con bioprótesis valvular1274,1275.
Los fármacos para el control de la frecuencia como los bloqueadores beta, el verapamilo, el diltiazem y la digital se pueden emplear pero tomando precauciones para evitar la bradicardia y la hipotensión. Las estrategias para el control del ritmo (amiodarona) pueden ser efectivas. Los bloqueadores de los canales del sodio suprimen aproximadamente la mitad de las arritmias auriculares de los pacientes sometidos a la operación de Fontan, pero deben tomarse precauciones por el riesgo de proarritmia. Cuando se planifique la cardioversión, se puede considerar la administración de ACO durante las 3 semanas previas y la realización de ETE, ya que en pacientes con cardiopatía congénita y taquiarritmias auriculares es frecuente la presencia de trombos1276,1277.
Para pacientes con comunicación interauricular, se puede considerar el cierre antes de la cuarta década de la vida para reducir el riesgo de FA o flutter auricular1278. Los pacientes con ictus sometidos a cierre del foramen oval permeable tienen mayor riesgo de FA1279, pero para los pacientes con foramen oval permeable y FA no se recomienda el cierre para la prevención del ictus, y la prescripción de ACO se debe decidir con base en las escalas convencionales de riesgo de ictus. Para pacientes con antecedente de FA, se debe considerar la cirugía o la ablación con catéter de la FA en el momento de cerrarse la comunicación interauricular1280–1282. La ablación con catéter de arritmias auriculares tardías suele ser efectiva tras el cierre quirúrgico de la comunicación interauricular1283.
Recomendaciones sobre el tratamiento de la FA de pacientes con cardiopatías congénitas
| Recomendaciones | Clasea | Nivelb |
| Se debe considerar la anticoagulación oral de todo paciente adulto con reparación intracardiaca, cianosis, paliación de Fontan o ventrículo derecho sistémico e historia de FA, flutter auricular o taquicardia auricular por reentrada1273 | ||
| Para pacientes con FA y otras cardiopatías congénitas, se debe considerar la anticoagulación en presencia de uno o más factores de riesgo de ictus no relacionados con el sexo 1273 | IIa | C |
| Se debe considerar el tratamiento quirúrgico de la FA en los siguientes casos: | ||
| • Pacientes que requieren la oclusión quirúrgica de comunicación interauricular y tienen antecedente de arritmias auriculares sintomáticas (se debe valorar la ablación auricular durante el cierre quirúrgico)1280–1282 | ||
| • Se debe considerar el procedimiento en laberinto de Cox para pacientes con FA sintomática y una indicación para la reparación de defectos cardiacos congénitos. El procedimiento quirúrgico se debe realizar en centros con experiencia1280–1282 | IIa | C |
| Se puede considerar la ablación con catéter de arritmias auriculares relacionadas con cardiopatías congénitas siempre que se realice en centros con experiencia1283 | IIb | C |
| Para pacientes con cardiopatía congénita, se puede considerar la ecocardiografía transesofágica y el tratamiento anticoagulante durante las 3 semanas previas a la cardioversión1292,1293 | IIb | C |
FA: fibrilación auricular.
Se han descrito mayores incidencia y prevalencia de la FA en pacientes con miocardiopatías heredadas y síndromes de arritmia primaria1284–1318. En ocasiones la FA es la presentación o solo la característica clínica manifiesta1319–1323, a menudo se asocia con resultados clínicos adversos1292,1299,1301,1307,1308,1310,1324–1329 y tiene importantes implicaciones:
El empleo de FAA puede ser complejo. Muchos fármacos están contraindicados en el síndrome congénito de QT largo debido al riesgo de prolongación del intervalo QT y torsades de pointes (http://www.crediblemeds.org/); en el síndrome de Brugada están contraindicados los fármacos de clase I (http://www.brugadadrugs.org/). Debido a los efectos adversos a largo plazo, la toma crónica de amiodarona es problemática para estos individuos, típicamente jóvenes.
En pacientes con desfibrilador automático implantable (DAI), la FA es una causa común de descargas inadecuadas1307,1311,1330–1333. Programar una única zona de fibrilación ventricular de frecuencia rápida ≥ 210-220 con un periodo de detección largo es seguro1295,1296,1334 y está recomendado para pacientes sin taquicardia ventricular monomórfica lenta documentada. Se puede considerar el implante de un electrodo auricular en caso de bradicardia significativa en pacientes tratados con bloqueadores beta.
La tabla 14 del material adicional resume las principales características clínicas de la FA en pacientes con cardiopatías heredadas.
Los pacientes con síndrome de Wolff-Parkinson-White y FA tienen riesgo de frecuencias ventriculares rápidas que se producen por la conducción rápida de la actividad eléctrica auricular a los ventrículos a través de la vía accesoria; además, tienen mayor riesgo de fibrilación ventricular y muerte súbita1335,1336. La cardioversión eléctrica debe estar inmediatamente disponible para los pacientes con deterioro hemodinámico y preexcitación de la FA, y se deben evitar los fármacos moduladores del nódulo auriculoventricular (p. ej., verapamilo, bloqueadores beta, digoxina)1337,1338. Se puede intentar la cardioversión eléctrica con ibutilida1339, mientras que los FAA de clase I (procainamida, propafenona, flecainida) deben emplearse con precaución por su efecto en el nódulo auriculoventricular1340–1343. La amiodarona podría no ser segura en la FA preexcitada, ya que puede potenciar la conducción a través de las vías1343.
11.17Fibrilación auricular durante el embarazoLa FA es una de las arritmias más frecuentes durante el embarazo1344, especialmente en mujeres con cardiopatías congénitas1345,1346 y gestantes de más edad1344,1347,1348, y se asocia con un aumento del riesgo de muerte1344. La conducción auriculoventricular rápida puede tener consecuencias hemodinámicas graves para la madre y el feto.
La gestación se asocia con un estado de hipercoagulación y un aumento del riesgo tromboembólico. Debido a la falta de datos específicos, para la evaluación del riesgo de ictus se aplican las mismas reglas que para las mujeres no gestantes1349. En la reciente guía de la ESC sobre gestación1349 se encuentran recomendaciones prácticas y detalladas sobre los regímenes de anticoagulación oral y parenteral dependiendo del trimestre de gestación, como el uso de dosis bajas y altas de AVK durante el segundo y el tercer trimestre, el momento de cambiar la heparina de bajo peso molecular (HBPM) por heparina no fraccionada (HNF) antes del parto y el control de los efectos terapéuticos. En caso de estenosis mitral clínicamente relevante, es necesaria la anticoagulación inmediata, con dosis terapéuticas de HBPM en el primero y el último trimestre y AVK con los objetivos normales para la INR o HBPM durante el segundo trimestre. El empleo de NACO durante el embarazo no está autorizado. El parto vaginal es aconsejable para la mayoría de las mujeres, pero está contraindicado para las tratadas con AVK por el riesgo de HIC para el feto1349.
Los bloqueadores beta por vía intravenosa están recomendados para el control agudo de la frecuencia. Los bloqueadores beta 1 selectivos (p. ej., metoprolol y bisoprolol) generalmente son seguros y están recomendados como primera elección1349. Si fracasa este tratamiento, se debe considerar la administración de digoxina y verapamilo para el control de la frecuencia.
El control del ritmo debe ser la estrategia preferida durante el embarazo. En caso de riesgo considerable para la madre o el feto o en presencia de inestabilidad hemodinámica, se debe considerar la cardioversión eléctrica. Esta se puede realizar con seguridad y sin comprometer el aporte sanguíneo al feto1350 y el riesgo asociado de arritmias fetales o parto prematuro es bajo1351,1352. Tras la cardioversión se debe controlar sistemáticamente la frecuencia cardiaca del feto1353. Generalmente, la cardioversión debe estar precedida por anticoagulación (véase la sección 10.2.2.6)1349. Para pacientes hemodinámicamente estables sin cardiopatía estructural, se puede considerar la administración intravenosa de ibutilida o flecainida para la reversión de la FA, pero hay poca experiencia1354,1355. Se deben considerar la flecainida, la propafenona o el sotalol para prevenir la FA si fracasa el tratamiento con bloqueadores del nódulo auriculoventricular. La ablación con catéter de la FA no tiene ningún papel durante el embarazo.
Recomendaciones sobre el tratamiento de la FA durante el embarazo
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Tratamiento agudo | ||
| Se recomienda la cardioversiónc eléctrica inmediata en caso de inestabilidad hemodinámica o preexcitación de la FA1350,1351,1354 | I | C |
| Se debe considerar la cardioversiónc para gestantes con MCH en caso de FA persistente882 | IIa | C |
| Se puede considerar la administración intravenosa de ibutilida o flecainida para revertir la FA en pacientes estables sin cardiopatía estructural1355 | IIb | C |
| Tratamiento a largo plazo (administración oral) | ||
| Se recomienda la anticoagulación terapéutica con heparina o AVK dependiendo del periodo de gestación para las pacientes con FA1349 | I | C |
| Los bloqueadores beta selectivos están recomendados para el control de la frecuencia cardiaca en la FAd | I | C |
| Se debe considerar la administración de flecainidae, propafenonae o sotalolf para prevenir la FA si fracasa el tratamiento con bloqueadores del NAV | IIa | C |
| Se debe considerar la administración de digoxinag o verapamilog para controlar la frecuencia cardiaca si fracasa el tratamiento con bloqueadores beta | IIa | C |
AVK: antagonistas de la vitamina K; ECG: electrocardiograma; FA: fibrilación auricular; FDA: Food and Drug Administration; MCH: miocardiopatía hipertrófica; NAV: nódulo auriculoventricular; QTc: intervalo QT corregido; VI: ventrículo izquierdo.
El atenolol se asocia con tasas más altas de retraso del crecimiento fetal y, por lo tanto, no está recomendado1356.
Se debe combinar la flecainida y la propafenona con bloqueadores del NAV, excluidos a los pacientes con cardiopatía estructural, función del VI reducida y bloqueo completo de rama izquierda.
No se debe administrar bloqueadores del NAV a pacientes con síndrome de preexcitación en ECG en reposo o FA preexcitada.
Recuérdese que la Pregnancy and Lactation Labelling Rule de la FDA sustituyó en junio de 2015 el antiguo sistema de clasificación de fármacos (categorías de A a X) para asesorar a las embarazadas que requieren tratamiento farmacológico, e incluye un resumen descriptivo de los riesgos e información detallada de los datos experimentales y clínicos.
La actividad física moderada mejora la salud cardiovascular y previene la FA, mientras que la actividad deportiva intensa aumenta el riesgo de FA35,1357. Los atletas tienen un riesgo de FA a lo largo de la vida aumentado 5 veces respecto a los individuos sedentarios, a pesar de la baja prevalencia de factores de riesgo de FA convencionales35,1020. Los factores de riesgo de FA en deportistas incluyen el sexo masculino, la mediana edad, los deportes de resistencia, la estatura alta y el tiempo total de ejercicio > 1.500-2.000 h a lo largo de la vida1020,1358–1361. Los deportes de resistencia como correr, el ciclismo y el esquí de fondo35,1362 conllevan el riesgo más alto.
Debido a la ausencia de ECA específicos, las recomendaciones sobre el tratamiento de la FA para deportistas se basa fundamentalmente en los datos de individuos no deportistas, datos observacionales y el consenso de expertos143. La necesidad de anticoagulación está determinada por los factores clínicos de riesgo. Los pacientes anticoagulados deben evitar los deportes con contacto corporal directo o propensos a traumatismos. Debido a la alta prevalencia de bradicardia y pausas sinusales entre los deportistas, el tratamiento farmacológico suele estar contraindicado o no se tolera bien1021,1363. La digoxina y el verapamilo a menudo no son efectivos para controlar la frecuencia cardiaca durante la FA de esfuerzo, y los bloqueadores beta no se toleran bien y, en algunos casos, están prohibidos. También se ha empleado la estrategia de «pastilla en el bolsillo», pero tras la autoadministración de flecainida o propafenona, los pacientes deben abstenerse de practicar deporte hasta que cese la FA y haya transcurrido el tiempo correspondiente a 2 vidas medias del fármaco586. Los deportistas suelen preferir el tratamiento de ablación con catéter, que ha demostrado una eficacia similar en poblaciones de deportistas y no deportistas en estudios pequeños1364,1365.
Recomendaciones sobre actividades deportivas de pacientes con FA
| Recomendaciones | Clasea | Nivelb |
| Se recomienda asesorar a los atletas profesionales acerca de que la práctica prolongada de deportes intensos puede favorecer la aparición de FA, mientras que la actividad física de intensidad moderada está recomendada para prevenir la FA35,38,1020,1360,1366–1368 | I | B |
FA: fibrilación auricular.
La FA perioperatoria se define como la aparición de la arritmia durante una intervención y es más relevante en pacientes sometidos a cirugía cardiaca. Aunque se han descrito distintas estrategias para reducir la incidencia de la FA posoperatoria con pretratamiento o con tratamiento farmacológico agudo, la evidencia de ECA grandes es escasa. La amiodarona es el fármaco más empleado para la prevención de la FA perioperatoria1369.
La FA posoperatoria, definida como FA de nueva aparición en el posoperatorio inmediato, es un problema clínico importante1370,1371, que ocurre en el 20-50% de los pacientes sometidos a cirugía cardiaca1372,1373, en el 10-30% de los casos de cirugía torácica no cardiaca1374 y en el 5-10% de los casos de cirugía vascular o colorrectal1375, con un pico de incidencia entre los días 2 y 4 del posoperatorio1376. Los cambios peroperatorios y posoperatorios que afectan a los desencadenantes de la FA y al sustrato auricular preexistente pueden aumentar la vulnerabilidad auricular a la FA. Muchos episodios de FA posoperatoria son autolimitados y algunos son asintomáticos, pero la FA posoperatoria se ha asociado con un aumento de 4-5 veces del riesgo de recurrencia de la FA durante los 5 años siguientes 1377,1378. También se la considera un factor de riesgo de ictus, infarto de miocardio y muerte frente a pacientes sin FA posoperatoria1379,1380.
Otras consecuencias adversas de la FA posoperatoria son inestabilidad hemodinámica, hospitalizaciones prolongadas, infecciones, complicaciones renales, hemorragias, aumento de la mortalidad hospitalaria y mayores costes sanitarios1371,1381,1382. La estrategia terapéutica para la FA posoperatoria se muestra en la figura 23.
Tratamiento de la FA posoperatoria. ACO: anticoagulantes orales; BCC: bloqueadores de los canales del calcio; CVE: cardioversión eléctrica; CVF: cardioversión farmacológica; FAA: fármaco antiarrítmico; FEVI: fracción de eyección del ventrículo izquierdo; PUFA: ácidos grasos poliinsaturados.
El tratamiento preoperatorio con bloqueadores beta (propranolol, carvedilol más N-acetilcisteína) antes de la cirugía cardiaca y no cardiaca se asoció con una disminución de la incidencia de FA posoperatoria1383–1386, sin una reducción de los eventos adversos graves, como muerte, ictus o daño renal agudo1387. Hay que señalar que la administración perioperatoria de metoprolol en la cirugía no cardiaca se asoció con un aumento del riesgo de muerte en un ECA grande1388. En un metanálisis, la amiodarona (oral o i.v.) y los bloqueadores beta fueron igualmente efectivos para reducir la FA posoperatoria1389, pero combinados fueron mejores que los bloqueadores beta solos1390. Las dosis acumuladas de amiodarona más bajas (< 3.000mg) pueden ser efectivas y con menos eventos adversos1391–1393. No son suficientes los datos sobre otras intervenciones, como la administración de estatinas974,1394, magnesio1395, sotalol1385 o colchicina1396, la pericardiotomía posterior1397,1398, el implante de marcapasos (bi)auricular1385 y los corticoides1399. Dos grandes ECA no mostraron un efecto significativo de la administración i.v. de esteroides en la incidencia de la FA posoperatoria tras la cirugía cardiaca1400,1401 y la colchicina se está investigando actualmente para la prevención de la FA posoperatoria (COP-AF, NCT03310125).
11.19.2Prevención de eventos tromboembólicosEn un metanálisis grande, los pacientes con FA posoperatoria tuvieron más probabilidad (62%) de ictus temprano y más riesgo (37%) de ictus a largo plazo que los pacientes sin FA posoperatoria (las tasas de ictus al año o más tarde fueron del 2,4 frente al 0,4%), así como una mayor probabilidad de mortalidad temprana (44%) y un riesgo mayor (37%) a largo plazo; el riesgo de ictus a largo plazo fue considerablemente mayor en la FA posoperatoria tras cirugía no cardiaca que tras cirugía cardiaca (FA posoperatoria tras cirugía no cardiaca, HR = 2,00; IC95%, 1,70-2,35; tras la cirugía cardiaca, HR = 1,20; IC95%, 1,07-1,34; para la diferencia por subgrupos, p < 0,0001)1379.
Sin embargo, la evidencia sobre los efectos de los ACO en pacientes con FA posoperatoria no es sólida1382,1402–1407. Datos observacionales1408 indican que, aunque la FA posoperatoria tras la cirugía de revascularización coronaria no es equivalente a la FA no relacionada con cirugía, la administración de ACO durante el seguimiento se asoció con un riesgo significativamente más bajo de eventos tromboembólicos en ambas formas de FA, comparada con la ausencia de ACO1408. Según datos publicados, la FA posoperatoria tras cirugía no cardiaca se asoció con un riego tromboembólico a largo plazo similar al de la FA no relacionada con cirugía, y el tratamiento anticoagulante oral se asoció con menos riesgo de eventos tromboembólicos y muerte por todas las causas, de manera comparable en ambos grupos1409. Los estudios actualmente en marcha sobre cirugía cardiaca (PACES; NCT04045665) y cirugía no cardiaca (ASPIRE-AF; NCT03968393) aportarán información sobre el tratamiento anticoagulante óptimo a largo plazo para los pacientes que contraen FA posoperatoria.
Para pacientes con inestabilidad hemodinámica y FA posoperatoria, está indicada la cardioversión eléctrica urgente (o la administración intravenosa de amiodarona1385 o vernakalant583, si se corresponde con la situación clínica). En un ECA reciente sobre pacientes con FA posoperatoria tras cirugía cardiaca, no se observó ninguna ventaja clínica neta entre los tratamientos para el control de la frecuencia y el control del ritmo1373. Por ello, las decisiones sobre el tratamiento para el control de la frecuencia o el ritmo se deben tomar con base en los síntomas y la cardioversión electiva debe seguir los mismos principios de anticoagulación periprocedimiento que se señalan en la sección 10.2.
Recomendaciones sobre la FA posoperatoria
| Recomendaciones | Clasea | Nivelb |
| Se recomienda el tratamiento perioperatorio con amiodarona o bloqueadores beta para la prevención de la FA posoperatoria tras la cirugía cardiaca1390,1492 | I | A |
| Se debe considerar los ACO a largo plazo para prevenir eventos tromboembólicos en pacientes con riesgo de ictus y FA posoperatoria tras cirugía no cardiaca, teniendo en cuenta el beneficio clínico estimado del tratamiento anticoagulante y las preferencias del paciente informado1404,1405,1408,1409 | IIa | B |
| Se pueden considerar los ACO a largo plazo para prevenir eventos tromboembólicos en pacientes con riesgo de ictus y FA posoperatoria tras cirugía cardiaca, teniendo en cuenta el beneficio clínico estimado del tratamiento anticoagulante y las preferencias del paciente informado1404,1405,1408,1409 | IIb | B |
| No se debe administrar sistemáticamente bloqueadores beta para la prevención de la FA posoperatoria a pacientes que se van a someter a cirugía no cardiaca1410 | III | B |
ACO: anticoagulantes orales; FA: fibrilación auricular.
La prevención primaria de la FA incluye la implementación de medidas preventivas para pacientes con riesgo pero sin FA previamente documentada. Esta estrategia se basa en la identificación y el tratamiento de los factores de riesgo y las comorbilidades que predisponen a la FA antes de que aparezcan el remodelado y la fibrosis auricular964,1411. El tratamiento previo consiste en fármacos no antiarrítmicos que modifiquen el sustrato auricular o actúen sobre mecanismos específicos de la FA para prevenir la aparición o la recurrencia de la arritmia. Los objetivos más importantes del tratamiento preventivo son los cambios en la estructura auricular (p. ej., fibrosis, hipertrofia, inflamación, estrés oxidativo), pero también son evidentes los efectos en los canales iónicos auriculares, en las conexiones comunicantes y en los canales del calcio964.
El control adecuado de la HTA y la IC puede prevenir la FA por la reducción de la elongación auricular, pero la inhibición del sistema renina-angiotensina-aldosterona puede tener un efecto protector adicional al suprimir el remodelado eléctrico y estructural964,1411,1412. Grandes ECA y metanálisis han arrojado resultados contradictorios ya sea a favor1413–1416 o en contra1417–1421 del uso de estatinas para la prevención primaria de la FA. También se han obtenido resultados conflictivos sobre los efectos del aceite de pescado en la prevención primaria de la FA1422. Consulte la sección 11.19 para la prevención primaria de la FA posoperatoria tras la cirugía cardiaca y no cardiaca.
12.2Prevención secundaria de la fibrilación auricularPara la prevención secundaria de la FA, consulte la sección 11.3 y la sección 12 del material adicional.
13Diferencias relacionadas con el sexo en la fibrilación auricularLas mujeres generalmente están insuficientemente representadas en los ECA, incluidos los estudios sobre FA. Constantemente se comunican diferencias relacionadas con el sexo en la epidemiología, la fisiopatología, la presentación clínica y el pronóstico de la FA19,107,124,1423,1424 que pueden influir en la eficacia del tratamiento de la FA y, por lo tanto, deben tenerse en cuenta para ofrecer un tratamiento de la FA con un enfoque personalizado y centrado en el paciente individual en la práctica clínica1425. El conocimiento de los mecanismos fisiopatológicos subyacentes y la biología puede ayudar a mejorar los tratamientos personalizados. Se recomienda que las mujeres tengan una representación adecuada en futuros estudios sobre FA, así como identificar y solventar los obstáculos relacionados específicamente con el sexo para implementar los tratamientos de la FA recomendados en las guías de práctica clínica.
Las mujeres que contraen FA son de más edad, tienen prevalencias más altas de hipertensión, valvulopatías e IC-FEc y una menor prevalencia de EC que los varones. Las mujeres con FA suelen presentar síntomas más frecuentemente que los varones y la gravedad de los síntomas suele ser mayor1423,1426.
El sexo femenino es un modificador del riesgo de ictus que aumenta el riesgo asociado con la FA en presencia de otros factores de riesgo de ictus353. Las mujeres con FA sufren ictus más graves y más discapacidad permanente que los varones1427. La anticoagulación con warfarina puede ser más difícil de controlar en las mujeres, que tienen incluso un mayor riesgo residual de ictus con anticoagulación con AVK bien controlada1428. En los estudios más importantes, la eficacia y la seguridad de los NACO fueron similares para ambos sexos, pero las mujeres estaban en gran medida infrarrepresentadas423.
En mujeres con FA, los FAA para el control del ritmo se asociaron con tasas significativamente más altas de eventos adversos potencialmente mortales (como el síndrome de QT largo adquirido con FAA de clase Ia o III)1429,1430 o enfermedad del nódulo sinusal/bradiarritmia que requiere el implante de marcapasos19, comparadas con los varones. Las mujeres con FA tienen menos probabilidades de someterse a cardioversión eléctrica1426 y son referidas más tardíamente a ablación con catéter de la FA que los varones, lo cual refleja posiblemente que la FA ocurre más tarde en la vida de las mujeres107,1431,1432. El resultado del AVP puede ser menos favorable para las mujeres1431,1432, que tienen tasas más altas de complicaciones relacionadas con el procedimiento1431. Las mujeres tienen más probabilidades de someterse a la ablación del nódulo auriculoventricular para la FA que los varones124. Faltan datos sobre el control del riesgo cardiovascular específicamente para las mujeres. Los principios que se describen en la sección 11.3 deben aplicarse a las mujeres con FA.
Recomendaciones sobre las diferencias relacionadas con el sexo en la FA
| Recomendaciones | Clasea | Nivelb |
| Se debe ofrecer pruebas diagnósticas y tratamientos a mujeres y varones por igual para prevenir el ictus y otras complicaciones relacionadas con la FA423,1433 | I | A |
| Las mujeres con FA sintomática, paroxística o persistente deben tener el oportuno acceso a tratamientos para controlar el ritmo cardiaco, incluida la ablación con catéter, cuando se considere necesario por razones médicas1448,1451 | IIa | B |
FA: fibrilación auricular.
La atención médica basada en las GPC —es decir, la implementación de las recomendaciones sobre el diagnóstico y el tratamiento de pacientes individuales— tiene como objetivo mejorar los resultados de los pacientes y reducir los costes sanitarios1238,1434,1435, pero la adherencia a las guías es insuficiente en el mundo124,1436–1439,1440,1441. Se ha demostrado que la administración de NACO como tratamiento de primera línea se asoció con un aumento de la prevención del ictus de acuerdo con las guías de práctica clínica1442,1443.
La falta de adherencia a las GPC es multifactorial1215,1444,1445 e incluye factores relacionados con los profesionales sanitarios y con los sistemas de salud1446. Una estrategia terapéutica integral para la FA podría facilitar la adherencia a las GPC. Distintas intervenciones educativas280,284,290,1447,1448 basadas en las recomendaciones de las guías284 y adaptadas para cubrir las lagunas de conocimiento de los profesionales sanitarios y los pacientes con FA1446 podrían facilitar la implementación del tratamiento de la FA basado en la evidencia para mejorar los resultados clínicos277,1449–1452. Es necesario seguir investigando para identificar los tipos de intervenciones más coste-efectivas que podrían mejorar de forma eficaz los resultados clínicos, la adherencia a la medicación y la CdV de los pacientes.
15Medidas de calidad e indicadores de rendimiento clínico en el TRATAMIENTO de la fibrilación auricularLa medición de la calidad del servicio es una pieza fundamental para lograr el tratamiento óptimo de la FA y es un paso imprescindible hacia la medicina basada en valores. Los indicadores de calidad y rendimiento deben proporcionar a los médicos e instituciones las herramientas para medir la calidad de la atención sanitaria (p. ej., el cumplimiento de las recomendaciones de clase I de las guías antes del alta o al final de la consulta, las complicaciones después de procedimientos, el acceso a los servicios y el tiempo en lista de espera) y para identificar oportunidades de mejora. Estos indicadores deben captar los aspectos más importantes de la calidad de la atención, como la estructura, los procesos, la medición de resultados y la atención centrada en el paciente, manteniendo al mínimo la carga de trabajo relacionada con la elaboración de informes para los hospitales, consultas y profesionales de la salud658,1453–1455.
La ESC, EHRA, Asia Pacific Heart Rhythm Society, Heart Rhythm Society y Latin American Heart Rhythm Society han unido esfuerzos para desarrollar un paquete de indicadores de calidad para el diagnóstico y el tratamiento de la FA; en la tabla 22 se resumen estos indicadores que se han publicado también en un documento separado317. Los indicadores de calidad de la ESC están destinados a mejorar la calidad y medir el rendimiento mediante la vigilancia de aspectos significativos, y su integración en registros diseñados específicamente para identificar áreas de mejora en la práctica clínica, y no para clasificar a los profesionales o proveedores de salud ni para el pago de incentivos.
Resumen de los indicadores de calidad para el diagnóstico y el tratamiento de la FA.
| Dominio: evaluación de los pacientes (basal y en el seguimiento) |
|---|
| Indicador principal de calidad: evaluación del riesgo cardioembólico mediante la escala CHA2DS2-VASc |
| Indicador principal de calidad: evaluación del riesgo hemorrágico mediante un método validado, como la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED |
| Numerador: número de pacientes con FA cuya puntuación de riesgo se ha documentado en el momento del diagnóstico y en las consultas de seguimiento |
| Denominador: número de pacientes con FA |
| Dominio: anticoagulación |
| Indicador principal de calidad: prescripción inadecuada de anticoagulación para pacientes con CHA2DS2-VASc de 0 puntos los varones y 1 punto las mujeres |
| Numerador: número de pacientes con FA y CHA2DS2-VASc de 0 puntos (varones) o 1 punto (mujeres) a los que se ha prescrito anticoagulación inadecuadamente |
| Denominador: número de pacientes con FA y CHA2DS2-VASc de 0 puntos (varones) o 1 punto (mujeres) que no tienen otra indicación para la anticoagulación |
| Indicador principal de calidad: porcentaje de pacientes con CHA2DS2-VASc ≥ 1 punto (varones) o ≥ 2 puntos (mujeres) a los que se prescribe anticoagulación |
| Numerador: número de pacientes con FA y CHA2DS2-VASc ≥ 1 punto (varones) o ≥ 2 puntos (mujeres) a los que se prescribe anticoagulación |
| Denominador: número de pacientes con FA y CHA2DS2-VASc ≥ 1 punto (varones) o ≥ 2 puntos (mujeres) que son aptos para la anticoagulación, no tienen contraindicaciones o no la rechazan |
| Dominio: control de la frecuencia cardiaca |
| Indicador principal de calidad: prescripción inadecuada de FAA a pacientes con FA permanente (es decir, cuando no se planifica restaurar el ritmo sinusal) |
| Numerador: número de pacientes con FA permanente a los que se prescribe 1 o más FAA para el control del ritmo cardiaco |
| Denominador: número de pacientes con FA permanente |
| Dominio: control del ritmo cardiaco |
| Indicador principal de calidad: prescripción inadecuada de FAA de clase IC a pacientes con cardiopatía estructural |
| Numerador: número de pacientes con FA y cardiopatía estructural a los que se prescribe inadecuadamente FAA de clase IC |
| Denominador: número de pacientes con FA y cardiopatía estructural |
| Indicador principal de calidad: porcentaje de pacientes con FA sintomática, paroxística o persistente a los que se ofrece ablación con catéter de la FA tras el fracaso con un FAA de clase I o III o la intolerancia al tratamiento |
| Numerador: número de pacientes con FA sintomática, paroxística o persistente a los que se ofrece ablación con catéter de la FA tras el fracaso de al menos 1 FAA de clases I o III o la intolerancia al tratamiento |
| Denominador: número de pacientes con FA sintomática, paroxística o persistente que no tienen contraindicaciones para la ablación con catéter (o no la rechazan), permanecen sintomáticos a pesar del tratamiento con al menos 1 FAA de clase I o III o no toleran este tratamiento |
| Dominio: control de los factores de riesgo |
| Indicador principal de calidad: porcentaje de pacientes cuyos factores de riesgo modificables se han identificado |
| Numerador: número de pacientes con FA en los que se ha identificado los factores de riesgo modificables (p. ej., PA, obesidad, AOS, consumo excesivo de alcohol, falta de ejercicio, control glucémico inadecuado y tabaquismo) |
| Denominador: número de pacientes con FA |
| Dominio: resultados |
| Indicador principal de calidad: ictus isquémico o AIT |
| Indicador principal de calidad: hemorragia grave o potencialmente mortalb |
| Numerador: número de pacientes con FA en los que se ha documentado una complicación isquémica o hemorrágica |
| Denominador: respectivamente, número de pacientes con FA o número de pacientes a los que se prescribe un ACO |
ACO: anticoagulantes orales; AIT: accidente isquémico transitorio; AOS: apnea obstructiva del sueño; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); FA: fibrilación auricular; FAA: fármaco antiarrítmico; INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedente o predisposición a las hemorragias, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol; PA: presión arterial.
Recomendaciones sobre medidas de calidad en pacientes con FA
| Recomendaciones | Clasea | Nivelb |
| Los profesionales médicos y las instituciones deben considerar la introducción de instrumentos para medir la calidad de la atención sanitaria e identificar oportunidades para mejorar la calidad y los resultados de los tratamientos de los pacientes con FA317 | IIa | B |
FA: fibrilación auricular.
La incidencia de AHRE/FA subclínica en pacientes con marcapasos o dispositivos implantables es del 30-70%, pero podría ser más baja en la población general1458. Los episodios muy cortos (≤ 10-20 s/día) se consideran clínicamente irrelevantes, ya que no tienen una asociación importante con episodios más largos o con un aumento del riesgo de ictus o embolia sistémica1459. No obstante, los episodios más largos de AHRE/FA subclínica (un mínimo de 5-6 min) se asocian con un aumento del riesgo de FA clínica467,469, ictus isquémico168,467, MACE1460 y muerte cardiovascular1461.
En términos generales, el riesgo absoluto de ictus asociado con AHRE/FA subclínica puede ser más bajo que con la FA clínica160,168,226,467. La disociación temporal con el ictus agudo indica que los AHRE/FA subclínicas pueden ser un marcador más que un factor de riesgo de ictus4,7,1462 (cuadro 6 del material adicional).
Los datos disponibles actualmente se obtuvieron de la información de marcapasos/DAI o de pacientes que sufrieron un ictus, mientras que aumenta la comunicación de casos de AHRE/FA subclínica en distintos tipos de pacientes con monitorización cardiaca. Algunos estudios indican que 1 de cada 5-6 pacientes con diagnóstico de AHRE/FA subclínica tendrá FA clínica en los 2,5 años siguientes168. Aunque es preciso disponer de más datos de calidad para establecer el tratamiento óptimo de estos pacientes, un seguimiento y una monitorización más intensos para detectar precozmente la FA clínica es una estrategia prudente (mejor con el apoyo de monitorización a distancia). Hay que señalar que la carga de los AHRE/FA subclínica no es estática y puede cambiar de día a día469, por lo que se debe revaluar regularmente: cuanto mayor es la carga de AHRE/FA subclínica en el diagnóstico, mayor es el riesgo de progresión a episodios más largos469 (figura 24).
Progresión de la carga de episodios de frecuencia auricular rápida (panel izquierdo) y tasas de ictus, según la carga diaria de AHRE y la escala CHA2DS2-VASc (panel derecho). ACO: anticoagulantes orales; AHRE: episodios de frecuencia auricular rápida; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer).
aCuanto mayor sea la carga en el momento del diagnóstico, mayor será la incidencia de la progresión en los siguientes 6 meses y después.
bLas tasas de ictus superiores al umbral para los ACO se muestran en rojo.
Aunque la evidencia actual no permite justificar el empleo sistemático de ACO para los pacientes con AHRE/FA subclínica, se deben identificar y tratar los factores de riesgo de ictus modificables en cada paciente.
Los ACO podrían considerarse para algunos pacientes seleccionados con periodos más largos de AHRE/FA subclínica (≥ 24h) y un riesgo estimado alto de ictus4,1462, teniendo en cuenta el beneficio clínico neto predicho y la preferencias del paciente informado (figuras 24 y 25).
Estrategia propuesta para la detección y el seguimiento de AHRE/FA subclínica. ACO: anticoagulantes orales; AHRE: episodios de frecuencia auricular rápida; AI: aurícula izquierda; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); ERC: enfermedad renal crónica; FA: fibrilación auricular; FASC: fibrilación auricular subclínica; NdE: nivel de evidencia.
*Pacientes con riesgo muy alto (p. ej., pacientes con ictus previo o edad ≥ 75 años o con al menos 3 factores de riesgo según la escala CHA2DS2-VASc, como ERC, biomarcadores sanguíneos elevados, contraste espontáneo en ecocardiografía de AI dilatada, etc.); pacientes con riesgo alto (p. ej., pacientes con ictus previo o edad ≥ 75 años o con al menos 3 factores de riesgo según la escala CHA2DS2-VASc, etc.).
En 2 estudios recientes, iniciaron ACO el 76,4 y el 56,3% de los pacientes con al menos 2 factores clínicos de riesgo de ictus y FA ≥ 6min detectada por un monitor cardiaco insertable y confirmada por el médico, pero las tasas de hemorragias durante el seguimiento no se comunicaron1463,1464. En un estudio retrospectivo de grandes cohortes con datos de monitorización a distancia sobre la carga diaria de la FA, se observó una gran variación en la instauración de tratamiento anticoagulante en la práctica clínica. A través de los estratos de aumento de la carga de FA (de > 6 min a > 24h), el riesgo de ictus de los pacientes no tratados aumentó numéricamente y la asociación más fuerte entre los ACO y la reducción de ictus se observó en los pacientes con episodios de FA > 24 h detectados mediante dispositivos5.
Recomendaciones sobre el tratamiento de los pacientes con AHRE
| Recomendaciones | Clasea | Nivelb |
| Para pacientes con AHRE/FA subclínica detectadas mediante DECI u otro dispositivo de monitorización electrocardiográfica, se recomienda realizar: | ||
| • Evaluación cardiovascular completa con registros de ECG, evaluación de los factores clínicos de riesgo/comorbilidades y la evaluación del riesgo tromboembólico mediante la escala CHA2DS2-VASc469 | ||
| • Seguimiento y monitorización continua de los pacientes (preferiblemente con la ayuda de monitorización a distancia), para detectar la progresión a FA clínica, detectar la carga de AHRE/FA subclínica (especialmente la transición a ≥ 24 h) y detectar cambios en entidades clínicas subyacentes469 | I | B |
AHRE: episodios de frecuencia auricular rápida; DECI: dispositivo electrónico cardiaco implantable; ECG: electrocardiograma; FA: fibrilación auricular.
Aunque el flutter auricular puede existir como una arritmia aislada, un porcentaje significativo de pacientes después sufren FA1466–1470. Típicamente, el flutter auricular puede presentarse en pacientes tratados con FAA de clase IC o amiodarona1467,1468,1471. La vía ABC para la atención integral de la FA se puede aplicar en casi su totalidad a los pacientes con flutter auricular. Se recomienda que las estrategias para la prevención del ictus de los pacientes con flutter auricular, incluido el tratamiento periprocedimiento, sigan los mismos principios que en los pacientes con FA1472.
El control de la frecuencia debe ser el primer paso para el tratamiento de los síntomas. No obstante, la cardioversión a ritmo sinusal puede ser más efectiva, especialmente la cardioversión eléctrica o (si fuera posible) la estimulación de frecuencia alta1473,1474. Los FAA de clase III dofetilida e ibutilida por vía intravenosa son muy efectivos para revertir el flutter auricular, mientras que los fármacos de clase Ic flecainida y propafenona1475–1478 no se deben emplear en ausencia de tratamiento con bloqueadores del nódulo auriculoventricular, ya que pueden ralentizar la frecuencia auricular y promover así la conducción 1:1 con una frecuencia ventricular rápida1479,1480. La ablación con catéter del ICT es el tratamiento más efectivo para el control del ritmo en el flutter auricular dependiente del ICT732,1481,1482. Cuando se desarrolla flutter auricular típico en pacientes con FA durante el tratamiento con FAA de clase Ic o amiodarona, se debe considerar la ablación del ICT para asegurar que pueda continuar el tratamiento con FAA para el control del ritmo en la FA732,1481.
El flutter auricular atípico, o taquicardia auricular macrorreentrante, ocurre más frecuentemente en el miocardio auricular enfermo o con tejido cicatricial. En términos generales, el tratamiento del flutter auricular atípico o taquicardia auricular macrorreentrante sigue los mismos principios que el tratamiento del flutter auricular típico, pero la prescripción de FAA suele estar limitada por la presencia de cardiopatía estructural significativa y la ablación es más compleja1336.
Las intervenciones para tratar las taquicardias auriculares (flutter auricular atípico o taquicardia auricular macrorreentrante) que ocurren poco después de la ablación con catéter de la FA se deben retrasar y, en su lugar, se debe considerar el control inicial de la frecuencia o administrar FAA, ya que algunas de estas taquiarritmias son transitorias y cesan cuando maduran las lesiones creadas en el procedimiento inicial1483–1485. Para más información sobre el flutter auricular, consulte el cuadro 7 del material adicional y la guía de la ESC sobre taquicardias supraventriculares publicada en 20191336.
18Mensajes clave- 1.
El diagnóstico de FA se debe confirmar mediante ECG convencional de 12 derivaciones o tira de ritmo que muestre FA ≥ 30 s.
- 2.
La caracterización estructurada de la FA, que incluye el riesgo de ictus, la gravedad de los síntomas, la gravedad de la carga y el sustrato de la FA, ayuda a mejorar el tratamiento personalizado de los pacientes con FA.
- 3.
Las nuevas herramientas y tecnologías para el cribado y la detección de la FA, como microimplantes y dispositivos portátiles, ofrecen oportunidades diagnósticas adicionales para los pacientes con riesgo de FA. Sin embargo, las vías de atención médica basadas en estos instrumentos no están suficientemente definidas.
- 4.
La atención holística integral de los pacientes con FA es esencial para mejorar los resultados.
- 5.
Es preciso considerar e incorporar los valores de los pacientes a la toma de decisiones terapéuticas y las vías de atención de la FA; la evaluación estructurada de los resultados referidos por los pacientes (RRP) es un elemento importante para documentar y medir el éxito del tratamiento.
- 6.
La vía ABC optimiza la atención integral de los pacientes con FA en todos los niveles de atención y entre distintas especialidades.
- 7.
La evaluación clínica estructurada del riesgo tromboembólico individual, con base en escalas de riesgo (CHA2DS2-VASc) debe ser el primer paso para el control óptimo del riesgo tromboembólico de los pacientes con FA.
- 8.
Los pacientes con FA y factores de riesgo de ictus deben recibir tratamiento anticoagulante oral para la prevención del ictus. Para los pacientes aptos para NACO, estos son preferibles a los AVK.
- 9.
La evaluación formal estructurada del riesgo hemorrágico mediante, por ejemplo, la escala INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol' alt='hipertensión, función renal/hepática anormal, ictus, historia o predisposición al sangrado, INR lábil, edad ≥ 65 años, consumo concomitante de drogas/alcohol'>HAS-BLED
Un elevado riesgo hemorrágico no debe llevar automáticamente a la retirada de los ACO a los pacientes con FA y riesgo de ictus. En su lugar, deben controlarse los factores de riesgo hemorrágico modificables y planificar revisiones y seguimiento más frecuentes para los pacientes con riesgo alto.
El control de la frecuencia es una parte integral del tratamiento de la FA y suele ser suficiente para mejorar los síntomas relacionados con la FA.
La primera indicación para el control del ritmo con cardioversión, FAA o ablación con catéter es la reducción de los síntomas relacionados con la FA y mejorar la calidad de vida.
En la decisión de iniciar tratamiento con FAA a largo plazo, se debe valorar la carga de los síntomas, las posibles reacciones adversas a los fármacos, particularmente la proarritmia inducida por fármacos o los efectos secundarios extracardiacos, y las preferencias del paciente.
La ablación con catéter es un tratamiento bien establecido para la prevención de las recurrencias de la FA. Cuando la realizan operadores entrenados adecuadamente, la ablación con catéter es una alternativa segura y superior a los FAA para mantener el ritmo sinusal y mejorar los síntomas.
Se debe evaluar y considerar los factores más importantes de riesgo de recurrencia de la FA para tomar decisiones sobre el tratamiento intervencionista.
Para pacientes con FA y FEVI normal, no está demostrado que la ablación con catéter reduzca la mortalidad total ni los ictus. Para pacientes con FA y miocardiopatía inducida por taquicardia, la ablación con catéter revierte la disfunción del VI en la mayoría de los casos.
La pérdida de peso, el control estricto de los factores de riesgo y evitar los factores desencadenantes de la FA son estrategias importantes para mejorar los resultados del control del ritmo.
La identificación y el tratamiento de los factores de riesgo y las enfermedades concomitantes forman parte integral del tratamiento de los pacientes con FA.
Para pacientes con FA y SCA que se someten a una ICP no compleja, se debe considerar la interrupción temprana del AAS y cambiar a tratamiento antitrombótico doble con ACO y un inhibidor del P2Y12.
Los pacientes con AHRE deben ser monitorizados regularmente para detectar la progresión a FA clínica y los cambios en el riesgo protrombótico individual (cambios en la puntuación CHA2DS2-VASc). Para pacientes con AHRE más largos (especialmente > 24 h) y una puntuación CHA2DS2-VASc alta, es razonable considerar el uso de ACO si se anticipa un beneficio clínico neto positivo en la toma conjunta de decisiones terapéuticas.
Aunque se han realizado progresos desde la publicación en 2016 de la guía de la ESC sobre FA, las lagunas de conocimiento identificadas en esa guía persisten en 2020, lo cual refleja la necesidad de seguir investigando más intensamente. En 2019, la EHRA publicó un libro blanco que aborda en detalle las lagunas más importantes en el campo de la FA1486. La siguiente lista resume las lagunas más relevantes en el conocimiento de la FA:
- •
Modificadores más importantes que causan fibrilación auricular
Los mecanismos de la FA aún no se conocen en profundidad. El mayor conocimiento de estos mecanismos en pacientes individuales, por ejemplo, pacientes con remodelado cardiaco estructural o insuficiencia cardiaca, podría mejorar la selección de tratamientos, incluidas las estrategias para un mejor control de la frecuencia y el ritmo y la ACO.
No se ha determinado en qué medida las intervenciones educativas se traducen en cambios reales del comportamiento (pacientes y médicos) que llevarían a tratamientos y resultados clínicos mejores, particularmente para los pacientes con FA y múltiples morbilidades.
- •
Implementación de tecnologías digitales para el cribado, el diagnóstico y la estratificación del riesgo del paciente con fibrilación auricular
Las nuevas técnicas de análisis digital del ECG (p. ej., aprendizaje automático e inteligencia artificial) y las nuevas tecnologías (dispositivos portátiles e insertables) han abierto un campo de potenciales oportunidades para la detección y el diagnóstico de la FA. Estas innovaciones podrían ayudar a personalizar el tratamiento y la estratificación del riesgo. Son necesarios más estudios para evaluar estas nuevas oportunidades y definir los grupos de pacientes que se podrían beneficiar.
- •
Tipo de fibrilación auricular
Existe una laguna del conocimiento en relación con la clasificación de la FA. Datos recientes indican que la FA paroxística no es una entidad. Según el patrón de FA, el tipo de tratamiento y los resultados podrían ser diferentes1487. Son necesarios más estudios en este campo.
- •
¿En qué medida la fibrilación auricular hace imperativo el tratamiento?
Es necesario definir más claramente el umbral de carga de la FA en el que iniciar el tratamiento anticoagulante oral. Esta laguna de conocimiento ha ocasionado una variabilidad considerable en las actitudes médicas y en modelos de práctica clínica5.
Se esperan los resultados de 2 ECA sobre pacientes con FA subclínica detectada mediante un DECI: Apixaban for the Reduction of Thrombo-Embolism in Patients With Device-Detected Sub-Clinical Atrial Fibrillation (NCT 01938248) y NOAH (Non-vitamin K AntagonistOral Anticoagulants in PatientsWith Atrial High Rate Episodes, NCT 02618577).
- •
Papel de los biomarcadores en el tratamiento de la fibrilación auricular
Aunque algunos estudios han demostrado la utilidad de la determinación de biomarcadores (incluidos péptidos natriuréticos y troponina) para la evaluación del riesgo de ictus, no está claro el momento más oportuno para evaluar los biomarcadores, los puntos de corte óptimos y el efecto en las decisiones terapéuticas basadas en los cambios de concentración de biomarcadores a lo largo del tiempo, especialmente con el envejecimiento y el desarrollo de comorbilidades.
- •
Riesgo de ictus en poblaciones específicas
Algunos estudios investigaron el efecto de ciertos biomarcadores en la predicción del riesgo de complicaciones relacionadas con la FA, incluido el ictus, en poblaciones específicas. Sin embargo, se desconoce si los biomarcadores y las escalas basadas en ellos ayudan de forma práctica a los médicos a refinar la evaluación del riesgo de ictus, especialmente en cohortes prospectivas no anticoaguladas, y particularmente por la naturaleza dinámica del riesgo de ictus y porque muchos de los biomarcadores actuales no son específicos de la FA ni de los resultados relacionados con ella.
Existen dudas sobre el riesgo real de ictus en los AHRE, comparado con el riesgo real de ictus en la FA manifiesta, en cohortes emparejadas adecuadamente en situaciones similares, y sobre el efecto de las estrategias terapéuticas apropiadas.
La relación entra la FA y el sexo ha sido objeto de más investigación. Los varones con FA tienen menos probabilidades de tener HTA o valvulopatías que las mujeres1488. Las mujeres suelen presentar síntomas atípicos relacionados con la FA. Son necesarios estudios comparativos en diferentes situaciones y grupos étnicos sobre el efecto de los diferentes factores de riesgo de ictus y del sexo femenino en los riesgos de ictus y hemorragias.
- •
Tratamiento anticoagulante para pacientes específicos
Existe una laguna del conocimiento sobre las dosis de NACO óptimas para grupos específicos, incluidos los pacientes con ERC leve o moderada, con un índice de masa corporal muy bajo o muy alto o que toman medicación con un riesgo alto de interacción metabólica1489.
En cuanto a los pacientes con un AclCr ≤ 25ml/min, no hay datos de ECA sobre el efecto del tratamiento con AVK o NACO, debido a la exclusión de estos pacientes de los estudios más importantes. No obstante, 2 ECA (NCT02933697 y NCT03987711) están investigando actualmente el uso de ACO y comparando la administración de NACO frente a AVK para pacientes con enfermedad renal avanzada.
- •
Anticoagulación para pacientes con valvulopatías
Existen lagunas en la evidencia sobre los NACO para pacientes con enfermedad mitral reumática y durante los primeros 3 meses tras el implante quirúrgico o percutáneo de una bioprótesis; los datos de estudios observacionales sobre NACO tras un TAVI son conflictivos1163.
- •
Anticoagulación para pacientes con fibrilación auricular tras un evento de ictus o hemorrágico
Debido a la falta de datos de calidad derivados de ECA sobre el momento óptimo para la administración de anticoagulación tras el ictus isquémico agudo, la prescripción de ACO en el periodo temprano tras el ictus se basa actualmente en el consenso de expertos. Varios estudios en desarrollo —ELAN (NCT03148457), OPTIMAS (EudraCT, 2018-003859-3), TIMING (NCT02961348) y START (NCT03021928)— están evaluando las diferencias entre 2 estrategias: el inicio temprano de NACO (< 1 semana) o el inicio más tardío para pacientes con ictus isquémico relacionado con FA.
- •
Cierre de la orejuela izquierda para la prevención del ictus
Se han realizado más estudios en este campo. Hay evidencia clara sobre la seguridad y las posibles complicaciones del procedimiento de cierre de la OI450–454. Sin embargo, aún hay lagunas del conocimiento que requieren atención: a) el tratamiento antitrombótico tras el cierre de la OI no se ha evaluado en estudios aleatorizados, y b) es preciso evaluar la eficacia y la seguridad del cierre de la OI frente al tratamiento anticoagulante en estudios aleatorizados.
El empleo de oclusores de la OI no se ha comparado con el tratamiento con NACO para pacientes con riesgo hemorrágico o con cierre/exclusión quirúrgica de la OI.
- •
Exclusión quirúrgica de la orejuela izquierda
Los datos de ECA457–459 sobre la exclusión quirúrgica de la OI son muy escasos. Aunque está en desarrollo un gran estudio de pacientes sometidos a un procedimiento quirúrgico combinado462, son necesarios ECA con suficiente potencia estadística.
Son necesarios ECA con suficiente potencia para definir las indicaciones más adecuadas de cierre/exclusión de la OI frente al tratamiento con ACO para pacientes con contraindicaciones relativas o absolutas para la anticoagulación, para los pacientes anticoagulados que sufren un ictus isquémico y para la evaluación del tratamiento antitrombótico más adecuado tras el cierre de la OI.
- •
Técnica de ablación con catéter de la fibrilación auricular
La mejor estrategia para un seguro y rápido aislamiento permanente de venas pulmonares en un solo procedimiento aún es una laguna del conocimiento respeto a las nuevas tecnologías para la ablación con catéter. Además, se desconoce si la ablación de zonas adicionales mejoraría los resultados de la ablación con catéter de la FA1490.
- •
Resultados de la ablación con catéter de la fibrilación auricular
Deben investigarse los siguientes aspectos en futuros estudios:
- •
La eficacia de la ablación temprana de la FA para prevenir la progresión de la FA.
- •
La medición de resultados más adecuada (FA de 30 s, carga de la FA, etc.) para los resultados relacionados con la FA.
- •
Cuánto es necesario reducir la carga de la FA para lograr un efecto en los resultados «duros» como la supervivencia, el ictus y las comorbilidades.
- •
El mecanismo principal del AVP que se traduce en ausencia de FA.
- •
El efecto potencial de la estructura y la función cardiacas en la posibilidad de éxito de la ablación con catéter de la FA.
A pesar de la publicación de los estudios CABANA y CASTLE-AF, son necesarios más datos sobre el efecto de la ablación con catéter de la FA en los resultados clínicos como muerte, ictus, hemorragias graves, recurrencia de la FA, CdV y parada cardiaca.
Es necesario investigar la relación entre el grado de dilatación/fibrosis y el éxito de la ablación con catéter de la FA. Además, el impacto de componentes específicos de la cardiopatía estructural, como la estructura/función de la AI, la estructura del VI, etc., en el éxito de la ablación con catéter de la FA y la probabilidad de recurrencias requiere más estudios.
- •
- •
¿Qué pacientes podrían obtener menos beneficios de la ablación con catéter de la fibrilación auricular?
Existen lagunas en el conocimiento sobre los subgrupos de pacientes que se beneficiarían menos de la ablación con catéter de la FA, entre los que se incluyen: a) los pacientes con FA persistente o persistente de larga duración; b) los pacientes con dilatación o fibrosis auricular; c) los pacientes con flutter auricular atípico, y d) los pacientes con factores de riesgo de recurrencia de FA, incluidas la obesidad y la apnea del sueño.
- •
Cirugía toracoscópica solo de la fibrilación auricular
No hay datos convincentes sobre los efectos de la ablación quirúrgica en un procedimiento separado o combinado con cierre/exclusión de la OI en los resultados relativos a la CdV, el ictus y la muerte.
- •
Tratamiento personalizado
El fenotipo de la arritmia puede variar entre pacientes. La evaluación adecuada del proceso fisiopatológico de los pacientes individuales que tenga en cuenta las características clínicas, biomarcadores sanguíneos y la determinación no invasiva del sustrato (eco/RM/TC) podría mejorar el tratamiento personalizado (p. ej., la selección del control del ritmo, sí o no; tratamiento de factores de riesgo y comorbilidades; tipo de FAA; ablación auricular, y el tipo/técnicas empleadas para la FA).
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones sobre el diagnóstico de la FA | ||
| Se requiere documentación de ECG para establecer el diagnóstico de FA | ||
| • El ECG estándar de 12 derivaciones o un trazado de ECG de una derivación ≥ 30 s que muestren un ritmo cardiaco con ondas P repetidas no discernibles e intervalos RR irregulares (siempre que no haya trastorno de la conducción auriculoventricular) son diagnósticos de FA | I | B |
| Recomendaciones sobre el cribado de la FA | ||
| Se recomienda el cribado oportunista de la FA mediante la palpación del pulso o tiras de ritmo de ECG para pacientes mayores de 65 años | I | B |
| Se recomienda revisar regularme el marcapasos o DAI para la detección de AHRE | I | B |
| Durante el cribado de la FA se recomienda: | ||
| • Informar a los individuos objeto de cribado sobre la importancia de la detección de la FA y sus implicaciones terapéuticas | ||
| • Organizar una plataforma estructurada de referencia para los casos de cribado positivos para las posteriores evaluación clínica y confirmación del diagnóstico por personal médico y para proporcionar atención médica óptima a los pacientes con FA confirmada | ||
| • El diagnóstico definitivo de FA en los casos de cribado positivos solo se establece cuando el médico revise el ECG de 12 derivaciones o de 1 derivación (≥ 30 s) y confirme la FA | I | B |
| Recomendaciones para la evaluación diagnóstica de los pacientes con FA | ||
| Para pacientes con FA, se recomienda: | ||
| • Evaluar los síntomas relacionados con la FA (fatiga, cansancio, disnea relacionada con el esfuerzo, palpitaciones y dolor torácico) y cuantificar el estado sintomático de los pacientes mediante la escala EHRA modificada, antes y después de instaurar el tratamiento | ||
| • Evaluar los síntomas relacionados con la FA antes y después de la cardioversión de la FA persistente para guiar las decisiones sobre el tratamiento antiarrítmico | I | C |
| Para pacientes con AHRE/FA subclínica detectadas mediante DECI u otro dispositivo de monitorización electrocardiográfica, se recomienda: | ||
| • Evaluación cardiovascular completa con registros de ECG, evaluación de los factores clínicos de riesgo/comorbilidades y la evaluación del riesgo tromboembólico mediante la escala CHA2DS2-VASc | ||
| • Seguimiento y monitorización continua de los pacientes (preferiblemente con la ayuda de monitorización a distancia), para detectar la progresión a FA clínica, detectar la carga de AHRE/FA subclínica (especialmente la transición a ≥ 24 h) y detectar cambios en entidades clínicas subyacentes | I | B |
| Recomendaciones sobre el abordaje integral de la FA | ||
| Para optimizar la toma compartida de decisiones sobre opciones específicas de tratamiento de la FA, se recomienda: | ||
| • Informar al paciente sobre las ventajas/limitaciones y riesgos/beneficios de las opciones de tratamiento que se están valorando y | ||
| • Discutir con el paciente la carga potencial del tratamiento e incluir en la toma de decisiones la percepción del paciente sobre ello | I | C |
| Se recomienda registrar regularmente los resultados referidos por los pacientes para medir la eficacia del tratamiento y mejorar el cuidado de los pacientes | I | C |
| Recomendaciones para la prevención de eventos tromboembólicos en la FA | ||
| Para la prevención del ictus en pacientes con FA aptos para los ACO, se recomienda emplear un NACO en lugar de un AVK (excepto para pacientes con válvulas mecánicas o estenosis mitral de moderada a grave) | I | A |
| Para la evaluación del riesgo de ictus, se recomienda una estrategia basada en la evaluación de los factores de riesgo mediante la escala clínica CHA2DS2-VASc para identificar inicialmente a los pacientes con «riesgo bajo de ictus» (CHA2DS2-VASc de 0 puntos los varones y 1 punto las mujeres), a los que no se debe ofrecer tratamiento antitrombótico | I | A |
| Se recomienda la administración de ACO para la prevención del ictus en pacientes con FA y CHA2DS2-VASc ≥ 2 los varones o ≥ 3 las mujeres | I | A |
| Se recomienda la evaluación estructurada del riesgo hemorrágico mediante una escala formal de riesgo para identificar los factores de riesgo hemorrágico no modificables y tratar los factores de riesgo modificables en todos los pacientes con FA e identificar a los pacientes con un riesgo potencialmente alto para planificar revisiones clínicas y seguimiento más precoces y frecuentes | I | B |
| Se recomienda revaluar los riesgos de ictus y hemorrágico a intervalos periódicos para informar las decisiones sobre el tratamiento (p. ej., inicio de ACO en pacientes cuyo riesgo de ictus aumenta de bajo a moderado o alto) y tratar factores de riesgo hemorrágico potencialmente modificables | I | B |
| Cuando se administre un AVK, se recomienda una INR 2,0-3,0, con un TRT individual ≥ 70% | I | B |
| Para pacientes tratados con AVK y con TRT corto (p. ej., < 70%), se recomienda cambiar a un NACO siempre que se asegure una buena adherencia y la continuidad del tratamiento | I | B |
| El tratamiento antiagregante solo (monoterapia o AAS combinado con clopidogrel) no está recomendado para la prevención del ictus en la FA | III | A |
| En ausencia de contraindicaciones absolutas a los ACO, el riesgo hemorrágico estimado no debe por sí solo guiar las decisiones sobre la prescripción de ACO para la prevención del ictus | III | A |
| El patrón clínico de la FA (diagnosticada por primera vez, paroxística, persistente, persistente de larga duración o permanente) no debe condicionar la indicación de tromboprofilaxis | III | B |
| Recomendaciones sobre el control del riesgo de ictus antes, durante y después de la cardioversión | ||
| Para pacientes con FA que van a someterse a cardioversión, se recomienda la administración de NACO con un perfil de eficacia y seguridad al menos similar a la warfarina | I | A |
| Para la cardioversión de la FA/flutter auricular, se recomienda la anticoagulación efectiva al menos las 3 semanas previas a la cardioversión | I | B |
| Se recomienda la ETE para excluir trombos cardiacos como alternativa a la anticoagulación durante las 3 semanas previas al procedimiento cuando se planifica una cardioversión precoz | I | B |
| Para pacientes con riesgo de ictus, se recomienda mantener el tratamiento anticoagulante a largo plazo después de la cardioversión, según las recomendaciones específicas sobre anticoagulación por tiempo indefinido, independientemente del método empleado para la cardioversión, el mantenimiento aparente del ritmo sinusal o la caracterización de la FA como un «episodio diagnosticado por primera vez» | I | B |
| Para pacientes con trombos identificados por ETE, se recomienda la anticoagulación efectiva al menos las 3 semanas previas a la cardioversión de la FA | I | B |
| Se recomienda advertir encarecidamente a los pacientes sobre la importancia de la adherencia y la continuidad del tratamiento con NACO antes y después de la cardioversión | I | C |
| Recomendaciones para el control del riesgo de ictus antes, durante y después de la ablación con catéter | ||
| Para pacientes con FA y factores de riesgo de ictus que no toman ACO antes de la ablación, se recomienda que el control del riesgo de ictus incluya la instauración de anticoagulación periprocedimiento, preferiblemente ACO terapéuticos al menos las 3 semanas previas a la ablación | I | C |
| Para pacientes que se van a someter a ablación con catéter de la FA y han recibido anticoagulación terapéutica con warfarina, dabigatrán, rivaroxabán, apixabán o edoxabán, se recomienda realizar el procedimiento de ablación sin interrumpir los ACO | I | A |
| Después de la ablación con catéter de la FA, se recomienda que: | ||
| • La anticoagulación sistémica con warfarina o un NACO se mantenga durante al menos 2 meses, y | ||
| • La anticoagulación sistémica a largo plazo (≥ 2 meses tras la ablación) se base en el perfil de riesgo de ictus del paciente y no en el éxito o el fracaso aparente del procedimiento de ablación | I | C |
| Recomendaciones sobre anticoagulación posoperatoria tras la cirugía de la FA | ||
| Se recomienda el tratamiento anticoagulante oral a largo plazo para pacientes sometidos a cirugía de la FA y cierre de la OI, según el riesgo tromboembólico del paciente evaluado mediante la escala CHA2DS2-VASc | I | C |
| Recomendaciones para pacientes con FA y SCA, ICP o SCC | ||
| Para pacientes con FA aptos para tratamiento con un NACO, estos son preferibles a los AVK, en combinación con un antiagregante plaquetario | I | A |
| Para pacientes con FA y SCA que se van a someter una ICP no compleja, se recomienda la suspensión temprana (≤ 1 semana) del AAS y continuar con tratamiento doble con un ACO y un inhibidor del P2Y12 (preferiblemente clopidogrel) por un periodo de hasta 12 meses si el riesgo de trombosis del stent es bajo o prevalece el riesgo hemorrágico sobre el riesgo de trombosis del stent, independientemente del tipo de stent implantado | I | B |
| Tras una ICP sin complicaciones, se recomienda la suspensión temprana (≤ 1 semana) del AAS y continuar con tratamiento doble con un ACO y clopidogrel durante un periodo de hasta 6 meses si el riesgo de trombosis del stent es bajo o prevalece el riesgo hemorrágico sobre el riesgo de trombosis del stent, independientemente del tipo de stent implantado | I | B |
| Recomendaciones sobre prevención secundaria del ictus en pacientes con FA e ictus isquémico agudo | ||
| Para pacientes con ictus isquémico o AIT, se recomienda la prevención secundaria del ictus con la administración a largo plazo de un ACO, siempre que no haya contraindicaciones estrictas; para pacientes candidatos a tratamiento con un NACO, este es preferible a un AVK | I | A |
| Para pacientes que ingresan con ictus isquémico agudo, no se recomienda la anticoagulación con HNF, HBPM o AVK en las primeras 48 h | III | B |
| Recomendaciones para pacientes con valvulopatía cardiaca y FA | ||
| Los NACO está contraindicados para pacientes con válvula cardiaca mecánica | III | B |
| Los NACO no están recomendados para pacientes con FA y estenosis mitral de moderada a grave | III | C |
| Recomendaciones sobre el tratamiento de la FA durante el embarazo | ||
| Se recomienda la anticoagulación terapéutica con heparina o AVK dependiendo del periodo de gestación para las pacientes con FA | I | C |
| Recomendaciones sobre el tratamiento de hemorragias activas de pacientes que toman ACO | ||
| Para pacientes con FA y hemorragia activa grave, se recomienda: | ||
| • Interrumpir el ACO hasta que se identifique la causa de la hemorragia y se resuelva el sangrado activo y | ||
| • Realizar con prontitud un diagnóstico específico e intervenciones terapéuticas para identificar y tratar la causa y el origen de la hemorragia | I | C |
| Recomendaciones para el control de la frecuencia ventricular en pacientes con FA | ||
| Se recomienda el uso de bloqueadores beta, diltiazem o verapamilo como fármacos de primera línea para el control de la frecuencia cardiaca de pacientes con FA y FEVI ≥ 40% | I | B |
| Los bloqueadores beta y la digoxina están recomendados para el control de la frecuencia cardiaca de pacientes con FA y FEVI < 40% | I | B |
| Recomendaciones sobre el tratamiento de la FA durante el embarazo | ||
| Los bloqueadores beta selectivos están recomendados para el control de la frecuencia cardiaca en la FA | I | C |
| Recomendaciones sobre el control del ritmo cardiaco | ||
| Se recomienda tratamiento para el control del ritmo cardiaco para mejorar los síntomas y la CdV de pacientes con FA sintomáticos | I | A |
| Recomendaciones sobre cardioversión | ||
| Para la cardioversión farmacológica de la FA de reciente aparición se recomienda el vernakalant intravenoso (excluidos los pacientes con SCA reciente o insuficiencia cardiaca grave) o flecainida o propafenona (excluidos los pacientes con cardiopatía estructural grave) | I | A |
| Se recomienda la amiodarona intravenosa para la cardioversión de la FA de pacientes con insuficiencia cardiaca o cardiopatía estructural si el retraso de la cardioversión está justificada por la situación clínica | I | A |
| Se recomienda la cardioversión de la FA (eléctrica o farmacológica) como parte del tratamiento de control del ritmo cardiaco para pacientes sintomáticos con FA persistente o persistente de larga duración | I | B |
| La cardioversión farmacológica de la FA está indicada solo para pacientes hemodinámicamente estables tras considerar el riesgo tromboembólico | I | B |
| Se recomienda la cardioversión eléctrica urgente para pacientes con FA e inestabilidad hemodinámica aguda o que empeora | I | B |
| En pacientes con síndrome del seno enfermo, alteraciones de la conducción auriculoventricular o QTc prolongado (> 500 ms), no se debe intentar la cardioversión farmacológica, excepto cuando se haya valorado el riesgo de proarritmia y bradicardia | III | C |
| Recomendaciones sobre el tratamiento de la FA durante el embarazo | ||
| Se recomienda la cardioversión eléctrica inmediata en caso de inestabilidad hemodinámica o preexcitación de la FA | I | C |
| Recomendaciones para el control del ritmo y la ablación con catéter de la FA | ||
| Para tomar decisiones sobre la ablación con catéter de la FA, se recomienda valorar los riesgos del procedimiento y los principales factores de riesgo de recurrencia de la FA tras el procedimiento, que deben discutirse con los pacientes | I | B |
| Ablación con catéter de la FA tras el fracaso del tratamiento farmacológico | ||
| Se recomienda la ablación con catéter de las venas pulmonares para el control del ritmo cardiaco en caso de fracaso o intolerancia al tratamiento con FAA de clase I o III para mejorar los síntomas de recurrencia de los pacientes con: | I | |
| • FA paroxística o | A | |
| • FA persistente sin factores de riesgo de recurrencia de la FA importantes o | A | |
| • FA persistente con factores de riesgo de recurrencia de la FA importantes | B | |
| Tratamiento de primera línea | ||
| La ablación con catéter de la FA está recomendada para revertir la disfunción del VI en pacientes con FA cuando la miocardiopatía inducida por taquicardia sea muy probable, independientemente del estado sintomático | I | B |
| Técnicas y tecnologías | ||
| Se recomienda el aislamiento eléctrico completo de las venas pulmonares en todos los procedimientos de ablación con catéter de la FA | I | A |
| Modificación del estilo de vida y otras estrategias para mejorar los resultados de la ablación | ||
| Se recomienda la pérdida de peso para los pacientes obesos con FA, especialmente si están siendo evaluados para ablación con catéter de la FA | I | B |
| Se recomienda el control estricto de los factores de riesgo y evitar los factores desencadenantes como parte de la estrategia para el control del ritmo cardiaco | I | B |
| Recomendaciones sobre el empleo a largo plazo de fármacos antiarrítmicos | ||
| La flecainida o la propafenona están recomendadas para el control del ritmo a largo plazo para pacientes con FA, función del VI normal y sin enfermedad estructural, incluidas la HVI y la isquemia miocárdica significativas | I | A |
| La dronedarona está recomendada para el control del ritmo a largo plazo de los pacientes con FA y: | ||
| • Función del VI normal o con deterioro leve (pero estable) o | ||
| • IC-FEc, cardiopatía isquémica o HVI | I | A |
| La amiodarona está recomendada para el control del ritmo a largo plazo para todos los pacientes con FA, incluidos los pacientes con IC-FEr. Sin embargo, debido a su toxicidad extracardiaca, deben considerarse primero otros FAA siempre que sea posible | I | A |
| Para pacientes tratados con sotalol, se recomienda un control adecuado del intervalo QT, concentraciones séricas de potasio, AclCr y otros factores de riesgo de proarritmia | I | B |
| El tratamiento con FAA no está recomendado para pacientes con FA permanente en tratamiento para el control de la frecuencia cardiaca o con alteraciones avanzadas de la conducción, excepto cuando se disponga de marcapasos para prevenir la bradicardia | III | C |
| Recomendaciones sobre intervenciones en el estilo de vida, control de factores de riesgo y tratamiento de enfermedades concomitantes de pacientes con FA | ||
| Se recomienda identificar y controlar los factores de riesgo y las enfermedades concomitantes como parte integral del tratamiento de los pacientes con FA888 | I | B |
| Se recomienda modificar hábitos de vida poco saludables y el tratamiento por objetivos de las enfermedades concomitantes para reducir la carga de la FA y la intensidad de los síntomas | I | B |
| Se recomienda el cribado oportunista de la FA en pacientes hipertensos | I | B |
| Se recomienda un buen control de la PA de los pacientes con FA e hipertensión para reducir la recurrencia de la FA y los riesgos de ictus y hemorrágico | I | B |
| Recomendaciones sobre actividades deportivas para pacientes con FA | ||
| Se recomienda asesorar a los atletas profesionales acerca de que la práctica prolongada de deportes intensos puede favorecer la aparición de FA, mientras que la actividad física de intensidad moderada está recomendada para prevenir la FA | I | B |
| Recomendaciones sobre la FA posoperatoria | ||
| Se recomienda el tratamiento perioperatorio con amiodarona o bloqueadores beta para la prevención de la FA posoperatoria tras la cirugía cardiaca | I | A |
| No se debe administrar sistemáticamente bloqueadores beta para la prevención de la FA posoperatoria a pacientes que se van a someter a cirugía no cardiaca | III | B |
| Recomendaciones sobre las diferencias relacionadas con el sexo en la FA | ||
| Se debe ofrecer pruebas diagnósticas y tratamientos a mujeres y varones por igual para prevenir el ictus y otras complicaciones relacionadas con la FA | I | A |
AAS: ácido acetilsalicílico; AclCr: aclaramiento de creatinina; ACO: anticoagulantes orales; AHRE: episodios de frecuencia auricular rápida; AIT: accidente isquémico transitorio; AVK: antagonistas de la vitamina K; AVP: aislamiento de vena pulmonar; CdV: calidad de vida; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65–74 años y sexo (mujer); DAI: desfibrilador automático implantable; DECI: dispositivo electrónico cardiaco implantable; ECG: electrocardiograma; ETE: ecocardiografía transesofágica; FA: fibrilación auricular; FAA: fármaco antiarrítmico; FEVI: fracción de eyección del ventrículo izquierdo; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; HVI: hipertrofia ventricular izquierda; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; ICP: intervención coronaria percutánea; INR: razón internacional normalizada; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PA: presión arterial; RRP: resultado referido por el paciente; SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; TRT: tiempo en rango terapéutico; VI: ventrículo izquierdo.
El material adicional con figuras, tablas y texto complementario al texto principal está disponible en las páginas web de European Heart Journal y la ESC a través del enlace www.escardio.org/guidelines.
22AnexoFiliación de los autores y miembros del Grupo de Trabajo: Nikolaos Dagres, Department of Electrophysiology, Heart Center Leipzig, University of Leipzig, Leipzig, Alemania; Elena Arbelo, Departamento de Arritmias, Instituto Cardiovascular, Hospital Clínic de Barcelona, Barcelona, España; Jeroen J. Bax, Cardiology, Leiden University Medical Center, Leiden, Países Bajos; Carina Blomström-Lundqvist, Department of Medical Science and Cardiology, Medicine, Uppsala, Suecia; Giuseppe Boriani, Cardiology Division, Department of Biomedical, Metabolic and Neural Sciences, University of Modena and Reggio Emilia, Policlinico di Modena, Módena, Italia; Manuel Castella, Cirugía Cardiovascular, Hospital Clínic de Barcelona, Universidad de Barcelona, Barcelona, España; Gheorghe-Andrei Dan, Cardiology Department, Internal Medicine Clinic, «Carol Davila» University of Medicine, Colentina University Hospital, Bucarest, Rumanía; Polychronis E. Dilaveris, 1st University Department of Cardiology, National & Kapodistrian University of Athens School of Medicine, Atenas, Grecia; Laurent Fauchier, Department of Cardiology, Centre Hospitalier Universitaire Trousseau and University of Tours, Tours, Francia; Gerasimos Filippatos, Department of Cardiology, Attikon University Hospital, National and Kapodistrian University of Athens, Atenas, Grecia; Jonathan M. Kalman, Department of Cardiology, Royal Melbourne Hospital and University of Melbourne, Melbourne, Australia; Mark La Meir, Cardiac surgery, UZ Brussel, Bruselas, Bélgica; Deirdre A. Lane, Liverpool Centre for Cardiovascular Science, University of Liverpool and Liverpool Heart & Chest Hospital, Liverpool, Reino Unido y Department of Clinical Medicine, Aalborg University, Aalborg, Dinamarca; Jean-Pierre Lebeau, Department of General Practice, University of Tours, Tours, Francia; Maddalena Lettino, Cardiovascular, San Gerardo Hospital, ASST-Monza, Monza, Italia; Gregory Y.H. Lip, Liverpool Centre for Cardiovascular Science, University of Liverpool y Liverpool Heart & Chest Hospital, Liverpool, Reino Unido y Department of Clinical Medicine, Aalborg University, Aalborg, Dinamarca; Fausto J. Pinto, Cardiology, CCUL, Faculdade de Medicina, Universidade de Lisboa, Lisboa, Portugal; G. Neil Thomas, Institute of Applied Health Research, University of Birmingham, Birmingham, Reino Unido; Marco Valgimigli, Cardiocentro Ticino, Lugano, Suiza; Isabelle C. Van Gelder, Department of Cardiology, University of Groningen, University Medical Center Groningen, Groningen, Países Bajos; Bart P. Van Putte, Cardiothoracic Surgery, St. Antonius Hospital, Nieuwegein, Países Bajos, y Caroline L. Watkins, Faculty of Health and Wellbeing, University of Central Lancashire, Preston, Reino Unido.
Comité de la ESC para la elaboración de guías de práctica clínica (GPC): Stephan Windecker (coordinador) (Suiza), Victor Aboyans (Francia), Colin Baigent (Reino Unido), Jean-Philippe Collet (Francia), Veronica Dean (Francia), Victoria Delgado (Países Bajos), Donna Fitzsimons (Reino Unido), Chris P. Gale (Reino Unido), Diederick E. Grobbee (Países Bajos), Sigrun Halvorsen (Noruega), Gerhard Hindricks (Alemania), Bernard Iung (Francia), Peter Jüni (Canadá), Hugo A. Katus (Alemania), Ulf Landmesser (Alemania), Christophe Leclercq (Francia), Maddalena Lettino (Italia), Basil S. Lewis (Israel), Béla Merkely (Hungría), Christian Mueller (Suiza), Steffen E. Petersen (Reino Unido), Anna Sonia Petronio (Italia), Dimitrios J. Richter (Grecia), Marco Roffi (Suiza), Evgeny Shlyakhto (Federación Rusa), Iain A. Simpson (Reino Unido), Miguel Sousa-Uva (Portugal) y Rhian M. Touyz (Reino Unido).
Sociedades nacionales de la ESC que participaron activamente en el proceso de revisión de la GPC ESC 2020 sobre el diagnóstico y tratamiento de la fibrilación auricular
Alemania: German Cardiac Society, Lars Eckardt; Argelia: Algerian Society of Cardiology, Tahar Delassi; Armenia: Armenian Cardiologists Association, Hamayak S. Sisakian; Austria: Austrian Society of Cardiology, Daniel Scherr; Bélgica: Belgian Society of Cardiology, Michel De Pauw; Bielorrusia: Belorussian Scientific Society of Cardiologists, Alexandr Chasnoits; Bosnia-Herzegovina: Association of Cardiologists of Bosnia and Herzegovina, Elnur Smajić; Bulgaria: Bulgarian Society of Cardiology, Tchavdar Shalganov; Chipre: Cyprus Society of Cardiology, Panayiotis Avraamides; Dinamarca: Danish Society of Cardiology, Christian Gerdes; Egipto: Egyptian Society of Cardiology, Ahmad Abd Alaziz; Eslovaquia: Slovak Society of Cardiology, Robert Hatala; Eslovenia: Slovenian Society of Cardiology, Zlatko Fras; España: Sociedad Española de Cardiología, Fernando Arribas; Estonia: Estonian Society of Cardiology, Priit Kampus; Federación Rusa: Russian Society of Cardiology, Evgeny N. Mikhaylov; Finlandia: Finnish Cardiac Society, Pekka Raatikainen; Francia: French Society of Cardiology, Serge Boveda; Georgia: Georgian Society of Cardiology, Giorgi Papiashvili; Grecia: Hellenic Society of Cardiology, Vassilios P. Vassilikos; Hungría: Hungarian Society of Cardiology, Zoltán Csanádi; Irlanda: Irish Cardiac Society, Joseph Galvin; Islandia: Icelandic Society of Cardiology, David O. Arnar; Israel: Israel Heart Society, Alon Barsheshet; Italia: Italian Federation of Cardiology, Pasquale Caldarola; Kazajstán: Association of Cardiologists of Kazakhstan, Amina Rakisheva; Kirguistán: Kyrgyz Society of Cardiology, Alina Kerimkulova; Kosovo (República de): Kosovo Society of Cardiology, Ibadete Bytyçi; Letonia: Latvian Society of Cardiology, Oskars Kalejs; Líbano: Lebanese Society of Cardiology, Mario Njeim; Lituania: Lithuanian Society of Cardiology, Aras Puodziukynas; Luxemburgo: Luxembourg Society of Cardiology, Laurent Groben; Macedonia del Norte: North Macedonian Society of Cardiology, Lidija Poposka; Malta: Maltese Cardiac Society, Mark A. Sammut; Marruecos: Moroccan Society of Cardiology, Abdelhamid Moustaghfir; Moldovia (República de): Moldavian Society of Cardiology, Aurel Grosu; Montenegro: Montenegro Society of Cardiology, Aneta Boskovic; Noruega: Norwegian Society of Cardiology, Ole-Gunnar Anfinsen; Países Bajos: Netherlands Society of Cardiology, Natasja de Groot; Polonia: Polish Cardiac Society, Przemyslaw P. Mitkowski; Portugal: Portuguese Society of Cardiology, Diogo Magalhães Cavaco; Reino Unido de Gran Bretaña e Irlanda del Norte: British Cardiovascular Society, Matthew G. D. Bates; República Checa: Czech Society of Cardiology, Josef Kautzner; Rumanía: Romanian Society of Cardiology, Calin Siliste; San Marino: San Marino Society of Cardiology, Luca Bertelli; Serbia: Cardiology Society of Serbia, Dejan Kojic; Suecia: Swedish Society of Cardiology, Tord Juhlin; Suiza: Swiss Society of Cardiology, Christian Sticherling; Túnez: Tunisian Society of Cardiology and Cardio-Vascular Surgery, Leila Abid; Turquía: Turkish Society of Cardiology, Ilyas Atar; Ucrania: Ukrainian Association of Cardiology, Oleg Sychov; Uzbekistán: Association of Cardiologists of Uzbekistan, Nodir U. Zakirov.
Representante de la European Association of Cardio-Thoracic Surgery (EACTS).La lista de miembros del Comité de la ESC para la elaboración de Guías de Práctica Clínica y los revisores de las sociedades nacionales se recogen en el anexo.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association for Acute CardioVascular Care (ACVC), Association of Cardiovascular Nursing & Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Preventive Cardiology (EAPC), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Consejos: Council on Stroke y Council on Valvular Heart Disease.Grupos de Trabajo: Cardiac Cellular Electrophysiology, Cardiovascular Pharmacotherapy, Cardiovascular Surgery, e-Cardiology y Thrombosis.El contenido de esta GPC de la ESC se publica exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal y representante autorizado de la ESC para estas cuestiones (journals.permissions@oup.com).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso de los datos y la evidencia disponibles hasta la fecha. La ESC no es responsable en caso de que haya alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.© The European Society of Cardiology 2020. Reservados todos los derechos. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Las declaraciones de conflicto de intereses de los expertos participantes en el desarrollo de esta guía están disponibles en la página web de la ESC: www.escardio.org/guidelines.El material adicional, que incluye información básica y trata en detalle los datos que sirven de base a esta guía, se encuentra disponible en la página web de European Heart Journal.Palabras clave:Guías de práctica clínica • Fibrilación auricular • Anticoagulación • Antagonistas de la vitamina K • Anticoagulantes orales no dependientes de la vitamina K • Oclusión de la orejuela izquierda • Control de la frecuencia cardiaca • Control del ritmo cardiaco • Cardioversión • Fármacos antiarrítmicos • Ablación con catéter • Aislamiento de venas pulmonares • Ablación auricular izquierda • Cirugía de la FA • Tratamiento previo • Estrategia ABC • Cribado • Ictus • Recomendaciones
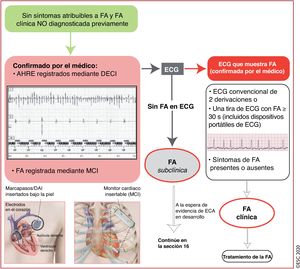
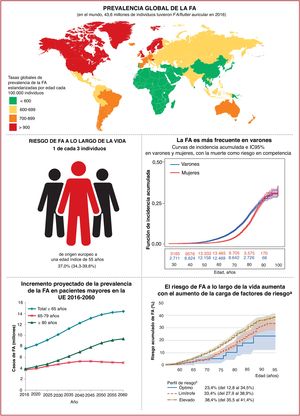
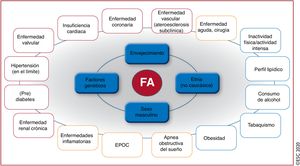
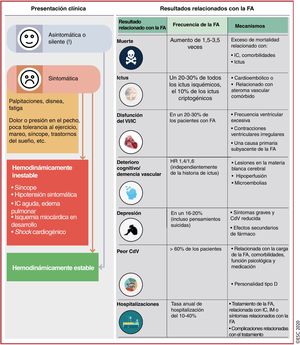
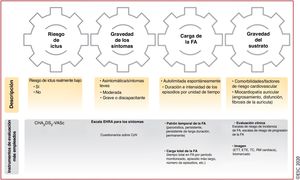


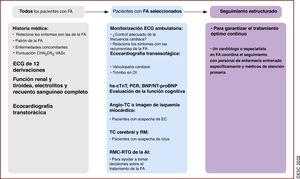
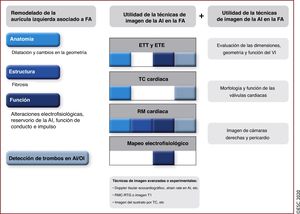
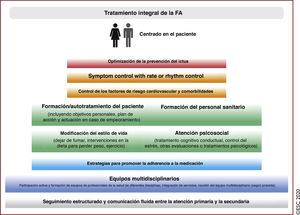
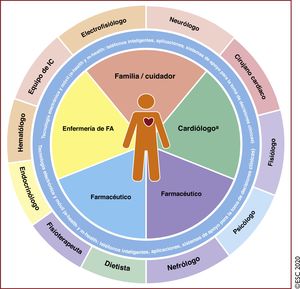
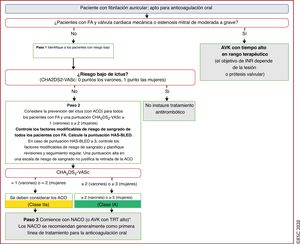
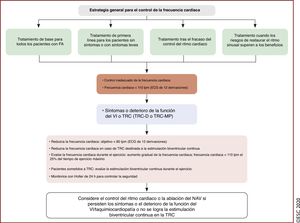
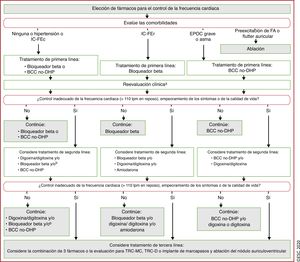
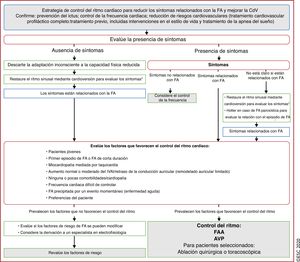
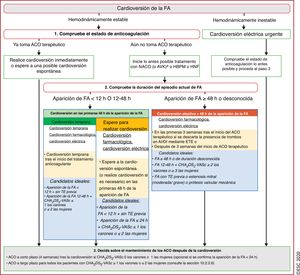
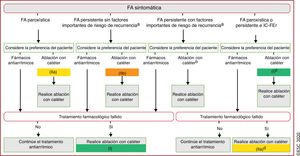
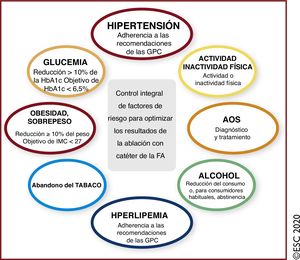
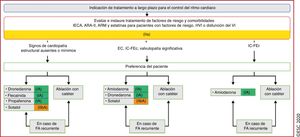
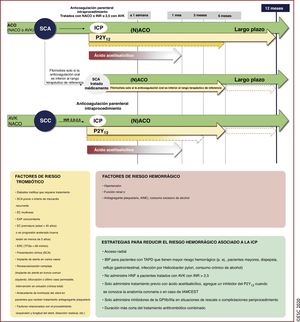
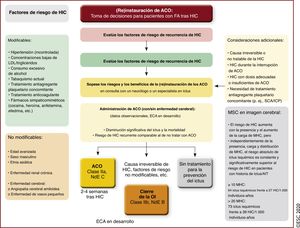
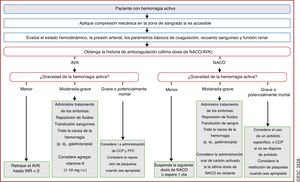
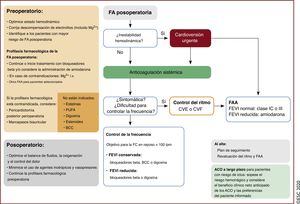

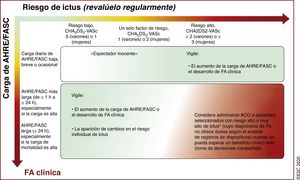






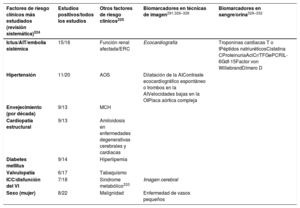
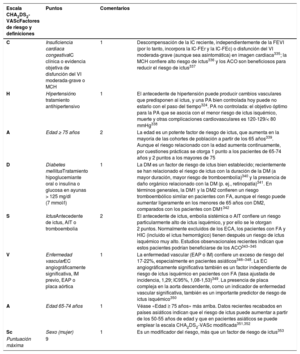


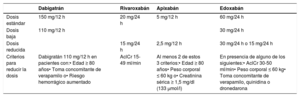
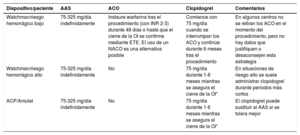
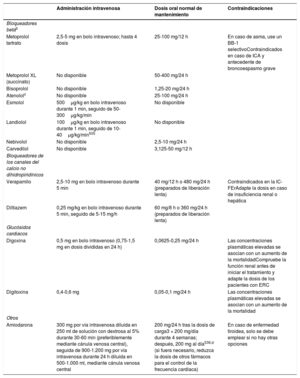
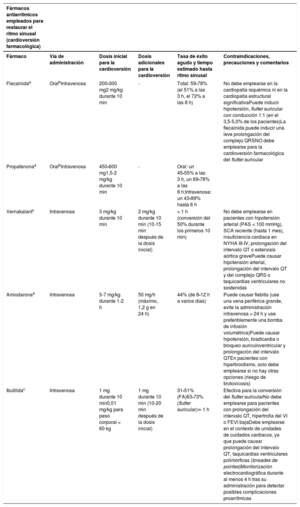

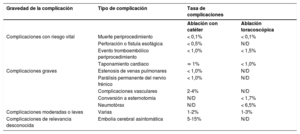













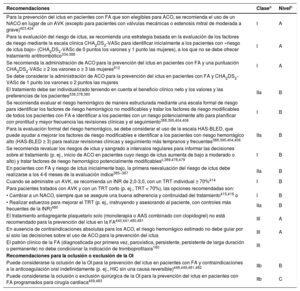





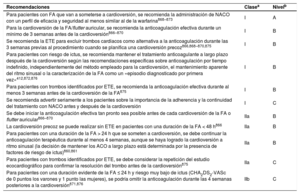

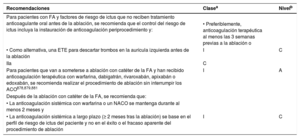

















 AHRE/FA subclínica. Un
AHRE/FA subclínica. Un 
 EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular.' title='Resumen de los factores de riesgo para la aparición de FA10,22,33,35–72 (véase la lista completa en la tabla 1 del material adicional).
EPOC: enfermedad pulmonar obstructiva crónica; FA: fibrilación auricular.' title='Resumen de los factores de riesgo para la aparición de FA10,22,33,35–72 (véase la lista completa en la tabla 1 del material adicional).  CdV: calidad de vida; FA: fibrilación auricular; HR: hazard ratio; IC: insuficiencia cardiaca; IM: infarto de miocardio; VI: ventrículo izquierdo. Los pacientes con FA pueden presentar distintos síntomas92,108,109,128,131, pero un 50-87% están asintomáticos al principio75,82,88,111,117,120,125,127, con un pronóstico posiblemente menos favorable79,82,87,88,117,119,127,134,139. Los síntomas de FA de nueva aparición están menos estudiados92,105,108,109,127 y pueden cambiar con el tratamiento119, y las recurrencias de la FA suelen ser asintomáticas113. Ictus/embolia sistólica: el riesgo anual de ictus relacionado con FA depende de las comorbilidades78,84,85,91,106,112. El ictus cardioembólico asociado con la FA generalmente es grave, muy recurrente y a menudo es mortal o produce discapacidad permanente10,83,115. En un registro poblacional, los pacientes con FA de nueva aparición también tuvieron tasas más altas de embolia sistémica89. Disfunción del ventrículo izquierdo e insuficiencia cardiaca: múltiples mecanismos o alteraciones miocárdicas pueden llevar a la disfunción del VI102,138, lo cual se asocia con altas prevalencia e incidencia de IC en pacientes con FA. Al compartir factores de riesgo comunes, la FA y la IC normalmente coexisten o pueden precipitarse/exacerbarse la una a la otra, lo cual resulta en una mortalidad significativamente mayor que la de cada una de estas enfermedades por separado140. Hospitalización: aproximadamente el 30% de los pacientes con FA ingresan en el hospital como mínimo 1 vez al año y el 10%, al menos 2 veces99,110,129, lo cual representa el doble de probabilidades de hospitalización que para la población sin FA ajustada por edad y sexo (el 37,5 frente al 17,5% respectivamente)98. En una cohorte nacional, la FA fue la causa principal de hospitalización del 14% de los pacientes hospitalizados, pero su tasa de mortalidad hospitalaria fue < 1%101. Las causas más comunes para la hospitalización de los pacientes con FA fueron alteraciones cardiovasculares (49%), causas no cardiovasculares (43%) y hemorragias (8%)129. Calidad de vida y estado funcional: más del 60% de los pacientes con FA tienen un deterioro significativo de la
CdV: calidad de vida; FA: fibrilación auricular; HR: hazard ratio; IC: insuficiencia cardiaca; IM: infarto de miocardio; VI: ventrículo izquierdo. Los pacientes con FA pueden presentar distintos síntomas92,108,109,128,131, pero un 50-87% están asintomáticos al principio75,82,88,111,117,120,125,127, con un pronóstico posiblemente menos favorable79,82,87,88,117,119,127,134,139. Los síntomas de FA de nueva aparición están menos estudiados92,105,108,109,127 y pueden cambiar con el tratamiento119, y las recurrencias de la FA suelen ser asintomáticas113. Ictus/embolia sistólica: el riesgo anual de ictus relacionado con FA depende de las comorbilidades78,84,85,91,106,112. El ictus cardioembólico asociado con la FA generalmente es grave, muy recurrente y a menudo es mortal o produce discapacidad permanente10,83,115. En un registro poblacional, los pacientes con FA de nueva aparición también tuvieron tasas más altas de embolia sistémica89. Disfunción del ventrículo izquierdo e insuficiencia cardiaca: múltiples mecanismos o alteraciones miocárdicas pueden llevar a la disfunción del VI102,138, lo cual se asocia con altas prevalencia e incidencia de IC en pacientes con FA. Al compartir factores de riesgo comunes, la FA y la IC normalmente coexisten o pueden precipitarse/exacerbarse la una a la otra, lo cual resulta en una mortalidad significativamente mayor que la de cada una de estas enfermedades por separado140. Hospitalización: aproximadamente el 30% de los pacientes con FA ingresan en el hospital como mínimo 1 vez al año y el 10%, al menos 2 veces99,110,129, lo cual representa el doble de probabilidades de hospitalización que para la población sin FA ajustada por edad y sexo (el 37,5 frente al 17,5% respectivamente)98. En una cohorte nacional, la FA fue la causa principal de hospitalización del 14% de los pacientes hospitalizados, pero su tasa de mortalidad hospitalaria fue < 1%101. Las causas más comunes para la hospitalización de los pacientes con FA fueron alteraciones cardiovasculares (49%), causas no cardiovasculares (43%) y hemorragias (8%)129. Calidad de vida y estado funcional: más del 60% de los pacientes con FA tienen un deterioro significativo de la  4S-AF: un ejemplo de caracterización estructurada de la FA (del inglés stroke risk, symptom severity, severity of AF burden, substrate severity). AI: aurícula izquierda;
4S-AF: un ejemplo de caracterización estructurada de la FA (del inglés stroke risk, symptom severity, severity of AF burden, substrate severity). AI: aurícula izquierda;  ECG de una derivación, dispositivos de FPG y otros sensores (que usan seismocardiografía, acelerómetros, giroscopios, etc.) que se emplean en aplicaciones para teléfonos inteligentes, bandas de muñeca y relojes. La detección intermitente de la FA mediante relojes inteligentes es posible gracias a los registros de FPG o
ECG de una derivación, dispositivos de FPG y otros sensores (que usan seismocardiografía, acelerómetros, giroscopios, etc.) que se emplean en aplicaciones para teléfonos inteligentes, bandas de muñeca y relojes. La detección intermitente de la FA mediante relojes inteligentes es posible gracias a los registros de FPG o  ACO: anticoagulación oral;
ACO: anticoagulación oral;  CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); EC: enfermedad coronaria;
CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, ictus, enfermedad vascular, edad 65-74 años y sexo (mujer); EC: enfermedad coronaria;  ECG y la A’ [pico de velocidad auricular] en TDI) y refleja también el strain rate de la AI252. La infiltración de grasa epicárdica en la pared de la AI puede ser un marcador temprano de inflamación y se puede detectar mediante TC cardiaca o RMC253. Antes de la ablación de la FA, la TC o la RMC permiten visualizar la anatomía de las venas pulmonares. AI: aurícula izquierda;
ECG y la A’ [pico de velocidad auricular] en TDI) y refleja también el strain rate de la AI252. La infiltración de grasa epicárdica en la pared de la AI puede ser un marcador temprano de inflamación y se puede detectar mediante TC cardiaca o RMC253. Antes de la ablación de la FA, la TC o la RMC permiten visualizar la anatomía de las venas pulmonares. AI: aurícula izquierda; 

 ABC de atención integrada.
ABC de atención integrada.  ECG: electrocardiograma; FA: fibrilación auricular; NAV: nódulo auriculoventricular; RS: ritmo sinusal;
ECG: electrocardiograma; FA: fibrilación auricular; NAV: nódulo auriculoventricular; RS: ritmo sinusal;  BCC: bloqueadores de los canales del calcio;
BCC: bloqueadores de los canales del calcio;  AVP: aislamiento de vena pulmonar;
AVP: aislamiento de vena pulmonar;  ACO: anticoagulante oral; AI: aurícula izquierda;
ACO: anticoagulante oral; AI: aurícula izquierda;  FAA a la ablación indican que fracasó el tratamiento farmacológico. AI: aurícula izquierda; FA: fibrilación auricular;
FAA a la ablación indican que fracasó el tratamiento farmacológico. AI: aurícula izquierda; FA: fibrilación auricular;  AOS: apnea obstructiva del sueño; FA: fibrilación auricular; GPC: guías de práctica clínica; HbA1c: glucohemoglobina; IMC: índice de masa corporal.' title='Factores de riesgo de FA que contribuyen al desarrollo de un sustrato anormal que se asocia con peores resultados de la estrategia para el control del ritmo cardiaco. Varios factores de riesgo de FA pueden contribuir al desarrollo de sustratos de la AI que influyen en el resultado de la ablación con catéter y se relacionan con una tasa más alta de recurrencias. El tratamiento intensivo de los factores de riesgo modificables puede reducir la tasa de recurrencias.
AOS: apnea obstructiva del sueño; FA: fibrilación auricular; GPC: guías de práctica clínica; HbA1c: glucohemoglobina; IMC: índice de masa corporal.' title='Factores de riesgo de FA que contribuyen al desarrollo de un sustrato anormal que se asocia con peores resultados de la estrategia para el control del ritmo cardiaco. Varios factores de riesgo de FA pueden contribuir al desarrollo de sustratos de la AI que influyen en el resultado de la ablación con catéter y se relacionan con una tasa más alta de recurrencias. El tratamiento intensivo de los factores de riesgo modificables puede reducir la tasa de recurrencias.  HVI: hipertrofia ventricular izquierda;
HVI: hipertrofia ventricular izquierda;  SCA/
SCA/ HIC de los pacientes con ictus isquémico/
HIC de los pacientes con ictus isquémico/ ACO: anticoagulantes orales;
ACO: anticoagulantes orales;  ACO: anticoagulantes orales;
ACO: anticoagulantes orales;  AHRE y la escala
AHRE y la escala  AHRE/FA subclínica.
AHRE/FA subclínica.