El incremento de la supervivencia del enfermo con cáncer, junto con el desarrollo de nuevas terapias antitumorales, han puesto de relieve el impacto negativo que las complicaciones vasculares asociadas con el tratamiento oncohematológico tienen en la salud cardiovascular del paciente con cáncer. El objetivo de este documento de consenso, promovido por el Grupo de Trabajo de Cardio-oncología de la Sociedad Española de Cardiología (SEC) y elaborado conjuntamente con diferentes áreas de conocimiento de la SEC junto con la Sociedad Española de Hematología y Hemoterapia (SEHH), la Sociedad Española de Oncología Médica (SEOM), la Sociedad Española de Oncología Radioterápica (SEOR), la Sociedad Española de Médicos Generales y de Familia (SEMG), la Asociación Española de Especialistas en Medicina del Trabajo (AEEMT), la Asociación Española de Enfermería Cardiovascular (AEEC), la Fundación Española del Corazón (FEC) y la Asociación Española contra el Cáncer (AECC), es proporcionar un enfoque coordinado, multidisciplinar y práctico para la estratificación, la monitorización y el tratamiento del riesgo cardiovascular de los pacientes con cáncer.
Palabras clave
La toxicidad cardiovascular (CV) derivada de los tratamientos onco-hematológicos (TOH) es un problema clínico creciente1,2. El cáncer y la enfermedad CV (ECV) están conectados por múltiples mecanismos fisiopatológicos y comparten factores de riesgo, de modo que el tratamiento conjunto de ambas condiciones plantea un reto y requiere un abordaje multidisciplinar por equipos de cardio-onco-hematología (COH) con el objetivo de minimizar el impacto de la cardiotoxicidad3–5. Se define cardiotoxicidad como cualquier evento CV derivado de los TOH1,2. Clásicamente la insuficiencia cardiaca (IC) era el principal foco de atención; sin embargo, el desarrollo de terapias dirigidas y el aumento de la supervivencia de muchos tumores han generado un mayor porcentaje de toxicidades vasculares6. En este contexto, las estrategias de prevención CV tienen un papel relevante y no cumplirlas se asocia con una mayor frecuencia de eventos CV7. Para poder coordinar la actividad asistencial, es necesario concienciar tanto a los especialistas involucrados en el proceso del cáncer como a los pacientes sobre la necesidad de optimizar la monitorización del riesgo cardiovascular (RCV). El presente documento de consenso analiza, de forma práctica, las estrategias multidisciplinares para la monitorización y el control del RCV en las diferentes etapas del proceso del cáncer. La metodología utilizada se presenta en el , donde se enumera a los expertos que han participado en este documento de consenso, así como las sociedades científicas a las que representan ().
TRATAMIENTOS ONCO-HEMATOLÓGICOS ASOCIADOS CON TOXICIDAD VASCULAR O APARICIÓN PRECOZ DE FACTORES DE RIESGO CARDIOVASCULAREl constante desarrollo de los fármacos antitumorales y las técnicas de radioterapia (RT), junto con las posibles toxicidades asociadas, requiere de los clínicos una actualización continua. La tabla 1 recoge los fármacos relacionados con toxicidad vascular o aparición temprana de factores de riesgo cardiovascular (FRCV)2,6,8. La los agrupa en función de su prescripción para diferentes neoplasias. La RT se ha asociado con un mayor riesgo de ateroesclerosis precoz en las estructuras vasculares incluidas en el campo de radiación, mediado por disfunción endotelial, inflamación y estrés oxidativo9–11.
Fármacos antitumorales y de soporte asociados con la aparición de FRCV o enfermedad vascular precoz
| Fármacos | |
|---|---|
| FRCV | |
| Hipertensión arterial | Abiraterona, aflibercept, alcaloides de la vinca (vincristina, vinblastina), alemtuzumab, agonistas de la LHRH, antiandrógenos, axitinib, bendamustina, bevacizumab, binimetinib, blinatumomab, bortezomib, bosutinib, brigatinib, busulfán, cabozantinib, carfilzomib, ciclofosfamida, ciclosporina, cisplatino, cobimetinib, copanlisib, corticoides, dabrafenib, daratumumab, dasatinib, elotuzumab, encorafenib, enzalutamida, estimuladores de eritropoyesis, everolimus, 90y-ibritumomab, ibrutinib, inhibidores de la aromatasa (letrozol, anastrozol, exemestano), interferones, lenalidomida, lenvatinib, nilotinib, nintedanib, nivolumab, obinutuzumab, ofatumumab, panitumumab, panobinostat, pazopanib, pembrolizumab, pomalidona, ponatinib, regorafenib, rituximab, ruxolitinib, sirolimus, sorafenib, sunitinib, tacrolimus, taxanos, temozolomida, temsirolimus, tiotepa, trametinib, tretinoína, vandetanib |
| Hiperglucemia | Agonistas de la LHRH (leuprolida, goserelina, triptorelina, histrelina), asparraginasa, brentuximab vedotina, brigatinib, busulfán, carfilzomib, copanlisib, corticoides, dabrafenib, daratumumab, everolimus, idealisib, imatinib, nilotinib, pentostatina, pomalidomida, temsirolimus, trióxido de arsénico, vorinostat |
| Dislipemia | Asparraginasa, bexaroteno, ciclosporina, copanlisib, corticoides, duvelisib, everolimus, idealisib, inhibidores de aromatasa (anastrozol, letrozol), mitotane, nilotinib, pegaspargasa, ruxolitinib, temsirolimus, tretinoína |
| Toxicidad vascular | |
| Enfermedad coronaria y ateroesclerosis acelerada | Abiraterona, aflibercept, agonistas de la LHRH (leuprolida, goserelina, triptorelina, histrelina), alcaloides de la vinca, aldesleukina, alemtuzumab, análogos de pirimidinas (capecitabina, citarabina, 5-fluorouracilo, gemcitabina, tegafur), bendamustina, bevacizumab, bleomicina, bortezomib, carfilzomib, ciclofosfamida, cisplatino, dasatinib, erlotinib, estramustina, etopósido, idarrubicina, ifosfamida, inhibidores de la aromatasa (letrozol, anastrozol), lenalidomida, nilotinib, nintedanib, obinutuzumab, ofatumumab, panobinostat, pazopanib, pentostatina, ponatinib, regorafenib, rituximab, sorafenib, taxanos, tretinoína |
| Vasculitis | Atezolizumab, avelumab, bleomicina, bortezomib, ciclofosfamida, cisplatino, durvalumab, gemcitabina, hidroxiurea, ipilimumab, melfalán, metotrexato, nivolumab, pentostatina, pembrolizumab, rituximab, tretinoína, trióxido de arsénico, vemurafenib |
| Eventos trombóticos arteriales/microangiopatía trombótica | Asparraginasa, aflibercept, axitinib, bevacizumab, bortezomib, busulfán, cabozantinib, carfilzomib, cisplatino, corticoides, dasatinib, estimuladores de la eritropoyesis, ibrutinib, imatinib, lenalidomida, lenvatinib, paclitaxel, pazopanib, pegaspargasa, pomalidomida, ponatinib, sorafenib, sunitinib, talidomida, tretinoína |
FRCV: factores de riesgo cardiovascular; LHRH: hormona liberadora de la hormona luteinizante (luliberina).
La estratificación del RCV en el paciente con cáncer es crucial con el fin de establecer los objetivos de control, iniciar estrategias de prevención dirigidas y planificar la monitorización12. Por tanto, el RCV debe evaluarse periódicamente durante todo el proceso del cáncer.
Las guías europeas13,14 recomiendan el uso de la escala SCORE (Systemic Coronary Risk Estimation) que incluye edad, sexo, tabaquismo, colesterol y presión arterial sistólica. Recientemente, se ha demostrado la utilidad de la escala en el paciente oncohematológico, al predecir cardiotoxicidad grave y mortalidad por cualquier causa a 2 años de seguimiento15.
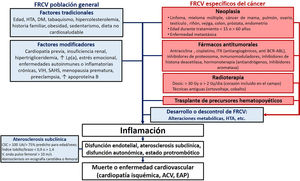
Los individuos con ECV previa, diabetes mellitus (DM) de larga evolución, insuficiencia renal crónica, hipercolesterolemia familiar, elevación extrema de la lipoproteína(a) o ateroesclerosis subclínica detectada con técnicas de imagen no invasiva deben ser identificados directamente como en alto o muy alto riesgo14. Entre los factores modificadores del RCV, destacan el antecedente familiar de ECV prematura, las enfermedades autoinmunitarias o el virus de la inmunodeficiencia humana (VIH)14 (figura 1).
Factores de riesgo cardiovascular en la población onco-hematológica. ACV: accidente cerebrovascular; CSC: puntuación de calcio coronario; DM: diabetes mellitus; EAP: edema agudo de pulmón; FRCV: factores de riesgo cardiovascular; HTA: hipertensión arterial; ITK: inhibidores de la tirosincinasa; Lp(a): lipoproteína(a); SAHS; síndrome de apneas-hipopneas del sueño.
En poblaciones especiales (menores de 40 y mayores de 70 años, diabéticos, ECV previa), la evaluación del RCV puede servirse de otras escalas específicas recogidas en el instrumento europeo U-Prevent16.
Ningún modelo de RCV de la población general incluye el cáncer ni el TOH como factores predictores ni considera el riesgo competitivo de muerte por cáncer17, lo cual subestima el RCV del paciente onco-hematológico18,19.
Factores modificadores del riesgo cardiovascularLos supervivientes de cáncer tienen un riesgo de 2 a 7 veces mayor de fallecer de ECV que la población general20–22. Esta mortalidad se produce sobre todo durante el primer año o tras supervivencias prolongadas (curva en U)22–24, y es mayor con diagnóstico en la infancia25–29 o la juventud22,23, edad >60 años22 o enfermedad metastática22. En pacientes diagnosticados después de los 40 años, la mayoría de las muertes cardiacas suceden con cánceres de próstata, mama, colorrectal o pulmón22. En neoplasias con mayor supervivencia, como los cánceres de próstata, vejiga, endometrio, tiroides, testicular o el linfoma de Hodgkin, la mortalidad CV puede incluso superar a la oncológica23,30,31 ().
La mayor prevalencia de FRCV en el enfermo onco-hematológico21 no justifica en su totalidad el mayor riesgo de eventos CV en esta población. De hecho, algunas neoplasias se comportan como predictores independientes de ECV: enfermedades hematológicas (linfoma, leucemia y mieloma múltiple)20,21,32, cáncer de mama32, pulmón20,32–34, ovario20,32, testículo32 o renal17,24.
Los TOH aumentan el riesgo de eventos CV. Los inhibidores del factor de crecimiento del endotelio vascular (VEGFi) aumentan en 3,5 veces el riesgo de infarto agudo de miocardio35. Los inhibidores de la tirosincinasa de segunda generación frente a la proteína BCR-ABL (nilotinib, ponatinib, bosutinib) se relacionan con un riesgo mayor de ateroesclerosis acelerada, eventos trombóticos y/o enfermedad arterial periférica36. En el mieloma múltiple, los inhibidores del proteosoma (carfilzomib), los inmunomoduladores (pomalidomida) o los inhibidores de la histona deacetilasa (panobinostat) también se han asociado con eventos de isquemia miocárdica37.
El cisplatino en el carcinoma testicular incrementa el riesgo de eventos CV mayores en más de 7 veces38,39. La administración de BEP (bleomicina-etopósido-cisplatino) acrecienta el riesgo de cardiopatía isquémica o ictus40,41 y el riesgo de muerte CV un 44% respecto a la población sana41.
RadioterapiaCuando el campo de irradiación incluye estructuras cardiovasculares, el riesgo de ateroesclerosis acelerada y eventos vasculares aumenta de forma significativa (). En linfomas tratados con RT mediastínica> 30Gy, el riesgo de mortalidad cardiaca aumenta entre 2,5 y 7,3 veces y el de infarto agudo de miocardio, entre 2,7 y 8,9 veces, mientras que los niños tratados en la infancia tienen entre 5 y 29 veces más riesgo de mortalidad cardiaca y 2,4-3,6 de infarto agudo de miocardio. Las mujeres con cáncer de mama tratadas con RT presentan un riesgo de mortalidad cardiaca entre 1,25 y 1,62 veces superior al de la población general. En los individuos con cáncer de pulmón también se ha demostrado un riesgo de eventos cardiacos mayores 3 veces superior. La latencia de aparición de los eventos CV difiere según tipo de tumor (tabla 2). La RT aplicada a tumores de cabeza y cuello o esófago eleva el riesgo de sufrir ictus en 1,4-5,6 veces. La RT holocraneal en cáncer infantil aumenta el riesgo de ictus 2,9 veces con dosis entre 30-49Gy y hasta 11 veces con las> 50Gy.
Factores que predisponen a sufrir complicaciones cardiovasculares tras la radioterapia
| Dosis de radioterapia | • 30Gy en dosis mediastínica• 5Gy en DMC en niños• 20Gy en DMC en supervivientes a linfoma•> 10Gy en DMC en cáncer pulmón |
| Técnica de radiación | • Ortovoltaje, cobalto, radioterapia basada en planificación 2D, campos tangenciales no conformados• Ausencia de protección cardiaca• Volumen cardiaco irradiado alto (campo del manto)• Fraccionamiento diario> 2 Gy• Irradiación antes de 1980 |
| Edad | • <21 años y> 65 años |
| Sexo | • En los varones favorece el desarrollo de cardiopatía isquémica• En las mujeres favorece el desarrollo de miocardiopatía dilatada |
| Localización tumor | • Izquierda> derecha en cáncer mama y pulmón• Irradiación en la base cardiaca aumenta el riesgo de daño en ostium coronarios y grandes vasos |
| Tratamiento concomitante con quimioterápicos | • AC aumentan el riesgo de miocardiopatía dilatada y muerte cardiaca• Alquilantes y platino aumentan el riesgo de ictus |
| FRCV y enfermedad cardiovascular previa | • Hipertensión arterial (mayor factor predictor), tabaquismo, DL, DM, obesidad, sedentarismo• Cualquier enfermedad cardiaca previa aumenta el riesgo |
| Tiempo trascurrido desde la radioterapia | • En niños irradiados en la infancia, latencia> 20 años• En linfomas, latencia 10 años• En cáncer de mama, latencia 5-10 años• En cáncer de pulmón, latencia <2 años• El riesgo de complicaciones cardiovasculares aumenta en proporción al tiempo transcurrido |
2D: bidimensional; AC: antraciclinas; DL: dislipemia; DM: diabetes mellitus; DMC: dosis media cardiaca; FRCV: factores de riesgo cardiovascular.
La dosis administrada y el tiempo desde su administración influyen en el riesgo de eventos CV (tabla 2). La recoge la dosis límite de tolerancia para las estructuras CV sanas. En supervivientes de cáncer infantil, el riesgo relativo (RR) de muerte aumenta un 60%/Gy en dosis media cardiaca (DMC), mientras que en linfomas y cáncer de mama el RR de eventos coronarios aumenta entre 7,4 y 16,5%/Gy en DMC. La relación entre dosis y eventos CV tiene un carácter lineal, sin determinar una dosis mínima segura42. El riesgo CV se mantiene elevado a 25-40 años tras la RT y la presencia de FRCV clásicos lo potencia. Actualmente, las técnicas basadas en planificación tridimensional, la RT de intensidad modulada (IMRT), el VMAT (volumetric modulated arc therapy), la RT con protones, el uso de protecciones con colimador multilaminar, el control respiratorio y el decúbito prono durante el tratamiento se asocian con menor DMC y, consecuentemente, una reducción del riesgo de cardiotoxicidad29 ().
HormonoterapiaLa terapia de privación de andrógenos promueve alteraciones metabólicas que incluyen ganancia ponderal, aumento de grasa visceral, resistencia a la insulina y un perfil lipídico desfavorable43,44, e incrementa el RCV, la aparición temprana de ateroesclerosis y la incidencia de cardiopatía isquémica44,45. Esta asociación es más evidente en pacientes tratados con abiraterona, bloqueo androgénico combinado o agonistas de la hormona liberadora de gonadotropina (GnRH). Es menos sólida en quienes reciben antagonistas de la GnRH44.
Los inhibidores de la aromatasa conllevan mayor riesgo de cardiopatía isquémica, mientras que el tamoxifeno se relaciona con enfermedad tromboembólica46.
Trasplante de precursores hematopoyéticosEl trasplante de precursores hematopoyéticos (TPH) aumenta el riesgo de mortalidad CV prematura (RR estimado entre 2,3 y 4), ECV (RR estimado entre 0,6 y 5,6) y aparición precoz de FRCV como hipertensión, diabetes y dislipemia (RR estimado entre 7,0 y 15,9) de los pacientes comparados con controles sin cáncer47–49. El riesgo es mayor en el TPH alogénico y en pacientes con enfermedad de injerto contra huésped.
Impacto de la fragilidad en la toma de decisionesLa fragilidad es un síndrome clínico dinámico, relacionado con el envejecimiento, que reduce la reserva fisiológica ante situaciones de estrés, lo que genera más vulnerabilidad y riesgo de complicaciones50. Más de la mitad de los pacientes mayores con cáncer son frágiles o prefrágiles y tienen una mayor prevalencia de FRC51, lo que genera un mayor riesgo de complicaciones posoperatorias e intolerancia a los TOH52. La evaluacion de la fragilidad permite ajustar los objetivos de control de los FRCV a las comorbilidades y el pronóstico vital13,53,54.
En los pacientes ancianos, se recomienda una valoración geriátrica que los clasifique en robustos, prefrágiles o frágiles para adaptar los objetivos terapéuticos y evitar sobretratar a pacientes frágiles o infratratar a los fuertes55. Existen diferentes escalas que evalúan la fragilidad como la escala FRAIL (tabla 3) o, más específica del paciente hematológico, la escala GAH (Geriatric Assessment in Hematology)56.
Valoración de la fragilidad. Escala FRAIL
| Ítem | Valoración | Respuesta | ||
|---|---|---|---|---|
| 1 | Fatiga | ¿Se siente cansado la mayor parte del tiempo? | Sí | No |
| 2 | Resistencia | ¿Puede subir un piso de escaleras sin hacer pausas sin ayuda? | Sí | No |
| 3 | Ambulación | ¿Es capaz de caminar 100 m sin hacer pausas sin ayuda? | Sí | No |
| 4 | Imperativo tener más de 5 de las siguientes comorbilidades: | Artritis, diabetes, angina/infarto, hipertensión, accidente cerebrovascular, asma, bronquitis crónica, enfisema, osteoporosis, cáncer colorrectal, cáncer cutáneo, depresión/ansiedad, demencia, úlceras en piernas | Sí | No |
| 5 | La pérdida de peso | Pérdida de peso> 5% en el último año | Sí | No |
Una forma de evaluar la presencia de fragilidad de forma sencilla es la escala FRAIL. Suma 1 punto contestar sí a las preguntas 1, 4 y 5, y no a las preguntas 2 y 3. Se considera frágil si la puntación es ≥ 3, prefrágil si es 1-2 y robusto si es 0 puntos.
En estos pacientes, también es relevante analizar la comorbilidad, por su repercusión en la toma de decisiones sobre los objetivos de control y las estrategias terapéuticas. Para ello se dispone de diferentes escalas como la CIRS-G (Cumulative Illness Rating Scale-Geriatrics)57.
Objetivos de control de los factores de riesgo cardiovascularLos objetivos de control para el paciente con cáncer son los mismos que se reflejan en las guías de práctica clínica actuales para pacientes sin neoplasias13,14,53,54. Por lo tanto, el punto crítico es asignar a cada paciente la categoría de riesgo adecuada valorando tanto sus antecedentes onco-hematológicos como el proceso activo. Es importante que el paciente conozca su RCV y los objetivos de control para lograr que se implique en conseguirlos. La tabla 4 recoge los objetivos de control de los FRCV para pacientes con cáncer13,14,53,54.
Objetivos de control de los factores de riesgo cardiovascular de los pacientes con cáncer13,14,53,54
| Presión arterial | <130/80mmHg siempre y cuando el tratamiento sea bien tolerado, si ≥ 65 años <140/80, evitando siempre la hipotensión arterial | |
| Lípidos | Grupo de muy alto riesgo (SCORE ≥ 10%) (prevención primaria o secundaria) | cLDL <55 mg/dlColesterol no-HDL <85 mg/dl |
| Grupo de alto riesgo (SCORE ≥ 5 y <10%) | cLDL <70 mg/dlColesterol no-HDL <100 mg/dl | |
| Grupo de riesgo moderado (SCORE ≥ 1 y <5%) | Colesterol cLDL <100 mg/dlColesterol no-HDL <130 mg/dl | |
| Grupo de bajo riesgo (SCORE <1%) | cLDL <116 mg/dl | |
| Perfil glucémico | Glucohemoglobina <7%Si edad avanzada, fragilidad, esperanza de vida reducida y/o múltiples comorbilidades, <8% | |
| Tabaco | Abstinencia completa del consumo de tabaco en cualquier forma de administración | |
| Alcohol | Deben limitarlo a 20 g/día los varones y 10 g/día las mujeres, excepto si su consumo está contraindicado por su relación con el propio cáncer o por interacciones con el tratamiento antitumoral | |
| Ejercicio | Ejercicio físico moderado al menos 150 min/semana (30 min/5 días a la semana), combinando con entrenamiento aeróbico y de resistenciaPara los pacientes con alto riesgo, y siempre que exista disponibilidad, se valorará la inclusión en programas de rehabilitación cardiaca durante y tras el tratamiento onco-hematológico | |
| Dieta | Dieta mediterránea basada en cereales integrales, vegetales, fruta, carnes blancas y pescado, con ingesta de aceite de oliva virgen extra, nuecesSe debe evitar grasas saturadas, carne roja y procesada, carbohidratos simples o de absorción rápida y alimentos procesados | |
| Peso | Se debe mantener el IMC entre 20 y 25 kg/m2 y la circunferencia de la cintura <94cm (varones)/<80cm (mujeres) | |
cLDL: colesterol unido a lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal.
Las ECV son, junto con las recidivas y las segundas neoplasias, las principales causas de muerte tras superar la fase de TOH21, y son más prevalentes con los tumores de mayor supervivencia23. Este mayor riesgo de muerte es consecuencia de una compleja interacción entre una alta prevalencia de FRCV y de ECV de base y los efectos deletéreos del TOH. La evidencia científica en este campo es escasa y la mayoría de las recomendaciones de seguimiento se basan en opiniones de expertos. La detección precoz de cardiopatía isquémica, disfunción ventricular o enfermedad vascular permite la intervención terapéutica temprana necesaria para mejorar el pronóstico1,2,58.
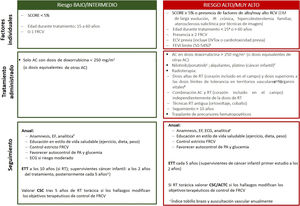
La estrategia de seguimiento depende del riesgo de ECV estimado (figura 2). Para los supervivientes sin síntomas cardiovasculares con RCV bajo, se recomienda una evaluación clínica y un análisis anuales que incluya los perfiles lipídico y glucémico. En caso de mayor RCV, se incluirá además un electrocardiograma periódico. La cuantificación de calcio coronario (calcio score) o la angiografía coronaria por tomografía computarizada podrían ser útiles para reclasificar al paciente y optimizar el control de los FRCV, aunque actualmente no hay evidencia científica específica de pacientes onco-hematológicos.
Estratificación riesgo y plan seguimiento después del tratamiento onco-hematológico. AC: antraciclinas; ACTC: angiografía coronaria por tomografía computarizada; CSC: puntuación de calcio; CTOX: cardiotoxicidad; DM: diabetes mellitus; DV: disfunción sistólica; ECG: electrocardiograma; ECV: enfermedad cardiovascular previa; EF: exploración física; ETT: ecocardiografía transtorácica; FRCV: factor de riesgo cardiovascular; IR: insuficiencia renal; PA: presión arterial; RT: radioterapia. aSe puede valorar a los supervivientes de cáncer infantil con la calculadora de riesgo cardiovascular para supervivientes de cáncer pediátrico, que permite estimar riesgo de disfunción ventricular, cardiopatía isquémica e ictus. Si todas las puntuaciones obtenidas corresponden a riesgo bajo (< 3), se incluye en la categoría de riesgo bajo; si alguna puntuación corresponde a riesgo moderado (≥ 3), se incluye en la categoría de riesgo alto. bSe considera en alto riesgo a los pacientes con fracción de eyección del ventrículo izquierdo límite en tratamiento con antraciclinas o radioterapia torácica con el corazón incluido en el campo, aunque sea en dosis menores que las consideradas de alto riesgo. cAumentan el riesgo de sufrir enfermedad arterial ateroesclerótica periférica. dVéase la sobre la dosis límite de tolerancia de diferentes órganos sanos en función de campo de irradiación. eAnalítica con hemograma, bioquímica básica (creatinina, tasa de filtrado glomerular, perfil hepático), perfil lipídico y glucohemoglobina.
Ante la aparición de síntomas o signos de ECV, hallazgos patológicos en pruebas complementarias y/o la imposibilidad de un correcto control de los FRCV, el paciente precisará valoración cardiológica, idealmente en una unidad de COH1,2,58.
RECOMENDACIONES PARA EL CONTROL DEL RIESGO CARDIOVASCULAREstilo de vidaDietaPara los pacientes con cáncer o supervivientes, se recomienda una dieta mediterránea, con ingesta de aceite de oliva virgen extra, nueces, frutas, verduras, legumbres, productos integrales, carnes blancas y pescado, evitando carbohidratos refinados, carne roja o procesada y comidas ricas en grasas saturadas, que ayuda al control del RCV59,60.
Actividad física y deporteSe recomienda realizar al menos 150min semanales de actividad física moderada de entrenamiento aeróbico o combinado con ejercicios de fuerza, especialmente a los pacientes con alto riesgo de sufrir cardiotoxicidad58. La rehabilitación cardiaca y los programas de ejercicio antes, durante y al finalizar el tratamiento son seguros y efectivos en la prevención cardiovascular61.
Hábitos tóxicos- •
Tabaco. Es fundamental insistir en su abandono; se pueden emplear sustitutos de la nicotina, bupropión o vareniclina62. Los cigarrillos electrónicos no se recomiendan como una opción segura y efectiva para el cese del tabaquismo63. Además, algunos componentes pueden modificar el metabolismo del TOH y reducir su eficacia64.
- •
Alcohol. Deben limitarlo a 20g/día los varones y 10 g/día las mujeres65, excepto si el consumo está contraindicado por su relación con el propio cáncer o por interacciones con el TOH.
El sobrepeso y la obesidad son importantes factores de riesgo de varios cánceres. Además, algunos TOH favorecen la obesidad y el riesgo de cardiotoxicidad puede incrementarse66.
Diabetes y cáncerEl control de los valores glucémicos de los pacientes con DM y cáncer activo plantea un desafío clínico significativo. No hay evidencia clara de que un control glucémico estricto mejore los resultados del TOH, por lo que el equipo de COH debe favorecer que el paciente se mantenga asintomático y con bajo riesgo de descompensación aguda. Se debe prever el efecto diabetógeno de algunos fármacos: corticoides, antiandrogénicos, platinos, 5-fluorouracilo, inhibidores de la mTOR o terapias dirigidas como nilotinib67 (tabla 1).
En el control de la DM, se priorizará el uso de antidiabéticos con beneficio demostrado en reducción de eventos CV13.
Hipertensión arterialLa hipertensión arterial es una de las comorbilidades más frecuentes durante y después de la fase de cáncer activo. Su incidencia depende de la edad, la presencia previa de hipertensión, el tipo de cáncer y/o el TOH2,58,68 (). El control estricto de la cifras de presión arterial reduce el riesgo de IC y fibrilación auricular69 y evita interrumpir TOH eficaces. La adherencia terapéutica y el control domiciliario son prioritarios para alcanzar cifras estables de presión arterial68. Se recomienda un control semanal durante el primer ciclo y después antes de cada ciclo1,53. Asimismo, se debe recomendar un estilo de vida cardiosaludable, restringir la ingesta de sal (< 5g/día)53,68 y evitar los antiinflamatorios no esteroideos68. Los inhibidores de la enzima de conversión de la angiotensina y los antagonistas del receptor de la angiotensina II son los fármacos de primera línea en el tratamiento de la hipertensión arterial en pacientes con DM, cardiopatía preexistente o riesgo de IC1,2; la combinación con antagonistas del calcio dihidropiridínicos es especialmente beneficiosa en pacientes tratados con VEGFi68. Los antagonistas del calcio no dihidropiridínicos (verapamilo, diltiacem) están desaconsejados por el riesgo de IC e interacciones medicamentosas (vía citocromo P450) con muchos antineoplásicos. En la hipertensión arterial refractaria, se recomienda agregar antialdosterónicos53 y monitorizar las cifras de potasio. El uso de bloqueadores beta debe favorecerse en pacientes con IC conocida o riesgo de disfunción ventricular por cardiotóxicos, así como si hay riesgo de fibrilación auricular. Es recomendable el uso de combinaciones fijas de antihipertensivos para mejorar la adherencia70.
En otros casos, el TOH reduce la presión arterial, y se requiere ajuste de dosis o incluso la suspensión del tratamiento antihipertensivo. Para estos pacientes es necesaria una revaluación precoz que evite la inercia terapéutica y/o los rebrotes hipertensivos al finalizar el TOH o si se produce tolerancia a este.
DislipemiasLas estatinas son la primera elección y tienen un potencial efecto protector en la incidencia de cáncer y mejoran el pronóstico de varios tumores (próstata, mama y colorrectal)71,72, si bien se precisarían estudios aleatorizados para confirmarlo. También se las relaciona con menor incidencia de IC en pacientes con cáncer de mama tratadas con antraciclinas, aunque no se ha demostrado que la incidencia de cardiotoxicidad disminuya73. La ezetimiba es segura para pacientes oncológicos. Los nuevos inhibidores de la PCSK9 pueden bajar el cLDL a ≤ 15mg/dl y, aunque no hay evidencias de pacientes en TOH, estas cifras no aumentaron la incidencia ni la progresión del cáncer en el estudio FOURIER74.
Diferentes TOH producen hipertrigliceridemia. Los fibratos se han mostrado eficaces y seguros en su tratamiento ().
Antes de iniciar fármacos para el tratamiento de la dislipemia u otros FRCV, se recomienda consultar las actualizaciones de las interacciones medicamentosas en las páginas web de RxList75, Electronic Medicines Compendium76 y Centro de información online de medicamentos de la AEMPS77.
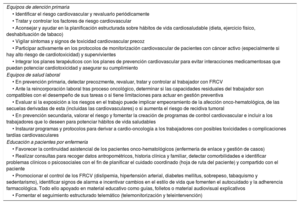
Programas de prevención y promoción de la saludLos equipos de atención primaria, salud laboral y enfermería son piezas clave en la prevención y la promoción de la salud CV durante todo el proceso onco-hematológico78,79. La presencia de enfermería especializada en la gestión y la atención de los pacientes con enfermedades crónicas mejora los resultados en salud y la continuidad asistencial de estos pacientes. Los equipos de salud laboral optimizan la gestión y la asistencia de personas laboralmente activas con antecedentes de cáncer, con lo que mejoran los resultados en salud, la continuidad y la coordinación asistencial y se facilita su integración y su reincorporación al trabajo79.
La tabla 5 recopila las estrategias para el control de FRCV desde atención primaria, salud laboral y los equipos de educación de enfermería.
Estrategias para el control de factores de riesgo cardiovascular de los pacientes oncológicos en atención primaria, salud laboral y programas de educación de enfermería
| Equipos de atención primaria |
| • Identificar el riesgo cardiovascular y revaluarlo periódicamente |
| • Tratar y controlar los factores de riesgo cardiovascular |
| • Aconsejar y ayudar en la planificación estructurada sobre hábitos de vida cardiosaludable (dieta, ejercicio físico, deshabituación de tabaco) |
| • Vigilar síntomas y signos de toxicidad cardiovascular precoz |
| • Participar activamente en los protocolos de monitorización cardiovascular de pacientes con cáncer activo (especialmente si hay alto riesgo de cardiotoxicidad) y supervivientes |
| • Integrar los planes terapéuticos con los planes de prevención cardiovascular para evitar interacciones medicamentosas que puedan potenciar cardiotoxicidad y asegurar su cumplimiento |
| Equipos de salud laboral |
| • En prevención primaria, detectar precozmente, revaluar, tratar y controlar al trabajador con FRCV |
| • Ante la reincorporación laboral tras proceso oncológico, determinar si las capacidades residuales del trabajador son compatibles con el desempeño de sus tareas o si tiene limitaciones para actuar en gestión preventiva |
| • Evaluar si la exposición a los riesgos en el trabajo puede implicar empeoramiento de la afección onco-hematológica, de las secuelas derivadas de esta (incluidas las cardiovasculares) o si aumenta el riesgo de recidiva tumoral |
| • En prevención secundaria, valorar el riesgo y fomentar la creación de programas de control cardiovascular e incluir a los trabajadores que lo deseen para potenciar hábitos de vida saludables |
| • Instaurar programas y protocolos para derivar a cardio-oncología a los trabajadores con posibles toxicidades o complicaciones tardías cardiovasculares |
| Educación a pacientes por enfermería |
| • Favorecer la continuidad asistencial de los pacientes onco-hematológicos (enfermería de enlace y gestión de casos) |
| • Realizar consultas para recoger datos antropométricos, historia clínica y familiar, detectar comorbilidades e identificar problemas clínicos o psicosociales con el fin de planificar el cuidado coordinado (hoja de ruta del paciente) y compartido con el paciente |
| • Promocionar el control de los FRCV (dislipemia, hipertensión arterial, diabetes mellitus, sobrepeso, tabaquismo y sedentarismo), identificar signos de alarma e incentivar cambios en el estilo de vida que fomenten el autocuidado y la adherencia farmacológica. Todo ello apoyado en material educativo como guías, folletos o material audiovisual explicativos |
| • Fomentar el seguimiento estructurado telemático (telemonitorización y teleintervención) |
FRCV: factores de riesgo cardiovascular.
Los avances terapéuticos han aumentado el número de supervivientes de cáncer infantil y su supervivencia. Sin embargo, el riesgo de muerte de causa cardiaca es 7 veces mayor comparado con el de la población general25–29. Este aumento en el RCV es de etiología multifactorial y depende de:
- •
El tipo de neoplasia: los tumores renales como el de Wilms, los sarcomas óseos, los linfomas sobre todo de Hodgkin y las leucemias se asocian con mayor riesgo debido a tratamientos más cardiotóxicos y/o su relación con FRCV25,80.
- •
La toxicidad directa del TOH: las antraciclinas, los alquilantes y la RT son los tratamientos más cardiotóxicos en población pediátrica81–83. Más del 50% de los niños con cáncer reciben antraciclinas, y la dosis total acumulada es el mayor predictor de disfunción cardiaca y, aunque no existe una dosis segura, se recomienda no superar los 450mg/m2 totales de adriamicina o su dosis equivalente de otras antraciclinas. La toxicidad se ve potenciada si es concomitante a RT torácica o abdominal alta ().
- •
Una alta prevalencia de FRCV: los TOH aumentan la vulnerabilidad del sistema CV y favorecen el desarrollo de FRCV y de síndrome metabólico82. Asimismo, el riesgo de insuficiencia renal es mayor, especialmente en niños muy pequeños, expuestos a corticoides y en el sexo femenino. Múltiples registros han relacionado FRCV y mortalidad tras un cáncer infantil80,83–88 (). Su adecuado control disminuye los eventos cardiacos, por lo que es prioritario concienciar de su prevención desde una temprana edad.
Se han desarrollado escalas específicas, como la calculadora de RCV del Children's Cancer Survivors Study (CCSS), que predicen el riesgo de IC, cardiopatía isquémica y/o ictus a la edad de 50 años de los supervivientes de cáncer infantil. Esta escala incluye la edad al diagnóstico, el TOH recibido (antraciclinas —dosis máxima—, alquilantes y platinos), la RT concomitante (campos y dosis) y la presencia de FRCV (DM, hipertensión arterial, dislipemia). La estimación del RCV individual29,89–93 en una consulta de transición identifica a quienes requieren un seguimiento más estrecho en unidades de COH.
Es imprescindible conseguir objetivos de control de los FRCV en estos niños, que expresados en percentiles (p) de edad y sexo o en valores absolutos son: índice de masa corporal (IMC) <p95, presión arterial <130/80mmHg o <p90, colesterol unido a lipoproteínas de baja densidad (cLDL) <130mg/dl (< 100mg/dl en alto riesgo como en caso de TPH), colesterol unido a lipoproteínas de no alta densidad (no-cHDL) <145mg/dl, triglicéridos <150mg/dl, glucosa basal <100mg/dl y HbA1c <5,7%82.
CÁNCER Y RCV: CUESTIONES PENDIENTESEntre los aspectos científicos pendientes de resolver relacionados con el RCV del paciente onco-hematológico, destacan:
- •
El antecedente de cáncer o de TOH o el cáncer activo no se consideran factores modificadores del RCV en las actuales escalas. No se dispone de escalas específicas para la valoración del RCV del paciente con cáncer.
- •
Los pacientes oncológicos están infrarrepresentados en los ensayos clínicos de prevención CV. Los objetivos de control de los FRCV se establecen por extrapolación de los de individuos sin cáncer con el mismo nivel de RCV. No existen ensayos aleatorizados de prevención CV en pacientes con antecedentes de cáncer y las recomendaciones se basan en consenso de expertos.
- •
No hay suficiente evidencia de la utilidad de terapias preventivas antes del inicio del TOH.
- •
Se precisa generar evidencia sólida sobre el impacto de los programas de COH y rehabilitación CV en el pronóstico de los supervivientes de cáncer.
- •
No se dispone de estudios que permitan precisar cómo realizar un seguimiento CV coste-efectivo de largas superviviencias.
- •
Se necesitan actuaciones coordinadas entre todas las especialidades implicadas que faciliten tanto el control y el seguimiento clínico como la reintegración social y una reincorporación laboral exenta de riesgos.
Las conclusiones del presente documento de consenso se recogen como recomendaciones finales en la tabla 6 con el objeto de sintetizar y favorecer su aplicación práctica. Todas fueron consensuadas, con un alto nivel de exigencia, por los autores firmantes del documento mediante el método Delfos (). La metodología utilizada en el proceso de consenso de las recomendaciones se explica detalladamente en el .
Recomendaciones finales
| Estratificación del RCV del paciente con cáncer. Factores asociados modificadores del RCV |
| • El paciente con cáncer tiene un riesgo de mortalidad CV al menos 2 veces superior al de la población general que exige una evaluación periódica y un control estricto a lo largo de todo el proceso onco-hematológico |
| • El control del RCV es responsabilidad de todos los profesionales implicados en el cuidado del paciente con cáncer con el apoyo de cardiología siempre que sea preciso |
| • La estratificación del RCV permite establecer los objetivos de control, iniciar estrategias de prevención dirigidas y planificar la monitorización en el seguimiento adaptada al RCV. Debe ser realizada antes del TOH y periódicamente a lo largo de todo el proceso onco-hematológico |
| • En la actualidad no se dispone de una escala específica para la valoración del RCV del paciente con cáncer. Las escalas validadas en la población general, como la escala SCORE, subestiman el RCV de estos pacientes. La evaluación del RCV requiere considerar factores modificadores específicos que incluyen: la edad al diagnóstico, tipo de neoplasia y TOH, presencia de enfermedad metastásica, RT torácica (momento de administración, dosis y técnica) y/o el trasplante de precursores hematopoyéticos. |
| • Los pacientes tratados con radioterapia torácica cuando el campo de irradiación incluye al corazón experimentan un incremento progresivo en el riesgo de ECV ateroesclerótica que precisa un control estricto de los FRCV |
| • Se valorará completar la estratificación del RCV con la evaluación de las comorbilidades, la fragilidad y la esperanza de vida del paciente con cáncer |
| • El incremento de las ECV en supervivientes de cáncer infantil requiere la evaluación del RCV, el seguimiento y el control estricto de los FRCV desde el momento de su diagnóstico |
| Objetivos de tratamiento de los FRCV del paciente con cáncer. Recomendaciones de seguimiento del paciente con cáncer en función del RCV |
| • Los objetivos de control de los FRCV deben seguir las recomendaciones de las guías de práctica clínica vigentes, en función del RCV estimado: |
| Se recomienda iniciar tratamiento con PA> 140/90mmHg con el objetivo de alcanzar valores ≤ 130/80mmHg siempre y cuando el tratamiento sea bien tolerado |
| En el paciente con diabetes, se recomiendan valores de HbA1c <7,0%; en el caso de edad avanzada, fragilidad, esperanza de vida reducida o comorbilidad el objetivo podrá ser menos estricto |
| Para los pacientes con bajo RCV, se recomiendan valores de cLDL <116 mg/dl; con RCV moderado, cLDL <100 mg/dl; con RCV alto, cLDL <70 mg/dl, y con muy alto riesgo, cLDL <55 mg/dl |
| En el caso de pacientes frágiles o con una esperanza de vida reducida condicionada por el propio cáncer y/o comorbilidades, los objetivos de control de los FRCV podrán flexibilizarse |
| • El seguimiento de supervivientes sin síntomas cardiovasculares con bajo RCV se realizará con evaluación anual clínica y análisis que incluya perfil lipídico y glucémico |
| • El seguimiento de supervivientes sin síntomas cardiovasculares con RCV intermedio, alto o muy alto precisa evaluación anual clínica, ECG y análisis que incluya perfil lipídico y glucémico |
| • Los pacientes asintomáticos en TOH con alto riesgo de enfermedad arterial periférica precisarán anamnesis dirigida, exploración física y estudio de índice tobillo/brazo |
| Recomendaciones para reducir el RCV del paciente con cáncer |
| • Para reducir el RCV del paciente con cáncer, el abordaje de los FRCV debe realizarse como en la población general, con modificaciones del estilo de vida y/o intervenciones farmacológicas |
| • El paciente oncohematológico debe seguir una dieta mediterránea, realizar semanalmente al menos 150 min de actividad física aeróbica combinada con ejercicios de fuerza y abandonar el hábito tabáquico |
| • Se priorizará el uso de IECA y ARA-II como antihipertensivos y, en el caso de tratamiento con VEGFi, su cobinación con antagonistas del calcio dihidropiridínicos |
| • El tratamiento de la dislipemia se debe realizar con estatinas como primera elección. En caso de contraindicación o de que se precise intensificación del tratamiento, se recomienda la ezetimiba y los inhibidores de PCSK9 |
| • En pacientes con DM y cáncer, debe priorizarse el uso de fármacos antidiabéticos beneficio demostrado en reducción de eventos cardiovasculares |
| • Los equipos de atención primaria y salud laboral, junto con los programas de educación de enfermería tienen un papel primordial en la evaluación, la monitorización y el control del RCV del paciente con cáncer. Además, es fundamental que el propio enfermo conozca su RCV y los objetivos de control para lograr que se implique en conseguirlos |
ARA-II: antagonistas del receptor de la angiotensina II; cLDL: colesterol unido a lipoproteínas de baja densidad; CV: cardiovascular; DM: diabetes mellitus; ECG: electrocardiograma; ECV: enfermedad cardiovascular; FRCV: factores de riesgo cardiovascular; IECA: inhibidores de la enzima de conversión de la angiotensina; PA: presión arterial; RCV: riesgo cardiovascular; RT: radioterapia; TOH: tratamiento onco-hematológico; VEGFi: inhibidores del factor de crecimiento del endotelio vascular.
A. Martín García ha recibido honorarios por ponencias de Daichii-Sankyo y ha realizado labores de consultoría para Bayer y Pfizer sin relación con el presente trabajo. C. Mitroi ha recibido honorarios personales de Bayer y Janssen junto a apoyo no financiero de Abbott, sin relación con el presente trabajo. P. Mazón Ramos ha recibido honorarios personales de Bayer, Boehringer-Lilly, AstraZeneca, Esteve, Novo-Nordisk, Mylan y Daichii-Sankyo sin relación con el presente trabajo. R. García Sanz ha recibido ayudas del Hospital Universitario de Salamanca y de la Sociedad Española de Hematología durante la realización del estudio; becas y honorarios personales de Janssen-Cilag, Gilead, Takeda, Roche, BeyondSpring y Novartis, todo ello sin relación con el presente trabajo. F. Ayala de la Peña ha recibido honorarios de AstraZeneca, Celgene, Eisai, Novartis, Roche, Pfizer y Pierre Fabre; apoyo no financiero de Roche, Pfizer, Celgene, Eisai, Pfizer, Pierre Fabre y MSD, y subvenciones de Celgene y Roche, todo ello sin relación con el presente trabajo. J. Cosín-Sales ha recibido honorarios por ponencias de Amgen, Sanofi, Almirall, Mylan, Astra-Zeneca y Mundipharma y ha realizado labores de consultoría para Amgen, Sanofi, Almirall, Boehringer-Ingelheim, AstraZeneca y Mundipharma, todo ello sin relación con el presente trabajo. T. López Fernández ha recibido honorarios por ponencias de Bayer, Philips, Pfizer/BMS, Daiichi-Sankyo, ROVI, Amgen, Janssen y MSD, sin relación con el presente trabajo. El resto de los autores declaran no tener conflictos de intereses.