The True Infection Rate (TIR) in the whole population of each country and the Infection Fatality Rate (IFR) for coronavirus disease 2019 (COVID-19) are unknown although they are important parameters. We devised a simple method to infer TIR and IFR based on the open data. The prevalence rate of the polymerase chain reaction (PCR) tests among the population (Examination Rate; ER) and the positive rate of PCR tests (Infection Rate; IR) for 66 countries were picked up at a website 5 times from April 10th to June 13th, 2020, and the trajectory of each country was drawn over the IR vs. ER plot. IR and ER showed a strong negative correlation for some countries, and TIR was estimated by extrapolating the regression line when the correlation coefficient was between -0.99 and -1. True/Identified Case Ratio (TICR) and IFR were also calculated using the estimated TIR. The estimated TIR well coincided with local antibody surveys. Estimated IFR took on a wide range of values up to 10%: generally high in the Western countries. The estimated IFR of Singapore was very low (0.018%), which may be related to the reported gene mutation causing the attenuation of the viral virulence.
Keywords
AAS ácido acetilsalicílico anticoagulación oral aurícula izquierda área del orificio regurgitante efectivo antagonistas del receptor de la angiotensina II Academic Research Consortium – High Bleeding Risk área valvular aórtica antagonista de la vitamina K área valvular mitral péptido natriurético cerebral cirugía de revascularización coronaria comisurotomía mitral percutánea dispositivo de asistencia ventricular izquierda tratamiento antiagregante plaquetario doble diámetro telediastólico del ventrículo izquierdo diámetro telesistólico del ventrículo izquierdo enfermedad coronaria European Association for Cardio-Thoracic Surgery electrocardiograma Sociedad Europea de Cardiología ecocardiografía transesofágica ecocardiografía transtorácica European System for Cardiac Operative Risk Evaluation fibrilación auricular fracción de eyección del ventrículo izquierdo guías de práctica clínica heparina de bajo peso molecular heparina no fraccionada intravenoso intervalo de confianza del 95% intervención coronaria percutánea inhibidor de la enzima de conversión de la angiotensina índice de masa corporal cociente internacional normalizado integral velocidad tiempo nuevos anticoagulantes orales no dependientes de la vitamina K New York Heart Association presión arterial presión arterial pulmonar sistólica tomografía por emisión de positrones resonancia magnética cardiaca reemplazo quirúrgico de válvula aórtica síndrome coronario agudo Society of Thoracic Surgeons desplazamiento sistólico del plano del anillo tricuspídeo implante percutáneo de válvula aórtica tomografía computarizada terapia de resincronización cardiaca tracto de salida del ventrículo izquierdo ventrículo derecho ventrículo izquierdo velocidad transvalvular máxima bidimensional tridimensional
Las guías de práctica clínica (GPC) reúnen y evalúan la evidencia disponible con objeto de ayudar a los profesionales sanitarios a seleccionar la mejor estrategia de manejo para cada paciente con una determinada enfermedad. Las GPC y sus recomendaciones deben facilitar la toma de decisiones de los profesionales de la salud en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto debe ser tomada por su médico responsable de acuerdo con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC) y su grupos asociados como la European Association for Cardio-Thoracic Surgery (EACTS), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido a su impacto en la práctica clínica, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
Además de la publicación de las GPS, la ESC lleva a cabo el EURObservational Research Programme sobre registros internacionales de enfermedades e intervenciones cardiovasculares que son esenciales para evaluar los procesos diagnósticos y terapéuticos, el consumo de recursos y la adherencia a las recomendaciones de las guías. El objetivo de estos registros es comprender mejor la práctica clínica en Europa y en el mundo en base a los datos recogidos en la práctica clínica cotidiana.
Los miembros de este Grupo de Trabajo fueron seleccionados por la ESC y EACTS, incluyendo representantes de los grupos de subespecialidades, en representación de los profesionales dedicados a los cuidados de la patología tratada en el presente documento. Los expertos seleccionados realizaron una revisión exhaustiva de la evidencia publicada sobre el manejo de una entidad determinada según las normas establecidas por el Comité de la ESC para la Elaboración de GPC. Se llevó a cabo una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. El nivel de evidencia y la fuerza de la recomendación de cada uno de ellos fue valorado de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Clases de recomendación.
| Definición | Expresión propuesta | ||
|---|---|---|---|
| Clases de recomendación | Clase I | Evidencia y/o acuerdo general de que determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | ||
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar | |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar | |
| Clase III | Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda | |
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
|---|---|
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Los expertos responsables de la redacción y la revisión del documento han declarado cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones se revisaron según las normas de la ESC y están disponibles en la página web de la ESC (http://www.escardio.org/guidelines); y se han recogido en un informe y publicado en documentación suplementaria al mismo tiempo que la guía.
Este proceso asegura la transparencia y previene de sesgos potenciales durante el desarrollo y revisión de la guía. Durante el periodo de redacción, las modificaciones en las relaciones que se pudieran considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y EACTS y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de GPC de la ESC supervisa y coordina la preparación de nuevas ediciones. El Comité es responsable también del proceso de aprobación de las GPC. Las directrices de la ESC se someten a una amplia revisión por parte del GPC y expertos externos. Tras las revisiones apropiadas, las guías son firmadas por todos los expertos miembros del Grupo de Trabajo. Por último, el documento final fue aprobado por el Comité de GPC de laESC para su publicación en European Heart Journal y European Journal of Cardio-Thoracic Surgery. La guía se desarrolló tras la evaluación exhaustiva de los datos científicos, el conocimiento médico y la evidencia disponible en el momento de su elaboración.
La tarea de elaboración de GPC incluye también la creación de herramientas educativas y programas de implementación de las recomendaciones, incluidas ediciones de bolsillo, diapositivas, resúmenes en tarjetas para no especialistas, folletos con mensajes clave y versiones electrónicas para aplicaciones digitales (smartphones, etc.). Estas versiones son resumidas y, por lo tanto, en caso de necesidad, debe consultarse la versión completa que se encuentra disponible gratuitamente en las páginas web de la ESC y la EACTS y de las publicaciones EHJ y EJCTS. Se recomienda a las sociedades nacionales que forman parte de la ESC suscribir, adoptar, traducir e implementar las GPC de la ESC. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos se ven favorablemente influidos por la aplicación de las recomendaciones clínicas.
Se recomienda a los profesionales de la salud que tengan en consideración la presente guía de la ESC/EACTS en la toma de decisiones clínicas en su ejercicio diario, así como en la determinación y la implementación de estrategias preventivas, diagnósticas y terapéuticas; no obstante, la decisión final sobre el cuidado de un paciente concreto, en consulta con dicho paciente y, si fuera necesario, con su representante legal, debe tomarla el médico responsable de su cuidado. Además, es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
2INTRODUCCIÓN2.1¿Por qué es necesaria una nueva guía sobre valvulopatías?Desde la edición anterior de la guía sobre el diagnóstico y tratamiento de las valvulopatías publicada en 2017, se dispone de nueva evidencia, especialmente en los siguientes campos:
- •
Epidemiología: la incidencia de la etiología degenerativa ha aumentado en los países industrializados, mientras que, desafortunadamente, la cardiopatía reumática sigue siendo muy frecuente en muchas partes del mundo1–3.
- •
Se han analizado en nuevos estudios nacionales y europeos las prácticas actuales en intervenciones y tratamientos farmacológicos.
- •
La evaluación no invasiva mediante ecocardiografía tridimensional (3D), tomografía computarizada (TC), resonancia magnética cardiaca (RMC) y biomarcadores tiene un papel cada vez más importante.
- •
Nuevas definiciones sobre el grado de insuficiencia mitral secundaria basadas en los resultados de estudios sobre intervenciones.
- •
Nueva evidencia sobre tratamientos antitrombóticos que llevan a nuevas recomendaciones para los pacientes con implantes quirúrgicos o percutáneos de bioprótesis durante el perioperatorio o a largo plazo. Se reforzó la recomendación de prescribir anticoagulantes orales no dependientes de la vitamina K (NACO) para los pacientes con enfermedad de válvula nativa, excepto en caso de estenosis mitral significativa, y para aquellos con bioprótesis.
- •
Estratificación del riesgo para el momento adecuado de la intervención. Esto se aplica a a) la evaluación de la progresión de la enfermedad en pacientes asintomáticos basada en estudios longitudinales recientes, mayormente sobre estenosis aórtica, y b) intervenciones en pacientes con alto riesgo, a los que se debe evitar los procedimientos innecesarios. En este aspecto, se destaca la relevancia de la fragilidad.
- •
Resultados e indicación de intervención:
- •
Elección del modo de intervención: la evidencia actual refuerza la importancia del equipo cardiológico, o heart team, que debe integrar las características clínicas, anatómicas y de procedimiento más allá de las escalas convencionales, y de la elección de tratamiento del paciente informado.
- •
Cirugía: la experiencia acumulada y la seguridad de los procedimientos han llevado a la ampliación de las indicaciones hacia intervenciones más tempranas en pacientes asintomáticos con estenosis aórtica o insuficiencia aórtica o mitral y destacan la preferencia por la reparación valvular cuando se espera que esta sea duradera. Se pone un énfasis especial en la necesidad de una evaluación más completa y cirugía temprana en la insuficiencia tricuspídea.
- •
Técnicas percutáneas: a) en cuanto al implante percutáneo de válvula aórtica (TAVI), los resultados de nuevos estudios aleatorizados que lo compararon frente a la cirugía en pacientes con bajo riesgo tras un seguimiento de 2 años indican que es necesario aclarar para qué tipo de pacientes se debe considerar un modo de intervención u otro; b) las reparaciones percutáneas de «borde con borde» están aumentando y su comparación frente al tratamiento médico óptimo ha llevado a actualizar su recomendación; c) el gran número de estudios sobre el implante percutáneo de «válvula en válvula» tras el fracaso de bioprótesis quirúrgicas sirven de base para actualizar su indicación, y d) por último, los prometedores resultados preliminares de intervenciones percutáneas de válvula tricúspide indican el papel potencial de este tratamiento para pacientes inoperables, aunque son necesarios más estudios para confirmar esta observación.
La evidencia descrita anteriormente hace necesario revisar las recomendaciones.
2.2MetodologíaPara la preparación de esta nueva edición de la guía 2021, se ha creado por primera vez un grupo de metodología cuya función es colaborar con el Grupo de Trabajo en la recolección e interpretación de la evidencia en la que se sustentan las recomendaciones específicas. El grupo se constituyó con dos delegados de la European Society of Cardiology (ESC) y dos delegados de la European Association for Cardio-Thoracic Surgery (EACTS) que también formaban parte del Grupo de Trabajo. Aunque la actividad principal del grupo se centró en el capítulo sobre estenosis aórtica e insuficiencia mitral secundaria, no se limitó únicamente a estos dos campos. El grupo de metodología estuvo a disposición del Grupo de Trabajo cuando este lo requiriese para resolver cuestiones metodológicas específicas.
2.3Contenido de esta nueva ediciónCuando se toman decisiones terapéuticas sobre valvulopatías es necesario, en primer lugar, hacer un diagnóstico preciso, valorar el momento más adecuado de la intervención y evaluar el riesgo, para posteriormente elegir el tipo de intervención más apropiada. Esta guía se centra en las valvulopatías adquiridas, está orientada a su tratamiento y no aborda la endocarditis4, las valvulopatías congénitas5 (incluida la valvulopatía pulmonar) ni las recomendaciones sobre deporte y ejercicio para los pacientes con enfermedad cardiovascular6, ya que estos temas se tratan en guías específicas publicadas por la ESC.
2.4Nuevo formato de la guíaEsta nueva edición de la guía se ha adaptado con el propósito de facilitar su uso en la práctica clínica y responder a las necesidades de los lectores presentando recomendaciones claras y condensadas. Al final del documento se resumen los puntos clave y en la sección sobre lagunas en la evidencia se proponen temas para futuras investigaciones. El texto de la guía está coordinado con el capítulo sobre valvulopatías incluido en el ESC Textbook of Cardiovascular Medicine (ISBN: 9780198784906). La guía y el libro son complementarios. La información de base y las discusiones detalladas sobre los datos que sustentan las recomendaciones se encuentran en los correspondientes capítulos del libro.
2.5Cómo usar esta guíaEl comité destaca que el tratamiento más adecuado para pacientes individuales que viven en una comunidad determinada dependen, en última instancia, de múltiples factores. Entre ellos se incluye la disponibilidad de equipos diagnósticos, la experiencia de cardiólogos y cirujanos, especialmente en el campo de la reparación valvular y las intervenciones percutáneas, y, particularmente, las preferencias de los pacientes bien informados. Por otra parte, debido a la escasez de datos basados en la evidencia en el campo de las valvulopatías, la mayoría de las recomendaciones se derivan en gran medida de la opinión consensuada de expertos. Por lo tanto, en algunas circunstancias clínicas se considera apropiado desviarse de la guía.
3ASPECTOS GENERALESEn esta sección se definen y discuten conceptos comunes a todos los tipos de valvulopatías, como el equipo cardiológico y los centros especializados, los pasos más importantes para la evaluación de los pacientes que presentan valvulopatías y las cardiopatías asociadas más frecuentes.
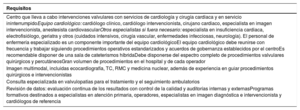
3.1Concepto de equipo cardiológico multidisciplinar (heart team) y centros especializados en valvulopatíasComo centros de excelencia, el objetivo fundamental de los centros especializados en el tratamiento de las valvulopatías es ofrecer una atención de máxima calidad centrada en el paciente. Los requisitos más importantes de un centro especializado en valvulopatías se presentan en la tabla 4.
Requisitos recomendados para un centro especializado en valvulopatías.
| Requisitos |
|---|
| Centro que lleva a cabo intervenciones valvulares con servicios de cardiología y cirugía cardiaca y en servicio ininterrumpidoEquipo cardiológico: cardiólogo clínico, cardiólogo intervencionista, cirujano cardiaco, especialista en imagen intervencionista, anestesista cardiovascularOtros especialistas si fuera necesario: especialista en insuficiencia cardiaca, electrofisiólogo, geriatra y otros (cuidados intensivos, cirugía vascular, enfermedades infecciosas, neurología). El personal de enfermería especializado es un componente importante del equipo cardiológicoEl equipo cardiológico debe reunirse con frecuencia y trabajar siguiendo procedimientos operativos estandarizados y acuerdos de gobernanza establecidos por el centroEs recomendable disponer de una sala de cateterismos híbridaDebe disponerse del espectro completo de procedimientos valvulares quirúrgicos y percutáneosGran volumen de procedimientos en el hospital y de cada operador |
| Imagen multimodal, incluidas ecocardiografía, TC, RMC y medicina nuclear, además de experiencia en guiar procedimientos quirúrgicos e intervencionistas |
| Consulta especializada en valvulopatías para el tratamiento y el seguimiento ambulatorios |
| Revisión de datos: evaluación continua de los resultados con control de la calidad y auditorías internas y externasProgramas formativos destinados a especialistas en atención primaria, operadores, especialistas en imagen diagnóstica e intervencionista y cardiólogos de referencia |
RMC: resonancia magnética cardiaca; TC: tomografía computarizada cardiaca.
Para logarlo es necesario un alto volumen de procedimientos combinado con entrenamiento especializado, formación continuada y enfoque clínico. Los centros especializados en valvulopatías deben promover la derivación oportuna de los pacientes para una evaluación integral antes de que se produzca un daño irreversible.
Las decisiones sobre el tratamiento y las intervenciones debe tomarlas un equipo cardiológico especializado en valvulopatías, activo y colaborativo, compuesto por cardiólogos clínicos e intervencionistas, cirujanos cardiacos, especialistas en imagen con experiencia en imagen intervencionista7,8, anestesistas cardiovasculares y otros especialistas si fuera necesario (p. ej., especialistas en insuficiencia cardiaca o electrofisiólogos). El personal de enfermería con experiencia y dedicación a la atención de pacientes con valvulopatías constituye un componente importante del equipo cardiológico. El enfoque del equipo cardiológico es particularmente recomendable para el tratamiento de los pacientes asintomáticos con riesgo alto y en los casos de incertidumbre o falta de evidencia firme.
Las consultas especializadas en valvulopatías son también un componente importante de los centros especializados, cuyo objetivo es proporcionar una organización estandarizada de la atención basada en las guías de práctica clínica. El acceso a las consultas especializadas mejora los resultados9.
Los médicos con experiencia en el tratamiento de valvulopatías y el personal de enfermería dedicado organizan las consultas ambulatorias y la derivación de los pacientes al equipo cardiológico, si fuera necesario. Debe promoverse la derivación temprana en caso de aparición o empeoramiento de los síntomas antes de la siguiente consulta programada10,11.
Se debe disponer de experiencia en el tratamiento intervencionista y quirúrgico de la enfermedad coronaria, las vasculopatías y las complicaciones, además de todo el espectro de las intervenciones valvulares.
Las técnicas con una curva de aprendizaje pronunciada pueden llevarse a cabo con mejores resultados en hospitales con gran volumen de procedimientos y experiencia. La relación entre el volumen de casos y los resultados de la cirugía y las intervenciones percutáneas, aunque es compleja, no debe obviarse12–14. No obstante, el número preciso de procedimientos por operador individual u hospital que se requiere para proporcionar una atención de alta calidad sigue siendo una cuestión controvertida debido a las diferencias entre los países con ingresos altos y medios15. Los programas de alto volumen de TAVI se asocian con menos mortalidad a los 30 días, particularmente en los hospitales con un volumen alto de reemplazo quirúrgico de válvula aórtica (RQVA)16,17. Son muy escasos los datos disponibles sobre la reparación percutánea de válvula mitral14,18 e, incluso más, los procedimientos percutáneos de válvula tricúspide.
Como la calidad de la atención no se relaciona exclusivamente con el volumen de intervenciones, es esencial la evaluación interna de la calidad mediante el registro sistemático de los datos de los procedimientos y los resultados de los pacientes en cada centro especializado en valvulopatías, además de la participación en registros nacionales y de la ESC/EACTS.
Un centro especializado en valvulopatías debe tener programas de entrenamiento estructurados, y posiblemente combinados, para intervencionistas, cirujanos cardiacos y especialistas en imagen (https://ebcts.org/syllabus/)13,19,20. Para minimizar los efectos de la curva de aprendizaje, la enseñanza de nuevas técnicas deben llevarla a cabo tutores competentes.
Por último, los centros especializados en valvulopatías deben contribuir a optimizar los cuidados médicos de los pacientes con valvulopatías, proporcionar los correspondientes servicios comunitarios y promover redes de atención que incluyan otros departamentos médicos, cardiólogos de referencia y médicos de atención primaria.
3.2Evaluación de pacientesEl objetivo de la evaluación de los pacientes con valvulopatías es diagnosticar, cuantificar y determinar el mecanismo de la valvulopatía, así como sus consecuencias.
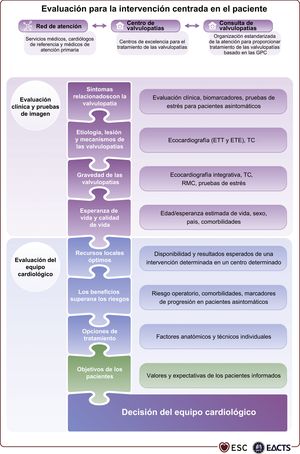
3.2.1Evaluación clínicaLa evaluación minuciosa de la historia clínica del paciente, su estado sintomático así como la exploración física, particularmente la auscultación21, y la búsqueda de signos de insuficiencia cardiaca, son cruciales. Además, la evaluación de las comorbilidades y del estado general requieren una atención especial. Las preguntas fundamentales que se debe formular cuando se valora a un paciente para una intervención valvular se resumen en la figura 1 (ilustración central).
3.2.2EcocardiografíaDespués de la evaluación clínica, la ecocardiografía es la técnica principal para confirmar el diagnóstico de valvulopatía y evaluar etiología, mecanismos, función, gravedad y pronóstico. El estudio ecocardiográfico lo deben hacer e interpretar especialistas en imagen cardiaca adecuadamente entrenados22,23.
Los criterios ecocardiográficos para definir la gravedad de la estenosis y la insuficiencia valvular se tratan en documentos específicos24,25 y se resumen en las secciones correspondientes de esta guía. La ecocardiografía es también una técnica fundamental para evaluar la viabilidad de una intervención específica.
Los indicadores de dilatación y función del ventrículo izquierdo (VI) son factores pronósticos importantes. Los resultados de estudios recientes indican que el strain longitudinal global tiene un valor pronóstico mayor que la fracción de eyección del VI (FEVI), aunque los valores de corte no son uniformes26,27. Debe considerarse la ecocardiografía transesofágica (ETE) cuando el examen transtorácico (ETT) no tenga una calidad óptima o cuando se sospeche trombosis, disfunción protésica o endocarditis. La ETE es útil cuando se requiere información detallada anatómica y funcional de una válvula para valorar la posibilidad de reparación. La ETE intraoperatoria, preferiblemente tridimensional, se emplea para guiar las intervenciones percutáneas de válvula mitral o tricúspide y para evaluar los resultados inmediatos de las intervenciones quirúrgicas. Las técnicas de imagen multimodal pueden ser necesarias en situaciones específicas para evaluar o guiar las intervenciones de TAVI o las intervenciones percutáneas de válvula mitral28,29.
3.2.3Otras pruebas no invasivas3.2.3.1Prueba de estrésEl objetivo principal de la prueba de esfuerzo es desenmascarar la aparición de síntomas objetivos en pacientes considerados asintomáticos y es particularmente útil para la estratificación del riesgo en la estenosis aórtica30. La prueba de esfuerzo sirve también para determinar el grado de actividad física recomendado, incluida la participación en deportes. Hay que destacar que la prueba de estrés es segura y útil para los pacientes con enfermedad valvular asintomáticos, aunque la encuesta VHD II indica que rara vez se prescribe a pacientes asintomáticos1.
La ecocardiografía de esfuerzo puede identificar el origen cardiaco de la disnea. Su impacto pronóstico se ha demostrado fundamentalmente en la estenosis aórtica y la insuficiencia mitral31,32.
No se recomienda la prueba de estrés para detectar enfermedad coronaria asociada con valvulopatía grave debido a su bajo rendimiento diagnóstico y los riesgos potenciales para los pacientes con estenosis aórtica sintomáticos.
3.2.3.2Resonancia magnética cardiacaPara pacientes con resultados ecocardiográficos de calidad inadecuada o discrepantes, debe emplearse la RMC para evaluar la gravedad de las lesiones valvulares, sobre todo en caso de lesiones regurgitantes, y para evaluar los volúmenes ventriculares, la función sistólica, las anomalías de la aorta ascendente y la fibrosis miocárdica33. La RMC es el método de referencia para la evaluación de los volúmenes y la función del ventrículo derecho (VD), de modo que es especialmente útil para evaluar las consecuencias de la insuficiencia tricuspídea34. Además, la RMC tiene un valor adicional para evaluar la gravedad de la insuficiencia aórtica o mitral.
3.2.3.3Tomografía computarizadaLa TC puede contribuir a la evaluación de la gravedad de la valvulopatía, particularmente en la estenosis aórtica35,36, y la posible asociación de enfermedad de la aorta torácica (dilatación, calcificación), así como a la evaluación del grado de calcificación del anillo mitral. Debe hacerse una TC cuando los datos ecocardiográficos indiquen una dilatación aórtica > 40 mm, para determinar el diámetro y evaluar la morfología y la configuración aórticas. La TC tiene un papel fundamental en la planificación de los procedimientos de TAVI y puede ser útil para evaluar la desproporción entre paciente y prótesis (mismatch)37. Es también un requisito para la planificación de las intervenciones de válvula mitral o tricúspide 38. La tomografía por emisión de positrones (PET)/TC es útil para evaluar a los pacientes con sospecha de endocarditis de válvula protésica39,40.
3.2.3.4Fluoroscopia cinéticaLa fluoroscopia es particularmente útil para la evaluación de la cinética de los discos de una prótesis mecánica.
3.2.3.5BiomarcadoresEn caso de pacientes asintomáticos, la concentración sérica de péptido natriurético cerebral (BNP), corregida por edad y sexo, puede ayudar a decidir el momento más adecuado para la intervención41, especialmente si los valores aumentan durante el seguimiento. Se han probado otros biomarcadores que proporcionan evidencia de fibrosis, inflamación y remodelado ventricular adverso y podrían mejorar la toma de decisiones42.
3.2.3.6Multimarcadores y clasificación por etapasEn pacientes con estenosis aórtica moderada o grave y FEVI>50%, la estratificación según el daño producido por la estenosis aórtica en el VI, el VD, la aurícula izquierda, las válvulas mitral y tricúspide y la circulación pulmonar permitió predecir un exceso de mortalidad tras los procedimientos de TAVI y RQVA. Esta clasificación también podría ayudar a identificar a los pacientes que se beneficiarían de intervención43,44.
3.2.4Pruebas invasivas3.2.4.1CoronariografíaLa coronariografía está indicada para evaluar la enfermedad coronaria (EC) cuando se planifica un procedimiento quirúrgico o intervencionista con el objetivo de determinar si está indicada la revascularización coronaria concomitante (véanse las recomendaciones sobre el tratamiento de la EC en pacientes con valvulopatías)45,46. Alternativamente, debido a su elevado valor predictivo negativo, la TC puede servir para descartar EC en pacientes con riesgo de ateroesclerosis bajo. La utilidad de la reserva fraccional de flujo y el cociente libre de ondas en los pacientes con valvulopatías no está bien establecida y se debe tener precaución al interpretar estas mediciones, especialmente en presencia de estenosis aórtica47,48.
3.2.4.2Cateterismo cardiacoLa medición de las presiones y el gasto cardiaco o la evaluación de la función ventricular y la insuficiencia valvular mediante ventriculografía o aortografía deben restringirse a situaciones en que las pruebas de imagen no invasivas no sean concluyentes o sean discordantes con los hallazgos clínicos. Cuando el único criterio para la indicación de cirugía sea la presión pulmonar elevada, se recomienda confirmar los datos ecocardiográficos mediante la determinación invasiva. El cateterismo de corazón derecho está indicado también para pacientes con insuficiencia tricuspídea grave, ya que la medición del gradiente mediante Doppler puede no ser posible o subestimar el grado de hipertensión pulmonar.
3.2.5Evaluación de comorbilidadesLa elección de pruebas específicas para evaluar las comorbilidades se decide con base en la evaluación clínica.
3.3Estratificación del riesgoLa estratificación del riesgo se aplica a cualquier tipo de intervención y es necesaria para sopesar los riesgos de una intervención frente a la historia natural esperada y como base para decidir el tipo de intervención. La mayoría de la experiencia acumulada se refiere a cirugía y TAVI.
3.3.1Escalas de riesgoLa escala de la Society of Thoracic Surgeons (STS-PROM) para la predicción del riesgo de mortalidad (http://riskcalc.sts.org/stswebriskcalc/calculate) y el EuroSCORE II (http://www.euroscore.org/calc.html) permiten discriminar con precisión a los pacientes con riesgo quirúrgico alto o bajo y muestra una buena calibración para predecir el resultado posoperatorio de la cirugía valvular en la mayoría de los pacientes49,50, aunque la estimación del riesgo puede ser menos precisa en los pacientes de riesgo alto51. La escala STS-PROM es dinámica y cambia a lo largo del tiempo. Hay que señalar que las escalas de riesgo no se han validado para la intervención aislada de la válvula tricúspide.
Cuando se emplean por separado, las escalas de riesgo quirúrgico tienen limitaciones importantes para aplicarlas en la práctica clínica a pacientes que se someten a una intervención percutánea debido a que no incluyen factores de riesgo relevantes, como la fragilidad, ni factores anatómicos que tienen un impacto en el procedimiento, ya sea quirúrgico o percutáneo, como la aorta de porcelana, la radiación torácica previa o la calcificación del anillo mitral.
Se han desarrollado nuevas escalas para estimar el riesgo de los pacientes sometidos a TAVI, que tienen una mayor precisión y capacidad de discriminación que las escalas de riesgo quirúrgico, pese a sus numerosas limitaciones52–54 (tabla 1 del material adicional).
La experiencia en la estratificación del riesgo es a día de hoy menor en otras intervenciones como las de la válvula mitral o tricúspide.
3.3.2Otros factoresSe debe tener en cuenta otros factores relevantes:
- •
La fragilidad, definida como una disminución de la reserva fisiológica y la capacidad de mantener la homeostasis que conduce a una mayor vulnerabilidad ante factores de estrés y confiere más riesgo de morbimortalidad tras cirugía o TAVI55. La evaluación de la fragilidad no debe basarse en un enfoque subjetivo, como una evaluación rápida y superficial, sino de la combinación de una serie de determinaciones objetivas55–59. Actualmente se dispone de varios instrumentos para evaluar la fragilidad (tabla 259 y tabla 3 del material adicional)60.
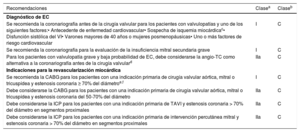
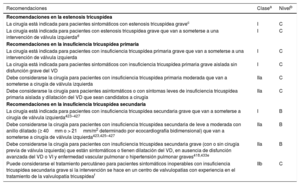
Tabla 3.Qué hay nuevo en esta edición.
Nueva o revisada Recomendaciones en la edición de 2017 Clase Recomendaciones en la edición de 2021 Clase Sección 3. Tratamiento de la fibrilación auricular para pacientes con enfermedad de válvula nativa Revisada Puede considerarse la escisión quirúrgica o el grapado externo de la orejuela de la AI en pacientes sometidos a cirugía valvular IIb Debe considerarse la oclusión de la orejuela de la AI para reducir el riesgo tromboembólico de los pacientes con FA y CHA2DS2-VASc ≥ 2 sometidos a cirugía valvular IIa Revisada Se debe considerar los NACO como alternativa a los AVK para pacientes con estenosis aórtica, insuficiencia aórtica o insuficiencia mitral que presentan FA IIa Para la prevención del ictus de los pacientes con FA e indicación de anticoagulación oral, son preferibles los NACO como alternativa a los AVK para los pacientes con estenosis o insuficiencia aórtica o mitral I Sección 4. Recomendaciones sobre la indicación de cirugía en la insuficiencia aórtica grave Revisada La cirugía está indicada para pacientes asintomáticos con FEVI en reposo ≤ 50% I La cirugía está recomendada para pacientes asintomáticos con DTSVI > 50mm o > 25mm/m2 de ASC (en pacientes de tamaño pequeño) o FEVI en reposo ≤ 50% I Debe considerarse la cirugía para pacientes asintomáticos con FEVI en reposo>50% y dilatación del VI grave: DTDVI>70mm o DTSVI > 50mm (o DTSVI>25mm/m2 de ASC en pacientes de tamaño pequeño) IIa Nueva Puede considerarse la cirugía para pacientes asintomáticos con DTSVI>20mm/m2 de ASC (sobre todo pacientes de tamaño pequeño) o FEVI en reposo ≤ 55%, si la cirugía presenta un riesgo bajo IIb Revisada El equipo cardiológico debe valorar los casos de pacientes seleccionados para los que la reparación de válvula aórtica puede ser una alternativa viable al reemplazo valvular I Puede considerarse la reparación de válvula aórtica en centros con experiencia para pacientes seleccionados si se espera que los resultados sean duraderos IIb Sección 4. Recomendaciones sobre las indicaciones de cirugía para la enfermedad de la raíz aórtica o aneurisma en aorta ascendente tubular (cualquiera sea la gravedad de la insuficiencia aórtica) Revisada Se recomienda la reparación de válvula aórtica mediante la técnica de reimplante o remodelado con anuloplastia aórtica para pacientes jóvenes con dilatación de la raíz aórtica y válvula aórtica tricúspide siempre que cirujanos con experiencia realicen la intervención I El reemplazo de la raíz aórtica con conservación de la válvula está recomendado para pacientes jóvenes con dilatación de la raíz aórtica siempre que la intervención se realice en un centro con experiencia y se esperen resultados duraderos I Sección 5. Recomendaciones sobre las indicaciones de intervención en la estenosis aórtica sintomática y asintomática Estenosis aórtica sintomática Revisada La intervención está indicada para pacientes sintomáticos con estenosis aórtica grave de gradiente alto (gradiente medio ≥ 40mmHg o velocidad pico ≥ 4,0m/s) I La intervención está recomendada para pacientes sintomáticos con estenosis aórtica grave de gradiente alto (gradiente medio ≥ 40mmHg, velocidad pico ≥ 4,0m/s y área valvular ≤ 1,0 cm2 o ≤ 0,6 cm2/m2) I Pacientes asintomáticos con estenosis aórtica grave Nueva Debe considerarse la intervención para pacientes asintomáticos con estenosis aórtica grave y disfunción sistólica del VI (FEVI<55%) sin otra causa IIa Revisada Debe considerarse el RQVA para pacientes asintomáticos con fracción de eyección normal y ninguno de los resultados de la prueba de esfuerzo mencionados antes siempre que el riesgo quirúrgico sea bajo y esté presente uno de los siguientes hallazgos:• Estenosis aórtica muy grave definida por un Vmáx>5,5ms• Calcificación valvular grave y una tasa de progresión de Vmáx ≥ 0,3m/s/año• Valores de BNP significativamente elevados (más de 3 veces el valor normal corregido por edad y sexo), confirmados en mediciones repetidas y que no se explican por otra causa• Hipertensión pulmonar grave (presión arterial pulmonar sistólica en reposo>60mmHg confirmada de manera invasiva) que no se explica por otra causa IIa Debe considerarse la intervención para pacientes asintomáticos con FEVI>55% y prueba de esfuerzo normal siempre que el riesgo del procedimiento sea bajo y esté presente uno de los siguientes parámetros:• Estenosis aórtica muy grave (gradiente medio ≥ 60mmHg o Vmáx ≥ 5m/s)• Calcificación valvular grave (determinada preferiblemente mediante TC) y una tasa de progresión de Vmáx ≥ 0,3m/s/año• Valores de BNP significativamente elevados (más de 3 veces el valor normal corregido por edad y sexo), confirmados en mediciones repetidas y que no se explican por otra causa IIa Sección 5. Modo recomendado de intervención para pacientes con estenosis aórtica Revisada La elección de la intervención debe basarse en una minuciosa evaluación individual de la viabilidad técnica y de los riesgos y beneficios de cada modalidad de intervención. Además, hay que considerar la experiencia del centro y los datos de los resultados de cada intervención específica I La elección entre intervención quirúrgica y percutánea debe tomarla el equipo cardiológico con base en la evaluación minuciosa de factores clínicos, anatómicos y del procedimiento, teniendo en cuenta, además, los riesgos y beneficios de cada estrategia terapéutica para el paciente individual. La recomendación del equipo cardiológico debe discutirse con el paciente para que pueda tomar una decisión informada sobre el tratamiento I Revisada Se recomienda el RQVA para pacientes con riesgo quirúrgico bajo (STS o EuroSCORE II<4% o EuroSCORE I logístico<10% y sin otros factores de riesgo que no se incluyan en estas escalas, como la fragilidad, la aorta de porcelana y las secuelas de la radiación torácica) I El RQVA está recomendado para pacientes más jóvenes con riesgo quirúrgico bajo (< 75 años y STS-PROM/EuroSCORE II<4%) o para pacientes que son operables y no son candidatos a TAVI transfemoral I Revisada Se recomienda el TAVI para pacientes que no son candidatos a RQVA según la valoración del equipo cardiológico I El TAVI está recomendado para pacientes mayores (≥ 75 años) o con riesgo alto (STS-PROM/EuroSCORE II>8%) o que no son candidatos para cirugía I Revisada Para los pacientes con riesgo quirúrgico aumentado (STS o EuroSCORE II ≥ 4% o EuroSCORE I logístico ≥ 10% u otros factores de riesgo que no se incluyan en estas escalas, como la fragilidad, la aorta de porcelana y las secuelas de la radiación torácica), la decisión entre RQVA y TAVI debe tomarse en el equipo cardiológico teniendo en cuenta las características individuales del paciente; se favorece el TAVI para los pacientes ancianos con acceso femoral viable I El RQVA o TAVI están recomendadas para el resto de los pacientes según las características clínicas, anatómicas y del procedimiento I Nueva Puede considerarse el TAVI no transfemoral para pacientes no aptos para el RQVA y con acceso transfemoral inviable IIb Sección 6. Indicaciones de intervención en la insuficiencia mitral primaria grave Revisada La cirugía está indicada para pacientes asintomáticos con disfunción del VI (DTSVI ≥ 45mm o FEVI ≤ 60%) I La cirugía está indicada para pacientes asintomáticos con disfunción del VI (DTSVI ≥ 40mm o FEVI ≤ 60%) I Revisada Debe considerarse la cirugía para pacientes asintomáticos con función del VI conservada (DTSVI<45mm y FEVI>60%) y fibrilación auricular secundaria a insuficiencia mitral o hipertensión pulmonar (presión pulmonar sistólica en reposo>50mmHg) IIa Debe considerarse la cirugía para pacientes asintomáticos con función del VI conservada (DTSVI<40mm y FEVI>60%) y fibrilación auricular secundaria a insuficiencia mitral o hipertensión pulmonar (presión pulmonar sistólica en reposo>50mmHg) IIa Revisada Debe considerarse la cirugía para pacientes asintomáticos con FEVI conservada (> 60%) y DTSVI de 40-44mm cuando sea probable una reparación duradera, el riesgo quirúrgico sea bajo, la reparación se lleve a cabo en un centro especializado en valvulopatías y haya al menos 1 de los siguientes hallazgos:• Rotura de cuerdas tendinosas o• Dilatación de la AI significativa (índice de volumen ≥ 60ml/m2 del ASC) en ritmo sinusal IIa Debe considerarse la reparación quirúrgica de válvula mitral para pacientes asintomáticos con riesgo bajo, FEVI > 60%, DTSVI<40mm y dilatación de la AI significativa (índice de volumen ≥ 60ml/m2 o diámetro ≥ 55mm) siempre que la reparación se lleve a cabo en un centro especializado en valvulopatías y sea probable una reparación duradera IIa Sección 6. Indicaciones de intervención valvular mitral en la insuficiencia mitral secundaria crónica grave Nueva La intervención o cirugía valvular están recomendadas solo para pacientes con insuficiencia mitral secundaria que siguen sintomáticos pese al tratamiento recomendado en las GPC (incluida la TRC, si está indicada) y la decisión debe tomarla un equipo cardiológico colaborativo y estructurado I Pacientes con enfermedad coronaria u otra cardiopatía concomitante que requiera tratamiento Nueva Para pacientes sintomáticos a los que el equipo cardiológico no considera candidatos a cirugía por sus características individuales, debe considerarse la ICP (o TAVI), posiblemente seguida de reparación percutánea «borde con borde» (en caso de que persista la insuficiencia mitral secundaria grave) IIa Revisada La cirugía está indicada para pacientes con insuficiencia mitral secundaria grave y FEVI>30% sometidos a CABG I La cirugía está recomendada para pacientes que van a someterse a CABG u otro procedimiento de cirugía cardiaca I Pacientes sin enfermedad coronaria u otra cardiopatía concomitante que requiera tratamiento Revisada Cuando la revascularización no esté indicada y el riesgo quirúrgico no sea bajo, puede considerarse el procedimiento percutáneo «borde con borde» para pacientes con insuficiencia mitral secundaria grave y FEVI > 30% que siguen sintomáticos a pesar del TMO (incluida la TRC si está indicada) y tienen una morfología valvular adecuada según los resultados ecocardiográficos, evitando los procedimientos inútiles IIb Debe considerarse el procedimiento percutáneo «borde con borde» para pacientes sintomáticos que no son candidatos a cirugía y cumplen los criterios que indican una probabilidad alta de adecuada respuesta al tratamiento IIa Revisada Para los pacientes con insuficiencia mitral secundaria grave y FEVI<30% que sigan sintomáticos a pesar del TMO (incluida la TRC si está indicada) y no tengan opción de revascularización, el equipo cardiológico puede considerar la indicación de un procedimiento «borde con borde» o cirugía valvular después de evaluar la necesidad de un dispositivo de asistencia ventricular o trasplante cardiaco según las características individuales del paciente IIb Para pacientes sintomáticos con riesgo alto que no son candidatos a cirugía ni cumplen los criterios que predicen una respuesta adecuada a la reparación «borde con borde», el equipo cardiológico puede considerar en casos seleccionados este u otro procedimiento valvular percutáneo siempre que sean viables y tras evaluar minuciosamente la necesidad de un dispositivo de asistencia ventricular o trasplante cardiaco IIb Sección 8. Indicaciones de intervención en la insuficiencia tricuspídea primaria Revisada Debe considerarse la cirugía para pacientes asintomáticos o con síntomas leves de insuficiencia tricuspídea primaria grave aislada y dilatación progresiva o deterioro de la función del VD IIa Debe considerarse la cirugía para pacientes asintomáticos o con síntomas leves de insuficiencia tricuspídea primaria grave aislada y dilatación del VD que son candidatos a cirugía IIa Sección 8. Indicaciones de intervención en la insuficiencia tricuspídea secundaria Revisada Después de la cirugía de válvula izquierda y en ausencia de disfunción valvular izquierda recurrente, debe considerarse la cirugía para pacientes con insuficiencia tricuspídea grave que están sintomáticos o tienen dilatación/disfunción progresiva del VD o disfunción del VI y enfermedad vascular pulmonar/hipertensión pulmonar graves IIa Debe considerarse la cirugía para pacientes con insuficiencia tricuspídea secundaria grave (con o sin cirugía previa de válvula izquierda) que están sintomáticos y tienen dilatación del VD, en ausencia de disfunción grave del VD o el VI y enfermedad vascular pulmonar/hipertensión pulmonar graves IIa Nueva Debe considerarse el tratamiento percutáneo en un centro especializado en valvulopatías para pacientes inoperables con insuficiencia tricuspídea secundaria grave IIb Sección 11. Recomendaciones sobre la selección de válvulas protésicas Nueva Puede considerarse el implante de bioprótesis para pacientes que toman NACO indefinidamente, debido al alto riesgo de tromboembolia IIb Revisada Debe considerarse el implante de una bioprótesis para los pacientes con una esperanza de vida más corta que la durabilidad estimada de la bioprótesis IIa Se recomienda una bioprótesis cuando una anticoagulación de buena calidad sea improbable (por problemas de adherencia, falta de disponibilidad), esté contraindicada debido a un riesgo hemorrágico alto (hemorragia mayor previa, comorbilidades, negación del paciente, problemas de adherencia, estilo de vida, ocupación) y cuando la esperanza de vida sea más corta que la durabilidad estimada de la bioprótesis I Sección 11. Recomendaciones sobre el tratamiento antitrombótico perioperatorio y posoperatorio tras reemplazo o reparación valvular Tratamiento antitrombótico en el periodo perioperatorio Nueva Cuando sea necesario interrumpir la ACO, se recomienda el tratamiento puente para los pacientes con cualquiera de las siguientes indicaciones:• Prótesis mecánica• FA con estenosis mitral significativa• FA con CHA2DS2-VASc ≥ 3 las mujeres o ≥ 2 los varones• Complicación trombótica aguda en las últimas 4 semanas• Riesgo tromboembólico agudo alto I Nueva Se recomienda suspender el tratamiento con AVK antes de la cirugía electiva con un objetivo de INR<1,5 I Nueva Para pacientes sometidos a cirugía, se recomienda mantener durante el periodo perioperatorio el tratamiento con ácido acetilsalicílico, si está indicado I Nueva Para pacientes sometidos a cirugía valvular que tienen una indicación de tratamiento puente posoperatorio, se recomienda administrar dosis terapéuticas de HNF o HBPM a las 12-24 horas de la cirugía I Nueva Para pacientes con prótesis mecánica, se recomienda iniciar el tratamiento con AVK el primer día del posoperatorio I Nueva Para pacientes con TAPD tras una ICP reciente (último mes) que requieren cirugía valvular, y en ausencia de una indicación de ACO, se recomienda reanudar el tratamiento con un inhibidor del P2Y12 en el posoperatorio cuando no haya riesgo de sangrado I Nueva Para pacientes con TAPD tras una ICP reciente (último mes) que requieren cirugía valvular, y en ausencia de una indicación de ACO, puede considerarse el tratamiento puente a la inhibición del P2Y12 con inhibidores de la glucoproteína IIb/IIIa o cangrelor IIb Pacientes con una indicación concomitante de tratamiento antiagregante plaquetario Revisada Para pacientes tratados con ICP, debe considerarse el tratamiento doble con AVK y clopidogrel (75mg/día) como alternativa al tratamiento antiagregante plaquetario triple durante 1 mes para los pacientes cuyo riesgo hemorrágico sea superior al isquémico IIa Después de una ICP o SCA sin complicaciones en pacientes que requieren ACO indefinidamente, está recomendado suspender pronto (≤ 1 semana) el ácido acetilsalicílico y continuar el tratamiento doble con ACO y un inhibidor del P2Y12 (preferiblemente clopidogrel) durante 6 meses (o hasta 12 meses en los SCA), siempre que el riesgo de trombosis del stent sea bajo o si el riesgo hemorrágico prevalece sobre el de trombosis del stent, independientemente del tipo de stent que se utilice I Nueva Está recomendado suspender a los 12 meses el tratamiento antiagregante plaquetario de los pacientes con ACO I Nueva Para pacientes tratados con un AVK (p. ej., aquellos con válvula mecánica), debe considerarse la administración de clopidogrel solo durante 12 meses en casos seleccionados (p. ej., con una puntuación HAS-BLED ≥ 3 o que cumplen los criterios ARC-HBR y tienen un riesgo bajo de trombosis del stent) IIa Nueva Para pacientes que requieren ácido acetilsalicílico o clopidogrel además de un AVK, se debe considerar y regular cuidadosamente la intensidad de la dosis de AVK con un INR en la parte inferior del intervalo recomendado y un tiempo en rango terapéutico > 65-70% IIa Nueva Después de una ICP o SCA sin complicaciones en pacientes que requieren ACO y tratamiento antiagregante plaquetario, debe considerarse el tratamiento triple con ácido acetilsalicílico, clopidogrel y un ACO durante más de 1 semana siempre que el riesgo de trombosis del stent prevalezca sobre el hemorrágico, con una duración total ≤ 1 mes decidida según la evaluación de estos riesgos y especificada claramente antes del alta IIa Reemplazo valvular quirúrgico Nueva Los NACO son preferibles a los AVK a los 3 meses del implante quirúrgico de válvula biológica en pacientes con FA IIa Nueva Para pacientes sin indicación basal de ACO, debe considerarse la administración de dosis bajas de ácido acetilsalicílico (75-100mg/día) o ACO con un AVK durante los primeros 3 meses tras el implante quirúrgico de una válvula aórtica biológica IIa Nueva Puede considerarse la administración de un NACO, en lugar de un AVK, durante los 3 meses siguientes al implante quirúrgico de válvula biológica en posición mitral para pacientes con FA IIb Implante percutáneo de válvula aórtica Nueva Se recomienda ACO indefinidamente para pacientes con TAVI que tienen otras indicaciones de ACO I Revisada Puede considerarse el tratamiento antiagregante simple tras un TAVI en caso de riesgo hemorrágico alto IIb Se recomienda el tratamiento antiagregante plaquetario simple indefinidamente tras un TAVI para pacientes sin indicación basal de ACO I Nueva No se recomienda administrar sistemáticamente ACO tras un TAVI a los pacientes sin indicación basal de ACO III Sección 11. Recomendaciones sobre el tratamiento de la disfunción de válvula protésica Hemolisis y fuga paravalvular Nueva Debe considerarse la decisión de cierre percutáneo o quirúrgico de fugas paravalvulares clínicamente significativas teniendo en cuenta el estado de riesgo del paciente, la morfología de la fuga y la experiencia del centro IIa Trombosis de válvulas bioprotésicas Nueva Debe considerarse la anticoagulación para pacientes con engrosamiento y movilidad reducida de las valvas que producen gradientes elevados, al menos hasta su resolución IIa Fracaso de válvulas bioprotésicas Nueva Puede considerarse el implante percutáneo de «válvula en válvula» en posición mitral y tricuspídea para pacientes con riesgo alto de reintervención quirúrgica seleccionados IIb ACO: anticoagulación oral; ACS: área de la superficie corporal; AI: aurícula izquierda; ARC-HBR: Academic Research Consortium-high bleeding risk; ASC: área de superficie corporal; AVK: antagonista de la vitamina K; BNP péptido natriurético cerebral; CABG: cirugía de revascularización coronaria; DTDVI: diámetro telediastólico ventricular izquierdo; DTSVI: diámetro telesistólico del VI; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; INR: cociente internacional normalizado; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; PAPS: presión arterial pulmonar sistólica; RQVA: reemplazo quirúrgico de válvula aórtica; SCA: síndrome coronario agudo; STS-PROM: Society of Thoracic Surgeons-predicted risk of mortality; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica; TC: tomografía computarizada; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho; VI: ventrículo izquierdo; Vmáx: velocidad pico transvalvular.
- •
La desnutrición61 y el deterioro cognitivo 62 predicen un mal pronóstico.
- •
El fracaso de órganos vitales (tabla 4 del material adicional) y en particular la combinación de enfermedad pulmonar grave63,64, dolor posoperatorio por esternotomía o toracotomía y un tiempo prolongado bajo anestesia de los pacientes sometidos a RQVA mediante esternotomía completa pueden contribuir a la aparición de complicaciones pulmonares. Existe una asociación positiva entre la disfunción renal y el aumento de la mortalidad después de la cirugía y las intervenciones valvulares percutáneas65, especialmente cuando la tasa de filtrado glomerular (TFG) es < 30ml/min. La enfermedad hepática es también un factor pronóstico importante66.
- •
Aspectos anatómicos relacionados con el procedimiento, como la aorta de porcelana o la calcificación grave del anillo mitral67 (véase la tabla 6 de la sección 5.1.3 de este documento y la figura 1 del material adicional).
Tabla 6.Factores clínicos, anatómicos y de procedimiento que influyen en la elección de la modalidad de tratamiento para el paciente individual.
A favor de TAVI A favor de RQVA Características clínicas Riesgo quirúrgico bajo – + Riesgo quirúrgico alto + – Edad más jovena – + Edad más avanzadaa + – Cirugía cardiaca previa (particularmente injertos coronarios intactos que corren riesgo durante la repetición de la esternotomía) + – Fragilidad grave b + – Sospecha de endocarditis o endocarditis activa – + Aspectos anatómicos y técnicos TAVI viable por acceso transfemoral + – Acceso transfemoral desfavorable o imposible y RQVA viable – + Acceso transfemoral desfavorable o imposible y RQVA desaconsejable +c – Secuelas de radiación torácica + – Aorta de porcelana + – Probabilidad alta de desproporción entre el paciente y la prótesis (AVA<0,65 cm2/m2 del ASC) + – Deformación torácica grave o escoliosis + – Tamaño del anillo aórtico inadecuado para los dispositivos de TAVI disponibles – + Válvula aórtica bicúspide – + Morfología valvular desfavorable para TAVI (p. ej., riesgo alto de obstrucción coronaria debido a la poca distancia al ostium coronario o calcificación avanzada de los velos/TSVI) – + Trombo en la aorta o el VI – + Cardiopatías concomitantes que requieren intervención EC multivaso significativa que requiere revascularización quirúrgicad – + Valvulopatía mitral primaria grave – + Valvulopatía tricuspídea grave – + Dilatación significativa o aneurisma de la raíz aórtica o de la aorta ascendente – + Hipertrofia septal que requiere miectomía – + ASC: área superficie corporal; AVA: área valvular aórtica; EC: enfermedad coronaria; ESC: Sociedad Europea de Cardiología; RQVA: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica; TSVI: tracto de salida del ventrículo izquierdo; VI: ventrículo izquierdo.
aLa esperanza de vida depende de la edad absoluta y la fragilidad, es diferente entre varones y mujeres y puede servir de guía mejor que la edad en sí. La esperanza de vida varía ampliamente entre distintas partes de Europa y el mundo (http://ghdx.healthdata.org/record/ihme-data/gbd-2017-life-tables-1950-2017).
bLa fragilidad grave se define como la presencia de más de 2 factores del índice de Katz59 (véase la sección 3.3 para más información).
dSegún la GPC ESC 2019 sobre el diagnóstico y tratamiento de los síndromes coronarios crónicos.
La integración de estos factores sirve como guía para la toma de decisiones del equipo cardiológico (véase la tabla de recomendaciones sobre las indicaciones para la intervención en la estenosis aórtica sintomática y asintomática y modalidades recomendadas de intervención).
Se debe evitar la futilidad en los pacientes situados en el extremo del espectro de riesgo. La futilidad terapéutica se ha definido como la falta de eficacia médica, particularmente cuando a juicio del médico sea poco probable que la terapia produzca el resultado clínico que se pretende, o como la falta de un aumento significativo en la supervivencia según los valores personales del paciente. Además de la supervivencia, la evaluación de la futilidad abarca otros aspectos, como la recuperación funcional. Debe considerarse la futilidad de las intervenciones, particularmente en el caso de las intervenciones percutáneas63.
La alta prevalencia de comorbilidades en los pacientes ancianos hace que la evaluación de la relación riesgo-beneficio de las intervenciones sea más compleja, por lo que el papel del equipo cardiológico es esencial para este grupo de población (tabla 5 del material adicional).
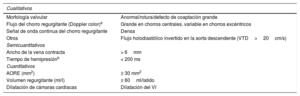
Criterios ecocardiográficos para la definición de insuficiencia aórtica grave.
| Cualitativos | |
|---|---|
| Morfología valvular | Anormal/rotura/defecto de coaptación grande |
| Flujo del chorro regurgitante (Doppler color)a | Grande en chorros centrales, variable en chorros excéntricos |
| Señal de onda continua del chorro regurgitante | Densa |
| Otros | Flujo holodiastólico invertido en la aorta descendente (VTD>20cm/s) |
| Semicuantitativos | |
| Ancho de la vena contracta | > 6mm |
| Tiempo de hemipresiónb | < 200 ms |
| Cuantitativos | |
| AORE (mm2) | ≥ 30 mm2 |
| Volumen regurgitante (ml/l) | ≥ 60ml/latido |
| Dilatación de cámaras cardiacas | Dilatación del VI |
AORE: área del orificio regurgitante efectivo; VI: ventrículo izquierdo; VTD: velocidad telediastólica.
El tiempo de hemipresión se acorta con el aumento de la presión diastólica del VI, el tratamiento vasodilatador y en pacientes con aorta dilatada distensible o alargada en la insuficiencia aórtica crónica.
Adaptada de Lancellotti et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;14:611-644. © 2013, con autorización de Oxford University Press en representación de la Sociedad Europea de Cardiología.
Debe tenerse en cuenta la esperanza y la calidad de vida estimadas de los pacientes. El paciente y su familia deben ser debidamente informados y asesorados para tomar la decisión sobre la mejor opción de tratamiento13. Un enfoque centrado en el paciente debe integrar la medición de los resultados y la experiencia referidos por los pacientes y debe incluir estos parámetros en la información ofrecida a los pacientes68,69.
Cuando el beneficio relacionado con el alivio de los síntomas está en consonancia con los objetivos del paciente, el tratamiento no se considera fútil; sin embargo, cuando no se espera la prolongación de la vida o el alivio de los síntomas, el tratamiento se considera innecesario70.
3.5Recursos localesAun cuando es deseable que los centros de valvulopatías tengan capacidad para llevar a cabo un amplio espectro de procedimientos, ya sea quirúrgicos o intervencionistas, la especialización y, por lo tanto, la experiencia en campos específicos, varían y hay que tenerlo en cuenta a la hora de tomar decisiones y orientar a los pacientes, sobre todo en casos específicos como la reparación quirúrgica compleja o las intervenciones percutáneas.
Además, la disponibilidad de las intervenciones percutáneas es heterogénea y depende en gran medida de desigualdades socioeconómicas en distintas partes del mundo15,71. La correcta administración de los recursos económicos es una responsabilidad fundamental del equipo cardiológico.
3.6Tratamiento de enfermedades asociadas3.6.1Enfermedad coronariaLas recomendaciones sobre el tratamiento de la EC asociada con valvulopatías se encuentran a continuación y se tratan con más detalle en las secciones correspondientes de esta guía (secciones 5 y 6.2), así como en otras guías específicas45,46,72,73.
Recomendaciones sobre el tratamiento de la enfermedad coronaria en pacientes con valvulopatía.
| Recomendaciones | Clasea | Claseb |
|---|---|---|
| Diagnóstico de EC | ||
| Se recomienda la coronariografía antes de la cirugía valvular para los pacientes con valvulopatías y uno de los siguientes factores:• Antecedente de enfermedad cardiovascular• Sospecha de isquemia miocárdicac• Disfunción sistólica del VI• Varones mayores de 40 años o mujeres posmenopáusicas• Uno o más factores de riesgo cardiovascular | I | C |
| Se recomienda la coronariografía para la evaluación de la insuficiencia mitral secundaria grave | I | C |
| Para los pacientes con valvulopatía grave y baja probabilidad de EC, debe considerarse la angio-TC como alternativa a la coronariografía antes de la cirugía valvulard | IIa | C |
| Indicaciones para la revascularización miocárdica | ||
| Se recomienda la CABG para los pacientes con una indicación primaria de cirugía valvular aórtica, mitral o tricuspídea y estenosis coronaria ≥ 70% del diámetroe,f | I | C |
| Debe considerarse la CABG para los pacientes con una indicación primaria de cirugía valvular aórtica, mitral o tricuspídea y estenosis coronaria del 50-70% del diámetro | IIa | C |
| Debe considerarse la ICP para los pacientes con una indicación primaria de TAVI y estenosis coronaria > 70% del diámetro en segmentos proximales | IIa | C |
| Debe considerarse la ICP para los pacientes con una indicación primaria de intervención percutánea mitral y estenosis coronaria > 70% del diámetro en segmentos proximales | IIa | C |
CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; ICP: intervención coronaria percutánea; TAVI: implante percutáneo de válvula aórtica; TC: tomografía computarizada; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cDolor de pecho, resultados anormales en pruebas no invasivas.
dLa angio-TC se puede emplear también para pacientes que requieren cirugía urgente por endocarditis infecciosa aguda con abscesos grandes que protruyen frente al ostium coronario.
ePuede considerarse una estenosis ≥ 50% del diámetro para las estenosis en el tronco común izquierdo.
fUna RFF ≤ 0,8 es un valor de corte útil que indica la necesidad de intervención de los pacientes con enfermedad mitral o tricuspídea, aunque no se ha validado en pacientes con estenosis aórtica.
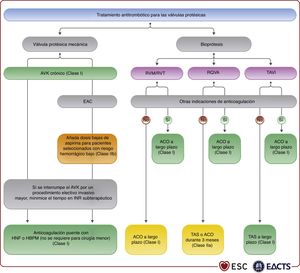
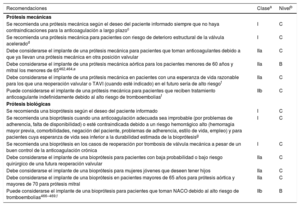
En guías específicas se detallan las recomendaciones sobre el tratamiento de los pacientes con fibrilación auricular (FA), incluido el tratamiento anticoagulante74. Los NACO están recomendados para los pacientes con estenosis o insuficiencia aórtica o insuficiencia mitral que se presentan con FA75–78, basándose en el análisis de subgrupos de estudios aleatorizados que respaldan la prescripción de apixabán, dabigatrán, edoxabán y rivaroxabán. El uso de NACO no están recomendados para los pacientes con FA asociada con estenosis mitral clínicamente significativa o con prótesis mecánicas.
La ablación quirúrgica de la FA combinada con cirugía de válvula mitral es eficaz para reducir la incidencia de FA, pero no tiene impacto en la supervivencia ajustada a corto plazo. Se ha observado un aumento del implante de marcapasos tras la ablación quirúrgica (9,5% en el grupo con FA frente al 7,6% en el grupo sin ablación quirúrgica)79. Se debe considerar la ablación concomitante de la FA para los pacientes que se someten a cirugía cardiaca, sopesando los beneficios de la ausencia de arritmias auriculares y los factores de riesgo de recurrencia, como la edad, la dilatación de la AI, la duración de la FA, la disfunción renal y otros factores de riesgo cardiovascular. Además, se debe considerar el cierre de la orejuela de la AI combinado con la cirugía valvular para pacientes con FA y una puntuación CHA2DS2-VASc ≥ 2 a efectos de reducir el riesgo tromboembólico80–82. La técnica quirúrgica elegida debe garantizar el cierre completo de la orejuela de la AI. Para los pacientes con FA y factores de riesgo de ictus, se recomienda la anticoagulación oral crónica aunque se haya llevado a cabo la ablación quirúrgica de la FA o el cierre quirúrgico de la orejuela.
En la siguiente tabla se resumen las recomendaciones sobre el tratamiento de la FA en las valvulopatías nativas. Las recomendaciones para los pacientes con válvulas protésicas y sobre la combinación de tratamiento anticoagulante y antiagregante plaquetario para los pacientes sometidos a ICP se tratan en la sección 11.3.2.2 y se resumen en la tabla de recomendaciones sobre el tratamiento perioperatorio y posoperatorio tras el reemplazo o la reparación valvular.
Recomendaciones sobre el tratamiento de la fibrilación auricular para pacientes con enfermedad de válvula nativa.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Anticoagulación | ||
| Para la prevención del ictus en pacientes con FA candidatos a ACO, se recomiendan los NACO en lugar de los AVK para los pacientes con estenosis aórtica o insuficiencia aórtica o mitral75–78,83,84 | I | A |
| No se recomiendan los NACO para los pacientes con FA y estenosis mitral moderada o grave | III | C |
| Intervenciones quirúrgicas | ||
| Se debe considerar la ablación concomitante de la FA para los pacientes que se someten a cirugía cardiaca, sopesando los beneficios de la ausencia de arritmias auriculares y los factores de riesgo de recurrencia (dilatación de la AI, duración de la FA, edad, disfunción renal y otros factores de riesgo cardiovascular)79,85–90 | IIa | A |
| Debe considerarse el cierre de la orejuela de la AI para reducir el riesgo tromboembólico de los pacientes con FA y una puntuación CHA2DS2VASc ≥ 2 sometidos a cirugía valvular82 | IIa | B |
ACO: anticoagulación oral; AI: aurícula izquierda; AVK: antagonistas de la vitamina K; FA: fibrilación auricular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K.
aClase de recomendación.
bNivel de evidencia.
Debe considerarse la profilaxis con antibióticos para procedimientos de alto riesgo en pacientes con válvulas protésicas, incluidas las válvulas percutáneas o la reparación con material protésico, y en pacientes con episodios previos de endocarditis infecciosa4. En esta población se aconseja prestar especial atención a la higiene dental y cutánea y tomar medidas asépticas estrictas durante cualquier procedimiento invasivo. Además, debe considerarse la profilaxis antibiótica para procedimientos dentales que impliquen la manipulación de la región gingival o periapical o de la mucosa oral4.
3.8Profilaxis de la fiebre reumáticaLa prevención de la cardiopatía reumática debe orientarse preferiblemente a evitar el primer ataque de fiebre reumática aguda. El tratamiento antibiótico para la infección de garganta por estreptococos del grupo A es clave en la prevención primaria. Actualmente se investiga el cribado ecocardiográfico combinado con la profilaxis antibiótica secundaria en niños con evidencia de cardiopatía reumática latente para reducir su prevalencia en regiones endémicas91. Para pacientes con cardiopatía reumática establecida, se recomienda la profilaxis secundaria a largo plazo contra la fiebre reumática con bencilpenicilina benzatina 1,2 M UI cada 3 o 4 semanas durante 10 años. Debe considerarse la profilaxis indefinida para los pacientes con riesgo alto, dependiendo de la gravedad de la valvulopatía y la exposición a estreptococos del grupo A92–95.
4INSUFICIENCIA AÓRTICALa insuficiencia aórtica puede estar causada por una enfermedad primaria de las cúspides aórticas o por anomalías en la raíz aórtica o de la geometría de la aorta ascendente. La enfermedad degenerativa y la valvulopatía bicuspídea son las etiologías más frecuentes en países desarrollados, y constituyen la causa de aproximadamente dos tercios de casos en el EURObservational Registry Programme Valvular Heart Disease II1. Otras causas incluyen la endocarditis infecciosa o la enfermedad reumática. La insuficiencia aórtica aguda grave suele estar causada por endocarditis infecciosa o menos frecuentemente por disección aórtica.
4.1Evaluación4.1.1EcocardiografíaLa ecocardiografía es la prueba más importante para describir la anatomía valvular, cuantificar la insuficiencia aórtica, evaluar sus mecanismos, definir la morfología de la aorta y determinar la viabilidad de una intervención quirúrgica de conservación o reparación valvular96,97. La identificación del mecanismo sigue el mismo principio que en la insuficiencia mitral: cúspides normales pero coaptación insuficiente debido a la dilatación de la raíz aórtica con chorro central (tipo 1), prolapso de cúspides con chorro excéntrico (tipo 2) o retracción con una calidad deficiente del tejido valvular y chorro central o excéntrico grande (tipo 3)96. La cuantificación de la insuficiencia aórtica debe seguir un abordaje integral que tenga en cuenta parámetros cualitativos, semicuantitativos y cuantitativos (tabla 5)24,98. Nuevos parámetros obtenidos mediante ecocardiografía tridimensional o bidimensional, como la imagen de strain longitudinal global del VI, pueden ser útiles, especialmente en pacientes con FEVI en el límite, en los que permite ayudar a tomar decisiones sobre la cirugía99. Las mediciones de la raíz aórtica y de la aorta ascendente en modo bidimensional deben tomarse en 4 niveles: anillo, senos de Valsalva, unión sinotubular y porción tubular de la aorta ascendente100,101. Las mediciones se hacen en el plano paraesternal eje largo, de borde exterior a borde exterior, en telediástole, excepto para el anillo aórtico, que se mide en mitad de la sístole. Debido a sus consecuencias para la cirugía, es importante diferenciar 3 fenotipos de aorta ascendente: aneurisma de la raíz aórtica (senos de Valsalva > 45mm), aneurisma de la aorta ascendente tubular (senos de Valsalva < 40-45mm) e insuficiencia aórtica aislada (todos los diámetros aórticos < 40mm). Se ha propuesto el cálculo de valores indexados teniendo en cuenta el tamaño corporal102, especialmente para pacientes de pequeña estatura. Se debe obtener información de la anatomía de las cúspides aórticas y de su reparabilidad mediante ETE preoperatoria cuando se considere la cirugía valvular de reparación o conservación de la raíz aórtica. La evaluación intraoperatoria del resultado quirúrgico mediante ETE es indispensable para pacientes sometidos a dicha cirugía.
4.1.2Tomografía computarizada y resonancia magnética cardiacasDebe emplearse la RMC para cuantificar la fracción regurgitante cuando las mediciones ecocardiográficas sean equívocas o discordantes con los hallazgos clínicos. Para pacientes con dilatación aórtica, se recomienda la TC para evaluar el diámetro máximo en 4 niveles, como en la ecocardiografía. La RMC puede servir en el seguimiento, pero la indicación de cirugía debe basarse preferiblemente en las mediciones de TC. Existen distintos métodos para la medición de la aorta. Para mejorar la reproducibilidad, se recomienda medir los diámetros mediante la técnica de borde interior a borde interior al final de la diástole en el plano estrictamente transversal, con reconstrucción doble oblicua perpendicular al eje del flujo sanguíneo del segmento correspondiente. El diámetro máximo de la raíz debe tomarse de seno a seno, en lugar de seno a comisura, ya que esta medida se correlaciona mejor con los diámetros máximos en el plano largo de borde exterior a borde exterior medidos por ecocardiografía103,104.
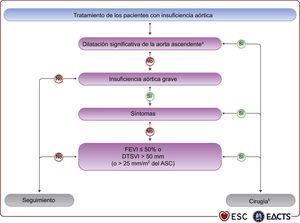
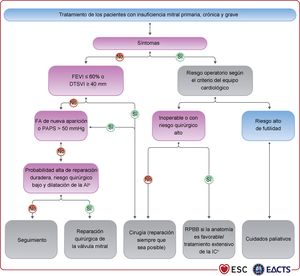
4.2Indicaciones para la intervenciónLa insuficiencia aórtica aguda puede requerir cirugía urgente. Sus causas principales son la endocarditis infecciosa y la disección aórtica, pero puede ocurrir también después de un traumatismo torácico o secundaria a complicaciones iatrogénicas de intervenciones percutáneas. Estas entidades se tratan en guías específicas4,101. Las recomendaciones sobre la indicación de cirugía en la insuficiencia aórtica grave y la enfermedad de la raíz aórtica pueden estar relacionadas con los síntomas, el estado del VI o la dilatación de la aorta; (véase la tabla de recomendaciones sobre las indicaciones para cirugía en la insuficiencia aórtica grave y el aneurisma en la raíz aórtica o la aorta ascendente independientemente del grado de insuficiencia aórtica) y la figura 2.
Tratamiento de los pacientes con insuficiencia aórtica. ASC: área de superficie corporal; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; VI: ventrículo izquierdo.
aVéanse la definición en las recomendaciones sobre las indicaciones de cirugía en la insuficiencia aórtica grave y enfermedad de la raíz aórtica.
bDebe considerarse también la cirugía si durante el seguimiento se observan cambios significativos de las dimensiones aórticas o del VI.
Para los pacientes sintomáticos, la cirugía está recomendada independientemente de la FEVI, siempre que la insuficiencia aórtica sea grave y el riesgo quirúrgico no sea prohibitivo105–109. La cirugía está recomendada para pacientes sintomáticos o asintomáticos con insuficiencia aórtica grave sometidos a CABG o cirugía de la aorta ascendente u otra válvula110,111. En los pacientes asintomáticos con insuficiencia aórtica grave, la función del VI reducida (FEVI ≤ 50%) o el diámetro telesistólico del VI [DTSVI] > 50mm se asocian con una evolución clínica desfavorable, por lo que se debe intentar la cirugía cuando se alcancen estos valores de corte107,108,112–114. El DTSVI debe indexarse con el área de superficie corporal (ASC), sobre todo en pacientes con tamaño corporal pequeño (ASC < 1,68 m2) o con un ASC grande, pero sin sobrepeso. El valor de 25mm/m2 es el punto de corte más apropiado108,115. Recientemente, varios estudios retrospectivos no aleatorizados han destacado el papel del DTSVI indexado y proponen un punto de corte más bajo,20 o 22mm/m2116–118. Uno de estos estudios propone también un valor de corte del 55% para la FEVI118. En base a estos datos, se puede valorar la cirugía para algunos pacientes seleccionados de bajo riesgo, asintomáticos con DTSVI > 20mm/m2 o FEVI en reposo del 50-55%. Para los pacientes que no alcanzan los umbrales para la cirugía, son necesarios un seguimiento estrecho y pruebas de esfuerzo para identificar a los pacientes en el límite de ser sintomáticos. El rápido aumento de las dimensiones del VI o la disminución progresiva de su función en pacientes asintomáticos que no alcanzan los umbrales para la cirugía pero tienen una dilatación del VI significativa (diámetro telediastólico del VI [DTDVI] > 65mm) también pueden ser indicación de cirugía.
Puede considerarse el tratamiento con TAVI en centros con experiencia para pacientes seleccionados con insuficiencia aórtica no candidatos a RQVA 119,120.
Para pacientes con aorta dilatada, las indicaciones para cirugía se han definido mejor en aquellos con síndrome de Marfan y dilatación de la raíz aórtica121,122. Los aneurismas de raíz requieren el reemplazo de esta, con o sin conservación de la válvula aórtica nativa. Por el contrario, los aneurismas de la aorta ascendente en presencia de válvula aórtica normal requieren únicamente el reemplazo con injerto tubular supracomisural. En pacientes con diámetros aórticos en valores límite para la cirugía, hay que tener en cuenta la historia familiar, la edad y el riesgo estimado del procedimiento. Independientemente del grado de insuficiencia aórtica y el tipo de valvulopatía, se recomienda la cirugía de la aorta ascendente para los pacientes con válvula aórtica bicúspide o tricúspide y un diámetro aórtico ≥ 55 mm siempre que el riesgo quirúrgico no sea prohibitivo (véanse las recomendaciones sobre las indicaciones para cirugía en la insuficiencia aórtica grave y la enfermedad de la raíz aórtica)123–125. En pacientes con válvula aórtica bicúspide y factores de riesgo o coartación adicionales126, debe considerarse la cirugía si el diámetro aórtico es ≥ 50 mm127–129. La cirugía aórtica está indicada para todo paciente con síndrome de Marfan y un diámetro aórtico máximo ≥ 50 mm5,121,122. Para los pacientes con síndrome de Marfan y factores de riesgo adicionales y los pacientes con mutación en TGFBR1 o TGFBR2 (incluido el síndrome de Loeys-Dietz), debe considerarse la cirugía si el diámetro aórtico máximo es ≥ 45 mm121,130 o incluso con un umbral menor (diámetro aórtico > 40mm) en mujeres con ASC pequeña, pacientes con mutación en TGFBR2 o pacientes con enfermedad grave no relacionada con la aorta que tienen un riesgo especialmente elevado130. En los pacientes que tienen una indicación para cirugía de válvula aórtica, un diámetro aórtico ≥ 45 mm se considera una indicación para cirugía concomitante de la raíz aórtica o de la aorta ascendente. Deben considerarse la estatura del paciente y la etiología de la enfermedad valvular (válvula bicúspide), además de la forma y el grosor de la pared de la aorta ascendente determinados durante el procedimiento, para tomar decisiones individualizadas.
La elección del procedimiento quirúrgico debe adaptarse a la experiencia del equipo, la presencia de aneurisma de raíz aórtica, las características de las cúspides, la esperanza de vida y el estado de anticoagulación deseado.
El reemplazo valvular es el procedimiento estándar para la mayoría de los pacientes con insuficiencia aórtica. El reemplazo de raíz aórtica con conservación de la válvula y la reparación valvular tienen buenos resultados a largo plazo en pacientes seleccionados, con tasas bajas de complicaciones y buena calidad de vida131–140 si se hacen en centros con experiencia. Está recomendado para pacientes jóvenes con dilatación de la raíz aórtica y movilidad normal de las cúspides siempre que cirujanos con experiencia lleven a cabo la intervención133–136,140. Para pacientes seleccionados, la reparación de válvula aórtica132,132,137 o el procedimiento de Ross138,139 pueden ser una alternativa al reemplazo valvular siempre que los operadores sean cirujanos con experiencia.
Recomendaciones sobre las indicaciones para cirugía en (A) la insuficiencia aórtica grave y (B) el aneurisma en la raíz aórtica o el aneurisma en la aorta ascendente tubular (cualquiera sea la gravedad de la insuficiencia aórtica).
| Indicaciones para cirugía | Clasea | Nivelb |
|---|---|---|
| A. Insuficiencia aórtica grave | ||
| La cirugía está indicada para pacientes sintomáticos, independientemente de la función del VI105–109 | I | B |
| La cirugía está indicada para pacientes asintomáticos con DTSVI > 50 mm o DTSVI > 25mm/m2 de ASC (en pacientes con tamaño corporal pequeño) o FEVI en reposo ≤ 50%107,108,112,114,115 | I | B |
| Debe considerarse la cirugía para pacientes asintomáticos con DTSVI > 20mm/m2 de ASC (sobre todo en pacientes con tamaño corporal pequeño) o FEVI en reposo ≤ 55% siempre que la cirugía sea de riesgo bajo | IIb | C |
| La cirugía está indicada para pacientes sintomáticos y asintomáticos con insuficiencia aórtica grave que van a someterse a CABG o cirugía de la aorta ascendente u otra válvula | I | C |
| Para pacientes seleccionados, puede considerarse la reparación de la válvula aórtica en centros con experiencia cuando se esperen resultados duraderos | IIb | C |
| B. Aneurisma en la raíz aórtica o aneurisma en la aorta ascendente tubularc(cualquiera sea la gravedad de la insuficiencia aórtica) | ||
| Para los pacientes jóvenes con dilatación de la raíz aórtica, se recomienda el reemplazo de la raíz aórtica con conservación de la válvula siempre que se lleve a cabo en centros con experiencia y se esperen resultados duraderos133–136,140 | I | B |
| Para los pacientes con síndrome de Marfan y enfermedad de la raíz aórtica con un diámetro máximo de aorta ascendente ≥ 50mm, está indicada la cirugía de la aorta ascendente | I | C |
| Debe considerarse la cirugía de la aorta ascendente para los pacientes con enfermedad de la raíz aórtica y un diámetro máximo de la aorta ascendente:• ≥ 55mm para todos los pacientes• ≥ 45mm en presencia de síndrome de Marfan y factores de riesgo adicionalesd o pacientes con mutación en TGFBR1 o TGFBR2 (incluido el síndrome de Loeys-Dietz)e• ≥ 50mm en presencia de válvula bicúspide con factores de riesgo adicionalesd o coartación | IIa | C |
| Cuando la válvula aórtica sea la indicación primaria para la cirugía, debe considerarse el reemplazo de la raíz aórtica o la aorta ascendente tubular si el diámetro es ≥ 45mmf | IIa | C |
ASC: área de superficie corporal; CABG: cirugía de revascularización coronaria; DTSVI: diámetro telesistólico del VI; ECG: electrocardiograma; FEVI: fracción de eyección del VI; RMC: resonancia magnética cardiaca; TC: tomografía computarizada; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cPara la toma de decisiones clínicas, deben confirmarse las dimensiones de la aorta mediante TC con ECG sincronizado.
dHistoria familiar de disección aórtica (o historia personal de disección vascular espontánea), insuficiencia aórtica o mitral grave, deseo de embarazo, hipertensión arterial sistémica no controlada o un aumento del tamaño aórtico > 3mm/año (en mediciones seriadas de ecocardiografía o RMC al mismo nivel de la aorta y confirmadas mediante TC con ECG sincronizado).
eSe puede considerar un umbral < 40mm en mujeres con ASC pequeña y pacientes con mutación en TGFBR2 o con enfermedad grave no relacionada con la aorta130.
fDebe considerarse la edad, el ASC, la etiología de la valvulopatía, la presencia de válvula bicúspide y la forma y el grosor de la pared de la aorta ascendente determinados durante el procedimiento.
El tratamiento farmacológico, especialmente los inhibidores de la enzima de conversión de la angiotensina (IECA) o las dihidropiridinas, pueden mejorar los síntomas de los pacientes con insuficiencia aórtica crónica grave para los que la cirugía no es una opción. No se ha establecido el valor de los IECA o las dihidropiridinas para retrasar la cirugía de pacientes asintomáticos con insuficiencia aórtica moderada o grave, y no se recomienda prescribirlos con esta indicación.
Para los pacientes que después de la cirugía siguen sufriendo insuficiencia cardiaca o hipertensión, son útiles los IECA, los antagonistas de los receptores de la angiotensina II (ARA-II) y los bloqueadores beta141,142.
Para los pacientes con síndrome de Marfan, los bloqueadores beta siguen siendo el tratamiento farmacológico de elección para reducir el estrés de cizallamiento y la tasa de crecimiento aórtico, por lo que se deben considerar antes y después de la cirugía143–145. Aunque los ARA-II no se han demostrado superiores a los bloqueadores beta, se pueden considerar como tratamiento alternativo para los pacientes con intolerancia a los bloqueadores beta146–148. Por analogía, y a pesar de que no hay estudios que proporcionen evidencia robusta, en la práctica clínica a menudo se recomienda el tratamiento con bloqueadores beta o ARA-II para los pacientes con válvula aórtica bicúspide si la raíz aórtica o la aorta ascendente están dilatadas. El tratamiento de la insuficiencia aórtica durante el embarazo se trata en la sección 13.
4.4Pruebas seriadasTodos los pacientes asintomáticos con insuficiencia aórtica grave y función normal del VI deben tener una consulta de seguimiento como mínimo una vez al año. Para los pacientes con un primer diagnóstico o si el diámetro del VI o la FEVI muestran cambios significativos o se acercan a los umbrales para cirugía, el seguimiento debe hacerse en intervalos de 3-6 meses. Se puede considerar la cirugía para los pacientes asintomáticos con dilatación significativa del VI (DTDVI>65mm) y un aumento progresivo de las dimensiones del VI o una disminución progresiva de la FEVI durante el seguimiento. Las concentraciones de BNP pueden tener un interés potencial como predictor de eventos clínicos (especialmente la aparición de síntomas y el deterioro de la función del VI) y puede ser útil para el seguimiento de los pacientes asintomáticos149. Para los pacientes con insuficiencia aórtica leve o moderada, el seguimiento debe ser anual y la ecocardiografía, cada 2 años.
En los casos de dilatación de la aorta ascendente (> 40mm), la TC o RMC están recomendadas. La evaluación en el seguimiento de las dimensiones de la aorta debe hacerse mediante ecocardiografía/RMC. Cualquier aumento>3mm debe validarse mediante angio-TC/RMC y compararse con los datos basales. Tras la reparación de la aorta ascendente, los pacientes con síndrome de Marfan siguen en riesgo de disección de la aorta residual y requieren de por vida un seguimiento multidisciplinario en un centro especializado.
4.5Grupos especiales de pacientesEn los casos de insuficiencia aórtica que requiere cirugía y de insuficiencia mitral grave primaria o secundaria concomitantes, se deben intervenir ambas en el mismo procedimiento.
En pacientes con insuficiencia aórtica moderada sometidos a CABG o cirugía de válvula mitral, la decisión de tratar la válvula aórtica es controvertida, ya que se ha demostrado que la insuficiencia aórtica moderada progresa lentamente en los pacientes sin dilatación aórtica150. La decisión del equipo cardiológico debe estar basada en la etiología de la insuficiencia aórtica, otros factores clínicos, la esperanza de vida y el riesgo operatorio del paciente.
El nivel de actividad física y la práctica deportiva en presencia de dilatación aórtica sigue siendo una cuestión de juicio médico debido a la falta de evidencia. Las guías actuales son muy restrictivas, en particular en lo que se refiere al ejercicio isométrico, para evitar acontecimientos irreversibles151. Este enfoque está claramente justificado en presencia de enfermedad del tejido conectivo, pero podría ser adecuado un enfoque menos restrictivo para otros pacientes.
Dado el riesgo familiar de aneurisma de aorta torácica, están indicados el cribado y las pruebas genéticas y de imagen a los familiares de primer grado de los pacientes con enfermedad del tejido conectivo. Para pacientes con válvulas bicúspides, es apropiado el cribado ecocardiográfico de los familiares de primer grado.
5ESTENOSIS AÓRTICALa estenosis aórtica es la valvulopatía primaria que con más frecuencia requiere tratamiento quirúrgico o percutáneo en Europa1 y Norteamérica, y su prevalencia está aumentando rápidamente debido al envejecimiento de la población2,152.
5.1Evaluación5.1.1EcocardiografíaLa ecocardiografía es la prueba más importante para confirmar el diagnóstico y la gravedad de la estenosis aórtica, evaluar al grado de calcificación valvular, la función del VI y el grosor de su pared, detectar otras valvulopatías concomitantes o enfermedad aórtica y obtener información pronóstica43,153,154. El examen ecocardiográfico se debe hacer cuando la presión arterial (PA) esté bien controlada para evitar los efectos de confusión de un aumento de la poscarga. Nuevos parámetros ecocardiográficos, pruebas estrés y la TC proporcionan información adicional cuando la gravedad sea incierta (figura 3).
Evaluación integral de la estenosis aórtica con pruebas de imagen. ΔPm: gradiente de presión medio; AVA: área valvular aórtica; EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; IVL: índice volumen-latido; TC: tomografía cardiaca computarizada; VA: válvula aórtica; VI: ventrículo izquierdo; Vmáx: velocidad pico transvalvular.
aEl alto flujo puede ser reversible en pacientes con anemia, hipertiroidismo o fístula arteriovenosa y puede observarse en pacientes con miocardiopatía hipertrófica obstructiva. Límite superior de lo normal mediante ecocardiografía con Doppler pulsado: índice cardiaco, 4,1 l/min/m2 en ambos sexos; IVL, 54ml/m2 los varones y 51ml/m2 las mujeres)155.
bConsidere también: síntomas típicos (sin otra causa), hipertrofia del VI (en ausencia de hipertensión coexistente) o función longitudinal del VI reducida (sin otra causa).
cReserva de flujo determinada mediante ecocardiografía con dobutamina: un incremento > 20% del volumen latido en respuesta a una dosis baja de dobutamina.
dEA seudograve: AVA>1,0 cm2 con aumento de flujo.
eUmbrales de EA grave según la medición por TC de la calcificación valvular aórtica (unidades de Agatston): en varones > 3.000 y en mujeres > 1.600, muy probable; en varones>2.000 y en mujeres>1.200, probable; en varones<1.600 y en mujeres<800, improbable.
Actualmente, las recomendaciones internacionales para la evaluación ecocadiográfica de los pacientes con estenosis aórtica25 dependen de la medición del gradiente medio de presión (el parámetro más robusto), la velocidad transvalvular máxima (Vmáx) y el área valvular. Aunque desde una perspectiva teórica el área valvular representa la medida ideal para evaluar la gravedad de la estenosis aórtica, su medición tiene numerosas limitaciones técnicas. Por ello, en caso de discrepancia, las decisiones clínicas deben tener en cuenta los siguientes factores: estado funcional, volumen latido, índice de velocidad Doppler156, grado de calcificación valvular, función del VI, presencia o ausencia de hipertrofia del VI, condiciones de flujo y el control adecuado de la PA25. El flujo bajo se define arbitrariamente como un índice de volumen latido (IVL) ≤ 35ml/m2, un umbral que está actualmente en debate155,157,158. Recientemente se ha propuesto utilizar umbrales específicos según el sexo159. La estenosis aórtica se puede clasificar en 4 categorías:
- •
Estenosis aórtica de gradiente alto (gradiente medio ≥ 40mmHg, velocidad pico ≥ 4,0m/s, área valvular ≤ 1 cm2 o ≤ 0,6 cm2/m2). Se puede confirmar una estenosis aórtica grave independientemente de la función del VI y las condiciones de flujo.
- •
Estenosis aórtica con flujo y gradiente bajos y FEVI reducida (gradiente medio<40mmHg, área valvular ≤ 1 cm2, FEVI < 50%, IVL ≤ 35ml/m2). En este contexto se recomienda la ecocardiografía de estrés con dosis bajas de dobutamina para diferenciar la verdadera estenosis aórtica grave de la pseudograve (definida como un aumento del área valvular a > 1,0 cm2 con aumento de flujo) e identificar a los pacientes sin reserva contráctil160. No obstante, su utilidad en pacientes ancianos solo se ha evaluado en registros peqeños161.
- •
Estenosis aórtica con flujo y gradiente bajos y FEVI conservada (gradiente medio < 40mmHg, área valvular ≤ 1 cm2, FEVI ≥ 50%, IVL ≤ 35ml/m2). Se encuentra típicamente en ancianos hipertensos con un tamaño ventricular pequeño e hipertrofia significativa157,162. Esta situación también puede ser resultado de entidades asociadas con un volumen latido bajo (p. ej., insuficiencia mitral moderada o grave, insuficiencia tricuspídea grave, estenosis mitral grave, comunicación interventricular grande y disfunción grave del VD). El diagnóstico de estenosis aórtica grave sigue siendo complejo y requiere la exclusión minuciosa de errores de medición y otros motivos para estos hallazgos ecocardiográficos25, además de la presencia o ausencia de síntomas típicos (sin otra explicación), hipertrofia del VI (en ausencia de hipertensión concomitante) o strain longitudinal del VI reducido (sin otra causa). El grado de calcificación valvular determinado mediante TC proporciona información adicional importante (umbrales de estenosis aórtica grave en unidades de Agatston: varones con > 3.000 y mujeres con > 1.600, muy probable; varones con>2.000 y mujeres > 1.200, probable, y varones con < 1.600 y mujeres con < 800, improbable)35,36,163,164.
- •
Estenosis aórtica con flujo normal, gradiente bajo y FEVI conservada (gradiente medio < 40mmHg, área valvular ≤ 1 cm2, FEVI ≥ 50%, IVL > 35ml/m2). Por lo general, estos pacientes presentan solo estenosis aórtica moderada36,165–167.
El índice de velocidad en reposo medido con Doppler (IVD, o índice adimensional) −el cociente entre la integral tiempo-velocidad en el tracto de salida del VI (TSVI) y el chorro de la válvula aórtica− no requiere el cálculo del área del TSVI y puede ser útil para la evaluación cuando otras mediciones son equívocas (un valor<0,25 indica una probabilidad alta de estenosis aórtica grave)156.
La determinación del strain longitudinal global proporciona información adicional sobre la función del VI y un umbral del 15% puede ayudar a identificar a los pacientes con estenosis aórtica grave asintomática que tienen más riesgo de deterioro clínico y muerte prematura26,168. La ETE permite evaluar la valvulopatía mitral concomitante y puede ser una técnica de imagen útil para la evaluación periprocedimiento en el TAVI o la RQVA169.
Las concentraciones de péptidos natriuréticos predicen la supervivencia libre de síntomas y la evolución de la enfermedad en la estenosis aórtica grave con flujo normal o bajo170,171. Pueden servir para determinar el origen de los síntomas cuando se dan varias causas posibles e identificar a los pacientes con estenosis aórtica grave asintomática y riesgo alto que podrían beneficiarse de una intervención temprana (sección 5.2.2, tabla 6 y figura 3).
La prueba de esfuerzo puede desenmascarar síntomas y se recomienda para la estratificación del riesgo de pacientes asintomáticos con estenosis aórtica grave172. La ecocardiografía de estrés puede proporcionar información pronóstica adicional de evaluar el aumento del gradiente medio de presión y los cambios en la función del VI173.
La TC proporciona información sobre la anatomía de la raíz aórtica y la aorta ascendente, el grado y la distribución de la calcificación valvular y vascular y la viabilidad del acceso vascular174. El grado de calcificación valvular predice la progresión de la enfermedad y los eventos clínicos164 y, combinado con la evaluación de la geometría del área valvular, puede ser útil para evaluar la gravedad de la estenosis aórtica de los pacientes con gradiente valvular bajo35,36,163,164.
La RMC permite detectar y cuantificar la fibrosis miocárdica, que es un factor importante de descompensación del VI en la estenosis aórtica (haya EC o no). La amiloidosis también es un hallazgo frecuente en pacientes ancianos con estenosis aórtica, con una incidencia del 9-15%175. Cuando existe sospecha clínica de amiloidosis cardiaca con base en los síntomas (neuropatía o datos hematológicos), debe considerarse la gammagrafía con bisfosfonatos y/o la RMC. Ambas entidades persisten después de las intervenciones valvulares y se asocian con un pronóstico desfavorable a largo plazo176–179.
La coronariografía es esencial antes del TAVI o el RQVA para determinar la necesidad de revascularización concomitante (véanse las secciones 3.2.4.1 y 5.5). El cateterismo del VI por acceso retrógrado no está recomendado, excepto cuando haya síntomas y signos de estenosis aórtica grave y resultados no concluyentes en pruebas no invasivas.
5.1.3Proceso diagnóstico antes del implante percutáneo de válvula aórticaAntes de un TAVI, la TC es la técnica de imagen preferida para evaluar: a) la anatomía de la válvula aórtica; b) el tamaño y la forma del anillo; c) el grado y la distribución de la calcificación valvular o vascular; d) el riesgo de obstrucción del ostium coronario; e) las dimensiones de la raíz aórtica; f) las proyecciones de fluoroscopia óptimas para el implante de la válvula, y g) la viabilidad del acceso vascular (femoral, subclavio, axilar, carotídeo, transcava o transapical). En caso de observarse factores anatómicos adversos, el RQVA podría ser una mejor opción de tratamiento (tabla 6). Aunque la ETE es una técnica más dependiente del operador, se podría considerar cuando la TC sea difícil de interpretar o presente contraindicaciones relativas (p. ej., en la insuficiencia renal crónica).
5.2Indicaciones para la intervención (RQVA o TAVI)Las indicaciones para las intervenciones de válvula aórtica se resumen en la tabla de recomendaciones sobre las indicaciones para la intervención en la estenosis aórtica sintomática y asintomática y modalidades de intervención recomendadas y en la figura 4.
Tratamiento de los pacientes con estenosis aórtica grave. EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección del ventrículo izquierdo; PA: presión arterial; RQVA: reemplazo quirúrgico de válvula aórtica; STS-PROM: Society of Thoracic Surgeons-predicted risk of mortality; TAVI: implante percutáneo de válvula aórtica.
aVéase la figura 3: evaluación integral de la estenosis aórtica con pruebas de imagen.
bEl riesgo excesivo se define en la tabla 5 del material adicional.
cLa evaluación del equipo cardiológico se basa en la evaluación minuciosa de los factores clínicos, anatómicos y técnicos (véase la tabla 6 y las recomendaciones sobre las indicaciones de intervención para pacientes sintomáticos y asintomáticos con estenosis aórtica y modalidades recomendadas de intervención). La recomendación del equipo cardiológico se debe discutir con el paciente para que pueda tomar una decisión informada sobre las opciones de tratamiento.
dCaracterísticas adversas según la evaluación clínica, de imagen (ecocardiografía/TC) y biomarcadores.
eSTS-PROM: http://riskcalc.sts.org/stswebriskcalc/#/calculate, EuroSCORE II: http://www.euroscore.org/calc.html.
fSi es candidato al procedimiento según los factores clínicos, anatómicos y técnicos (tabla 6).
La estenosis aórtica grave sintomática tiene un pronóstico desalentador y para estos pacientes se recomienda la intervención temprana. Las únicas excepciones se aplican a los pacientes para quienes sea poco probable que la intervención mejore la calidad de vida o la supervivencia (debido a comorbilidades graves) o que tengan enfermedades concomitantes que conlleven una supervivencia estimada < 1 año (p. ej., enfermedad maligna; véase la sección 3).
Se recomienda intervenir a los pacientes sintomáticos con estenosis aórtica y gradiente alto, independientemente de la FEVI. Sin embargo, el tratamiento de los pacientes con estenosis aórtica con gradiente bajo es más complejo:
- •
Por lo general, la función del VI de los pacientes con estenosis aórtica con flujo y gradiente bajos mejora después de la intervención si la causa de la reducción de la fracción de eyección es predominantemente una poscarga excesiva32,180. En cambio, la mejoría es incierta cuando la causa primaria de la FEVI reducida es el tejido cicatricial producido por infarto de miocardio o miocardiopatía. La intervención está recomendada cuando la estenosis aórtica grave se confirme mediante ecocardiografía de estrés (estenosis aórtica grave auténtica; figura 3)32, mientras que los pacientes con estenosis aórtica pseudograve deben recibir tratamiento convencional para la insuficiencia cardiaca142,181. No parece que la presencia o ausencia de reserva de flujo (un aumento del volumen latido ≥ 20%) haya influido en el pronóstico en series contemporáneas de pacientes sometidos a TAVI o RQVA182–184, y aunque los pacientes sin reserva de flujo muestran un aumento de la mortalidad relacionada con el procedimiento, ambas modalidades de intervención mejoran la fracción de eyección y los resultados clínicos32,180,182. Para estos pacientes, la decisión sobre el tratamiento debe tener en cuenta las comorbilidades, el grado de calcificación de la válvula, el grado de EC y la viabilidad de la revascularización.
- •
Los datos relativos a la historia natural de la estenosis aórtica con flujo y gradiente bajos y fracción de eyección conservada y los resultados tras RQVA y TAVI siguen siendo controvertidos162,165,167. La intervención solo se debe considerar para los pacientes con síntomas y obstrucción valvular significativa (véase la tabla de recomendaciones sobre las indicaciones para la intervención en la estenosis aórtica sintomática y asintomática y modalidades recomendadas de intervención y la figura 4).
- •
El pronóstico de los pacientes con estenosis aórtica con flujo normal, gradiente bajo y fracción de eyección conservada es similar al de aquellos con estenosis aórtica moderada. Para ellos, se recomienda la vigilancia clínica y ecocardiográfica regular165,166,185.
Se recomienda intervenir a los pacientes asintomáticos con estenosis aórtica grave y función del VI reducida sin otra causa9 y para aquellos que están asintomáticos durante actividades normales pero sufren síntomas durante la prueba de esfuerzo172,186. En el resto de los casos, el tratamiento de la estenosis aórtica asintomática grave sigue siendo controvertido y la decisión de operar requiere sopesar cuidadosamente los beneficios y los riesgos del procedimiento para el paciente individual.
En ausencia de características pronósticas adverso, por lo general se ha recomendado vigilancia estrecha y pronta intervención en cuanto aparezcan síntomas187. Los datos de un estudio aleatorizado muestran una reducción significativa de la variable principal (muerte intraoperatoria o en los primeros 30 días tras la cirugía o muerte cardiovascular durante el periodo completo de seguimiento) tras RQVA temprano comparado con el tratamiento conservador (el 1 frente al 15%; hazard ratio [HR]=0,09; intervalo de confianza del 95% [IC95%], 0,01-0,67; p = 0,003)188. No obstante, los sujetos del estudio fueron seleccionados por criterios de inclusión (media de edad, 64 años; mínima comorbilidad, riesgo operatorio bajo) y el seguimiento en el grupo de tratamiento conservador fue corto. Otros estudios aleatorizados en desarrollo −EARLY TAVR (NCT03042104), AVATAR (NCT02436655), EASY-AS (NCT04204915), EVOLVED (NCT03094143)− ayudarán a determinar recomendaciones en el futuro.
Entre los predictores de aparición de síntomas y resultados adversos en pacientes asintomáticos, se incluyen las características clínicas (edad avanzada, factores de riesgo ateroesclerótico), los parámetros ecocardiográficos (calcificación valvular, pico de velocidad del chorro)189,190, la FEVI, la tasa de progresión hemodinámica189, un aumento del gradiente medio > 20mmHg durante el ejercicio172, la hipertrofia grave del VI191, el índice de volumen latido158, el volumen de la AI192, el strain longitudinal global del VI26,168,193 y las concentraciones anormales de biomarcadores (péptidos natriuréticos, troponina y fetuina A)170,171,194,195. Puede considerarse la intervención temprana de los pacientes asintomáticos con estenosis aórtica grave y 1 o más de estos predictores siempre que el riesgo quirúrgico sea bajo, aunque el TAVI en este contexto no se ha validado formalmente (tabla 6 y figura 4). De lo contrario, la espera vigilante es más segura y una estrategia más adecuada.
5.2.3Tipo de intervenciónEn la última década, el RQVA y el TAVI como opciones de tratamiento complementarias han permitido un aumento sustancial del número total de pacientes con estenosis aórtica sometidos a una intervención quirúrgica o percutánea196. En ensayos clínicos aleatorizados se han evaluado los 2 modos de intervención en todo el espectro de riesgo quirúrgico, sobre todo en pacientes ancianos. En la sección 5 del material adicional se muestra una valoración detallada de la evidencia acumulada. En resumen, estos estudios usaron escalas de riesgo quirúrgico para determinar la selección de pacientes y demostraron que el TAVI es superior al tratamiento farmacológico para pacientes con riesgo extremo197 y no inferior al RQVA en pacientes con riesgo alto198–201 o intermedio durante los 5 años de seguimiento202–208. Los recientes estudios PARTNER 3 y Evolut Low Risk demostraron que el TAVI es no inferior al RQVA para pacientes con riesgo bajo en el seguimiento a 2 años209–212. Cabe destacar que entre los pacientes con riesgo bajo predominaban los varones de edad relativamente avanzada (PARTNER 3: media, 73,4 años; el 24%, < 70 años; el 36%, 70-75 años; el 40%, > 75 años y el 13%, > 80 años), mientras que se excluyó a los pacientes con estenosis aórtica con flujo bajo o características anatómicas adversas para cualquiera de los 2 procedimientos (incluidas las válvulas aórticas bicúspides o la EC compleja).
Las tasas de complicaciones vasculares, el implante de marcapasos y la insuficiencia paravalvular son significativamente más altas después del TAVI, mientras que las hemorragias mayores, la insuficiencia renal aguda y la FA de nueva aparición son más frecuentes tras el RQVA. Aunque la probabilidad de insuficiencia paravalvular se ha reducido con los nuevos diseños de válvulas transcatéter, el implante de marcapasos (y el bloqueo de rama izquierda de nueva aparición) puede tener consecuencias a largo plazo213-215, por lo que es necesario mejorar los dispositivos. Los pacientes sometidos a TAVI tienen una recuperación rápida, una estancia hospitalaria corta y un retorno rápido a las actividades normales216,217. A pesar de estos beneficios, existe una gran variación en el acceso a este procedimiento como resultado del alto coste de los dispositivos y los diferentes niveles de acceso a los recursos sanitarios71,218,219.
El Grupo de Trabajo ha intentado abordar las lagunas en la evidencia y proporcionar recomendaciones sobre las indicaciones de intervención y los modos de tratamiento (tabla de recomendaciones sobre las indicaciones para la intervención en la estenosis aórtica sintomática y asintomática y modalidades recomendadas de intervención y figura 4), que se basan en los hallazgos de ensayos controlados aleatorizados y son compatibles con la toma de decisiones del equipo cardiológico en la práctica clínica para pacientes individuales (que en muchos casos no cumplen los criterios de inclusión de los ensayos aleatorizados). La estenosis aórtica es una entidad heterogénea y el equipo cardiológico debe valorar cuidadosamente el modo de intervención más adecuado para cada paciente, teniendo en cuenta la edad y la esperanza de vida estimada, las comorbilidades (incluida la fragilidad y la calidad de vida; sección 3), las características anatómicas y técnicas (tabla 6), los riesgos relativos del RQVA y el TAVI y sus resultados a largo plazo, la durabilidad de válvulas protésicas, la viabilidad del TAVI transfemoral, la experiencia del centro y los datos de resultados. Estos factores se deben tratar con el paciente y su familia para que tomen una decisión informada sobre la opción de tratamiento.
La relación entre la esperanza de vida estimada y la durabilidad de la válvula protésica es un aspecto clave que hay que considerar en la toma de decisiones. La edad es un estimador indirecto de la esperanza de vida, aunque no tuvo impacto alguno en los eventos clínicos en los ensayos controlados aleatorizados con pacientes de bajo bajo con seguimientos a 1 y 2 años. La esperanza de vida varía ampliamente en el mundo y depende en gran manera de la edad absoluta, el sexo, la fragilidad y la presencia de comorbilidades (http://ghdx.healthdata.org/record/ihme-data/gbd-2017-life-tables-1950-2017), y aunque podría ser más útil para tomar decisiones, es difícil de determinar en pacientes individuales.
Recomendaciones sobre las indicaciones para la intervencióna en la estenosis aórtica sintomática y asintomática y modalidades recomendadas de intervención.
| A. Estenosis aórtica sintomática | Claseb | Nivelc |
|---|---|---|
| Se recomienda intervenir a los pacientes con estenosis aórtica sintomática grave con gradiente alto (gradiente medio ≥ 40mmHg, velocidad pico ≥ 4,0m/s y área valvular ≤ 1,0 cm2 o ≤ 0,6 cm2/m2)235,236 | I | B |
| Se recomienda intervenir a los pacientes sintomáticos con estenosis aórtica grave con flujo bajo (IVL ≤ 35ml/m2), gradiente bajo (< 40mmHg), fracción de eyección reducida (< 50%) y evidencia de reserva de flujo (o reserva contráctil)32,237 | I | B |
| Debe considerarse intervenir a los pacientes sintomáticos con estenosis aórtica con flujo bajo, gradiente bajo (< 40mmHg) y fracción de eyección normal después de confirmar que la estenosis aórtica es realmente grave (figura 3) | IIa | C |
| Debe considerarse intervenir a los pacientes sintomáticos con estenosis aórtica grave con flujo y gradiente bajos y fracción de eyección reducida, sin reserva de flujo (reserva contráctil), particularmente cuando se confirme su gravedad mediante la determinación de calcio por TC | IIa | C |
| No se recomienda intervenir a los pacientes con comorbilidades graves cuando no sea probable que la intervención mejore la calidad de vida o prolongue la supervivencia > 1 año | III | C |
| B. Pacientes asintomáticos con estenosis aórtica grave | ||
| Se recomienda intervenir a los pacientes asintomáticos con estenosis aórtica grave y disfunción sistólica del VI (FEVI<50%) que no se debe a ninguna otra causa9,238,239 | I | B |
| Se recomienda intervenir a los pacientes asintomáticos con estenosis aórtica grave y síntomas durante la prueba de esfuerzo | I | C |
| Debe considerarse intervenir a los pacientes asintomáticos con estenosis aórtica grave y disfunción sistólica del VI (FEVI<55%) que no se debe a otra causa9,240,241 | IIa | B |
| Debe considerarse intervenir a los pacientes asintomáticos con estenosis aórtica grave y una caída persistente de la presión arterial (> 20mmHg) durante la prueba de esfuerzo | IIa | C |
| Debe considerarse intervenir a los pacientes asintomáticos con FEVI > 55% y prueba de esfuerzo normal siempre que esté presente 1 de los siguientes factores:• Estenosis aórtica muy grave (gradiente medio ≥ 60mmHg o Vmáx > 5m/s)9,242• Calcificación valvular grave (idealmente por TC) y una tasa de progresión de la Vmáx ≥ 0,3m/s/año164,189,243• Concentraciones de BNP significativamente elevadas (más de 3 veces el valor normal corregido por edad y sexo), confirmadas en mediciones repetidas y que no se explican por otra causa163,171 | IIa | B |
| C. Modalidad de intervención | ||
| Las intervenciones de válvula aórtica se deben llevar a cabo en centros especializados en valvulopatías que declaren su experiencia y sus resultados, dispongan de cardiología intervencionista y cirugía cardiaca en el propio centro y de un equipo cardiológico estructurado y colaborativo | I | C |
| La elección de la intervención quirúrgica o percutánea debe basarse en la evaluación minuciosa del equipo cardiológico de los factores clínicos, anatómicos y técnicos, sopesando los riesgos y los beneficios de cada estrategia para el paciente individual. La recomendación del equipo cardiológico debe discutirse con el paciente para que pueda tomar una decisión informada sobre las opciones de tratamiento | I | C |
| Se recomienda el RQVA para los pacientes jóvenes que tienen un riesgo quirúrgico bajo (< 75 añose y STS-PROM o EuroSCORE II < 4%)e,f o para pacientes operables que no sean candidatos a TAVI transfemoral244 | I | B |
| Se recomienda el TAVI para los pacientes de edad avanzada (≥ 75 años) o con riesgo quirúrgico alto (STS-PROM o EuroSCORE IIf > 8%) o que no sean candidatos a cirugía197–206,245 | I | A |
| Para los demás pacientes, se recomiendan el RQVA o el TAVI dependiendo de las características clínicas, anatómicas y técnicas individuales202–205,207,209,210,212,f,g | I | B |
| Puede considerarse el TAVI no transfemoral para pacientes no operables que no son candidatos a TAVI transfemoral | IIb | C |
| Puede considerarse la valvulotomía aórtica con balón como puente al RQVA o el TAVI para pacientes hemodinámicamente inestables y, si es factible i, para pacientes con estenosis aórtica grave que requiera cirugía mayor no cardiaca urgente (figura 11) | IIb | C |
| D. Cirugía aórtica concomitante durante otro procedimiento quirúrgico cardiaco o de aorta ascendente | ||
| Se recomienda el RQVA para los pacientes con estenosis aórtica grave sometidos a CABG o cirugía de la aorta ascendente o de otra válvula | I | C |
| Debe considerarse el RQVA para los pacientes con estenosis aórtica moderada sometidos a CABG o cirugía de la aorta ascendente o de otra válvula tras la valoración del equipo cardiológico | IIa | C |
BNP: péptido natriurético cerebral; CABG: cirugía de revascularización coronaria; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FEVI: fracción de eyección del ventrículo izquierdo; IVL: índice volumen latido; RQVA: reemplazo quirúrgico de válvula aórtica; STS-PROM: Society of Thoracic Surgeons-predicted risk of mortality; TAVI: implante percutáneo de válvula aórtica; TCC: tomografía computarizada cardiaca; VI: ventrículo izquierdo; Vmáx: velocidad pico transvalvular.
aRQVA o TAVI.
bClase de recomendación.
cNivel de evidencia.
dLa presencia de un área valvular pequeña pero con gradiente bajo a pesar de la FEVI conservada a menudo se explica por causas diferentes de la estenosis aórtica grave, que deben descartarse tras una evaluación minuciosa (figura 3).
eSTS-PROM: http://riskcalc.sts.org/stswebriskcalc/#/calculate; EuroSCORE II: http://www.euroscore.org/calc.html.
fSiempre que sean candidatos a cirugía (véase la tabla 6).
gSiempre que sean candidatos a TAVI transfemoral (véase la tabla 6).
hLa estenosis aórtica moderada se define como un área valvular de 1,0-1,5 cm2 (o un gradiente aórtico medio de 25-40mmHg) en condiciones de flujo normales; la evaluación clínica es esencial para determinar si el RQVA es apropiado para el paciente individual.
Aunque algunos diseños de bioprótesis quirúrgicas, ya abandonados, fallaban pronto, la durabilidad superior a 10 años de las bioprótesis contemporáneas está bien establecida220. Por otra parte, los datos de registros proporcionan cierta seguridad sobre la durabilidad a largo plazo de los dispositivos de TAVI de hasta 8 años, pero se refieren fundamentalmente a pacientes de edad más avanzada con riesgo intermedio o alto221–224, mientras que la información relativa a la durabilidad en pacientes con riesgo bajo actualmente se limita a 2 años de seguimiento. Los datos de la comparación directa de la durabilidad entre las válvulas percutáneas y las bioprótesis quirúrgicas siguen siendo escasos. En el estudio PARTNER 2A, las tasas de reintervención de válvula aórtica fueron más altas después de TAVI con válvula expandible con balón que tras RQVA a los 5 años de seguimiento (el 3,2 frente al 0,8%; HR = 3,3; IC95%, 1,3-8,1)206, mientras que las tasas de deterioro estructural de la válvula no fueron estadísticamente diferentes entre RQVA y TAVI con el dispositivo SAPIEN 3 de tercera generación en un registro observacional paralelo hecho en el mismo periodo de tiempo225.
El TAVI «válvula en válvula» es una opción de tratamiento establecida en caso de deterioro de la bioprótesis quirúrgica, aunque puede no ser adecuado o viable para todos los pacientes debido a la mayor probabilidad de desproporción entre paciente y prótesis (mismatch) cuando la raíz aórtica es pequeña (o la prótesis original es de tamaño insuficiente), diseños incompatibles de válvula quirúrgica asociados con un aumento de riesgo de oclusión coronaria o acceso vascular difícil. En este contexto, se puede considerar también un nuevo RQVA226–228. Se han demostrado resultados favorables a corto plazo de la repetición del TAVI en pacientes seleccionados de edad más avanzada con deterioro de una válvula percutánea229, a pesar de las reservas teóricas sobre el mantenimiento del acceso coronario230.
Las válvulas aórticas bicúspides son más frecuentes en pacientes con estenosis aórtica más jóvenes. Aunque varios registros comunicaron resultados excelentes del TAVI en pacientes no candidatos a cirugía231–233, el RQVA sigue siendo la estrategia más adecuada para pacientes con estenosis aórtica sobre válvula bicúspide y para aquellos con enfermedades asociadas (p. ej., dilatación de la raíz aórtica, enfermedad coronaria compleja o insuficiencia mitral grave) que requieren tratamiento quirúrgico.
En resumen, la durabilidad de la válvula protésica es un aspecto clave que hay que considerar para los pacientes más jóvenes (< 75 años) con riesgo quirúrgico bajo y, por lo tanto, el RQVA es la opción preferida de tratamiento, siempre que sea viable. En cambio, la durabilidad tiene una prioridad menor en los pacientes de edad más avanzada (≥ 75 años) o inoperables o con riesgo quirúrgico alto, por lo que para ellos el TAVI es la opción preferida (particularmente si es viable el acceso transfemoral). Para el resto de los pacientes, el equipo cardiológico debe emitir recomendaciones individualizadas basadas en las características de cada paciente (tabla 6). Se deberá revaluar estas recomendaciones cuando se disponga de datos sobre la durabilidad a largo plazo de los dispositivos de TAVI.
La valvuloplastia aórtica con balón (VAB) puede considerarse como puente al TAVI o el RQVA para los pacientes con estenosis aórtica descompensada y, cuando sea viable, los pacientes con estenosis aórtica grave que requiera cirugía mayor no cardiaca urgente y de riesgo alto (sección 12). El procedimiento conlleva un riesgo de complicaciones significativo234 y solo se debe llevar a cabo tras la valoración del equipo cardiológico.
5.3Tratamiento médicoNingún tratamiento farmacológico tiene efectos en la historia natural de la estenosis aórtica. Las estatinas, que en estudios preclínicos mostraron efectos favorables, no afectan a la progresión de la enfermedad246 y hay en marcha estudios sobre las vías metabólicas del calcio. Los pacientes con insuficiencia cardiaca que no son candidatos o están en lista de espera para RQVA o TAVI deben recibir tratamiento acorde con la guía de la ESC sobre insuficiencia cardiaca247. Los IECA son seguros en la estenosis aórtica (siempre que se controle la PA) y pueden tener efectos miocárdicos beneficiosos antes de la aparición de síntomas y después del TAVI o el RQVA248–250. Se debe tratar la hipertensión para evitar la sobrecarga adicional, aunque debe ajustarse gradualmente la medicación (sobre todo los vasodilatadores) para evitar la hipotensión sintomática.
El tratamiento antitrombótico tras el TAVI se trata en la sección 11.
5.4Pruebas seriadasLa tasa de progresión de la estenosis aórtica varía ampliamente. Los pacientes asintomáticos, sus familias y los profesionales sanitarios deben recibir instrucciones adecuadas con un énfasis especial en la importancia del seguimiento regular (idealmente en un centro especializado en valvulopatías)9 y en la necesidad de informar de los síntomas en cuanto aparezcan. Se debe evaluar a los pacientes con estenosis aórtica asintomática grave como mínimo cada 6 meses para vigilar la aparición de síntomas (con prueba de esfuerzo si los síntomas son dudosos) y detectar cambios en los parámetros ecocardiográficos (particularmente la FEVI). Se puede considerar la determinación de péptidos natriuréticos.
Varios estudios indican que el pronóstico de la estenosis aórtica degenerativa moderada es peor de lo que se pensaba251–254 (especialmente en presencia de calcificación valvular significativa) y se debe reexaminar a estos pacientes como mínimo cada año. Para los pacientes más jóvenes con estenosis aórtica leve y sin calcificación significativa, se recomienda el seguimiento cada 2-3 años.
5.5Grupos especiales de pacientesLas mujeres con estenosis aórtica tienen mayor mortalidad que los varones como resultado de un diagnóstico y evaluación especializada tardíos, que se siguen de la menor frecuencia y el mayor retraso de las derivaciones a intervención255–257. Son necesarias medidas para mejorar esta situación y garantizar que ambos sexos reciben una atención igualitaria.
La EC y la estenosis aórtica a menudo coexisten y su combinación confiere un riesgo alto de eventos clínicos, por lo que es frecuente que se considere la necesidad de revascularización combinada con la intervención de válvula aórtica. El impacto de la revascularización coronaria en pacientes con EC silente acompañada de estenosis aórtica no está claro, por lo que son necesarios más estudios en este contexto (sección 3). Tanto el RQVA y la CABG simultáneos como el RQVA después de la CABG implican mayor riesgo asociado con el procedimiento que el RQVA solo. No obstante, datos de estudios retrospectivos indican que los pacientes con estenosis aórtica moderada, que tienen indicada la CABG, se benefician del RQVA simultáneo. Los pacientes de menos de 70 años con una tasa de progresión del gradiente medio ≥ 5mmHg/año se benefician del RQVA concomitante a la cirugía coronaria una vez que se haya excedido el pico de gradiente basal en 30 mmHg258. Las decisiones sobre pacientes individuales deben tener en cuenta los datos hemodinámicos, la tasa de progresión, el grado de calcificación de las valvas, la esperanza de vida y las comorbilidades, además del riesgo individual del RQVA simultáneo o el TAVI diferido244.
La intervención coronaria percutánea (ICP) y el TAVI pueden llevarse a cabo como procedimientos combinados o en diferentes etapas según la situación clínica, el patrón de la EC y la extensión del miocardio en riesgo259. En el estudio SURTAVI, no hubo diferencias significativas en la variable principal (mortalidad por cualquier causa o ictus a los 2 años de seguimiento) en los pacientes con riesgo intermedio, estenosis aórtica grave y EC no compleja (puntuación SYNTAX < 22) sometidos a TAVI e ICP (el 16,0%; IC95%, 11,1-22,9) o RQVA y CABG (el 14%; IC95%, 9,2-21,1; p = 0,62)260. El objetivo de varios estudios aleatoizados en curso es evaluar el valor clínico de la ICP sistemática en pacientes con EC significativa sometidos a TAVI. Los pacientes con estenosis aórtica sintomática grave y EC difusa que no son candidatos para revascularización deben recibir tratamiento farmacológico óptimo y RQVA o TAVI dependiendo de las características individuales.
La gravedad de la insuficiencia mitral asociada con estenosis aórtica grave se podría sobrestimar en presencia de presiones del VI elevadas, por lo que se requiere una cuantificación minuciosa. Los pacientes con insuficiencia mitral primaria grave requieren cirugía de válvula mitral al mismo tiempo que el RQVA. Para los pacientes con insuficiencia mitral secundaria grave, se puede considerar también la cirugía siempre que haya dilatación anular significativa y aumento marcado de las dimensiones del VI. Para los pacientes con estenosis aórtica grave y riesgo alto o inoperables, puede ser factible la combinación de TAVI y reparación percutánea de borde con borde (lo más habitual, en procedimientos secuenciales), aunque la experiencia acumulada no permite establecer recomendaciones firmes261–263. Para los pacientes con insuficiencia mitral primaria grave, se debe considerar la reparación percutánea de borde con borde si el paciente sigue sintomático y la insuficiencia mitral sigue siendo grave después del TAVI. Los pacientes con insuficiencia mitral secundaria grave deben tener un seguimiento clínico y ecocardiográfico después del TAVI para determinar la necesidad de una intervención mitral posterior264.
En la sección 4 se encuentran las recomendaciones sobre el tratamiento del aneurisma o la dilatación de la aorta ascendente asociados con estenosis aórtica. El diagnóstico y el tratamiento de la estenosis aórtica congénita se tratan en la guía de la ESC sobre cardiopatías congénitas del adulto265.
6INSUFICIENCIA MITRALLa insuficiencia mitral es la segunda valvulopatía más frecuente en Europa1,3. El mecanismo subyacente de la insuficiencia mitral primaria o secundaria determina la estrategia terapéutica.
6.1Insuficiencia mitral primariaEn la insuficiencia mitral primaria, están afectados uno o varios componentes de la válvula. La etiología degenerativa (el déficit fibroelástico y la enfermedad de Barlow) es más frecuente en países occidentales1,2,266, mientras que en países en desarrollo lo es la reumática267. La endocarditis es una causa de insuficiencia mitral primaria y se trata en una guía específica de la ESC4.
6.1.1EvaluaciónLa ecocardiografía es la prueba de imagen de primera elección para evaluar la gravedad de la insuficiencia mitral primaria (tabla 7). Se recomienda un enfoque integrador de parámetros cualitativos, semicuantitativos y cuantitativos, además de la cuantificación de las dimensiones del VI y la AI24,268. El área del orificio regurgitante efectivo (AORE), presenta una fuerte correlación con la mortalidad por cualquier causa y un AORE ≥ 20 mm2 se asocia con un exceso de mortalidad comparada con la población general269, que aumenta firmemente a partir de 40 mm2. La evaluación de las lesiones específicas que causan insuficiencia mitral tiene implicaciones pronósticas266,270 y es fundamental para determinar la viabilidad de la reparación valvular quirúrgica o percutánea271–273 (figura 1 del material adicional). La ETE tridimensional proporciona proyecciones ortogonales de las valvas que se asemejan a como se ve la válvula durante la cirugía y facilitan la valoración del equipo cardiológico24,268. Además, la ecocardiografía tridimensional muestra una mayor concordancia con la RMC en la cuantificación del volumen regurgitante que la ecocardiografía bidimensional, particularmente en chorros de regurgitación excéntricos, múltiples o telesistólicos274–277. En caso de discordancia entre varios parámetros ecocardiográficos empleados para determinar la gravedad de la insuficiencia mitral, la RMC es una alternativa válida para cuantificar el volumen regurgitante y es la técnica estándar de referencia para cuantificar los volúmenes del VI y la AI278. Además, la cuantificación de insuficiencia mitral con RMC ha mostrado implicaciones pronósticas277. Por último, datos preliminares muestran que la fibrosis miocárdica determinada por RMC es frecuente en la insuficiencia mitral primaria y se asocia con muerte súbita cardiaca y arritmias ventriculares279.
Criterios para definir la insuficiencia mitral grave basados en ecocardiografía bidimensional.
| Insuficiencia mitral primaria | Insuficiencia mitral secundaria | |
|---|---|---|
| Cualitativos | ||
| Morfología valvular | Velo valvular suelto o evertido, rotura de músculo papilar, retracción excesiva, perforación grande | Velos normales pero con volumen excesivo entre el anillo y los velos mitrales (tenting), defecto de coaptación |
| Área del chorro regurgitante en Doppler color | Chorro central grande (≥ 50% de la AI) o chorro excéntrico de tamaño variable que afecta a la pared | Chorro central grande (≥ 50% de la AI) o chorro excéntrico de tamaño variable que afecta a la pared |
| Zona del flujo de convergencia | Grande en toda la sístole | Grande en toda la sístole |
| Chorro regurgitante en Doppler de onda continua | Holosistólico/denso/triangular | Holosistólico/denso/triangular |
| Semicuantitativos | ||
| Anchura de vena contracta | ≥ 7mm (≥ 8mm en biplano) | ≥ 7mm (≥ 8mm en biplano) |
| Flujo venoso pulmonar | Flujo sistólico invertido | Flujo sistólico invertido |
| Flujo de entrada | Onda E dominante (> 1,2m/s) | Onda E dominante (> 1,2m/s) |
| IVT mitral/IVT aórtica | > 1,4 | > 1,4 |
| Cuantitativos | ||
| AORE (PISA 2D) | ≥ 40 mm2 | ≥ 40 mm2 (podría ser ≥ 30 mm2 en caso de área elíptica del orificio regurgitante) |
| Volumen regurgitante (ml/latido) | ≥ 60ml | ≥ 60ml (podría ser ≥ 45ml en caso de condiciones de flujo bajo) |
| Fracción regurgitante | ≥ 50% | ≥ 50% |
| Estructurales | ||
| Ventrículo izquierdo | Dilatado (DTSVI ≥ 40mm) | Dilatado |
| Aurícula izquierda | Dilatada (diámetro ≥ 55mm o volumen ≥ 60ml/m2) | Dilatada |
2D: bidimensional; AI: aurícula izquierda; AORE: área del orificio regurgitante efectivo; DTSVI: diámetro telesistólico del ventrículo izquierdo; IVT: integral velocidad tiempo; PISA: área de isoconvergencia proximal.
Adaptada de Lancellotti P et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;14:611-644. © 2013, con autorización de Oxford University Press en representación de la Sociedad Europea de Cardiología. Reproducida de Zoghbi WA et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the American Society of Echocardiography developed in collaboration with the Society for Cardiovascular Magnetic Resonance. J Am Soc Echocardiogr. 2017;30:303-371. © 2017, con autorización de la American Society of Echocardiography.
La ecocardiografía de estrés permite evaluar los cambios del volumen mitral regurgitante y las presiones pulmonares durante el pico de ejercicio y es particularmente útil en pacientes con síntomas discordantes y algún grado de insuficiencia en reposo280,281. En pacientes asintomáticos con insuficiencia mitral primaria grave sin dilatación del VI y AI, las concentraciones bajas de BNP se asocian con una mortalidad baja, y su determinación puede ser útil durante el seguimiento41,282.
Aunque las dimensiones del VI y la FEVI se emplean para guiar el tratamiento de los pacientes con insuficiencia mitral primaria grave, la evidencia acumulada muestra que el strain longitudinal global del VI tiene un valor pronóstico adicional para los pacientes sometidos a reparación quirúgica283,284. Recientemente se ha propuesto la escala Mitral Regurgitation International Database (MIDA) para estimar el riesgo de mortalidad por cualquier causa en pacientes con insuficiencia mitral primaria grave causada por eversión de los velos en tratamiento farmacológico o con cirugía285. Entre las variables incluidas en esta escala, un diámetro de la AI ≥ 55mm y un DTSVI ≥ 40mm son 2 nuevos valores de corte que se han integrado en las recomendaciones actuales.
El cateterismo derecho se usa sistemáticamente para confirmar la hipertensión pulmonar diagnosticada mediante ecocardiografía cuando este es el único criterio para referir al paciente a cirugía.
6.1.2Indicaciones de intervenciónLa cirugía urgente está indicada para pacientes con insuficiencia mitral aguda grave. En general, si la rotura del músculo papilar es la causa subyacente, es necesario reemplazar la válvula.
Las indicaciones de cirugía en la insuficiencia mitral primaria crónica se muestran en la tabla de recomendaciones y la figura 5. La cirugía está indicada para pacientes con insuficiencia mitral primaria grave y un riesgo quirúrgico aceptable según la valoración del equipo cardiológico. FEVI ≤ 60%, DTSVI ≥ 40 mm285,286, volumen de la AI ≥ 60ml/m2 o diámetro de la AI ≥ 55 mm287,288, presión arterial pulmonar sistólica (PAPS) > 50 mmHg289 y la nueva aparición de FA290,291 se han asociado con una evolución más desfavorable, por lo que se consideran indicadores de intervención independientemente del estado sintomático292. En ausencia de estos criterios, la espera vigilante, idealmente en un centro especializado en valvulopatías, es una estrategia segura para los pacientes con insuficiencia mitral primaria grave.
Tratamiento de los pacientes con insuficiencia mitral primaria, crónica y grave. AI: aurícula izquierda; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; PAPS: presión arterial pulmonar sistólica; RPBB: reparación percutánea «borde con borde»; TRC: terapia de resincronización cardiaca.
aDilatación de la AI: índice de volumen ≥ 60ml/m2 o diámetro ≥ 55mm en ritmo sinusal.
bEl tratamiento extensivo de la insuficiencia cardiaca incluye: TRC, dispositivos de asistencia ventricular y trasplante cardiaco247.
Cuando se considere la cirugía, la reparación de la válvula mitral es la intervención quirúrgica de primera elección si se esperan resultados duraderos según la valoración del equipo cardiológico, ya que se asocia con una mayor supervivencia comparada con el reemplazo de válvula mitral293,294. La insuficiencia mitral primaria causada por prolapso valvular segmentario puede repararse con bajo riesgo de recurrencia y reintervención294–296. La posibilidad de reparación de válvulas reumáticas, prolapso valvular extenso y, especialmente, de la insuficiencia mitral con calcificación de valvas o calcificación extensa del anillo es mucho más compleja297,298. Los pacientes que requieren una reparación mitral predeciblemente compleja deben ser intervenidos en centros con experiencia y tasas altas de reparación, mortalidad operatoria baja y datos de resultados duraderos. Cuando la reparación no sea posible, el reemplazo de la válvula mitral conservando el aparato subvalvular es la alternativa.
El implante percutáneo de válvula mitral para la insuficiencia mitral primaria grave es una alternativa segura en pacientes con contraindicaciones para la cirugía o con riesgo quirúrgico alto299–302. La reparación «borde con borde» es la técnica que acumula más experiencia, mientras que la seguridad y la eficacia de otras técnicas se han probado en series más pequeñas303–306. La eficacia de nuevos sistemas de reparación «borde con borde»307 se está investigando en pacientes con riesgo alto en el estudio MITRA-HR (NCT03271762)308 y pacientes con riesgo intermedio en el estudio REPAIR-MR (NCT04198870).
Recomendaciones sobre las indicaciones para la intervención en la insuficiencia mitral primaria grave.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| La reparación de válvula mitral es la técnica quirúrgica recomendada cuando se esperen resultados duraderos293–296 | I | B |
| La cirugía está indicada para pacientes sintomáticos que sean operables y no tengan riesgo alto293–296 | I | B |
| La cirugía está indicada para pacientes asintomáticos con disfunción del VI (DTSVI ≥ 40mm o FEVI ≤ 60%)277,286,292 | I | B |
| Debe considerarse la cirugía para pacientes asintomáticos con función del VI conservada (DTSVI < 40mm y FEVI > 60%) y FA secundaria a insuficiencia mitral o hipertensión pulmonarc (PAPS en reposo > 50mmHg)285,289 | IIa | B |
| Debe considerarse la reparación quirúrgica de la válvula mitral para los pacientes asintomáticos con riesgo bajo, FEVI > 60%, DTSVI < 40mm y dilatación de la AI significativa (índice de volumen ≥ 60ml/m2 o diámetro ≥ 55mm) siempre que el procedimiento se haga en un centro especializado en valvulopatías y se esperen resultados duraderos285,288 | IIa | B |
| Puede considerarse la reparación «borde con borde» para los pacientes sintomáticos que cumplan los criterios ecocardiográficos de selección y el equipo cardiológico considere inoperables o de riesgo quirúrgico alto siempre que el procedimiento no se considere fútil 299–302 | IIb | B |
AI: aurícula izquierda; DTSVI: diámetro telesistólico del VI; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; PAPS: presión arterial pulmonar sistólica; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cSi el aumento de la PAPS es la única indicación para la cirugía, la determinación debe confirmarse mediante una prueba invasiva.
dLos valores de corte se refieren a adultos de tamaño medio y puede ser necesario adaptarlos a los pacientes con un tamaño particularmente pequeño o grande.
En la insuficiencia mitral aguda se emplean nitratos y diuréticos para reducir las presiones de llenado. El nitroprusiato de sodio reduce la poscarga y la fracción regurgitante. Los inotrópicos y el balón de contrapulsación intraaórtico son útiles en caso de hipotensión e inestabilidad hemodinámica.
En la insuficiencia mitral primaria crónica con FEVI conservada, no hay datos que respalden el uso profiláctico de vasodilatadores. Para pacientes con insuficiencia cardiaca franca aplican las recomendaciones actuales sobre el tratamiento de la insuficiencia cardiaca247.
6.1.4Pruebas seriadasLos pacientes asintomáticos con insuficiencia mitral grave y FEVI>60% deben tener un seguimiento clínico y ecocardiográfico cada 6 meses, preferiblemente en un centro especializado en valvulopatías309. La medición de las concentraciones de BNP, la ecocardiografía de esfuerzo, la monitorización electrocardiográfica con Holter y la RMC son complementarias para el diagnóstico y la estratificación del riesgo268. La asociación entre la insuficiencia mitral primaria, la muerte súbita cardiaca y las arritmias ventriculares sigue siendo controvertida310–312. La presencia de disyunción del anillo mitral (desplazamiento auricular anormal del punto de articulación separándose del miocardio ventricular) se ha asociado también con un aumento del riesgo de arritmias ventriculares310,311,313. Curiosamente, la mayoría de estos pacientes no presentaban insuficiencia mitral grave. Para los pacientes asintomáticos con insuficiencia mitral primaria grave y crecimiento progresivo del VI (DTSVI cerca de 40mm) o disminución de la FEVI determinada en pruebas seriadas, debe valorarse la reparación quirúrgica de la válvula mitral. Los pacientes asintomáticos con insuficiencia mitral moderada y función del VI conservada deben tener un seguimiento clínico anual y seguimiento ecocardiográfico cada 1 o 2 años. Tras la intervención, el seguimiento con pruebas seriadas debe centrarse en el estado funcional, la presencia de arritmias, la evaluación de la función valvular314 y la recurrencia de la insuficiencia mitral. En cuanto a la reparación quirúrgica de la válvula mitral, los centros con alto volumen de casos han obtenido buenos resultados de durabilidad, con una tasa de recurrencia de la insuficiencia mitral moderada o grave del 12,5% a los 20 años de seguimiento296. Las tasas de insuficiencia mitral moderada o grave residual (23-30%) después de la reparación percutánea de la válvula mitral indican que es recomendable el seguimiento ecocardiográfico anual14,300,301.
6.1.5Grupos especiales de pacientesSe han publicado las diferencias entre sexos en las prevalencias de las etiologías subyacentes de la insuficiencia mitral primaria y su tratamiento298,315,316. A pesar de la reducción de la prevalencia de la enfermedad reumática en países occidentales, las mujeres siguen presentando tasas más altas de insuficiencia mitral reumática que los varones y nuevas etiologías, como la cardiopatía inducida por radiación, son también más frecuentes en mujeres297. Estas etiologías se suelen caracterizar por la calcificación grave del aparato valvular y se asocia con estenosis mitral que impide una reparación duradera. Las mujeres con insuficiencia mitral primaria referidas a tratamiento quirúrgico tienen una tasa de reparación mitral similar a la de los varones316. Sin embargo, las mujeres a menudo presentan insuficiencia cardiaca posoperatoria, probablemente por una derivación más tardía y una enfermedad más avanzada que en los varones.
6.2Insuficiencia mitral secundariaEn la insuficiencia mitral secundaria, las valvas y las cuerdas tendinosas son estructuralmente normales y la insuficiencia mitral se produce por un desequilibrio entre las fuerzas de cierre y de anclaje que resulta de alteraciones en la geometría del VI y la AI317,318. Se observa más en la miocardiopatía dilatada o en la cardiopatía isquémica, tanto en los casos de VI muy dilatado con marcado deterioro de la función del VI como en el infarto de miocardio del segmento inferobasal aislado que conduce al anclaje de las valvas, a pesar de que el tamaño del VI y la FEVI sean casi normales. La insuficiencia mitral secundaria también puede estar causada por el crecimiento de la AI y la dilatación del anillo mitral en pacientes con FA de larga duración, cuya FEVI suele ser normal y la dilatación del VI, menos pronunciada (llamada también «insuficiencia mitral auricular funcional»)319.
6.2.1EvaluaciónLos criterios ecocardiográficos para definir la insuficiencia mitral secundaria no son diferentes de los empleados en la insuficiencia mitral primaria y deben aplicarse con un enfoque integral (tabla 7)24,268. No obstante, hay que recordar que, cuando se cuantifique el AORE y el volumen regurgitante en la insuficiencia mitral secundaria, deben aplicarse umbrales más bajos para definir la insuficiencia mitral secundaria grave. En pacientes con insuficiencia cardiaca, el volumen latido total del VI es menor y esto puede llevar a un menor volumen regurgitante estimado (< 60ml/latido). En estas circunstancias, el cálculo de la fracción regurgitante podría ser más representativo y tiene demostradas implicaciones pronósticas320. Además, la forma de medialuna del orificio regurgitante característico de la insuficiencia mitral secundaria puede llevar a subestimar la anchura de la vena contracta y el AORE. Un AORE ≥ 30 mm2 determinado por el área de isoconvergencia proximal (PISA) bidimensional probablemente corresponda a insuficiencia mitral secundaria grave, mientras que sigue siendo controvertido si un AORE ≥ 20 mm2 define la insuficiencia mitral secundaria grave. En pacientes con insuficiencia cardiaca, la insuficiencia mitral, aunque sea leve, se asocia con un mal pronóstico321 y, según la evidencia, el tratamiento quirúrgico o percutáneo de la insuficiencia mitral secundaria moderada no parece que mejore los resultados de los pacientes322,323, lo cual sustenta el cambio en la definición de la insuficiencia mitral secundaria grave. Por lo tanto, es necesario tener cuidado cuando se clasifique la insuficiencia mitral secundaria como grave con base solamente en las implicaciones pronósticas. Otros factores, como la extensión de la fibrosis miocárdica determinada por RMC, se han asociado con un mal pronóstico324. Además, en pacientes con insuficiencia mitral secundaria grave, se ha demostrado que la FEVI puede llevar a errores, mientras que el strain longitudinal global del VI tiene un valor pronóstico adicional325,326. La ecocardiografía tridimensional, la RMC y la ecocardiografía de estrés pueden ayudar a identificar a los pacientes con insuficiencia mitral secundaria grave cuando la ecocardiografía bidimensional en reposo no sea concluyente24,268.
6.2.2Tratamiento médicoEl tratamiento médico óptimo acorde con la guía sobre insuficiencia cardiaca247 es el primer paso del tratamiento de los pacientes con insuficiencia mitral secundaria y debe incluir la sustitución de IECA o ARA−II por sacubitrilo-valsartán, inhibidores del cotransportador de sodio-glucosa tipo 2 o ivabradina siempre que esté indicado247,327. Las indicaciones para la TRC deben evaluarse según las guías específicas247. Si persisten los síntomas tras la optimización del tratamiento convencional para la insuficiencia cardiaca, deben evaluarse las opciones de intervención de válvula mitral antes de que se produzcan un mayor deterioro de la función sistólica del VI o remodelado cardiaco.
6.2.3Indicaciones para la intervenciónLa insuficiencia mitral secundaria crónica tiene un mal pronóstico321,328 y su tratamiento intervencionista es complejo (véanse las recomendaciones sobre las indicaciones para la intervención de válvula mitral en la insuficiencia mitral secundaria crónica y grave y la figura 6). El análisis detallado de la evidencia disponible realizado por el grupo de metodología del Grupo de Trabajo se puede consultar en la sección 5 del material adicional. En este contexto, es muy importante que el equipo cardiológico tome las decisiones sobre el tratamiento. El equipo cardiológico, que incluya un especialista en insuficiencia cardiaca, debe optimizar el tratamiento médico basado en las guías de práctica clínica y valorar las indicaciones para las intervenciones electrofisiológicas, percutáneas y quirúrgicas, su prioridad y el orden de implementación.
Tratamiento de los pacientes con insuficiencia mitral secundaria, crónica y grave. CABG: cirugía de revascularización coronaria; DAVI: dispositivo de asistencia ventricular izquierda; EC: enfermedad coronaria; ESC: Sociedad Europea de Cardiología; FEVI: fracción de eyección del ventrículo izquierdo; GPC: guías de práctica clínica; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; IMS: insuficiencia mitral secundaria; RPBB: reparación percutánea «borde con borde»; TAVI: implante percutáneo de válvula aórtica; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho; VI: ventrículo izquierdo; VM: válvula mitral.
aFEVI, riesgo quirúrgico estimado, grado de viabilidad miocárdica, anatomía coronaria/vasos diana, tipo de procedimiento concomitante necesario, candidato a RPBB, probabilidad de reparación quirúrgica duradera, necesidad de reemplazo quirúrgico de válvula mitral y experiencia del centro.
bParticularmente cuando es necesaria la cirugía concomitante de válvula tricúspide.
cCriterios COAPT (Cardiovascular Outcomes Assessment of the MitraClip Percutaneous Therapy for Heart Failure Patients With Functional Mitral Regurgitation): véase la tabla 7 del material adicional.
Los datos a favor de la intervención quirúrgica siguen siendo insuficientes. La cirugía de válvula mitral está recomendada para los pacientes con insuficiencia mitral secundaria grave sometidos a CABG u otra cirugía cardiaca329,330. La estrategia quirúrgica debe adaptarse a las características de los pacientes individuales247,331. Para pacientes seleccionados sin remodelado avanzado del VI, la reparación mitral con un anillo completo rígido de tamaño inferior a la válvula restaura la competencia valvular, mejora los síntomas y resulta en el remodelado inverso del VI331. Se puede considerar otras técnicas valvulares o subvalvulares o el reemplazo valvular con conservación de cuerdas tendinosas para pacientes en los que se prevé el fracaso de la reparación con base en predictores ecocardiográficos332. Aunque el reemplazo valvular evita la recurrencia de la insuficiencia mitral, esto no se traduce en mejoras del remodelado inverso del VI o la supervivencia333. Las indicaciones para la cirugía aislada de válvula mitral en la insuficiencia mitral secundaria son particularmente restrictivas debido al riesgo significativamente alto del procedimiento, las altas tasas de recurrencia de la insuficiencia mitral y la ausencia de un beneficio probado en supervencia333–335. En pacientes con insuficiencia mitral auricular funcional, la FEVI suele ser normal, la dilatación del VI es menos pronunciada y la dilatación del anillo mitral es el mecanismo subyacente principal. Para este subgrupo, el tratamiento con anuloplastia, a menudo junto con la ablación de la FA, puede ser más efectivo, aunque la evidencia sigue siendo escasa319.
La reparación percutánea «borde con borde» con el sistema MitraClip es una opción de tratamiento mínimamente invasivo para la insuficiencia mitral secundaria. Dos estudios aleatorizados (COAPT y MITRA-FR)323,336,337 evaluaron su seguridad y su eficacia en pacientes con insuficiencia cardiaca sintomática e insuficiencia mitral secundaria grave persistente pese al tratamiento médico a los que el equipo cardiológico consideró inelegibles o no candidatos a cirugía (tabla 7 del material adicional). Los resultados indican que el procedimiento es seguro y efectivo para la reducción de la insuficiencia mitral secundaria en el seguimiento a los 3 años338. Sin embargo, en el estudio MITRA-FR323,336, el implante del dispositivo MitraClip no tuvo un impacto en la variable principal compuesta de mortalidad por cualquier causa u hospitalización por insuficiencia cardiaca a los 12 meses y a los 2 años, comparado con el tratamiento médico basado en las guías de práctica clínica. En el estudio COAPT337, el implante de MitraClip redujo sustancialmente la variable principal de hospitalizaciones por insuficiencia cardiaca y otras variables secundarias preespecificadas, incluida la mortalidad por cualquier causa a los 2 años.
Los subanálisis del estudio COAPT confirman la respuesta positiva a la reparación percutánea «borde con borde» de varios subgrupos de pacientes339–343, mientras que el efecto del tratamiento intervencionista fue neutro en todos los subgrupos del subanálisis ecocardiográfico del estudio MITRA-FR344.
Los resultados divergentes de estos 2 estudios han generado un gran debate. Las divergencias podrían explicarse en parte por el efecto del tamaño de los estudios, las diferencias de diseño, la selección de pacientes, la evaluación ecocardiográfica de la gravedad de la insuficiencia mitral secundaria, el uso de tratamiento médico y factores técnicos. Los pacientes del estudio COAPT tenían insuficiencia mitral secundaria de mayor gravedad (AORE, 41±15 frente a 31±10 mm2) y menos dilatación del VI (volumen telediastólico del VI medio indexado, 101±34 frente a 135±35ml/m2), que los incluidos en el estudio MITRA-FR. Quizá como reflejo de la mayor gravedad de la insuficiencia mitral secundaria en relación con las dimensiones del VI (insuficiencia mitral «desproporcionada»), la reparación percutánea «borde con borde» fue más beneficiosa para los pacientes del estudio COAPT en reducción de la mortalidad y las hospitalizaciones por insuficiencia cardiaca345.
Son necesarios más estudios para identificar a los pacientes que obtendrían mayor beneficio de la reparación percutánea «borde con borde».
Por lo tanto, debe considerarse la reparación percutánea «borde con borde» para pacientes con insuficiencia mitral secundaria seleccionados que cumplan los criterios de inclusión del estudio COAPT346–348, reciban tratamiento médico óptimo supervisado por un especialista en insuficiencia cardiaca y tengan características lo más similares posible a los pacientes incluidos en el estudio. Debe intentarse siempre la optimización de los resultados del procedimiento. Además, la reparación percutánea «borde con borde» podría considerarse para pacientes seleccionados que no cumplen los criterios del estudio COAPT a fin de mejorar los síntomas y la calidad de vida349–353. Para pacientes con insuficiencia mitral secundaria menos grave (AORE < 30 mm2) y dilatación o disfunción avanzada del VI, no se ha probado el beneficio pronóstico del implante de MitraClip323,354,355. Los pacientes con insuficiencia ventricular izquierda o derecha muy avanzada que no tienen opción de revascularización podrían beneficiarse más del trasplante cardiaco o el implante de un dispositivo de asistencia ventricular. Por lo general, no se considera que la intervención valvular sea una opción cuando la FEVI es < 15%247.
El tratamiento de la insuficiencia mitral secundaria isquémica moderada para los pacientes sometidos a CABG sigue siendo objeto de debate322,330. Es más probable considerar la cirugía en caso de viabilidad miocárdica y comorbilidad baja. La presencia de disnea inducida por el ejercicio y un aumento significativo de la insuficiencia mitral y la PAPS favorecen la indicación de cirugía combinada.
Aparte de la reparación percutánea «borde con borde», hay otros dispositivos de reparación o reemplazo de válvula mitral en estudio, pero los datos clínicos todavía son escasos.
Recomendaciones sobre las indicaciones para la intervención de válvula mitral en la insuficiencia mitral secundaria, crónica y gravea.
| Recomendaciones | Claseb | Nivelc |
|---|---|---|
| La cirugía o la intervención valvular percutánea está indicada solo para pacientes con insuficiencia mitral secundaria grave que siguen sintomáticos pese al tratamiento médico óptimo basado en las GPC (incluida la TRC si está indicada); y un equipo cardiológico estructurado y colaborativo debe tomar la decisión sobre el tratamiento247,323,336,337 | I | B |
| Pacientes con enfermedad coronaria u otra cardiopatía concomitante que requiere tratamiento | ||
| La cirugía valvular está indicada para pacientes sometidos a CABG u otra cirugía cardiaca329,330,333 | I | B |
| Para pacientes sintomáticos que no son candidatos a cirugía según el criterio del equipo cardiológico basado en características individualesd, debe considerarse la ICP (y el TAVI), posiblemente seguida de reparación percutánea «borde con borde» (en caso de que persista la insuficiencia mitral secundaria grave) | IIa | C |
| Pacientes sin enfermedad coronaria u otra cardiopatía concomitante que requiera tratamiento | ||
| Debe considerarse la reparación percutánea «borde con borde» para los pacientes sintomáticos seleccionados que no son candidatos a cirugía y cumplen los criterios que indican mayor probabilidad de respuesta positiva al tratamiento337,338,356,357,e | IIa | B |
| Puede considerarse la cirugía valvular para pacientes sintomáticos valorados aptos para cirugía por el equipo cardiológico | IIb | C |
| Para los pacientes sintomáticos con riesgo alto que no son candidatos a cirugía y no cumplen los criterios que indican una probabilidad alta de respuesta a la reparación percutánea «borde con borde», el equipo cardiológico puede considerar este procedimiento u otra intervención percutánea, si es aplicable, tras evaluar minuciosamente la posible necesidad de trasplante cardiaco o implante de un dispositivo de asistencia ventriculare | IIb | C |
2D: bidimensional; AORE: área del orificio regurgitante efectivo; CABG: cirugía de revascularización coronaria; FEVI: fracción de eyección del ventrículo izquierdo; GPC: guías de práctica clínica; ICP: intervención coronaria percutánea; TAVI: implante percutáneo de válvula aórtica; TRC: terapia de resincronización cardiaca.
aVéase la tabla 7 para la cuantificación de la insuficiencia mitral secundaria (un AORE ≥ 30 mm2 determinado por el área isoconvergencia proximal 2D probablemente se corresponda con insuficiencia mitral secundaria grave). La cuantificación de la gravedad se debe hacer siempre con el paciente en tratamiento óptimo basado en las GPC.
bClase de recomendación.
cNivel de evidencia.
dFEVI, viabilidad miocárdica, anatomía coronaria y vasos diana ¿, tipo de procedimiento concomitante necesario, elegibilidad para reparación «borde con borde», probabilidad de reparación percutánea duradera, necesidad de reemplazo quirúrgico de válvula aórtica, experiencia del centro.
eCriterios del estudio COAPT (Cardiovascular Outcomes Assessment of the MitraClip Percutaneous Therapy for Heart Failure Patients With Functional Mitral Regurgitation); véase la tabla 7 del material adicional.
En la mayoría de los casos, la etiología de la estenosis mitral es reumática o degenerativa. La fiebre reumática es la causa más frecuente de estenosis mitral en todo el mundo. Su prevalencia ha disminuido notablemente en países industrializados, pero sigue siendo un importante problema de salud en países en desarrollo y afecta a pacientes jóvenes2,267,358. La estenosis mitral degenerativa relacionada con la calcificación anular es una afección diferente y su prevalencia aumenta significativamente con la edad359,360. Ambos tipos de estenosis mitral son más frecuentes en mujeres361. En casos raros, la estenosis mitral causada por rigidez valvular sin fusión de las comisuras puede estar relacionada con la radiación torácica, el síndrome carcinoide o enfermedades metabólicas hereditarias.
7.1Estenosis mitral reumática7.1.1EvaluaciónLa estenosis mitral clínicamente significativa se define como un área valvular mitral (AVM) ≤ 1,5 cm2. La fusión de las comisuras con engrosamiento del velo posterior es el mecanismo más importante de la estenosis. La ecocardiografía es el método preferido para el diagnóstico, la evaluación de la gravedad y las consecuencias hemodinámicas de la estenosis mitral. El área valvular calculada mediante planimetría bidimensional es la medida de referencia de la gravedad de la estenosis mitral, mientras que el gradiente transvalvular y las presiones pulmonares reflejan sus consecuencias y tienen un valor pronóstico362. La ETT tridimensional puede tener un valor diagnóstico adicional. El ETT suele proporcionar suficiente información para el tratamiento habitual. Se han desarrollado distintos sistemas de puntuación para ayudar a evaluar la viabilidad de la comisurotomía mitral percutánea (CMP) (véase la tabla 8 del material adicional)363–365. Se debe hacer un estudio con ETE para descartar trombos en la AI antes de la CMP o después de un episodio embólico y para obtener información detallada de la anatomía valvular (comisuras y aparato subvalvular) antes de la intervención cuando la ETT no sea óptima. La prueba de estrés está indicada para pacientes sin síntomas o con síntomas equívocos o discordantes con la gravedad de la estenosis mitral. La ecocardiografía de esfuerzo puede proporcionar información objetiva cuando se evalúen los cambios en el gradiente transmitral y la presión arterial pulmonar y es superior a la ecocardiografía de estrés con dobutamina. Además, la ecocardiografía tiene un papel importante en la monitorización periprocedimiento de la CMP y el seguimiento.
Contraindicaciones para la comisurotomía mitral percutánea en la estenosis mitral reumática.
| Contraindicaciones |
|---|
| Área valvular mitrala>1,5 cm2 |
| Trombo en aurícula izquierda |
| Insuficiencia mitral mayor que leve |
| Calcificación grave o bicomisural |
| Ausencia de fusión comisural |
| Valvulopatía aórtica grave concomitante o estenosis e insuficiencia tricuspídea graves combinadas que requieren cirugía |
| Enfermedad coronaria concomitante que requiere cirugía |
Puede considerarse la comisurotomía mitral percutánea para pacientes con un área valvular>1,5 cm2 y síntomas que no pueden explicarse por otra causa, siempre que la anatomía sea favorable.
El tipo de tratamiento (CMP o cirugía), así como el momento más adecuado para llevarlo a cabo, debe decidirse basándose en las características clínicas, la anatomía de la válvula y el aparato subvalvular y la experiencia del centro366–369. En general, la indicación de intervención debe limitarse a los pacientes con estenosis mitral reumática clínicamente significativa (de moderada a grave; área valvular ≤ 1,5 cm2), para los que el tratamiento con CMP ha tenido un impacto muy importante. En países desarrollados, donde la incidencia de la fiebre reumática y el número de CMP son bajos, el tratamiento lo deben hacer operadores experimentados en centros especializados para mejorar la seguridad y las tasas de éxito de los procedimientos366. Se debe hacer un esfuerzo para aumentar la disponibilidad de la CMP en países en desarrollo, donde el acceso a este tratamiento está limitado por motivos económicos267. Debe considerarse la CMP como tratamiento inicial para pacientes seleccionados con calcificación o afectación del aparato subvalvular leve o moderada pero que, por lo demás, tengan características clínicas favorables360.
El tratamiento de la estenosis mitral reumática clínicamente significativa se resume en la figura 7; las indicaciones y contraindicaciones para la CMP se encuentran a continuación en la tabla de recomendaciones y la tabla 8.
Tratamiento de la estenosis mitral reumática clínicamente relevante (AVM ≤ 1,5 cm2). AI: aurícula izquierda; AVM: área valvular mitral; CMP: comisurotomía mitral percutánea; CNC: cirugía no cardiaca; FA: fibrilación auricular.
aRiesgo tromboembólico alto: antecedente de embolia sistémica, contraste espontáneo denso en la AI, FA de nueva aparición. Riesgo alto de descompensación hemodinámica: presión pulmonar sistólica>50mmHg en reposo, necesidad de CNC mayor, deseo de gestar.
bPara los pacientes con contraindicaciones para la CMP, puede considerarse la comisurotomía quirúrgica si la realiza un equipo quirúrgico con experiencia.
cVéanse las recomendaciones sobre las indicaciones de CMP y cirugía valvular mitral en la estenosis mitral clínicamente significativa en la sección 7.2.
dCirugía si los síntomas se presentan con un nivel bajo de ejercicio y el riesgo operatorio es bajo.
Recomendaciones sobre las indicaciones para la comisurotomía mitral percutánea y la cirugía de válvula mitral en la estenosis mitral clínicamente relevante (moderada o grave; área valvular ≤ 1,5 cm2).
| Recomendaciones | Clasea | Nivelb |
| La CMP está indicada para pacientes sintomáticos sin características desfavorablesc para este procedimiento360,363–365,367 | I | B |
| La CMP está recomendada para todo paciente sintomático con contraindicaciones o alto riesgo quirúrgico | I | C |
| La cirugía de válvula mitral está indicada para pacientes sintomáticos que no son candidatos a CMP, siempre que no se considere un procedimiento fútil. | I | C |
| Debe considerarse la CMP como tratamiento inicial para pacientes sintomáticos con anatomía subóptima pero sin características clínicas desfavorables para este procedimientoc | IIa | C |
| Debe considerarse la CMP para pacientes asintomáticos sin características clínicas y anatómicas desfavorables para este procedimientoc y:• Riesgo tromboembólico alto (antecedente de embolia sistémica, contraste denso espontáneo en la AI, FA de nueva aparición o paroxística, o• Riesgo alto de descompensación hemodinámica (presión pulmonar sistólica en reposo > 50mmHg, necesidad de cirugía no cardiaca mayor, deseo de gestación) | IIa | C |
AI: aurícula izquierda; AVM: área valvular mitral; CMP: comisurotomía mitral percutánea; FA: fibrilación auricular; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
cLas características desfavorables para CMP se pueden definir como la presencia de varias de las siguientes características. Características clínicas: edad avanzada, comisurotomía previa, NYHA IV, FA permanente e hipertensión pulmonar grave. Características anatómicas: puntuación ecocardiográfica > 8, puntuación de Cormier 3 (cualquier grado de calcificación de la válvula mitral determinada por fluoroscopia), AVM muy pequeña e insuficiencia tricuspídea grave. Para la definición de estas escalas, véase la tabla 8 del material adicional.
El tratamiento con diuréticos, bloqueadores beta, digoxina, bloqueadores de los canales del calcio no dihidropiridínicos e ivabradina puede mejorar los síntomas. La anticoagulación con un antagonista de la vitamina K (AVK) con un INR entre 2 y 3 está indicada para los pacientes con FA. Los pacientes con estenosis mitral moderada o grave y FA deben recibir anticoagulación con un AVK, en lugar de NACO, ya que actualmente no hay evidencia firme que respalde la prescripción de NACO en este contexto370 y se esperan resultados de un ensayo controlado aleatorizado (INVICTUS VKA, NCT 02832544). La cardioversión y el aislamiento de venas pulmonares no están indicados antes de la intervención en pacientes con estenosis mitral significativa, ya que no restauran el ritmo sinusal de modo duradero. Si la FA ha comenzado recientemente y la dilatación de la AI es solo moderada, la cardioversión se debe llevar a cabo pronto tras una intervención eficaz; debe considerarse también para pacientes con estenosis mitral no grave. El tratamiento con amiodarona es muy efectivo para mantener el ritmo sinusal tras la cardioversión. Para los pacientes en ritmo sinusal, la anticoagulación oral está indicada si hay antecedentes de embolia sistémica o cuando se localicen trombos en la AI y también debe considerarse cuando la ETE muestre denso ecocontraste espontaneo o dilatación de la AI (diámetro en modo M > 50mm o volumen de la AI > 60ml/m2).
7.1.4Pruebas seriadasLos pacientes asintomáticos con estenosis mitral clínicamente significativa deben tener un seguimiento clínico y ecocardiográfico anual y a intervalos más largos (2 o 3 años) cuando la estenosis sea moderada. El seguimiento de los pacientes tras una CMP eficaz es similar al de los pacientes asintomáticos y debe ser más frecuente si se produce reestenosis asintomática.
7.1.5Grupos especiales de pacientesCuando se produce reestenosis sintomática después de la comisurotomía quirúrgica o percutánea, la reintervención en la mayoría de los casos requiere reemplazo valvular, aunque la CMP se puede considerar para pacientes seleccionados con características favorables si el mecanismo predominante de la reestenosis es la fusión comisural369.Para los pacientes con estenosis mitral reumática grave combinada con valvulopatía aórtica grave, la cirugía es preferible siempre que no esté contraindicada. El tratamiento de los pacientes con contraindicaciones para la cirugía es difícil y requiere la evaluación integral e individualizada del equipo cardiológico. En los casos de estenosis mitral grave asociada con valvulopatía aórtica moderada, se puede hacer la CMP para posponer el tratamiento quirúrgico de ambas válvulas. Para pacientes con insuficiencia tricuspídea grave, se puede considerar la CMP para pacientes seleccionados en ritmo sinusal, con dilatación auricular moderada e insuficiencia tricuspídea grave secundaria a hipertensión pulmonar. En otros casos es preferible la cirugía de las 2 válvulas371.
Para los pacientes ancianos con estenosis mitral reumática y riesgo quirúrgico alto, la CMP es una opción útil, aunque solo sea paliativa364,367,368. El tratamiento de los pacientes con estenosis mitral grave de gradiente bajo (AVM ≤ 1,5 cm2, gradiente medio < 10mmHg) es complejo, ya que estos pacientes suelen tener una edad más avanzada y una anatomía menos adecuada372.
7.2Estenosis mitral degenerativa con calcificación anularLa calcificación del anillo mitral es una entidad diferenciada que se distingue de la estenosis mitral reumática. Por lo general, estos pacientes son ancianos y pueden presentar comorbilidades importantes, incluso otras valvulopatías. El pronóstico suele ser desfavorable debido al perfil de riesgo alto y las dificultades técnicas por la calcificación anular373. Entre el 9 y el 15% de la población general puede tener calcificación del anillo mitral, con mayor frecuencia ancianos (40%)67,374–376. Además, casi la mitad de los pacientes con estenosis aórtica tratados con TAVI tienen calcificación del anillo mitral y la enfermedad es grave en el 9,5% de los casos359,377. La calcificación del anillo mitral puede producir estenosis mitral (más frecuente), insuficiencia mitral o ambas.
7.2.1EvaluaciónEn pacientes con estenosis mitral degenerativa y calcificación anular, la evaluación ecocardiográfica de la gravedad es compleja y los parámetros empleados habitualmente no están validados. La planimetría es menos fiable debido a la presencia de calcio difuso y la irregularidad del orificio. El gradiente transmitral medio tiene demostrado valor pronóstico378. Para la evaluación de la gravedad antes de indicar una intervención, es necesario tener en cuenta las anomalías de la AI y el grado de distensibilidad del VI. En caso de plantearse una intervención, la ecocardiografía sirve para la evaluación inicial y la TC para evaluar el grado y la localización de la calcificación, además de la viabilidad del procedimiento379.
7.2.2Indicaciones para la intervenciónLas estrategias de tratamiento, incluidas las intervenciones percutáneas y quirúrgicas, tienen un riesgo alto y no hay evidencia firme de estudios aleatorizados sobre sus resultados. Incluso en caso de que el procedimiento tenga éxito y se reduzca el gradiente transvalvular, la presión en la aurícula izquierda puede seguir siendo alto a causa de la baja distensibilidad de la AI y el VI.
En pacientes ancianos con estenosis mitral degenerativa y calcificación anular, la cirugía presenta dificultades técnicas y tiene un riesgo alto380. Dado que en estos casos no hay fusión comisural, la estenosis mitral degenerativa no se puede tratar mediante CMP359. Para los pacientes sintomáticos inoperables pero con anatomía adecuada, estudios preliminares muestran que el implante valvular percutáneo (mediante una prótesis de TAVI montada invertida sobre un balón expandible en posición mitral) es factible en pacientes con estenosis mitral grave seleccionados, siempre que lo lleve a cabo un operador experimentado tras una planificación cuidadosa mediante pruebas de imagen multimodal379. Hasta ahora, la serie más grande solo incluyó a 116 pacientes381. No obstante, la mortalidad intraoperatoria es alta, particularmente debido al riesgo de obstrucción del TSVI, y los resultados a medio plazo son menos favorables que en las intervenciones mitrales «válvula en válvula»382,383. Las series de casos más recientes muestran mejores resultados debido a una mejor selección de los pacientes y al uso de vías de acceso diferentes, además de medidas concomitantes o preventivas, como la ablación septal con alcohol384 o la laceración/resección de la valva anterior385–387.
Recientemente, una serie de casos preliminar ha indicado que el reemplazo percutáneo de la válvula mitral con una prótesis específicamente diseñada para este fin es factible y puede mejorar los síntomas388.
8INSUFICIENCIA TRICUSPÍDEALa insuficiencia tricuspídea moderada o grave está presente en el 0,55% de la población general, su prevalencia aumenta con la edad y afecta a alrededor del 4% de los pacientes de 75 años o más389. En más del 90% de los casos, la etiología es secundaria a la dilatación del VD por sobrecarga de presión o volumen o la dilatación de la aurícula derecha y el anillo tricuspídeo debido a FA crónica. La insuficiencia tricuspídea secundaria se asocia en la mayoría de los casos con valvulopatía izquierda o disfunción miocárdica, mientras que es aislada en el 8,1% de los pacientes y tiene relación independiente con la mortalidad389. La insuficiencia tricuspídea secundaria puede aparecer también tardíamente después de la cirugía valvular izquierda390,391.
Entre las causas de la insuficiencia tricuspídea primaria, están la endocarditis infecciosa (especialmente en adictos a drogas por vía parenteral), la cardiopatía reumática, el síndrome carcinoide, la enfermedad mixomatosa, la fibrosis endomiocárdica, la displasia valvular congénita (p. ej., la anomalía de Ebstein), el traumatismo torácico y el daño valvular iatrogénico.
La FA induce el remodelado anular incluso en ausencia de enfermedad del corazón izquierdo392. Los electrodos de los dispositivos cardiacos producen insuficiencia tricuspídea progresiva en un 20-30% de los pacientes393–395 y predice su progresión con el tiempo396.
En pacientes con insuficiencia cardiaca y FEVI reducida, la insuficiencia tricuspídea secundaria es un hallazgo frecuente y un predictor independiente de los resultados clínicos397.
8.1EvaluaciónLa insuficiencia triscuspídea debe evaluarse en primer lugar mediante ecocardiografía. En la insuficiencia triscuspídea primaria, pueden identificarse anomalías específicas de la válvula. En la insuficiencia triscuspídea secundaria se debe medir la dilatación anular, las dimensiones del VD y la aurícula derecha, además de la función del VD, debido a su relevancia pronóstica398. En servicios con experiencia se puede considerar la determinación del strain del VD27 o la medición tridimensional de los volúmenes del VD399,400 para superar las limitaciones de los índices convencionales empleados para determinar la función del VD102. Cuando esté disponible, la RMC es la técnica preferida para evaluar el VD400 debido a su gran precisión y su reproducibilidad401.
La evaluación ecocardiográfica de la gravedad de la insuficiencia cardiaca se basa en la integración de múltiples parámetros cualitativos y cuantitativos (tabla 9). Debido a que el orificio regurgitante tiene una morfología no circular y tridimensional, debe evaluarse el ancho de la vena contracta en biplano, además de las mediciones bidimensionales convencionales402. Igualmente, mediante el método PISA se puede subestimar la gravedad de la insuficiencia tricuspídea403. En caso de hallazgos contradictorios, se puede evaluar el área tridimensional de la vena contracta, aunque se han propuesto distintos valores de corte402,404–406. Recientemente se ha propuesto un nuevo sistema de gradación que incluye 2 grados nuevos («masivo» y «torrencial»)407 que se han empleado en estudios clínicos sobre intervenciones percutáneas408,409. Sus resultados muestran un valor pronóstico adicional de estos nuevos grados en cuanto a la mortalidad y las rehospitalizaciones por insuficiencia cardiaca en pacientes con enfermedad avanzada410–412.
Criterios ecocardiográficos para establecer la gravedad de la insuficiencia triscuspídea.
| Cualitativos | |
|---|---|
| Morfología tricuspídea | Anormal/velo valvular suelto o evertido |
| Flujo del chorro regurgitante (Doppler color) | Chorro central muy grande o chorro excéntrico que incide en la pareda |
| Señal Doppler de onda continua del chorro regurgitante | Densa/triangular con pico prematuro |
| Semicuantitativos | |
| Anchura de vena contracta | > 7mma,b |
| Radio de PISA | > 9mmc |
| Flujo en venas hepáticasc | Flujo sistólico invertido |
| Flujo de entrada | Onda E dominante ≥ 1m/sd |
| Cuantitativos | |
| AORE | ≥ 40 mm2 |
| Volumen regurgitante | ≥ 45ml/latido |
| Dilatación de cámaras o vasos cardiacos | VD, aurícula derecha, vena cava inferior |
AORE: área del orificio regurgitante efectivo; PISA: área de isocovergencia proximal; VD: ventrículo derecho.
Alternativamente, calcular el volumen regurgitante tricuspídeo mediante RMC puede ser útil.
Por último, la estimación de las presiones pulmonares mediante el gradiente Doppler puede no ser posible o subestimar la gravedad de la hipertensión pulmonar en presencia de insuficiencia tricuspídea grave, lo cual justifica el cateterismo cardiaco para evaluar las resistencias vasculares pulmonares413.
8.2Indicaciones para la intervenciónLa insuficiencia tricuspídea grave se asocia con supervivencia más corta389,414–416 y empeoramiento de la insuficiencia cardiaca397,417. En la práctica clínica, las intervenciones de válvula tricuspídea están infrautilizadas y frecuentemente se hacen demasiado tarde418–420. La intervención en el momento adecuado es crucial para evitar un daño irreversible del VD y el fracaso orgánico, con el consecuente aumento del riesgo quirúrgico421,422 (véase la tabla de recomendaciones sobre las indicaciones de intervención en la valvulopatía tricuspídea en la sección 9 y la figura 8).
Tratamiento de la insuficiencia tricuspídea. AT: anillo tricuspídeo; IT: insuficiencia tricuspídea; VD: ventrículo derecho; VI: ventrículo izquierdo; VT: válvula tricúspide.
aUn equipo cardiológico con experiencia en el tratamiento de la válvula tricúspide evalúa la viabilidad anatómica para el tratamiento percutáneo incluyendo localización del chorro, defecto de coaptación, velo valvular suelto y posible interferencia con electrodos de marcapasos.
bReemplazo cuando no sea posible la reparación.
La cirugía está indicada para pacientes sintomáticos con insuficiencia tricuspídea primaria grave. Para pacientes seleccionados asintomáticos o con síntomas leves que son candidatos a cirugía, debe considerarse la intervención si se observa dilatación o deterioro de la función del VD, aunque hasta ahora no se han definido umbrales precisos.
Según datos de estudios observacionales, en pacientes con insuficiencia tricuspídea secundaria la reparación de esta debe plantearse sin restricciones durante la cirugía de valvulopatías izquierdas, ya que no aumenta el riesgo quirúrgico, favorece el remodelado inverso del VD y mejora el estado funcional si hay dilatación anular, incluso en ausencia de insuficiencia tricuspídea grave423–427.
El beneficio de la corrección quirúrgica de la insuficiencia triscupídea secundaria aislada, comparada con el tratamiento médico, no está claramente establecido428 y tiene un riesgo no despreciable de morbimortalidad periprocedimiento cuando se hace demasiado tarde429–432. Sin embargo, para pacientes seleccionados cuidadosamente, la cirugía puede ser segura y proporcionar una buena supervivencia a largo plazo418,433. Por lo tanto, la cirugía se debe considerar pronto para pacientes seleccionados sintomáticos candidatos a cirugía y también para asintomáticos o con síntomas leves que presenten dilatación del VD e insuficiencia tricuspídea grave. Aunque un desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE) < 17mm se ha asociado con un peor pronóstico en pacientes con insuficiencia tricuspídea secundaria398,434, no se han definido los umbrales de gravedad de la disfunción del VD que indicarían la futilidad de la intervención.
La reoperación de la válvula tricúspide en los casos de insuficiencia tricúspide secundaria de nueva aparición o persistente después de la cirugía de lado izquierdo implica un riesgo quirúrgico alto, posiblemente debido a una indicación tardía del tratamiento y, consecuentemente, a un peor estado clínico de los pacientes435. Para mejorar el pronóstico de estos pacientes debe considerarse el tratamiento de la insuficiencia tricuspídea grave incluso para pacientes asintomáticos si hay signos de dilatación o deterioro de la función del VD (tras excluir disfunción valvular izquierda disfunción grave del VD o el VI y enfermedad vascular pulmonar o hipertensión pulmonar graves).
Siempre que sea posible, la anuloplastia con prótesis anular es preferible al reemplazo valvular423,430,436, que solo debe considerarse cuando haya engrosamiento de las valvas y dilatación grave del anillo. En presencia de electrodos de dispositivos, la técnica quirúrgica debe adaptarse a la patología del paciente y la experiencia del cirujano437.
Las intervenciones percutáneas de la válvula tricúspide (IPVT) están en fase de desarrollo clínico. Los primeros datos de registros y estudios demuestran que es factible reducir la insuficiencia tricuspídea mediante distintos sistemas que permiten la aproximación de los velos408,438–440, la anuloplastia directa409,441 o el reemplazo valvular442–444 con la consiguiente mejoría sintomática y hemodinámica445,446. En un análisis ajustado por propensity score que comparó el tratamiento médico con el intervencionista, la mortalidad por cualquier causa y los reingresos al año fueron menos en el grupo de tratamiento intervencionista447. Varios estudios en curso investigan la eficacia del IPVT frente al tratamiento médico.
Por lo tanto, en centros especializados en valvulopatías, el equipo cardiológico puede considerar la IPVT para pacientes sintomáticos, inoperables y con una anatomía adecuada en los que cabe esperar una mejoría sintomática o pronóstica. Para la evaluación anatómica completa, la ETE y la TC son las técnicas preferidas debido a su mayor resolución espacial448,449.
8.3Tratamiento médicoLos diuréticos son útiles en presencia de insuficiencia cardiaca derecha. Para contrarrestar la activación del sistema renina-angiotensina-aldosterona asociada con la congestión hepática, puede considerarse la adición de un antagonista de la aldosterona247. El tratamiento de la hipertensión pulmonar está indicado en casos específicos. El control del ritmo puede ayudar a reducir la insuficiencia tricuspídea y contener la dilatación anular en pacientes con FA crónica, aunque los datos a este respecto son insuficientes450. En cualquier caso en ausencia de disfunción avanzada del VD o hipertensión pulmonar grave, ninguno de los tratamientos mencionados debe retrasar la derivación de los pacientes a tratamiento quirúrgico o percutáneo.
9ESTENOSIS TRICUSPÍDEALa estenosis tricuspídea suele aparecer combinada con insuficiencia tricuspídea y en la mayoría de los casos es de origen reumático. Por ello, se suele asociar con lesiones de válvulas izquierdas, particularmente con estenosis mitral. Es raro que se produzca por otras causas, como valvulopatías congénitas, síndrome carcinoide o valvulopatías inducidas por fármacos, enfermedad de Whipple, endocarditis o tumores grandes en la aurícula derecha.
9.1EvaluaciónLa ecocardiografía es la técnica que aporta la información más útil. La estenosis tricuspídea suele estar enmascarada y requiere una evaluación minuciosa. La evaluación ecocardiográfica de la anatomía valvular y del aparato subvalvular es importante para determinar la posibilidad de reparación de la válvula. Aunque no existe una clasificación aceptada universalmente para definir la gravedad de la estenosis tricuspídea, un gradiente transvalvular medio ≥ 5mmHg con una frecuencia cardiaca normal se considera indicativo de estenosis tricuspídea clínicamente significativa362.
9.2Indicaciones para la intervenciónLa intervención de la válvula tricúspide se suele hacer al mismo tiempo que la de válvulas izquierdas en pacientes que siguen sintomáticos a pesar del tratamiento médico. Aunque la ausencia de tejido flexible de las valvas es la limitación más importante para la reparación valvular, la elección entre la reparación y el reemplazo valvular depende de la anatomía y de la experiencia del cirujano. Dada su satisfactoria durabilidad a largo plazo, se suele preferir las prótesis biológicas antes que las prótesis mecánicas por su alto riesgo de trombosis451.
La valvuloplastia tricuspídea con balón solo se ha llevado a cabo en un pequeño número de casos, ya sea sola o combinada con CMP, aunque es frecuente que induzca insuficiencia significativa y no se dispone de datos sobre sus resultados a largo plazo452. Puede considerarse en algunos casos con anatomía valvular adecuada si la estenosis tricuspídea es aislada o si la estenosis mitral también va a ser tratada de forma percutánea. (véase en la sección 7 la tabla de recomendaciones sobre las indicaciones para la CMP y la cirugía de válvula mitral en la estenosis mitral clínicamente relevante).
9.3Tratamiento médicoEn presencia de síntomas de insuficiencia cardiaca, los diuréticos son útiles, pero tienen poca eficacia a largo plazo.
10VALVULOPATÍAS COMBINADAS Y MÚLTIPLESSe puede encontrar en la misma válvula estenosis e insuficiencia significativas. La valvulopatía múltiple puede presentarse en distintas enfermedades, sobre todo en las cardiopatías reumáticas y congénitas, pero también en la valvulopatía degenerativa, aunque con menos frecuencia. Debido a la falta de datos sobre las valvulopatías combinadas o múltiples453–460, no se puede establecer recomendaciones basadas en la evidencia. Los principios generales para el tratamiento de las valvulopatías combinadas o múltiples son los siguientes:
- •
Cuando la estenosis o la insuficiencia sean la enfermedad predominante, el tratamiento debe seguir las recomendaciones de la valvulopatía predominante. Cuando la gravedad de la estenosis y la insuficiencia estén equilibradas, las indicaciones para la intervención deben basarse en los síntomas y las consecuencias objetivas, en lugar de en los índices de gravedad de una u otra453–456. En este contexto, el gradiente de presión medido por Doppler refleja la carga hemodinámica global (estenosis e insuficiencia) de la lesión valvular453.
- •
Además de evaluar por separado cada lesión valvular, es necesario tener en cuenta la interacción entre distintas lesiones valvulares. Como ejemplo de ello, la insuficiencia mitral concomitante puede llevar a que se subestime la gravedad de la estenosis aórtica, ya que la disminución del volumen latido debida a la insuficiencia mitral disminuye el flujo a través de la válvula aórtica y, por lo tanto, reduce también el gradiente aórtico453. Esto subraya la necesidad de combinar distintas mediciones, que incluyan la evaluación de las áreas valvulares y, siempre que sea posible, con los métodos menos dependientes de las condiciones de carga, como la planimetría457.
Recomendaciones sobre las indicaciones para la intervención en la valvulopatía triscuspídea.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones en la estenosis tricuspídea | ||
| La cirugía está indicada para pacientes sintomáticos con estenosis tricuspídea gravec | I | C |
| La cirugía está indicada para pacientes con estenosis tricuspídea grave que van a someterse a una intervención de válvula izquierdad | I | C |
| Recomendaciones en la insuficiencia tricuspídea primaria | ||
| La cirugía está indicada para pacientes con insuficiencia tricuspídea primaria grave que van a someterse a una intervención de válvula izquierda | I | C |
| La cirugía está indicada para pacientes sintomáticos con insuficiencia tricuspídea primaria grave aislada sin disfunción grave del VD | I | C |
| Debe considerarse la cirugía para pacientes con insuficiencia tricuspídea primaria moderada que van a someterse a cirugía de válvula izquierda | IIa | C |
| Debe considerarse la cirugía para pacientes asintomáticos o con síntomas leves de insuficiencia tricuspídea primaria aislada y dilatación del VD que sean candidatos a cirugía | IIa | C |
| Recomendaciones en la insuficiencia tricuspídea secundaria | ||
| La cirugía está indicada para pacientes con insuficiencia tricuspídea secundaria grave que van a someterse a cirugía de válvula izquierda423–427 | I | B |
| Debe considerarse la cirugía para pacientes con insuficiencia tricuspídea secundaria de leve a moderada con anillo dilatado (≥ 40mm o > 21mm/m2 determinado por ecocardiografía bidimensional) que van a someterse a cirugía de válvula izquierda423,425–427 | IIa | B |
| Debe considerarse la cirugía para pacientes con insuficiencia tricuspídea secundaria grave (con o sin cirugía previa de válvula izquierda) que están sintomáticos o tienen dilatación del VD, en ausencia de disfunción avanzada del VD o VI y enfermedad vascular pulmonar o hipertensión pulmonar graves418,433e | IIa | B |
| Puede considerarse el tratamiento percutáneo para pacientes sintomáticos inoperables con insuficiencia tricuspídea secundaria grave si la intervención se hace en un centro de valvulopatías con experiencia en el tratamiento de la valvulopatía tricuspídeaf | IIb | C |
CMP: comisurotomía mitral percutánea; VD: ventrículo derecho; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cPuede intentarse una valvulopastia con balón como primer abordaje si la estenosis tricupídea es aislada.
dPuede intentarse una valvuloplastia con balón si se puede hacer una CMP en la válvula mitral.
eEn pacientes sometidos previamente a cirugía hay que descartar la presencia de disfunción valvular izquierda recurrente.
fEl tratamiento percutáneo se puede llevar a cabo en un centro especializado después de la evaluación del equipo cardiológico para pacientes con anatomía favorable en los que cabe esperar una mejoría de la calidad de vida y la supervivencia.
- •
Las indicaciones de la intervención se basan en la evaluación general de las consecuencias de las distintas lesiones valvulares (los síntomas o la presencia de dilatación disfunción del VI). Puede considerarse la intervención de lesiones múltiples que no son graves pero están asociadas con los síntomas o pueden llevar al deterioro del VI453.
- •
La decisión de intervenir varias válvulas debe tener en cuenta la edad, las comorbilidades y el riesgo de los procedimientos combinados y debe tomarla el equipo cardiológico después de la evaluación minuciosa y completa de las lesiones valvulares y su interacción453,461. Se debe sopesar el riesgo de la intervención combinada frente al de la evolución de la valvulopatía no tratada y el riesgo inherente de una intervención ulterior.
- •
En la elección de la técnica quirúrgica o intervencionista se debe valorar la presencia de otras valvulopatías453,458,459,461.
- •
Cuando se valore el tratamiento intervencionista, pueden ser preferibles los procedimientos secuenciales en los casos de estenosis aórtica e insuficiencia mitral (véase la sección 5.5). Se han comunicado tasas más altas de supervivencia al año tras el tratamiento percutáneo combinado de la insuficiencia mitral y tricuspídea, comparadas con la insuficiencia mitral sola263. La CMP puede retrasar la cirugía en las algunas situaciones, como en el caso de la estenosis mitral grave asociada con insuficiencia aórtica moderada.
El tratamiento de combinaciones específicas de valvulopatías se trata en los apartados correspondientes de este documento.
11VÁLVULAS PROTÉSICAS11.1Elección de la válvula protésicaLos factores que determinan la elección de la válvula son la esperanza de vida del paciente, el estilo de vida y factores ambientales, el riesgo tromboembólico y hemorrágico relacionado con la anticoagulación, la posibilidad de reintervención quirúrgica o percutánea y las preferencias del paciente informado.
Recomendaciones sobre la selección de válvulas protésicas.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Prótesis mecánicas | ||
| Se recomienda una prótesis mecánica según el deseo del paciente informado siempre que no haya contraindicaciones para la anticoagulación a largo plazoc | I | C |
| Se recomienda una prótesis mecánica para pacientes con riesgo de deterioro estructural de la válvula aceleradod | I | C |
| Debe considerarse el implante de una prótesis mecánica para pacientes que toman anticoagulantes debido a que ya llevan una prótesis mecánica en otra posición valvular | IIa | C |
| Debe considerarse el implante de una prótesis mecánica aórtica para los pacientes menores de 60 años y mitral los menores de 65462,464,e | IIa | B |
| Debe considerarse el implante de una prótesis mecánica en pacientes con una esperanza de vida razonable para los que una reoperación valvular o TAVI (cuando esté indicado) en el futuro sería de alto riesgof | IIa | C |
| Puede considerarse el implante de una prótesis mecánica para pacientes que reciben tratamiento anticoagulante indefinidamente debido al alto riesgo de tromboemboliasf | IIb | C |
| Prótesis biológicas | ||
| Se recomienda una bioprótesis según el deseo del paciente informado | I | C |
| Se recomienda una bioprótesis cuando una anticoagulación adecuada sea improbable (por problemas de adherencia, falta de disponibilidad) o esté contraindicada debido a un riesgo hemorrágico alto (hemorragia mayor previa, comorbilidades, negación del paciente, problemas de adherencia, estilo de vida, empleo) y para pacientes cuya esperanza de vida sea inferior a la durabilidad estimada de la bioprótesisg | I | C |
| Se recomienda una bioprótesis en los casos de reoperación por trombosis de válvula mecánica a pesar de un buen control de la anticoagulación crónica | I | C |
| Debe considerarse el implante de una bioprótesis para pacientes con baja probabilidad o bajo riesgo quirúrgico de una futura reoperación valvular | IIa | C |
| Debe considerarse el implante de una bioprótesis para mujeres jóvenes que deseen tener hijos | IIa | C |
| Debe considerarse el implante de una bioprótesis en pacientes mayores de 65 años para prótesis aórtica y mayores de 70 para prótesis mitral | IIa | C |
| Puede considerarse el implante de una bioprótesis para pacientes que toman NACO debido al alto riesgo de tromboembolias466–469,f | IIb | B |
FA: fibrilación auricular; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; TAVI: implante percutáneo de válvula aórtica.
aClase de recomendación.
bNivel de evidencia.
cRiesgo hemorrágico aumentado debido a comorbilidades, problemas de adherencia o condiciones geográficas, estilo de vida u ocupación.
dEdad temprana (< 40 años), hiperparatiroidismo, hemodiálisis.
ePara pacientes de 60-65 años que necesitan una prótesis aórtica y aquellos de 65-70 años en caso de prótesis mitral, ambos tipos de válvula son aceptables y la elección requiere un análisis meticuloso de los factores, aparte de la edad.
fLos factores de riesgo de tromboembolia son FA, tromboembolia venosa profunda proximal no provocada o embolia pulmonar sintomática previas, estado de hipercoagulación, anticuerpos antifosfolipídicos.
gLa esperanza de vida se debe estimar a más de 10 años según la edad, el sexo, las comorbilidades y la esperanza de vida específica del país.
En general, las bioprótesis valvulares son preferibles para pacientes con una esperanza de vida estimada más corta o con comorbilidades que puedan requerir tratamiento quirúrgico y para los pacientes con un riesgo de complicaciones hemorrágicas aumentado. Las complicaciones tromboembólicas son menos frecuentes en mujeres con bioprótesis embarazadas.
En un registro observacional nacional, pacientes de 45-54 años con implante quirúrgico de bioprótesis aórtica y de 40-70 años con implante de bioprótesis mitral tuvieron una mortalidad a los 15 años más alta que los que recibieron una prótesis mecánica. Un análisis de pacientes de 55-64 años no mostró ninguna diferencia en la mortalidad entre los pacientes con prótesis mecánicas y biológicas462. Sin embargo, una revisión sistemática anterior463 y un reciente metanálisis464 de estudios que compararon las prótesis mecánicas frente a las biológicas en posición aórtica mostraron una reducción significativa de la mortalidad con las mecánicas en pacientes de edad ≤ 60 y de 50-70 años respectivamente. Estos estudios tenían limitaciones por su naturaleza observacional y la falta de información sobre el tipo de prótesis implantada. No hay nuevos datos que sustenten una reducción de los umbrales de edad establecidos para la selección de la prótesis.
No se ha establecido todavía el mejor sustituto de la válvula aórtica para adultos jóvenes. En pacientes seleccionados adecuadamente, se puede hacer el reemplazo de válvula aórtica mediante un autoinjerto, que ha demostrado tasas de supervivencia a largo plazo y reoperación valvular comparables a las obtenidas con prótesis mecánicas, pero es necesaria una gran experiencia en cirugía de la raíz aórtica465. Las estrategias para los pacientes con anillo aórtico pequeño incluyen la ampliación de la raíz y el uso de válvulas sin stent. Aunque el implante de válvula aórtica sin sutura y de rápido despliegue es un procedimiento mínimamente invasivo que puede reducir el tiempo de pinzamiento aórtico y derivación cardiopulmonar, y posiblemente también las complicaciones del RQVA, no hay estudios aleatorizados a gran escala que comparen la seguridad y la eficacia, además de los efectos en los parámetros hemodinámicos a corto y a largo plazo, de este tratamiento frente al reemplazo convencional de válvula aórtica, que sigue siendo la técnica más utilizada.
11.2Evaluación basal y seguimientoTodos los pacientes con válvulas protésicas requieren seguimiento durante el resto de la vida para detectar el deterioro precoz de la función protésica o ventricular o la progresión de la enfermedad en otra válvula cardiaca314. El seguimiento clínico debe ser anual o tan pronto como sea posible si aparecen nuevos síntomas cardiacos. Debe hacerse un estudio de ETT en caso de nuevos síntomas o si hay sospecha de posibles complicaciones. Tras el implante percutáneo o quirúrgico de una bioprótesis, debe hacerse un estudio ecocardiográfico que incluya la medición de los gradientes transprotésicos en los primeros 30 días tras el implante (estudio basal), al año y anualmente después470. Debe considerarse la ETE si las imágenes de ETT son de baja calidad y en todos los casos de sospecha de disfunción protésica (especialmente si la prótesis está en posición mitral) o endocarditis314,471. La fluoroscopia para válvulas mecánicas y la TC proporcionan información adicional útil si se sospecha que la función valvular puede estar afectada por trombo o pannus314.
11.3Tratamiento antitrombótico11.3.1Prótesis mecánica11.3.1.1Tratamiento anticoagulante posoperatorioLas válvulas mecánicas requieren tratamiento con AVK guiado por el INR durante el resto de la vida472,473. Actualmente no se trata con NACO a los pacientes con válvulas mecánicas474. El tratamiento con un AVK debe iniciarse el primer día del posoperatorio combinado con tratamiento puente (con dosis terapéuticas de heparina no fraccionada [HNF] o, fuera de indicación, heparina de bajo peso molecular [HBPM]) hasta que se alcance un INR terapéutico475. Se han observado resultados similares de seguridad y eficacia del tratamiento puente con HNF o HBPM476. Cuando se alcance un INR terapéutico estable al menos 24 h, se puede suspender el tratamiento puente. El mayor riesgo de tromboembolia se mantiene durante aproximadamente 1 mes tras el implante, pero el riesgo sigue siendo sustancialmente alto hasta los 6 meses477,478. La prevención a largo plazo de la trombosis valvular y la tromboembolia tras el implante de una válvula mecánica requiere medicación antitrombótica eficaz y la modificación de los factores de riesgo de tromboembolia479.
11.3.1.2Cociente internacional normalizado objetivoEl objetivo de INR debe basarse en la trombogenicidad de las prótesis y los factores de riesgo de los pacientes (tabla 10)479. Se recomienda un valor medio de INR en lugar de un intervalo de valores para evitar que se considere válido un INR en valores extremos dentro del intervalo objetivo. Una alta variabilidad del INR es un importante factor de predicción independiente de eventos adversos tras el reemplazo valvular. Aunque algunos estudios apoyan la reducción del objetivo de INR para las válvulas aórticas mecánicas480,481, es necesaria más investigación en grandes cohortes antes de que se puedan actualizar las recomendaciones. El uso del autocontrol del INR se asoció con tasas más bajas de complicaciones relacionadas con el tratamiento con AVK en pacientes de todas las edades482. En un estudio que comparó dosis más bajas de warfarina combinada con ácido acetilsalicílico (INR 1,5-2,0) frente a dosis estándar de warfarina y ácido acetilsalicílico (INR 2,0-3,0) tras el implante de una válvula mecánica modelo On-X en posición aórtica, se observó una seguridad similar de los 2 tratamientos que se atribuyó, en parte, a la monitorización domiciliaria del INR y un mayor grado de adherencia de los pacientes481. La formación de los pacientes tiene un papel importante para alcanzar una anticoagulación estable en el rango terapéutico. El tratamiento eficaz de los pacientes con un INR inestable requiere la monitorización frecuente y el ajuste de las dosis en consulta. Debido a la falta de datos de buena calidad, no se puede recomendar el control farmacogenético para guiar la intensidad del tratamiento con AVK.
INR objetivo con prótesis valvular mecánica.
| Trombogenicidad de la prótesis | Factores de riesgo relacionados con el pacientea | |
|---|---|---|
| Ninguno | ≥ 1 factor de riesgo | |
| Bajab | 2,5 | 3,0 |
| Mediac | 3,0 | 3,5 |
| Altad | 3,5 | 4,0 |
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo.
El riesgo hemorrágico aumenta exponencialmente a partir de un INR de 4,5483. En caso de hemorragia mayor potencialmente mortal o pacientes que requieren cirugía urgente, debe interrumpirse el tratamiento con AVK y administrarse 10mg de vitamina K en infusión intravenosa lenta, que se repetirá cada 12 h si fuera necesario. Hasta que se revierta el efecto anticoagulante, debe iniciarse la administración de concentrado de complejo de protrombina o plasma fresco congelado según el peso corporal y el INR previo. La eficacia del tratamiento debe controlarse mediante la determinación del INR a los 30 min y cada 4-6 h hasta la normalización. Se debe valorar el momento más adecuado para reiniciar la anticoagulación teniendo en cuenta la zona de sangrado y las intervenciones para detener la hemorragia o tratar la causa subyacente484.
En ausencia de sangrado, no se recomiendan el concentrado de complejo de protrombina o el plasma fresco congelado y la decisión de iniciar el tratamiento con vitamina K debe individualizarse. Para pacientes asintomáticos con INR > 10, se debe suspender el AVK, iniciar la administración de vitamina K oral (2,5-5mg) y controlar el INR diariamente durante 2 semanas. Varios estudios aleatorizados de pacientes con INR entre 4,5 y 10 indican que no hay diferencia en la incidencia de complicaciones hemorrágicas entre la vitamina K y el placebo483,485. Por lo tanto, en estos pacientes se debe suspender temporalmente la warfarina y se puede valorar individualizadamente la administración de una dosis baja de vitamina K oral (1-2mg) sopesando los riesgos. Por último, los pacientes asintomáticos con un INR<4,5 requieren una reducción cuidadosa de la dosis o la omisión de una o más dosis. Se debe reanudar el tratamiento con AVK de todos los pacientes con válvula mecánica cuando se haya alcanzado un INR en rango terapéutico o ligeramente elevado.
11.3.1.4Combinación de fármacos anticoagulantes y antiagregantes plaquetariosAñadir dosis bajas de ácido acetilsalicílico (75-100mg) a los AVK reduce la incidencia de tromboembolias a costa de un aumento del riesgo hemorrágico477. Por ello, la combinación de antiagregantes plaquetarios con AVK debe reservarse para pacientes con un riesgo tromboembólico muy alto, en los que las ventajas superan claramente a los riesgos486,487. Para pacientes con tromboembolia a pesar de un INR adecuado, se puede añadir dosis bajas de ácido acetilsalicílico (75-100mg) al tratamiento con AVK. La estrategia de tratamiento antitrombótico oral para pacientes con EC se resume en la figura 2 del material adicional.
11.3.1.5Interrupción del tratamiento anticoagulante para procedimientos invasivos planificadosPara los pacientes con válvulas mecánicas, el tratamiento puente con HNF o HBPM antes de la cirugía implica un riesgo de hemorragia perioperatoria, mientras que la interrupción de la anticoagulación conlleva un aumento del riesgo de tromboembolia488. Por ello, para pacientes con válvulas mecánicas que van a someterse a cirugía no cardiaca electiva, la anticoagulación requiere un control meticuloso y el consenso multidisciplinario478,489. Para procedimientos quirúrgicos menores (p. ej., procedimientos dentales, cirugía de cataratas, incisiones cutáneas) en los que la pérdida de sangre es pequeña y fácil de controlar, no se recomienda interrumpir la anticoagulación. La cirugía mayor requiere la suspensión temporal de la anticoagulación y tratamiento puente con HNF o HBPM con un objetivo de INR < 1,5 (figura 3 del material adicional). El fondaparinux no debe emplearse sistemáticamente como tratamiento puente, pero puede ser útil para pacientes con historia de trombocitopenia inducida por heparina490.
11.3.2Prótesis biológica11.3.2.1Pacientes sin indicación basal de anticoagulación oralBioprótesis quirúrgicas: el tratamiento antitrombótico óptimo tras el implante quirúrgico de bioprótesis aórticas sigue siendo controvertido por la falta de evidencia firme. Varios estudios observacionales apoyan el uso de AVK para reducir el riesgo de tromboembolias491–493. Un estudio aleatorizado pequeño mostró que la administración de AVK durante 3 meses aumentó significativamente el riesgo de hemorragias mayores, comparado con el ácido acetilsalicílico, sin una reducción de las tasas de mortalidad o complicaciones tromboembólicas, aunque el estudio no tuvo suficiente potencia estadística para demostrar un beneficio en términos de trombosis494. Debe considerarse la administración de AVK durante 3 meses a todos los pacientes con bioprótesis mitral o tricúspide y ácido acetilsalicílico o AVK durante 3 meses tras el implante quirúrgico de bioprótesis aórticas.
Bioprótesis percutáneas: un metanálisis de 3 ensayos controlados aleatorizados pequeños mostró un aumento significativo de hemorragias mayores o potencialmente mortales a los 30 días con el tratamiento antiagregante plaquetario doble (TAPD) comparado con ácido acetilsalicílico, sin diferencias en las complicaciones isquémicas495. Igualmente, el más reciente estudio POPular TAVI (cohorte A) mostró tasas más bajas de hemorragia y de la variable compuesta de complicaciones hemorrágicas o tromboembólicas con ácido acetilsalicílico frente a TAPD496. Un estudio aleatorizado se interrumpió prematuramente debido a problemas de seguridad del tratamiento basado en rivaroxabán comparado con el TAPD, con mayores riesgos de muerte, complicaciones tromboembólicas y hemorragias497. Faltan datos sobre el tratamiento antitrombótico tras el implante percutáneo de bioprótesis mitral (p. ej., válvula en válvula o válvula en anillo), para el que se suele prescribir 3 meses de AVK498.
11.3.2.2Pacientes con indicación basal de anticoagulación oralBioprótesis quirúrgica: la anticoagulación oral crónica está recomendada para los pacientes con bioprótesis quirúrgica que tienen otras indicaciones para la anticoagulación. La evidencia que respalda utilizar NACO en lugar de AVK ha aumentado desde la publicación de la guía en 2017. En el estudio RIVER, que incluyó a pacientes con FA y bioprótesis en posición mitral, el rivaroxabán (NACO) fue no inferior a la warfarina en el beneficio neto de la variable principal a los 12 meses499 y este beneficio fue consistente entre los subgrupos de pacientes. Sin embargo, se reclutó antes del tercer mes del posoperatorio solo al 20% de los pacientes, lo cual plantea dudas y hace necesarios más datos sobre este subgrupo de pacientes. En el pequeño estudio ENAVLE (n = 220), que incluyó a pacientes con o sin FA, el edoxabán fue no inferior a la warfarina para la prevención de tromboembolias y hemorragias mayores en los primeros 3 meses tras el implante o la reparación quirúrgicos de bioprótesis aórtica o mitral; este hallazgo requiere confirmación en estudios más grandes500.
Recomendaciones sobre el tratamiento antitrombótico perioperatorio y posoperatorio en el implante de válvula protésica o la reparación valvular.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Tratamiento antitrombótico perioperatorio | ||
| Se recomienda suspender el tratamiento con AVK en el momento adecuado antes de la cirugía electiva con un objetivo de INR<1,5c | I | C |
| Cuando sea necesario interrumpir la anticoagulación oral, se recomienda el tratamiento puente para los pacientes con cualquiera de las siguientes indicaciones:• Prótesis valvular mecánica• FA con estenosis mitral significativa• FA con una puntuación CHA2DS2-VASc ≥ 3 las mujeres o 2 los varonesd• Complicación trombótica aguda en las 4 semanas anteriores• Riesgo alto de complicación tromboembólica agudae | I | C |
| Se recomienda el tratamiento puente con dosis terapéuticas de HNF o HBPM subcutánea476,504 | I | B |
| Para pacientes con prótesis valvular mecánica, se recomienda reiniciar el tratamiento con AVK el primer día del posoperatorio | I | C |
| Para pacientes sometidos a cirugía valvular que tienen una indicación de tratamiento puente posoperatorio, se recomienda iniciar la administración de HNF o HBPM a las 12-24h de la cirugía | I | C |
| Para pacientes sometidos a cirugía, se recomienda mantener el tratamiento con ácido acetilsalicílico, si está indicado, durante el periodo perioperatorio | I | C |
| Para pacientes con TAPD tras una ICP reciente (≤ 1 mes) que requieren cirugía valvular, en ausencia de una indicación de anticoagulación oral, se recomienda reiniciar el tratamiento con un inhibidor del P2Y12 tan pronto como disminuya el riesgo hemorrágico | I | C |
| Para pacientes con TAPD tras una ICP reciente (≤ 1 mes) que requieren cirugía valvular, en ausencia de una indicación de anticoagulación oral, se puede considerar el tratamiento puente con inhibidores de la glucoproteína IIb/IIIa (inhibidores del P2Y12) de acción corta o cangrelor | IIb | C |
| Pacientes con una indicación de tratamiento antiagregante plaquetario concomitante | ||
| Tras una ICP o un SCA sin complicaciones en pacientes que requieren ACO crónica, se recomienda la interrupción temprana (≤ 1 semana) del ácido acetilsalicílico y continuar tratamiento doble con anticoagulación oral y un inhibidor del P2Y12 (preferiblemente clopidogrel) durante 6 meses (o 12 meses en los SCA), si el riesgo de trombosis del stent es bajo o si prevalece el riesgo hemorrágico sobre el riesgo de trombosis del stent, independientemente del tipo de stent implantado505–509 | I | B |
| Para los pacientes tratados con anticoagulación oral, se recomienda suspender el tratamiento antiagregante a los 12 meses74,510–512 | I | B |
| Tras una ICP o SCA sin complicaciones en pacientes que requieren tratamiento anticoagulante y antiagregante plaquetario, debe considerarse el tratamiento triple con ácido acetilsalicílico, clopidogrel y anticoagulación oral durante más de 1 semana cuando el riesgo de trombosis del stent sea superior al hemorrágico; la duración total del tratamiento (≤ 1 mes) debe decidirse según la evaluación de estos riesgos y se especificará claramente antes del alta | IIa | C |
| Para pacientes tratados con un AVK (p. ej., pacientes con válvulas mecánicas), debe considerarse la administración de clopidogrel solo en casos seleccionados (p. ej., pacientes con una puntuación HAS-BLED ≥ 3 o que cumplen los criterios ARC-HBR y tienen bajo riesgo de trombosis del stent) con una duración máxima de 12 meses512,513 | IIa | B |
| Para pacientes que requieren ácido acetilsalicílico/clopidogrel además de un AVK, la dosis de AVK se debe regular cuidadosamente con un objetivo de INR en los valores inferiores del intervalo recomendado y un tiempo en rango terapéutico > 65-70%505,514 | IIa | B |
| Reemplazo valvular quirúrgico | ||
| Está recomendada la anticoagulación oral crónica con un AVK para todos los pacientes con prótesis valvulares mecánicas472,473 | I | B |
| Para pacientes tratados con un AVK, se recomienda el autocontrol del INR siempre que se proporcione al paciente la adecuada formación y se haga un control de calidad482 | I | B |
| La anticoagulación oral está recomendada para pacientes sometidos a implante quirúrgico de bioprótesis que tienen otras indicaciones para la anticoagulaciónf | I | C |
| Debe considerarse el tratamiento con un NACO en lugar de un AVK a los 3 meses del implante quirúrgico de una bioprótesis en pacientes con FA74,499,500,515–518 | IIa | B |
| Para pacientes sin una indicación basal de anticoagulación oral, debe considerarse la administración de dosis bajas de ácido acetilsalicílico (75-100mg/día) o anticoagulación con un AVK durante los primeros 3 meses tras el implante quirúrgico de una bioprótesis aórtica491,494 | IIa | B |
| Para pacientes sin una indicación basal de anticoagulación oral, debe considerarse la administración de anticoagulación con un AVK durante los primeros 3 meses tras el implante quirúrgico de una bioprótesis en posición mitral o triscuspídea519,520 | IIa | B |
| Puede considerarse la adición de dosis bajas de ácido acetilsalicílico (75-100mg/día) al tratamiento con AVK para pacientes seleccionados con prótesis mecánicas en caso de enfermedad ateroesclerótica concomitante y riesgo hemorrágico bajo | IIb | C |
| Debe considerarse la adición de dosis bajas de ácido acetilsalicílico (75-100mg/día) al tratamiento con AVK en caso de tromboembolia pese a un INR adecuado | IIa | C |
| Debe considerarse el tratamiento con un NACO en lugar de AVK durante los primeros 3 meses tras el implante quirúrgico de bioprótesis en posición mitral para pacientes con FA499 | IIb | C |
| Los NACO no están indicados para pacientes con prótesis valvulares mecánicas474 | III | B |
| Reparación valvular quirúrgica | ||
| Debe considerarse la anticoagulación oral con un AVK durante los primeros 3 meses tras la reparación mitral o tricuspídea | IIa | C |
| Debe considerarse el tratamiento antiagregante simple con dosis bajas de ácido acetilsalicílico (75-100mg/día) durante los primeros 3 meses tras la cirugía de válvula aórtica con conservación de la válvula cuando no haya otras indicaciones basales para la anticoagulación | IIa | C |
| Implante percutáneo de válvula aórtica | ||
| La anticoagulación oral crónica está indicada para pacientes tratados con TAVI que tienen otras indicaciones para la anticoagulación501f | I | B |
| Está indicado el tratamiento antiagregante plaquetario simple crónico para pacientes tratados con TAVI que no tienen indicaciones basales para la anticoagulación495,496,521 | I | A |
| No está indicado el uso sistemático de la anticoagulación oral para pacientes tratados con TAVI que no tienen indicaciones basales para la anticoagulación497 | III | B |
ACO: anticoagulación oral; ARC-HBR: Academic Research Consortium-high bleeding risk; AVK: antagonista de la vitamina K; FA: fibrilación auricular; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; INR: cociente internacional normalizado; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
c≤ 5 días para warfarina y ≤ 3 días para acenocoumarol.
dCHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer).
eTrombo en el ápex del VI, déficit de antitrombina 3 y déficit de proteínas C o S.
fFA, tromboembolia venosa, estado de hipercoagulación o, con menor grado de evidencia, disfunción grave del VI (fracción de eyección<35%).
Bioprótesis percutánea: en el estudio POPular TAVI (cohorte B), la incidencia de hemorragias en un periodo de 1 mes o 1 año fue inferior con anticoagulación sola que con anticoagulación y clopidogrel501. La anticoagulación oral sola fue no inferior a la anticoagulación más clopidogrel con respecto a las complicaciones isquémicas, pero el margen de no inferioridad fue grande. Un estudio observacional mostró un mayor riesgo de complicaciones isquémicas al año en los pacientes tratados con NACO frente a AVK tras el ajuste de los posibles factores de confusión502. Actualmente están en desarrollo estudios que comparan el tratamiento con NACO o AVK (NCT02943785, NCT02664649). Los datos sobre el tratamiento antitrombótico tras el implante de válvula mitral o tricúspide son escasos498.
11.3.3Reparación valvularDatos de estudios observacionales indican que el riesgo de tromboembolia tras la reparación de válvula mitral con ácido acetilsalicílico y con AVK es comparable503, pero son necesarios resultados de estudios aleatorizados que lo confirmen. La alta incidencia de la FA de nueva aparición y su recurrencia, la tendencia trombogénica de componentes de la reparación que no están endotelizados y la tasa relativamente alta de pacientes resistentes al ácido acetilsalicílico convierten a los AVK en la opción preferida de tratamiento para el periodo inicial (p. ej., 3 meses). No obstante, debido a la posibilidad de complicaciones hemorrágicas en el posoperatorio es necesario seleccionar cuidadosamente a los pacientes. El tratamiento antitrombótico tras el implante de prótesis o la reparación valvular se resume en la tabla de recomendaciones y en la figura 9.
Tratamiento antitrombótico para las válvulas protésicas. ACO: anticoagulación oral; AVK: antagonista de la vitamina K; EC: enfermedad coronaria; FA: fibrilación auricular; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; INR: cociente internacional normalizado; RQVA: reemplazo quirúrgico de válvula aórtica; RVM: reemplazo o reparación de válvula mitral; RVT: reemplazo o reparación de válvula tricúspide; TAPD: tratamiento antiagregante plaquetario doble; TAS: tratamiento antiagregante plaquetario simple; TAVI: implante percutáneo de válvula aórtica; VI: ventrículo izquierdo; VPM: válvula protésica mecánica.
Los códigos de color corresponden a la clase de recomendación.
Las definiciones de deterioro estructural de la válvula y fallo de la bioprótesis se estandarizaron recientemente en un documento de consenso470,522. Es necesario comparar la durabilidad a largo plazo de las bioprótesis percutáneas o quirúrgicas (TAVI o RQVA). Hay que descartar las causas reversibles del fallo de la bioprótesis (p. ej., endocarditis, trombosis) y considerar algunos aspectos del momento en que se presenta la disfunción (p. ej., en prótesis biológicas con obstrucción, el desajuste paciente-prótesis (mismatch) en la fase inicial y la trombosis en la fase tardía) y la localización de la disfunción (p. ej. endocarditis o deterioro estructural en caso de regurgitación central, endocarditis o factores anatómicos/técnicos en caso de regurgitación paravalvular) pueden revelar la causa subyacente más probable y guiar las decisiones clínicas.
Se deben evitar las intervenciones percutáneas con balón para el tratamiento de las bioprótesis estenóticas del lado izquierdo. El implante percutáneo válvula en válvula es una opción para el tratamiento del deterioro de la bioprótesis en pacientes con riesgo quirúrgico alto227,523–525. La repetición del TAVI es segura y viable en pacientes seleccionados, pero hay que considerar el riesgo de desajuste paciente-prótesis en caso de válvulas pequeñas y el de oclusión coronaria, o dificultad de acceso a las arterias coronarias en el futuro229,526–528. La experiencia acumulada sobre en qué pacientes con riesgo quirúrgico elevado puede ser razonable el tratamiento «válvula en válvula» se refiere fundamentalmente a bioprótesis aórticas, y es menor la información sobre este procedimiento en posición mitral y mucho menor en posición tricuspídea529–532.531,533. Los procedimientos de válvula en anillo para la válvula mitral también son aceptables para candidatos seleccionados, mientras que el papel de este procedimiento para la válvula tricúspide sigue siendo incierto. El equipo cardiológico debe estudiar cada paciente y escoger la mejor estrategia individualizada. En pacientes con reintervención de bioprótesis aórtica es necesaria una cuidadosa planificación antes del procedimiento para minimizar el riesgo de obstrucción coronaria y permitir el acceso coronario en el futuro si fuera necesario. En las reintervenciones de válvula mitral es necesario evaluar detenidamente el riesgo de obstrucción del TSVI534.
11.4.2Disfunción no estructural de la válvula11.4.2.1Desajuste paciente-prótesisEl desajuste paciente-prótesis reduce significativamente la supervivencia a largo plazo, se correlaciona con el deterioro estructural valvular y aumenta las tasas de reingreso por insuficiencia cardiaca y reoperación535–537. Se debe prestar más atención y tomar medidas para prevenir el desajuste paciente-prótesis y mejorar la supervivencia a largo plazo tras el RQVA o el TAVI538.
11.4.2.2Fuga paravalvular y hemolisisLos análisis sanguíneos para la hemolisis deben formar parte del seguimiento sistemático después del reemplazo valvular. El diagnóstico de anemia hemolítica precisa de la ETE para detectar una fuga paravalvular de las prótesis en posición mitral si la ETT no aporta datos. La reoperación está recomendada si la fuga paravalvular está relacionada con endocarditis o causa una hemolisis que requiere transfusiones sanguíneas repetidas o produce síntomas graves. El cierre percutáneo de la fuga paravalvular es factible, pero la experiencia es poca y no hay evidencia concluyente que demuestre su eficacia constante539. Debe considerarse el cierre percutáneo de fugas paravalvulares con una anatomía favorable en pacientes seleccionados por el equipo cardiológico540. El tratamiento farmacológico, que incluye suplementos de hierro, bloqueadores beta y eritropoyetina, está indicado para pacientes con anemia hemolítica grave que tengan contraindicada la cirugía o el cierre percutáneo540.
11.4.3EndocarditisEl tratamiento de los pacientes con endocarditis debe seguir las recomendaciones de las guías específicas4.
11.4.4Trombosis11.4.4.1Comentarios generalesHay que sospechar precozmente trombosis valvular obstructiva ante todo paciente con válvula protésica de cualquier tipo que se presente con síntomas recientes de disnea o un evento embólico. El diagnóstico debe confirmarse mediante ETT y ETE, fluoroscopia o TC si está disponible rápidamente268,314. La trombosis valvular ocurre más frecuentemente en prótesis mecánicas, aunque también se han descrito casos de trombosis de bioprótesis después de cirugía o implante percutáneo541. El trombo en una bioprótesis se puede presentar como un engrosamiento hipoatenuado de las valvas (HALT) con movilidad relativamente normal, como HALT con movilidad reducida de las valvas pero con gradientes normales o como trombosis valvular clínica con gradientes elevados. Es importante distinguir entre trombo y pannus mediante TC para guiar las decisiones terapéuticas.
11.4.4.2Trombosis valvularEl tratamiento de la trombosis valvular de prótesis mecánicas es de alto riesgo, sea cual sea la opción que se siga. La fibrinolisis implica riesgos de hemorragia, embolia sistémica y trombosis recurrente542. Se recomienda el reemplazo valvular urgente para la trombosis obstructiva en pacientes críticos sin contraindicaciones para la cirugía. El tratamiento de la trombosis no obstructiva de válvula protésica mecánica depende más que nada de si ha habido un evento tromboembólico y del tamaño del trombo. Debe considerarse la cirugía cuando en la prótesis valvular haya un trombo no obstructivo grande (> 10mm) complicado con embolia o que persiste a pesar del tratamiento anticoagulante óptimo543. Aunque la trombolisis conlleva riesgo de hemorragia y tromboembolia, puede considerarse para el tratamiento de prótesis valvulares derechas cuando la cirugía no sea una opción o sea de alto riesgo. La anticoagulación con un AVK o HNF es el tratamiento de primera línea para la trombosis de bioprótesis. Debido a que la trombosis de bioprótesis se asocia con la recurrencia y el deterioro temprano de esta, debe considerarse la anticoagulación crónica cuando se confirme el primer episodio y teniendo en cuenta el aumento de riesgo de hemorragia (figura 10)544,545.
Tratamiento de la trombosis obstructiva y no obstructiva de válvula mecánica en el corazón izquierdo. ETE: ecocardiografía transesofágica; ETT: ecocardiografía transtorácica; HNF: heparina no fraccionada; i.v.: intravenoso; TCC: tomografía computarizada cardiaca; TE: tromboembolia.
aVéanse las recomendaciones para la evaluación de válvulas protésicas mediante pruebas de imagen. La evaluación generalmente incluye ETT además de ETE o TCC y ocasionalmente fluoroscopia.
Se debe individualizar los riesgos y beneficios de ambos tratamientos. La presencia de prótesis de primera generación es un incentivo para la cirugía.
Se detectó HALT mediante TC a los 3 meses en el 12,4 y el 32,4% de los pacientes sometidos a TAVI tratados con anticoagulación o TAPD respectivamente546. Se desconoce la importancia clínica de estos hallazgos. Debe considerarse la administración selectiva de ACO para pacientes con HALT confirmado y movilidad restringida de las valvas con gradientes elevados.
11.4.5Insuficiencia cardiacaLa insuficiencia cardiaca después de una cirugía valvular debe llevar a la búsqueda rápida de disfunción estructural o desajuste paciente-prótesis, deterioro de la reparación, disfunción del VI o progresión de otra valvulopatía. Deben considerarse también otras causas no relacionadas con las válvulas, como EC, hipertensión o arritmias sostenidas. El tratamiento de los pacientes con insuficiencia cardiaca debe seguir las recomendaciones de la guía específica sobre esta enfermedad y los documentos de consenso142,247.
Recomendaciones sobre el tratamiento de la disfunción de válvulas protésicas.
| Recomendaciones | Clasea | Claseb |
|---|---|---|
| Trombosis de prótesis mecánicas | ||
| Se recomienda el reemplazo valvular urgente o emergente para la trombosis obstructiva en pacientes críticos sin comorbilidad grave542 | I | B |
| Debe considerarse la fibrinolisis (con bolo de 10mg de activador tisular del plasminógeno recombinante+90mg de HNF en 90min o infusión de 1.500.000 U de estreptoquinasa sin HNF en 60min) cuando la cirugía no esté disponible o sea de alto riesgo o para la trombosis de prótesis de lado derecho542 | IIa | B |
| Debe considerarse la cirugía en presencia de trombos no obstructivos grandes (> 10mm) complicados con embolia | IIa | C |
| Trombosis de bioprótesis | ||
| Se recomienda la anticoagulación con un AVK o HNF para la trombosis de bioprótesis antes de considerar la reintervención | I | C |
| Debe considerarse la anticoagulación para los pacientes con engrosamiento y movilidad reducida de las valvas que producen gradientes elevados, al menos hasta su resolución541,546 | IIa | B |
| Hemolisis y fuga paravalvular | ||
| Se recomienda la reoperación si la fuga paravalvular está relacionada con endocarditis o causa hemolisis que requiere transfusiones sanguíneas repetidas o produce síntomas graves de insuficiencia cardiaca | I | C |
| Debe considerarse el cierre percutáneo de las fugas paravalvulares que producen insuficiencia clínicamente significativa o hemolisis en pacientes con riesgo quirúrgico alto o prohibitivo 547 | IIa | B |
| La decisión sobre el cierre percutáneo o quirúrgico de fugas paravalvulares clínicamente significativas debe tener en cuenta el perfil de riesgo del paciente, la morfología de la fuga y la experiencia del centro | IIa | C |
| Disfunción de bioprótesis | ||
| Se recomienda la reintervención para los pacientes sintomáticos que presentan un aumento significativo del gradiente transprotésico (tras la exclusión de trombosis valvular) o insuficiencia grave | I | C |
| El equipo cardiológico debe considerar el implante percutáneo transfemoral «válvula en válvula» en posición aórtica dependiendo de aspectos anatómicos y las características de la prótesis y para pacientes con riesgo quirúrgico alto o inoperables529 | IIa | B |
| Puede considerarse el implante percutáneo «válvula en válvula» en posición mitral o tricuspídea para pacientes seleccionados con riesgo alto de reintervención quirúrgica382,531,532 | IIb | B |
| Debe considerarse la reintervención para los pacientes asintomáticos con disfunción significativa de la prótesis si la reoperación es de riesgo bajo | IIa | C |
AVK: antagonistas de la vitamina K; HNF: heparina no fraccionada.
aClase de recomendación.
bNivel de evidencia.
La morbimortalidad cardiovascular está aumentada en los pacientes con valvulopatías que se someten a cirugía no cardiaca. La estenosis aórtica o la estenosis mitral sintomáticas graves pueden requerir el reemplazo valvular o una intervención percutánea antes de la cirugía no cardiaca. En la guía específica de la ESC se encuentra una descripción detallada de las recomendaciones489.
12.1Evaluación preoperatoriaLos factores específicos del paciente y la cirugía dictan la estrategia terapéutica489,548,549. El cardiólogo debe proporcionar recomendaciones sobre el tratamiento preoperatorio y perioperatorio, su supervisión y la continuación del tratamiento cardiovascular crónico. Debe hacerse un estudio ecocardiográfico a todos los pacientes con valvulopatías que requieran cirugía no cardiaca. La determinación de la capacidad funcional es un paso esencial en la evaluación preoperatoria del riesgo y se puede medir según la capacidad para llevar a cabo actividades cotidianas o mediante una prueba de esfuerzo. La decisión sobre el tratamiento se debe tomar después de la valoración de un equipo multidisciplinario que incluya a cardiólogos, cirujanos y anestesistas cardiacos, además del equipo responsable de la cirugía no cardiaca.
Para los pacientes que toman ACO, deben seguirse las recomendaciones de la sección 11.
12.2Lesiones valvulares específicas12.2.1Estenosis aórticaEn pacientes con estenosis aórtica grave, la cirugía no cardiaca urgente se debe llevar a cabo con estricta monitorización hemodinámica. En caso de cirugía no cardiaca de riesgo alto, puede considerarse la valvuloplastia con balón antes de la cirugía549. El tratamiento en la cirugía no cardiaca electiva depende de la presencia de síntomas y el tipo de cirugía489,549–553. Para los pacientes sintomáticos, debe considerarse la intervención de válvula aórtica antes de la cirugía no cardiaca y el equipo cardiológico debe decidir el tipo de procedimiento (TAVI o RQVA). En pacientes asintomáticos, la cirugía no cardiaca electiva, si es de riesgo bajo o moderado, puede llevarse a cabo con seguridad, aunque con riesgo de empeoramiento de la insuficiencia cardiaca489,552,553. Si la cirugía no cardiaca implica grandes cambios de volumen, debe considerarse primero la intervención de la válvula aórtica (TAVI o RQVA) según la decisión del equipo cardiológico (figura 11).
12.2.2Estenosis mitralLa cirugía no cardiaca puede llevarse a cabo con seguridad en pacientes con estenosis mitral no significativa (área valvular > 1,5 cm2) o en pacientes asintomáticos con estenosis mitral significativa y PAPS < 50mmHg. Para los pacientes sintomáticos o con PAPS > 50mmHg, debe intentarse la corrección de la estenosis mitral, mediante CMP siempre que sea posible, antes de la cirugía no cardiaca si esta es de riesgo alto.
12.2.3Insuficiencia aórtica y mitralLa cirugía no cardiaca puede llevarse a cabo con seguridad en pacientes asintomáticos con insuficiencia mitral o aórtica graves y la función del VI conservada. La presencia de síntomas o disfunción del VI requiere que se considere la cirugía valvular, aunque rara vez es necesaria antes de la cirugía no cardiaca. Si la disfunción del VI es grave (FEVI < 30%) o la PAPS es > 50/60mmHg, la cirugía solo debe hacerse si es estrictamente necesaria y tras la optimización del tratamiento médico para la insuficiencia cardiaca.
12.3Monitorización perioperatoriaEs necesario controlar la frecuencia cardiaca (especialmente en la estenosis mitral) y el control meticuloso de los fluidos (especialmente en la estenosis aórtica). Puede considerarse la monitorización mediante ETE.
13TRATAMIENTO DURANTE LA GESTACIÓNLas recomendaciones sobre el tratamiento de la enfermedad cardiovascular durante la gestación se describen en otra guía554. La decisión sobre el tratamiento antes y durante la gestación debe tomarse después de la discusión de un equipo multidisciplinario que incluya a cardiólogos, cirujanos cardiacos, obstetras, neonatólogos y anestesistas.
13.1Tratamiento antes del embarazoSe debe evaluar la valvulopatía antes del embarazo y tratarla si fuera necesario554,555.
Se debe desaconsejar el embarazo y recomendar una intervención antes del embarazo en los siguientes casos:
- •
Pacientes con estenosis mitral y área valvular<1,5 cm2 (especialmente si es < 1,0 cm2)554,556.
- •
Pacientes sintomáticas con estenosis aórtica grave o pacientes asintomáticas con función del VI reducida (FEVI < 50%) o prueba de esfuerzo anormal; la cirugía se debe hacer antes del embarazo554,557.
- •
A las mujeres con síndrome de Marfan y un diámetro aórtico > 45mm, se les debe desaconsejar firmemente el embarazo si no se hace antes la reparación aórtica debido al alto riesgo de disección aórtica. Aunque un diámetro aórtico < 40mm raramente se asocia con disección aórtica, no existe un diámetro completamente seguro. En caso de un diámetro aórtico entre 40 y 45mm, el crecimiento aórtico previo y la historia familiar son factores importantes para hacer recomendaciones sobre el embarazo con o sin reparación aórtica558. Aunque el riesgo real de disección no está bien documentado en el contexto de las válvulas bicúspides, se recomienda desaconsejar el embarazo en caso de diámetros aórticos > 50mm (ASC > 27 mm2)559. Por último, un diámetro aórtico > 25mm/m2 del ASC en pacientes con síndrome de Turner o síndrome vascular de Ehlers-Danlos son también contraindicaciones para el embarazo.
Para las mujeres que deseen gestar y requieran reemplazo valvular, se recomienda que la elección de la prótesis se haga en consulta con un equipo cardiológico especializado554,560.
La gestación de mujeres con válvulas mecánicas, especialmente en posición mitral, se asocia con un riesgo alto de complicaciones para la madre y el feto554,561 que se debe discutir con la paciente y su familia.
13.2Tratamiento durante del embarazo13.2.1Pacientes con valvulopatía nativaLas gestantes toleran mal la estenosis mitral moderada o grave con un área valvular < 1,5 cm2. Debe considerarse la CMP para las pacientes con síntomas graves (NYHA III-IV) o PAPS > 50mmHg a pesar del tratamiento médico óptimo. La CMP debe hacerse preferiblemente después de la semana 20 de gestación en un centro con experiencia554.
Para las pacientes con síntomas graves a pesar del tratamiento médico, se puede llevar a cabo una valvuloplastia aórtica con balón, siempre que la lleve a cabo un operador experimentado557. El TAVI es una alternativa prometedora, pero hasta ahora la experiencia durante el embarazo es muy escasa554.
La cirugía con derivación cardiopulmonar se asocia con una tasa de mortalidad fetal del 15-56%562 y debe restringirse a entidades raras que pongan en riesgo la vida de la madre cuando no sea posible o haya fracasado una intervención percutánea. Debe considerarse el reemplazo valvular tras el parto prematuro por cesárea.
Se recomienda el parto por cesárea para las pacientes con estenosis mitral o aórtica grave, diámetro de la aorta ascendente > 45mm o hipertensión pulmonar grave o cuando comience el parto de pacientes que tomen AVK o menos de 2 semanas después de la suspensión del AVK.
13.2.2Prótesis mecánicasSe recomienda que las gestantes con prótesis mecánica reciban tratamiento en un centro que disponga de un equipo cardiológico especializado en el embarazo554.
La anticoagulación terapéutica durante el embarazo es de extrema importancia para evitar complicaciones a estas pacientes, teniendo en cuenta que no hay un régimen anticoagulante ideal y que el tratamiento requiere sopesar meticulosamente los riesgos para la madre y el feto.
Para las pacientes que requieran warfarina < 5mg/día, es preferible la ACO durante el embarazo y cambiar a HNF antes del parto. Para las pacientes que requieran dosis más altas, se prefiere cambiar a HBPM durante el primer trimestre con control estricto de la actividad anti-Xa (intervalo terapéutico, 0,8-1,2 UI/ml para prótesis aórticas y 1,0-1,2 UI/ml para prótesis mitrales y de lado derecho) y ACO después, y cambiar a HNF antes del parto554.
14MENSAJES CLAVEAspectos generales
1. La evaluación completa de la historia del paciente y el estado sintomático, además de la exploración física, son cruciales para el diagnóstico y el tratamiento de las valvulopatías.
2. La ecocardiografía es la técnica más importante para diagnosticar las valvulopatías y evaluar su gravedad y su pronóstico. Otras técnicas no invasivas, como RMC, TC, fluoroscopia y biomarcadores, proporcionan información adicional relevante en pacientes seleccionados. La prueba de estrés debe aplicarse sin restricciones a los pacientes asintomáticos. Las pruebas invasivas, aparte de la coronariografía preoperatoria, deben restringirse a las situaciones en que la evaluación no invasiva no sea concluyente.
3. Las decisiones sobre el tratamiento de los pacientes ancianos requieren la integración de múltiples parámetros, incluida la estimación de la esperanza de vida y la calidad de vida esperada, la evaluación de las comorbilidades y el estado general del paciente (incluida la fragilidad).
4. En las decisiones sobre el tratamiento de los pacientes asintomáticos, deben sopesarse los riesgos de la intervención frente a la historia natural estimada de la valvulopatía. La prueba de esfuerzo debe emplearse sin restricciones.
5.Las expectativas y los valores de los pacientes informados adecuadamente son una parte importante del proceso de toma de decisiones.
6. Están indicadas las intervenciones percutáneas o quirúrgicas para pacientes con síntomas (espontáneos o inducidos por el ejercicio) siempre que no sean procedimientos fútiles. En pacientes asintomáticos seleccionados, la presencia de factores predictivos de una rápida progresión de los síntomas justifica la intervención temprana siempre que el riesgo del procedimiento sea bajo.
7. Son necesarios centros especializados en valvulopatías con equipos cardiológicos multidisciplinarios, consultas de valvulopatías, equipamiento completo y un volumen suficiente de procedimientos para proporcionar una atención de alta calidad y un entrenamiento adecuado.
8. Es imprescindible un seguimiento estricto del estado sintomático, las dimensiones y la función del VI y el VD de los pacientes asintomáticos con valvulopatías graves, para los que todavía no está indicada una intervención.
9. En pacientes con FA, los NACO están contraindicados para los pacientes con estenosis mitral clínicamente significativa o prótesis mecánica. Para la prevención del ictus en pacientes candidatos a ACO, se recomienda el tratamiento con NACO en lugar de un AVK para los pacientes con estenosis aórtica, insuficiencia aórtica o mitral o bioprótesis aórtica más de 3 meses después del implante.
Insuficiencia aórtica
10. La evaluación de la insuficiencia aórtica requiere determinar una posible dilatación aórtica para decidir el tipo de cirugía y el momento más adecuado para implementarla.
Estenosis aórtica
11. El diagnóstico de la estenosis aórtica grave requiere la evaluación integral de los gradientes de presión (la medición más robusta), AVA, grado de calcificación valvular, condiciones de flujo y función del VI.
12. El equipo cardiológico debe seleccionar la modalidad de intervención más apropiada teniendo en cuenta las características clínicas (edad y esperanza de vida estimada, estado general), las características anatómicas, los riesgos relativos del RQVA y el TAVI, la viabilidad del TAVI transfemoral, la experiencia del centro y los datos de resultados, además de las preferencias del paciente informado.
Insuficiencia mitral
13. En cuanto a las técnicas de imagen, la cuantificación sistemática del AORE es una parte importante de la evaluación integral para la cuantificación y la estratificación del riesgo de los pacientes con insuficiencia mitral primaria. La ETE tridimensional es más precisa que la ecocardiografía bidimensional para definir el mecanismo subyacente de la insuficiencia mitral primaria. La RMC es útil cuando la evaluación ecocardiográfica de la gravedad de la insuficiencia mitral primaria no es concluyente.
14. La reparación quirúrgica de la válvula mitral es el método preferido para tratar la insuficiencia mitral primaria si se esperan resultados duraderos. La reparación percutánea «borde con borde», aunque segura, es una alternativa menos eficaz que se puede considerar para pacientes con contraindicaciones para la cirugía o con riesgo quirúrgico alto.
15. Para pacientes con insuficiencia mitral secundaria grave, el tratamiento médico basado en las GPC (incluida la TRC si está indicada) debe ser la primera opción de tratamiento. Si el paciente sigue sintomático, se recomienda la cirugía mitral concomitante en pacientes con una indicación para CABG u otra cirugía cardiaca. Puede considerarse la cirugía valvular aislada ena pacientes seleccionados. Debe considerarse la reparación percutánea «borde con borde» para los pacientes que no son candidatos a cirugía y cumplen los criterios que indican una posibilidad alta de respuesta al tratamiento. Deben considerarse los dispositivos de asistencia circulatoria, el trasplante cardiaco o los cuidados paliativos como alternativa para los pacientes con disfunción ventricular izquierda o derecha avanzada.
Estenosis mitral
16. La CMP es actualmente el tratamiento estándar para los pacientes con estenosis mitral reumática grave y anatomía valvular favorable.
17. La decisión sobre el tipo de intervención para los pacientes con anatomía desfavorable sigue siendo objeto de debate y en ella se debe tener en cuenta múltiples factores que influyen en la predicción de los resultados de la CMP.
Insuficiencia tricuspídea
18. La insuficiencia tricuspídea grave requiere una intervención temprana para evitar el daño secundario del VD.
19. La insuficiencia tricuspídea debe tratarse durante la cirugía de válvula izquierda. La cirugía solo para la insuficiencia tricuspídea secundaria grave (con o sin cirugía previa de válvula izquierda) requiere una evaluación minuciosa de la enfermedad subyacente, los factores hemodinámicos pulmonares y la función del VD.
Válvulas protésicas
20. La elección entre una prótesis mecánica y una bioprótesis debe estar centrada en el paciente y basada en múltiples factores relativos a las características de los pacientes, la indicación de anticoagulación crónica, la posibilidad y los riesgos de una reintervención y las preferencias de los pacientes informados adecuadamente.
21. La evaluación clínica de las válvulas protésicas debe hacerse cada año y tan pronto como sea posible si se producen nuevos síntomas cardiacos.
15LAGUNAS EN LA EVIDENCIAExisten importantes lagunas en la evidencia sobre los siguientes aspectos de las valvulopatías:
Aspectos generales
1. Valor pronóstico de los índices derivados de la RMC en pacientes con insuficiencia aórtica, estenosis aórtica e insuficiencia mitral.
2. Herramientas de estratificación del riesgo para tomar decisiones sobre las intervenciones (evitando las intervenciones fútiles y el tipo de intervención (TAVI o RQVA para la estenosis aórtica, reparación o reemplazo para la insuficiencia mitral y aórtica).
3. En pacientes asintomáticos con insuficiencia aórtica, estenosis aórtica e insuficiencia mitral, identificar y evaluar marcadores tempranos de disfunción del VI (biomarcadores, pruebas de imagen y multimodales), además de los estudios longitudinales y traslacionales sobre la progresión de la enfermedad.
4. Aspectos sobre el sexo relacionados con la fisiopatología, las indicaciones y el momento más adecuado del tratamiento.
5. Volumen mínimo de procedimientos necesario para obtener resultados óptimos de las intervenciones.
6. Seguridad y eficacia de los NACO para pacientes con bioprótesis quirúrgicas o percutáneas durante los primeros 3 meses tras el implante.
7. Formación de los pacientes para la toma compartida de decisiones y el momento más adecuado de la evaluación.
8. Datos epidemiológicos sistemáticos sobre la carga de cardiopatía reumática.
9. Apoyo y refuerzo de las enfermedades valvulares en el contexto global de las cardiopatías.
Insuficiencia aórtica
10. Posibles diferencias en el riesgo de complicaciones aórticas dependiendo de los subtipos de aneurisma aórtico (localización y morfología) y en los pacientes con válvulas aórticas bicúspides.
11. Más investigación sobre la reparación quirúrgica de la válvula aórtica.
Estenosis aórtica
12. Fisiopatología de la progresión de la enfermedad y nuevos objetivos terapéuticos del tratamiento médico.
13. Más investigación para evaluar el papel de las intervenciones:
- •
Durabilidad a largo plazo de las válvulas percutáneas comparadas con las bioprótesis quirúrgicas.
- •
El papel de las intervenciones (RQVA o TAVI) para pacientes asintomáticos.
- •
El papel del TAVI para pacientes más jóvenes con riesgo bajo, pacientes con estenosis aórtica de válvulas bicúspides y pacientes con estenosis aórtica moderada y disfunción del VI.
- •
Resultados de la reintervención (valvular o coronaria) después del TAVI o RQVA.
- •
El papel de la revascularización en pacientes con estenosis aórtica grave y EC asintomática concomitante.
Insuficiencia mitral
14. La asociación entre la insuficiencia mitral primaria y la muerte súbita cardiaca y las arritmias ventriculares.
15. El papel de las pruebas genéticas en el prolapso de válvula mitral.
16. Más investigación sobre el papel de las intervenciones:
- •
Resultados a largo plazo de las intervenciones percutáneas.
- •
Indicaciones de las intervenciones percutáneas para pacientes con insuficiencia mitral primaria grave y riesgo quirúrgico bajo.
- •
Impacto potencial de las intervenciones quirúrgicas o percutáneas de válvula mitral en la supervivencia de los pacientes con insuficiencia mitral primaria.
- •
Selección de los criterios para definir a los pacientes que pueden responder a la reparación percutánea «borde con borde» en la insuficiencia mitral primaria (criterios de gravedad, concepto de «insuficiencia mitral desproporcionada»).
- •
El papel de nuevas opciones de tratamiento percutáneo (anuloplastia, técnicas combinadas de reparación, reemplazo valvular).
Estenosis mitral
17. Escalas para predecir los resultados y las complicaciones de la CMP, especialmente en la insuficiencia mitral grave.
18. El papel del implante percutáneo de válvula mitral para pacientes con riesgo alto, sobre todo con estenosis mitral degenerativa grave y calcificación del anillo mitral.
Insuficiencia tricuspídea
19. Cuantificación de la gravedad de la insuficiencia tricuspídea y evaluación de la función del VD.
20. Más investigación para evaluar el papel de las intervenciones:
- •
Criterios para decidir el momento más adecuado para la cirugía en la insuficiencia tricuspídea primaria.
- •
Evidencia sobre el impacto clínico, la modalidad de tratamiento y el momento para implementarlo en la insuficiencia tricuspídea secundaria, grave y aislada.
- •
Criterios sobre la cirugía de válvula tricúspide concomitante a la cirugía del lado izquierdo para pacientes sin insuficiencia tricúspide grave.
- •
Resultados e indicaciones del tratamiento percutáneo de válvula tricúspide.
Valvulopatías combinadas y múltiples
21. Más investigación sobre el impacto en los resultados y las modalidades de intervención percutánea para definir adecuadamente las indicaciones de la intervención.
Embarazo
22. Régimen de tratamiento antitrombótico óptimo para gestantes portadoras de prótesis valvulares mecánicas.
Cirugía no cardiaca
23. Evaluación del papel del «TAVI urgente» para el tratamiento de los pacientes con estenosis aórtica grave que se someten a cirugía no cardiaca.
16MENSAJES CLAVE DE LA GUÍA SOBRE QUÉ HACER Y QUÉ NO| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones sobre el tratamiento de la enfermedad coronaria en pacientes con valvulopatía | ||
| Diagnóstico de EC | ||
| Se recomienda la coronariografía antes de la cirugía valvular para los pacientes con valvulopatías y 1 de los siguientes factores:• Antecedente de enfermedad cardiovascular• Sospecha de isquemia miocárdica• Disfunción sistólica del VI• Varones de más de 40 años y mujeres posmenopáusicas• Uno o más factores de riesgo cardiovascular | I | C |
| Se recomienda la coronariografía para la evaluación de la insuficiencia mitral secundaria grave | I | C |
| Indicaciones para la revascularización miocárdica | ||
| Se recomienda la CABG para los pacientes con una indicación primaria de cirugía valvular aórtica, mitral o tricúspide y estenosis coronaria ≥ 70% del diámetro | I | C |
| Recomendaciones sobre el tratamiento de la fibrilación auricular en pacientes con enfermedad de válvula nativa | ||
| Anticoagulación | ||
| Para la prevención del ictus en pacientes con FA candidatos a ACO, se recomiendan los NACO en lugar de AVK para los pacientes con estenosis o insuficiencia aórtica o mitral | I | A |
| No se recomiendan los NACO para los pacientes con FA y estenosis mitral moderada o grave | III | C |
| Recomendaciones sobre las indicaciones para cirugía en (A) la insuficiencia aórtica grave y (B) el aneurisma en la raíz aórtica o el aneurisma en la aorta ascendente tubular (cualquiera sea la gravedad de la insuficiencia aórtica) | ||
| A. Insuficiencia aórtica grave | ||
| La cirugía está indicada para pacientes sintomáticos, independientemente de la función del VI | I | B |
| La cirugía está indicada para pacientes asintomáticos con DTSVI > 50mm o DTSVI > 25mm/m2 de ASC (en pacientes con tamaño corporal pequeño) o FEVI en reposo ≤ 50% | I | B |
| La cirugía está indicada para pacientes sintomáticos o asintomáticos con insuficiencia aórtica grave que van a someterse a CABG o cirugía de la aorta ascendente u otra válvula | I | C |
| B. Aneurisma en la raíz aórtica o aneurisma en la aorta ascendente tubular (cualquiera sea la gravedad de la insuficiencia aórtica) | ||
| Se recomienda el reemplazo de la raíz aórtica conservando la válvula para pacientes jóvenes con dilatación de la raíz aórtica, siempre que se lleve a cabo en centros con experiencia y se esperen resultados duraderos | I | B |
| La cirugía de la aorta ascendente está indicada para pacientes con síndrome de Marfan y enfermedad de la raíz aórtica con un diámetro máximo de aorta ascendente ≥ 50mm | I | C |
| Recomendaciones sobre las indicaciones para la intervención en la estenosis aórtica sintomática y asintomática y modalidades recomendadas de intervención | ||
| A. Estenosis aórtica sintomática | ||
| Se recomienda intervenir a los pacientes con estenosis aórtica sintomática grave con gradiente alto (gradiente medio ≥ 40mmHg, velocidad pico ≥ 4,0m/s y área valvular ≤ 1,0 cm2 o ≤ 0,6 cm2/m2) | I | B |
| Se recomienda intervenir a los pacientes sintomáticos con estenosis aórtica grave con flujo bajo (IVL ≤ 35ml/m2), gradiente bajo (< 40mmHg), fracción de eyección reducida (< 50%) y evidencia de reserva de flujo (o reserva contráctil) | I | B |
| No se recomienda intervenir a los pacientes con comorbilidades graves cuando no sea probable que la intervención mejore la calidad de vida o prolongue la supervivencia más de 1 año | III | C |
| B. Pacientes asintomáticos con estenosis aórtica grave | ||
| Se recomienda intervenir a los pacientes asintomáticos con estenosis aórtica grave y disfunción sistólica del VI (FEVI < 50%) que no se debe a otra causa | I | B |
| Se recomienda intervenir a los pacientes asintomáticos con estenosis aórtica grave y desarrollo de síntomas durante la prueba de esfuerzo | I | C |
| C. Modalidad de intervención | ||
| Las intervenciones de válvula aórtica deben hacerse en centros especializados en valvulopatías que declaren su experiencia y sus resultados, dispongan de cardiología intervencionista y cirugía cardiaca en el propio centro y de un equipo cardiológico estructurado y colaborativo | I | C |
| La elección de la intervención quirúrgica o percutánea debe basarse en la evaluación minuciosa del equipo cardiológico de los factores clínicos, anatómicos y técnicos, sopesando los riesgos y los beneficios de cada estrategia para el paciente individual. La recomendación del equipo cardiológico debe discutirse con el paciente para que pueda tomar una decisión informada sobre las opciones de tratamiento | I | C |
| El RQVA está recomendado para pacientes de edad menos avanzada y con riesgo quirúrgico bajo (< 75 años y STS-PROM o EuroSCORE II < 4%) o para pacientes operables que no son candidatos a TAVI transfemoral | I | B |
| El RQVA está recomendado para pacientes de edad menos avanzada y con riesgo quirúrgico bajo (< 75 años y STS-PROM o EuroSCORE II < 4%) o para pacientes operables que no son candidatos a TAVI transfemoral | I | B |
| El TAVI está recomendado para pacientes de edad avanzada (≥ 75 años) o con riesgo quirúrgico alto (STS-PROM o EuroSCORE II > 8%) o que no son candidatos a cirugía | I | A |
| Para los demás pacientes, se recomienda RQVA o TAVI dependiendo de las características clínicas, anatómicas y técnicas individuales | I | B |
| D. Cirugía aórtica concomitante a otra cirugía cardiaca o de aorta ascendente | ||
| El RQVA está recomendado para pacientes con estenosis aórtica grave sometidos a CABG o cirugía de la aorta ascendente o de otra válvula | I | C |
| Recomendaciones sobre las indicaciones para la intervención en la insuficiencia mitral primaria grave | ||
| La reparación de válvula mitral es la técnica quirúrgica recomendada cuando se esperen resultados duraderos | I | B |
| La cirugía está indicada para pacientes sintomáticos que sean operables y no tengan riesgo alto | I | B |
| La cirugía está indicada para pacientes asintomáticos con disfunción del VI (DTSVI ≥ 40mm o FEVI ≤ 60%) | I | B |
| Recomendaciones sobre las indicaciones para la intervención de válvula mitral en la insuficiencia mitral secundaria, crónica y grave | ||
| La cirugía o la intervención percutánea valvulares están indicadas solo para pacientes con insuficiencia mitral secundaria grave que siguen sintomáticos pese al tratamiento médico óptimo basado en las GPC (incluida la TRC si está indicada); un equipo cardiológico estructurado y colaborativo debe tomar la decisión sobre el tratamiento | I | B |
| Pacientes con enfermedad coronaria u otra cardiopatía concomitante que requiere tratamiento | ||
| La cirugía valvular está indicada para pacientes sometidos a CABG u otro procedimiento quirúrgico cardiaco | I | B |
| Recomendaciones sobre las indicaciones para la comisurotomía mitral percutánea y la cirugía de válvula mitral en la estenosis mitral clínicamente relevante (moderada o grave; área valvular ≤ 1,5 cm2) | ||
| La CMP está indicada para pacientes sintomáticos sin características desfavorables para este procedimiento | I | B |
| La CMP está recomendada para todo paciente sintomático con contraindicaciones o alto riesgo quirúrgico | I | C |
| La cirugía de válvula mitral está indicada para pacientes sintomáticos que no son candidatos a CMP, en ausencia de futilidad | I | C |
| Recomendaciones sobre las indicaciones para la intervención en la valvulopatía triscuspídea | ||
| Recomendaciones en la estenosis tricuspídea | ||
| La cirugía está indicada para pacientes sintomáticos con estenosis tricuspídea grave | I | C |
| La cirugía está indicada para pacientes con estenosis tricuspídea grave que van a someterse a una intervención de válvula izquierda | I | C |
| Recomendaciones en la insuficiencia tricuspídea primaria | ||
| La cirugía está indicada para pacientes con insuficiencia tricuspídea primaria grave que van a someterse a una intervención de válvula izquierda | I | C |
| La cirugía está indicada para pacientes sintomáticos con insuficiencia tricuspídea primaria grave aislada sin disfunción grave del VD | I | C |
| Recomendaciones en la insuficiencia tricuspídea secundaria | ||
| La cirugía está indicada para pacientes con insuficiencia tricuspídea secundaria grave que van a someterse a cirugía de válvula izquierda | I | B |
| Recomendaciones sobre la selección de válvulas protésicas | ||
| Prótesis mecánicas | ||
| Se recomienda una prótesis mecánica según el deseo del paciente informado siempre que no haya contraindicaciones para la anticoagulación a largo plazo | I | C |
| Se recomienda la prótesis mecánica para pacientes con riesgo de deterioro estructural de la válvula acelerado | I | C |
| Prótesis biológicas | ||
| Se recomienda una bioprótesis según el deseo del paciente informado | I | C |
| Se recomienda una bioprótesis cuando una anticoagulación adecuada sea improbable (por problemas de adherencia, falta de disponibilidad) o esté contraindicada debido a un riesgo hemorrágico alto (hemorragia mayor previa, comorbilidades, negación del paciente, problemas de adherencia, estilo de vida, empleo) y para pacientes cuya esperanza de vida sea inferior a la durabilidad estimada de la bioprótesis | I | C |
| Se recomienda una bioprótesis en los casos de reoperación por trombosis de válvula mecánica a pesar de un buen control de la anticoagulación crónica. | I | C |
| Recomendaciones sobre el tratamiento antitrombótico perioperatorio y posoperatorio en el implante de prótesis o la reparación valvular | ||
| Tratamiento antitrombótico perioperatorio | ||
| Se recomienda suspender el tratamiento con AVK en el momento adecuado antes de la cirugía electiva con un objetivo de INR < 1,5 | I | C |
| Cuando sea necesario interrumpir la anticoagulación oral, se recomienda el tratamiento puente para los pacientes con cualquiera de las siguientes indicaciones:• Prótesis valvular mecánica• FA con estenosis mitral significativa• FA con CHA2DS2-VASc ≥ 3 las mujeres o ≥ 2 los varones• Complicación trombótica aguda en las 4 semanas anteriores• Riesgo alto de complicación tromboembólica aguda | I | C |
| Se recomienda el tratamiento puente con dosis terapéuticas de HNF o HBPM subcutánea | I | B |
| Para pacientes con prótesis valvular mecánica, se recomienda reiniciar el tratamiento con AVK el primer día del posoperatorio | I | C |
| Para pacientes sometidos a cirugía valvular que tienen una indicación de tratamiento puente posoperatorio, se recomienda iniciar la administración de HNF o HBPM a las 12-24h de la cirugía | I | C |
| Para pacientes sometidos a cirugía, se recomienda mantener el tratamiento con ácido acetilsalicílico, si está indicado, durante el periodo perioperatorio | I | C |
| Para pacientes con TAPD tras una ICP reciente (≤ 1 mes) que requieren cirugía valvular, en ausencia de una indicación de ACO, se recomienda reiniciar el tratamiento con un inhibidor del P2Y12 tan pronto como disminuya el riesgo hemorrágico | I | C |
| Pacientes con una indicación de tratamiento antiagregante concomitante | ||
| Tras una ICP o SCA sin complicaciones en pacientes que requieren ACO crónica, se recomienda la interrupción temprana (≤ 1 semana) del ácido acetilsalicílico y continuar con tratamiento doble con ACO y un inhibidor del P2Y12 (preferiblemente clopidogrel) durante 6 meses (o 12 meses en los SCA), si el riesgo de trombosis del stent es bajo o si prevalece el riesgo hemorrágico sobre el riesgo de trombosis del stent, independientemente del tipo de stent implantado | I | B |
| Se recomienda suspender a los 12 meses el tratamiento antiagregante plaquetario de los pacientes tratados con ACO | I | B |
| Reemplazo valvular quirúrgico | ||
| Está recomendada la ACO crónica con un AVK para todos los pacientes con prótesis valvulares mecánicas | I | B |
| Para pacientes tratados con un AVK, se recomienda el autocontrol del INR siempre que se proporcione la adecuada formación al paciente y se haga un control de calidad | I | B |
| Se recomienda ACO para los pacientes sometidos a implante quirúrgico de bioprótesis que tienen otras indicaciones para la anticoagulación | I | C |
| Los NACO no están indicados para pacientes con prótesis valvulares mecánicas | III | B |
| Implante percutáneo de válvula aórtica | ||
| La ACO crónica está indicada para los pacientes con TAVI que tienen otras indicaciones para la anticoagulación | I | B |
| Está indicado el tratamiento antiagregante plaquetario simple crónico para los pacientes con TAVI que no tienen indicaciones basales para la anticoagulación | I | A |
| No está indicada la administración sistemática de ACO para los pacientes con TAVI que no tienen indicaciones basales para la anticoagulación | III | B |
| Recomendaciones sobre el tratamiento de la disfunción de válvulas protésicas | ||
| Trombosis de prótesis mecánicas | ||
| Se recomienda el reemplazo valvular urgente o emergente para la trombosis obstructiva en pacientes críticos sin comorbilidad grave | I | B |
| Trombosis de bioprótesis | ||
| Se recomienda la anticoagulación con un AVK o HNF para la trombosis de bioprótesis antes de considerar la reintervención | I | C |
| Hemolisis y fuga paravalvular | ||
| Se recomienda reoperar si la fuga paravalvular está relacionada con endocarditis o causa hemolisis que requiere transfusiones sanguíneas repetidas o produce síntomas graves de insuficiencia cardiaca | I | C |
| Disfunción de bioprótesis | ||
| Se recomienda reintervenir a los pacientes sintomáticos que presentan un aumento significativo del gradiente transprotésico (tras excluir una trombosis valvular) o insuficiencia grave | I | C |
ACO: anticoagulación oral; ASC: área de superficie corporal; AVK: antagonistas de la vitamina K; CABG: cirugía de revascularización coronaria; CMP: comisurotomía mitral percutánea; DTSVI: diámetro telesistólico del VI; EC: enfermedad coronaria; EuroSCORE: European System for Cardiac Operative Risk Evaluation; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; GPC: guías de práctica clínica; HBPM: heparina de bajo peso molecular; HNF: heparina no fraccionada; ICP: intervención coronaria percutánea; INR: cociente internacional normalizado; IVL: índice volumen-latido; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; RQVA: reemplazo quirúrgico de válvula aórtica; SCA: síndrome coronario agudo; STS-PROM: Society of Thoracic Surgeons-predicted risk of mortality; TAPD: tratamiento antiagregante plaquetario doble; TAVI: implante percutáneo de válvula aórtica; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho; VI: ventrículo izquierdo.
El material adicional, con tablas, figuras y texto que complementan el texto principal, solo está disponible en inglés y en formato electrónico en la página web de European Heart Journal y la página web de la ESC en: www.escardio.org/guidelines.
18FILIACIÓN DE LOS AUTORES Y MIEMBROS DEL GRUPO DE TRABAJOFiliaciones de los autores y miembros del grupo de trabajo
Fabien Praz, Department of Cardiology, Bern University Hospital, University of Bern, Berna, Suiza; Milan Milojevic1, Department of Cardiac Surgery and Cardiovascular Research, Dedinje Cardiovascular Institute, Belgrado, Serbia y Department of Cardiothoracic Surgery, Erasmus University Medical Center, Rotterdam, Países Bajos; Stephan Baldus, Heart Centre, Department of Cardiology, University Hospital Cologne, Colonia, Alemania; Johann Bauersachs, Department of Cardiology and Angiology, Hannover Medical School, Hannover, Alemania; Davide Capodanno, Division of Cardiology, Azienda Ospedaliero Universitaria Policlinico Gaspare Rodolico-San Marco, Catania, Italia; Lenard Conradi1, Department of Cardiovascular Surgery, University Heart and Vascular Centre Hamburg, Hamburgo, Alemania; Michele De Bonis1, Department of Cardiac Surgery, IRCCS San Raffaele Hospital, Vita-Salute San Raffaele University, Milán, Italia; Ruggero De Paulis1, Cardiac Surgery Department, European Hospital, Unicamillus International Medical University, Roma, Italia; Victoria Delgado, Cardiology, Leiden University Medical Centre, Leiden, Países Bajos; Nick Freemantle1, Institute of Clinical Trials and Methodology, University College London, Londres, Reino Unido; Martine Gilard, Cardiology, Brest University Hospital, Brest, Francia; Kristina H. Haugaa, Department of Cardiology, Oslo University Hospital and University of Oslo, Oslo, Noruega; Anders Jeppsson1, Department of Cardiothoracic Surgery, Sahlgrenska University Hospital, Gotemburgo, Suecia; Peter Jüni, Applied Health Research Centre (AHRC), Li Ka Shing Knowledge Institute of St. Michael's Hospital, Department of Medicine and Institute of Health Policy, Management and Evaluation, University of Toronto, Toronto, Canadá; Luc Pierard, Cardiology, University of Liège, Lieja, Bélgica; Bernard D. Prendergast, Department of Cardiology, St Thomas’ Hospital and Cleveland Clinic London, Londres, Reino Unido; J. Rafael Sádaba1, Departmento de Cirugía Cardiaca, Complejo Hospitalario de Navarra, Pamplona, España; Christophe Tribouilloy, Department of Cardiology, Amiens University Hospital, Amiens, Francia, y Wojtek Wojakowski, Cardiology and Structural Heart Diseases, Medical University of Silesia, Katowice, Polonia.
19ANEXOGRUPO PARA LA ELABORACIÓN DE DOCUMENTOS CIENTÍFICOS DE LA ESC
Incluye a los revisores del documento y las Sociedades de Cardiología de la ESC.
Referencias no citadasRepresentantes de la European Association for Cardio-Thoracic Surgery (EACTS).La filiación de los autores y los miembros del Grupo de Trabajo se recoge en el anexo.La lista de miembros del Comité de la ESC para la elaboración de Guías de Práctica Clínica y los revisores de las sociedades nacionales se recoge en el anexo.La lista de miembros del Consejo de la EACTS se recoge en el anexo.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association for Acute CardioVascular Care (ACVC), European Association of Cardiovascular Imaging (EACVI), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Consejos: Council on Valvular Heart Disease.Grupos de Trabajo: Cirugía Cardiovascular, Trombosis.Foro de pacientesEl contenido de esta guía de práctica clínica (GPC) de la ESC/EACTS se ha publicado exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC y la EACTS. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal y representante autorizado de la ESC para tales permisos (journals.permissions@oup.com).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC/EACTS y se ha elaborado tras el estudio minucioso de los datos y la evidencia disponibles hasta la fecha. La ESC y la EACTS no son responsables en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC/EACTS y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, la GPC de la ESC/EACTS no exime al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos.Este documento se ha publicado con permiso de European Heart Journal y European Journal of Cardio-Thoracic Surgery.© The European Society of Cardiology y European Association for Cardio-Thoracic Surgery 2021. Reservados todos los derechos. Ambos documentos son idénticos a excepción de diferencias menores relativas al estilo y la ortografía para mantener el estilo de ambas publicaciones. Puede emplearse cualquiera de las dos referencias a la hora de citar este artículo. Para la solicitud de autorizaciones, contacte con: journals.permissions@oup.com.Las declaraciones de conflicto de intereses de los expertos que participaron en el desarrollo de esta guía se recogen en un informe publicado simultáneamente en el documento de material adicional. Este informe también está disponible en la página web de la ESC (www.escardio.org/guidelines). El anexo de material adicional, solo disponible online y en inglés, incluye información básica y discusiones detalladas sobre los datos que sirven de base a esta guía y está disponible en la página web de European Heart Journal.Palabras clave:Guía de práctica clínica • Valvulopatías • Cirugía cardiaca valvular • Intervención percutánea valvular • Insuficiencia aórtica • Estenosis aórtica • Insuficiencia mitral • Estenosis mitral • Insuficiencia tricuspídea • Estenosis tricuspídea • Válvulas cardiacas protésicas