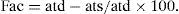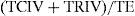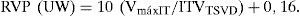La función del ventrículo derecho tiene un importante papel en la morbilidad y la mortalidad de los pacientes sometidos a cirugía cardiaca. En este artículo se hace una revisión de las diferentes herramientas diagnósticas disponibles en quirófano, entre las que destacan la visión directa del corazón, la ecocardiografía en sus distintas modalidades (transesofágica, epicárdica), el estudio hemodinámico invasivo con el catéter de Swan-Ganz y, en casos de infarto del ventrículo derecho, el electrocardiograma. Los diferentes métodos diagnósticos disponibles son complementarios y no excluyentes, ya que cada uno de ellos aporta información que subsana las limitaciones de los diferentes sistemas de monitorización hemodinámica.
Palabras clave
La función del ventrículo derecho (VD) tiene un importante papel en la morbilidad y la mortalidad de los pacientes sometidos a cirugía cardiaca (CC). La aparición de insuficiencia ventricular derecha (IVD) grave que requiere soporte inotrópico prolongado o la inserción de asistencia ventricular derecha se calcula en alrededor de un 0,1% después de una cardiotomía; tras el trasplante cardiaco se eleva a un 2–3%; tras asistencia ventricular, a un 20–30%, y cuando la IVD se hace refractaria al tratamiento, conlleva una elevada mortalidad (70–75%)1. Nos podemos encontrar intraoperatoriamente con diferentes situaciones de IVD: IVD aislada, IVD debida a afección izquierda o IVD coincidente con disfunción ventricular izquierda. Las principales causas de IVD en CC son múltiples (tabla 1)2.
Causas de insuficiencia ventricular derecha en cirugía cardiaca
| Mecanismos de IVD postoperatoria | Etiología específica |
| Disfunción preexistente del VD | Disfunción preoperatoria del VD asociada a HTP/congénito/valvular/enfermedad coronaria |
| Infarto de miocardio del VD | Embolia coronaria (aire, trombo), oclusión trombótica, disfunción del injerto |
| Disfunción miocárdica posquirúrgica | Protección miocárdica subóptima. Tiempo bypass cardiopulmonar largo |
| Hipertensión pulmonar postoperatoria | Hipertensión pulmonar preexistente |
| Daño isquemia-reperfusión | |
| Embolia pulmonar | |
| Insuficiencia ventricular izquierda | |
| Excesiva transfusión de sangre | |
| Obstrucción dinámica del TSVD | Depleción de volumen, alta dosis de inotrópicos |
| Excesivo aporte de volumen del VD | Excesivas transfusiones o infusión volumen |
| Regurgitación tricuspídea grave | |
| Disfunción aguda del VI | Tras colocación de asistencia ventricular izquierda |
| Trasplante | Hipertensión pulmonar |
| Prolongación del tiempo de isquemia | |
| Rechazo agudo | |
| Obstrucción de la anastomosis de arteria pulmonar | |
| Constricción pericárdica | Síndrome tras cardiotomía |
HTP: hipertensión pulmonar; IVD: insuficiencia del ventrículo derecho; TSVD: tracto de salida del ventrículo derecho; VI: ventrículo izquierdo.
El diagnóstico precoz de la IVD es fundamental. El diagnóstico intraoperatorio de la disfunción del VD se realiza mediante ecocardiografía, pero la combinación de diferentes técnicas nos permitirá determinar con más exactitud la etiología, el perfil hemodinámico que se presenta y cuál es el componente principal que genera la inestabilidad hemodinámica; también nos permite seleccionar adecuadamente el tratamiento y valorar el grado de respuesta a dichas medidas.
Entre las diferentes herramientas diagnósticas disponibles en quirófano, destacan la ecocardiografía en sus diferentes modalidades (transesofágica, epicárdica, 3D), la visión directa del corazón, donde observamos la existencia de dilatación VD o alteraciones de la contractilidad, el estudio hemodinámico invasivo con el catéter de Swan-Ganz (SG) y, en casos de infarto del VD, la electrocardiografía.
Valoración ecocardiográfica del ventrículo derechoLa ecocardiografía transesofágica (ETE) es fundamental en el estudio de la estructura y la función del VD (incluidas las funciones sistólica y diastólica), la estructura de la válvula y la arteria pulmonares, la función valvular y la fisiología pericárdica3,4.
Existen diferentes guías y recomendaciones que ayudan al conocimiento ecocardiográfico del VD4–7, aunque también presenta importantes limitaciones para el estudio ecocardiográfico8,9:
- •
Dificultad en la estimación del volumen del VD debido a:
- –
Morfología. Ausencia de modelos geométricos que reproduzcan la morfología del VD.
- –
Las cámaras de entrada y salida se sitúan en distintos planos ecocardiográficos.
- –
Dificultad para delinear el borde endocárdico debido a la gran trabeculación de su pared.
- –
- •
Dificultad para estandarizar el método de evaluación de la función del VD:
- –
Son frecuentes las variaciones en la dirección o localización del VD.
- –
Se ve afectada con facilidad por variaciones de precarga, poscarga y función del VI. Esta dificultad cobra gran importancia en la cirugía cardiaca, ya que las grandes variaciones de la precarga que se producen en sus distintas fases interfieren enormemente en la valoración de la función del VD.
- –
- •
Dificultad para una correcta visualización de las cámaras derechas desde el acceso transesofágico, ya que las cavidades derechas son las más lejanas al transductor. Los planos en que se basa la valoración de las dimensiones y la función del VD no son siempre accesibles con ETE.
A pesar de las dificultades y con el uso de diferentes planos y métodos, la ETE permite estudiar el conjunto de las cavidades derechas. Los parámetros más utilizados por la ETE para el estudio del VD se incluyen en la tabla 2. Los planos esofágicos a nivel superior, medio e inferior, así como el acceso transgástrico, aportan información sobre el tamaño, la morfología y la función del VD2.
Valoración ecocardiográfica de la función del ventrículo derecho
| Dimensiones | Diámetro basal, medio y longitudinal (medioesofágico de cuatro cámaras) TSVD1 (plano aórtico) y TSVD2 (plano pulmonar) en eje corto medioesofágico |
| Función sistólica | Fracción de acortamiento del área (plano medioesofágico de cuatro cámaras) |
| TAPSE | |
| Velocidad sistólica anular (s’) | |
| Aceleración miocárdica durante la contracción isovolumétrica: IVA | |
| Strain y strain rate | |
| Función sistólica/diastólica | Índice Tei (general y tisular), relación E/e’ |
| Fracción de eyección y volúmenes | Ecografía 3D en tiempo real con software específico |
IVA: isovolumic acceleration; TAPSE: Tricuspid Annular Plane Systolic Excursion; TSVD: tracto de salida del ventrículo derecho.
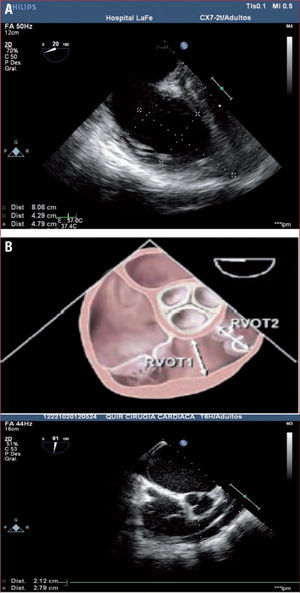
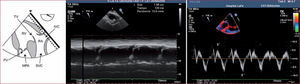
Las dimensiones del VD se determinan en el plano medioesofágico de cuatro cámaras con tres determinaciones: diámetro basal, medio y longitudinal. Además, en el eje corto de grandes vasos se mide el tracto de salida del VD (TSVD) en sus dos medidas habituales, la del plano valvular aórtico (TSVD1) y por debajo del plano valvular pulmonar (TSVD2), como muestra la10figura 1. Los puntos de corte quedan reflejados en la tabla 3.
Dimensiones del ventrículo derecho: puntos de corte
| Dimensiones | Puntos de corte |
| VD basal | > 42mm |
| VD medio | > 35mm |
| VD longitudinal | > 86mm |
| TSVD1 | > 33mm |
| TSVD2 | > 27mm |
TSVD1: tracto de salida del ventrículo derecho plano valvular aórtico; TSVD2: tracto de salida del ventrículo derecho por debajo del plano valvular pulmonar; VD: ventrículo derecho.
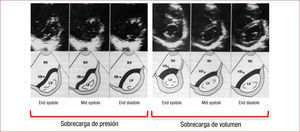
Otro parámetro que puede aportar información es el índice de excentricidad del VI (fig. 2). El aplanamiento o desplazamiento de septo interventricular hacia el VI como consecuencia de la sobrecarga del VD puede medirse con este parámetro que, además, sirve para diferenciar si la sobrecarga es diastólica o sistólica. Consiste en la relación simple entre el diámetro anteroposterior y el septolateral del VI a nivel medioventricular, que puede medirse desde el acceso transgástrico. En un corazón normal, la morfología del VI es circular, por lo que el índice será 1. En el caso de la sobrecarga del VD, se produce un aplanamiento e incluso un desplazamiento del septo hacia el VI. Este desplazamiento se traduce en un índice > 1 que, en el caso de la sobrecarga de volumen, se produce en diástole y se normaliza en sístole. En el caso de la sobrecarga de presión, el índice es > 1 durante todo el ciclo, pero en sístole se produce la mayor deformidad por el mayor desplazamiento del septo4.
Índice de excentricidad del ventrículo izquierdo. Tomado de Rudski et al4.
Como ya se ha mencionado, la valoración ecocardiográfica de la función del VD presenta importantes dificultades. De los métodos existentes hoy, no todos son de fácil aplicación en el entorno de la cirugía cardiaca; además, existe escasa literatura al respecto. Por ello, es nuestro objetivo analizar los métodos existentes y valorar desde nuestra experiencia y la literatura existente qué puede aportar cada uno y cuál puede ser su utilidad práctica.
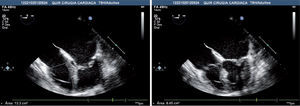
Fracción acortamiento área (Fac)Es la relación porcentual de la diferencia entre el área planimetrada en telediástole (atd) menos el área en telesístole (ats) dividido por el área en telediástole (fig. 3):
Con el estudio transesofágico se pueden obtener estas áreas desde el plano medioesofágico de cuatro cámaras. Diversos estudios han mostrado la buena correlación de este método con la función ventricular determinada por resonancia magnética cardiaca (RMC) o ventriculografía isotópica9,10.
Una de las mayores dificultades de este método es la de delinear adecuadamente el borde endocárdico trabeculado del ápex del VD y conseguir desde el acceso transesofágico visualizar correctamente el VD en toda su extensión, incluido el ápex. Otro problema, inherente en cualquier caso a muchos de los métodos analizados, es la dependencia de la precarga. De todos modos, y desde nuestra experiencia, es uno de los métodos factibles en el entorno de la cirugía, aunque no está exento de dificultad.
Por debajo de una Fac de área del 35% se considera que hay una depresión significativa de la función sistólica.
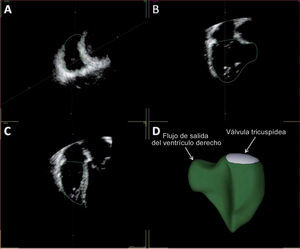
Fracción de eyección. Estimación tridimensional de volúmenes de ventrículo derechoLa nueva generación de transductores transesofágicos permite la representación tridimensional del VD y, con un software específico, la determinación de los volúmenes telediastólico y telesistólico y la fracción de eyección (FE) del VD (fig. 4). Esta técnica ha mostrado en la mayoría de los estudios una excelente correlación con la FE medida por RMC11–16, aunque algunos han referido subestimación17 e incluso sobrestimación de la FE respecto a la RMC18–22. Estas discrepancias se resolvieron con un metanálisis, publicado en 201023, que mostró la subestimación de los volúmenes telediastólico y, en menor medida, telesistólico, fundamentalmente en dos subgrupos de pacientes: jóvenes (< 18 años) y sujetos con volúmenes ventriculares grandes (volúmenes telediastólicos > 200ml). En cambio, no hubo diferencias significativas respecto a la estimación de la FE.
Estudio por ecocardiografía 3D. Evaluación de volumen y fracción de eyección del ventrículo derecho mediante ecocardiografía 3D en tiempo real. El software muestra tres planos: sagital (A), coronal (B) y cuatro cámaras (C). En D se muestra la reconstrucción del ventrículo derecho (TomTec®).
A las dificultades generales de delineación del borde endocárdico y adecuada visualización del VD, se añade en este método el tiempo necesario para la reconstrucción 3D del VD y la realización de los cálculos. No obstante, se ha publicado al menos un estudio, de Fusini et al24, destinado a demostrar que es posible utilizar este método en el ámbito intraoperatorio con buenas correlaciones con los resultados obtenidos con ecografía 3D transtorácica.
Valoración no volumétrica del ventrículo derechoLa valoración no volumétrica de la función del VD comprende distintos métodos que pueden englobarse en dos grupos: los que valoran la función general y los que valoran la contractilidad de una región del ventrículo asumiendo que la función de un segmento es representativa de la de todo el VD, lo que no siempre es cierto.
Dentro de la valoración general se consideran dos métodos: el cálculo del dp/dt, muy poco utilizado, y el método Tei (índice Tei o índice de comportamiento miocárdico, también conocido por sus siglas inglesas MPI o RMPI).
En cuanto a la valoración regional, analizamos el desplazamiento sistólico del anillo tricúspide o TAPSE, los métodos derivados del Doppler tisular, como la velocidad de la onda sistólica s’ y la aceleración isovolumétrica (IVA), y el strain y el strain rate.
Índice TeiEs la relación entre la suma de los tiempos isovolumétricos y el tiempo de eyección, es decir, aporta una valoración general de las funciones sistólica y diastólica25:
donde TCIV es el tiempo de contracción isovolumétrica; TRIV, el tiempo de relajación isovolumétrica, y TE, el tiempo de eyección.Debe medirse con un intervalo RR constante, no es un método adecuado en aumentos de presión de AD (rápido equilibrio de presiones AD-VD → acortamiento del IVRT → falso acortamiento del Tei). El índice Tei se puede obtener por dos métodos: por Doppler pulsado y por Doppler tisular. En el primer caso, se registra el flujo de llenado del VD y se mide el tiempo desde el cierre a la apertura de la tricúspide en un plano de cuatro cámaras o, lo que es lo mismo, si hay regurgitación tricuspídea, su duración, y el tiempo de eyección del VD en un plano medioesofágico corto. Al restar del tiempo de cierre de la tricúspide el tiempo de eyección, se obtendrá la suma de los tiempos isovolumétricos, y solo queda dividirlos por el tiempo de eyección para obtener el índice Tei.
Cuando se utiliza el Doppler tisular, la medida del tiempo de eyección es la duración de la onda s’, y se puede medir los tiempos isovolumétricos directamente u obtenerlos de la diferencia entre el tiempo de cierre de la tricúspide (fin de A’-inicio de E’) y la duración de s’. La ventaja fundamental de este método sobre el pulsado es que todas las mediciones se llevan a cabo en un solo latido, y con el Doppler pulsado hay que intentar que los intervalos RR sean similares para la mayor exactitud del índice. Además, desde un acceso transesofágico, es más factible obtener un buen registro tisular desde un plano transgástrico profundo del segmento basal del VD que obtenerlo de un Doppler pulsado del TSVD. La figura 5 muestra cómo obtener un registro de Doppler tisular desde un plano transgástrico.
Registro de Doppler tisular y TAPSE desde un plano transgástrico profundo. Esquema tomado de Haddad et al2.
Muchos estudios han demostrado el valor pronóstico de este índice en distintas enfermedades26–31 y, además, es un método que evita asunciones geométricas. Es destacable, como se ha demostrado para el VI, que ambos métodos no son comparables e incluso sus valores de corte son distintos, > 0,40 para el Doppler pulsado y > 0,55 para el Doppler tisular.
Entre sus desventajas, la más importante es que no se puede utilizar con ritmos irregulares y, como recomiendan las guías, no se debería utilizar como una única medida de función ventricular derecha.
Desplazamiento sistólico del anillo tricúspide (TAPSE)Consiste en medir la altura del desplazamiento longitudinal del anillo lateral tricúspide en modo M. Es un método sencillo y reproducible, con un acreditado valor pronóstico y buena correlación con otros métodos de valoración del VD32,33. El punto de corte establecido es el de TAPSE < 16mm. El acceso transesofágico requiere un plano transgástrico para obtener una imagen adecuada del anillo y una orientación adecuada del modo M, ya que este método depende del ángulo, lo que complica mucho su determinación con ETE. A esta desventaja hay que añadir la inherente a su condición de método regional, que, como hemos comentado, presupone que la contractilidad regional es extrapolable a la general.
Respecto a este método y al que se describe a continuación —la determinación de la velocidad de la onda sistólica (s’)— en el contexto de la cirugía cardiaca, hay que destacar que se ha planteado en los últimos años que la contracción longitudinal del VD está alterada en los pacientes sometidos a cirugía cardiaca ya desde la misma incisión del pericardio34, sin que refleje en realidad un deterioro real de la función, ya que en estos estudios la determinación de la FE por ecografía 3D se mantiene normal35. Se desconoce la razón de este hecho y se han formulado diversas hipótesis que apuntan a cambios geométricos en el VD, más que a su deterioro funcional.
Velocidad de la onda sistólica tisularSe analiza la zona basal de la pared lateral del VD o el anillo lateral tricúspide; con la muestra del Doppler en esta localización, se obtiene el registro de la velocidad longitudinal sistólica o s’, como muestra la figura 5. Los valores normales en la población sana36 se sitúan en torno a 15cm/s; los valores < 10cm/s se consideran patológicos. Es un método simple y reproducible, con buena capacidad discriminatoria, pero es dependiente del ángulo y un método regional, con las limitaciones ya comentadas de ambos aspectos. El acceso transesofágico obliga a obtenerlo desde un plano transgástrico profundo (fig. 5).
Otros métodosLa aceleración isovolumétrica, el strain y el strain rate son poco aplicables en un entorno clínico y aún menos en el entorno de la cirugía cardiaca. En el caso del strain y el strain rate, además, hay pocos estudios y los puntos de corte no están bien definidos37.
Datos hemodinámicos aportados por la ecocardiografíaComo ya es conocido, la ecocardiografía aporta no solo una valoración morfofuncional del VD, sino también una estimación de parámetros hemodinámicos muy útiles en la monitorización del VD, como la presión sistólica de la arteria pulmonar (PsAP) a partir de la velocidad máxima de la regurgitación tricuspídea mediante la ecuación de Bernoulli simplificada (gradiente = 4v2), a la que se suma la presión de la aurícula derecha y el cálculo de resistencias pulmonares a partir del cociente entre la velocidad máxima de la insuficiencia tricuspídea (IT) y la integral velocidad-tiempo (ITV) del TSVD multiplicado por 10 más 0,16:
Estos cálculos tienen el inconveniente de la difícil alineación del flujo del TSVD en el ETE.
Función diastólica del ventrículo derechoEste es un aspecto poco estudiado y, en general, como en muchos otros aspectos, se asumen parámetros del VI, con el problema añadido de la gran influencia del ciclo respiratorio en el llenado del VD, ya que la inspiración ocasiona una elevación de la velocidad de onda E y un aumento del cociente E/A. Se ha analizado38 el patrón de llenado de forma similar al del VI con la relación E/A (< 0,8, alteración de la relajación; 0,8–2,1, normal o seudonormal, y > 2,1 con tiempo de deceleración < 120ms, patrón restrictivo). La relación E/E’ se ha analizado en diversos estudios como predictor de presiones de la aurícula derecha39,40.
Los estudios que analizan la utilidad clínica de estos parámetros son escasos y, en lo que nos concierne, que es la monitorización quirúrgica, no existen. De todos modos, a nuestro entender, es poco probable que aporten información relevante que sirva para tomar decisiones a corto plazo, pues estos parámetros se han usado para la detección precoz de la disfunción sistólica, ya que pueden preceder a su aparición.
En definitiva, los métodos más accesibles y sencillos son el TAPSE y la velocidad de s’, ambos con problemas en el ámbito de la cirugía cardiaca. Otro método muy utilizado es la Fac de área, quizá menos reproducible por las dificultades para obtener una adecuada visión del ápex. El método que se perfila como ideal es la determinación de los volúmenes y FE por ecografía 3D, pese a la ligera subestimación ya referida; este método tiene otro inconveniente, requiere un software especial, del que no todos los hospitales disponen, y tiempo para la reconstrucción tridimensional. El índice Tei presenta ventajas respecto a los previos, ya que es relativamente independiente de la precarga, lo que supone un problema importante en la valoración del VD, que es muy sensible a los cambios de carga; además, estos cambios son especialmente importantes en un paciente anestesiado y tras ser sometido a circulación extracorpórea, por lo que el índice Tei podría tener un valor añadido en este contexto.
Otro método diagnóstico disponible en el quirófano es la ecocardiografía epicárdica. Sin duda alguna, cada vez está más en desuso tras la introducción de la ETE, pero en ocasiones puede aportar ventajas41. La ecocardiografía epicárdica requiere la interrupción momentánea de la intervención quirúrgica, ya que la sonda debe aplicarse directamente a la superficie del corazón. Sus indicaciones se están limitando a la dificultosa posibilidad de la inserción de la sonda de ETE o a sus contraindicaciones. Algunos autores42 refieren que en situaciones específicas la ecocardiografía epicárdica puede ser superior a la ETE, ya que se reducen los artefactos y se facilita la consecución de imágenes de alta calidad.
Monitorización hemodinámica invasivaA pesar de que la ETE es una magnífica herramienta para el diagnóstico intraoperatorio de IVD, también presenta limitaciones como, por ejemplo: la medición del GC es dependiente del operador, la mala delimitación del área ventricular derecha, la ausencia de datos como presión venosa central (PVC), saturación venosa mixta (SvO2), resistencias vasculares pulmonares (RVP) y resistencias vasculares sistémicas (RVS), la monitorización semicontinua, el nivel de entrenamiento-formación, etc. Además, los incrementos de las presiones pulmonares, resistencias vasculares pulmonares, lesiones por isquemia-reperfusión, circulación extracorpórea, transfusiones de sangre, etc., pueden acarrear no solo dilatación del VD, sino que también se puede producir compresión del VI, lo que causa bajo gasto y, con ello, disminución de la perfusión del VD que conduzca a insuficiencia biventricular. Hemodinámicamente, la IVD se define: IC < 2,2l/min/m2, presión de aurícula derecha > 8–10mmHg, PAD/PCP > 0,8 (disfunción derecha sola), gradiente de presión VD-AP > 25mmHg (obstrucción del TSVD).
Han pasado más de 30 años desde la introducción del catéter SG como técnica de valoración hemodinámica. Aún se plantean dudas sobre la necesidad de su uso sistemático en CC por su posible relación con un aumento de la mortalidad. El catéter de SG proporciona datos hemodinámicos con una mayor sensibilidad diagnóstica que los datos clínicos de la IVD43–46. Además tiene mayor precisión en la estimación de la precarga que la PVC en pacientes con disfunción sistólica ventricular47. Autores como Chatterjee et al48 referencian las indicaciones del catéter de SG. A través del catéter de SG se determina de manera continua el GC, las presiones de la arteria pulmonar (PAP), PVC y SvO2. Además, da información de presión capilar pulmonar, consumo y aporte de O2, RVP, RVS, etc. Todos estos datos permiten tener información que influye en el manejo terapéutico de los pacientes.
Existen otros métodos diagnósticos, denominados «mínimamente invasivos», de medición del GC y la precarga que también pueden proporcionar información de la funcionalidad del VD49,50. Se basan en el análisis de la onda de pulso. En alguno de ellos, el sistema se calibra bien por termodilución transpulmonar (PiCCO), bien con dilución por litio (LiDCO plus). Otros sistemas miden el GC por análisis de la onda de pulso sin calibración previa (Lidco-rapid, FloTrac). Cada uno utiliza un software diferente. La termodilución transpulmonar (TDTP) es una variante del principio de termodilución utilizado por el catéter de la arteria pulmonar. Este método requiere un catéter venoso central convencional, al que se conecta externamente un sensor capaz de medir la temperatura de la solución inyectada y un catéter arterial femoral o axilar que, además de permitir la medición de la presión arterial, posee un sensor de temperatura en su extremo distal. La inyección venosa central de suero frío produce cambios en la temperatura de la sangre, medidos por el termistor arterial, con lo que se obtiene el GC mediante una ecuación modificada de la de Stewart- Hamilton.
Registro electrocardiográficoEntre las causas de IVD intraoperatoria está el infarto de ventrículo derecho (IAVD). Una aproximación diagnóstica de IVD en quirófano se da por cambios en el segmento ST, alteraciones en la conducción auriculoventricular y trastornos del ritmo. Siempre que sea posible, realizar un ECG de 12 derivaciones ayuda al diagnóstico, teniendo en cuenta que la elevación del segmento ST > 1mm en V3R y V4R es de gran utilidad para establecer el diagnóstico de IAVD. La elevación del segmento ST > 0,5mm en la derivación V4R indica IAVD, y cuando se considera que la elevación del segmento ST es > 1mm estos porcentajes se incrementan51,52.
ConclusionesLa exploración intraoperatoria del VD supone una gran dificultad. La visión directa del corazón es la medida que más se ajusta a los datos clínicos observados. La ETE informa de las alteraciones geométricas y la función del VD, pero tiene limitaciones intraoperatorias debidas a la compleja anatomía y las consecuencias de la circulación extracorpórea. La ecocardiografía epicárdica se podría utilizar en caso de dificultad o contraindicación de la colocación de una sonda ETE. La ecocardiografía 3D supondrá en un futuro un gran avance. Solo la valoración conjunta de distintos parámetros, así como de otras técnicas, permitirá una valoración correcta de la situación del VD y la etiología de lo que le sucede. No obstante, dado lo accesible de la técnica y pese a las dificultades de adquisición e interpretación, la ecocardiografía es de gran valor en el diagnóstico de la disfunción del VD y la etiología de esta. La monitorización con métodos invasivos con catéter de SG permite obtener información de PAP, RVP, GC y PVC. La monitorización volumétrica con termodilución transpulmonar define adecuadamente la precarga. La electrocardiografía puede informar en determinados casos de la existencia de IAVD intraoperatorio. Todos los métodos de monitorización disponibles deben ser complementarios y no excluyentes, ya que cada uno de ellos aporta ventajas que subsanan las limitaciones de los diferentes sistemas de monitorización hemodinámica.
Conflicto de interesesNinguno.