Mujer de 40 años que, tras ingresar en la unidad de cuidados intensivos por neumonía por coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2), sufrió un accidente cerebrovascular (ACV) en la arteria cerebral media izquierda. La tomografía computarizada (TC) craneal evidenció oclusión focal de M1, por lo que se realizó trombectomía mecánica. La ecografía de extremidades inferiores descartó trombosis. Sin embargo, la ecografía transtorácica (ETT) con contraste con suero salino agitado, realizada desde el catéter venoso central de inserción periférica (CCIP) (vena cefálica izquierda), mostró un cortocircuito masivo a la aurícula izquierda (AI), sin foramen oval o comunicación interauricular evidente. La ETT mostró paso directo de burbujas desde el CCIP a la AI, sin pasar por la aurícula derecha (AD), lo que indica un shunt extracardiaco. No se evidenció dilatación de cavidades cardiacas ni del seno coronario, tampoco comunicación interauricular ni ostium secundum a nivel de ninguna de las venas cavas. Tras retirar el CCIP izquierdo, se colocó otro contralateral y se repitió la ETT. Esta vez, el suero salino agitado permaneció únicamente en las cavidades derechas (figura 1, figura 2).
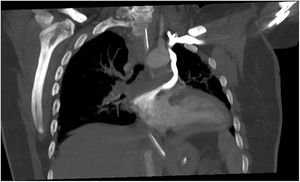
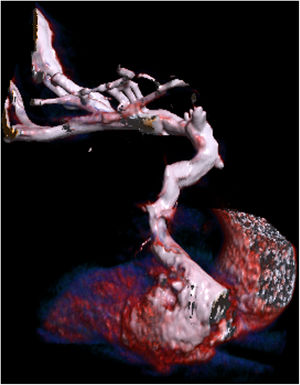
Ante la sospecha de ACV secundario a embolia paradójica por drenaje anómalo del sistema venoso de la extremidad superior izquierda a AI, se solicitó una angio-TC torácica. Esta demostró la presencia de una vena que nacía de la vena subclavia izquierda, drenaba a una vena pulmonar segmentaria del lóbulo superior izquierdo y finalmente a la AI, por lo que se consideró necesario el diagnóstico diferencial entre: vena cava superior izquierda persistente (VCSIP) y vena levoatriocardinal. Se identificó la vena innominada gravemente estenótica, así como un seno coronario normal, sin comunicaciones entre este y la AI.
Se completó el estudio con 72h de telemetría cardiaca, que no detectó arritmias potencialmente embolígenas. Se orientó la etiología como de origen embólico paradójico, promovido por el CCIP izquierdo.
Cuando un trombo proveniente de la circulación venosa pasa a la circulación arterial, a través de un defecto vascular o intracardiaco, causa embolia paradójica1. Aproximadamente un 2% de las isquemias arteriales agudas son por embolias paradójicas (causa infrecuente de ACV). El defecto intracardiaco que más frecuentemente se asocia con esta entidad es el foramen oval permeable2. Existen otras entidades que pueden ocasionar la aparición de embolia paradójica, como las alteraciones del drenaje venoso sistémico que condicionan cortocircuitos derecha-izquierda extracardiacos: fístulas arteriovenosas pulmonares (enfermedad de Rendu-Osler), drenaje de VCSIP en AI o una vena levoatriocardinal que conecte la circulación venosa pulmonar (habitualmente la vena pulmonar superior izquierda) y la circulación venosa sistémica (comúnmente la vena innominada izquierda).
La anomalía más común del drenaje venoso sistémico es la VCSIP, que se observa en un 0,3-0,5% de la población general y un 12% de las cardiopatías congénitas. Los casos en adultos se diagnostican mayoritariamente a raíz de la colocación de catéteres venosos centrales (CVC)3. Habitualmente la VCSIP drena a la AD a través del seno coronario (80-92%), mientras que en un 10-20% lo hace a la AI (directamente o a través de un defecto parcial del techo del seno coronario), lo que genera un cortocircuito derecha-izquierda, con más predisposición a las embolias paradójicas4. El marcador ecocardiográfico más característico, no siempre presente, es la dilatación del seno coronario3.
Por otro lado, la vena levoatriocardinal es una conexión anormal persistente entre el sistema venoso pulmonar y el sistémico, a través del plexo esplácnico, comúnmente asociada con cardiopatías congénitas con obstrucción de cavidades izquierdas (ventrículo izquierdo hipoplásico)5. Gracias a la disponibilidad actual de técnicas radiológicas avanzadas (angio-TC), esta malformación infrecuente se diagnostica más a menudo. Puede ser una anomalía aislada, asintomática, diagnosticada incidentalmente, que produce una conexión extracardiaca entre los circuitos venosos pulmonar y sistémico.
En nuestro caso, al realizar la angio-TC en fase venosa, se visualizó opacificación de contraste a través de la vena subclavia izquierda que continuaba a una estructura venosa irregular, que drenaba a la vena segmentaria del lóbulo superior izquierdo y esta a la AI. Asimismo, se observó otra estructura venosa de menor calibre en el trayecto de la vena innominada izquierda con escaso paso de contraste, y no se pudo descartar un componente de trombosis crónica o fibrosis. La vena cava superior derecha presentaba un calibre conservado, y tanto la vena subclavia como la vena yugular derechas tenían aspecto normal.
Si se considera que la ecocardiografía no mostró dilatación del seno coronario, marcador característico de una VCSIP, ni se observó un cortocircuito derecha-izquierda considerable, se piensa que, a pesar de no observarse alteraciones obstructivas del corazón izquierdo, los hallazgos radiológicos se podrían relacionar con una malformación venosa levoatriocardinal (que conectaría la vena pulmonar superior izquierda con la vena innominada izquierda). Cabe destacar que la simple ETT desde posición supraesternal (o paraesternal alta) puede mostrar la vena vertical izquierda y evidenciar con Doppler color el flujo intravascular en dirección ascendente o descendente. Sin embargo, en esta paciente, la intubación orotraqueal y el mal acceso supraesternal no permitieron confirmar su presencia por ETT.
Aunque las anomalías del drenaje venoso se asocian frecuentemente con malformaciones congénitas pediátricas, en ocasiones resultan evidentes en la edad adulta. Los casos descritos se diagnostican mayormente tras la colocación de CVC. En consecuencia, ante una embolia paradójica después de la colocación de CVC, se considera importante el estudio de las posibles variantes anatómicas del sistema de drenaje venoso como su posible causa.