Determinar la contribución de la apertura de un nuevo laboratorio de cateterismo diagnóstico en el centro a la modificación de la mortalidad a 30 días y a 2 años en pacientes con infarto de miocardio (IM).
MétodosSe incluyó en el estudio a 1.539 pacientes consecutivos con IM, de 25-74 años de edad, en los periodos 1995-1997 y 1999-2003, antes y después de la apertura de un laboratorio de cateterismo, que tuvo lugar en 1998.
ResultadosLos 641 pacientes consecutivos con IM del periodo 1995-1997 tuvieron una mortalidad a 30 días peor que la de los 898 pacientes reclutados en el periodo 1999-2003 (el 11,2 frente al 6,35%; p=0,001). El número de angiografías coronarias y intervenciones coronarias percutáneas aumentó en el segundo periodo (el 19,4 y el 3,3%, y el 54,8 y el 23%; p<0,001). Las curvas de supervivencia a los 2 años fueron significativamente mejores en el segundo periodo tanto en lo relativo a las muertes por todas las causas como en lo referente a las muertes cardiovasculares. La odds ratio ajustada de la mortalidad a 30 días fue 0,58 (intervalo de confianza [IC] del 95%, 0,36-0,95) y la razón de riesgos ajustada de la mortalidad cardiovascular a los 2 años para los pacientes que habían sobrevivido a los 30 días fue 0,62 (IC del 95%, 0,39-0,99) para el segundo periodo en comparación con el primero. Al introducir un ajuste adicional relativo a la prescripción de estatinas, inhibidores de la enzima de conversión de la angiotensina, bloqueadores beta y antiagregantes plaquetarios al alta, el efecto observado a los 2 años dejaba de ser significativo.
ConclusionesLa apertura de una nueva sala de cateterismos diagnósticos local aumentó significativamente el número de supervivientes a 30 días, pero no el de supervivientes a dos 2 de aquellos que habían sobrevivido 30 días, lo que puede explicarse suficientemente por una mejor prevención secundaria en este segundo periodo de de tiempo.
Palabras clave
Aunque las tasas de mortalidad son inferiores a las del norte de Europa, en España la enfermedad cardiovascular (EC) continúa siendo la principal causa de muerte. En consecuencia, está ampliamente aceptado que la carga de trabajo de los departamentos de cardiología continuará aumentando a causa del envejecimiento de la población y el aumento de la supervivencia tras el primer episodio1,2,3.
La evidencia obtenida en ensayos clínicos y en estudios retrospectivos ha puesto de relieve que la angiografía y la angioplastia coronarias aportan un efecto beneficioso en el tratamiento de los pacientes con síndrome coronario agudo (SCA) y sus resultados4. La morbimortalidad a los 6 meses no se ve afectada cuando la tasa de utilización de la angiografía coronaria es de entre el 15 y el 50% de los pacientes con infarto de miocardio (IM), siempre que las indicaciones urgentes se atiendan en un plazo breve5. En cambio, cuando la tasa de utilización es muy diferente en distintos centros (p. ej., del 6 al 93%), la mortalidad varía de forma significativa6. La disponibilidad de un laboratorio de hemodinámica en el propio centro es precisamente el factor que tiene una mayor relación con el uso de la angiografía y la angioplastia5,7,8. En consecuencia, la apertura de una nueva unidad de cateterismo coronario diagnóstico en un centro que tenía que remitir a todos sus pacientes a un hospital terciario distante brinda una buena oportunidad para cuantificar el efecto beneficioso obtenido de forma prospectiva.
El objetivo del presente estudio es determinar si la disponibilidad de una nueva unidad de cateterismo cardiaco diagnóstico en un hospital terciario tenía influencia en la mortalidad cardiovascular a los 30 días y a los 2 años en pacientes con IM ingresados de forma consecutiva. Dado que en la última década se ha demostrado que el uso de nuevos tratamientos, como la trombolisis9, los antiagregantes plaquetarios9,10, los bloqueadores beta (BB)11, los inhibidores de la enzima de conversión de la angiotensina (IECA)12 o las estatinas13, mejora el pronóstico de los pacientes con SCA que presentan elevación del ST conducente a un IM, un segundo objetivo del estudio es determinar también si la pauta de tratamiento prescrita al paciente en el momento del alta contribuía a producir alguna diferencia en los parámetros de valoración.
MétodosPacientesEl REgistre GIroní del COR (REGICOR), creado en 1978, es un registro de todos los pacientes consecutivos de entre 25 y 74 años, con IM y residentes en el área de asistencia sanitaria de Girona14.
PeriodosIncluimos a los pacientes registrados en dos periodos distintos de la era de la cardiología invasiva: 641 pacientes del periodo 1995-1997 y 898 del periodo 1999-2003. El laboratorio de cateterismo diagnóstico fue inaugurado a comienzos de 1998; omitimos ese año inicial en el análisis.
Evaluaciones y manejo de los pacientesSe recogieron prospectivamente los siguientes datos: edad, sexo, tabaquismo, antecedentes de hipertensión, diabetes mellitus y angina, tipo de SCA y localización final del IM según el electrocardiograma (ECG). La gravedad de la enfermedad se estableció mediante el grado clínico de disfunción ventricular (edema pulmonar agudo o shock cardiogénico) y por la presencia de arritmias ventriculares (fibrilación o taquicardia) que requirieran tratamiento inmediato. Se registraron también las variables del manejo del paciente, como el uso de trombolisis, antiagregantes plaquetarios, angiografía coronaria, intervencionismo coronario percutáneo (ICP) y cirugía de bypass arterial coronario (CABG). Se determinó asimismo la prescripción de antiagregantes plaquetarios, estatinas, IECA y BB en el momento del alta para evaluar la posible influencia del tratamiento farmacológico en los resultados obtenidos a los 2 años.
Se trató a los pacientes según las guías terapéuticas en vigor en cada momento, que no diferían de manera sustancial en los dos periodos estudiados15,16. Así pues, en esos periodos, la angiografía coronaria se limitó a los pacientes con insuficiencia cardiaca, disfunción ventricular, angina tras infarto agudo de miocardio (IAM) o isquemia residual.
DefinicionesSe diagnosticó un IM con onda Q, sin onda Q o inclasificable mediante el electrocardiograma de alta, cuando los pacientes presentaban un dolor torácico de una duración superior a 20 min al ingresar, tras el cual se habían producido las alteraciones electrocardiográficas características en los ECG seriados. Con objeto de estandarizar las series de diagnósticos en los dos periodos estudiados, se tuvo en cuenta para el diagnóstico el aumento anormal de la curva de valores de creatincinasa (CK). No tuvimos en cuenta la troponina, puesto que este marcador no se utilizaba todavía en el periodo inicial de nuestro estudio.
El diagnóstico de reinfarto se evaluó mediante los cambios típicos en el ECG, con los mismos criterios que en el IM inicial, y un segundo incremento de la CK tras el máximo causado por el IM del ingreso inicial.
Los criterios de angina post-IM fueron la recurrencia de los síntomas de angina con alteraciones electrocardiográficas de 24 h a 30 días después del inicio de los síntomas de IM, sin aumento de las enzimas cardiacas.
La angina inestable durante el seguimiento (30 días a 2 años después del inicio de los síntomas de IM) se diagnosticó por la recurrencia de los síntomas anginosos junto con alteraciones electrocardiográficas en ECG seriados, con aumento de las enzimas cardiacas sin llegar a los límites indicados antes para el diagnóstico del IM. En el seguimiento se utilizó la misma definición para el IM que en el IM inicial.
SeguimientoA los 2 años se realizó por teléfono un seguimiento de los pacientes que habían sobrevivido a los 30 días y se llevó a cabo una comprobación de nuestras cohortes cruzándolas con los datos del registro oficial de mortalidad del Departamento de Salud de Cataluña. Examinamos y extrajimos los datos de las historias clínicas hospitalarias de todos los pacientes que declararon haber sido hospitalizados por un proceso aparentemente cardiaco.
Las variables de valoración principales fueron la mortalidad cardiovascular a 30 días y a 2 años. Especificamos también la mortalidad por todas las causas (durante la fase aguda, es decir, los primeros 30 días siguientes al inicio de los síntomas, todas las muertes se consideraron de origen cardiaco) y registramos los nuevos IM y los ingresos por angina inestable.
Tamaño muestral y análisis estadísticosNuestro estudio tuvo la potencia adecuada (86%) para identificar como estadísticamente significativa (p<0,05) una razón de riesgos (HR) de mortalidad ≤ 0,65 para el segundo periodo en una prueba estadística bilateral, partiendo del supuesto de que la mortalidad a 2 años sería > 15% en el primer periodo; una tasa de primero/segundo del 40%, y una correlación de la variable de periodo con los posibles factores de confusión <0,3.
Las diferencias entre los periodos y entre los pacientes con episodios y sin episodios a los 30 días y a los 2 años en los supervivientes a 30 días se evaluaron con la prueba de la χ2 para las variables discretas y con la prueba de la t de Student para las variables continuas o sus equivalentes no paramétricos, según fuera apropiado.
Los valores de odds ratio (OR) ajustada de sufrir un episodio en 30 días en el segundo periodo se estimaron con un modelo logístico, y la HR de la mortalidad a 2 años en los supervivientes a los 30 días se estimó con un modelo de Cox. Las variables demográficas, de comorbilidad, clínicas y de gravedad que mostraban diferencias como mínimo marginalmente significativas (p ≤ 0,15) en el análisis bivariable al comparar los periodos de tratamiento y al comparar a los pacientes con episodios y sin ellos a los 30 días o a los 2 años, y las variables que se consideraron importantes según el criterio clínico, se incluyeron como posibles factores de confusión (p. ej., sexo, edad y diabetes mellitus). Las variables de gravedad (es decir, edema agudo de pulmón o shock cardiogénico) que pueden interpretarse como mecanismos intermedios de muerte se incluyeron en modelos aparte, junto con las variables anteriores. El modelo final para el seguimiento a 2 años de los supervivientes a 30 días incluyó la prescripción de estatinas, IECA, antiagregantes plaquetarios y BB en el momento del alta.
Las curvas de supervivencia se estimaron con el método de Kaplan-Meier y se compararon con análisis estadísticos de Mantel-Cox. Los cálculos se realizaron con el programa estadístico R.
ResultadosDurante el periodo 1995-1997 hubo 3.345 ingresos en el Servicio de Cardiología, de los que 919 se debieron a un IAM. En 783 de ellos se trataba de un primer IAM en personas residentes en nuestra área de influencia. Durante el periodo 1999-2003 hubo 4.629, 1.332 y 1.108 casos, respectivamente.
Las características demográficas y la distribución de factores de riesgo cardiovascular en los pacientes ingresados en los periodos 1995-1997 y 1999-2003 se muestran en la Tabla 1. Los pacientes del periodo más reciente eran de menor edad y era más frecuente que fueran fumadores actuales y que se les hubiera diagnosticado hipertensión, hipercolesterolemia o un IM sin onda Q. La proporción de pacientes tratados con trombolisis y CABG fue similar, pero el número de cateterismos coronarios y de ICP aumentó con la disponibilidad del laboratorio de hemodinámica en el centro. El tiempo transcurrido hasta la realización de angiografía coronaria, ICP o CABG se redujo de forma significativa en el segundo periodo. La proporción de pacientes tratados con estatinas, IECA, BB y antiagregantes plaquetarios al alta aumentó en el segundo periodo.
Tabla 1. Características demográficas y clínicas de los pacientes con infarto de miocardio según el periodo de ingreso con y sin disponibilidad de un laboratorio de cateterismo en el centro (1995-1997 y 1999-2003).
| 1995-1997 | 1999-2003 | p | |
| Pacientes, n | 641 | 898 | |
| Edad | 63,7±11,9 | 60,7±10,9 | < 0,001 |
| Mujeres, % | 22,0 | 20,3 | 0,411 |
| Antecedentes de factores de riesgo, % | |||
| Hipertensión | 46,5 | 52,2 | 0,029 |
| Diabetes mellitus | 27,3 | 26,0 | 0,568 |
| Hipercolesterolemia | 41,2 | 52,0 | < 0,001 |
| Fumadores actuales | 35,9 | 43,6 | 0,003 |
| Localización electrocardiográfica del infarto de miocardio, % | |||
| Sin onda Q | 16,5 | 26,7 | |
| Cara inferior | 42,7 | 37,0 | |
| Cara anterior | 35,7 | 31,7 | |
| Inclasificable | 5,0 | 4,6 | < 0,001 |
| Tipo de síndrome coronario agudo, % | |||
| Elevación del ST | 82,5 | 74,4 | |
| Sin elevación del ST | 12,3 | 20,8 | |
| Inclasificable | 5,2 | 4,8 | < 0,001 |
| Uso de la intervención en los primeros 30 días, % | |||
| Trombolisis | 41,5 | 40,2 | 0,612 |
| Angiografía coronaria | 19,4 | 54,8 | < 0,001 |
| Días hasta la angiografía coronaria | 15 [10-24,5] | 9 [5-13] | < 0,001 |
| Intervención percutánea, % | 3,3 | 23,0 | < 0,001 |
| Días hasta la intervención percutánea | 21 [14-33] | 10,5 [5-17] | < 0,001 |
| CABG, % | 5,5 | 8,4 | 0,054 |
| Días hasta el CABG | 29 [22,5-51] | 23 [15,5-33,5] | 0,015 |
| Tratamiento farmacológico al alta, % | |||
| Antagonistas del calcio | 20,1 | 19,0 | 0,606 |
| Estatinas | 13,6 | 66,2 | < 0,001 |
| IECA | 29,0 | 52,6 | < 0,001 |
| Bloqueadores beta | 32,4 | 57,1 | < 0,001 |
| Antiagregantes plaquetarios | 86,7 | 91,7 | 0,002 |
| Nitratos | 30,9 | 22,9 | < 0,001 |
CABG: cirugía de bypass arterial coronario; IECA: inhibidores de la enzima de conversión de la angiotensina; SCA: síndrome coronario agudo.
Salvo otra indicación, los datos expresan media±desviación estándar o mediana [intervalo intercuartílico] en pacientes a los que se aplica la intervención.
La proporción de pacientes que fallecieron o sufrieron angina postinfarto fue significativamente menor a los 30 días en el segundo periodo. La proporción de pacientes con complicaciones se mantuvo en cifras similares (Tabla 2).
Tabla 2. Proporción de pacientes con infarto de miocardio que presentan un evento mayor en un plazo de 30 días tras el inicio de los síntomas, o hasta los 2 años en los supervivientes a 30 días, según el periodo de ingreso con o sin laboratorio de cateterismo en el centro (1995-1997 y 1999-2003, respectivamente).
| 1995-1997 | 1999-2003 | p | |
| Episodios a 30 días, n | 641 | 898 | |
| Muerte cardiovascular | 11,2 | 6,35 | 0,001 |
| Reinfarto | 3,25 | 3,64 | 0,697 |
| Angina postinfarto de miocardio | 22,4 | 15,1 | < 0,001 |
| Clase III-IV de Killip | 17,2 | 14,3 | 0,115 |
| Episodios a 2 años en los supervivientes a 30 días, n | 569 | 841 | |
| Muerte por todas las causas | 12,3 | 7,61 | 0,003 |
| Muerte cardiovascular | 8,29 | 4,78 | 0,008 |
| Infarto de miocardio | 6,59 | 7,81 | 0,475 |
| Angina inestable | 4,43 | 2,79 | 0,115 |
| Cateterismo coronario | 4,21 | 8,1 | 0,014 |
| Intervención percutánea | 1,55 | 4,65 | 0,008 |
| Cirugía de bypass arterial coronario | 0,23 | 0,27 | 1 |
Killip III-IV: edema agudo de pulmón o shock cardiogénico.
Salvo otra indicación, los datos expresan porcentaje.
El seguimiento en cuanto a la mortalidad a los 2 años se completó en todos los pacientes (causa desconocida en 6, es decir, el 0,4%) de los que sobrevivieron a la fase aguda a los 30 días (569 en el primer periodo y 841 en el segundo). Al cabo de 2 años, 499 (87,7%) pacientes en el primer periodo y 777 (92,4%) en el segundo periodo continuaban con vida. Las tasas de mortalidad por todas las causas y por EC a los 2 años del alta fueron significativamente inferiores en el segundo periodo (Tabla 2).
El seguimiento en cuanto a los reingresos por IM o angina inestable se completó en 455 (91,2%) de los 499 pacientes supervivientes del primer periodo y en 755 (97,2%) de los 777 pacientes supervivientes del segundo periodo (Tabla 2).
La tasa de mortalidad total por todas las causas entre el ingreso y los 2 años fue del 22,2 y el 13,5% en el primero y el segundo periodo, respectivamente (p<0,001) y la tasa de muerte cardiovascular fue del 18,6 y el 10,9% (p<0,001).
En la Tabla 3 se presentan las características demográficas, clínicas, de factores de riesgo y de tratamiento en función de la muerte cardiovascular a los 30 días para el conjunto de ambos periodos. Los pacientes que presentaron eventos de este tipo eran de mayor edad y con mayor frecuencia mujeres y era menos común que fueran fumadores o presentaran hipercolesterolemia; se les administró menos tratamiento trombolítico, tenían una clase de Killip peor, se les practicaron más intervenciones angiográficas y había un mayor número de casos con IM de cara anterior y ECG inclasificables.
Tabla 3. Características demográficas, clínicas, de factores de riesgo y de tratamiento de los pacientes con infarto de miocardio según la mortalidad a 30 días.
| Muerte | p | ||
| No | Sí | ||
| Pacientes, n | 1.410 | 129 | 0,001 |
| Periodo 1999–2003 | 59,6 | 44,2 | |
| Edad (años) | 61,3±11,4 | 69,6±9,24 | < 0,001 |
| Mujeres | 20,1 | 31,0 | 0,004 |
| Antecedentes de factores de riesgo | |||
| Hipertensión | 49,3 | 55,7 | 0,174 |
| Diabetes | 25,9 | 33,3 | 0,079 |
| Hipercolesterolemia | 48,8 | 32,2 | 0,001 |
| Fumadores actuales | 42,0 | 21,7 | < 0,001 |
| Localización electrocardiográfica del infarto de miocardio | |||
| Sin onda Q | 23,3 | 14,0 | |
| Cara inferior | 40,4 | 27,9 | |
| Cara anterior | 32,8 | 40,3 | |
| Inclasificable | 3,6 | 17,8 | < 0,001 |
| Tipo de síndrome coronario agudo | |||
| Elevación del ST | 77,9 | 76,0 | |
| Sin elevación del ST | 18,4 | 5,4 | |
| Inclasificable | 3,7 | 18,6 | < 0,001 |
| Trombolisis | 42,1 | 25,2 | < 0,001 |
| Clase III-IV de Killip | 11,0 | 68,1 | < 0,001 |
| Angiografía coronaria durante el ingreso | 42,7 | 10,5 | < 0,001 |
| Antiagregantes plaquetarios durante el ingreso | 97,5 | 80,8 | < 0,001 |
Killip III-IV: edema agudo de pulmón o shock cardiogénico.
Los datos expresan porcentaje (%) o media±desviación estándar.
En la Tabla 4 se muestran las características demográficas, clínicas, de factores de riesgo y de tratamiento de los pacientes con IM, en función de la muerte cardiovascular a los 2 años, en los que habían sobrevivido a los 30 días. Los pacientes que presentaron eventos de este tipo tenían una edad significativamente superior, era más frecuente que fueran mujeres y que presentaran diabetes mellitus, tabaquismo y ECG inclasificables y eran más común que correspondieran al segundo periodo, aunque esta diferencia sólo era marginalmente significativa. También era más probable que recibieran tratamiento con IECA y menos probable que recibieran BB y trombolisis y que se les practicaran angiografías coronarias (durante el ingreso, pero muchas más tras el alta que en los supervivientes).
Tabla 4. Características demográficas, clínicas, de factores de riesgo y de tratamiento de los pacientes con infarto de miocardio según la mortalidad cardiovascular a 2 años, en los supervivientes a 30 días, para el conjunto de los dos periodos.
| Muerte cardiovascular | p a | ||
| No | Sí | ||
| Pacientes, n | 1.317 | 87,0 | |
| Periodo 1999-2003 | 60,5 | 46,0 | 0,008 |
| Edad (años) | 60,7±11,2 | 69,9±9,52 | < 0,001 |
| Mujeres | 19,2 | 33,3 | 0,001 |
| Antecedentes de factores de riesgo | |||
| Hipertensión | 48,8 | 54,1 | 0,317 |
| Diabetes | 24,5 | 47,7 | < 0,001 |
| Hipercolesterolemia | 48,8 | 49,4 | 0,914 |
| Fumadores actuales | 43,3 | 22,6 | < 0,001 |
| Localización electrocardiográfica del infarto de miocardio | |||
| Sin onda Q | 23,1 | 26,4 | ref. |
| Cara inferior | 40,9 | 31,0 | 0,155 |
| Cara anterior | 33,0 | 31,0 | 0,569 |
| Inclasificable | 3,0 | 11,5 | 0,002 |
| Tipo de síndrome coronario agudo | |||
| Elevación del ST | 78,2 | 73,6 | |
| Sin elevación del ST | 18,6 | 14,9 | |
| Inclasificable | 3,2 | 11,5 | < 0,001 |
| Trombolisis | 43,9 | 16,3 | < 0,001 |
| Killip III-IV | 9,0 | 41,9 | < 0,001 |
| Tratamientos prescritos al alta | |||
| Estatinas | 49,8 | 27,8 | < 0,001 |
| Inhibidores de la enzima de conversión de la angiotensina | 45,0 | 57,0 | 0,03 |
| Bloqueadores beta | 53,1 | 19,0 | < 0,001 |
| Antiagregantes plaquetarios | 94,3 | 89,3 | 0,062 |
| Angiografía coronaria durante los primeros 30 días | 43,8 | 25,6 | 0,001 |
| Angiografía coronaria, 30 días a 2 años | 6,0 | 15,4 | < 0,001 |
Killip III-IV: edema agudo de pulmón o shock cardiogénico.
Salvo otra indicación, los datos expresan porcentaje o media±desviación estándar.
a Estimado con regresión de Cox.
En la Tabla 5 se indican las características de los pacientes con y sin angiografía coronaria, con independencia de la intervención percutánea, en los dos periodos estudiados. La angiografía coronaria aumenta en los pacientes con SCA sin elevación del ST en el segundo periodo.
Tabla 5. Características de los pacientes con o sin angiografía coronaria, independientemente de la intervención percutánea, en los dos periodos estudiados.
| 1995-1997 | 1999-2003 | ||||||
| Angiografía coronaria | Angiografía coronaria | ||||||
| No | Sí | p1* | No | Sí | p2* | p3* | |
| Pacientes, n | 508 | 122 | 400 | 485 | |||
| Edad (años) | 64,3±12,2 | 61,9±10,2 | 0,052 | 61,2±11,2 | 60,3±10,7 | 0,212 | 0,116 |
| Mujeres | 22 | 21,3 | 0,86 | 17 | 22,7 | 0,036 | 0,746 |
| Antecedentes de factores de riesgo | |||||||
| Hipertensión | 45,5 | 50,0 | 0,372 | 46,9 | 57,1 | 0,003 | 0,158 |
| Diabetes mellitus | 26,5 | 29,2 | 0,548 | 25,1 | 26,7 | 0,585 | 0,589 |
| Hipercolesterolemia | 40,7 | 43,0 | 0,645 | 47,7 | 55,8 | 0,018 | 0,012 |
| Fumadores actuales | 37,1 | 32,0 | 0,289 | 46,3 | 41,1 | 0,132 | 0,064 |
| Localización electrocardiográfica del IM | |||||||
| Sin onda Q | 15,9 | 18,9 | 18,0 | 34,6 | |||
| Cara inferior | 44,3 | 37,7 | 47,2 | 28,7 | |||
| Cara anterior | 34,1 | 41,8 | 31,0 | 32,2 | |||
| Inclasificable | 5,71 | 1,64 | 0,091 | 3,75 | 4,54 | < 0,001 | 0,001 |
| Tipo de SCA | |||||||
| Elevación del ST | 82,1 | 83,6 | 81,8 | 68,5 | |||
| Sin elevación del ST | 12,0 | 14,8 | 14,5 | 26,6 | |||
| Inclasificable | 5,91 | 1,64 | 0,126 | 3,75 | 4,95 | < 0,001 | 0,004 |
| Trombolisis | 38,7 | 50,8 | 0,014 | 45,6 | 35,4 | 0,002 | 0,002 |
| Clase III-IV de Killip | 17,6 | 15,6 | 0,601 | 14,1 | 14,2 | 0,991 | 0,693 |
ECG: electrocardiograma; SCA: síndrome coronario agudo.
Sin angiografía coronaria frente a con angiografía coronaria: p1 en el primer periodo, p2 en el segundo periodo y p3, total.
Salvo otra indicación, los datos expresan porcentaje o media±desviación estándar.
Hubo 11 participantes sin información disponible sobre la angiografía coronaria en el primer periodo y 13 en el segundo.
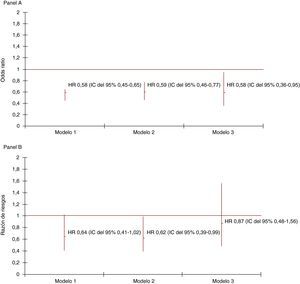
En la Figura 1 se indica la OR de la mortalidad para el segundo periodo con el aumento de la complejidad del ajuste de los modelos logísticos en el seguimiento a 30 días (Figura 1A). El riesgo inferior de este periodo alcanzaba significación estadística con independencia del nivel de ajuste utilizado. El modelo de Cox mostró una HR significativa de la mortalidad cardiovascular para el segundo periodo en el seguimiento a los 2 años de los supervivientes a 30 días (Figura 1B) tras el ajuste respecto a edad, sexo, hipertensión, dislipemia, tabaquismo, diabetes mellitus, localización del IM en el ECG, edema agudo de pulmón o shock cardiogénico y trombolisis (Figura 1B, modelo 2). Este efecto se veía afectado por los factores de confusión del tratamiento con estatinas, IECA, BB y antiagregantes plaquetarios prescritos al alta (Figura 1B, modelo 3). La HR para la mortalidad por todas las causas en los supervivientes a los 30 días fue de 0,73 (IC del 95%, 0,50-1,06), 0,72 (IC del 95%, 0,50-1,05) y 0,89 (IC del 95%, 0,56-1,42) para el segundo periodo en tres modelos con ajustes como en la Figura 1B.
Figura 1. Razón de riesgos (RR) ajustada de la mortalidad a 30 días (A) y de la mortalidad cardiovascular a los 2 años en los supervivientes a los 30 días (B) para el periodo de ingreso, con y sin la disponibilidad de un laboratorio de cateterismo en el centro (1995-1997 y 1999-2003). IC: intervalo de confianza; HR: hazard ratio.Panel A: Modelo 1: ajustado para edad, sexo, hipertensión, dislipemia, tabaquismo, diabetes mellitus y localización electrocardiográfica del infarto de miocardio; Modelo 2: ajustado como en el Modelo 1 y además para el edema agudo de pulmón o shock cardiogénico; Modelo 3: ajustado como en el Modelo 2 y además para el uso de trombolisis y antiagregantes plaquetarios al ingreso.Panel B: Modelo 1: ajustado para edad, sexo, hipertensión, dislipemia, tabaquismo, diabetes mellitus, localización electrocardiográfica del infarto de miocardio y edema agudo de pulmón o shock cardiogénico; Modelo 2: ajustado como en el Modelo 1 y además para la trombolisis; Modelo 3: ajustado como en el Modelo 2 y además para la prescripción de estatinas, inhibidores de la enzima de conversión de la angiotensina, bloqueadores beta y antiagregantes plaquetarios al alta.
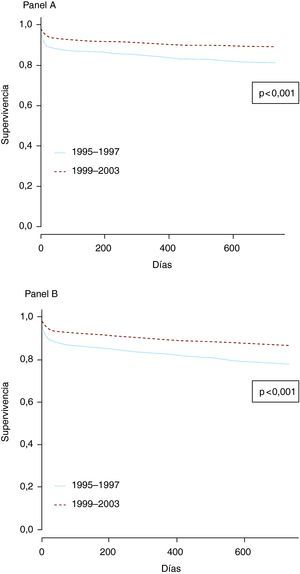
En la Figura 2 se presentan las curvas de supervivencia (muerte cardiovascular en el panel A y muerte por cualquier causa en el panel B) desde el ingreso hasta los 2 años, en ambos periodos. En los dos casos, los pacientes presentaron una supervivencia significativamente mejor a los 2 años en el periodo 1999-2003, con la disponibilidad del laboratorio de cateterismo en el centro.
Figura 2. Curvas de supervivencia para la mortalidad por enfermedad coronaria (panel A) y por todas las causas (panel B) desde el ingreso hasta los 2 años para ambos periodos.
DiscusiónLos resultados de este estudio de cohorte con un seguimiento de 2 años de pacientes ingresados en el mismo hospital terciario en dos periodos bien diferenciados, sin disponer de laboratorio de cateterismo diagnóstico en el centro o disponiendo de él, muestran que la disponibilidad de esta unidad en el centro comporta un aumento del uso de las estrategias invasivas, con plazos hasta el tratamiento más breves y con menor mortalidad a 30 días, que persistía a los 2 años. La mejora a los 2 años dependía principalmente de los resultados obtenidos en los 30 días iniciales tras el ingreso, junto con la mejora de la prescripción de estatinas, IECA, BB y antiagregantes plaquetarios al alta. Los menores tiempos hasta el tratamiento y el mayor uso de todas las intervenciones diagnósticas y terapéuticas en relación con la actividad del laboratorio de cateterismo indican que el tratamiento general de los pacientes con IM en la fase aguda puede ser la causa del efecto beneficioso observado.
El acceso fácil a una unidad cardiaca invasiva se asocia a un aumento del uso, pero hay discrepancia en cuanto a su influencia en los resultados, sobre todo si tenemos en cuenta el aumento que se produce al mismo tiempo en el uso de tratamientos farmacológicos17,18,19,20. El estudio RESCATE comparó el tratamiento y los resultados obtenidos en el mismo periodo en varios hospitales españoles, con y sin laboratorios de cateterismo en los propios centros, y observó que los hospitales que disponían de unidad de hemodinámica realizaban más intervenciones, con un menor tiempo hasta su aplicación, pero no hubo diferencias de mortalidad a los 6 meses5. En otro estudio se comparó el tratamiento y los resultados obtenidos en el mismo periodo en dos hospitales con unas tasas notablemente diferentes de uso del cateterismo, y se observó una supervivencia significativamente mejor a los 28 días en el hospital con un mayor uso6. En un estudio de los registros de 19 hospitales de Seattle, no se observaron diferencias de mortalidad a pesar de las diferencias existentes en el porcentaje de uso de la angiografía y la angioplastia coronarias17. En un registro francés, la menor mortalidad asociada al ingreso en un hospital que disponía de posibilidades de angioplastia en el propio centro se atribuyó a su mayor uso de tratamientos médicos basados en la evidencia21. En un análisis post-hoc de la base de datos del ensayo Gusto IIb, se observó que la mortalidad a 1 año era comparable a pesar de que las tasas de intervención eran mayores en Estados Unidos que en Canadá22. La mayor parte de estos estudios datan de la era anterior al uso generalizado de la angioplastia primaria.
Se sabe que el empleo de la angioplastia primaria fue relativamente bajo en España en el periodo estudiado. Las cifras de nuestro estudio concuerdan con las halladas en los registros nacionales españoles a comienzos de la presente década23,24.
Características y posibles limitaciones del estudioUna característica especialmente atractiva de este estudio es que la comparación se hace en el mismo hospital, lo cual evita la variabilidad entre centros en cuanto al tratamiento de los pacientes.
A pesar de que la disponibilidad del laboratorio de cateterismo en el centro se inició en 1998, al principio sólo llevó a cabo angiografías coronarias diagnósticas. Para las intervenciones de angioplastia, los pacientes eran trasladados a otros hospitales terciarios. Este hecho nos permitió evaluar la contribución del laboratorio de cateterismo a la reducción de la tasa de episodios a los 2 años con independencia del uso de la angioplastia, incluso en nuestro caso en el que el número total de intervenciones puede considerarse inferior al que recomiendan los criterios actuales.
En nuestro estudio, tuvimos en cuenta los tratamientos prescritos al alta (prescripciones que son casi gratuitas para la población general en España), pero no dispusimos de información sobre el cumplimiento ni sobre los posibles efectos secundarios durante el seguimiento de 2 años. Este hecho puede haber introducido algunos sesgos no determinados, que ciertamente no irían a favor de la hipótesis del estudio, puesto que los datos existentes indican que el cumplimiento de la medicación por los pacientes con IM no se ha modificado en los últimos 10 años25.
Una limitación de este estudio es que no se pudiera incluir el uso de la medicación durante el ingreso. Observamos un aumento del uso de BB (del 30% en 1993 al 83% en 2003) y de los IECA (del 36% en 1996 al 74% en 2003). El uso de trombolisis (del 45% en 1993 al 37% en 2003) y el de antiagregantes plaquetarios (del 94% en 1993 al 98% en 2003) se mantuvo estable en los últimos 15 años en el registro REGICOR (datos no publicados). El registro español de IM mostró también una disminución de la mortalidad a 28 días y a 1 año (del 14,2 al 11,3%; p<0,001; y del 18,5 al 16,4%; p<0,001) entre 1995 y 2000, de forma asociada a un aumento del uso de las estrategias de reperfusión y de los tratamientos médicos26. En consecuencia, una parte indeterminada del efecto beneficioso contenido en el efecto del «periodo» en la tasa de mortalidad a los 30 días podría haberse debido a estos cambios.
Además, no incluimos la fracción de eyección, ya que en el primer periodo no se documentó de manera sistemática.
El aumento de la prevalencia de hipertensión, diabetes mellitus e hipercolesterolemia puede deberse a cambios en los criterios diagnósticos que se produjeron a finales de los años noventa27,28,29.
El tratamiento diferente de estos pacientes, motivado por las diferencias en las guías terapéuticas en vigor en cada periodo, puede contribuir a producir diferencias en la prescripción de la angiografía coronaria.
Por último, el análisis del efecto del uso de angiografía coronaria e ICP se ve limitado por un sesgo de supervivencia en la fase aguda (es decir, en las primeras horas siguientes al inicio de los síntomas). En consecuencia, no introdujimos un ajuste de los modelos para estas variables, puesto que podrían haber conducido a una sobrestimación de su efecto real debido a la causalidad inversa. La hipótesis analizada se limita al efecto de la disponibilidad de un laboratorio de cateterismo (es decir, el efecto del «periodo»).
ConclusionesLa apertura de una nueva unidad de cateterismo en un hospital terciario se asoció no sólo a un aumento del número de cateterismos coronarios y de ICP en pacientes con IM, sino también a una reducción en los tiempos transcurridos hasta la aplicación de estas técnicas.
La mayor disponibilidad de este recurso tiende a incrementar su uso y ampliar la gama de indicaciones.
Ello dio lugar a una menor mortalidad cardiovascular a los 30 días, que se mantuvo a los 2 años. La menor mortalidad persiste después del alta y se combinó con el efecto de la prevención secundaria más intensiva con estatinas, IECA, BB y antiagregantes plaquetarios prescritos al alta.
FinanciaciónEste proyecto fue financiado con subvenciones de la Agència d’Avaluació de Tecnologia i Recerca Mèdiques (069/18/02); por el Ministerio de Ciencia e Innovación, Instituto de Salud Carlos III/FEDER (Red HERACLES RD06/0009) y por la Agència de Gestió d’Ajuts Universitaris I de Recerca, Generalitat de Catalunya (2009SGR1195).
Conflicto de interesesNinguno.
Agradecimientos
Los autores desean agradecer la contribución del registro de certificados de defunción del Departamento de Salud de Cataluña, de Susana Tello y Lenny Franco en el manejo de los datos, de Izabella Rohlfs en la organización de la obtención de los datos, de Ruth Martí, Isabel Ramió, Sergi Moral y Xavier Oliva en la obtención de los datos, y de Elaine Lilly, PhD, por la corrección de la redacción inglesa.
Recibido 22 Enero 2010
Aceptado 9 Julio 2010
Autor para correspondencia: Programa de Investigación en Procesos Inflamatorios y Cardiovasculares (RICAD), Institut Municipal d’Investigació Mèdica (IMIM), Dr. Aiguader 88, 08003 Barcelona, España. jmarrugat@imim.es