No se conoce el impacto de la descarga del ventrículo izquierdo (DVI) en el pronóstico posoperatorio de los candidatos a trasplante cardiaco asistidos con oxigenador extracorpóreo de membrana venoarterial (ECMO-VA). Nuestro propósito fue comparar el pronóstico tras el trasplante en pacientes asistidos con ECMO VA con o sin diferentes estrategias de DVI.
MétodosSe realizó un análisis retrospectivo del pronóstico posoperatorio de los receptores de trasplante cardiaco asistidos con ECMO-VA, con o sin DVI asociado, en 16 hospitales españoles durante el periodo 2010-2020. El desenlace principal del estudio fue la supervivencia a 1 año del trasplante. La supervivencia se analizó mediante regresión de Cox.
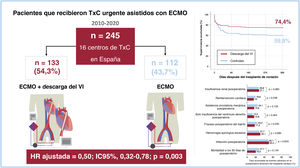
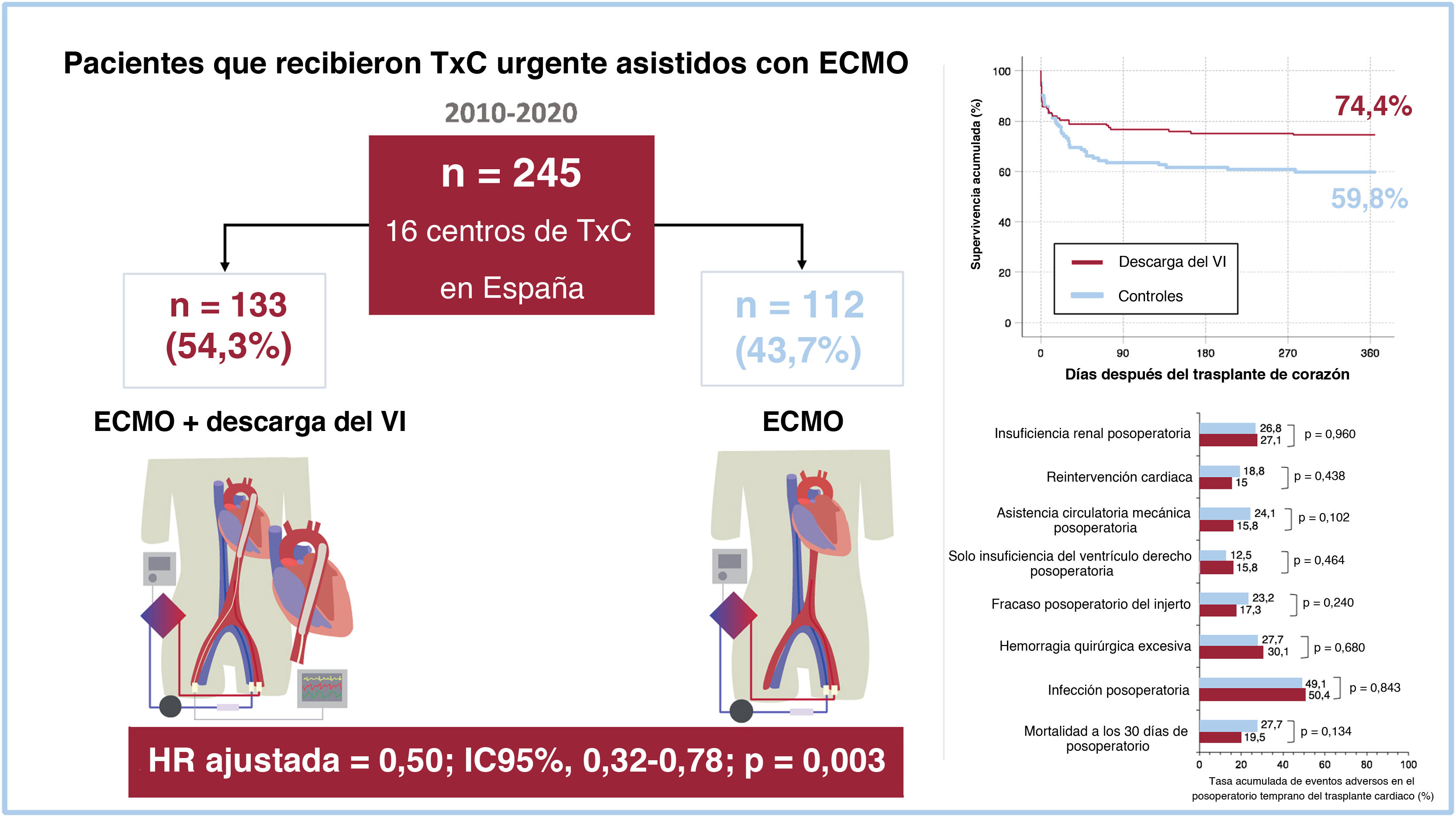
ResultadosSe estudio a 245 pacientes que recibieron un trasplante cardiaco urgente en asistencia con ECMO-VA. Se empleó alguna estrategia mecánica de DVI en 133 (54,3%) de ellos; la más utilizada fue el balón de contrapulsación intraaórtico (n=112; 84,2%). La supervivencia a 1 año tras el trasplante fue del 74,4% en el grupo con DVI y del 59,8% en el grupo sin DVI (p=0,025). La DVI preoperatoria se asoció con una reducción de la mortalidad a 1 año del trasplante en el análisis multivariante (HR ajustada=0,50; IC95%, 0,32-0,78; p=0,003). Esta asociación se observó tanto en los pacientes tratados solo con balón de contrapulsación intraaórtico (HR ajustada=0,52; IC95%, 0,32-0,84; p=0,007) como en los tratados con otras estrategias mecánicas de DVI (HR ajustada=0,43; IC95%, 0,19-0,97; p=0,042). No se observaron diferencias entre ambos grupos en cuanto a otras complicaciones posoperatorias.
ConclusionesLa DVI mecánica preoperatoria se asoció de manera independiente con un incremento de la supervivencia a 1 año tras el trasplante en receptores asistidos con ECMO-VA.
Palabras clave
El oxigenador extracorpóreo de membrana venoarterial (ECMO-VA) se puede utilizar para asistir a candidatos a trasplante cardiaco (TxC) en shock cardiogénico. Sin embargo, nunca se han evaluado en ensayos clínicos aleatorizados la eficacia y la seguridad de esta estrategia. Los datos de los registros multicéntricos indican que estos candidatos corren un mayor riesgo de mortalidad temprana tras el trasplante1. A pesar de ello, los resultados tras el TxC de los asistidos con ECMO-VA ha mejorado considerablemente los últimos años, probablemente por un mejor tratamiento clínico previo al trasplante, una selección de candidatos más refinada y una mejor programación de la cirugía de trasplante2.
La descarga del ventrículo izquierdo (DVI) es una cuestión importante en el tratamiento clínico de los pacientes con ECMO-VA, ya que contribuye a prevenir la congestión pulmonar y la insuficiencia respiratoria causadas por el aumento de la poscarga sistémica. Los estudios observacionales indican que el uso de varias estrategias para la descompresión mecánica del VI puede asociarse con una mejora de la supervivencia de los pacientes en shock cardiogénico asistidos con ECMO-VA3,4. Los métodos mecánicos de DVI serían septostomía auricular5, inserción transaórtica de un catéter en J en el VI6, ventilación quirúrgica del VI7, la aurícula izquierda7 o la arteria pulmonar8 y asistencia simultánea con un balón de contrapulsación intraaórtico (BCIAo)9 o dispositivos temporales de asistencia del VI10.
Que sepamos, no se ha demostrado el posible impacto beneficioso de la DVI en los resultados tras el TxC de los pacientes asistidos con ECMO-VA. Un pequeño estudio previo analizó el uso de BCIAo con este propósito, pero no encontró ninguna ventaja en la supervivencia al combinar BCIAo con ECMO-VA frente a ECMO-VA solo11.
El objetivo de este estudio es comparar los resultados tras el TxC de los pacientes asistidos con ECMO-VA con y sin diversas estrategias de DVI mecánica.
MÉTODOSDescripción del estudioLos datos clínicos de este estudio se extrajeron de la base de datos de un registro retrospectivo multicéntrico que incluye a pacientes consecutivos en lista de espera para TxC por primera vez, de gran urgencia y de un solo órgano, en 16 centros españoles. Se trató a estos pacientes con varios tipos de dispositivos de asistencia circulatoria mecánica temporal entre el 1 de enero de 2010 y el 31 de diciembre de 2020. El protocolo del estudio, ya descrito en otra parte12, fue aprobado por el Comité de Ética de la Investigación Clínica de la Comunidad Autónoma de Galicia y lo ratificaron los consejos de revisión institucional de todos los centros participantes.
Los datos del registro se recopilaron mediante una revisión retrospectiva e individualizada de las historias clínicas de cada participante por investigadores locales encargados de esta tarea. No se ha realizado ningún seguimiento externo de los datos registrados.
En este artículo se analizan los resultados clínicos de los pacientes incorporados al registro sometidos a TxC asistidos con ECMO-VA. Se compara a los que recibieron una estrategia mecánica adicional para la DVI con los que no. A lo largo del periodo de estudio, los pacientes en lista de espera asistidos con ECMO-VA recibieron la máxima prioridad en el protocolo nacional de asignación de donantes de órganos, denominado estadio 0. Esta prioridad hizo que estos candidatos tuvieran prioridad absoluta para recibir el primer órgano de donante adecuado disponible en España. En otra parte12 se han descrito los detalles específicos sobre las sucesivas modificaciones del protocolo nacional de asignación de donantes de órganos durante el periodo de estudio.
Como se trata de un estudio observacional y retrospectivo, la decisión de añadir la DVI mecánica al ECMO-VA, incluidos el tipo y la programación, se dejó a criterio del equipo clínico responsable en función de los protocolos locales y la experiencia clínica.
Seguimiento y resultadosSe realizó un seguimiento de todos los pacientes desde la fecha del TxC hasta 1 año después de este y la supervivencia a 1 año del TxC sirvió como criterio de objetivo primario del estudio. También se evaluaron otros resultados clínicos adversos relevantes que aparecieron durante el posoperatorio en el hospital, como hemorragia quirúrgica excesiva, reintervención cardiaca, disfunción del injerto posoperatoria, infección posoperatoria, necesidad de asistencia circulatoria mecánica posoperatoria e insuficiencia renal posoperatoria que requirió diálisis. Las definiciones específicas de todos los resultados del estudio se presentan en el .
Análisis estadísticoLas variables cualitativas se expresan en número de pacientes y porcentajes, mientras que las variables cuantitativas se expresan en media±desviación estándar o mediana [intervalo intercuartílico] según corresponda. Las comparaciones estadísticas entre los grupos se realizaron con la prueba de la χ2 en el caso de las variables cualitativas y la prueba de la t de Student o la prueba de la U de Mann-Whitney, según corresponda, en el caso de las variables cuantitativas.
Las curvas de Kaplan-Meier se construyeron para representar gráficamente la probabilidad acumulada de supervivencia durante el primer año después del TxC de los pacientes asistidos con ECMO-VA solo o con ECMO-VA y estrategias de DVI. Las funciones de supervivencia se compararon mediante la prueba del orden logarítmico.
Se utilizó la regresión de Cox multivariante para adaptar los posibles factores de confusión en la asociación observada entre la DVI y la supervivencia a 1 año del TxC. Se realizó un análisis escalonado retrógrado con un criterio de exclusión de p>0,10 para identificar variables clínicas con asociación independiente con el objetivo de interés. Se consideraron todas las variables clínicas iniciales a menos que tuvieran más del 10% de valores ausentes (bilirrubina, albúmina, aspartato-aminotransferasa, pH, relación PaO2/FiO2, diámetro telediastólico del VI, índice cardiaco, presión venosa central, presión de enclavamiento capilar, presión de la arteria pulmonar sistólica, presión de la arteria pulmonar diastólica, presión de la arteria pulmonar media y gradiente transpulmonar medio).
Para su inclusión en el primer paso del proceso escalonado retrógrado, se seleccionaron las variables que tenían asociación univariante con la supervivencia a 1 año del TxC con p<0,20. Entre las variables candidatas que se incorporaron al modelo multivariante, se encontraban edad del receptor, antecedentes de ictus, infección preoperatoria, ventilación mecánica invasiva preoperatoria, tratamiento de sustitución renal preoperatorio, uso de vasopresores preoperatorio, tiempo de isquemia fría, hemoglobina preoperatoria, creatinina preoperatoria y DVI mecánica.
El modelo multivariante final del proceso escalonado retrógrado se utilizó para estimar la hazard ratio (HR) ajustada de la mortalidad a 1 año del TxC de los pacientes con DVI mecánica frente a los controles. La suposición de riesgos proporcionales se verificó con la representación gráfica de los residuos de Schoenfeld frente al tiempo (prueba global, p=0,820).
Se realizaron nuevos ajustes para validar los resultados mediante la adición de otras covariables relacionadas con los receptores, donantes y dispositivos que se distribuyeron de forma asimétrica entre los grupos de estudio en el modelo básico.
Dado el mayor uso de estrategias de DVI mecánica como complemento del ECMO-VA a lo largo del tiempo y la mejora general de los resultados del TxC urgente en los últimos años, se realizó un análisis explorador de la supervivencia a 1 año del TxC en ambos grupos de estudio, estratificado por etapas cronológicas para descartar efectos de confusión significativos de los cambios temporales en las asociaciones observadas. Las etapas cronológicas se definieron conforme a las modificaciones históricas del protocolo nacional de asignación de donantes de órganos, como está descrito12. La etapa 1 abarcó de enero de 2010 a mayo de 2014; la etapa 2, de junio de 2014 a mayo de 2017, y la etapa 3, de junio de 2017 a diciembre de 2020. Los análisis estadísticos se realizaron con la versión 25 de SPSS.
RESULTADOSPacientesDurante el periodo de estudio, 245 pacientes (184 varones y 61 mujeres) se sometieron a TxC de gran urgencia asistidos con ECMO-VA en los centros participantes. Se utilizó una estrategia mecánica para la DVI en 133 pacientes (54,3%) que formaron el grupo de intervención. Los 112 pacientes restantes (45,7%) recibieron asistencia solo con ECMO-VA y constituyeron el grupo de control (figura 1).
Los métodos mecánicos utilizados para la DVI incluyeron asistencia con BCIAo (n=112), ventilación apical del VI (n=12), ventilación de la aurícula izquierda (n=9), septostomía auricular (n=4), ventilación de la arteria pulmonar (n=2), implante temporal de dispositivo de asistencia ventricular izquierda (n=2) y otros métodos no especificados (n=1).
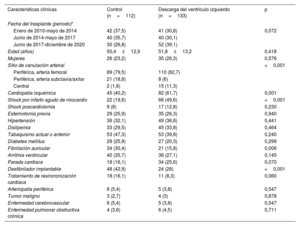
Características clínicas basalesLa tabla 1 muestra una comparación de las características clínicas preoperatorias de los pacientes asistidos hasta el TxC con ECMO-VA, con y sin una estrategia mecánica para la DVI.
Características clínicas basales de los pacientes del estudio
| Características clínicas | Control (n=112) | Descarga del ventrículo izquierdo (n=133) | p |
|---|---|---|---|
| Fecha del trasplante (periodo)* | |||
| Enero de 2010-mayo de 2014 | 42 (37,5) | 41 (30,8) | 0,072 |
| Junio de 2014-mayo de 2017 | 40 (35,7) | 40 (30,1) | |
| Junio de 2017-diciembre de 2020 | 30 (26,8) | 52 (39,1) | |
| Edad (años) | 50,4±12,9 | 51,8±13,2 | 0,418 |
| Mujeres | 26 (23,2) | 35 (26,3) | 0,576 |
| Sitio de canulación arterial | <0,001 | ||
| Periférica, arteria femoral | 89 (79,5) | 110 (82,7) | |
| Periférica, arteria subclavia/axilar | 21 (18,8) | 8 (6) | |
| Central | 2 (1,8) | 15 (11,3) | |
| Cardiopatía isquémica | 45 (40,2) | 82 (61,7) | 0,001 |
| Shock por infarto agudo de miocardio | 22 (19,6) | 66 (49,6) | <0,001 |
| Shock poscardiotomía | 9 (8) | 17 (12,8) | 0,230 |
| Esternotomía previa | 29 (25,9) | 35 (26,3) | 0,940 |
| Hipertensión | 36 (32,1) | 49 (36,8) | 0,441 |
| Dislipemia | 33 (29,5) | 45 (33,8) | 0,464 |
| Tabaquismo actual o anterior | 53 (47,3) | 53 (39,8) | 0,240 |
| Diabetes mellitus | 29 (25,9) | 27 (20,3) | 0,299 |
| Fibrilación auricular | 34 (30,4) | 21 (15,8) | 0,006 |
| Arritmia ventricular | 40 (35,7) | 36 (27,1) | 0,145 |
| Parada cardiaca | 18 (16,1) | 34 (25,6) | 0,070 |
| Desfibrilador implantable | 48 (42,9) | 24 (28) | <0,001 |
| Tratamiento de resincronización cardiaca | 18 (16,1) | 11 (8,3) | 0,060 |
| Arteriopatía periférica | 6 (5,4) | 5 (3,8) | 0,547 |
| Tumor maligno | 3 (2,7) | 4 (3) | 0,878 |
| Enfermedad cerebrovascular | 6 (5,4) | 5 (3,8) | 0,547 |
| Enfermedad pulmonar obstructiva crónica | 4 (3,6) | 6 (4,5) | 0,711 |
Los valores expresan n (%) o media±desviación estándar.
Los periodos se definieron según los cambios en el protocolo nacional de asignación de donantes de órganos, descritos con todo detalle en Barge-Caballero et al.12.
La cardiopatía isquémica y el shock cardiogénico relacionados con el infarto agudo de miocardio fueron más comunes entre los pacientes con DVI, mientras que la fibrilación auricular y el implante previo de desfibriladores fueron más comunes en pacientes sin DVI.
La canulación femoral fue el acceso predominante para la canulación arterial en ambos grupos de estudio (n=199; 81,2%). Entre los pacientes en que se utilizaron otros sitios de canulación arterial, la canulación central predominó en el grupo de DVI, mientras que la canulación subclavia/axilar predominó en el grupo de control.
El grupo de DVI tuvo un mayor porcentaje de pacientes tratados en la etapa más reciente y una menor proporción de pacientes con antecedentes de parada cardiaca o tratamiento de resincronización cardiaca, aunque ninguna de estas diferencias alcanzó significación estadística.
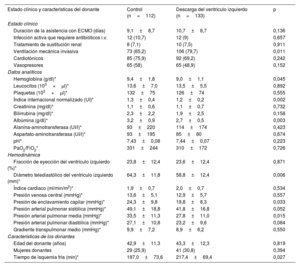
Estado clínico previo al trasplanteLa tabla 2 compara el estado clínico, las pruebas analíticas y la hemodinámica de los receptores antes del trasplante. Los pacientes asistidos con ECMO y DVI estaban intubados en el momento del TxC con mayor frecuencia que los del grupo de control. No se observaron otras diferencias importantes entre los grupos respecto a los tratamientos de soporte vital, la tasa de infección previa al trasplante o la duración de la asistencia con ECMO. Los pacientes con DVI también tenían valores medios de albúmina sérica e índice internacional normalizado más bajos que los del grupo de control.
Estado clínico de los pacientes del estudio antes del trasplante y características de los donantes
| Estado clínico y características del donante | Control (n=112) | Descarga del ventrículo izquierdo (n=133) | p |
|---|---|---|---|
| Estado clínico | |||
| Duración de la asistencia con ECMO (días) | 9,1±8,7 | 10,7±8,7 | 0,136 |
| Infección activa que requiere antibióticos i.v. | 12 (10,7) | 12 (9) | 0,657 |
| Tratamiento de sustitución renal | 8 (7,1) | 10 (7,5) | 0,911 |
| Ventilación mecánica invasiva | 73 (65,2) | 106 (79,7) | 0,011 |
| Cardiotónicos | 85 (75,9) | 92 (69,2) | 0,242 |
| Vasopresores | 65 (58) | 65 (48,9) | 0,152 |
| Datos analíticos | |||
| Hemoglobina (g/dl)* | 9,4±1,8 | 9,0±1,1 | 0,045 |
| Leucocitos (103×μl)* | 13,6±7,0 | 13,5±5,5 | 0,892 |
| Plaquetas (103×μl)* | 132±75 | 126±74 | 0,555 |
| Índice internacional normalizado (UI)* | 1,3±0,4 | 1,2±0,2 | 0,002 |
| Creatinina (mg/dl)* | 1,1±0,6 | 1,1±0,7 | 0,732 |
| Bilirrubina (mg/dl)* | 2,3±2,2 | 1,9±2,5 | 0,158 |
| Albúmina (g/dl)* | 3,2±0,9 | 2,7±0,5 | 0,003 |
| Alanina-aminotransferasa (UI/l)* | 93±220 | 114±174 | 0,423 |
| Aspartato-aminotransferasa (UI/l)* | 93±195 | 85±80 | 0,674 |
| pH* | 7,43±0,08 | 7,44±0,07 | 0,223 |
| PaO2/FiO2* | 331±244 | 310±172 | 0,726 |
| Hemodinámica | |||
| Fracción de eyección del ventrículo izquierdo (%)* | 23,8±12,4 | 23,6±12,4 | 0,871 |
| Diámetro telediastólico del ventrículo izquierdo (mm)* | 64,3±11,8 | 58,8±12,4 | 0,006 |
| Índice cardiaco (ml/min/m2)* | 1,9±0,7 | 2,0±0,7 | 0,534 |
| Presión venosa central (mmHg)* | 13,6±5,1 | 12,9±5,7 | 0,557 |
| Presión de enclavamiento capilar (mmHg)* | 24,3±9,8 | 19,8±8,3 | 0,033 |
| Presión arterial pulmonar sistólica (mmHg)* | 49,1±18,8 | 41,8±16,8 | 0,052 |
| Presión arterial pulmonar media (mmHg)* | 33,5±11,3 | 27,8±11,0 | 0,015 |
| Presión arterial pulmonar diastólica (mmHg)* | 27,1±10,8 | 23,2±9,6 | 0,084 |
| Gradiente transpulmonar medio (mmHg)* | 9,9±7,2 | 8,9±6,2 | 0,550 |
| Características de los donantes | |||
| Edad del donante (años) | 42,9±11,3 | 43,3±12,3 | 0,819 |
| Mujeres donantes | 29 (25,9) | 41 (30,8) | 0,394 |
| Tiempo de isquemia fría (min)* | 197,0±73,6 | 217,4±69,4 | 0,027 |
ECMO: oxigenador extracorpóreo de membrana; i.v.: intravenoso.
Los valores expresan n (%) o media±desviación estándar.
Valores ausentes: hemoglobina (n=10), leucocitos (n=4), plaquetas (n=3), índice internacional normalizado (n=6), creatinina (n=5), bilirrubina (n=31), albúmina (n=120), alanina-aminotransferasa (n=21), aspartato-aminotransferasa (n=37), pH (n=40), PaO2/FiO2 (n=109), fracción de eyección del ventrículo izquierdo (n=23), diámetro telediastólico del ventrículo izquierdo (n=92), índice cardiaco (n=136), presión venosa central (n=158), presión de enclavamiento capilar (n=166), presión arterial pulmonar sistólica (n=152), presión arterial pulmonar diastólica (n=162), presión arterial pulmonar media (n=148), gradiente transpulmonar medio (n=167) y tiempo de isquemia fría (n=1).
Los parámetros hemodinámicos preoperatorios se midieron en una pequeña proporción de pacientes. Los valores medios de la fracción de eyección del VI, el diámetro telediastólico del VI, la presión de la arteria pulmonar y la presión de enclavamiento capilar pulmonar fueron considerablemente menores en el grupo de DVI que en el de control.
DonantesLas características clínicas más relevantes de los donantes de los corazones implantados se detallan en la tabla 2. Los tiempos medios de isquemia fría fueron significativamente más largos en el grupo de DVI que en el de control (217,9±69,4 frente a 197,0±73,6min; p=0,032). La distribución por sexos y la media de edad de los donantes fueron comparables entre los 2 grupos.
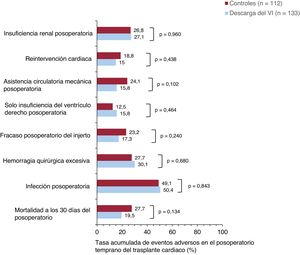
Eventos adversos hospitalarios en el posoperatorio del trasplanteLa figura 1 y la figura 2 comparan los principales resultados clínicos adversos hospitalarios durante el posoperatorio del TxC en ambos grupos de estudio. Las cifras acumuladas de fracaso posoperatorio del injerto y la necesidad de asistencia circulatoria mecánica fueron del 17,3 y el 15,8% en los pacientes asistidos con DVI, en comparación con el 23,2 y el 24,1% en el grupo de control. Sin embargo, estas diferencias no alcanzaron significación estadística (fracaso posoperatorio del injerto, p=0,240; necesidad posoperatoria de asistencia circulatoria mecánica, p=0,102). Las cifras acumuladas de insuficiencia del ventrículo derecho posoperatoria aislada, hemorragia quirúrgica excesiva, reintervención cardiaca, infección posoperatoria e insuficiencia renal posoperatoria fueron comparables entre los 2 grupos.
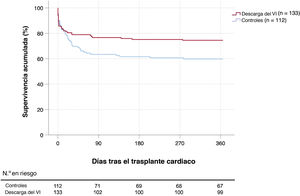
Supervivencia postrasplanteEn general, 79 pacientes (32,2%) murieron durante el primer año después del TxC. Entre las causas de muerte se pueden citar: infección (n=28), disfunción primaria del injerto (n=27), insuficiencia multiorgánica no especificada (n=9), hemorragia (n=8), rechazo agudo (n=2), ictus (n=2), insuficiencia renal (n=1) e insuficiencia respiratoria (n=1). Las curvas de supervivencia de Kaplan-Meier se muestran en la figura 1 y la figura 3. La supervivencia acumulada a 1 año tras el trasplante fue del 74,4% del grupo de DVI (34 muertes) y el 59,8% del grupo de control (45 muertes). Según la prueba del orden logarítmico univariante, los candidatos a TxC asistidos con DVI tuvieron una supervivencia 1 año después del trasplante significativamente mayor que los del grupo de control (p=0,025).
Entre los candidatos varones, la supervivencia a 1 año del TxC fue del 76,5% de los tratados con DVI frente al 62,8% de los tratados sin descarga (p=0,042). Entre las mujeres, la supervivencia a 1 año del TxC fue del 68,6% de las tratadas con DVI y el 50% de las tratadas sin descarga (p=0,142).
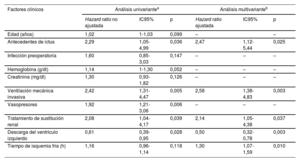
Los análisis multivariante de regresión escalonada retrógrada de Cox identificaron 5 factores clínicos asociados con el riesgo de mortalidad a 1 año del TxC en la cohorte del estudio (tabla 3): antecedente de ictus (HR ajustada=2,47; intervalo de confianza del 95% [IC95%], 1,12-5,44; p=0,025), tiempo de isquemia fría (HR ajustada=1,30; IC95%, 1,07-1,59; p=0,010), tratamiento de sustitución renal previo al trasplante (HR ajustada=2,14; IC95%, 1,05-4,38; p=0,037), ventilación mecánica invasiva previa al trasplante (HR ajustada=2,58; IC95%, 1,38-4,83; p=0,003) y DVI previa al trasplante (HR ajustada=0,50; IC95%, 0,32-0,78; p=0,003). La fuerza de la asociación entre la DVI antes del trasplante y la mortalidad a 1 año en varones (HR ajustado=0,48; IC95%, 0,28-0,83) y mujeres (HR ajustado=0,49; IC95%, 0,21-1,12) fue similar; sin embargo, en el último grupo, la asociación no alcanzó significación estadística, probablemente a causa del pequeño tamaño muestral.
Factores clínicos asociados con la mortalidad a 1 año del trasplante: análisis de regresión de Cox univariante y multivariante
| Factores clínicos | Análisis univariantea | Análisis multivarianteb | ||||
|---|---|---|---|---|---|---|
| Hazard ratio no ajustada | IC95% | p | Hazard ratio ajustada | IC95% | p | |
| Edad (años) | 1,02 | 1-1,03 | 0,099 | – | – | |
| Antecedentes de ictus | 2,29 | 1,05-4,99 | 0,036 | 2,47 | 1,12-5,44 | 0,025 |
| Infección preoperatoria | 1,60 | 0,85-3,03 | 0,147 | – | – | – |
| Hemoglobina (g/dl) | 1,14 | 1-1,30 | 0,052 | – | – | – |
| Creatinina (mg/dl) | 1,30 | 0,93-1,82 | 0,126 | – | – | – |
| Ventilación mecánica invasiva | 2,42 | 1,31-4,47 | 0,005 | 2,58 | 1,38-4,83 | 0,003 |
| Vasopresores | 1,92 | 1,21-3,06 | 0,006 | – | – | – |
| Tratamiento de sustitución renal | 2,08 | 1,04-4,17 | 0,039 | 2,14 | 1,05-4,38 | 0,037 |
| Descarga del ventrículo izquierdo | 0,61 | 0,39-0,95 | 0,028 | 0,50 | 0,32-0,78 | 0,003 |
| Tiempo de isquemia fría (h) | 1,16 | 0,96-1,14 | 0,118 | 1,30 | 1,07-1,59 | 0,010 |
IC95%: intervalo de confianza del 95%.
La asociación inversa entre la DVI mecánica y la mortalidad a 1 año se observó tanto en pacientes tratados con BCIAo solo (HR ajustada=0,52; IC95%, 0,32-0,84; p=0,007) como en los tratados con otras estrategias de DVI mecánica (HR ajustada=0,43; IC95%, 0,19-0,97; p=0,042).
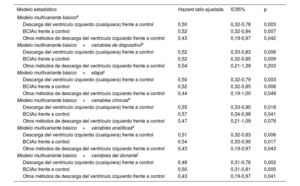
Se realizaron nuevos ajustes multivariantes para evaluar el posible sesgo de confusión añadiendo otras covariables relacionadas con los momentos temporales y las características de los dispositivos, los receptores y los donantes que se consideraron posibles factores de confusión. Con todo, no se observaron cambios relevantes en las asociaciones estadísticas observadas (tabla 4).
Asociaciones estadísticas entre la descarga del ventrículo izquierdo y la mortalidad a 1 año del trasplante: resultados según varios modelos multivariantes
| Modelo estadístico | Hazard ratio ajustada | IC95% | p |
|---|---|---|---|
| Modelo multivariante básicoa | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,50 | 0,32-0,78 | 0,003 |
| BCIAo frente a control | 0,52 | 0,32-0,84 | 0,007 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,43 | 0,19-0,97 | 0,042 |
| Modelo multivariante básico+variables de dispositivob | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,52 | 0,33-0,83 | 0,006 |
| BCIAo frente a control | 0,52 | 0,32-0,85 | 0,009 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,54 | 0,21-1,39 | 0,203 |
| Modelo multivariante básico+etapac | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,50 | 0,32-0,79 | 0,003 |
| BCIAo frente a control | 0,52 | 0,32-0,85 | 0,008 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,44 | 0,19-1,00 | 0,049 |
| Modelo multivariante básico+variables clínicasd | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,55 | 0,33-0,90 | 0,018 |
| BCIAo frente a control | 0,57 | 0,34-0,98 | 0,041 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,47 | 0,21-1,09 | 0,078 |
| Modelo multivariante básico+variables analíticase | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,51 | 0,32-0,83 | 0,006 |
| BCIAo frente a control | 0,54 | 0,33-0,90 | 0,017 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,43 | 0,19-0,97 | 0,043 |
| Modelo multivariante básico+variables del donantef | |||
| Descarga del ventrículo izquierdo (cualquiera) frente a control | 0,48 | 0,31-0,76 | 0,002 |
| BCIAo frente a control | 0,50 | 0,31-0,81 | 0,005 |
| Otros métodos de descarga del ventrículo izquierdo frente a control | 0,43 | 0,19-0,97 | 0,041 |
BCIAo: balón de contrapulsación intraaórtico; IC95%: intervalo de confianza del 95%.
Covariables de ajuste: antecedentes de ictus, ventilación mecánica preoperatoria, tratamiento de sustitución renal preoperatorio, tiempo de isquemia fría.
Covariables de ajuste: antecedentes de ictus, ventilación mecánica preoperatoria, tratamiento de sustitución renal preoperatorio, tiempo de isquemia fría, tipo de canulación arterial, duración de la asistencia con oxigenador extracorpóreo de membrana antes del trasplante.
Covariables de ajuste: antecedentes de ictus, ventilación mecánica preoperatoria, tratamiento de sustitución renal preoperatorio, tiempo de isquemia fría, periodo del trasplante.
Covariables de ajuste: antecedentes de ictus, ventilación mecánica preoperatoria, tratamiento de sustitución renal preoperatorio, tiempo de isquemia fría, edad, sexo, shock cardiogénico por infarto agudo de miocardio, antecedentes de fibrilación auricular, antecedentes de paro cardiaco, dispositivo cardiaco implantable.
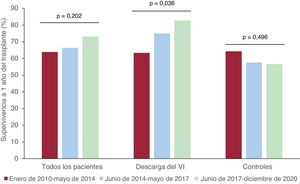
La figura 4 muestra un análisis estratificado de las tasas de supervivencia a 1 año del TxC en la población del estudio según los periodos temporales. En toda la cohorte, la supervivencia postrasplante a 1 año aumentó del 63,9% en la etapa 1 al 66,3% en la etapa 2 y al 73,9% en la etapa 3; sin embargo, esta tendencia no alcanzó significación estadística (p=0,240).
Las cifras de supervivencia a 1 año del TxC de los pacientes asistidos con DVI aumentaron significativamente con el tiempo (etapa 1, 63,4%; etapa 2, 75%; etapa 3, 82,7%; p=0,036) y fueron mayores que las del grupo de control, que se mantuvieron sin cambios (etapa 1, 64,3%; etapa 2, 57,5%; etapa 3, 56,7%; p=0,496).
DISCUSIÓNEn nuestro estudio con una cohorte española multicéntrica de pacientes asistidos con ECMO-VA como puente al TxC, la DVI mecánica, independientemente del tipo, se asoció con una supervivencia considerablemente mayor a 1 año del trasplante. Por lo que se sabe, este es el primer estudio que indica que el uso de la DVI puede influir positivamente en los resultados del trasplante de estos pacientes.
El ECMO-VA se utiliza mucho en pacientes en shock cardiogénico como potencial asistencia a la recuperación del miocardio o tratamientos de sustitución cardiaca, como el TxC o el implante de dispositivos de asistencia del VI13. Sin embargo, la asistencia de ECMO-VA se asocia con varios efectos hemodinámicos perjudiciales, como el aumento de la poscarga del VI, la apertura inadecuada de la válvula aórtica, la elevación de la presión telediastólica del VI, la dilatación del VI y el empeoramiento de la función ventricular, la isquemia miocárdica, el edema pulmonar y la formación de trombos en el ventrículo14,15.
Se pueden utilizar varios métodos mecánicos para la DVI para atenuar las consecuencias hemodinámicas adversas de la fisiología del ECMO-VA, como varias estrategias de ventilación quirúrgica o percutánea de las cavidades cardiacas izquierdas, así como la asistencia concomitante con dispositivos mecánicos complementarios como BCIAo o dispositivos percutáneos de asistencia del VI. En nuestra cohorte, más de la mitad de los pacientes fueron tratados con DVI, principalmente mediante la inserción de un BCIAo, en consonancia con otros estudios3.
Un metanálisis de estudios observacionales indica que la DVI puede conllevar un aumento de la supervivencia de los pacientes en shock cardiogénico asistidos con ECMO-VA16-18. A pesar de ello, un ensayo clínico aleatorizado reciente19 no pudo demostrar ningún impacto significativo de una estrategia habitual temprana de DVI mediante una cánula transeptal auricular izquierda. Sorprendentemente, la tasa de grupos cruzados fue elevada en ese ensayo, ya que se trató con DVI a casi la mitad de los pacientes del grupo de control en algún momento durante el periodo de seguimiento19.
Hay que reconocer que, en nuestra cohorte, los pacientes tratados con o sin DVI presentaban diferentes características clínicas basales y, por consiguiente, la influencia observada de la estrategia de asistencia combinada en el pronóstico posterior al trasplante podría verse afectada por el sesgo de confusión. Sin embargo, cabe señalar que el perfil clínico de los pacientes que recibieron DVI no necesariamente indicaba menor riesgo que el del grupo de control. De hecho, el grupo sin carga presentó cifras más altas de shock cardiogénico por infarto agudo de miocardio, cifras más altas de ventilación mecánica invasiva en el momento de la cirugía de trasplante y tiempos más largos de isquemia fría. Aun así, la supervivencia posterior al trasplante fue mucho mayor en el grupo sin carga. Además, la asociación entre la descarga preoperatoria del VI y el aumento de la supervivencia postrasplante se mantuvo estadísticamente significativo tras amplios ajustes multivariantes para controlar los posibles factores de confusión. Curiosamente, las tasas de supervivencia postrasplante del grupo de intervención fueron similares entre los pacientes tratados con BCIAo u otros tipos de DVI mecánica. Estudios previos no pudieron demostrar una clara ventaja en relación con la supervivencia de los métodos alternativos de la DVI durante la asistencia con ECMO-VA, como Impella, frente al tratamiento más sencillo con BCIAo concomitante20.
La DVI mecánica tiene varios efectos fisiopatológicos positivos que pueden promover beneficios clínicos en los pacientes asistidos con ECMO-VA. Por ejemplo, la asistencia concomitante de BCIAo se ha asociado con una reducción importante de la presión de oclusión de la arteria pulmonar y las dimensiones del VI, así como un aumento significativo en la tensión diferencial21. Se observaron efectos similares en la pequeña cohorte de pacientes de nuestro estudio que tenían datos hemodinámicos disponibles; la DVI se asoció con menores diámetros del VI, presión de enclavamiento capilar y presión pulmonar media. Esta mejora hemodinámica preoperatoria podría afectar al pronóstico del paciente, en consonancia con los resultados de otras cirugías cardiacas22. En el contexto específico de puente al trasplante, existe una justificación fisiopatológica para plantear la hipótesis de que la reducción de la congestión pulmonar y las presiones pulmonares de los candidatos en espera de un corazón podría generar mejores resultados tras el trasplante, sobre todo al disminuir el riesgo de insuficiencia cardiaca temprana del corazón trasplantado. En nuestro estudio, los pacientes asistidos con DVI presentaron cifras numéricamente más bajas de disfunción del injerto en el posoperatorio temprano y necesidad de asistencia circulatoria mecánica; sin embargo, esta asociación no fue estadísticamente significativa.
En nuestra cohorte, la supervivencia a 1 año del TxC fue aceptable si se tiene en cuenta el estado crítico de la población tratada. Históricamente, los resultados tras el trasplante de los candidatos españoles asistidos con ECMO-VA fue significativamente peor que el de los asistidos con otros modos de asistencia circulatoria mecánica23. Sin embargo, los resultados tras el trasplante de los pacientes asistidos con ECMO-VA experimentaron una mejora temporal en la cohorte del estudio y las crecientes tasas de uso de estrategias mecánicas auxiliares en la DVI habrían sido importantes en este contexto. Así pues, la supervivencia a 1 año del TxC urgente con asistencia combinada de ECMO-VA y DVI alcanzó el 82%, una cifra bastante cercana a la observada en otros centros internacionales de elevada carga asistencial24.
LimitacionesEste estudio tiene varias limitaciones. Al tratarse de un trabajo de investigación retrospectivo, puede ser objeto de varias fuentes de sesgo, como los sesgos de selección, información y confusión. Por lo tanto, sus resultados deben considerarse solo generadores de hipótesis. Un punto fuerte de este estudio es la inclusión de toda la actividad de los centros españoles que mantuvieron activo un programa de TxC para adultos durante el periodo evaluado. Sin embargo, esto también significa que puede haber posibles diferencias en los protocolos de selección y tratamiento entre los centros, que no se han tenido en cuenta en el análisis. Asimismo, los eventos clínicos fueron validados por investigadores locales, y no por un comité independiente. Aunque nuestros resultados pueden aplicarse directamente a España, se debe tener precaución al aplicarlos a otros países con sistemas compartidos de donación de órganos, que pueden diferenciarse del sistema español.
Hay que reconocer que la caracterización de la población del estudio podría haberse mejorado si se hubieran recopilado otras variables clínicas importantes, como la escala de vasoactivos inotrópicos o los estadios de la Society of Cardiovascular Angiography and Intervention; sin embargo, esta información no estaba disponible para el estudio. Además, el número de valores ausentes en las variables hemodinámicas era demasiado grande para extraer conclusiones fiables. Tampoco puede proporcionarse información específica sobre el tipo y la duración de la asistencia circulatoria mecánica posterior al trasplante de los pacientes que la necesitaron, por lo que no se pueden extraer conclusiones sobre su posible impacto en los resultados del estudio.
Por último, aunque se ha hecho un esfuerzo considerable para corregir los potenciales factores de confusión más relevantes, es posible que falten algunas variables que podrían afectar a estas diferencias. A pesar de ello, se ha recogido un gran número de variables para reducir la influencia de potenciales factores de confusión.
CONCLUSIONESEste estudio indica que la DVI en pacientes asistidos con ECMO-VA como puente al TxC urgente podría asociarse con una mayor supervivencia a 1 año del TxC; sin embargo, los motivos que podrían explicar este hallazgo no están completamente claros. Se necesitan más estudios clínicos y mecánicos para confirmar esta nueva hipótesis y ofrecer información fisiopatológica que respalde los beneficios potenciales de la DVI en el contexto del puente al trasplante antes de hacer recomendaciones terapéuticas específicas.
FINANCIACIÓNEl estudio ASIS-TC fue financiado por la Fundación Mutua Madrileña (Madrid) a través de 2 becas de investigación públicas (Ayudas para Investigación en Salud, X y XIV convocatorias anuales, años 2014 y 2018), obtenidas por el primer autor de este artículo (E. Barge-Caballero).
CONSIDERACIONES ÉTICASEl protocolo del estudio fue aprobado por primera vez por el Comité de Ética en Investigación Clínica de la Comunidad Autónoma de Galicia y después fue ratificado por los comités de revisión de todos los hospitales participantes en el estudio. Dada la naturaleza retrospectiva del estudio, los investigadores obtuvieron una exención del comité de ética y no tuvieron la obligación de obtener el consentimiento informado por escrito de los participantes en el estudio. Todos los datos clínicos recopilados en el estudio fueron seudoanonimizados para garantizar que terceros no pudieran identificar a los participantes en el estudio. El estudio abordó los posibles sesgos de sexo y género según las directrices de SAGER (Sex and Gender Equity in Research).
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó inteligencia artificial para la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESD. Enríquez-Vázquez y E. Barge-Caballero contribuyeron por igual al artículo y son los primeros autores. D. Enríquez-Vázquez contribuyó al concepto, la redacción del original y la recopilación de datos. E. Barge-Caballero contribuyó al concepto, la redacción del original, la recopilación de datos, la obtención de fondos, el análisis estadístico, la coordinación y la supervisión. M.G. Crespo-Leiro contribuyó a la obtención de fondos, la recopilación de datos, la revisión del original, la coordinación y la supervisión. J. Muñiz contribuyó a la obtención de fondos, el análisis estadístico y la revisión del original. Los demás autores contribuyeron a la recopilación de datos y la revisión del original.
CONFLICTO DE INTERESESNada que declarar.
- –
El ECMO-VA se puede utilizar como puente al trasplante cardiaco de urgencia para ciertos enfermos graves seleccionados.
- –
La descarga mecánica del ventrículo izquierdo se utiliza con frecuencia como tratamiento complementario en pacientes con ECMO-VA para prevenir el desarrollo de distensión del ventrículo izquierdo y congestión pulmonar, que son consecuencias conocidas del aumento de la poscarga del ventrículo izquierdo en estos pacientes.
- –
A pesar de algunas pruebas que respaldan los beneficios clínicos de la descarga mecánica del ventrículo izquierdo de pacientes en shock cardiogénico tratados con ECMO-VA, su posible impacto en el contexto específico de puente al trasplante continúa siendo desconocido.
- –
El estudio indica que el uso concomitante de descarga mecánica del ventrículo izquierdo en pacientes con ECMO-VA como puente al trasplante cardiaco de urgencia podría asociarse con mejores resultados tras el trasplante.