El objetivo es evaluar el impacto del acceso vascular en las complicaciones hemorrágicas tras una intervención coronaria percutánea en pacientes con alto riesgo de sangrado (ARS) a los 30 días y a los 2 años.
MétodosEl presente estudio es un subanálisis predefinido del estudio LEADERS FREE, que incluyó a 2.432 pacientes con ARS y en el que el stent farmacoactivo Biolimus A9 resultó superior al stent convencional en seguridad y eficacia.
ResultadosEl acceso radial (AR) se utilizó en 1.454 pacientes (59,8%) y el femoral (AF), en 978 (40,2%), ambos a elección del operador. La seguridad y los beneficios del stent farmacoactivo sobre el convencional fueron independientes del acceso vascular. A los 30 días y a los 2 años, habían sufrido un sangrado mayor el 2,4 y el 7,5% de los pacientes con AR y el 4,6 y el 10,9% de los pacientes con AF (p=0,003), la mayoría en ambos grupos (el 2,1 y el 7,0% del de AR; el 3,2 y el 9,4% del de AF) no relacionados con el sitio de acceso vascular. El AR se asoció con una reducción significativa en las tasas ajustadas de sangrado mayor tanto a 30 días (HR=1,98; IC95%, 1,25-3,11; p=0,003) como a 2 años de seguimiento (HR=1,51; IC95%, 1,14-2,01; p=0,003).
ConclusionesLos operadores prefirieron el AR en la mayoría de los pacientes con ARS, lo cual se asoció con una reducción significativa del sangrado mayor. Asimismo, un número significativo de sangrados en el seguimiento de esta población son no relacionados con el acceso vascular.
Palabras clave
El sitio de acceso vascular en la intervención coronaria percutánea (ICP) cumple una función esencial entre los factores de riesgo hemorrágico asociados al procedimiento. La adopción del acceso radial (AR) como acceso vascular de primera elección para los pacientes sometidos a ICP se ha extendido a escala internacional y hoy está demostrado que reduce las complicaciones hemorrágicas relacionadas con el sitio de acceso en un número creciente de poblaciones y entornos1,2, como los pacientes ancianos3 o con síndrome coronario agudo (SCA)4, insuficiencia renal5 o shock cardiogénico6. En el caso de los pacientes con SCA, la reducción de complicaciones vasculares y de hemorragia mayor con el AR se asocia significativamente con una disminución de la mortalidad7,8.
Se calcula que cerca del 20% de los pacientes con enfermedad coronaria sometidos a ICP presentan alto riesgo hemorrágico (ARH)9,10. Esta población engloba principalmente a pacientes ancianos (≥ 75 años), los que están en tratamiento prolongado con anticoagulantes orales (ACO) y los que presentan anemia, insuficiencia renal o cáncer o que precisan cirugía mayor10,11. Pese a que cualquier estrategia de prevención de las hemorragias es de particular importancia para estos pacientes, no hay estudios específicos que analicen los posibles riesgos y beneficios del AR comparado con el acceso femoral (AF) en esta población.
El presente estudio es un subanálisis predefinido del estudio LEADERS FREE10,11, que tiene por objeto evaluar el efecto del AR y el AF en las complicaciones hemorrágicas y el pronóstico a los 30 días y a los 2 años de seguimiento tras una ICP en pacientes con ARH con implante de un stent farmacoactivo Biolimus A9 libre de polímero o un stent convencional10.
MÉTODOSPacientes y dispositivos del estudioSe incluyó a todos los pacientes sometidos a ICP que participaron en el estudio LEADERS FREE, cuyos diseño y resultados se han publicado previamente10,11. A modo de resumen, LEADERS FREE es un ensayo clínico aleatorizado a doble ciego que integró a 2.466 pacientes provenientes de 68 centros participantes de 20 países desde diciembre de 2012 hasta mayo de 2014. Los pacientes debían cumplir 1 o varios de los 13 criterios de inclusión establecidos de riesgo hemorrágico creciente (tabla 1), entre los que se emplearon con mayor frecuencia la edad ≥ 75 años, el tratamiento prolongado con ACO, la insuficiencia renal, la cirugía mayor programada, la anemia o transfusión reciente y el cáncer. Se aleatorizó a los pacientes 1:1 al tratamiento con ICP con implante de un stent farmacoactivo BA9 libre de polímero (BiofreedomTM DCS, Biosensors Europe, Morges, Suiza) o un stent convencional de características similares (GazelleTM, Biosensors Interventional Technologies, Singapur). Tanto los pacientes con SCA (infarto agudo de miocardio con y sin elevación del segmento ST) como con enfermedad coronaria estable eran candidatos para participar en el ensayo. Por su parte, el presente estudio es el resultado de un subanálisis predefinido en función del acceso vascular empleado (AR o AF).
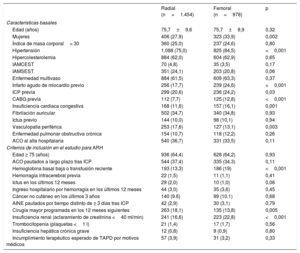
Características basales y criterios de inclusión de los pacientes
| Radial (n=1.454) | Femoral (n=978) | p | |
|---|---|---|---|
| Características basales | |||
| Edad (años) | 75,7±9,6 | 75,7±8,9 | 0,32 |
| Mujeres | 406 (27,9) | 323 (33,9) | 0,002 |
| Índice de masa corporal> 30 | 360 (25,0) | 237 (24,6) | 0,80 |
| Hipertensión | 1.088 (75,0) | 825 (84,5) | <0,001 |
| Hipercolesterolemia | 884 (62,0) | 604 (62,9) | 0,65 |
| IAMCEST | 70 (4,8) | 35 (3,5) | 0,17 |
| IAMSEST | 351 (24,1) | 203 (20,8) | 0,06 |
| Enfermedad multivaso | 884 (61,5) | 609 (63,3) | 0,37 |
| Infarto agudo de miocardio previo | 256 (17,7) | 239 (24,6) | <0,001 |
| ICP previa | 299 (20,6) | 236 (24,2) | 0,03 |
| CABG previa | 112 (7,7) | 125 (12,8) | <0,001 |
| Insuficiencia cardiaca congestiva | 168 (11,6) | 157 (16,1) | 0,001 |
| Fibrilación auricular | 502 (34,7) | 340 (34,8) | 0,93 |
| Ictus previo | 144 (10,0) | 98 (10,1) | 0,94 |
| Vasculopatía periférica | 253 (17,6) | 127 (13,1) | 0,003 |
| Enfermedad pulmonar obstructiva crónica | 154 (10,7) | 118 (12,2) | 0,26 |
| ACO al alta hospitalaria | 540 (36,7) | 331 (33,5) | 0,11 |
| Criterios de inclusión en el estudio para ARH | |||
| Edad ≥ 75 (años) | 936 (64,4) | 628 (64,2) | 0,93 |
| ACO pautados a largo plazo tras ICP | 544 (37,4) | 335 (34.3) | 0,11 |
| Hemoglobina basal baja o transfusión reciente | 193 (13,3) | 186 (19) | <0,001 |
| Hemorragia intracerebral previa | 22 (1,5) | 11 (1,1) | 0,41 |
| Ictus en los últimos 12 meses | 29 (2,0) | 10 (1,0) | 0,06 |
| Ingreso hospitalario por hemorragia en los últimos 12 meses | 44 (3,0) | 35 (3,6) | 0,45 |
| Cáncer no cutáneo en los últimos 3 años | 140 (9.6) | 99 (10.1) | 0,68 |
| AINE pautados por tiempo distinto de ≥ 3 días tras ICP | 42 (2,9) | 30 (3,1) | 0,79 |
| Cirugía mayor programada en los 12 meses siguientes | 263 (18,1) | 135 (13,8) | 0,005 |
| Insuficiencia renal (aclaramiento de creatinina <40 ml/min) | 241 (16,6) | 223 (22,8) | <0,001 |
| Trombocitopenia (plaquetas <1 l) | 21 (1,4) | 17 (1,7) | 0,56 |
| Insuficiencia hepática crónica grave | 12 (0,8) | 9 (0,9) | 0,80 |
| Incumplimiento terapéutico esperado de TAPD por motivos médicos | 57 (3,9) | 31 (3,2) | 0,33 |
ACO: anticoagulantes orales; AINE: antiinflamatorios no esteroideos; ARH: alto riesgo hemorrágico; CABG: cirugía de revascularización coronaria; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan n (%) o media±desviación estándar.
La ICP se realizó según el procedimiento habitual de cada centro participante. La elección del sitio de acceso vascular, el tratamiento antitrombótico periprocedimiento y la preparación de la lesión se dejaron a discreción del operador. Todas las lesiones diana se trataron al menos con uno de los stents del estudio. Se permitieron intervenciones seriadas en el transcurso de 1 semana desde el procedimiento inicial. Conforme al protocolo, se pautó a todos los pacientes 1 mes de tratamiento antiagregante plaquetario doble con ácido acetilsalicílico y un inhibidor del receptor plaquetario P2Y12 y, a partir de ese momento, un antiagregante plaquetario en monoterapia (ácido acetilsalicílico como opción preferida). A los pacientes en tratamiento con ACO al alta hospitalaria se les administraba tratamiento triple o ACO más clopidogrel (sin ácido acetilsalicílico) durante los primeros 30 días. Se realizó una consulta de seguimiento en el propio centro a los 30 días y a los 360 días y se estableció contacto telefónico a los 60, 120 y 720 días.
Objetivos del estudioEn el estudio LEADERS FREE, el objetivo principal de eficacia fue la incidencia de la revascularización de la lesión diana por indicación clínica, mientras que el objetivo principal de seguridad se centraba en la incidencia acumulada de la variable combinada de muerte cardiaca, infarto de miocardio (IM) y trombosis del stent (TS) probable o confirmada. Se registraron ambos objetivos hasta los dos años de la ICP de referencia. Se caracterizó el IM en función de la definición universal tercera, la trombosis del stent en consonancia con el Academic Research Consortium y hemorragia con arreglo a las definiciones del Bleeding Academic Research Consortium (BARC), que clasifican los BARC 3-5 como episodios de hemorragia mayor. La revascularización de la lesión diana por indicación clínica se definió como ICP o cirugía para: a) reestenosis de la lesión tratada que se asocia con angina de pecho o isquemia miocárdica diagnosticada, o b) reestenosis establecida en el estudio angiográfico por el laboratorio central,> 70% de la arteria tratada con o sin manifestaciones de isquemia miocárdica. Un comité de ética independiente para las complicaciones clínicas validó los objetivos principales del estudio y todas las hemorragias.
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar y las variables categóricas, como números absolutos y porcentajes. Se compararon las variables categóricas con la prueba de la χ2 y las variables continuas, mediante la prueba de la t para muestras binarias. Cuando procediera, se empleó en su lugar la prueba exacta de Fisher. Para las variables de tiempo transcurrido hasta la primera complicación, se extrajeron la hazard ratio (HR) o su intervalo de confianza del 95% (IC95%) del modelo de riesgos proporcionales de Cox sin ajuste. Las tasas de incidencia acumulada se calcularon por el estimador de Kaplan-Meier, donde el valor de p de rangos logarítmicos (log-rank) sirvió para probar si las distribuciones de supervivencia diferían con el paso del tiempo. Los supuestos de riesgos proporcionales se evaluaron mediante el análisis de los residuos de Schoenfeld, sin imputar los datos omitidos. Se comprobaron formalmente las hipótesis de proporcionalidad al incorporar las covariables que dependen del tiempo al modelo diseñado a partir de la interacción del tipo de acceso y del logaritmo de tiempo de supervivencia. Se empleó el total de datos disponibles en el análisis de todos los objetivos. Asimismo, a fin de indagar los posibles errores de cálculo del modelo y en concreto el impacto de los centros, se incluyó la variable centro como efecto aleatorio en un modelo de fragilidad con una distribución que se presume lognormal. Puesto que no se aleatorizó a los pacientes en función de la vía de acceso vascular, se ajustaron todos los análisis comparativos de AR y AF para la corrección de los desequilibrios basales con el modelo de puntuación de propensión. Las puntuaciones se obtuvieron del modelo de regresión logística por el que se ajustaron las 13 covariables basales de riesgo hemorrágico creciente que fue necesario introducir en el estudio (). Estas puntuaciones de propensión se utilizaron, a su vez, en la estimación de la probabilidad inversa con el método de ponderación del tratamiento. Todos los análisis estadísticos se realizaron en la aplicación SAS V.9.4 (SAS Institute, Cary, Carolina del Norte, Estados Unidos).
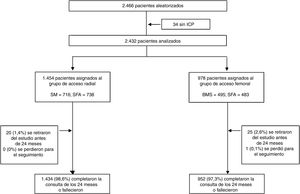
RESULTADOSDe los 2.432 pacientes sometidos a ICP del estudio LEADERS FREE, se trató a 1.454 (59,8%) con AR y 978 (40,2%) con AF. Se logró el seguimiento completo de 2.387 (98,1%) pacientes (excluidos los retirados del estudio o perdidos para el seguimiento) hasta los 730 días o la muerte (figura 1). Fallecieron 325 pacientes (el 13,3% de la cohorte total) durante el periodo de estudio. La muerte cardiaca, que formaba parte del objetivo primario, ocurrió en 156 (6,4%) pacientes, y en el caso de los 169 restantes (6,9%) fue por causa distinta de la cardiaca. Se ofrece información pormenorizada de la mortalidad no cardiaca en el (). La elección del sitio de acceso vascular difirió considerablemente de un centro a otro; se empleó el AR en el 80% (20/68) y el 20% (11/68) de los centros.
Las características basales y los criterios de inclusión se muestran en la tabla 1. En comparación con los pacientes asignados al grupo de AR, los de AF fueron con mayor frecuencia mujeres (el 27,9 frente al 33,9%; p=0,002) y presentaban de manera significativa un mayor número de enfermedades concomitantes. La mayoría de las características demográficas y de procedimiento basales se emparejaron adecuadamente en los 2 grupos (tabla 1). Con respecto a los criterios de inclusión del estudio, el grupo de AR comprendía un mayor número de pacientes con cirugía programada que exigía la interrupción del tratamiento antiagregante plaquetario doble, mientras que en el grupo de AF eran más numerosos los pacientes con anemia o transfusión reciente e insuficiencia renal. El grupo de AR, frente al de AF, integraba más pacientes con lesión diana del tronco comu, o una lesión diana más extensa, además de, en conjunto, un mayor número de stent implantados y superpuestos y una mayor longitud total del stent por paciente (tabla 2).
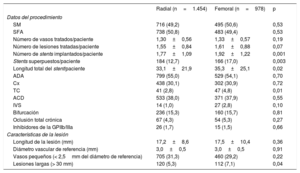
Datos del procedimiento y medicación
| Radial (n=1.454) | Femoral (n=978) | p | |
|---|---|---|---|
| Datos del procedimiento | |||
| SM | 716 (49,2) | 495 (50,6) | 0,53 |
| SFA | 738 (50,8) | 483 (49,4) | 0,53 |
| Número de vasos tratados/paciente | 1,30±0,56 | 1,33±0,57 | 0,19 |
| Número de lesiones tratadas/paciente | 1,55±0,84 | 1,61±0,88 | 0,07 |
| Número de stents implantados/paciente | 1,77±1,09 | 1,92±1,22 | 0,001 |
| Stents superpuestos/paciente | 184 (12,7) | 166 (17,0) | 0,003 |
| Longitud total del stent/paciente | 33,1±21,9 | 35,3±25,1 | 0,02 |
| ADA | 799 (55,0) | 529 (54,1) | 0,70 |
| Cx | 438 (30,1) | 302 (30,9) | 0,72 |
| TC | 41 (2,8) | 47 (4,8) | 0,01 |
| ACD | 533 (38,0) | 371 (37,9) | 0,55 |
| IVS | 14 (1,0) | 27 (2,8) | 0,10 |
| Bifurcación | 236 (15,3) | 160 (15,7) | 0,81 |
| Oclusión total crónica | 67 (4,3) | 54 (5,3) | 0,27 |
| Inhibidores de la GPIIb/IIIa | 26 (1,7) | 15 (1,5) | 0,66 |
| Características de la lesión | |||
| Longitud de la lesión (mm) | 17,2±8,6 | 17,5±10,4 | 0,36 |
| Diámetro vascular de referencia (mm) | 3,0±0,5 | 3,0±0,5 | 0,91 |
| Vasos pequeños (< 2,5mm del diámetro de referencia) | 705 (31,3) | 460 (29,2) | 0,22 |
| Lesiones largas (> 30 mm) | 120 (5,3) | 112 (7,1) | 0,04 |
ACD: arteria coronaria derecha; ADA: arteria descendente anterior; Cx: arteria coronaria circunfleja izquierda; GPIIb/IIIa: glucoproteína IIb/IIIa; IVS: injerto de vena safena; SFA: stent farmacoactivo; SM: stent metálico.
Los valores expresan n (%) o media±desviación estándar.
Al alta hospitalaria, el 99,1% de los pacientes asignados al grupo de AR y el 93,1% del grupo de AF se encontraban en tratamiento antiagregante plaquetario doble (p=0,001); al 0,5% y el 6,5%, respectivamente, se les administraban antiagregantes plaquetarios en monoterapia (p=0,001), y al 0,3 y el 0,4% no se les pautó ningún antiagregante plaquetario. Por otro lado, el 36,7% de los pacientes del grupo AR y el 33,5% del grupo de AF recibían ACO (el 0,5 y el 5,9% respectivamente, ACO+clopidogrel; p=0,001; el 33,1 y el 23,8%, en triple terapia; p=0,001).
Inmediatamente después de la consulta de seguimiento a los 30 días, el 9,3% de los pacientes asignados al grupo de AR y el 9,8% del grupo de AF se encontraban en tratamiento antiagregante plaquetario doble; al 88,9 y el 86,5%, respectivamente, se les administraban antiagregantes plaquetarios en monoterapia; al 1,8 y el 3,8%, no se les pautó ningún antiagregante plaquetario, y al 37,2% de los pacientes del grupo de AR y el 33,1% del grupo de AF recibían ACO (el 2,1 y el 1,3%, en triple terapia; el 7,3 y el 11,6%, ACO+clopidogrel; p=0,001).
A los 24 meses, el 5,8% del grupo de AR y el 7,5% del de AF recibían tratamiento antiagregante plaquetario doble (p=0,11); el 81,2 y el 72,7% respectivamente, antiagregantes plaquetarios en monoterapia (p=0,001) y el 13,1 y el 19,8% no tomaban antiagregante plaquetario alguno (p=0,001). Se administraba ACO al 39,2% de los pacientes del grupo de AR y al 35,7% del grupo de AF (p=0,11).
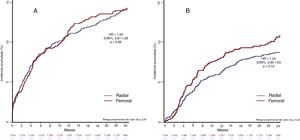
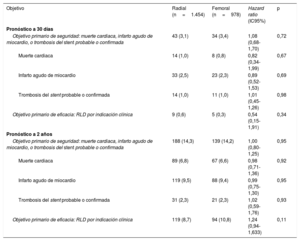
Objetivos primariosA los 30 días, el objetivo primario de seguridad (variable combinada de muerte cardiaca, infarto agudo de miocardio y TS probable o confirmada) sucedió en 43 pacientes (3,2%) del grupo AR y en 34 (3,4%) del de AF (HR=1,08; IC95%, 0,68-1,70; p=0,72) (tabla 3). El objetivo primario de eficacia (revascularización de la lesión diana por indicación clínica) aconteció en 9 pacientes (0,7%) del grupo de AR y en 5 (0,4%) del de AF (HR=0,54; IC95%, 0.15-1,91; p=0,34) (tabla 3). Las curvas de tiempo transcurrido hasta la primera complicación de los objetivos primarios de seguridad y de eficacia a los 30 días se muestran en la figura 2.
Incidencia de los objetivos de seguridad y eficacia a los 30 días y a los 2 años
| Objetivo | Radial (n=1.454) | Femoral (n=978) | Hazard ratio (IC95%) | p |
|---|---|---|---|---|
| Pronóstico a 30 días | ||||
| Objetivo primario de seguridad: muerte cardiaca, infarto agudo de miocardio, o trombosis del stent probable o confirmada | 43 (3,1) | 34 (3,4) | 1,08 (0,68-1,70) | 0,72 |
| Muerte cardiaca | 14 (1,0) | 8 (0,8) | 0,82 (0,34-1,99) | 0,67 |
| Infarto agudo de miocardio | 33 (2,5) | 23 (2,3) | 0,89 (0,52-1,53) | 0,69 |
| Trombosis del stent probable o confirmada | 14 (1,0) | 11 (1,0) | 1,01 (0,45-1,26) | 0,98 |
| Objetivo primario de eficacia: RLD por indicación clínica | 9 (0,6) | 5 (0,3) | 0,54 (0,15-1,91) | 0,34 |
| Pronóstico a 2 años | ||||
| Objetivo primario de seguridad: muerte cardiaca, infarto agudo de miocardio, o trombosis del stent probable o confirmada | 188 (14,3) | 139 (14,2) | 1,00 (0,80-1,25) | 0,95 |
| Muerte cardiaca | 89 (6,8) | 67 (6,6) | 0,98 (0,71-1,36) | 0,92 |
| Infarto agudo de miocardio | 119 (9,5) | 88 (9,4) | 0,99 (0,75-1,30) | 0,95 |
| Trombosis del stent probable o confirmada | 31 (2,3) | 21 (2,3) | 1,02 (0,59-1,76) | 0,93 |
| Objetivo primario de eficacia: RLD por indicación clínica | 119 (8,7) | 94 (10,8) | 1,24 (0,94-1,633) | 0,11 |
IC95%: intervalo de confianza del 95%; RLD: revascularización de la lesión diana.
Salvo otra indicación, los valores expresan n (%).
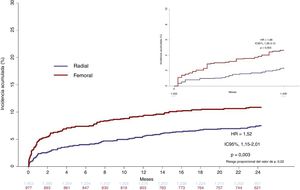
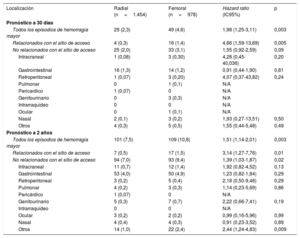
A los 30 días, se produjo hemorragia mayor (BARC 3-5) en 78 pacientes: 29 (2,4%) del grupo de AR y 49 (4,6%) del de AF (HR=1,98; IC95%, 1,25-3,11; p=0,003). De estos, se vieron afectados por las complicaciones hemorrágicas asociadas con el sitio de acceso 20 pacientes (26%), 4 del grupo de AR y 16 del de AF (HR=4,66; IC95%, 1,59-13,69; p=0,005) (figura 3). El resto de los 58 (74%) episodios de hemorragia mayor no se relacionaron con el sitio de acceso (25 [2,1%] en el grupo de AR y 33 [3,2%] en el de AF) y consistieron, principalmente, en hemorragia gastrointestinal en ambos grupos (figura 3, figura 4 y tabla 4).
Curvas de tiempo transcurrido hasta la primera complicación para el objetivo de hemorragia mayor (BARC 3-5) relacionada con el sitio de acceso (A) y no relacinada con el sitio de acceso (B) a los 30 días (incrustación) y a los 2 años. HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Incidencia y localización de los episodios de hemorragia mayor (BARC 3-5) a los 30 días y a los 2 años
| Localización | Radial (n=1.454) | Femoral (n=978) | Hazard ratio (IC95%) | p |
|---|---|---|---|---|
| Pronóstico a 30 días | ||||
| Todos los episodios de hemorragia mayor | 29 (2,3) | 49 (4,6) | 1,98 (1,25-3,11) | 0,003 |
| Relacionados con el sitio de acceso | 4 (0,3) | 16 (1,4) | 4,66 (1,59-13,69) | 0,005 |
| No relacionados con el sitio de acceso | 25 (2,0) | 33 (3,1) | 1,55 (0,92-2,59) | 0,09 |
| Intracraneal | 1 (0,08) | 3 (0,30) | 4,28 (0,45-40,036) | 0,20 |
| Gastrointestinal | 16 (1,3) | 14 (1,2) | 0,91 (0,44-1,90) | 0,81 |
| Retroperitoneal | 1 (0,07) | 3 (0,20) | 4,07 (0,37-43,82) | 0,24 |
| Pulmonar | 0 | 1 (0,1) | N/A | |
| Pericardico | 1 (0,07) | 0 | N/A | |
| Genitourinario | 0 | 3 (0,3) | N/A | |
| Intrarraquídeo | 0 | 0 | N/A | |
| Ocular | 0 | 1 (0,1) | N/A | |
| Nasal | 2 (0,1) | 3 (0,2) | 1,93 (0,27-13,51) | 0,50 |
| Otros | 4 (0,3) | 5 (0,5) | 1,55 (0,44-5,48) | 0,49 |
| Pronóstico a 2 años | ||||
| Todos los episodios de hemorragia mayor | 101 (7,5) | 109 (10,8) | 1,51 (1,14-2,01) | 0,003 |
| Relacionados con el sitio de acceso | 7 (0,5) | 17 (1,5) | 3,14 (1,27-7,76) | 0,01 |
| No relacionados con el sitio de acceso | 94 (7,0) | 93 (9,4) | 1,39 (1,03-1,87) | 0,02 |
| Intracraneal | 11 (0,7) | 12 (1,4) | 1,92 (0,82-4,52) | 0,13 |
| Gastrointestinal | 53 (4,0) | 50 (4,9) | 1,23 (0,82-1,84) | 0,29 |
| Retroperitoneal | 3 (0,2) | 5 (0,4) | 2,18 (0,50-9,48) | 0,29 |
| Pulmonar | 4 (0,2) | 3 (0,3) | 1,14 (0,23-5,69) | 0,86 |
| Pericárdico | 1 (0,07) | 0 | N/A | |
| Genitourinario | 5 (0,3) | 7 (0,7) | 2,22 (0,66-7,41) | 0,19 |
| Intrarraquídeo | 0 | 0 | N/A | |
| Ocular | 3 (0,2) | 2 (0,2) | 0,99 (0,16-5,96) | 0,99 |
| Nasal | 4 (0,4) | 4 (0,3) | 0,91 (0,23-3,52) | 0,89 |
| Otros | 14 (1,0) | 22 (2,4) | 2,44 (1,24-4,83) | 0,009 |
IC95%: intervalo de confianza del 95%; N/A: no aplicable.
Los valores expresan n (%) o media±desviación estándar.
A los 2 años, el objetivo primario de seguridad se alcanzó en 327 pacientes (14,3%): 188 (14,3%) del grupo de AR y 139 (14,3%) del de AF (HR=1,00; IC95%, 0,80-1,25; p=0,95) (tabla 3); mientras que el objetivo primario de eficacia se cumplió en el caso de 213 pacientes (9,6%): 119 (8,8%) del grupo de AR y 94 (10,9%) del de AF (HR=1,24; IC95%, 0,94-1,63; p=0,11). Las curvas de tiempo transcurrido hasta la primera complicación de los objetivos primarios de seguridad y de eficacia a los 2 años se presentan en la figura 2.
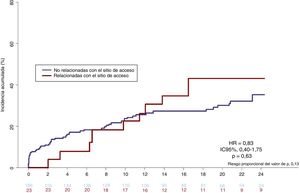
A los 2 años, se había producido hemorragia mayor en 101 pacientes (7,5%) del grupo de AR y 109 (10,9%) del de AF (HR=1,51; IC95%, 1,14-2,01; p=0,003). De estos, las complicaciones hemorrágicas relacionadoas con el sitio de acceso afectaron a 24 (11%) pacientes, 7 del grupo de AR y 17 del de AF (HR=3,14; IC95%, 1,27-7,76; p=0,01). Los 187 (89%) episodios de hemorragia mayor restantes no estaban relacionados con el sitio de acceso (94 [7,0%] en el grupo de AR y 93 [9,4%] en el de AF; p=0,02) y más de la mitad fueron hemorragias gastrointestinales en ambos grupos (figura 3, figura 4 y tabla 4). Las tasas de mortalidad asociada durante el seguimiento a los 2 años de los episodios de hemorragia mayor relacionados y no relacionados con el sitio de acceso fueron similares (figura 5). Los resultados del modelo de fragilidad, que se ofrecen en el material adicional (), concordaban con el análisis estándar.
Análisis de los dispositivos del estudioA la hora de analizar si el acceso vascular influyó en el citado beneficio de los stents farmacoactivos sobre los convencionales, el valor de p para la interacción no fue significativo para la seguridad (p=0,51) ni para la eficacia (p=0,39). El objetivo primario de eficacia se mantuvo a lo largo del seguimiento de 2 años tanto en el grupo de AR (HR=0,49; IC95%, 0,33-0,72; p <0,001) como en el de AF (HR=0,63; IC95%, 0,41-0,95; p=0,03), mientras que el objetivo primario de seguridad se sostuvo durante este periodo de seguimiento en el grupo de AR (HR=0,75; IC95%, 0,56-0,99; p=0,046), pero no mostró una tendencia significativa en el grupo de AF, menos numeroso (HR=0,87; IC95%, 0,62-1,23; p=0,43).
DISCUSIÓNEstos son los primeros datos que se publican acerca de cómo el sitio de acceso vascular afecta al pronóstico de los pacientes con ARH tratados con ICP. Surgieron 2 hallazgos principales: a) el empleo del AR se asoció con una reducción significativa de las complicaciones de hemorragia mayor frente al uso de AF a los 30 días y a los 2 años de seguimiento, que estuvo motivado por una reducción de las hemorragias, tanto relacionadas como no relacionadas con el sitio de acceso; b) el beneficio de seguridad y eficacia de los stents farmacoactivos frente a los metálicos, del que se ha informado previamente11,12, es independiente del sitio de acceso vascular y con magnitudes semejantes con acceso de la ICP por vía radial o vía femoral.
La guía de práctica clínica para el diagnóstico y el tratamiento del síndrome coronario agudo sin elevación del segmento ST de la Sociedad Europea de Cardiología aconseja el empleo del AR como recomendación de clase I, nivel de evidencia A, siempre que lo realice un operador experimentado13. La guía de práctica clínica sobre el tratamiento del infarto agudo de miocardio en pacientes con elevación del segmento ST prima el uso del AR sobre el AF como recomendación de clase IIa y nivel de evidencia B14. En el presente estudio, que incluye a pacientes con SCA y coronariopatía estable entre 2012 y 2014, se empleó el AR en un 60%, un porcentaje quizá menor de lo esperado para una población con ARH, que es reflejo de las importantes diferencias entre los centros y operadores participantes: en algunos centros, el uso del AR supuso el 80% y en otros, el 20%. Por otro lado, se trató mediante AF a los pacientes con tendencia a un mayor número de enfermedades concomitantes graves y, pese a que esta decisión esté más que justificada desde el punto de vista clínico en ciertas circunstancias, como son que los injertos de arteria mamaria interna contralateral se canulen, en general, con mayor facilidad por el AF y que el AR esté contraindicado en los pacientes con fístulas arteriovenosas en el antebrazo para hemodiálisis, el AF también podría ser la opción de elección de los operadores menos experimentados que normalmente se decantan por el AR en el caso de los pacientes con menos enfermedades concomitantes y una anatomía adecuada.
Aunque se estima que las hemorragias relacionadas con el sitio de acceso comprenden casi la mitad de todas las hemorragias periprocedimiento del conjunto de pacientes incluidos sin previa selección, la incidencia publicada de complicaciones hemorrágicas periprocedimiento difiere bastante entre ensayos, entre el 1 y el 12%, y se asocia con el incremento de la mortalidad a los 30 días de los pacientes con SCA15,16. La variación entre ensayos es una función de la población del estudio, así como la definición empleada en la clasificación de hemorragias17,18. En el presente estudio, el uso de la vía radial se correlacionó con un descenso significativo de la incidencia del sangrado del sitio de acceso a los 30 días y este beneficio se mantuvo a lo largo del seguimiento de 2 años para los pacientes con ARH (figura 4A).
En un análisis conjunto de registros de pacientes de 7 ensayos clínicos aleatorizados7, resultó significativamente mayor la mortalidad al año de los pacientes con hemorragia relacionada con el sitio de acceso que la de los pacientes sin hemorragias periprocedimiento (el 4,5 y el 2,5% respectivamente; odds ratio [OR]=2,03; IC95%, 1,49-2,77). El beneficio de mortalidad asociado con el AR frente al AF de los pacientes con SCA también lo ha confirmado otro metanálisis19, además de que se han apuntado varios mecanismos que explicarían la relación entre los episodios de hemorragia y la mortalidad por causa isquémica, entre los que se encuentran la anemia, la suspensión del tratamiento antiagregante plaquetario doble, el estado protrombótico motivado por la hemorragia y los efectos de la transfusiones sanguíneas20. El hecho de que en el presente estudio no se observara ningún beneficio del AR frente al AF en términos de mortalidad cardiaca, IM o TS, tanto a los 30 días como a los 2 años, es indicativo de ciertos factores: solo una minoría de pacientes ingresaron por SCA en el estudio LEADERS FREE, los pacientes con ARH se comportan de modo distinto que los incluidos sin selección previa y cabe esperar que el ciclo breve conforme al protocolo de tratamiento antiagregante plaquetario doble para todos los pacientes reduzca la necesidad de ajustes no programados de dicho tratamiento más allá de los 30 días.
Cobra importancia que los pacientes con ARH presentaban una incidencia de episodios de hemorragia, tanto relacionados como no relacionados con el sitio de acceso, que era notablemente superior a la identificada en el conjunto de pacientes no seleccionados. A los 30 días, se observó una tasa general de hemorragia mayor del 2,4% en el grupo de AR y del 4,6% en el de AF. En el ensayo RIVAL1, en el que solo participaron pacientes con SCA, la hemorragia mayor no relacionada con la cirugía de revascularización coronaria (CABG) a los 30 días sucedió al 0,7% de los pacientes del grupo de AR frente al 0,9% de los del grupo de AF. Por su parte, en el ensayo MATRIX4, la incidencia general de hemorragia mayor BARC 3-5 a los 30 días fue del 1,6% en el grupo de AR frente al 2,3% en el de AF. A la hora de estimar las complicaciones a largo plazo en este estudio, el 8,9% de los pacientes había tenido un episodio de hemorragia mayor a los 2 años, de los que un 7,5% se atribuye al grupo de AR y un 10,9%, al de AF. Por otro lado, en el registro PARIS21, donde analizaron a 4.190 pacientes dados de alta tras una ICP realizada con éxito y con el tratamiento recomendado por las guías de práctica clínica de antiagregación plaquetaria doble, se produjeron hemorragias mayores extrahospitalarias BARC 3-5 en el 3,3% a lo largo de 2 años, pero no se informó de la opción elegida de acceso vascular.
La hemorragia no relacionada con el sitio de acceso de la presente serie da cuenta de más de 3 cuartos de todos los episodios de hemorragia mayor del grupo de AR y más de 2/3 en el grupo de AF. Esta estimación supera la incidencia publicada en otros estudios4,22 y se relaciona de manera evidente con la edad avanzada, la elevada tasa de enfermedades concomitantes y la necesidad de ACO que define a la población con ARH analizada en el estudio LEADERS FREE. En un análisis conjunto de 3 ensayos clínicos aleatorizados en los que participaron 17.000 pacientes con ICP15, la hemorragia no relacionada con el sitio de acceso también supuso la mayoría de todos los episodios de hemorragia menor y mayor por TIMI (Thrombolysis in Myocardial Infarction), que cuatriplicaba la mortalidad al año, además de que la HR para la mortalidad al año de la hemorragia no relacionada con el sitio de acceso casi duplicaba a la de la hemorragia relacionada con el sitio de acceso. Este último hallazgo se distingue de la presente serie, donde la tasa de mortalidad asociada durante el seguimiento a 2 años se mostró elevada y semejante entre episodios de hemorragia mayor relacionados y no relacionados con el sitio de acceso (HR=0,83; IC95%, 0,40-1,75; p=0,63) (figura 5). Esta aparente discordancia se explicaría por las definiciones de hemorragia empleadas (TIMI frente a BARC 3-5) y las poblaciones de pacientes estudiadas (cohorte no seleccionada frente a pacientes con ARH).
En la presente serie, la localización de los episodios de hemorragia mayor se asemejó a la de las publicaciones anteriores con cohortes de pacientes que no fueron seleccionados previamente15,23, donde las hemorragias gastrointestinal, urinaria e intracraneal constituyeron la mayoría de los episodios de hemorragia mayor. La frecuencia de hemorragia no relacionada con el sitio de acceso significativamente menor en el AR que en el AF (tabla 4) refleja, con toda probabilidad, los desequilibrios iniciales entre ambos grupos de pacientes, más que cualquier beneficio específico del AR al respecto. En su conjunto, la incidencia de hemorragia relacionada con el sitio de acceso a los 30 días y a los 2 años resultó baja en ambos grupos y se relacionó con procedimientos invasivos coronarios, vasculares o valvulares. En estudios anteriores se ha informado de la creciente incidencia de embolización con el AR en comparación con el AF1. No se halló ninguna repercusión del sitio de acceso vascular en la cohorte del presente estudio en lo que respecta a las tasas de ictus tras la ICP, lo que concuerda con un metanálisis de reciente publicación24.
LimitacionesLa elección del sitio de acceso no se aleatorizó, sino que quedó a la discreción del operador, hecho que supone una limitación para la comparación de los resultados tras realizar la ICP fuera por vía de AR o de AF. Hay que añadir que no se evaluó previamente la experiencia de cada centro y operador para cada vía de acceso vascular, lo que pudo afectar a los resultados. Se pretendió corregir ciertos desequilibrios iniciales mediante el modelo de puntuación de propensión, pero faltó dar respuesta a algunas diferencias. Esta es la explicación más factible para el descenso de la tasa de hemorragia relacionada con el sitio de acceso del grupo de AR que persistía 4 meses tras la ICP (figura 4).
Las evidentes diferencias de tratamiento antiplaquetario entre los grupos de AR y de AF en diferentes secuencias temporales apuntan de nuevo a la naturaleza no aleatorizada de la comparación. De igual manera que con la elección del sitio de acceso, es muy probable que estas diferencias sean consecuencia de las opciones preferidas por cada centro al interpretar las guías de práctica clínica. Por ejemplo, los mismos centros que mostraron su preferencia por el AF también adoptaron más asiduamente la estrategia terapéutica del ensayo WOEST durante los primeros 30 días o suspendieron todo antiagregante plaquetario a partir del año a los pacientes que recibían tratamiento prolongado con ACO.
En su calidad de subanálisis predefinido, el presente estudio no se planteó una valoración completa de los stents farmacoactivos frente a los metálicos en los grupos de AR y de AF por separado, por lo que los resultados deben considerarse únicamente hallazgos de generación de hipótesis. Por último, solo se registró el sitio de acceso vascular empleado definitivamente, así que no se dispone de datos sobre un posible entrecruzamiento del sito de acceso.
CONCLUSIONESEl empleo del AR frente al AF se asoció con una reducción significativa de la tasa de hemorragia mayor, tanto relacionada como no relacionada con el sitio de acceso, a lo largo de un periodo de seguimiento de 2 años tras la ICP de pacientes con ARH, y se obtuvieron resultados semejantes en términos de la revascularización de la lesión diana por indicación clínica y del objetivo de seguridad combinado de muerte cardiaca, infarto agudo de miocardio y TS. Los beneficios de seguridad y eficacia de los stents farmacoactivos sobre los convencionales fueron independientes de la vía de acceso vascular.
FINANCIACIÓNBiosensors Europe financió el estudio LEADERS FREE.
CONFLICTO DE INTERESESP. Urban es consultor financiado por Biosensors, D. Walters ha recibido ayudas a la investigación de Biosensors y tanto S. Copt como H.-P. Stoll son empleados de Biosensors. Los demás coautores no manifiestan ningún conflicto de intereses.
- –
Se ha demostrado que la adopción del sitio de AR como abordaje vascular preferido para los pacientes tratados con ICP reduce las complicaciones hemorrágicas asociadas con el sitio de acceso en un número creciente de poblaciones y entornos.
- –
Sin embargo, se carece de pruebas irrefutables acerca del efecto pronóstico de los episodios hemorrágicos en los pacientes con ARH en función de la localización de la hemorragia y del pronóstico de la hemorragia no relacionada con el sitio de acceso en el seguimiento a corto y medio plazo.
- –
El empleo del AR se asoció con una reducción significativa de las tasas ajustadas de hemorragia mayor tanto a los 30 días como a los 2 años de seguimiento de la población con ARH. Esta diferencia estuvo motivada por las hemorragias tanto relacionadas como no relacionadas con la vía de acceso.
- –
El presente estudio demostró que la seguridad y los beneficios del stent farmacoactivo sobre el convencional fueron independientes de la vía de acceso vascular. En consecuencia, el beneficio del AR resulta incluso mayor para la población con ARH, por lo que debe primarse su empleo.