Evaluar el impacto del recambio valvular pulmonar (RVP) en pacientes con tetralogía de Fallot reparada (TFr) en la evolución de los volúmenes y función b-ventricular, y en los eventos adversos.
MétodosSe identificó adultos con TFr del registro SACHER. Se evaluó los datos seriados de cardiorresonancia magnética, ecocardiografía, capacidad de ejercicio y fracción aminoterminal del propéptido natriurético cerebral (tipo B) (NT-proBNP). El objetivo primario fue la fracción de eyección del ventrículo derecho (FEVD) medida por cardiorresonancia. Los objetivos secundarios fueron volúmenes biventriculares, capacidad de ejercicio, valores de NT-proBNP y tiempo hasta eventos adversos (arritmia auricular o ventricular, endocarditis). Se analizó las asociaciones entre el RVP previo y las trayectorias longitudinales de los resultados funcionales, y el tiempo hasta los eventos cardiacos adversos con modelos lineales de efectos mixtos y modelos de riesgos proporcionales de Cox, respectivamente.
ResultadosSe analizó a 308 pacientes (153 con y 155 sin RVP) con 887 visitas de estudio. No se asoció el RVP de manera significativa con la trayectoria de la FEVD (CE=-1,33; IC95%, –5,87-3,21; p=0,566). Se asoció el RVP previo con menor volumen telediastólico del ventrículo derecho, pero no tuvo efecto significativo en la fracción de eyección del ventrículo izquierdo, capacidad de ejercicio o valores de NT-proBNP. Se asoció el RVP previo con un riesgo incrementado de arritmias auriculares (HR=2,09; IC95%, 1,17-3,72; p=0,012) y endocarditis infecciosa (HR=12,72; IC95%, 4,69-34,49; p<0,0001), pero no con un riesgo aumentado de arritmias ventriculares sostenidas (HR=0,64; IC95%, 0,18-2,27; p=0,490).
ConclusionesNo se asoció el RVP previo de manera significativa con la trayectoria de la FEVD, pero sí con un riesgo aumentado de arritmias auriculares y endocarditis infecciosa.
Palabras clave
Partiendo de las asociaciones encontradas en estudios retrospectivos, se ha señalado que la insuficiencia pulmonar (IP) es un importante factor de riesgo de aparición tardía de complicaciones arrítmicas y disfunción sistólica progresiva del ventrículo derecho en pacientes con tetralogía de Fallot corregida (TFc)1. Teniendo en cuenta estos supuestos, se ha recomendado la sustitución protésica de la válvula pulmonar (SVP) para pacientes con IP de moderada a grave (incluso en ausencia de síntomas) para conservar la función sistólica del ventrículo derecho y reducir las complicaciones a largo plazo1-3. Recientemente la cohorte INDICATOR, un estudio de cohortes internacional, prospectivo y bien definido con más de 800 pacientes con TFc, proporcionó nueva información detallada sobre la estratificación del riesgo y el papel de la SVP en la reducción del riesgo de los pacientes con TFc4. Los datos de la cohorte INDICATOR identificaron la fracción de eyección del ventrículo derecho (FEVD), medida por resonancia magnética cardiaca (RMC), como predictor independiente de complicaciones arrítmicas, mientras que los volúmenes del ventrículo derecho y la gravedad de la IP no se asociaron con eventos adversos5. Si bien un primer análisis emparejado por puntuación de propensión de la cohorte INDICATOR no pudo demostrar ningún beneficio en el pronóstico de la SVP, su análisis más reciente con un seguimiento a más largo plazo demostró menor riesgo del objetivo compuesto de muerte o taquicardia ventricular sostenida después de la SVP6,7.
Por lo tanto, los objetivos de este estudio son averiguar las relaciones de la SVP con los cambios a largo plazo en la función sistólica del ventrículo derecho y el ventrículo izquierdo y con la aparición de complicaciones cardiovasculares a largo plazo.
MATERIAL Y MÉTODOSSe trata de un estudio de cohortes retrospectivo. Para la presentación de informes, se siguen las recomendaciones de las directrices STROBE8. Se identificó a adultos con TFc previamente inscritos en un registro suizo (registro SACHER), a quienes se hizo un seguimiento en 3 centros suizos de atención especializada. Los métodos y protocolos detallados de dicho registro ya se han publicado9. El registro y los análisis de datos actuales fueron aprobados por los comités de ética locales y todos los pacientes dieron el consentimiento informado por escrito para el análisis de los datos clínicos en el momento de la inscripción en el registro. El protocolo del estudio se ajustó a las normas éticas de la Declaración de Helsinki de 1975.
Cohorte de pacientesLa cohorte del estudio estaba formada por pacientes con TFc inscritos en el registro SACHER, a quienes se hizo seguimiento en uno de los centros participantes. Se excluyó a los pacientes con variantes de atresia pulmonar, que requieren corrección primaria con conductos protésicos, y a los pacientes sin prueba de RMC o ecocardiografía cuantitativa.
Recopilación de datosEntre las características demográficas se encuentran la edad en el momento de la corrección intracardiaca, la información relacionada con las intervenciones paliativas (intervenciones previas a la corrección intracardiaca) y la realización de la SVP, así como la edad en el momento de las intervenciones paliativas y la SVP si se llevaron a cabo. Los datos sobre la fecha de nacimiento, la edad en el momento de la corrección intracardiaca, la edad en la primera visita, las intervenciones paliativas y la edad en el momento de dichas intervenciones se extrajeron directamente del registro SACHER. La recopilación de datos relacionados con la SVP, la RMC, la ecocardiografía, el electrocardiograma (ECG), la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), la capacidad de ejercicio y la anamnesis se realizó mediante la revisión de historias clínicas. A efectos de este estudio, se definió como primera visita la visita clínica en la que se hizo la primera RMC. Para evaluar los cambios en los volúmenes ventriculares y la función sistólica, la capacidad de ejercicio y el NT-proBNP, se registraron y analizaron los datos de los informes clínicos durante las visitas de seguimiento. Todas las pruebas del estudio se realizaron durante el seguimiento clínico habitual, siguiendo las recomendaciones de las guías de práctica clínica10-12.
Los datos recuperados de los informes de RMC contenían los volúmenes telediastólicos del ventrículo derecho y el ventrículo izquierdo, normalizados en función de la superficie corporal (IVTDVD e IVTDVI respectivamente), la FEVD, la fracción de eyección del ventrículo izquierdo (FEVI) y la fracción de IP en porcentaje.
Los datos recuperados de los informes de ecocardiografía contenían la gravedad de la IP (ninguna, leve, moderada o grave), el área telediastólica del ventrículo derecho en la proyección de 4 cámaras, el cambio del área fraccional del ventrículo derecho en la proyección de 4 cámaras, el desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE), la velocidad sistólica del anillo tricuspídeo y la FEVI. Se registraron los gradientes máximos de presión sistólica a través del infundíbulo del ventrículo derecho (como una medida de la obstrucción del infundíbulo del ventrículo derecho) y a través de la válvula tricúspide (como una medida de la presión sistólica del ventrículo derecho).
Los datos recuperados de los informes de las pruebas de esfuerzo cardiopulmonar contenían la carga de trabajo máxima (CT máxima) y el consumo máximo de O2 (VO2 máximo), y los porcentajes de los valores previstos, así como la frecuencia cardiaca máxima y la presión arterial en el momento de máximo esfuerzo.
En cada visita, se registraron el ancho máximo del complejo QRS en el ECG de 12 derivaciones y los valores de NT-proBNP en caso de que estuvieran disponibles.
Los resultados adversos cardiacos durante el seguimiento se evaluaron mediante la revisión de las historias clínicas e incluían arritmias auriculares sostenidas (definidas como más de 30 s de aleteo auricular, taquicardia por reentrada intraauricular o fibrilación auricular), taquiarritmias ventriculares sostenidas y episodios de endocarditis infecciosa (que cumplen los criterios de Duke modificados)13. Dada las bajas tasas de insuficiencia cardiaca y muerte en la cohorte del estudio, estos resultados no se analizaron.
RESULTADOSEl resultado principal del estudio fue la FEVD medida por RMC. Los resultados secundarios fueron: a) otros valores relacionados con los volúmenes y la función ventriculares (IVTDVD, IVTDVI y FEVI), los valores de NT-proBNP y la CT máxima (en vatios) como indicador de la capacidad de ejercicio, y b) la aparición de eventos adversos cardiacos como ya se ha definido. Los volúmenes y la función biventriculares se obtuvieron a partir del análisis de las visitas periódicas de seguimiento. Los eventos adversos se recopilaron en un archivo separado con las fechas exactas de su aparición.
Métodos estadísticosTodos los análisis estadísticos se realizaron con el sistema R para estadísticas y gráficos, versión 4.0.414. Las estadísticas descriptivas de los pacientes y los resultados adversos cardiacos se tabularon según la presencia y el momento de la SVP (sin SVP, SVP antes de la primera visita o SVP después de la primera visita). Las mediciones longitudinales de los valores médicos de los pacientes se tabularon según la presencia o ausencia de SVP previa (antes de una medición específica). Los datos son las medianas [intervalo intercuartílico] comunicadas de variables continuas o frecuencias y porcentajes de variables cualitativas. Además se comunicó la proporción de valores ausentes de cada variable.
Para explicar los valores ausentes en las visitas del estudio individuales, se utilizó la imputación múltiple con el paquete de R «mice» con la función de imputación «mice.2l.pmm» del paquete de R «miceadds», que se basa en un modelo mixto de 2 niveles y un emparejamiento medio predictivo15,16. Se realizaron 100 imputaciones por valor ausente. El modelo de imputación incluyó diversas variables, además de las utilizadas en el análisis estadístico. Aparte de la edad, el sexo, la estatura, el peso y las variables indicadoras de intervenciones paliativas previas y la SVP, también se incluyó un término cuadrático de edad e interacciones con la variable indicadora de SVP. La imputación múltiple también incluyó mediciones ecocardiográficas de FEVI, cambio del área fraccional, TAPSE y velocidad sistólica del anillo tricuspídeo medida por ecocardiografía transtorácica, la fracción de IP medida por RMC, la anchura del QRS y las medidas de capacidad de ejercicio (tabla 1 del material adicional). Las mediciones ecocardiográficas, IVTDVD, IVTDVI y FEVI se omitieron de la imputación porque solo se realizaron en el Hospital Universitario de Zúrich.
El resultado longitudinal principal fue FEVD medida por RMC. Este resultado se analizó con un modelo de regresión lineal con efectos mixtos (paquete de R «nlme») con intersecciones aleatorias específicas del paciente, jerarquizadas por centros17. Se utilizaron como variables explicativas la edad (en la visita correspondiente), el sexo y las variables indicadoras con una variación en el tiempo para determinar si un paciente se había sometido a una intervención paliativa o se le había realizado SVP antes de la visita. Cada modelo incluía, además, un término de interacción entre la edad y la SVP.
El modelo aplicado al resultado principal se reutilizó para analizar los resultados funcionales secundarios (IVTDVD, FEVI, IVTDVI, NT-proBNP y CT máxima). El resultado, NT-proBNP, suele estar sesgado a la derecha y estrictamente positivo, y se transformó logarítmicamente para cumplir mejor el supuesto de normalidad. Cada modelo se ajustó a cada conjunto de datos imputado. Las estimaciones de coeficientes resultantes se agruparon según las reglas de Rubin18. Para evaluar el impacto de los datos ausentes en los resultados de estos análisis, se llevó a cabo un análisis de sensibilidad de cada modelo utilizando solo casos completos (sin imputación de datos ausentes).
La IP es la indicación más frecuente para la SVP tardía entre los pacientes con TFc y se reduce de manera fiable con la SVP, al menos en el seguimiento a corto plazo después de la SVP. Sin embargo, la propia IP (determinada por la fracción de IP en la RMC) puede tener un impacto en los resultados funcionales principal y secundarios analizados en este estudio (FEVD, FEVI, VO2 máximo, etc.). Para explicar el efecto de la IP residual relevante en los resultados funcionales principal y secundarios, se realizaron análisis de sensibilidad en los que se reajustaron los modelos lineales de efectos mixtos, como la fracción de IP y su interacción con el indicador SVP con una variación en el tiempo como términos explicativos (tabla 2 del material adicional).
Los eventos adversos cardiacos (taquicardia auricular sostenida, taquiarritmias ventriculares sostenidas y endocarditis infecciosa) se analizaron utilizando modelos de riesgos proporcionales de Cox con las covariables con una variación en el tiempo, intervenciones paliativas y SVP y la covariable ordinaria, sexo. En cuanto a la escala de tiempo, se utilizaron los años desde el nacimiento. Las curvas de supervivencia ajustadas por covariables de pacientes con SVP y sin ella se estimaron a partir de estos modelos.
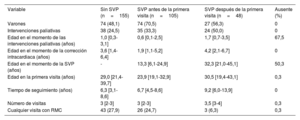
RESULTADOSEstadística descriptivaSe incluyó a 308 pacientes que representaron 887 visitas del estudio (307 pacientes tuvieron 1 visita de seguimiento). La tabla 1 presenta una descripción general de las características de los pacientes, estratificadas según la realización de la SVP (sin SVP, SVP antes de la primera visita y SVP después de la primera visita). Los pacientes sometidos a SVP antes de la primera visita fueron con más frecuencia varones y más jóvenes en la primera visita. Las intervenciones paliativas previas a la intervención de corrección intracardiaca infantil fueron más comunes entre los pacientes sometidos a SVP después de la primera visita. La incidencia de resultados adversos cardiacos estratificados según la realización de SVP se representa en la tabla 2. Las arritmias auriculares durante el seguimiento fueron especialmente comunes en el grupo de pacientes con SVP después de la primera visita, seguido por el grupo de pacientes con SVP antes de la primera visita. Los episodios de endocarditis infecciosa afectaron casi exclusivamente a pacientes con una SVP previa. Los resultados de la función ventricular continua en las 887 visitas, estratificados según la presencia o ausencia de SVP previa se representan en la tabla 3. La FEVD media fue ligeramente mayor en las visitas sin SVP previa y, como era de esperar, la IVTDVD también fue mayor en las visitas sin SVP previa. De la misma manera, la fracción de IP fue considerablemente menor en las visitas posteriores a la SVP previa.
Características del paciente y seguimiento estratificado por realización de la SVP
| Variable | Sin SVP (n=155) | SVP antes de la primera visita (n=105) | SVP después de la primera visita (n=48) | Ausente (%) |
|---|---|---|---|---|
| Varones | 74 (48,1) | 74 (70,5) | 27 (56,3) | 0 |
| Intervenciones paliativas | 38 (24,5) | 35 (33,3) | 24 (50,0) | 0 |
| Edad en el momento de las intervenciones paliativas (años) | 1,0 [0,3-3,1] | 0,6 [0,1-2,5] | 1,7 [0,7-3,5] | 67,5 |
| Edad en el momento de la corrección intracardiaca (años) | 3,6 [1,4-6,4] | 1,9 [1,1-5,2] | 4,2 [2,1-6,7] | 0 |
| Edad en el momento de la SVP (años) | - | 13,3 [6,1-24,9] | 32,3 [21,0-45,1] | 50,3 |
| Edad en la primera visita (años) | 29,0 [21,4-39,7] | 23,9 [19,1-32,9] | 30,5 [19,4-43,1] | 0,3 |
| Tiempo de seguimiento (años) | 6,3 [3,1-8,6] | 6,7 [4,5-8,6] | 9,2 [6,0-13,9] | 0 |
| Número de visitas | 3 [2-3] | 3 [2-3] | 3,5 [3-4] | 0,3 |
| Cualquier visita con RMC | 43 (27,9) | 26 (24,7) | 3 (6,3) | 0,3 |
RMC: resonancia magnética cardiaca; SVP: sustitución de la válvula pulmonar.
Los valores expresan n. (%) o mediana [intervalo intercuartílico].
Incidencia de resultados adversos cardiacos estratificados por realización de la SVP
| Variable | Sin SVP (n=155) | SVP antes de la primera visita (n=105) | SVP después de la primera visita (n=48) | Ausente |
|---|---|---|---|---|
| TRIA | 20 (13) | 20 (19) | 16 (33) | 0 |
| Aleteo auricular | 13 (8) | 16 (15) | 14 (29) | 0 |
| Otros SVT | 4 (3) | 5 (5) | 1 (2) | 0 |
| Taquicardia ventricular | 4 (3) | 6 (6) | 6 (13) | 0 |
| Endocarditis infecciosa | 3 (2) | 19 (18) | 4 (8) | 0 |
| Muerte | 6 (4) | 3 (3) | 0 | 0 |
FA: fibrilación auricular; SVP: sustitución de la válvula pulmonar; TRIA: taquicardia por reentrada intraauricular; TSV: taquicardia supraventricular.
Los valores expresan n. (%).
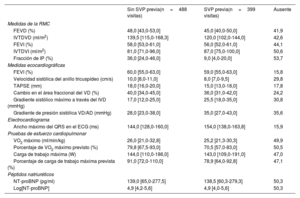
Estadísticas descriptivas de mediciones tomadas en visitas individuales
| Sin SVP previa(n=488 visitas) | SVP previa(n=399 visitas) | Ausente | |
|---|---|---|---|
| Medidas de la RMC | |||
| FEVD (%) | 48,0 [43,0-53,0] | 45,0 [40,0-50,0] | 41,9 |
| IVTDVD (ml/m2) | 139,5 [115,0-168,3] | 120,0 [102,0-144,0] | 42,6 |
| FEVI (%) | 58,0 [53,0-61,0] | 56,0 [52,0-61,0] | 44,1 |
| IVTDVI (ml/m2) | 81,0 [71,0-96,0] | 87,0 [75,0-100,0] | 50,6 |
| Fracción de IP (%) | 36,0 [24,0-46,0] | 9,0 [4,0-20,0] | 53,7 |
| Medidas ecocardiográficas | |||
| FEVI (%) | 60,0 [55,0-63,0] | 59,0 [55,0-63,0] | 15,8 |
| Velocidad sistólica del anillo tricuspídeo (cm/s) | 10,0 [8,0-11,0] | 8,0 [7,0-9,5] | 29,8 |
| TAPSE (mm) | 18,0 [16,0-20,0] | 15,0 [13,0-18,0] | 17,8 |
| Cambio en el área fraccional del VD (%) | 40,0 [34,0-45,0] | 36,0 [31,0-42,0] | 24,2 |
| Gradiente sistólico máximo a través del IVD (mmHg) | 17,0 [12,0-25,0] | 25,5 [18,0-35,0] | 30,8 |
| Gradiente de presión sistólica VD/AD (mmHg) | 28,0 [23,0-38,0] | 35,0 [27,0-43,0] | 35,6 |
| Electrocardiograma | |||
| Ancho máximo del QRS en el ECG (ms) | 144,0 [128,0-160,0] | 154,0 [138,0-163,8] | 15,9 |
| Pruebas de esfuerzo cardiopulmonar | |||
| VO2 máximo (ml/min/kg) | 26,0 [21,0-32,8] | 25,2 [21,3-30,3] | 49,9 |
| Porcentaje de VO2 máximo previsto (%) | 79,8 [67,5-93,0] | 70,5 [57,0-83,0] | 50,5 |
| Carga de trabajo máxima (W) | 144,0 [110,0-186,0] | 143,0 [109,0-191,0] | 47,0 |
| Porcentaje de carga de trabajo máxima prevista (%) | 91,0 [72,0-110,0] | 78,9 [64,0-92,8] | 47,1 |
| Péptidos natriuréticos | |||
| NT-proBNP (pg/ml) | 139,0 [65,0-277,5] | 138,5 [60,3-279,3] | 50,3 |
| Log[NT-proBNP] | 4,9 [4,2-5,6] | 4,9 [4,0-5,6] | 50,3 |
FEVD: fracción de eyección del ventrículo derecho; FEVI: fracción de eyección del ventrículo izquierdo; IP: insuficiencia pulmonar; IVD: infundíbulo del ventrículo derecho; IVTDVD: volumen telediastólico del ventrículo derecho, normalizado por el área de superficie corporal; IVTDVI: volumen telediastólico del ventrículo izquierdo, normalizado por el área de superficie corporal; RMC: resonancia magnética cardiaca; SVP: sustitución de la válvula pulmonar; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; VD/AD: gradiente de presión sistólica entre el ventrículo derecho y la aurícula derecha; VO2: consumo de O2 en las pruebas de esfuerzo cardiopulmonar.
Estadísticas descriptivas de mediciones tomadas en visitas individuales (n=887 en total), estratificadas por presencia o ausencia de SVP previa. Los valores expresan n. (%) o mediana [intervalo intercuartílico].
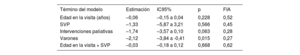
La tabla 4 presenta estimaciones de coeficientes de un modelo mixto lineal de FEVD. Estas estimaciones se agruparon en todos los análisis como consecuencia de la imputación múltiple de valores ausentes y el análisis posterior de todos los conjuntos de datos completos. La FEVD fue, por término medio, menor en pacientes con una SVP previa, pero esta asociación no fue estadísticamente significativa (estimación del coeficiente, –1,33; intervalo de confianza del 95% [IC95%], –5,87 a 3,21; p=0,566). Además, se evaluó la interacción entre la edad y la realización de SVP en la visita. Una interacción importante habría indicado que la asociación de la edad con la FEVD dependería de la SVP. Las estimaciones de la edad y el término de interacción fueron negativas, lo que indica que la FEVD disminuyó con la edad (disminución estimada de 0,06 puntos porcentuales por año), pero a un ritmo ligeramente más rápido en pacientes con SVP previa (disminución adicional estimada de 0,03 puntos porcentuales). Sin embargo, ninguna de las 2 asociaciones fue estadísticamente significativa. El sexo masculino se asoció significativamente con una FEVD menor que en el sexo femenino. Las intervenciones paliativas previas también se asociaron (pero no significativamente) con una FEVD menor. Estas conclusiones indican que la SVP previa no tuvo ninguna asociación significativa con el resultado funcional principal, la FEVD.
Estimaciones de coeficientes agrupados de FEVD a partir del modelo lineal de efectos mixtos
| Término del modelo | Estimación | IC95% | p | FIA |
|---|---|---|---|---|
| Edad en la visita (años) | –0,06 | –0,15 a 0,04 | 0,228 | 0,52 |
| SVP | –1,33 | –5,87 a 3,21 | 0,566 | 0,45 |
| Intervenciones paliativas | –1,74 | –3,57 a 0,10 | 0,063 | 0,28 |
| Varones | –2,12 | –3,84 a -0,41 | 0,015 | 0,27 |
| Edad en la visita × SVP | –0,03 | –0,18 a 0,12 | 0,668 | 0,62 |
FEVD: fracción de eyección del ventrículo derecho; FIA: fracción de información ausente; IC95%: intervalo de confianza del 95%; SVP: sustitución de la válvula pulmonar.
Modelo lineal de efectos mixtos con intersecciones aleatorias específicas de los pacientes, jerarquizadas por centros de tratamiento aplicadas para multiplicar datos imputados con m=100 imputaciones por valor ausente. Los datos contenían registros de 887 visitas de 307 pacientes únicos. El término de intersección de la FEVD hace referencia a la media de FEVD (%) en visitas a pacientes mujeres a la edad de la primera visita sin SVP y sin intervenciones paliativas.
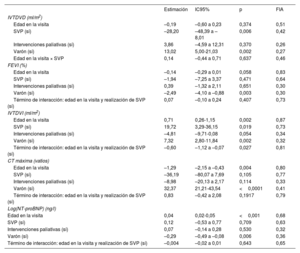
Las estimaciones de los modelos mixtos lineales para la asociación de SVP, intervenciones paliativas, edad y sexo y la interacción entre la edad y la SVP con los resultados funcionales secundarios (FEVI, IVTDVD, IVTDVI, CT máxima y (log)NT-proBNP) se presentan en la tabla 5, similar a la tabla 4. Como era de esperar, la SVP previa se asoció con un IVTDVD menor. Entre los pacientes varones, el IVTDVD fue considerablemente mayor que en las mujeres.
Estimaciones de coeficientes agrupados de variables de objetivos secundarios a partir de modelos lineales de efectos mixtos
| Estimación | IC95% | p | FIA | |
|---|---|---|---|---|
| IVTDVD (ml/m2) | ||||
| Edad en la visita | –0,19 | –0,60 a 0,23 | 0,374 | 0,51 |
| SVP (sí) | –28,20 | –48,39 a –8,01 | 0,006 | 0,42 |
| Intervenciones paliativas (sí) | 3,86 | –4,59 a 12,31 | 0,370 | 0,26 |
| Varón (sí) | 13,02 | 5,00-21,03 | 0,002 | 0,27 |
| Edad en la visita × SVP | 0,14 | –0,44 a 0,71 | 0,637 | 0,46 |
| FEVI (%) | ||||
| Edad en la visita | –0,14 | –0,29 a 0,01 | 0,058 | 0,83 |
| SVP (sí) | –1,94 | –7,25 a 3,37 | 0,471 | 0,64 |
| Intervenciones paliativas (sí) | 0,39 | –1,32 a 2,11 | 0,651 | 0,30 |
| Varón (sí) | –2,49 | –4,10 a –0,88 | 0,003 | 0,30 |
| Término de interacción: edad en la visita y realización de SVP (sí) | 0,07 | –0,10 a 0,24 | 0,407 | 0,73 |
| IVTDVI (ml/m2) | ||||
| Edad en la visita | 0,71 | 0,26-1,15 | 0,002 | 0,87 |
| SVP (sí) | 19,72 | 3,29-36,15 | 0,019 | 0,73 |
| Intervenciones paliativas (sí) | –4,81 | –9,71-0,08 | 0,054 | 0,34 |
| Varón (sí) | 7,32 | 2,80-11,84 | 0,002 | 0,32 |
| Término de interacción: edad en la visita y realización de SVP (sí) | –0,60 | –1,12 a –0,07 | 0,027 | 0,81 |
| CT máxima (vatios) | ||||
| Edad en la visita | –1,29 | –2,15 a –0,43 | 0,004 | 0,80 |
| SVP (sí) | –36,19 | –80,07 a 7,69 | 0,105 | 0,77 |
| Intervenciones paliativas (sí) | –8,98 | –20,13 a 2,17 | 0,114 | 0,33 |
| Varón (sí) | 32,37 | 21,21-43,54 | <0,0001 | 0,41 |
| Término de interacción: edad en la visita y realización de SVP (sí) | 0,83 | –0,42 a 2,08 | 0,1917 | 0,79 |
| Log(NT-proBNP) (ng/l) | ||||
| Edad en la visita | 0,04 | 0,02-0,05 | <0,001 | 0,68 |
| SVP (sí) | 0,12 | –0,53 a 0,77 | 0,709 | 0,63 |
| Intervenciones paliativas (sí) | 0,07 | –0,14 a 0,28 | 0,530 | 0,32 |
| Varón (sí) | –0,29 | –0,49 a –0,08 | 0,006 | 0,36 |
| Término de interacción: edad en la visita y realización de SVP (sí) | –0,004 | –0,02 a 0,01 | 0,643 | 0,65 |
CT: carga de trabajo máxima en las pruebas de esfuerzo cardiopulmonar; FEVI: fracción de eyección del ventrículo izquierdo; FIA: fracción de información ausente; IC95%: intervalo de confianza del 95%; IVTDVD: volumen telediastólico del ventrículo derecho normalizado por el área de superficie corporal; IVTDVI: volumen telediastólico del ventrículo izquierdo normalizado por el área de superficie corporal; SVP: sustitución de la válvula pulmonar.
Modelo lineal de efectos mixtos con intersecciones aleatorias específicas de los pacientes, jerarquizadas por centros de tratamiento aplicadas para multiplicar datos imputados con m=100 imputaciones por valor ausente. Los datos contenían registros de 887 visitas de 307 pacientes únicos.
Además, el sexo masculino se asoció con menor FEVI. No hubo evidencia de una asociación entre SVP y FEVI. Hubo una asociación de la edad con valores más altos de IVTDVI, pero solo sin SVP previa, ya que la interacción entre la edad y la SVP previa en la visita fue negativa y casi anuló la asociación con la edad en las visitas con SVP previa. No hubo una asociación importante entre la CT máxima y la SVP previa, aunque la disminución de la CT máxima a lo largo del tiempo fue más lenta en pacientes con SVP previa que en aquellos sin SVP (no estadísticamente significativa). Por último, no se encontró asociación entre NT-proBNP y SVP previa. Estas conclusiones indican que la SVP previa no tuvo ninguna asociación significativa con los resultados funcionales secundarios (FEVI, IVTDVI, CT máxima y NT-proBNP), excepto para IVTDVD.
Efecto de la información ausente e insuficiencia de la válvula pulmonar residualPuesto que faltaba información en una proporción relativamente alta en este conjunto de datos, se realizaron análisis de casos completos para los resultados funcionales principal y secundarios como análisis de sensibilidad. Los resultados de estos análisis de casos completos fueron concordaban mucho con las observaciones presentadas antes y se muestran en la tabla 3 del material adicional. Sin embargo, dado que estos análisis solo incluyeron entre 438 y 515 visitas de 224 a 267 pacientes, los análisis que utilizan los datos imputados pueden considerarse más fiables.
Puesto que la IP puede afectar a los resultados funcionales evaluados en este estudio, se realizó otro conjunto de análisis de sensibilidad que incluyen la fracción de IP y su interacción con el indicador SVP con una variación en el tiempo como términos explicativos (tabla 3 del material adicional). Si bien los patrones principales se mantuvieron similares a los de los análisis comunicados en la tabla 3 y la tabla 4, la inclusión de la IP y su interacción con la SVP redujo los coeficientes de SVP en el resultado de IVTDVD y IVTDVI y un aumento de la IP se asoció con un aumento del IVTDVD. Además, el aumento de la IP se asoció con una reducción del IVTDVI, pero esta asociación no fue significativa. La interacción entre IP y SVP, que indicaría que la asociación de IP con el resultado depende de la SVP (o viceversa), siempre fue no significativa y los coeficientes fueron relativamente pequeños. Esto indica que el grado de IP no se asoció con los resultados funcionales principal o secundarios (FEVD, FEVI, IVTDVI, CT máxima o valores de [log]NT-proBNP), excepto con el IVTDVD, independientemente de si a los pacientes se les había realizado SVP previamente o no.
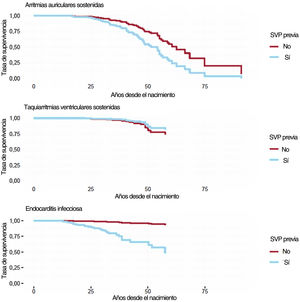
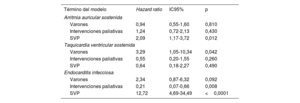
Eventos adversos cardiacosLas hazards ratio de eventos adversos cardiacos de los modelos de riesgos proporcionales de Cox se representan en la tabla 6. Las curvas de supervivencia ajustadas por covariables según la realización de la SVP de los pacientes se muestran en la figura 1. La SVP previa se asoció con un mayor riesgo de arritmias auriculares sostenidas y más aún con endocarditis infecciosa, pero no con taquiarritmias ventriculares sostenidas. El riesgo de taquiarritmias ventriculares sostenidas se asoció de manera importante con el sexo masculino. Se observó endocarditis infecciosa casi exclusivamente en pacientes con SVP previa. Curiosamente, los pacientes con intervenciones paliativas antes de la corrección intracardiaca presentaron un menor riesgo de endocarditis infecciosa (un 79% de reducción del riesgo).
Estimaciones de hazard ratio a partir de los modelos de riesgos proporcionales de Cox de eventos adversos cardiacos
| Término del modelo | Hazard ratio | IC95% | p |
|---|---|---|---|
| Arritmia auricular sostenida | |||
| Varones | 0,94 | 0,55-1,60 | 0,810 |
| Intervenciones paliativas | 1,24 | 0,72-2,13 | 0,430 |
| SVP | 2,09 | 1,17-3,72 | 0,012 |
| Taquicardia ventricular sostenida | |||
| Varones | 3,29 | 1,05-10,34 | 0,042 |
| Intervenciones paliativas | 0,55 | 0,20-1,55 | 0,260 |
| SVP | 0,64 | 0,18-2,27 | 0,490 |
| Endocarditis infecciosa | |||
| Varones | 2,34 | 0,87-6,32 | 0,092 |
| Intervenciones paliativas | 0,21 | 0,07-0,66 | 0,008 |
| SVP | 12,72 | 4,69-34,49 | <0,0001 |
IC95%: intervalo de confianza del 95%; SVP: sustitución de la válvula pulmonar.
Curvas de supervivencia de pacientes con y sin sustitución de la válvula pulmonar. Las curvas se estimaron a partir de los modelos de riesgos proporcionales de Cox (estimaciones de la hazard ratio en la tabla 6) y, por lo tanto, se ajustan por sexo e intervenciones paliativas. SVP: sustitución de la válvula pulmonar.
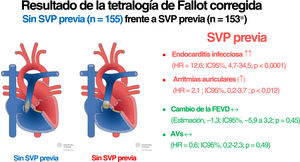
En este estudio retrospectivo de adultos con TFc, no se halló evidencia de una asociación positiva de la SVP protésica con cambios en la FEVD y la FEVI durante el seguimiento. Después de la SVP protésica, los pacientes tuvieron un mayor riesgo de arritmias auriculares sostenidas y endocarditis infecciosa durante el seguimiento, mientras que no se encontraron diferencias significativas respecto a las arritmias ventriculares sostenidas (figura 2)19.
Ilustración central. Resultado de la tetralogía de Fallot corregida: sin SVP previa (n=155) frente a SVP previa (n=153*). AVs: arritmias ventriculares sostenidas; SVP: sustitución de la válvula pulmonar. Reproducción autorizada por Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License por el New Media Center de la Universidad de Basilea19.
*105 pacientes presentaban SVP antes de la primera visita y 48 pacientes presentaban SVP después de la primera visita.
La IP de moderada a grave es la lesión residual hemodinámica más común en adultos con TFc y se encuentra en, aproximadamente, la mitad de todos los pacientes1. Aunque la indicación y el momento de la SVP protésica en pacientes con TFc han estado en el punto de mira de la atención a las cardiopatías congénitas durante más de 2 décadas, todavía no existe ningún estudio aleatorizado prospectivo que demuestre un beneficio en el pronóstico de la SVP.
Estudios recientes en cohortes más contemporáneas de pacientes con TFc, en especial el trabajo del grupo que realiza los estudios INDICATOR, han revelado nuevos datos importantes sobre la estratificación del riesgo y los resultados. Una clasificación mejor y más detallada de los pacientes con datos más precisos, que incluyan sobre todo el análisis de datos de RMC de alta calidad, no pudo mostrar una asociación de la IP o los volúmenes del ventrículo derecho con resultados arrítmicos. En cambio, la disfunción sistólica del ventrículo derecho se identificó como un predictor independiente de resultados adversos5.
Se ha dado por sentado el concepto de que la IP causa la dilatación y la disfunción progresiva del ventrículo derecho, pero no está respaldado por los datos publicados. Recientemente, un pequeño estudio con adultos con TFc que presentaron IP grave y estudios de RMC en serie realizados por este grupo indica que, en la mayoría de los adultos con IP grave, los volúmenes del ventrículo derecho y la fracción de eyección permanecen bastante estables durante el seguimiento. Por lo tanto, el concepto de que la SVP en pacientes con IP de moderada a grave mejora los cambios a largo plazo en la FEVD y, así, mejora los resultados actualmente no está respaldado por datos empíricos19.
Principales conclusiones y comparación con las conclusiones de la cohorte INDICATOREste estudio no demostró ningún impacto favorable en la FEVD a largo plazo después de la SVP. Esto puede ser importante, ya que, en contraste con los volúmenes del ventrículo derecho, la FEVD se ha identificado como un factor determinante de los resultados a largo plazo5. Si bien el número de muertes fue pequeño, por lo que no se analizó, no se encontró impacto de la SVP previa en la aparición de arritmias ventriculares sostenidas.
Esto contrasta con los resultados del último informe de la cohorte INDICATOR. En su estudio, Bokma et al.7 encontraron un efecto importante de la SVP en el riesgo de un objetivo compuesto de mortalidad por cualquier causa y taquicardia ventricular sostenida o muerte súbita cardiaca recuperada. Desde su primer análisis similar publicado en 2018, cuando no se había demostrado un impacto importante de la SVP en el objetivo compuesto, en su análisis reciente se indicó un beneficio significativo6,7. En comparación con su informe inicial sobre 41 resultados (el 4% de la población del estudio con un seguimiento medio de 5,3 años), el estudio más reciente analizó 82 resultados (el 7% de la población del estudio con una mediana de seguimiento de 8,0 años)6,7. Curiosamente, los eventos adicionales en su último análisis se debieron a un aumento de la mortalidad por cualquier causa (30 muertes en el primer análisis frente a 58 en el informe más reciente) y taquicardia ventricular sostenida (6 eventos en el primer análisis frente a 18 en el análisis más reciente). En comparación con su primer informe, solo otros 2 pacientes murieron por muerte súbita cardiaca y solo 1 más sufrió una muerte súbita cardiaca recuperada7. Esta es una observación importante, ya que la mayoría de las muertes en la cohorte INDICATOR fueron por causas no cardiacas o desconocidas (35/58, el 60% de todas las muertes). Aunque los investigadores de la cohorte INDICATOR intentaron superar algún sesgo con un análisis de subgrupos, emparejado con una puntuación de propensión, es importante reconocer que la cohorte INDICATOR no es un ensayo prospectivo aleatorizado y que la inclusión de muchos pacientes con muerte no cardiaca puede generar un sesgo sustancial, ya que es poco probable que se someta a SVP a los pacientes con mal pronóstico por comorbilidades no cardiacas. Además, los pacientes con TFc suelen tolerar hemodinámicamente bastante bien la taquicardia ventricular monomórfica sostenida, de modo que puede ser una entidad diferente de la muerte súbita cardiaca, causada por lo general por fibrilación ventricular o taquicardia ventricular polimórfica20. Estas taquicardias ventriculares más organizadas pueden ser tributarias de ablación con catéter o cirugía de la arritmia. Sin un análisis cuidadoso de la cirugía de la arritmia concomitante, que se ha convertido en el tratamiento habitual en muchos centros, es difícil estimar el verdadero impacto de la SVP sola en la propensión a las arritmias ventriculares posteriores.
Otra diferencia importante entre este estudio y la cohorte INDICATOR es que se excluyó a los pacientes con variantes de atresia pulmonar y otras anatomías, que requieren corrección primaria con un conducto del ventrículo derecho a la arteria pulmonar (VD-AP), mientras que estos pacientes representaron el 14% de toda la población en la cohorte INDICATOR5. De hecho, el implante previo del conducto VD-AP se identificó como uno de los más potentes predictores de resultados adversos7. Así, el estudio INDICATOR es parcialmente un estudio de reintervención en pacientes con SVP previa y los resultados pueden ser diferentes de aquellos de los pacientes con insuficiencia de la válvula pulmonar pura. Ya se ha evaluado el impacto del momento de la SVP en los pacientes después de la corrección del parche transanular, que inevitablemente provoca una IP grave, generalmente sin obstrucción del infundíbulo del VD. Los autores encontraron peores resultados en el grupo de pacientes con SVP temprana que en aquellos con SVP tardía. Además, desde el punto de vista del objetivo de eficacia combinado de mortalidad por cualquier causa, arritmia ventricular e implante de un desfibrilador automático implantable, los pacientes con los mejores resultados fueron aquellos sin SVP21.
Eventos adversos cardiacosEn este estudio, la SVP previa se asoció con un mayor riesgo de arritmias auriculares sostenidas y un mayor riesgo de endocarditis infecciosa. Si bien las tasas de endocarditis infecciosa no se notificaron en el último estudio de la cohorte INDICATOR, la SVP no se asoció de manera importante con un objetivo secundario combinado compuesto por insuficiencia cardiaca, arritmias auriculares y taquicardias ventriculares no sostenidas7. Con todo, el objetivo secundario se debió a taquicardias ventriculares no sostenidas (el 53% de todos los eventos secundarios) y no se proporcionó ningún análisis independiente de los componentes individuales del objetivo secundario combinado. Curiosamente, en su primer informe hubo tendencia a que la SVP temprana (sin cumplir los criterios de consenso) se asociara con un mayor riesgo del objetivo secundario de morbilidad. La mayoría de las arritmias en pacientes con TFc son taquicardias reentrantes relacionadas con cicatrices. Por lo tanto, las diferencias en la propensión a las arritmias auriculares pueden estar relacionadas con el tipo y el tamaño de las auriculotomías y el tipo de canulación en el momento de la corrección intracardiaca. Para reducir el riesgo a largo plazo de arritmias ventriculares sostenidas, la selección directa y la eliminación de los istmos anatómicos relacionados con las taquicardias ventriculares mediante cartografía electroanatómica y ablación, según lo propuesto por el grupo de Katja Zeppenfeld, puede ser una alternativa valiosa a la SVP para la reducción del riesgo en esta temida complicación a largo plazo21. Sin duda será de gran relevancia clínica obtener más información sobre las complicaciones a largo plazo del seguimiento más prolongado de la cohorte INDICATOR. En particular, será de suma importancia saber más sobre el impacto de la endocarditis infecciosa en los resultados a largo plazo22.
En pacientes con TFc e IP grave, solo un ensayo aleatorizado prospectivo con seguimiento a largo plazo (durante décadas) que compare la SVP con el tratamiento médico podría responder a la pregunta de si la SVP realmente proporciona un beneficio en pacientes asintomáticos con IP grave o si incluso puede causar un daño.
LimitacionesSe trata de un estudio retrospectivo observacional. Aunque actualmente la indicación más frecuente de SVP es la dilatación del VD a causa de la IP (independientemente de los síntomas), este no es un estudio aleatorizado y puede haber un sesgo, ya que la indicación de SVP para algunos de estos pacientes puede haber estado relacionada con los síntomas. A diferencia de la taquicardia ventricular y la endocarditis, algunas arritmias auriculares pueden permanecer asintomáticas, por lo que la fecha exacta de aparición puede ser ligeramente imprecisa y dificultar la precisión del análisis de supervivencia. Además, dados la naturaleza y el análisis de estos datos, la causalidad no puede inferirse de nuestras observaciones y la evidencia presentada es puramente observacional. Sin embargo, estos hallazgos que no muestran una asociación significativa de la SVP con el curso de la FEVD, así como el aumento de la endocarditis y las arritmias auriculares en esta cohorte relativamente grande de pacientes con TFc, se sumarán a la bibliografía descriptiva sobre esta población de pacientes.
Aunque todas las instituciones colaboradoras son centros de atención especializada consolidados en la atención a adultos con cardiopatía congénita, siguiendo las recomendaciones nacionales e internacionales sobre la atención a estos pacientes, no hubo ningún laboratorio central para el reanálisis de la RMC y otros datos clínicos.
Estos modelos, aunque complejos, pueden haber omitido inadvertidamente variables con importancia para los resultados analizados en este estudio.
La proporción de información ausente en este conjunto de datos es relativamente alta y puede afectar a los resultados. Sin embargo, que el análisis de sensibilidad con análisis de casos completos arrojara resultados similares indica la relativa solidez de estas conclusiones.
Este conjunto de datos no permite determinar la indicación exacta de SVP en pacientes concretos. Además, a efectos de este estudio, no se analizaron ni el momento ni la indicación de reintervención.
En este estudio solo se incluyó a pacientes con una RMC previa (o ecocardiografía de alta calidad). Esto podría haber introducido el truncamiento a la izquierda al omitir del análisis todos los registros anteriores a la primera evaluación de la RMC. Los pacientes de edad avanzada y aquellos con contraindicaciones para la RMC (marcapasos eléctricos o desfibriladores implantables no compatibles con la RMC) pueden estar infrarrepresentados.
Puesto que esta cohorte se obtuvo íntegramente de un único país con una población relativamente homogénea, quizás estos resultados no sean aplicables a poblaciones con mayor diversidad racial.
Por último, durante la realización de este estudio no se tuvieron en cuenta las recomendaciones SAGER sobre sexo y equidad de género en investigación23.
CONCLUSIONESLa SVP previa no se asoció significativamente con cambios en FEVD, FEVI, capacidad de ejercicio o valores de NT-proBNP en adultos con TFc. La SVP previa se asoció con un mayor riesgo de arritmias auriculares y endocarditis infecciosa, pero no tuvo impacto en el riesgo de taquiarritmias ventriculares sostenidas. Estas conclusiones deben tenerse en cuenta al indicar la SVP a pacientes asintomáticos con TFc.
- -
Los pacientes con TFc constituyen un amplio grupo de adultos con cardiopatía congénita. Una gran proporción de estos pacientes padece IP grave.
- -
La FEVD se ha identificado como un factor determinante importante de resultados adversos.
- -
Se ha planteado que la IP crónica provoca un deterioro progresivo de la FEVD y que la SVP puede detener este proceso, por lo que puede mejorar los resultados a largo plazo.
- -
Sin embargo, faltan datos empíricos que confirmen estas hipótesis.
- -
La SVP no se asoció con FEVD ni tampoco con otros resultados funcionales, como la FEVI, la capacidad de ejercicio o las concentraciones de péptidos natriuréticos en una cohorte de adultos con TFc.
- -
La SVP previa se asoció con un mayor riesgo de arritmias auriculares y endocarditis infecciosa, pero no tuvo impacto en el riesgo de taquiarritmias ventriculares sostenidas.
El registro SACHER se financia mediante subvenciones internas sin el apoyo de la industria farmacéutica.
CONSIDERACIONES ÉTICASEl registro y los análisis de datos actuales fueron aprobados por los comités de ética locales y todos los pacientes dieron el consentimiento informado por escrito. El protocolo del estudio se ajustó a las directrices éticas de la Declaración de Helsinki de 1975. En este estudio no se tuvieron en cuenta las recomendaciones SAGER sobre sexo y equidad de género en investigación.
DECLARACIÓN SOBRE EL USO DE LA INTELIGENCIA ARTIFICIALNo se utilizó ninguna herramienta de inteligencia artificial en la preparación de este artículo.
CONTRIBUCIONES DE LOS AUTORESF.J. Ruperti-Repilado, T. Fischer, S. von Felten y M. Greutmann contribuyeron a la redacción del texto, la concepción de la investigación, la revisión crítica del contenido intelectual del original y la supervisión. S. von Felten y T. Fischer fueron los responsables del análisis estadístico. El resto de los autores contribuyeron a la selección de pacientes y la recopilación de datos, y a la revisión crítica del contenido intelectual del original y la supervisión.
CONFLICTO DE INTERESESNo hay conflicto de intereses.