Comparar la estrategia de revascularización percutánea de lesiones graves en ramas coronarias secundarias (RS) (diámetro ≥ 2 mm) de arterias epicárdicas mayores frente al tratamiento conservador.
MétodosEstudio de cohortes retrospectivo en el que se compara a pacientes con lesiones graves en RS de arterias epicárdicas principales tratados con revascularización percutánea o con un tratamiento farmacológico a criterio del operador. Se analizó el porcentaje de eventos relacionados con la rama (muerte cardiovascular, infarto de miocardio atribuible a RS o necesidad de revascularización de la RS).
ResultadosSe analizaron 679 lesiones en RS (662 pacientes). Tras un seguimiento medio de 22,2±10,5 meses, no hubo diferencias significativas entre ambos grupos de tratamiento en mortalidad de causa cardiovascular (el 1,7 frente al 0,4%; p=0,14), infarto agudo de miocardio (IAM) no fatal (el 1,7 frente al 1,7%; p=0,96) o necesidad de revascularización de la RS (el 4,1 frente al 5,4%; p=0,45) ni en el porcentaje total de eventos (el 5,1 frente al 6,3%; p=0,54). Las variables que mostraron asociación con la ocurrencia de eventos en el análisis multivariable fueron la diabetes (sHR=2,87; IC95%, 1,37-5,47; p=0,004), IAM previo (sHR=3,54; IC95%, 1,77-7,30; p < 0,0001), el diámetro de referencia de la RS (sHR=0,16; IC95%, 0,03-0,97; p=0,047) y la longitud de la lesión (sHR=3,77; IC95%, 1,03-1,13; p < 0,0001). Estos resultados se mantuvieron tras realizar análisis por puntuación de propensión.
ConclusionesEn el seguimiento, el porcentaje de eventos relacionados con la RS fue bajo respecto al total de pacientes, sin diferencias significativas entre una y otra estrategia de tratamiento. Las variables que se asociaron con la ocurrencia de eventos en el análisis multivariable fueron la diabetes mellitus, el antecedente de IAM y la mayor longitud de la lesión.
Palabras clave
Las ramas coronarias secundarias (RS) son, en general, los vasos menos desarrollados y de menor calibre de las arterias coronarias principales que irrigan una porción más pequeña del miocardio. El enfoque terapéutico que debe guiar el tratamiento de una RS suele centrarse en el diámetro, pero existen además otros factores que deben tenerse en cuenta, como la longitud y la evolución de la RS, el tamaño del vaso principal y la cantidad de miocardio irrigado1.
Los pocos estudios que abordan el tratamiento de las lesiones en RS se basan en un análisis a posteriori de ensayos clínicos y en la revascularización de vasos de pequeño calibre, sean RS o no. Por otro lado, los estudios publicados sobre los procedimientos intervencionistas aplicados a las lesiones en RS se centran en la evaluación del tratamiento de lesiones bifurcadas, ya sea con técnicas simples o complejas; sin embargo, la eficacia del tratamiento de RS en este contexto todavía es objeto de debate2–7. Al prestar atención al contexto de lesiones angiográficamente graves localizadas en vasos de RS, el presente estudio se propone comparar una estrategia terapéutica dirigida a la revascularización coronaria percutánea con otra basada en el tratamiento farmacológico que suele prescribirse en la práctica clínica habitual.
MÉTODOSSe diseñó un estudio de cohortes retrospectivo en el que se comparó a pacientes con lesiones graves en RS de las arterias epicárdicas tratados con revascularización percutánea con otros pacientes que recibieron únicamente tratamiento farmacológico. La decisión sobre el tratamiento de elección para cada paciente quedó a criterio del operador.
Criterios de inclusiónSe incluyó a pacientes con lesiones coronarias graves (estenosis del 70% valorada por estimación visual) en RS de 2 mm de diámetro a los que se practicó una coronariografía por angina estable o síndrome coronario agudo sin elevación del segmento ST. Las RS incluían ramas diagonales, ramas marginales (o la arteria circunfleja distal si era de menor calibre y estaba menos desarrollada que la rama marginal) y el ramo intermedio, así como la arteria posterolateral y la descendente posterior.
Criterios de exclusiónSe excluyó a los pacientes que presentaban las siguientes características: indicación para coronariografía por síndrome coronario agudo con elevación del segmento ST, lesiones no revascularizadas graves en las arterias coronarias principales, antecedente de cirugía de revascularización coronaria, reestenosis de un stent implantado previamente en la RS, contraindicación para el tratamiento antiagregante plaquetario doble, valvulopatías graves o portador de prótesis valvular, indicación para el tratamiento quirúrgico, y cualquier lesión en RS cuyo tratamiento exigiera una técnica de bifurcación que afectara al vaso principal (a saber, pacientes con lesiones en RS que afectaran a la arteria principal y pacientes con lesiones en las arterias principales cuyo tratamiento afectara a la RS); es decir, únicamente se consideraron las lesiones independientes.
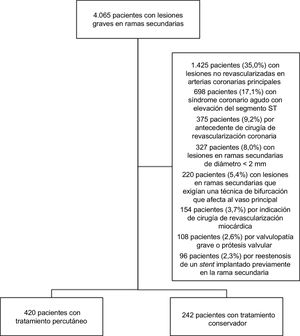
Población del estudioEn el presente estudio se incluyó a 4.065 pacientes con lesiones graves en RS tratados con cateterismo cardiaco en un periodo de 3 años (desde enero de 2013 hasta diciembre de 2015) en 2 centros hospitalarios con gran volumen de pacientes. Tras la valoración de la historia médica y el angiograma, se incluyó en el estudio a 662 pacientes (figura 1).
Definiciones y complicaciones clínicasLos pacientes incluidos presentaban lesiones coronarias graves (estenosis del 70% valorada por estimación visual a partir de los resultados angiográficos) en RS de 2 mm de diámetro. La decisión sobre el tratamiento percutáneo la tomó el cardiólogo intervencionista que practicó el procedimiento, mientras que el tratamiento farmacológico prescrito al alta hospitalaria lo eligió el cardiólogo clínico que trató al paciente.
Se realizó el seguimiento clínico de cada paciente en el servicio de consultas externas mediante la evaluación de su historia clínica. Se consideraron los siguientes eventos clínicos relacionados con la RS: a) necesidad de revascularización de la RS (definida como revascularización repetida de la lesión estudiada o de los 5 mm adyacentes; b) infarto de miocardio no fatal atribuible a la lesión diana (definido como un evento coronario estimado infarto de miocardio en relación con la desestabilización o la aparición de una complicación de la lesión estudiada), y c) muerte por causa cardiovascular (definida como muerte por insuficiencia cardiaca, isquemia, arritmia o muerte súbita).
Se define infarto de miocardio como la detección de un aumento de los valores del biomarcador cardiaco (troponina) al menos superior al percentil 99 conforme a los intervalos del laboratorio de cada centro hospitalario, en concomitancia con al menos 1 de los siguientes: síntomas de isquemia; nuevas, o supuestamente nuevas, alteraciones significativas del segmento ST o nuevo bloqueo de la rama izquierda; aparición de onda Q patológica en el electrocardiograma; técnicas de imagen que mostraran nueva pérdida de miocardio viable o nuevas anomalías regionales del movimiento de la pared, e identificación angiográfica de un trombo intracoronario de la lesión estudiada.
Variables angiográficasLa cuantificación digital se llevó a cabo mediante análisis coronario cuantitativo (Artis Syngo X, Workplace VB21, de Siemens).
Tras la coronariografía, se calcularon las puntuaciones SYNTAX basales y residuales de todos los pacientes mediante la calculadora en línea8. El cálculo de la puntuación SYNTAX de cada paciente lo realizaron 2 cardiólogos intervencionistas formados en el empleo de este instrumento. Se estableció la puntuación SYNTAX de cada paciente a partir de la puntuación media calculada por cada observador. Resultó un coeficiente de correlación intraclase entre diferentes observadores de 0,88 (intervalo de confianza del 95% [IC95%], 0,83-0,93; p < 0,0001) y un coeficiente de correlación intraclase de un mismo observador de 0,90 (IC95%, 0,86-0,94; p < 0,0001).
Principios éticosSe siguieron los protocolos establecidos por cada centro hospitalario para el acceso a los datos de las historias clínicas a efectos de la investigación clínica. El estudio se atuvo a los principios éticos recogidos en la Declaración de Helsinki (1975) de la World Medical Association para la investigación médica con seres humanos.
Análisis estadísticoSe calculó el tamaño muestral según la demostración de la superioridad y para la comparación de proporciones. La frecuencia de complicaciones combinadas se estimó en un 8% para el grupo de tratamiento médico y en un 4% para el de la intervención coronaria percutánea (ICP). A partir de un error alfa de 0,05 y una potencia del 80%, se consideró que el número de pacientes que debía incluirse en la muestra era de 458 (229 pacientes en cada grupo). El proceso de inclusión finalizó cuando se alcazaba al menos el número mínimo de pacientes para cada grupo.
Las variables cualitativas se expresan como números absolutos y porcentaje del total. Las variables cuantitativas se muestran como media ± desviación estándar siempre que la distribución de los valores fuera simétrica. Cuando dicha distribución era asimétrica, se representan como media [intervalo intercuartílico]. Al objeto de establecer las diferencias significativas, se utilizó la prueba de la χ2 para las variables cualitativas y el ANOVA para las variables cuantitativas.
Se realizó un análisis de supervivencia mediante el método de regresión de riesgos en competencia siguiendo el modelo de riesgos de subdistribución proporcional de Fine y Gray9, y se calculó la función de incidencia acumulada y la hazard ratio de subdistribución (sHR) con su IC95%. Se compararon las curvas de incidencia acumulada mediante el valor de p de la prueba de Gray. Se consideró indicativo de significación estadística un valor de p < 0,05. Se calculó la variable principal de la valoración combinada de eventos durante el seguimiento para cada paciente en función de que se presentase: a) necesidad de revascularización de la RS incluida en el estudio; b) infarto de miocardio no fatal atribuible a una de las lesiones estudiadas (lesiones diana), y c) muerte por causa cardiovascular (definida como muerte por insuficiencia cardiaca, isquemia, arritmia o muerte súbita).
Tras la estimación inicial, se realizó un análisis de sensibilidad mediante puntuación de propensión y regresión logística para ajustar los posibles factores de confusión. Este análisis se llevó a cabo mediante emparejamientos (apareamiento por el método del vecino más cercano) y para cada paciente. Las variables incluidas fueron hospital de origen, hipertensión, tabaquismo, antecedentes de infarto de miocardio, número de arterias epicárdicas afectadas, localización de la lesión estudiada y tratamiento con ácido acetilsalicílico (AAS) y clopidogrel. Se obtuvo un estadístico C = 0,87.
Todos los análisis se ejecutaron con IBM® SPSS® Statistics, versión 21,0 (IBM Corporation; Armonk, Nueva York, Estados Unidos), el software R (The R Foundation for Statistical Computing; Viena, Austria) y el paquete estadístico Data Analysis and Statistical Software Stata® (StataCorp LLC; College Station, Texas, Estados Unidos).
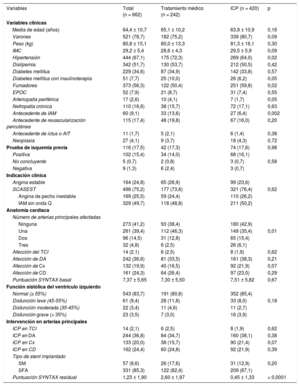
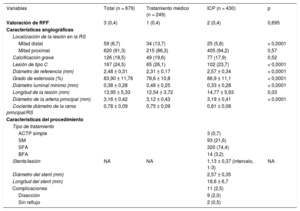
RESULTADOSPoblación inicialCaracterísticas clínicas y angiografía basalSe estudiaron 679 lesiones en RS de 662 pacientes. De las 679 lesiones, 430 (63,3%) se trataron con ICP (420 pacientes, 63,4%), mientras que se dio tratamiento conservador a las 249 restantes (36,7%) (242 pacientes, 36,6%). No se observaron diferencias significativas en la indicación clínica para la cateterización. La tabla 1 resume las características clínicas de los pacientes.
Características angiográficas y clínicas de los pacientes incluidos en el estudio
| Variables | Total (n = 662) | Tratamiento médico (n = 242) | ICP (n = 420) | p |
|---|---|---|---|---|
| Variables clínicas | ||||
| Media de edad (años) | 64,4 ± 10,7 | 65,1 ± 10,2 | 63,9 ± 10,9 | 0,16 |
| Varones | 521 (78,7) | 182 (75,2) | 339 (80,7) | 0,09 |
| Peso (kg) | 80,8 ± 15,1 | 80,0 ± 13,3 | 81,3 ± 16,1 | 0,30 |
| IMC | 29,2 ± 5,4 | 28,6 ± 4,3 | 29,5 ± 5,9 | 0,09 |
| Hipertensión | 444 (67,1) | 175 (72,3) | 269 (64,0) | 0,02 |
| Dislipemia | 342 (51,7) | 130 (53,7) | 212 (50,5) | 0,42 |
| Diabetes mellitus | 229 (34,6) | 87 (34,9) | 142 (33,8) | 0,57 |
| Diabetes mellitus con insulinoterapia | 51 (7,7) | 25 (10,0) | 26 (6,2) | 0,05 |
| Fumadores | 373 (56,3) | 122 (50,4) | 251 (59,8) | 0,02 |
| EPOC | 52 (7,9) | 21 (8,7) | 31 (7,4) | 0,55 |
| Arteriopatía periférica | 17 (2,6) | 10 (4,1) | 7 (1,7) | 0,05 |
| Nefropatía crónica | 110 (16,6) | 38 (15,7) | 72 (17,1) | 0,63 |
| Antecedente de IAM | 60 (9,1) | 33 (13,6) | 27 (6,4) | 0,002 |
| Antecedente de revascularización percutánea | 115 (17,4) | 48 (19,8) | 67 (16,0) | 0,20 |
| Antecedente de ictus o AIT | 11 (1,7) | 5 (2,1) | 6 (1,4) | 0,38 |
| Neoplasia | 27 (4,1) | 9 (3,7) | 18 (4,3) | 0,72 |
| Prueba de isquemia previa | 116 (17,5) | 42 (17,3) | 74 (17,6) | 0,98 |
| Positiva | 102 (15,4) | 34 (14,0) | 68 (16,1) | |
| No concluyente | 5 (0,7) | 2 (0,8) | 3 (0,7) | 0,58 |
| Negativa | 9 (1,3) | 6 (2,4) | 3 (0,7) | |
| Indicación clínica | ||||
| Angina estable | 164 (24,8) | 65 (26,9) | 99 (23,6) | |
| SCASEST | 498 (75,2) | 177 (73,6) | 321 (76,4) | 0,62 |
| Angina de pecho inestable | 169 (25,5) | 59 (24,4) | 110 (26,2) | |
| IAM sin onda Q | 329 (49,7) | 118 (48,8) | 211 (50,2) | |
| Anatomía cardiaca | ||||
| Número de arterias principales afectadas | ||||
| Ninguna | 273 (41,2) | 93 (38,4) | 180 (42,9) | |
| Una | 261 (39,4) | 112 (46,3) | 149 (35,4) | 0,01 |
| Dos | 96 (14,5) | 31 (12,8) | 65 (15,4) | |
| Tres | 32 (4,8) | 6 (2,5) | 26 (6,1) | |
| Afección del TCI | 14 (2,1) | 6 (2,5) | 8 (1,9) | 0,62 |
| Afección de DA | 242 (36,6) | 81 (33,5) | 161 (38,3) | 0,21 |
| Afección de Cx | 132 (19,9) | 40 (16,5) | 92 (21,9) | 0,07 |
| Afección de CD | 161 (24,3) | 64 (26,4) | 97 (23,0) | 0,29 |
| Puntuación SYNTAX basal | 7,37 ± 5,65 | 7,30 ± 5,50 | 7,51 ± 5,82 | 0,67 |
| Función sistólica del ventrículo izquierdo | ||||
| Normal (≥ 55%) | 543 (83,7) | 191 (80,6) | 352 (85,4) | |
| Disfunción leve (45-55%) | 61 (9,4) | 28 (11,8) | 33 (8,0) | 0,18 |
| Disfunción moderada (35-45%) | 22 (3,4) | 11 (4,6) | 11 (2,7) | |
| Disfunción grave (< 35%) | 23 (3,5) | 7 (3,0) | 16 (3,9) | |
| Intervención en arterias principales | ||||
| ICP en TCI | 14 (2,1) | 6 (2,5) | 8 (1,9) | 0,62 |
| ICP en DA | 244 (36,8) | 84 (34,7) | 160 (38,1) | 0,38 |
| ICP en Cx | 133 (20,0) | 38 (15,7) | 90 (21,4) | 0,07 |
| ICP en CD | 162 (24,4) | 60 (24,8) | 92 (21,9) | 0,39 |
| Tipo de stent implantado | ||||
| SM | 57 (8,6) | 26 (17,6) | 31 (12,9) | 0,20 |
| SFA | 331 (85,3) | 122 (82,4) | 209 (87,1) | |
| Puntuación SYNTAX residual | 1,23 ± 1,90 | 2,60 ± 1,97 | 0,45 ± 1,33 | < 0,0001 |
AIT: accidente isquémico transitorio; CD: coronaria derecha; Cx: arteria circunfleja izquierda; DA: descendente anterior; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco común izquierdo.
Los valores expresan media ± desviación estándar o n (%).
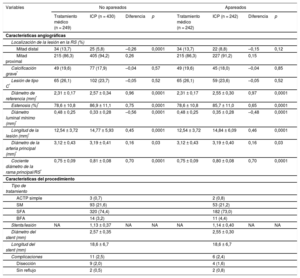
Se localizaron 679 lesiones coronarias graves en RS. Se exponen brevemente las características angiográficas de estas lesiones en la tabla 2. Las lesiones tratadas mediante ICP se ubicaban principalmente en la mitad proximal de la RS (el 94,2 frente al 86,3%; p < 0,0001) y mostraban un diámetro de referencia más grande (2,57 ± 0,34 frente a 2,31 ± 0,17 mm; p < 0,0001), una mayor longitud de la lesión (14,77 ± 5,93 frente a 12,54 ± 3,72 mm; p < 0,0001), estenosis más graves (el 86,9 ± 11,1 frente al 78,6 ± 10,8%; p < 0,0001) y un diámetro luminal mínimo más pequeño (0,33 ± 0,28 frente a 0,48 ± 0,25 mm; p < 0,0001). Hay que añadir que el calibre del vaso principal del que dependía la RS era significativamente mayor en el grupo de ICP (3,19 ± 0,41 frente a 3,12 ± 0,43 mm; p = 0,03), así como el cociente entre el diámetro de la RS y el de la rama principal (0,81 ± 0,08 frente a 0,75 ± 0,09; p < 0,0001). Solo de 3 lesiones (0,4%) se realizó una valoración funcional de la lesión a partir de la cuantificación de la reserva fraccional de flujo (RFF) obtenida mediante guía de presión intracoronaria, y se dio tratamiento percutáneo a los pacientes que obtuvieron una RFF < 0,80. La ofrece un resumen de los procedimientos intervencionistas de las arterias epicárdicas mayores.
Características angiográficas de las lesiones graves localizadas en el ramas secundarias y variables relacionadas con el procedimiento
| Variables | Total (n = 679) | Tratamiento médico (n = 249) | ICP (n = 430) | p |
|---|---|---|---|---|
| Valoración de RFF | 3 (0,4) | 1 (0,4) | 2 (0,4) | 0,695 |
| Características angiográficas | ||||
| Localización de la lesión en la RS | ||||
| Mitad distal | 59 (8,7) | 34 (13,7) | 25 (5,8) | < 0,0001 |
| Mitad proximal | 620 (91,3) | 215 (86,3) | 405 (94,2) | 0,57 |
| Calcificación grave | 126 (18,5) | 49 (19,6) | 77 (17,9) | 0,52 |
| Lesión de tipo C | 167 (24,5) | 65 (26,1) | 102 (23,7) | < 0,0001 |
| Diámetro de referencia (mm) | 2,48 ± 0,31 | 2,31 ± 0,17 | 2,57 ± 0,34 | < 0,0001 |
| Grado de estenosis (%) | 83,90 ± 11,76 | 78,6 ± 10,8 | 86,9 ± 11,1 | < 0,0001 |
| Diámetro luminal mínimo (mm) | 0,38 ± 0,28 | 0,48 ± 0,25 | 0,33 ± 0,28 | < 0,0001 |
| Longitud de la lesión (mm) | 13,95 ± 5,33 | 12,54 ± 3,72 | 14,77 ± 5,93 | 0,03 |
| Diámetro de la arteria principal (mm) | 3,16 ± 0,42 | 3,12 ± 0,43 | 3,19 ± 0,41 | < 0,0001 |
| Cociente diámetro de la rama principal/RS | 0,78 ± 0,09 | 0,75 ± 0,09 | 0,81 ± 0,08 | |
| Características del procedimiento | ||||
| Tipo de tratamiento | ||||
| ACTP simple | 3 (0,7) | |||
| SM | 93 (21,6) | |||
| SFA | 320 (74,4) | |||
| BFA | 14 (3,2) | |||
| Stents/lesión | NA | NA | 1,13 ± 0,37 (intervalo, 1-3) | NA |
| Diámetro del stent (mm) | 2,57 ± 0,35 | |||
| Longitud del stent (mm) | 18,6 ± 6,7 | |||
| Complicaciones | 11 (2,5) | |||
| Disección | 9 (2,0) | |||
| Sin reflujo | 2 (0,5) | |||
ACTP: angioplastia coronaria transluminal percutánea; BFA: balón farmacoactivo; ICP: intervención coronaria percutánea; NA: no aplicable; RFF: reserva fraccional de flujo; RS: rama secundaria; SFA: stent farmacoactivo; SM: stent metálico.
Los valores expresan media ± desviación estándar o n (%).
En cuanto al tratamiento farmacológico tras el alta (), se prescribió AAS al alta a un mayor porcentaje del grupo de tratamiento percutáneo que del de tratamiento conservador (el 99,4 frente al 93,9%; p < 0,0001). Asimismo se administró clopidogrel, el segundo antiagregante plaquetario más utilizado, a un mayor número de pacientes del grupo de tratamiento percutáneo (el 66,8 frente al 54,2%; p = 0,003). No se apreciaron diferencias significativas en el empleo de ticagrelor o prasugrel.
En el grupo de ICP, hubo un mayor porcentaje de pacientes con bloqueadores beta (el 83,0 frente al 75,9%; p = 0,04) y estatinas (el 94,7 frente al 88,2%; p = 0,005) prescritos al alta, mientras que en el grupo del tratamiento médico fueron más frecuentes los nitratos (el 14,0 frente al 32,5%; p < 0,0001) y la ranolazina (el 1,7 frente al 7,5%; p < 0,0001). Hubo diferencias significativas en el número total de medicamentos antiisquémicos pautados al alta, pues se administró 1 o ninguno a más pacientes del grupo de ICP, mientras que el porcentaje de pacientes del grupo en tratamiento conservador que tomaban 2, 3, 4 o más antiisquémicos fue mayor.
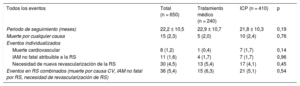
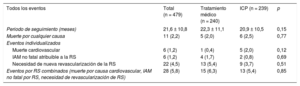
Eventos por grupo de tratamientoSe dio seguimiento a 650 de los 662 pacientes incluidos en la muestra del estudio. Tras un seguimiento medio de 22,2 ± 10,5 meses (21,8 ± 10,3 frente a 22,9 ± 10,7 meses; p = 0,19), la mortalidad por cualquier causa fue de 15 pacientes (2,3%) y la mortalidad por causa cardiovascular, de 8 (1,2%). El porcentaje de infarto agudo de miocardio (IAM) no fatal atribuible a la lesión diana en la RS fue del 1,6% (11 pacientes), mientras que el 4,5% (30 pacientes) precisó la revascularización de la RS. La tasa total de eventos relacionados con RS (muerte por causa cardiovascular, IAM no fatal atribuible a la RS y necesidad de revascularización de la RS) fue del 5,4% (36 eventos).
No se observaron diferencias significativas entre ambos grupos de tratamiento en los porcentajes de mortalidad de causa cardiovascular, IAM no fatal y necesidad de revascularización de la RS o en la tasa total combinada de eventos relacionados con la RS (tabla 3).
Eventos durante el seguimiento
| Todos los eventos | Total (n = 650) | Tratamiento médico (n = 240) | ICP (n = 410) | p |
|---|---|---|---|---|
| Periodo de seguimiento (meses) | 22,2 ± 10,5 | 22,9 ± 10,7 | 21,8 ± 10,3 | 0,19 |
| Muerte por cualquier causa | 15 (2,3) | 5 (2,0) | 10 (2,4) | 0,76 |
| Eventos individualizados | ||||
| Muerte cardiovascular | 8 (1,2) | 1 (0,4) | 7 (1,7) | 0,14 |
| IAM no fatal atribuible a la RS | 11 (1,6) | 4 (1,7) | 7 (1,7) | 0,96 |
| Necesidad de nueva revascularización de la RS | 30 (4,5) | 13 (5,4) | 17 (4,1) | 0,45 |
| Eventos en RS combinados (muerte por causa CV, IAM no fatal por RS, necesidad de revascularización de RS) | 36 (5,4) | 15 (6,3) | 21 (5,1) | 0,54 |
CV: cardiovascular; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; RS: rama secundaria.
Los valores expresan media ± desviación estándar o n (%).
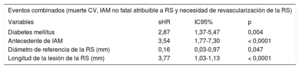
El análisis multivariable realizado según el método de riesgos competitivos (tabla 4) demostró que las variables más significativas asociadas con la aparición de los eventos combinados fueron la presencia de diabetes mellitus (sHR = 2,87; IC95%, 1,37-5,47; p = 0,004), el antecedente de IAM (sHR = 3,54; IC95%, 1,77-7,30; p < 0,0001), el diámetro de referencia del vaso de RS (sHR = 0,16; IC95%, 0,03-0,97; p = 0,047) y la longitud de la lesión (sHR = 3,77; IC95%, 1,03-1,13; p < 0,0001).
Análisis multivariable: variables asociadas con la tasa de eventos combinados durante el seguimiento
| Eventos combinados (muerte CV, IAM no fatal atribuible a RS y necesidad de revascularización de la RS) | |||
|---|---|---|---|
| Variables | sHR | IC95% | p |
| Diabetes mellitus | 2,87 | 1,37-5,47 | 0,004 |
| Antecedente de IAM | 3,54 | 1,77-7,30 | < 0,0001 |
| Diámetro de referencia de la RS (mm) | 0,16 | 0,03-0,97 | 0,047 |
| Longitud de la lesión de la RS (mm) | 3,77 | 1,03-1,13 | < 0,0001 |
CV: cardiovascular; IC95%: intervalo de confianza del 95%; IAM: infarto agudo de miocardio; RS: rama secundaria; sHR: hazard ratio de la subdistribución.
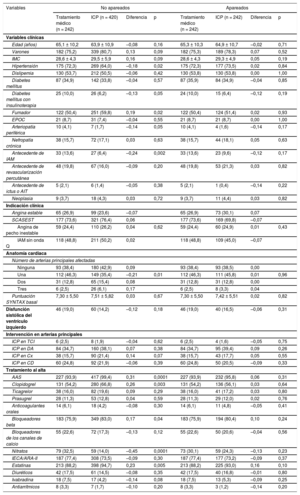
Mediante regresión logística, se realizó un análisis por puntuación de propensión en cada grupo a fin de ajustar por posibles factores de confusión. Las variables incluidas fueron hospital de origen, hipertensión, tabaquismo, antecedentes de infarto de miocardio, número de arterias epicárdicas afectadas, localización de la lesión estudiada y tratamiento con AAS y clopidogrel. Como resultado, se seleccionó a 484 pacientes (242 de cada grupo de tratamiento). La distribución de las distintas variables se ilustra en la tabla 5 y la tabla 6.
Características angiográficas, clínicas y del tratamiento farmacológico de ambos grupos de tratamiento (con ajuste por puntuación de propensión)
| Variables | No apareados | Apareados | ||||||
|---|---|---|---|---|---|---|---|---|
| Tratamiento médico (n = 242) | ICP (n = 420) | Diferencia | p | Tratamiento médico (n = 242) | ICP (n = 242) | Diferencia | p | |
| Variables clínicas | ||||||||
| Edad (años) | 65,1 ± 10,2 | 63,9 ± 10,9 | –0,08 | 0,16 | 65,3 ± 10,3 | 64,9 ± 10,7 | –0,02 | 0,71 |
| Varones | 182 (75,2) | 339 (80,7) | 0,13 | 0,09 | 182 (75,3) | 189 (78,3) | 0,07 | 0,52 |
| IMC | 28,6 ± 4,3 | 29,5 ± 5,9 | 0,16 | 0,09 | 28,6 ± 4,3 | 29,3 ± 4,9 | 0,05 | 0,19 |
| Hipertensión | 175 (72,3) | 269 (64,0) | –0,18 | 0,02 | 175 (72,3) | 177 (73,5) | 0,02 | 0,84 |
| Dislipemia | 130 (53,7) | 212 (50,5) | –0,06 | 0,42 | 130 (53,8) | 130 (53,8) | 0,00 | 1,00 |
| Diabetes mellitus | 87 (34,9) | 142 (33,8) | –0,04 | 0,57 | 87 (35,9) | 84 (34,9) | –0,04 | 0,85 |
| Diabetes mellitus con insulinoterapia | 25 (10,0) | 26 (6,2) | –0,13 | 0,05 | 24 (10,0) | 15 (6,4) | –0,12 | 0,19 |
| Fumador | 122 (50,4) | 251 (59,8) | 0,19 | 0,02 | 122 (50,4) | 124 (51,4) | 0,02 | 0,93 |
| EPOC | 21 (8,7) | 31 (7,4) | –0,04 | 0,55 | 21 (8,7) | 21 (8,7) | 0,00 | 1,00 |
| Arteriopatía periférica | 10 (4,1) | 7 (1,7) | –0,14 | 0,05 | 10 (4,1) | 4 (1,6) | –0,14 | 0,17 |
| Nefropatía crónica | 38 (15,7) | 72 (17,1) | 0,03 | 0,63 | 38 (15,7) | 44 (18,1) | 0,05 | 0,63 |
| Antecedente de IAM | 33 (13,6) | 27 (6,4) | –0,24 | 0,002 | 33 (13,6) | 23 (9,6) | –0,12 | 0,17 |
| Antecedente de revascularización percutánea | 48 (19,8) | 67 (16,0) | –0,09 | 0,20 | 48 (19,8) | 53 (21,3) | 0,03 | 0,82 |
| Antecedente de ictus o AIT | 5 (2,1) | 6 (1,4) | –0,05 | 0,38 | 5 (2,1) | 1 (0,4) | –0,14 | 0,22 |
| Neoplasia | 9 (3,7) | 18 (4,3) | 0,03 | 0,72 | 9 (3,7) | 11 (4,4) | 0,03 | 0,82 |
| Indicación clínica | ||||||||
| Angina estable | 65 (26,9) | 99 (23,6) | –0,07 | 65 (26,9) | 73 (30,1) | 0,07 | ||
| SCASEST | 177 (73,6) | 321 (76,4) | 0,06 | 177 (73,6) | 169 (69,8) | –0,07 | ||
| Angina de pecho inestable | 59 (24,4) | 110 (26,2) | 0,04 | 0,62 | 59 (24,4) | 60 (24,9) | 0,01 | 0,43 |
| IAM sin onda Q | 118 (48,8) | 211 (50,2) | 0,02 | 118 (48,8) | 109 (45,0) | –0,07 | ||
| Anatomía cardiaca | ||||||||
| Número de arterias principales afectadas | ||||||||
| Ninguna | 93 (38,4) | 180 (42,9) | 0,09 | 93 (38,4) | 93 (38,5) | 0,00 | ||
| Una | 112 (46,3) | 149 (35,4) | –0,21 | 0,01 | 112 (46,3) | 111 (45,8) | 0,01 | 0,96 |
| Dos | 31 (12,8) | 65 (15,4) | 0,08 | 31 (12,8) | 31 (12,8) | 0,00 | ||
| Tres | 6 (2,5) | 26 (6,1) | 0,17 | 6 (2,5) | 8 (3,3) | 0,04 | ||
| Puntuación SYNTAX basal | 7,30 ± 5,50 | 7,51 ± 5,82 | 0,03 | 0,67 | 7,30 ± 5,50 | 7,42 ± 5,51 | 0,02 | 0,82 |
| Disfunción sistólica del ventrículo izquierdo | 46 (19,0) | 60 (14,2) | –0,12 | 0,18 | 46 (19,0) | 40 (16,5) | –0,06 | 0,31 |
| Intervención en arterias principales | ||||||||
| ICP en TCI | 6 (2,5) | 8 (1,9) | –0,04 | 0,62 | 6 (2,5) | 4 (1,6) | –0,05 | 0,75 |
| ICP en DA | 84 (34,7) | 160 (38,1) | 0,07 | 0,38 | 84 (34,7) | 95 (39,4) | 0,09 | 0,26 |
| ICP en Cx | 38 (15,7) | 90 (21,4) | 0,14 | 0,07 | 38 (15,7) | 43 (17,7) | 0,05 | 0,55 |
| ICP en CD | 60 (24,8) | 92 (21,9) | –0,06 | 0,39 | 60 (24,8) | 50 (20,5) | –0,09 | 0,33 |
| Tratamiento al alta | ||||||||
| AAS | 227 (93,9) | 417 (99,4) | 0,31 | 0,0001 | 227 (93,9) | 232 (95,8) | 0,06 | 0,31 |
| Clopidogrel | 131 (54,2) | 280 (66,8) | 0,26 | 0,003 | 131 (54,2) | 136 (56,1) | 0,03 | 0,64 |
| Ticagrelor | 38 (16,0) | 82 (19,6) | 0,09 | 0,29 | 38 (16,0) | 41 (17,2) | 0,03 | 0,80 |
| Prasugrel | 28 (11,3) | 53 (12,8) | 0,04 | 0,59 | 28 (11,3) | 29 (12,0) | 0,02 | 0,76 |
| Anticoagulantes orales | 14 (6,1) | 18 (4,2) | –0,08 | 0,30 | 14 (6,1) | 11 (4,8) | –0,05 | 0,41 |
| Bloqueadores beta | 183 (75,9) | 349 (83,0) | 0,17 | 0,04 | 183 (75,9) | 194 (80,4) | 0,10 | 0,24 |
| Bloqueadores de los canales de calcio | 55 (22,6) | 72 (17,3) | –0,13 | 0,12 | 55 (22,6) | 50 (20,6) | –0,04 | 0,56 |
| Nitratos | 79 (32,5) | 59 (14,0) | –0,45 | 0,0001 | 73 (30,1) | 59 (24,3) | –0,13 | 0,23 |
| IECA/ARA-II | 187 (77,4) | 308 (73,5) | –0,09 | 0,30 | 187 (77,4) | 177 (73,2) | –0,09 | 0,37 |
| Estatinas | 213 (88,2) | 398 (94,7) | 0,23 | 0,005 | 213 (88,2) | 225 (93,0) | 0,16 | 0,10 |
| Diuréticos | 42 (17,5) | 61 (14,5) | –0,08 | 0,35 | 42 (17,5) | 40 (16,8) | –0,01 | 0,80 |
| Ivabradina | 18 (7,5) | 17 (4,2) | –0,14 | 0,08 | 18 (7,5) | 13 (5,3) | –0,09 | 0,25 |
| Antiarrítmicos | 8 (3,3) | 7 (1,7) | –0,10 | 0,20 | 8 (3,3) | 3 (1,2) | –0,14 | 0,20 |
AAS: ácido acetilsalicílico; AIT: accidente isquémico transitorio; ARA-II: antagonistas del receptor de la angiotensina II; CD: coronaria derecha; Cx: circunfleja izquierda; DA: descendente anterior; EPOC: enfermedad pulmonar obstructiva crónica; IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; SCASEST: síndrome coronario agudo sin elevación del segmento ST; TCI: tronco común izquierdo.
Los valores expresan media ± deviación estándar o n (%).
Características angiográficas de las lesiones graves localizadas en el ramas secundarias y variables asociadas con el procedimiento (con ajuste por puntuación de propensión)
| Variables | No apareados | Apareados | ||||||
|---|---|---|---|---|---|---|---|---|
| Tratamiento médico (n = 249) | ICP (n = 430) | Diferencia | p | Tratamiento médico (n = 242) | ICP (n = 242) | Diferencia | p | |
| Características angiográficas | ||||||||
| Localización de la lesión en la RS (%) | ||||||||
| Mitad distal | 34 (13,7) | 25 (5,8) | –0,26 | 0,0001 | 34 (13,7) | 22 (8,8) | –0,15 | 0,12 |
| Mitad proximal | 215 (86,3) | 405 (94,2) | 0,26 | 215 (86,3) | 227 (91,2) | 0,15 | ||
| Calcificación grave* | 49 (19,6) | 77 (17,9) | –0,04 | 0,57 | 49 (19,6) | 45 (18,0) | –0,04 | 0,85 |
| Lesión de tipo C* | 65 (26,1) | 102 (23,7) | –0,05 | 0,52 | 65 (26,1) | 59 (23,6) | –0,05 | 0,52 |
| Diámetro de referencia (mm)* | 2,31 ± 0,17 | 2,57 ± 0,34 | 0,96 | 0,0001 | 2,31 ± 0,17 | 2,55 ± 0,30 | 0,97 | 0,0001 |
| Estenosis (%)* | 78,6 ± 10,8 | 86,9 ± 11,1 | 0,75 | 0,0001 | 78,6 ± 10,8 | 85,7 ± 11,0 | 0,65 | 0,0001 |
| Diámetro luminal mínimo (mm)* | 0,48 ± 0,25 | 0,33 ± 0,28 | –0,56 | 0,0001 | 0,48 ± 0,25 | 0,35 ± 0,28 | –0,48 | 0,0001 |
| Longitud de la lesión (mm)* | 12,54 ± 3,72 | 14,77 ± 5,93 | 0,45 | 0,0001 | 12,54 ± 3,72 | 14,84 ± 6,09 | 0,46 | 0,0001 |
| Diámetro de la arteria principal (mm)* | 3,12 ± 0,43 | 3,19 ± 0,41 | 0,16 | 0,03 | 3,12 ± 0,43 | 3,19 ± 0,40 | 0,16 | 0,03 |
| Cociente diámetro de la rama principal/RS* | 0,75 ± 0,09 | 0,81 ± 0,08 | 0,70 | 0,0001 | 0,75 ± 0,09 | 0,80 ± 0,08 | 0,70 | 0,0001 |
| Características del procedimiento | ||||||||
| Tipo de tratamiento | ||||||||
| ACTP simple | 3 (0,7) | 2 (0,8) | ||||||
| SM | 93 (21,6) | 53 (21,2) | ||||||
| SFA | 320 (74,4) | 182 (73,0) | ||||||
| BFA | 14 (3,2) | 11 (4,4) | ||||||
| Stents/lesión | NA | 1,13 ± 0,37 | NA | NA | NA | 1,14 ± 0,40 | NA | NA |
| Diámetro del stent (mm) | 2,57 ± 0,35 | 2,55 ± 0,30 | ||||||
| Longitud del stent (mm) | 18,6 ± 6,7 | 18,6 ± 6,7 | ||||||
| Complicaciones | 11 (2,5) | 6 (2,4) | ||||||
| Disección | 9 (2,0) | 4 (1,6) | ||||||
| Sin reflujo | 2 (0,5) | 2 (0,8) | ||||||
ACTP: angioplastia coronaria transluminal percutánea; BFA: balón farmacoactivo; ICP: intervención coronaria percutánea; NA: no applicable; RS: rama secundaria; SFA: stent farmacoactivo; SM: stent metálico.
Los valores expresan media ± desviación estándar o n (%).
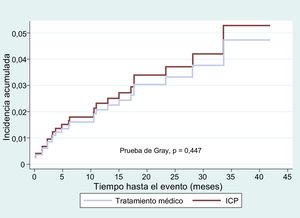
Se dio seguimiento a 479 de los 484 pacientes incluidos en el análisis por puntuación de propensión. Tras un seguimiento medio de 21,6 ± 10,8 meses, se obtuvo una tasa de eventos combinados relacionados con RS del 5,8% (28 pacientes), sin diferencias entre los grupos de tratamiento. Los eventos observados durante el seguimiento se muestran en la tabla 7.
Complicaciones durante el seguimiento por grupo ajustado
| Todos los eventos | Total (n = 479) | Tratamiento médico (n = 240) | ICP (n = 239) | p |
|---|---|---|---|---|
| Periodo de seguimiento (meses) | 21,6 ± 10,8 | 22,3 ± 11,1 | 20,9 ± 10,5 | 0,15 |
| Muerte por cualquier causa | 11 (2,2) | 5 (2,0) | 6 (2,5) | 0,77 |
| Eventos individualizados | ||||
| Muerte cardiovascular | 6 (1,2) | 1 (0,4) | 5 (2,0) | 0,12 |
| IAM no fatal atribuible a la RS | 6 (1,2) | 4 (1,7) | 2 (0,8) | 0,69 |
| Necesidad de nueva revascularización de la RS | 22 (4,5) | 13 (5,4) | 9 (3,7) | 0,51 |
| Eventos por RS combinados (muerte por causa cardiovascular, IAM no fatal por RS, necesidad de revascularización de RS) | 28 (5,8) | 15 (6,3) | 13 (5,4) | 0,85 |
IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; RS: rama secundaria.
Los valores expresan media ± desviación estándar o n (%).
El análisis multivariable realizado según el método de riesgos competitivos demostró que las variables más significativas asociadas con la aparición de eventos fueron la presencia de diabetes mellitus (sHR = 2,84; IC95%, 1,47-8,44; p = 0,005), el antecedente de IAM (sHR = 2,82; IC95%, 1,56- 11,95; p = 0,005) y la longitud de la lesión (sHR = 3,52; IC95%, 1,03-1,13; p < 0,0001, tabla 8).
Análisis multivariable: variables asociadas con la tasa de eventos combinados durante el seguimiento
| Eventos combinados (muerte CV, IAM no fatal atribuible a la RS y necesidad de revascularización de la RS) | |||
|---|---|---|---|
| Variables | sHR | IC95% | p |
| Diabetes mellitus | 2,84 | 1,47-8,44 | 0,005 |
| Antecedente de IAM | 2,82 | 1,56-11,95 | 0,005 |
| Longitud de la lesión en la RS (mm) | 3,52 | 1,03-1,13 | < 0,0001 |
CV: cardiovascular; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; RS: rama secundaria; sHR: hazard ratio de la subdistribución.
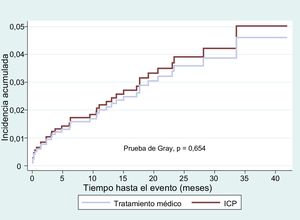
Las funciones incidencia acumulada de eventos combinados (muerte por causa cardiovascular, IAM no fatal relacionado con RS y necesidad de revascularización de la RS) no mostraron diferencias en el conjunto de la muestra de pacientes (figura 2) o en la muestra ajustada por la puntuación de propensión (figura 3). Se cumplió el supuesto de proporcionalidad para el tratamiento en ambos casos (conjunto de la muestra, p = 0,975; muestra ajustada por la puntuación de propensión, p = 0,871).
Los principales hallazgos de este estudio son: a) en esta serie, se dio tratamiento percutáneo a la mayoría de las lesiones graves en RS observadas angiográficamente; b) se eligió el tratamiento percutáneo para las RS de mayor diámetro, con mayor longitud de la lesión, con estenosis más graves y de tamaño semejante al del vaso principal; c) la tasa de eventos durante el seguimiento fue baja en el conjunto de la muestra, mientras que el 5,4% de los eventos combinados relacionados con RS se debió principalmente a la necesidad de nueva revascularización; d) no se apreciaron diferencias significativas en la supervivencia libre de eventos combinados entre los pacientes en tratamiento conservador y aquellos con tratamiento percutáneo; e) en el análisis multivariable, las variables que se correspondieron con la tasa de eventos en el seguimiento fueron la presencia de diabetes mellitus, el antecedente de IAM, el menor diámetro de la RS y la mayor longitud de la lesión, y f) tras el ajuste por puntuación de propensión, los resultados no mostraron diferencias significativas.
A pesar de que numerosos estudios han comparado el tratamiento de revascularización percutánea de lesiones cardiacas graves frente al tratamiento médico, hasta la fecha ninguno de ellos ha prestado atención a la comparación del tratamiento percutáneo frente al médico para las estenosis graves en RS de las arterias epicárdicas mayores. Los estudios publicados sobre los procedimientos intervencionistas en RS hacen hincapié en la evaluación de una estrategia terapéutica para tratar lesiones bifurcadas mediante técnicas de 1 o 2 stents. No obstante, en la práctica clínica diaria a menudo se encuentra a pacientes sometidos a cateterismo por angina estable o síndrome coronario agudo. En muchos de estos pacientes se observan lesiones coronarias graves en las RS, que son los vasos menos desarrollados y de menor calibre que aportan irrigación sanguínea a una porción pequeña del miocardio, con o sin otras arterias coronarias principales afectádas. Sin embargo, todavía debe clarificarse el valor pronóstico de estas lesiones a partir de las posibles mejoras introducidas por los tratamientos farmacológico y percutáneo.
La presencia de isquemia inducible asociada con la estenosis coronaria es necesaria para decidir si se revasculariza la lesión. En principio, la revascularización para reducir la isquemia miocárdica mejora la clase funcional del paciente, mientras que la cuestión de revascularizar las lesiones no isquémicas siempre ha estado en debate10,11. En el contexto de la enfermedad multivaso, suele ser difícil establecer la lesión que origina la isquemia, pues en la mayoría de los casos no se dispone de pruebas de isquemia previas que guíen el procedimiento. Por otro lado, en escenarios de lesiones localizadas en RS, es preciso que los cardiólogos intervencionistas se planteen si la revascularización de una lesión concreta reviste relevancia clínica, si es esa estenosis en particular lo que causa la isquemia o si la revascularización conlleva una mejora para la evolución del paciente. Por medio de la RFF, Ahn et al.12 evaluaron 230 lesiones bifurcadas donde se había implantado un stent en el vaso principal que dejaba enjaulada la RS; destaca que, según sus hallazgos, las lesiones ostiales de las ramas laterales que en la valoración angiográfica mostraban estenosis > 50% demostraron tan solo un 28,4% de frecuencia de RFF positiva. Asimismo, Koh et al.13 observaron que la RFF no se asociaba con el porcentaje de estenosis de las lesiones ostiales de las RS (r = –0,067; p = 0,635) y que mostraba una asociación débil con el área luminal mínima establecida en la ecografía endovascular (r = 0,30; p = 0,026). Dichos estudios ilustran las dificultades que surgen a la hora de evaluar las lesiones coronarias graves localizadas en RS teniendo en cuenta los criterios angiográficos exclusivamente. No obstante, aunque la RFF hoy es el criterio de referencia para valorar el impacto funcional de las lesiones coronarias, sigue siendo una técnica infrautilizada14. Además, en el estudio DKCRUSH-VI, el ensayo clínico aleatorizado que comparó el tratamiento guiado por angiografía de lesiones bifurcadas en RS con el guiado por RFF, si bien la intervención mediante RFF exigía en menor medida el implante de un stent en la RS, no se apreciaron diferencias entre una y otra estrategia terapéutica en la tasa de eventos a 1 año15.
Aunque no se haya determinado el significado pronóstico de las lesiones graves ubicadas en RS y tratadas con procedimientos intervencionistas percutáneos o tratamiento médico, se dispone de estudios sobre el pronóstico a medio plazo de las lesiones bifurcadas en RS. En un metanálisis a partir de los resultados de un grupo de 5 estudios aleatorizados, Zhang et al.16 indicaron un menor porcentaje de infarto de miocardio durante el seguimiento en el grupo asignado al tratamiento conservador de las RS que en el grupo sometido a una técnica compleja (el 5,0 frente al 9,4%; p = 0,0001), y un porcentaje similar de reestenosis de RS (el 14,1 frente al 12,6%; p = 0,140). Del mismo modo, ciertos estudios se centran en el valor pronóstico de la revascularización percutánea practicada en arterias coronarias de pequeño calibre, que representa entre el 35 y el 50% de los procedimientos intervencionistas. Se sabe de la relación inversa existente entre el calibre del vaso y el riesgo de reestenosis y peor resultado después de una ICP. Por otro lado, en el estudio ISAR-SMART, Kastrati et al.17 señalaron la necesidad de una nueva revascularización en el 20,1% del grupo de pacientes tratados con angioplastia simple tras un seguimiento de 6-7 meses, algo muy semejante al porcentaje del grupo tratado con implante de stent convencional. En nuestra serie, la tasa de eventos relacionados con RS fue del 5,4%, menor que en los estudios citados. Es decir, una vez tratadas las arterias coronarias principales, ambas actuaciones (revascularización o ausencia de revascularización de una RS) se relacionaron con un bajo número de eventos, en su mayoría relacionados con la necesidad de nuevas revascularizaciones, lo cual pone de relieve el necesario debate acerca de cuál es la intervención en las arterias coronarias que tendrá menor repercusión clínica para los pacientes con angina estable o síndrome coronario agudo sin elevación del segmento ST.
LimitacionesEste estudio tiene ciertas limitaciones. Se trata de un estudio de 2 centros retrospectivo y no aleatorizado, lo cual dificulta el control de los datos, así como el análisis y la posterior extrapolación de los resultados. No obstante, es un registro de pacientes con quienes el cardiólogo intervencionista ha mantenido contacto en la práctica clínica habitual y sobre los que el operador debe decidir si aplica una estrategia terapéutica intervencionista o se reafirma en el tratamiento conservador. En segundo lugar, hay una desproporción en el número de pacientes incluidos en cada grupo. Esto se debe a que, en la mayoría de las lesiones, el operador optó por la revascularización percutánea. Sin embargo, en el presente estudio se incluyó el número mínimo de pacientes que se había calculado previamente en la determinación del tamaño muestral. En aras de ajustar por este factor y cualquier otra posible variable de confusión, el presente análisis se completó con el método de la puntuación de propensión. No obstante, teniendo en cuenta que es un estudio observacional, ciertos factores de confusión residuales han podido influir en los resultados, por no incluirse algunas de las variables recogidas pero no aplicadas en la puntuación de propensión o porque no se estimaron ciertas covariables. Por último, cabe destacar el bajo porcentaje de valoración funcional guiada por la RFF de las lesiones diana, lo que demuestra que hoy sigue siendo una técnica infrautilizada.
CONCLUSIONESLa tasa de eventos relacionados con RS durante el seguimiento fue baja en el total de pacientes, sin diferencias significativas entre una y otra estrategia terapéutica. En el análisis multivariable, las variables que se asociaron con la incidencia de eventos fueron la presencia de diabetes mellitus, el antecedente de IAM y una mayor longitud de la lesión.
FINANCIACIÓNEste trabajo ha recibido subvenciones del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CB16/11/00360), Instituto de Salud Carlos III, y ha sido cofinanciado por el Fondo Europeo de Desarrollo Regional.
Este artículo obtuvo apoyo financiero para su análisis estadístico de la Cátedra de Terapias Avanzadas en Patología Cardiovascular de la Universidad de Málaga (CIF Q-2918001-E).
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Los vasos de las RS son los menos desarrollados y de menor calibre de las arterias coronarias principales y aportan irrigación sanguínea a una porción más pequeña del miocardio. Los estudios publicados sobre los procedimientos intervencionistas en lesiones de RS se centran en la evaluación del tratamiento de lesiones bifurcadas. Sin embargo, no se dispone de estudios que aborden el valor pronóstico de este tipo de lesiones en otros contextos.
- –
La tasa de eventos relacionados con RS durante el seguimiento fue baja en el total de pacientes, sin diferencias significativas entre una y otra estrategia terapéutica (tratamiento médico o ICP). Las variables asociadas con eventos fueron la presencia de diabetes mellitus, el antecedente de IAM y una mayor longitud de la lesión.
Los autores agradecen su inestimable ayuda al Dr. Mario Gutiérrez Bedmar, profesor del Departamento de Medicina Preventiva y Salud Pública de la Universidad de Málaga, España.