Palabras clave
INTRODUCCIÓN
La arteriosclerosis es una enfermedad sistémica que afecta a diferentes lechos vasculares. Por ello la coexistencia de afección coronaria, periférica y cerebral es muy frecuente. La enfermedad arterial periférica suele coexistir con enfermedad coronaria y los pacientes que la presentan tienen un riesgo entre 2 y 4 veces mayor de infarto de miocardio y muerte; por otra parte, un tercio de los pacientes con enfermedad coronaria también tienen enfermedad arterial periférica asociada1.
La arteria mamaria interna (AMI) es el injerto de elección para la revascularización coronaria2, pero en pacientes con enfermedad oclusiva aortoiliaca el flujo de las extremidades inferiores puede depender en mayor o menor grado de la circulación colateral originada en la arteria mamaria interna3-5 y su uso como injerto sin las debidas precauciones puede ocasionar isquemia aguda en los miembros inferiores6-9. Presentamos a 3 pacientes con síndrome de Leriche y enfermedad coronaria a quienes en el cateterismo diagnóstico se les realizó una angiografía selectiva de la AMI, y se documentó la circulación colateral a la arteria femoral ipsolateral, a través de anastomosis abdominales con la arteria epigástrica inferior.
CASO 1
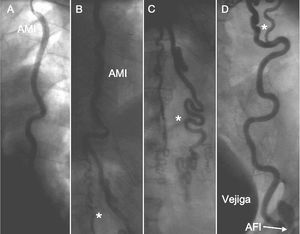
Varón de 62 años, ex fumador, con enfermedad pulmonar obstructiva crónica, diagnosticado de síndrome de Leriche en 1999, monorreno funcional y con stent en la arteria renal derecha desde el año 2000 a través de la arteria axilar izquierda. Ingresa por síndrome coronario agudo sin elevación del segmento ST, con cambios dinámicos en la cara lateral y elevación de troponinas (Tn) hasta 7,7 ng/dl. Se realizó coronariografía por arteria braquial izquierda 5F (arterias radial y cubital izquierdas filiformes y las derechas no palpables), y se encontró estenosis moderada en el tercio medio de la arteria descendente anterior (DA), oclusión crónica de la arteria coronaria derecha en el tercio medio y de la circunfleja (Cx) proximal (con retención de contraste), a partir de la DA había circulación colateral a los otros vasos, con buenos lechos distales. Además, tenía deterioro de la función ventricular (fracción de eyección del 40%) e insuficiencia mitral moderada. Se intentó angioplastia del vaso causal (Cx) que resultó fallida. Al final del procedimiento se realizó el sondaje de la AMI izquierda (fig. 1) que mostró circulación colateral abdominal hacia la arteria femoral izquierda. Debido al acceso vascular no realizamos inyección en la mamaria derecha. El paciente continuó con tratamiento médico, y experimentó lenta mejoría (desaparición de la angina de reposo y clínica de angina de esfuerzo CF II).
Fig. 1. Las imágenes A, B, C y D son secuenciales. A: sondaje de la arteria mamaria interna (AMI) izquierda desde arteria braquial izquierda. B y C: anastomosis a nivel abdominal de la arteria mamaria con la arteria hipogástrica a través de colaterales. D: drenaje de la arteria hipogástrica en la arteria femoral izquierda (AFI). *Se observa la circulación colateral.
CASO 2
Varón de 75 años con hipertensión arterial, dislipemia, ex fumador y diabético tipo 2. En 1988 se le diagnosticó síndrome de Leriche y enfermedad coronaria de 3 vasos, y se revascularizó con 3 injertos de vena safena. Actualmente, por clínica de angina progresiva, lo remiten para coronariografía (realizada a través de la arteria radial derecha 5F) que muestra progresión de la enfermedad en el árbol nativo con puentes de safena permeables sin estenosis significativas (> 50%) y buena función ventricular. La aortografía abdominal confirma la oclusión infrarrenal, y una inyección en arteria mamaria derecha muestra circulación colateral desde ésta a la arteria femoral derecha. El paciente mejoró con intensificación del tratamiento médico y está en seguimiento por cirugía vascular (por el momento rechaza cualquier tipo de intervención quirúrgica).
CASO 3
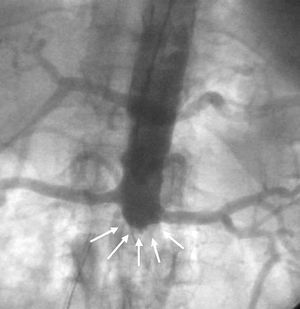
Varón de 53 años, fumador de 60 cigarrillos al día como único factor de riesgo cardiovascular conocido. Clínica de claudicación intermitente no estudiada de varios años de evolución. Ingresa por síndrome coronario agudo sin elevación del segmento ST con edema agudo de pulmón que requirió ventilación mecánica durante 24 h. El electrocardiograma mostraba isquemia subepicárdica en precordiales y la TnI máxima fue de 4 ng/dl. En la exploración física destacaba falta de pulsos femorales, soplo sistólico en la subclavia derecha y ausencia de pulsos cubitales en ambas extremidades superiores. Se realizó coronariografía diagnóstica por acceso radial izquierdo 5F. El árbol coronario estaba difusamente enfermo y calcificado con una estenosis crítica a nivel de DA media con buenos lechos distales, la aortografía abdominal mostró oclusión de la aorta abdominal a nivel infrarrenal (fig. 2, flechas blancas), y la inyección en la mamaria izquierda mostraba circulación colateral a arteria femoral profunda. Se desestimó al paciente para cirugía por su comorbilidad vascular, y en un segundo tiempo se trató percutáneamente con éxito la DA media mediante aterectomía rotacional e implantación de un stent; el acceso en esta ocasión fue a través de la arteria braquial izquierda 6F.
Fig. 2. Oclusión de la aorta abdominal.
DISCUSIÓN
La coexistencia de enfermedad vascular periférica y enfermedad coronaria es frecuente, puesto que tienen factores de riesgo comunes10.
Ante un paciente con síndrome de Leriche y enfermedad coronaria con indicación de cirugía de revascularización, es importante documentar el origen de la circulación colateral a extremidades inferiores. En la enfermedad aortoiliaca obstructiva puede haber circulación colateral a partir de ramas viscerales y/o parietales6, y la cantidad de flujo que aporten cada una de ellas dependerá del grado de la obstrucción. Por tanto, cuanto más alta sea la oclusión en la aorta, menos probable es que la circulación colateral provenga de las arterias mesentéricas y lumbares (y en caso de existir, será de menor entidad), y más importancia adquiere la procedente de las arterias mamarias4.
Las AMI son el injerto de elección para el pontaje coronario2, sobre todo a la arteria descendente anterior. Las complicaciones relacionadas con el uso de esta arteria son infrecuentes, pero se han publicado casos de isquemia aguda en las extremidades inferiores cuando se usan las AMI en pacientes con enfermedad oclusiva aortoiliaca6,7,9. En estos pacientes las AMI pueden ser la principal fuente de circulación colateral a las arterias femorales, y su uso para la revascularización miocárdica se puede asociar con isquemia severa más o menos aguda en los miembros inferiores6-9. La circulación desde la AMI a las extremidades inferiores se realiza a través de anastomosis por pequeñas colaterales entre ésta y la arteria epigástrica inferior por debajo de los músculos rectos abdominales, y el daño de estos vasos en la cirugía abdominal (o en un traumatismo accidental) también puede producir isquemia aguda en miembros inferiores11,12. La proporción de flujo a las extremidades inferiores aportado por la arteria mamaria depende de la localización de la oclusión de la aorta abdominal, que es máxima cuanto más proximal4.
En estos pacientes, cuando se realiza una angiografía selectiva en la AMI, se observa que su calibre es superior al normal (> 3 mm), que están más desarrolladas las arterias epigástricas superior e inferior5,13, y que tras unas anastomosis intraabdominales acaban drenando en las arterias iliaca o femoral correspondientes.
Nuestros pacientes no tenían flujo en aorta abdominal inmediatamente tras el origen de las arterias renales, y en los 3 la AMI cateterizada aportaba circulación a la arteria femoral homolateral.
Dada la trascendencia de esta entidad, cabría plantear la realización de una aortografía abdominal a los pacientes con afección coronaria y datos de enfermedad vascular periférica, especialmente en aquellos en los que se palpan los pulsos femorales débiles, tienen claudicación intermitente o acceso femoral dificultoso. Y, lo que es más importante, en los pacientes con oclusión aortoiliaca, realizar angiografía selectiva sistemática de las AMI cuando se los orienta a cirugía cardiaca3. Teniendo en cuenta que el acceso vascular es «obligado» por extremidades superiores (radial, braquial o muy aisladamente axilar), el sondaje de la AMI homolateral es sencillo.
El tratamiento idóneo en estos pacientes todavía no está claro. Dietzek et al6 recomiendan evitar el uso de la arteria mamaria para la revascularización coronaria y realizar una cirugía secuencial coronario-periférica, pero algunos grupos han tenido buenos resultados con la revascularización quirúrgica simultánea utilizando la arteria mamaria como injerto coronario y pontaje a extremidades inferiores (con diferentes técnicas según el nivel de la oclusión)3,14. Finalmente, en algunos casos con comorbilidad importante la angioplastia puede ser una alternativa igualmente válida. No obstante, la experiencia en este campo es limitada, y la decisión debe tomarse de forma conjunta en cada paciente entre cardiólogos, hemodinamistas, cirujanos cardiacos y vasculares.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. M.C. Ferrer-Gracia.
Sección de Hemodinámica. Hospital Universitario Miguel Servet.
Paseo Isabel la Católica, 1-3. 50009 Zaragoza. España.
Correo electrónico: mcferrergracia@yahoo.es
Recibido el 25 de abril de 2007.
Aceptado para su publicación el 9 de mayo de 2007.