En este artículo se resume la evidencia disponible para el empleo del implante valvular aórtico transcatéter como tratamiento de elección para los pacientes con estenosis aórtica grave sintomática considerados inoperables y con esperanza de vida superior a 1 año. También se resume la evidencia disponible acerca de la no inferioridad del implante valvular aórtico transcatéter en comparación con el recambio valvular aórtico en pacientes de elevado riesgo quirúrgico, por lo que se lo considera una alternativa válida a la cirugía. Finalmente se expone la experiencia reportada respecto a la aplicabilidad de este tratamiento en otros escenarios clínicos en los que se puede convertir, en un futuro cercano, en una alternativa terapéutica sólida al recambio valvular aórtico quirúrgico.
Palabras clave
El implante valvular aórtico transcatéter (transcatheter aortic valve implantation [TAVI]) se ha convertido en el tratamiento de elección para los pacientes con estenosis aórtica grave considerados inoperables, con mejores resultados que con el manejo conservador, incluida la valvuloplastia aórtica. En otro grupo de pacientes, aquellos con alto riesgo quirúrgico, el TAVI se ha demostrado no inferior al recambio valvular aórtico quirúrgico (RVAo). En este artículo se resume la evidencia disponible para el empleo del TAVI en estas dos indicaciones actuales, así como la experiencia reportada respecto a la aplicabilidad de este tratamiento en otros escenarios clínicos en los que se puede convertir, en un futuro cercano, en una alternativa terapéutica sólida al RVAo.
TAVI: Indicaciones actualesLa actual guía europea de práctica clínica sobre el tratamiento de las valvulopatías1 otorga un papel central al equipo cardiológico (Heart Team) en la valoración individualizada de la mejor opción de tratamiento para los pacientes con estenosis aórtica inoperables o de alto riesgo quirúrgico. Este equipo debe evaluar los riesgos individuales del paciente, la factibilidad técnica del TAVI y el tipo de abordaje más indicado para tomar decisiones clínicas para este grupo de pacientes. Se debe identificar las contraindicaciones clínicas y anatómicas, y los pacientes candidatos deben tener una expectativa de vida≥1 año y probabilidades de mejorar su calidad de vida teniendo en cuenta sus comorbilidades. Como norma general, se propone como indicación de TAVI el alto riesgo quirúrgico con EuroSCORE logístico>20%1–3. No obstante, como ya es sabido, el EuroSCORE tiende a sobrestimar la mortalidad perioperatoria, por lo que se ha señalado que una puntuación superior al 10% por el sistema de la Society of Thoracic Surgeons (STS) podría ser más realista4.
En determinados escenarios clínicos, como fragilidad, aorta de porcelana, historia de irradiación torácica y existencia de injertos aortocoronarios previos, en ausencia de elevado riesgo quirúrgico, se considera el TAVI como una opción atractiva frente al RVAo1,2. No obstante, en estas situaciones clínicas la decisión siempre debe tomarse en el Heart Team. Por el momento, y a falta de nuevos estudios, algunos de ellos ya en marcha, los pacientes con riesgo quirúrgico intermedio quedan excluidos de este tratamiento.
TAVI: Evidencia científicaLa evidencia disponible hace referencia a diferentes registros observacionales y a dos estudios aleatorizados, cuyos resultados se resumen a continuación.
Registros observacionales con seguimiento a corto-medio plazoRegistros SOURCE y CoreValve 18FLos estudios observacionales exploran la factibilidad y los problemas derivados de la introducción de una nueva técnica como paso previo a plantear un ensayo aleatorizado. En un segundo escalón y en presencia de estudios aleatorizados, representan la piedra angular para incrementar el cuerpo de conocimiento, complementando la evidencia generada por dichos estudios. Son fundamentales a la hora de considerar nuevas indicaciones que surgen en la práctica habitual, así como en la evaluación de muestras poblacionales más complejas, heterogéneas y representativas de los pacientes reales, en contraposición a los pacientes estudiados en los estudios aleatorizados2,5.
Tras la aprobación de los primeros dispositivos (prótesis Edwards SAPIEN y CoreValve) en Europa, se realizaron dos registros, el SOURCE6 y el CoreValve 18F7.
El registro SOURCE se llevó a cabo en 32 hospitales europeos y se diseñó para analizar los resultados inmediatos del implante de la válvula Edwards SAPIEN en 1.038 pacientes. Los pacientes tratados por vía transapical (TA) (n=575) tenían más comorbilidades y, por lo tanto, un EuroSCORE logístico mayor (el 29,1 frente al 25,7%; p < 0,001) que los pacientes tratados por vía transfemoral (TF) (n=463). Se trata de grupos con perfiles de riesgo diferentes y, por lo tanto, no comparables. Se observó éxito del procedimiento a corto plazo en el 93,8% de los casos. Las incidencias de embolización de la válvula y de oclusión coronaria fueron del 0,3 y el 0,6% respectivamente. La incidencia de accidente cerebrovascular fue del 2,5%, similar para ambas vías de tratamiento. La mortalidad a los 30 días fue del 6,3% de los pacientes tratados por vía TF y el 10,3% de los pacientes tratados por vía TA.
El registro CoreValve 18F7 incluyó a 646 pacientes con estenosis aórtica grave tratados con la prótesis CoreValve por vía femoral y con EuroSCORE logístico del 23,1%±13,8%. El éxito del procedimiento se observó en el 97% de los casos, con una mortalidad del 1,5%. A los 30 días, el objetivo combinado de muerte, ictus o infarto de miocardio fue del 8%. Estos dos registros iniciales demostraron que el TAVI es una técnica factible y con buenos resultados inmediatos.
Registro británicoEl principal objetivo del registro UK TAVI fue definir las características de los pacientes sometidos a TAVI y los resultados en cuanto a supervivencia en pacientes tratados en el Reino Unido8. Se incluyó a 870 pacientes consecutivos hasta el 31 de diciembre de 2009. Las válvulas implantadas fueron CoreValve (52%) y Edwards SAPIEN (48%), y la mayoría de los implantes se realizaron por vía TF. Una de las fortalezas de este registro es que participaron todos los centros con programa de TAVI de Inglaterra y Gales (n=25), que incluyeron a todos sus pacientes consecutivos. El 100% de la evaluación de la mortalidad lo llevó a cabo una entidad externa independiente de los hospitales participantes. Los resultados de mortalidad a 30 días y a 1 y 2 años de seguimiento fueron el 7,1, el 21,4 y el 26% respectivamente. El 62% de los pacientes sometidos a TAVI estaban vivos a los 3 años y el 48,4% a los 5 años. Otros datos relevantes respecto al seguimiento a 5 años fueron la mayor supervivencia de los pacientes tratados por vía TF frente a otras vías de implante (el 64,3 y el 55,7%; p=0,017) y la menor mortalidad de los tratados con la válvula CoreValve frente a la Edwards SAPIEN, aunque sin diferencias estadísticamente significativas (el 35,4 y el 40,7%; p=0,078)8.
Registro francésEn el registro FRANCE 2 se incluyó de manera prospectiva a 3.195 pacientes desde enero de 2010 hasta octubre de 2011 en 34 centros franceses. Las válvulas implantadas fueron Edwards SAPIEN (66,9%) y CoreValve (33,1%); la principal vía de acceso fue la TF (74,6%). La mortalidad a 30 días y a 1 año fue del 9,7 y el 24% respectivamente, y tras realizar un análisis multivariable, se demostró que al año los pacientes con insuficiencia aórtica mayor que moderada después del implante tenían un riesgo de muerte 2,5 veces superior9.
Registro alemánEl registro alemán de TAVI es un estudio multicéntrico y prospectivo que se inició en 2009 con el objetivo de evaluar indicación, intervención, resultados clínicos e impacto en la calidad de vida después del TAVI en la práctica clínica habitual. Hay datos de seguimiento disponibles de 1.370 pacientes procedentes de 27 centros alemanes. Las válvulas empleadas fueron CoreValve (82%) y Edwards SAPIEN (18%). Las tasas de mortalidad a los 30 días y a 1 año fueron del 8,2 y el 20,2% respectivamente5,10.
Respecto a la experiencia alemana, se debe comentar el registro GARY11, en el que se incluyó a un total de 13.860 pacientes consecutivos durante el año 2011, sometidos a tratamiento por enfermedad de la válvula aórtica mediante cirugía convencional o por técnicas transcatéter, ya fuera TA o transvascular. Los pacientes sometidos a TAVI eran significativamente mayores. La mortalidad hospitalaria en el grupo quirúrgico fue del 2,1% del grupo de RVAo solo y del 4,5% cuando se asociaba cirugía de revascularización coronaria. En el grupo transcatéter, la mortalidad hospitalaria en el grupo transvascular fue del 5,1% y en el grupo TA, del 7,7%11.
En el seguimiento a 1 año, la mortalidad en el grupo quirúrgico fue del 6,7% con el RVAo convencional (n=6.523) y el 11% con la cirugía de RVAo combinada con revascularización coronaria (n=3.464). En el grupo de pacientes de tratamiento transcatéter, la mortalidad al año fue del 20,7% con el acceso transvascular (n=2.695) y el 28% con el acceso TA (n=1.181)12.
Registro italianoEl registro italiano14 incluyó a 663 pacientes tratados con la tercera generación de CoreValve (18 Fr) procedentes de 14 centros diferentes. La mortalidad acumulada fue del 5,4% a los 30 días, el 12,2% a los 6 meses y el 15% a 1 año13.
Hay datos de seguimiento a 3 años de 181 pacientes, cuyas tasas de mortalidad a 1, 2 y 3 años fueron del 23,6, el 30,3 y el 34,8%14.
Registro iberoamericanoEl registro iberoamericano15 incluyó a 1.220 pacientes procedentes de 42 centros iberoamericanos tratados con la válvula CoreValve. La mortalidad hospitalaria fue del 7,3% y la supervivencia estimada a 1 y 2 años, del 82,1 y el 73,4%15. Estos datos concuerdan con los reportados previamente en una serie más corta16.
Los predictores de mortalidad hospitalaria fueron la insuficiencia renal aguda, el accidente cerebrovascular, el sangrado mayor y un EuroSCORE alto. Los predictores de mortalidad a largo plazo fueron la diabetes mellitus, la enfermedad pulmonar obstructiva crónica grave y la clase funcional avanzada (III/IV)15.
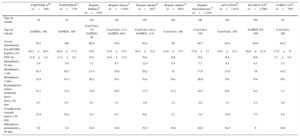
| PARTNER A28 (n=348) | PARTNER B31 (n=179) | Registro británico8 (n=870) | Registro francés9 (n=3.195) | Registro alemán10 (n=697) | Registro italiano14 (n=663) | Registro iberoamericano15 (n=1.220) | ADVANCE22 (n=1.015) | SOURCE XT21 (n=2.760) | COREV US32 (n=795) | |
|---|---|---|---|---|---|---|---|---|---|---|
| Tipo de estudio | Al | Al | Ob | Ob | Ob | Ob | Ob | Ob | Ob | Al |
| Tipo de válvula | SAPIEN, 100 | SAPIEN, 100 | CoreValve, 52; SAPIEN, 48 | CoreValve, 33,1; SAPIEN, 66,9 | CoreValve, 84,4; SAPIEN, 15,6 | CoreValve, 100 | CoreValve, 100 | CoreValve, 100 | SAPIEN XT, 100 | CoreValve, 100 |
| Acceso transfemoral | 70,1 | 100 | 68,9 | 74,6 | 92,4 | 90 | 94,7 | 88,4 | 62,6 | 82,8 |
| EuroSCORE logístico (%) | 29,3±16,5 | 26,4±17,2 | 18,5 | 21,9±14,3 | 20,5±13,2 | 23,0±13,7 | 17,8±13 | 19,4±12,3 | 20,4±12,4 | 17,6±13 |
| STS (%) | 11,8±3,4 | 11,2±5,8 | NA | 14,4±11,9 | NA | NA | NA | NA | NA | 7,3±3,0 |
| Mortalidad a 30 días | 3,4 | 5,0 | 7,1 | 9,7 | 12,4 | 5,4 | 7,3 | 4,5 | 4,3 | 3,3 |
| Mortalidad a 1 año | 24,3 | 30,7 | 21,4 | 24,0 | 20,2 | 15 | 17,9 | 17,9 | 19 | 14,2 |
| Mortalidad a 2 años | 33,9 | 43,3 | 26,3 | NA | NA | NA | 26,6 | NA | NA | NA |
| Regurgitación aórtica moderada-grave | 13,1 | 15,2 | 13,6 | 16,5 | 17,5 | 21,2 | 24.5 | NA | 6,2 | 2,1 |
| Ictus a 30 días | 4,7 | 6,7 | 4,1 | 4,1 | 2,8 | 1,2 | 2,8 | 3,3 | 2,3 | 4,9 |
| Complicación vascular mayor a 30 días | 11,0 | 16,2 | 6,3 | 4,7 | NA | 2,1 | 3,9 | 10,9 | 7,3 | 5,9 |
| Marcapasos permanente a 30 días | 3,8 | 3,4 | 16,3 | 15,6 | 39,3 | 16,6 | 24,8 | 26,3 | 8 | 19,8 |
Los valores expresan porcentajes o media±desviación estándar. Al: aleatorizado; Ob: observacional.
Uno de los principales problemas para poder comparar los resultados de los diferentes registros es la falta de concordancia en los criterios que definen las complicaciones. Este problema quedó solucionado con la aparición de los criterios del VARC17,18 y la actualización de los criterios del VARC 219.
El registro STS/ACC TVT20 comunica los resultados iniciales de 224 hospitales estadounidenses tras la comercialización de la válvula aórtica Edwards SAPIEN. De los 7.710 pacientes incluidos en el estudio, se consideró inoperables a 1.559 (20%) y operables, pero de alto riesgo quirúrgico, a 6.151 (80%). La mediana de edad fue 84 años y la del score STS, del 7%. El objetivo principal del estudio fue la mortalidad hospitalaria por cualquier causa (5,5%) y el accidente cerebrovascular (2%).
Registros SOURCE XT y ADVANCELos registros SOURCE XT21, con la válvula SAPIEN XT, y ADVANCE22, con la CoreValve, incluyeron a pacientes entre 2010 y 2012. Como novedad, y en contraposición a los registros anteriores, en ambos casos un comité independiente asignó los eventos. En ambos registros se observó una importante reducción de la mortalidad con respecto a registros previos (mortalidad a 30 días, el 4,3% en el registro SOURCE XT y el 4,5% en el ADVANCE; mortalidad a 1 año, el 19 frente al 17,9%). En ambos casos, las complicaciones se ven reducidas de manera importante, de modo que las secundarias al implante de la válvula son excepcionales, lo que demuestra que el implante resulta más eficaz y seguro. Gran parte de los resultados obtenidos, aparte de la gran experiencia de los centros involucrados, puede explicarse por la mejor selección de los pacientes y la optimización en la elección del tamaño valvular21,22.
Registro US CoreValve Extreme Risk PivotalEl registro US CoreValve Extreme Risk Pivotal23 evaluó la seguridad y la eficacia de la válvula CoreValve para el tratamiento de la estenosis aórtica grave en pacientes en riesgo quirúrgico extremo. En 41 hospitales de Estados Unidos se incluyó a 506 pacientes, de los que se programó para TAVI a 489. El objetivo primario era un combinado de mortalidad por cualquier causa y accidente cerebrovascular mayor a los 12 meses, y se comparó con un objetivo preespecificado estimado en un 43%, obtenido de dos fuentes: un metanálisis de resultados de siete estudios de valvuloplastia aórtica y los resultados del tratamiento médico de la cohorte B del estudio PARTNER24. La tasa de mortalidad por cualquier causa o accidente cerebrovascular mayor a los 12 meses fue del 26 frente al 43%, correspondiente al objetivo preespecificado (p < 0,0001). A los 30 días y a los 12 meses, se analizaron los objetivos individuales, la mortalidad por cualquier causa (el 8,4 y el 24,3%) y el accidente cerebrovascular mayor (el 2,3 y el 4,3%). La frecuencia de la regurgitación aórtica paravalvular moderada o grave fue menor 12 meses después del implante comparado con el momento del alta hospitalaria (el 4,2 y el 10,7%; p=0,004).
Registros con seguimiento a largo plazoTal y como se ha expuesto, existe mucha información disponible respecto a los resultados alcanzados con el TAVI tanto a corto como a medio plazo. No obstante, en el momento actual la evidencia es escasa respecto a los resultados a largo plazo. Uno de los primeros trabajos en que se publicaron los datos de seguimiento a largo plazo es el de Gurvitch et al25, que incluyó a 70 pacientes tratados con la válvula de Edwards SAPIEN que sobrevivieron los 30 días iniciales tras el implante y con un seguimiento superior a 3 años.
La supervivencia fue del 81% al año, el 74% a los 2 años y el 61% a los 3 años. El seguimiento ecocardiográfico demostró un comportamiento estable del funcionamiento de la válvula, con una mínima reducción del área valvular (0,006cm2 al año; p < 0,001) y sin incremento de la regurgitación aórtica reportada en el implante. Se realizó evaluación seriada mediante tomografía computarizada, que mostró ausencia de engrosamiento, calcificación o fusión de los velos y de fractura del anillo. Estos resultados respecto a la estabilidad de la función valvular se corroboraron en el seguimiento a 3 años reportado por el registro italiano con la válvula CoreValve, que al final del seguimiento mostraba ausencia de cambios significativos en el gradiente transvalvular o el grado de insuficiencia aórtica tras el implante14.
Posteriormente, Rodés-Cabau et al26 analizaron los resultados a 5 años del Canadian Multicenter Experience Study. Se incluyó a 339 pacientes procedentes de seis centros canadienses, con implante de tres tipos diferentes de válvulas percutáneas: Cribier Edwards (n=57), Edwards SAPIEN (n=275) y SAPIEN XT (n=7)26.
El 52% de los procedimientos se realizaron por vía TF y el 48%, por vía TA. El seguimiento ecocardiográfico demostró una ligera reducción gradual del área valvular efectiva en los primeros 2 años de seguimiento (1,62±0,38cm2 en el momento basal, 1,44±0,33cm2 en el primer año de seguimiento y 1,38±0,35cm2 al segundo año; p < 0,007). Estos cambios se estabilizaron durante el seguimiento a más largo plazo, de modo que no hubo reducciones significativas al tercer año (1,36±0,38cm2) ni al cuarto año (1,35±0,37cm2). Aunque estos datos son muy favorables, deben valorarse con cautela, dado que hacen referencia a pocos pacientes (50 al tercer año y 28 al cuarto). Una de las principales aportaciones de este trabajo de seguimiento a largo plazo es la identificación de los principales factores predictores de mortalidad a largo plazo, que fueron: enfermedad pulmonar obstructiva crónica (hazard ratio [HR]=2,18; intervalo de confianza del 95% [IC95%], 1,53-3,11), insuficiencia renal crónica (por cada 10 ml/min de reducción del filtrado glomerular, HR=1,08; IC95%, 1,01-1,19), fibrilación auricular crónica (HR=1,44; IC95%, 1,02-2,03) y fragilidad (HR=1,52; IC95%, 1,07-2,17).
Gotzmann et al27 analizaron los datos a 3 años de 150 pacientes consecutivos con estenosis aórtica grave tratados con la prótesis CoreValve. La mortalidad por cualquier causa fue del 25% al año, el 32% a los 2 años y el 41% a los 3 años, y la mortalidad cardiovascular, del 14, el 21 y el 27% respectivamente. En cuanto a la evolución de la función valvular, los autores objetivaron una reducción anual del área aórtica de 0,1cm2, y al final del seguimiento hubo 2 casos de estenosis aórtica. La proporción de regurgitación aórtica moderada o grave inmediatamente tras el implante fue del 15% y no hubo nuevos casos durante el seguimiento. La incidencia de endocarditis fue del 0,66% por año27.
Los datos de durabilidad y estabilidad de la función valvular expuestos se han confirmado en el reciente trabajo de Toggweiler et al28, en el que se evaluó el seguimiento a 5 años de 88 pacientes tratados con TAVI. En ese estudio de seguimiento, del que se excluyó a los pacientes que fallecieron en los primeros 30 días post-TAVI, el 73% (n=64) de los implantes se realizó por vía TF y el 27% (n=24), por vía TA.
El gradiente transvalvular medio por ecocardiografía pasó de 10±4,5mmHg después del implante a 11,8±5,7mmHg a los 5 años, lo que supuso un cambio no significativo (p=0,06). El área valvular aórtica sufrió una reducción significativa por datos ecocardiográficos, pero sin repercusión clínica: 1,67±0,41cm2 tras el implante y 1,4±0,25cm2 a los 5 años (p=0,01). A los 5 años de seguimiento, 3 pacientes (3,4%) presentaban degeneración valvular moderada (uno de ellos, regurgitación moderada; otro, estenosis moderada y otro, degeneración moderada mixta). Las tasas de supervivencia en los 5 años de seguimiento fueron respectivamente del 83, el 74, el 53, el 42 y el 35%; la mediana de supervivencia fue 3,4 (IC95%, 2,6-4,3) años y fueron predictores de mortalidad la enfermedad pulmonar obstructiva crónica (HR=2,17; IC95%, 1,28-3,70) y la regurgitación aórtica al menos moderada (HR=2,98; IC95%, 1,44-6.17).
A la vista de estos resultados, se puede afirmar que al parecer hay un adecuado comportamiento de la competencia valvular con el paso del tiempo, si bien es cierto que se necesitan trabajos con mayor seguimiento y mayor número de pacientes que confirmen este hecho.
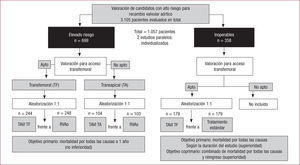
Ensayos clínicos aleatorizadosEstudio PARTNEREl primer estudio aleatorizado realizado para evaluar la eficacia del tratamiento con TAVI es el ensayo PARTNER24. Ese estudio aleatorizado, pionero en la «era del TAVI», estaba constituido por dos cohortes de pacientes (figura 1). La primera de ellas, la cohorte A (n=699), estaba formada por los pacientes considerados de alto riesgo quirúrgico, con un STS>10%. La cohorte B (n=358) estaba constituida por los pacientes que no eran candidatos a RVAo por considerárselos inoperables, con un riesgo de muerte estimado≥50% en los primeros 30 días después de la cirugía. Los criterios de selección del estudio PARTNER eran muy estrictos, ya que se excluyó a los pacientes con estenosis aórtica y válvula aórtica bicúspide o con ausencia de calcificación importante, con enfermedad coronaria grave que necesitara revascularización, función ventricular izquierda < 20%, insuficiencia mitral o aórtica grave, insuficiencia renal grave o accidente cerebrovascular en los 6 meses previos, lo que constituye una muestra muy seleccionada que supuso la inclusión del 34% del total de 3.105 pacientes evaluados para la aleatorización24. Se trató a todos los pacientes con la primera generación de la válvula Edwards SAPIEN.
PARTNER, cohorte A, pacientes de alto riesgo quirúrgicoEsta cohorte presenta un diseño de no inferioridad en el que los pacientes considerados operables eran sometidos a una evaluación exhaustiva del eje iliofemoral y, en función del resultado, se los clasificaba como candidatos a acceso TF o TA; posteriormente los aleatorizaron a TAVI o a cirugía. De este modo, en la rama TF se comparó el grupo de TAVI TF (n=244) con el grupo de RVAo, y en la rama TA se comparó el grupo de TAVI TA (n=104) con el grupo de RVAo (n=103). El objetivo principal fue la mortalidad al año. Las características demográficas (media de edad, 84 años; varones, el 57%) y clínicas fueron similares en los dos grupos, incluido el STS (11,8±3,3 y 11,7±3,5 en los grupos de TAVI y de RVAo respectivamente). Entre los grupos de TAVI y de RVAo, no hubo diferencias en mortalidad (a los 30 días, el 3,4 frente al 6,5%; p=0,07; al año, el 24,2 frente al 26,8%; p=0,44; a los 2 años, el 34 frente al 35%; p=0,78), necesidad de rehospitalización o la situación funcional a partir de los 6 meses. Los eventos vasculares totales (ictus y accidentes isquémicos transitorios) fueron más frecuentes en el grupo de TAVI (a los 30 días, el 5,5 y el 2,4%; p=0,04; al año, el 8,7 y el 4,3%; p=0,04; a los 2 años, el 11,2 y el 6,5%; p=0,05), pero esta diferencia no alcanzó significación estadística al considerar solo los ictus (a los 30 días, el 4,6 y el 2,4%; p=0,12; al año, el 6 y el 3,2%; p=0,08; a los 2 años, el 7,7 y el 4,9%; p=0,17). Las complicaciones vasculares también fueron más frecuentes en el grupo de TAVI (el 11 y el 3,2%; p < 0,001), mientras que los sangrados mayores (el 9,3 y el 19,5%; p < 0,001) y los episodios de fibrilación auricular (el 8,6 y el 16%; p=0,006) lo fueron en el grupo de RVAo. El seguimiento ecocardiográfico confirmó el buen comportamiento hemodinámico de la válvula al año y a los 2 años y la mejoría persistente de la situación funcional. Un aspecto importante que por primera vez quedó bien documentado es el impacto de la regurgitación aórtica (incluso leve) en la mortalidad a medio plazo24,29,30.
PARTNER, cohorte B, pacientes inoperablesLos resultados de la cohorte B son de pacientes inoperables aleatorizados a TAVI o tratamiento médico. Los resultados fueron superiores en el grupo de TAVI, con una marcada reducción de la mortalidad al año (el 30,7 frente al 50,7%; con TAVI, HR=0,55; IC95%, 0,40-0,74; p < 0,001), que se mantenía en el seguimiento a los 2 años (el 43,3 frente al 68,0%; p < 0,001). Esto supone una disminución del 20% de la mortalidad por cualquier causa al año de seguimiento, lo que significa que solo 5 pacientes necesitaron tratamiento con TAVI para que 1 paciente adicional sobreviviera al año de seguimiento con respecto al tratamiento estándar. A estos buenos resultados de eficacia, se añade la mejora relevante en la calidad de vida y el estado funcional obtenida en los pacientes tratados con TAVI, con una mejora significativa de la clase funcional de la New York Heart Association (NYHA) (NYHA I-II, el 75 frente al 42%; p < 0,001)31.
Estudio US COREVALVEEn este ensayo multicéntrico32, se aleatorizó a un total de 795 pacientes de elevado riesgo quirúrgico (figura 2), procedentes de 45 centros de Estados Unidos, a tratamiento con TAVI con el dispositivo CoreValve (n=390) o RVAo convencional (n=357). El perfil de riesgo de los pacientes estaba equilibrado entre ambos grupos (STS, 7,3%±3% y 7,5%±3,4%). En el análisis de supervivencia, la mortalidad al año fue inferior en el grupo de TAVI que en el de RVAo (el 14,2 frente al 19,1%), con una reducción absoluta del riesgo de 4,9 puntos porcentuales (p < 0,001 para no inferioridad y p=0,04 para superioridad). Los resultados concuerdan con los encontrados en el análisis por intención de tratar. La incidencia de eventos adversos cardiovasculares y cerebrovasculares al año fue significativamente inferior en el grupo de TAVI que en el quirúrgico (el 20,4 y el 27,3%; p=0,03). La proporción de accidente cerebrovascular de cualquier tipo a los 30 días fue del 4,9% del grupo de TAVI y el 6,2% del quirúrgico (p=0,03), con tendencia a mantenerse al año (el 8,8 y el 12,6%; p=0,10)32. Este trabajo marca un antes y un después en la historia del TAVI, ya que es el primer trabajo aleatorizado que reporta tasas de supervivencia después de 1 año de seguimiento superiores en el grupo de TAVI que en el de tratamiento quirúrgico convencional en pacientes con estenosis aórtica y alto riesgo quirúrgico. Según los autores, que el procedimiento de TAVI sea menos invasivo y la movilización precoz de los pacientes pueden ser dos factores que hayan contribuido de forma definitiva a los buenos resultados obtenidos.
Aparte de los resultados en cuanto a mortalidad, de este estudio se puede destacar varios aspectos importantes. En primer lugar, no se documentaron tasas superiores de accidentes cerebrovasculares en el grupo de la válvula percutánea, en contra de lo reportado en el estudio PARTNER A33.
En segundo lugar, un apunte fundamental de este trabajo es el referente a la regurgitación paravalvular post-TAVI. La incidencia de regurgitación aórtica moderada o grave tras el implante fue del 6,1%, comparado con las proporciones superiores reportadas en otros trabajos, que varían del 7 al 16%34,35.
Aunque las tasas de regurgitación aórtica fueron superiores en el grupo de TAVI durante todo el seguimiento, este factor no tuvo influencia en la supervivencia global. Además, la mayoría de los pacientes que tenían regurgitación moderada o grave al alta (76,2%) presentaban regurgitación ligera o moderada en el seguimiento al año. Los autores apuntan como factores determinantes de este hecho la exhaustiva medición del anillo aórtico por tomografía computarizada para la adecuada determinación del tamaño valvular, los implantes valvulares altos con respecto al anillo aórtico y la adecuada expansión de la estructura de nitinol de la válvula autoexpandible32.
TAVI: Indicaciones especialesPacientes de riesgo intermedioSi bien está disponible información indirecta derivada de registros observacionales de pacientes con estenosis aórtica y riesgo quirúrgico intermedio, no se ha hecho ningún estudio comparativo directo entre TAVI y cirugía36,37.
En los próximos años se llevarán a cabo dos estudios aleatorizados (SURTAVI y PARTNER II) en los que se va a comparar los resultados del TAVI y el RVAo en pacientes con estenosis aórtica grave sintomática y riesgo quirúrgico intermedio (puntuación STS entre el 4 y el 8%). Los resultados de estos estudios deberán confirmar si el TAVI es equivalente al RVAo para el tratamiento de estos pacientes.
Insuficiencia aórticaDe los estudios llevados a cabo en pacientes con insuficiencia aórtica, se puede destacar el de Roy et al38, en el que se analizan los datos procedentes de 43 pacientes inoperables con insuficiencia aórtica grave a los que se implantó una válvula CoreValve en 14 hospitales (media de edad, 75,3±8,8 años; el 53% mujeres; media de EuroSCORE logístico, 26,9%±17,9%; STS, 10,2%±5,3%). Todos los pacientes tenían insuficiencia aórtica grave sin estenosis aórtica y 17 (39,5%) tenían algún grado de calcificación valvular documentada por tomografía computarizada o ecocardiografía. El implante se realizó con éxito en 42 pacientes (97,7%) y 8 de ellos (18,6%) requirieron una segunda válvula durante el procedimiento por insuficiencia aórtica residual tras el primer implante, en todos los casos en ausencia de calcificación valvular. La regurgitación aórtica final de grado II-III se objetivó en 9 pacientes (20,9%). A los 30 días, la incidencia de ictus era del 4,7% y la mortalidad por cualquier causa, del 9,3%. A los 12 meses, la mortalidad por cualquier causa era del 21,4%. De los datos expuestos, se puede concluir que los pacientes inoperables con insuficiencia aórtica grave pueden obtener resultados aceptables con TAVI, pero es importante tener en cuenta dos factores: la necesidad de implantar una segunda prótesis y el grado de insuficiencia aórtica residual.
Válvulas biológicas degeneradasTeniendo en cuenta la gran cantidad de pacientes de más de 65 años con estenosis aórtica tratados quirúrgicamente con prótesis biológicas, la durabilidad de estas es uno de los principales aspectos que considerar en el tratamiento de la estenosis aórtica con estos dispositivos. La degeneración puede producirse tanto en modo de estenosis como de regurgitación, aunque muchas veces es mixta. Los principales mecanismos implicados y que representan las principales causas de reintervención son: calcificación, fractura, formación de pannus y trombosis valvular2.
La reintervención, que hasta ahora ha sido el estándar en el tratamiento para las prótesis biológicas degeneradas, implica un riesgo no despreciable en cuanto a morbilidad y mortalidad. La frecuencia de reintervención es variable. A partir de un registro de más de 300.000 pacientes, de los que el 36% recibió tratamiento con válvulas biológicas en posición aórtica, se estima que la tasa de reintervención a los 10 años sea del 3,1%39.
En procedimientos electivos y con pacientes de bajo riesgo, la mortalidad a los 30 días de la RVAo por prótesis biológica es baja (2-7%), pero cuando se debe realizar el procedimiento a pacientes de mayor riesgo quirúrgico, estas cifras pueden superar el 20%40,41.
Así pues, es en estos pacientes donde se abre el campo para el TAVI como alternativa terapéutica mucho menos invasiva que la reintervención quirúrgica para las prótesis biológicas degeneradas (conocido en la literatura anglosajona como valve-in-valve)42.
Los primeros 2 casos de TAVI en este escenario se hicieron en Canadá y Alemania. Se implantó una prótesis CoreValve a través de una Mitroflow degenerada y una SAPIEN por vía TA en una Carpentier-Edwards Perimounts43,44.
Los datos iniciales obtenidos de los registros preliminares como el canadiense (n=24), seguido del italiano (n=25) y dos registros alemanes (n=20 y n=47), fueron muy favorables respecto a la reducción de los gradientes y la disminución del grado de regurgitación aórtica45–47.
En el Global Valve-in-Valve Registry se incluyó a 202 pacientes, procedentes de 38 centros, con prótesis biológicas degeneradas en posición aórtica tratados con TAVI48.
Los tipos de degeneración valvular observada fueron estenosis (n=85; 42%), regurgitación (n=68; 34%) y la combinación de ambas (n=49; 24%). Los gradientes posprocedimiento fueron: pico, 28±14mmHg y medio, 16±9mmHg. En el grupo de pacientes tratados con la válvula CoreValve, la media de gradiente transprotésico fue 5mmHg inferior que en el grupo tratado con Edwards SAPIEN, lo que podría explicarse por la localización supraanular de los velos en el dispositivo CoreValve. El 93,1% de los procedimientos tuvieron éxito y la mortalidad a los 30 días era del 8,4%. Al año se pudo completar el seguimiento del 84,1% de los pacientes, y la supervivencia fue del 85,8%48.
Recientemente se han publicado los datos de un registro multinacional que englobó a 55 centros diferentes e incluyó en total a 459 pacientes con prótesis biológicas degeneradas tratados con TAVI. La principal aportación del registro, además de que los datos concuerdan con los previos en cuanto a supervivencia, es la relevancia de la clasificación en función del tamaño de las prótesis biológicas a las que se va a practicar un valve-in-valve49.
En este registro, las prótesis valvulares se clasificaron en función del tamaño en pequeñas (≤ 21mm; 29,7%), intermedias (> 21 y < 25mm; 39,3%) y grandes (≥ 25mm; 31%). Los tipos de disfunción valvular fueron estenosis (n=181; 39,4%), regurgitación (n=139; 30,3%) y mixta (n=139; 30,3%). En el grupo de las prótesis con estenosis hubo mayor porcentaje de válvulas pequeñas (el 37 frente al 20,9 y el 26,6% con respecto a los grupos de regurgitación y degeneración mixta respectivamente; p=0,005). La supervivencia al mes era del 92,6% y al año, del 83,2% (IC95%, 80,8-84,7). Los pacientes con degeneración tipo estenosis presentaron peor supervivencia al año (76,6%; IC95%, 68,9-83,1) que los grupos de regurgitación (91,2%; IC95%, 85,7-96,7) y de degeneración combinada (83,9%; IC95%, 76,8-91). Las prótesis clasificadas como pequeñas presentaron peor pronóstico, con una supervivencia al año del 74,8% (IC95%, 66,2-83,4) frente a las válvulas de tamaño intermedio (81,8%; IC95%, 75,3-88,3) y grande (93,3%; IC95%, 85,7-96,7). Los factores asociados significativamente a la mortalidad al año fueron el tamaño pequeño de la prótesis (≤ 21mm; HR=2,04; IC95%, 1,14-3,67; p=0,02) y la presencia de degeneración tipo estenosis frente a regurgitación (HR=3,07; IC95%, 1,33-7,08; p=0,008)49.
Los riesgos principales del valve-in-valve son la mala posición valvular y la obstrucción de las arterias coronarias, ambas más frecuentes en este contexto que en la válvula nativa. La mala posición valvular, cuya frecuencia puede alcanzar el 15% en estos procedimientos, se debe al desplazamiento del dispositivo hacia la raíz aórtica o el ventrículo izquierdo48.
Un factor que se relaciona con este hecho es la menor calcificación radiológica de las prótesis biológicas respecto a las válvulas nativas. Por otro lado, el posicionamiento de la válvula puede resultar más dificultoso en las prótesis cuya estructura no cuenta con un stent radioopaco. Para limitar esta complicación, son aspectos clave la experiencia del equipo, el análisis detallado de cada caso, conocer las particularidades arquitectónicas de cada tipo de prótesis biológica aórtica y el uso simultáneo de ecografía transesofágica durante el implante48.
La incidencia de obstrucción de las arterias coronarias puede alcanzar el 3,5%, lo que supone una frecuencia muy superior a lo comunicado sobre el TAVI en válvulas nativas, que no supera el 1%50.
Se trata de una complicación extremadamente grave, por lo que se debe tener especialmente en cuenta. La arteria coronaria que se ocluye con más frecuencia es el tronco común izquierdo, aunque la coronaria derecha también puede verse involucrada. El mecanismo por el que se produce la obstrucción coronaria es el desplazamiento de los velos de la prótesis biológica al implantar la nueva válvula. Suele ser más frecuente en las prótesis estenóticas que en las regurgitantes. Algunos de los factores implicados son la proximidad de los ostium coronarios a la estructura de la válvula quirúrgica, el nacimiento bajo de estos, el tamaño estrecho de la unión sinotubular y senos de Valsalva, engrosamiento acusado de los velos de la válvula degenerada y el implante alto del dispositivo de TAVI50,51.
Algunos autores han propuesto introducir una guía de angioplastia en el tronco común como referencia que, junto con la evaluación minuciosa de cada caso y la identificación de aquellos con mayor riesgo potencial, es fundamental para minimizar el riesgo de esta grave complicación51.
Teniendo en cuenta lo expuesto y la necesidad de seguir acumulando experiencia en el campo, el TAVI se muestra actualmente como una solución alternativa a la reintervención quirúrgica para las prótesis biológicas en posición aórtica que se hayan degenerado, y en los casos de alto riesgo podría ser la opción de tratamiento de elección.
Válvula aórtica bicúspideLa válvula aórtica bicúspide (VAB) es la alteración valvular congénita más frecuente, con una prevalencia estimada de un 1-2%52.
En los estudios iniciales de TAVI, se consideraba la VAB como criterio de exclusión, pero los avances tecnológicos y la mayor experiencia acumulada abren nuevas perspectivas en este campo. Actualmente, se considera la VAB como contraindicación relativa para el TAVI, sobre todo en relación con el mayor riesgo de regurgitación aórtica residual1. No obstante, se han publicado series con buenos resultados del tratamiento con TAVI de pacientes seleccionados con estenosis aórtica y VAB.
Las VAB presentan varios aspectos morfológicos y estructurales que se debe tener en cuenta cuando se considera el tratamiento con TAVI. El anillo de las VAB suele presentar una forma extremadamente elíptica comparada con la morfología oval más propia de las válvulas aórticas tricúspides. En las VAB se ha descrito también una distribución muy asimétrica del calcio anular. Estas particularidades estructurales se han relacionado con una mayor frecuencia de infraexpansión y mala posición, así como mayor proporción de regurgitación paravalvular y degeneración precoz de las prótesis valvulares52.
En contraposición, se han publicado varios casos clínicos de pacientes con VAB que informan de las adecuadas expansión y adaptación anular de las válvulas del tipo expandibles con balón. En relación con las válvulas autoexpandibles, debido a su diseño, el nivel de los velos valvulares de la prótesis es supraanular respecto al anillo nativo, por lo que no es imprescindible la completa aposición de la plataforma de la válvula a nivel anular.
Según datos procedentes del registro alemán, la prevalencia de VAB fue del 3%, que supone un total de 38 pacientes con VAB tratados con TAVI, que es la serie más larga publicada hasta el momento53. En este estudio, Bauer et al53 comparan los resultados y el pronóstico de los pacientes con VAB y con válvula aórtica tricúspide. No hubo diferencias en las características basales ni en la tasa de éxito del procedimiento. En el grupo de VAB hubo mayor proporción de insuficiencia aórtica≥III/IV (el 25 frente al 15%; p=0,05), que no se tradujo en diferencias en la mortalidad a 30 días. La presencia de VAB no se asoció a mayor tasa de mortalidad al año53. Estos datos de seguimiento concuerdan con los publicados previamente por Himber et al54.
Los datos procedentes de otras series informan de la ausencia de diferencias significativas en la tasa de insuficiencia aórtica tras el procedimiento, con datos discordantes en cuanto al seguimiento55,56.
Hayashida et al55 no encontraron diferencias en la mortalidad a 30 días (el 4,8 y el 8,2%; p=1), mientras que en la serie de Costopoulos et al56, la mortalidad a 30 días fue superior en los pacientes con VAB (el 14,2 y el 3,6%; p=0,02), sin diferencias significativas en la mortalidad cardiovascular al año (el 10,5 y el 7,45; p=0,62).
A pesar de que los resultados expuestos son esperanzadores, se debe tener en cuenta que proceden de estudios observacionales de tamaño pequeño y, por lo tanto, hay que considerarlos únicamente en este contexto.
ConclusionesCon los datos actuales derivados de registros observacionales y ensayos aleatorizados, se puede afirmar que el TAVI es el tratamiento de elección para los pacientes con estenosis aórtica grave sintomática considerados inoperables y con esperanza de vida>1 año. En otro grupo de pacientes, con alto riesgo quirúrgico, el TAVI se ha demostrado no inferior al RVAo, por lo que se lo considera una alternativa válida a la cirugía. Hay datos preliminares prometedores en el tratamiento mediante TAVI de pacientes con disfunción de prótesis quirúrgicas valve-in-valve. Actualmente no hay evidencia científica sólida que permita recomendar el procedimiento en pacientes de menor riesgo. Sin embargo, todo parece indicar que a medio plazo el TAVI sustituirá progresivamente al RVAo en el tratamiento de la mayoría de los pacientes con estenosis valvular aórtica grave.
Conflicto de interesesC. Morís: proctor de la válvula CoreValve y miembro del Advisory Board Latinoamericano de Medtronic.