El procedimiento de implante valvular aórtico transcatéter se asocia a tasas relativamente altas de complicaciones, que en algunos casos pueden ser graves. Desde las experiencias iniciales, la mejora en el diseño de dispositivos y en la técnica de implante, unida a un mayor conocimiento de las complicaciones y sus factores de riesgo, ha contribuido en muchos casos a reducir significativamente su incidencia. En este artículo se revisa la evidencia actual sobre las complicaciones más importantes del implante valvular aórtico transcatéter.
Palabras clave
Conocer las complicaciones del implante valvular aórtico transcatéter (TAVI) es fundamental tanto para el cardiólogo intervencionista como para el clínico o el especializado en imagen, dados el indiscutible papel de esta técnica en la práctica actual y futura y la necesidad de un manejo multidisciplinario de los pacientes. Desde los primeros implantes se ha avanzado mucho en el diseño de dispositivos y en la prevención y el tratamiento de las complicaciones, pero estas siguen siendo frecuentes, por lo que es preciso conocer sus factores etiológicos y las mejores estrategias de prevención y tratamiento.
El objetivo de este artículo es revisar las complicaciones más importantes del TAVI en cuanto a prevalencia, etiología, diagnóstico, impacto pronóstico, tratamiento y prevención. También hemos intentado, en los casos en que la evidencia científica lo permite, mostrar la tendencia evolutiva en la prevalencia y la gravedad de cada complicación durante los últimos años. Los trastornos de la conducción en el TAVI se revisan específicamente en otro artículo de este número de Revista Española de Cardiología Suplementos, por lo que no se tratan aquí.
Siempre que ha sido posible, hemos utilizado las definiciones actualmente aceptadas de los criterios del Valve Academic Research Consortium (VARC)1,2, ya que es la recomendación actual de las sociedades científicas. No obstante, en algunas ocasiones se hace referencia a publicaciones relevantes que no han utilizado estos criterios terminológicos por ser previas al consenso o por algún otro motivo.
Complicaciones vasculares y del punto de accesoEl TAVI precisa del uso de introductores vasculares de gran tamaño (16-22 Fr), que a menudo han de avanzar por un árbol arterial ateromatoso, tortuoso y calcificado debido a la edad avanzada de los pacientes tratados habitualmente. Esto, unido a la necesidad ocasional de reposicionar o recapturar la prótesis y las maniobras y dispositivos destinados a la hemostasia del punto de acceso, hace que las complicaciones vasculares sean relativamente frecuentes en el procedimiento de TAVI. Además, las complicaciones vasculares son importantes por el impacto que tienen en el pronóstico del paciente3,4, como se explica más adelante.
En nuestro medio, el acceso transfemoral es el más utilizado; según datos del registro nacional español, casi en un 80% de los pacientes. Aunque inicialmente el acceso y el cierre vascular se realizaban por disección quirúrgica, actualmente en España el acceso percutáneo es el más frecuente, por encima del 90% de los pacientes sometidos a TAVI con prótesis CoreValve y cerca del 60% de los pacientes a los que se implanta la prótesis de Edwards por vía arterial. Las complicaciones del punto de acceso en el abordaje transapical son menos frecuentes, aunque habitualmente más graves.
Siguiendo las recomendaciones de los criterios del VARC1,2, las complicaciones vasculares se clasifican como relacionadas con el lugar de acceso y no relacionadas con el lugar de acceso. Según su gravedad, se dividen en complicaciones mayores y menores. En la tabla 1 se expone la clasificación con más detalle.
Complicaciones vasculares del implante valvular aórtico transcatéter.
| Complicaciones mayores | Disección de aorta torácica, rotura aórtica, rotura del anillo, perforación del ventrículo izquierdo, seudoaneurisma |
| Daño vascular en lugar de acceso (disección, estenosis, perforación, rotura, fístula auriculoventricular, seudoaneurisma, hematoma, daño irreversible de un nervio, síndrome compartimental, fallo del dispositivo hemostático) que desencadena la muerte del paciente, sangrado mayor o con riesgo vital, isquemia visceral o daño neurológico | |
| Intervención endovascular o quirúrgica no planeada asociada a muerte, sangrado mayor, isquemia visceral o daño neurológico | |
| Isquemia en extremidad inferior homolateral a la intervención documentada con síntomas, examen físico o pruebas de imagen | |
| Daño nervioso en relación con el lugar de acceso, ya sea irreversible o que requiera cirugía | |
| Embolización distal (no cerebral) que requiere cirugía o amputación o que produce daño irreversible en un órgano | |
| Complicaciones menores | Daño vascular en el lugar de acceso (los anteriores) que no conduce a la muerte, sangrado mayor o con riesgo vital, isquemia visceral o daño neurológico |
| Embolización distal tratada con embolectomía o trombectomía que no requiera cirugía ni amputación ni cause daño irreversible en ningún órgano | |
| Fallo del cierre percutáneo que requiera otra intervención diferente de la compresión manual o tratamiento con balón endovascular | |
| Intervención endovascular o quirúrgica no planeada que no cumpla criterios de complicación mayor |
Reproducida con permiso de Kappetein et al2.
En el ensayo PARTNER, realizado entre 2007 y 2009, presentaron complicaciones mayores el 15% de los pacientes y complicaciones menores, el 12%. El registro de TAVI de Reino Unido, realizado en la misma época, mostraba una tasa global del 6%, algo superior (8,4%) en el grupo femoral. Los datos provenientes de registros más recientes indican un descenso en la frecuencia de las complicaciones vasculares. Así, en el registro FRANCE-2, en el que se incluyó a 3.195 pacientes tratados en 2010-1011, la incidencia de complicaciones vasculares mayores fue del 4,7%, mientras otros registros europeos más recientes presentan tasas ligeramente inferiores, en torno al 3%. En nuestro medio los resultados son superponibles a los descritos, con tasas de complicaciones vasculares que oscilan entre el 5,6% de la experiencia inicial publicada en 20109 y el 3-4% descrito en los datos del registro iberoamericano y el nacional.
Las complicaciones vasculares mayores tras TAVI transfemoral se asocian con más sangrado y necesidad de transfusión4,11 y con un incremento de hasta 4 veces en la mortalidad a los 30 días. Las complicaciones vasculares menores, sin embargo, no parece que influyan en el pronóstico.
El sexo femenino, la presencia de importante calcificación femoral o enfermedad vascular periférica, la tortuosidad vascular, la experiencia del operador, diámetros femorales menores y una relación tamaño del introductor/arteria femoral>1,05 son algunos de los predictores de complicaciones vasculares mayores3,4,12,13.
Las adecuadas selección y valoración anatómica del paciente y una técnica cuidadosa de punción y hemostasia pueden ayudar a prevenir las complicaciones vasculares. En los últimos años, el uso de la tomografía computarizada para la valoración del acceso, la mejora en el diseño de los dispositivos —que han pasado de requerir 22-24 Fr de diámetro a los actuales de 16-18 Fr— y el desarrollo de nuevas vías de acceso como la subclavia y la transaórtica han contribuido a disminuir las complicaciones vasculares.
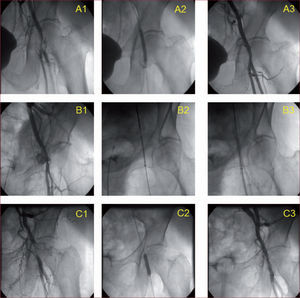
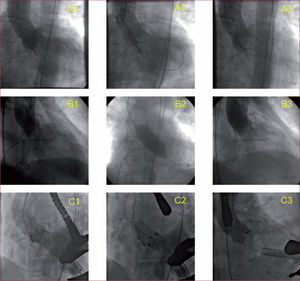
El tratamiento de las complicaciones vasculares abarca desde la hemostasia manual hasta la reparación quirúrgica urgente. Aunque en series como las del estudio PARTNER se recurrió mayoritariamente a la reparación quirúrgica, en la práctica habitual la mayoría de las complicaciones vasculares hemorrágicas se solucionan con hemostasia prolongada, a veces apoyada en el uso de un balón oclusivo o de un stent cubierto. Es frecuente la necesidad de transfusión de hemoderivados. La figura 1 muestra ejemplos de complicaciones vasculares de nuestra experiencia y el modo en que se trataron.
Complicaciones vasculares del TAVI. A: ejemplo de fallo de hemostasia, con salida de contraste alrededor de la arteria femoral tras utilizar el cierre percutáneo con Prostar (A1); en el centro (A2) se hace hemostasia prolongada (15 min) con un balón; a la derecha (A3) se muestra resolución de la complicación con hemostasia satisfactoria. B: ejemplo de sangrado femoral grave tras la hemostasia con Prostar (B1); en esta ocasión el sangrado no cedió con un inflado de balón, por lo que se implantó un stent cubierto en la zona de punción (B2); a la derecha, resolución completa del sangrado (B3). C: trombosis de la arteria femoral común en el lugar de punción (C1), que causaba grave deterioro del flujo; en medio, inflado de balón (C2), y a la derecha, resolución de la imagen trombótica y mínima estenosis residual, con flujo normal de la arteria (C3).
La regurgitación aórtica residual es muy frecuente en el TAVI, a diferencia de en la sustitución valvular quirúrgica, debido a que las prótesis se implantan sin sutura, directamente sobre el anillo, sin retirar previamente la válvula nativa engrosada y calcificada del paciente. Además, la regurgitación residual tiene impacto en la supervivencia, por lo que es una complicación importante.
Es preciso distinguir entre insuficiencia transvalvular y paravalvular. La regurgitación transvalvular hoy es muy infrecuente, aunque puede observarse durante el procedimiento, debido a la interferencia de los catéteres con el funcionamiento de la válvula, o más raramente por daño de los velos, montaje inadecuado de la prótesis o inadecuada expansión que impida el cierre correcto de las comisuras. Más frecuente es la insuficiencia paravalvular, cuyo desarrollo se suele deber a una incompleta aposición de la prótesis sobre el anillo valvular, que puede deberse a una selección inadecuada del tamaño valvular, mala expansión del dispositivo por calcificación importante de los velos o la raíz aórtica o la liberación en una posición subóptima, infraanular o supraanular14,15.
La insuficiencia aórtica residual se da en algún grado en más del 50% de los pacientes sometidos a TAVI aunque, si se considera exclusivamente la regurgitación de grado≥2, la frecuencia se encuentra entre el 10 y el 20%5,6,16–19. En el estudio PARTNER se objetivó regurgitación paravalvular moderada o grave en el 12% de los pacientes en ambas cohortes de TAVI18,19. La experiencia española inicial con CoreValve mostró cifras más altas, en torno al 24% de regurgitación≥29,10, pero en años posteriores la prevalencia ha disminuido. Así, el registro FRANCE-2, realizado entre 2010 y 2011, mostró una tasa de regurgitación del 16%, y el registro nacional español, que incluyó a pacientes entre 2010 y 2011, arroja una tasa global del 6%, que es del 8% con la prótesis CoreValve. Datos más recientes del registro europeo Sentinel, que incluyó a pacientes entre 2011 y 2012, muestran cifras del 7,7%. Por último, un reciente metanálisis que incluyó a 12.926 pacientes estima una incidencia de insuficiencia aórtica de grado al menos moderado del 11,7% de los pacientes.
La insuficiencia residual moderada o grave conlleva un incremento en la mortalidad total, como han mostrado todos los grandes registros5,6,15–17,20,21. El impacto de la regurgitación leve es controvertido ya que, si bien algunos estudios apuntan a que aumenta la mortalidad15,20, otras publicaciones no han encontrado ningún impacto. Probablemente, las diferencias metodológicas entre distintos estudios en la medición y la clasificación de la regurgitación paravalvular influyan en esta disparidad de resultados.
La implantación baja de la prótesis, la subestimación del tamaño de la prótesis y la calcificación extensa del anillo son predictores de regurgitación residual post-TAVI. Prevenir la regurgitación, por lo tanto, pasa por una minuciosa valoración anatómica de la raíz aórtica mediante técnicas tridimensionales, como la tomografía computarizada16,22,23 o la ecocardiografía 3D, para determinar con exactitud el tamaño del anillo aórtico, y por una técnica cuidadosa para optimizar la altura del implante y la expansión de la prótesis.
La valoración de la regurgitación aórtica post-TAVI debe tener el doble objetivo de determinar la gravedad de la regurgitación y su mecanismo, para orientar la necesidad de tratamiento y sus posibilidades. Aunque es habitual en la práctica diaria valorar el resultado final del TAVI mediante aortografía y parámetros hemodinámicos, el consenso del VARC recomienda la ecocardiografía para la valoración definitiva de la regurgitación. En la tabla 2 se reflejan las recomendaciones actuales para la valoración ecocardiográfica24–27.
Valoración ecocardiográfica de la regurgitación paravalvular en el implante valvular aórtico transcatéter
| Insuficiencia valvular | |||
|---|---|---|---|
| Ligera | Moderada | Grave | |
| Parámetros semicuantitativos | |||
| Inversión flujo diastólico aorta descendente | Ausencia | Intermedio | Prominente, holodiastólico |
| Extensión circunferencial del flujo regurgitante (%) | < 10 | 10-29 | > 30 |
| Parámetros cuantitativos | |||
| Volumen regurgitante (ml/lat) | < 30 | 30-59 | > 60 |
| Fracción regurgitante (%) | < 30 | 30-49 | > 50 |
| Orificio regurgitante efectivo (cm2) | 0,10 | 0,10-0,29 | > 0,30 |
Reproducida con permiso de Kappetein et al2.
El tratamiento de la regurgitación post-TAVI depende de la gravedad, la tolerancia hemodinámica y el mecanismo de la insuficiencia28. Si el principal problema es una mala aposición de la prótesis, bien por subexpansión o por calcificación del anillo, la sobredilatación con balón puede ser efectiva. Si el mecanismo de la regurgitación es un implante de la prótesis demasiado alto o bajo, suele ser necesario implantar una segunda prótesis, lo que habitualmente soluciona el problema28,30–33.
En los últimos años, los dispositivos habitualmente utilizados para el TAVI se han sometido a sucesivas mejoras de diseño, tanto en la válvula como en el sistema de liberación, para mejorar el control del sitio de implante y perfeccionar la aposición de la prótesis sobre el anillo. Estas mejoras, unidas al uso de la tomografía computarizada para determinar el tamaño óptimo del dispositivo que se va a implantar, han contribuido a reducir la incidencia de regurgitación paravalvular. Las nuevas prótesis disponibles actualmente34,35, así como los futuros modelos, podrían contribuir a controlar aún más este problema al mejorar el sellado a nivel del anillo y permitir el reposicionamiento y la recaptura del dispositivo de una manera más efectiva.
Accidente cerebrovascularEl accidente cerebrovascular (ACV) quizá sea la complicación más temida del TAVI, ya que, aunque no es muy frecuente, tiene un importante impacto en la supervivencia y la calidad de vida del paciente36,37.
Se define ictus como un evento de alteración o disfunción neurológica focal o general causada por daño vascular en el cerebro, la médula espinal o la vasculatura retiniana, ya sea de causa isquémica o hemorrágica. Se distingue entre: a) accidente isquémico transitorio si la alteración persiste menos de 24 h y no se evidencian secuelas en las pruebas de imagen, y b) ACV, cuando la alteración persiste más de 24 h, se evidencian alteraciones en las pruebas de imagen o se produce la muerte del paciente. Se recomienda además distinguir entre ictus incapacitante y no incapacitante en función de las secuelas evaluadas mediante la puntuación en la escala de Rankin a los 90 días de la intervención.
El procedimiento de TAVI precisa el avance de catéteres de gran tamaño, habitualmente retrógrado, por el arco aórtico y la manipulación de la válvula aórtica degenerada, en la que se suele realizar valvuloplastia con balón antes de implantar la prótesis sobre ella, rechazando hacia los lados los velos nativos calcificados, que quedan enjaulados en la aorta sinusal. En ocasiones, a lo anterior se añaden maniobras para reposicionar o recapturar la prótesis, sobredilataciones con balón o intentos repetidos de implante. Todo lo anterior puede favorecer la embolización de material ateromatoso o trombótico a los troncos supraaórticos. Por técnicas de imagen se ha podido comprobar que la embolización cerebral asintomática es la norma en el procedimiento de TAVI, con tasas entre el 68 y el 84% de los pacientes38,39. Afortunadamente, la prevalencia de daño neurológico clínico es mucho menor. Aunque la mayoría de los eventos son precoces (primeras 24 h), la distribución es bimodal, con un pequeño riesgo en los días y meses siguientes al procedimiento, lo que indica la contribución de otros factores tromboembólicos36,40,41.
En el ensayo clínico PARTNER18,19, los pacientes sometidos a TAVI presentaron unas tasas de ACV a los 30 días altas, del 6,7% en la cohorte inoperable y el 5,5% en la de alto riesgo quirúrgico. En estudios posteriores, las tasas registradas han sido menores, de un 1-4%5,6,10,21; un metanálisis de 2012 cifra la frecuencia de ACV en el 3,3%. La mitad de ellos fueron durante el procedimiento y la otra mitad en los días siguientes. El registro europeo Sentinel, que incluye a pacientes más recientes, presenta tasas del 1,8%.
El ensayo PARTNER describió un exceso significativo de ACV en la rama de TAVI en comparación con el tratamiento médico (el 6,7 y el 1,7%) y con la cirugía convencional (el 5,5 y el 2,4%). Dos metanálisis más recientes42,43 han comparado la incidencia de ACV entre TAVI y cirugía convencional, sin encontrar diferencias significativas (el 3,5 frente al 2,8% y el 2,6 frente al 2,3%). En el registro alemán GARY, que incluyó a 13.860 pacientes con valvulopatía aórtica grave sometidos a recambio valvular aórtico con cirugía convencional (9.987 pacientes) o TAVI por vía retrógrada transarterial (3.366 pacientes), tampoco hubo diferencias en la incidencia de ACV (un 1,3-1,9% frente a un 1,7-2,3%).
Diversos factores se han asociado con mayor riesgo de ACV durante el procedimiento, de los cuales probablemente los más importantes sean un área valvular aórtica menor y la presencia de ateromatosis aortocarotídea45,46. La posdilatación de la prótesis y los intentos múltiples de implante también se han relacionado con un riesgo aumentado de ACV29,47. Se ha especulado con la posibilidad de que la vía transapical presente menor riesgo de ACV, al evitar la manipulación retrógrada de la aorta y la válvula aórtica; los datos del ensayo PARTNER y otros estudios no confirman esta hipótesis5,6,48, aunque un metanálisis sobre más de 10.000 pacientes sí lo hizo36. En el periodo tras la intervención persiste un riesgo aumentado de ACV, en el que parecen influir variables del paciente no relacionadas directamente con el procedimiento, como la enfermedad vascular, la clase funcional previa y la fibrilación auricular45–49.
El ACV en el TAVI se relaciona con un riesgo de muerte al menos 3 veces mayor10,36,47 y en los pacientes supervivientes a menudo persisten secuelas discapacitantes.
La prevención del ACV en el TAVI se basa en la combinación de terapia antitrombótica y minimizar la agresión vascular y valvular durante el procedimiento50. En los últimos años, los catéteres de liberación de las prótesis han ido mejorando su diseño, lo que ha permitido procedimientos menos agresivos. Se han probado en humanos diversos dispositivos percutáneos de protección embólica, y son aparentemente seguros, pero su eficacia en la prevención del ACV está por determinar37,41,45,51,52.
Insuficiencia renalLa insuficiencia renal (IR) aguda post-TAVI es una importante complicación por el gran impacto que tiene en la mortalidad. La aparición de IR post-TAVI probablemente sea multifactorial, en relación con la edad de los pacientes, enfermedades previas como hipertensión, diabetes mellitus y enfermedad vascular, periodos de hipotensión durante el procedimiento, ateroembolia por el uso de catéteres y toxicidad por contraste.
El consenso del VARC recomienda utilizar la clasificación de la Acute Kidney Injury Network (AKIN)53, que gradúa la IR tras el procedimiento en tres estadios según su gravedad. Se recomienda realizar análisis de función renal dentro de las primeras 72 h y a los 7 días, y continuar la monitorización durante 7 días más en caso de IR1,14.
Se estima una incidencia de IR tras TAVI del 7-28% de los pacientes30, aunque los datos disponibles adolecen de falta de estandarización en los criterios diagnósticos. En el ensayo PARTNER precisaron diálisis el 1% de los pacientes inoperables y el 3% de los de alto riesgo. Estudios más recientes que utilizan los criterios del VARC10,54–57 estiman la tasa general de daño renal entre el 10 y el 20%, y la tasa de daño renal de grados 2-3 en un 4-8%. Un 1,5-5% de los pacientes requieren diálisis8,56,57.
La hipertensión arterial, las complicaciones vasculares, el sangrado tras la intervención y la transfusión se han relacionado con mayor riesgo de deterioro de la función renal post-TAVI. La cantidad de contraste administrado, sin embargo, no parece ser determinante55–57, y la función renal basal ha sido predictora en algunos estudios54, pero no en otros.
El daño renal agudo post-TAVI aumenta el riesgo de muerte al menos al doble, aunque en algunos estudios se ha encontrado un riesgo hasta 18 veces mayor. La mortalidad intrahospitalaria de los pacientes con daño renal agudo oscila entre el 20 y el 50%54–57.
La prevención del daño renal post-TAVI se basa en las medidas habituales utilizadas en procedimientos intervencionistas: mantener la perfusión renal con adecuada presión arterial, hidratación, evitar la anemia, controlar la cantidad de contraste, etc. Hay en marcha un ensayo para determinar si la diuresis forzada controlada con el dispositivo Renal Guard puede ayudar a prevenir la IR post-TAVI58. Cuando se produce IR, no hay tratamiento específico distinto de las medidas de hidratación y control metabólico habituales, y la diálisis si fuera necesaria.
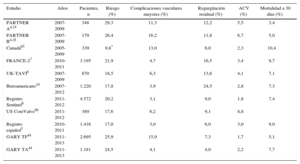
Prevalencia de las principales complicaciones del implante valvular aórtico transcatéter en distintos estudios clínicos
| Estudio | Años | Pacientes, n | Riesgo (%) | Complicaciones vasculares mayores (%) | Regurgitación residual (%) | ACV (%) | Mortalidad a 30 días (%) |
|---|---|---|---|---|---|---|---|
| PARTNER A4,19 | 2007-2009 | 348 | 29,3 | 11,3 | 12,2 | 5,5 | 3,4 |
| PARTNER B4,18 | 2007-2009 | 179 | 26,4 | 16,2 | 11,8 | 6,7 | 5,0 |
| Canadá65 | 2005-2009 | 339 | 9,8* | 13,0 | 6,0 | 2,3 | 10,4 |
| FRANCE-27 | 2010-2011 | 3.195 | 21,9 | 4,7 | 16,5 | 3,4 | 9,7 |
| UK-TAVI6 | 2007-2009 | 870 | 18,5 | 6,3 | 13,6 | 4,1 | 7,1 |
| Iberoamericano10 | 2007-2012 | 1.220 | 17,8 | 3,9 | 24,5 | 2,8 | 7,3 |
| Registro Sentinel8 | 2011-2012 | 4.572 | 20,2 | 3,1 | 9,0 | 1,8 | 7,4 |
| US CoreValve66 | 2011-2012 | 389 | 17,6 | 6,2 | 9,1 | 8,8 | |
| Registro español5 | 2010-2011 | 1.416 | 17,0 | 3,0 | 6,0 | 3,0 | 9,0 |
| GARY TF44 | 2011-2013 | 2.695 | 25,9 | 15,9 | 7,3 | 1,7 | 5,1 |
| GARY TA44 | 2011-2013 | 1.181 | 24,5 | 4,1 | 4,0 | 2,2 | 7,7 |
ACV: accidente cerebrovascular.
La perforación cardiaca puede ocurrir tanto en el ventrículo derecho por la colocación del cable de marcapasos como en el ventrículo izquierdo por la utilización de guías de alto soporte y los catéteres necesarios para el implante. La aparición de hipotensión durante el procedimiento o en los días siguientes debe motivar la sospecha de derrame pericárdico. El taponamiento cardiaco se produce en el 2% de los TAVI aproximadamente y es más frecuente en la vía transfemoral que en la transapical8. El drenaje pericárdico suele solucionar el problema, aunque se puede precisar la reparación quirúrgica en caso de sangrado persistente. El uso de guías de alto soporte especialmente diseñadas para TAVI59 y el manejo cuidadoso y la retirada precoz del electrodo del marcapasos pueden contribuir a prevenir la perforación cardiaca.
Rotura del anillo o de la raíz aórticaEs una complicación muy rara, menos del 1%60. Se relaciona con calcificación extensa y circunferencial del tracto de salida ventricular izquierdo, del anillo aórtico y de la raíz aórtica y con el uso de balones o prótesis de mayor tamaño que el real. La manifestación clínica suele ser deterioro hemodinámico inmediato debido a taponamiento cardiaco que requiere pericardiocentesis urgente como puente a la entrada en el quirófano. La rotura del anillo es poco frecuente en las prótesis autoexpandibles, aunque se han descrito casos que en ocasiones pueden manifestarse más de 24 h después del implante61.
Oclusión coronariaLa oclusión coronaria tras TAVI es una complicación infrecuente (< 1%), pero con consecuencias muy graves. Suele producirse por desplazamiento del velo coronario nativo sobre el ostium coronario al implantar la prótesis (70%), o durante la predilatación o posdilatación, y se produce sobre la coronaria izquierda en el 80% de los casos. Es más frecuente en pacientes con salida baja de las arterias coronarias, aorta sinusal estrecha, mujeres y pacientes más ancianos. El riesgo parece ser mayor también en los procedimientos de valve-in-valve por bioprótesis degenerada y en los pacientes tratados con prótesis Edwards41,62. Las manifestaciones clínicas suelen ser inmediatas, con hipotensión grave, arritmias ventriculares y frecuentemente parada cardiaca. El tratamiento indicado es la desobstrucción urgente mediante angioplastia coronaria, aunque en algunos casos con prótesis autoexpandible se ha resuelto retirando la prótesis con un lazo. En una serie publicada en 201362, la tasa de éxito de la desobstrucción63 urgente cuando se intenta es mayor del 80%, y en algún caso se ha recurrido a la reperfusión con bypass al fallar la desobstrucción. La mortalidad de esta complicación es muy alta (40%), por lo que debe hacerse el mayor esfuerzo en la prevención. Las adecuadas valoración y selección anatómica, evitando especialmente los casos que combinan una salida muy baja del ostium coronario y una aorta sinusal estrecha, probablemente sean la mejor estrategia de prevención. Se ha propuesto también el uso de prótesis reposicionables y la protección con una guía de angioplastia coronaria en casos de alto riesgo62.
Mortalidad precozLos resultados del estudio PARTNER muestran una mortalidad a 30 días del 6,4% de la cohorte inoperable y el 3,4% del grupo de alto riesgo. Más recientemente, en el estudio US CoreValve se han reproducido estas cifras de mortalidad, con un 3,3% de los pacientes a los 30 días del TAVI. No obstante, estas tasas de mortalidad tan bajas no han podido reproducirse en los grandes registros que muestran la «práctica real» en Europa, donde la mortalidad a 30 días oscila entre el 5 y el 10% en la mayoría de las series5–8,10,21,64.
ConclusionesLas complicaciones del TAVI son frecuentes y a menudo graves, por lo que es fundamental conocer los factores predisponentes y las mejores estrategias de prevención y tratamiento. En los últimos años, los avances en el desarrollo de los dispositivos y la mayor experiencia en la técnica del procedimiento han contribuido a reducir significativamente la prevalencia de algunas complicaciones graves. Para que se pueda comparar las tasas entre distintos estudios y establecer un patrón evolutivo, es imprescindible la estandarización diagnóstica y terminológica, basada actualmente en el consenso del VARC. En los próximos años debemos determinar el papel de las nuevas prótesis y otros dispositivos —como los de protección embólica— en la prevención y el tratamiento de las complicaciones del TAVI.
Conflicto de interesesNinguno.