El índice de resistencia microcirculatoria (IRM) medido tras una angioplastia primaria (ICPp) por infarto agudo de miocardio con elevación del segmento ST (IAMCEST) se asocia con la aparición de obstrucción microvascular (OMV) y eventos clínicos adversos. Para evaluar la OMV tras una ICPp exitosa por IAMCEST sin guías de presión ni administración de agentes hiperémicos, variables que parecen limitar la adopción del IRM en el laboratorio de hemodinámica, se investiga la viabilidad y la utilidad de la medición del IRM mediante resonancia magnética cardiaca (RMC) (angio-IRM).
MétodosEl estudio incluyó a 285 pacientes con IAMCEST sometidos a ICPp y RMC. Con un programa informático comercial, se calculó el angio-IRM del vaso culpable tras la ICPp exitosa. Se evaluaron la OMV, el tamaño del infarto y el índice de rescate miocárdico medidos una mediana de 3 [rango intercuartílico, 3-5] días después de la ICPp.
ResultadosDe la población total, 154 pacientes (54,0%) mostraron valores de angio-IRM elevados (> 40 U) en el vaso culpable. La OMV fue significativamente más frecuente en los pacientes con angio-IRM> 40 U que en aquellos con angio-IRM ≤ 40 U (el 88,3 frente al 32,1%; p <0,001). El tamaño del infarto, la extensión de la OMV y el área en riesgo fueron significativamente mayores en los pacientes con angio-IRM> 40 U que con angio-IRM ≤ 40 U (p <0,001 para todas las comparaciones). El angio-IRM mostró una capacidad de discriminación de OMV significativamente mayor que el grado de flujo TIMI o de blush miocárdico (área bajo la curva, 0,821, 0,504 y 0,496 respectivamente; p <0,001).
ConclusionesEl angio-IRM se asoció significativamente con el tamaño del infarto, la extensión de la OMV y el área en riesgo. Cifras altas del angio-IRM (> 40 U) tras una ICPp por IAMCEST fueron muy predictivas de OMV en la RMC.
Ensayo clínico registrado en ClnicalTrialsgov (Identifier: NCT04828681).
Palabras clave
A pesar del restablecimiento del flujo sanguíneo coronario epicárdico mediante intervención coronaria percutánea primaria (ICPp) del paciente con infarto agudo de miocardio con elevación del segmento ST (IAMCEST), puede producirse un fallo de la reperfusión del miocardio en hasta 2 de cada 3 pacientes con IAMCEST, lo cual se atribuye a la aparición de una disfunción microcirculatoria coronaria y una obstrucción microvascular (OMV)1–3. En consecuencia, la evaluación de la disfunción microcirculatoria y la OMV tras una ICPp sería importante para evaluar la eficacia del tratamiento de reperfusión y la necesidad de un posible tratamiento adicional. La resonancia magnética cardiaca (RMC) se considera el patrón de referencia para evaluar la OMV, y se sabe que constituye un indicador de mal pronóstico tras una ICPp en los pacientes con IAMCEST4. Sin embargo, no siempre es posible obtener una RMC en los pacientes con IAMCEST, dada su escasa disponibilidad, el coste médico que supone y las dificultades logísticas5.
El índice de resistencia microcirculatoria (IRM) es un índice fisiológico determinado con una guía con sensor de presión, que permite una evaluación cuantitativa de la función microcirculatoria en un determinado territorio vascular. En estudios previos se ha demostrado que un IRM elevado en el vaso culpable de un IAMCEST tras una ICPp se asocia de manera significativa con OMV y riesgo de muerte súbita o ingreso por insuficiencia cardiaca1,5–7. Sin embargo, la medición convencional del IRM requiere una guía con un sensor de presión-temperatura y la inducción de hiperemia, lo cual limita la adopción del IRM en la practica clínica diaria, en especial tras una ICPp en pacientes con IAMCEST. Recientemente, los avances técnicos han permitido obtener índices fisiológicos, como la reserva fraccional de flujo (FFR) o el IRM, a partir de imágenes angiográficas sin usar una guía con sensor de presión-temperatura ni agentes causantes de hiperemia8–10. Un estudio reciente ha puesto de manifiesto que el IRM obtenido a partir de la coronariografía (angio-IRM) podría utilizarse como alternativa a la determinación convencional del IRM mediante una guía con sensor de presión en los pacientes con IAMCEST para facilitar su estratificación según el pronóstico11,12. Dadas su simplicidad y las relaciones tiempo-efectividad y coste-efectividad favorables, sin necesidad de ninguna intervención adicional, el angio-IRM resultaría especialmente útil en los pacientes con IAMCEST.
El objetivo de este estudio es investigar la viabilidad del angio-IRM para la evaluación de la OMV tras una ICPp realizada con éxito en pacientes con IAMCEST.
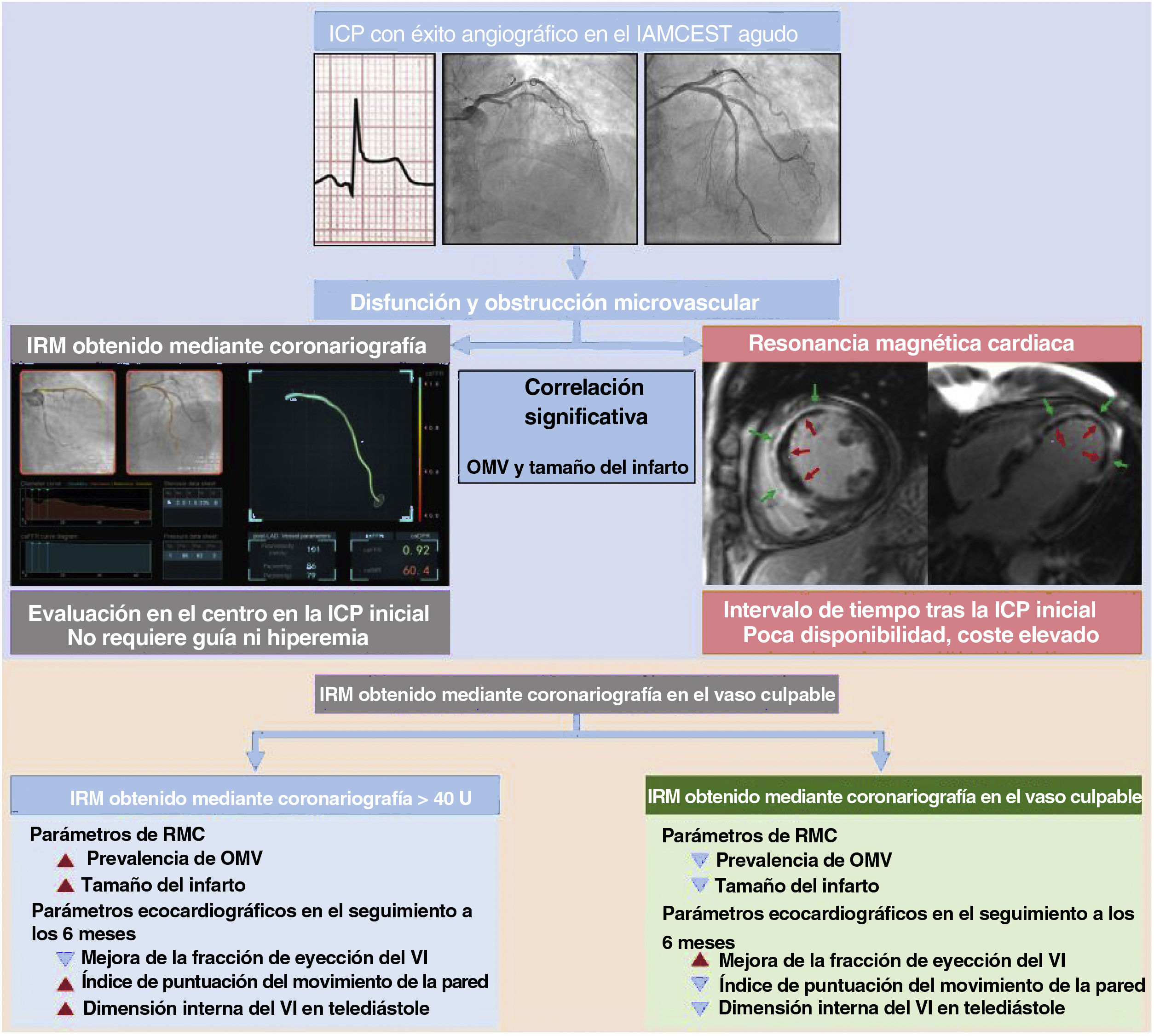
MÉTODOSPoblación del estudioLa población del estudio procede del registro prospectivo de RMC en el infarto agudo de miocardio (IAM) de un centro médico académico de nivel terciario. En este registro unicéntrico se incluyó prospectivamente, entre diciembre de 2007 y julio de 2014, a 515 pacientes consecutivos que presentaron un IAM y a los que se hizo una RMC. Este estudio es un análisis retrospectivo post hoc de los datos prospectivos del registro. El IAM se definió como la presencia de signos clínicos, electrocardiográficos o ecocardiográficos de isquemia miocárdica con elevación de las concentraciones de troponina cardiaca por encima del percentil 99 del límite superior de referencia. Del total de pacientes, se seleccionó para el estudio a los que presentaban un IAMCEST (n=332) y cuyo electrocardiograma mostraba una elevación del segmento ST> 1 mm en 2 o más derivaciones contiguas o un bloqueo de rama izquierda presumiblemente de nueva aparición. Se excluyó a los pacientes en los que fracasó la ICPp (n=1), así como a los que solo recibieron tratamiento médico sin ICP (n=4), no tenían imágenes de coronariografía disponibles (n=3) o imágenes angiográficas funcionales de calidad suficiente (n=39). Tras aplicar estas exclusiones, se analizó a un total de 285 pacientes en el presente estudio (figura 1). El comité de ética de investigación de nuestro instituto aprobó el estudio y todos los participantes dieron su consentimiento informado por escrito. Los datos demográficos y los factores de riesgo cardiovascular se registraron en el momento de la intervención índice de cualificación para el estudio. El protocolo del estudio se registró en clinicaltrials.gov (NCT04828681).
Coronariografía e intervención coronaria percutánea primariaLa coronariografía se llevó a cabo con las técnicas habituales. Las imágenes angiográficas se obtuvieron tras la administración intracoronaria de nitrato (100 o 200 μg) con un catéter diagnóstico de calibre 5 Fr y un catéter guía de calibre 6 Fr antes y después de la ICP respectivamente. Se inyectó el medio de contraste a través del catéter, a una velocidad de 3 y 4ml/s, respectivamente, en las arterias coronarias derecha e izquierda durante aproximadamente 2 s, con un inyector automático (ACIST Medical Systems, Eden Prairie, Estados Unidos). La ICPp se llevó a cabo con las técnicas habituales. Todas las coronariografías se analizaron en un laboratorio central independiente con enmascaramiento y se hizo una coronariografía cuantitativa en proyecciones óptimas con un programa informático validado (CAAS II, Pie Medical Imaging, Países Bajos).
Análisis del índice de resistencia microcirculatoria obtenido mediante coronariografíaPara obtener el angio-IRM, se analizaron las imágenes de coronariografía en un examen post hoc con un programa informático comercial (FlashAngio, Rainmed Ltd, China) en un laboratorio central independiente (Zhongshan Hospital, Fudan University, Shanghai Institute of Cardiovascular Diseases, Shanghái, China). En estudios anteriores se ha presentado información detallada sobre cómo calcular el angio-IRM10,11, partiendo del supuesto de que la media de velocidad de flujo durante todo el periodo de la diástole es aproximadamente proporcional a la de la existente en la hiperemia. En resumen, se registraron las imágenes de coronariografía de Digital Imaging and Communications in Medicine y las presiones aórticas en la consola FlashAngio10. A continuación, se calculó el angio-IRM mediante un proceso de 3 etapas8,10,11. En primer lugar, se reconstruyó un modelo de malla tridimensional de la arteria coronaria a lo largo del vaso, a partir de la entrada en el segmento distal del vaso diana, utilizando como mínimo 2 proyecciones de la coronariografía separadas por un mínimo de 30°. En segundo lugar, se calculó la FFR obtenida a partir de la coronariografía (angio-FFR) mediante dinámica de presión-flujo computacional, según un método descrito con anterioridad8. Por último, se calculó el angio-IRM aplicando la siguiente ecuación: angio-IRM = presión aórtica hiperémica estimada (Pa) × angio-FFR × (longitud del vaso / K+ × Vdiástole)10,11. El valor estimado de la Pa hiperémica fue el supuesto a partir de la presión arterial media (PAM) durante la intervención índice: PAM × 0,2 cuando la PAM es ≥ 95mmHg y PAM × 0,15 cuando la PAM es < 95mmHg8,11. La longitud del vaso se determinó como la distancia entre la entrada y el segmento distal del vaso diana en el que se obtuvieron los valores de angio-FFR y angio-IRM11. K era la constante utilizada para el ajuste de la diferencia entre la velocidad de flujo en reposo y en hiperemia. La Vdiástole era la velocidad del flujo en reposo durante la diástole, que se obtuvo mediante el método de recuento de fotogramas de Thrombolysis In Myocardial Infarction (TIMI)11.
Resonancia magnética cardiacaLa RMC se realizó tras una mediana de 3,0 [intervalo intercuartílico, 3,0-5,0] días tras la ICPp con un escáner de 1,5 T (Magnetom Avanto, Syngo MR version D13; Siemens Medical Solutions, Alemania) con bobinas receptoras en disposición fásica (phased array) de 32 canales. Se obtuvieron imágenes de cineventriculografía del ventrículo izquierdo (VI) mediante una secuencia de precesión libre en fase de equilibrio estable, con proyecciones de eje corto y tetracamerales, tricamerales y bicamerales. Se obtuvieron imágenes con sangre en negro, con ponderación T2 mediante una secuencia de espín-eco turbo segmentada en la misma proyección de eje corto que las secuencias de cineventriculografía. Se obtuvieron imágenes con realce tardío de gadolinio que abarcaban todo el VI 10 min después de la inyección intravenosa de 0,15 mmol/kg de gadobutrol (Bayer Healthcare, Alemania) mediante un disparo de ángulo bajo turbo-fast de inversión-recuperación sensible a la fase, segmentado, en una pila de VI de eje corto contigua. Los tiempos de inversión se ajustaron individualmentre para optimizar la anulación del miocardio visualmente normal (200-350 ms). Radiólogos cardiovasculares experimentados en el mismo instituto tomaron todas las mediciones de la RMC de manera independiente y con enmascaramiento de la identidad de los pacientes. El análisis del volumen del VI se llevó a cabo con un programa informático comercial (CAAS MRV versión 1.0, Pie Medical Imaging B.V., Países Bajos)13. Los límites del endocardio y el epicardio se trazaron manualmente y se excluyeron del endocardio los músculos papilares y las trabéculas del VI13. Se utilizó la imagen con ponderación T2 para determinar una posible hemorragia intramiocárdica y cuantificar el área en riesgo (AR)13. El área con hiperintensificación se especificó como área de infarto y la presencia de hipointensificación dentro del área con hiperintensificación se consideró un signo de OMV13. Se calculó el volumen de hiperintensificación tardía mediante la suma del área de hiperintensificación tardía existente dentro de cada segmento multiplicada por 10mm13. Se definió como tamaño del infarto (%) la proporción de la hiperintensificación tardía respecto al volumen miocárdico del VI. La extensión de la OMV se calculó de la misma manera. El índice de miocardio salvado se calculó como sigue: (AR – tamaño del infarto) × 100 / AR13.
Ecocardiografía bidimensionalSe hizo una ecocardiografía bidimensional completa a todos los pacientes en la situación basal —mediana, 2,0 [1,0-3,0] días— y a los 6 meses de seguimiento —mediana, 199,0 [179,0-259,0] días—. Se midió el grosor de la pared del VI y las dimensiones del VI en la proyección de eje largo paraesternal con métodos estándar según las guías vigentes14. Se calculó la masa del VI al final de la diástole con el método lineal14. La fracción de eyección del VI (FEVI) se determinó con la técnica de biplano de Simpson o con una estimación visual. Las velocidades de flujo de entrada transmitral (E y A) y el tiempo de desaceleración se obtuvieron con la exploración por Doppler con onda pulsada en la proyección tetracameral apical. Se utilizaron imágenes de Doppler tisular para evaluar las velocidades anulares diastólicas inicial (e’) y tardía (a’) en la proyección tetracameral apical, y se promediaron las velocidades anulares mitrales lateral y septal. Se determinó visualmente una puntuación del movimiento de la pared semicuantitativa y se asignó a cada segmento del VI para calcular el índice de puntuación del movimiento de la pared mediante el promedio de las puntuaciones de todos los segmentos visualizados (suma de puntuaciones de todos los segmentos evaluados/número de segmentos evaluados)14.
Análisis estadísticoTodas las variables cualitativas se presentan mediante el número y la frecuencia relativa, y las variables continuas, mediante la media±desviación estándar o la mediana [intervalo intercuartílico] en función de su tipo de distribución, que se verificó mediante la prueba de asimetría y curtosis y el examen visual de los gráficos Q-Q. Las correlaciones entre los valores del angio-IRM y los parámetros cuantitativos obtenidos en la RMC (extensión de la OMV, tamaño del infarto y AR) se evaluaron calculando los coeficientes de correlación de Pearson o Spearman en función de la normalidad de la distribución. Se compararon los parámetros obtenidos en la RMC y los parámetros ecocardiográficos según los valores del angio-IRM, con un valor de corte de 40 basado en lo indicado por estudios previos1,5–7,11. Se utilizó un análisis de regresión logística multivariable para calcular los valores de odds ratio (OR) junto con los intervalos de confianza del 95% (IC95%), para identificar predictores de OMV independientes. Se elaboró un modelo de regresión multivariable con todas las variables con un valor de p <0,1 en los análisis univariables. Se utilizaron curvas de características operativas del receptor y el área bajo la curva (AUC) para comparar la capacidad discriminatoria de los valores del angio-IRM en la predicción de una OMV de la RMC con la que tenían los parámetros angiográficos convencionales de la reperfusión del vaso culpable, incluidos el grado de flujo TIMI y el grado de opacificación (blush) del miocardio. Todos los valores de probabilidad fueron bilaterales y se consideraron estadísticamente significativos los valores de p <0,05.
RESULTADOSCaracterísticas basales de la población del estudioDe la población total, 154 pacientes (54,0%) tenían un angio-IRM> 40 U y 131 (46,0%), ≤ 40 U. No hubo diferencias significativas en los parámetros demográficos ni en los factores de riesgo cardiovascular entre los 2 grupos (tabla 1). Los pacientes con un angio-IRM> 40 U presentaron unos valores de creatincinasa-MB y troponina I máxima superiores y solían tener como vaso culpable del IAMCEST la arteria descendente anterior izquierda con más frecuencia que los pacientes con un angio-IRM ≤ 40 U. Aunque no hubo una diferencia significativa entre los 2 grupos respecto al tiempo puerta-balón ni en el grado de flujo TIMI antes de la ICP, un flujo TIMI ≤ 2 tras la ICPp fue más frecuente en los pacientes con angio-IRM> 40 U. En cambio, el grado de opacificación del miocardio tras la ICP y la incidencia de flujo no restablecido fueron similares en los 2 grupos. Los pacientes con un angio-IRM> 40 U mostraron un valor medio de angio-FFR tras la ICP superior al de los pacientes con angio-IRM ≤ 40 U (0,88±0,05 frente a 0,92±0,05; p <0,001) (tabla 1).
Características basales de la población del estudio
| Variables | Total(n=285) | Angio-IRM ≤ 40 U(n=131, 46,0%) | Angio-IRM> 40 U(n=154, 54,0%) | p |
|---|---|---|---|---|
| Características de los pacientes | ||||
| Parámetros demográficos | ||||
| Edad (años) | 59,5±12,1 | 60,4±11,7 | 58,7±12,5 | 0,236 |
| Varones | 232 (81,4) | 104 (79,4) | 128 (83,1) | 0,420 |
| Índice de masa corporal | 24,6±3,4 | 24,5±3,2 | 24,7±3,6 | 0,661 |
| Factores de riesgo cardiovascular | ||||
| Hipertensión | 122 (42,8) | 61 (46,6) | 61 (39,6) | 0,237 |
| Diabetes mellitus | 70 (24,6) | 31 (23,7) | 39 (25,3) | 0,746 |
| Hiperlipemia | 47 (16,5) | 20 (15,3) | 27 (17,5) | 0,608 |
| Fumador actual | 138 (48,4) | 62 (47,3) | 76 (49,4) | 0,733 |
| Intervención coronaria percutánea previa | 14 (4,9) | 7 (5,3) | 7 (4,6) | 0,789 |
| Infarto de miocardio previo | 10 (3,5) | 5 (3,8) | 5 (3,3) | 0,999 |
| Enfermedad multivaso | 123 (43,2) | 57 (43,5) | 66 (42,9) | 0,999 |
| Parámetros hemodinámicos | ||||
| Presión arterial sistólica (mmHg) | 115 [102-127] | 112 [99-124] | 115 [107-131] | 0,046 |
| Presión arterial diastólica (mmHg) | 71 [63-80] | 70 [60-78] | 73 [65-81] | 0,017 |
| Perfiles analíticos | ||||
| Troponina I máxima (ng/ml) | 61,2 [16,3-143,1] | 31,9 [7,6-83,8] | 86,9 [38,4-173,2] | <0,001 |
| CK-MB máxima (ng/ml) | 171,1 [60,8-276,4] | 101,5 [36,7-196,7] | 234,8 [133,6-319,7] | <0,001 |
| PCR ultrasensible (mg/dl) | 1,2 [0,3-7,6] | 1,3 [0,3-7,9] | 1,2 [0,3-7,5] | 0,964 |
| Lipoproteínas de baja densidad (mg/dl) | 127,0 [100,0-150,0] | 123,0 [99,0-142,0] | 131 [100,0-151,0] | 0,111 |
| Medicación al alta | ||||
| Ácido acetilsalicílico | 281 (98,6) | 130 (99,2) | 151 (98,1) | 0,397 |
| Inhibidores del P2Y12 | 279 (97,9) | 129 (98,5) | 150 (97,4) | 0,530 |
| Bloqueadores beta | 262 (91,9) | 120 (91,6) | 142 (92,2) | 0,852 |
| Inhibidores del SRAA | 233 (81,8) | 107 (81,7) | 126 (81,8) | 0,976 |
| Estatinas | 272 (95,4) | 128 (97,7) | 144 (93,5) | 0,152 |
| Características de la lesión | ||||
| Vaso culpable | 0,001 | |||
| Arteria descendente anterior izquierda | 155 (54,4) | 63 (48,1) | 92 (59,7) | |
| Arteria circunfleja izquierda | 29 (10,2) | 8 (6,1) | 21 (13,6) | |
| Arteria coronaria derecha | 101 (35,4) | 60 (45,8) | 41 (26,6) | |
| Características de la intervención | ||||
| Tiempo puerta-balón (min) | 68 [50-81] | 68 [48-82] | 67 [51-80] | 0,588 |
| Grado TIMI antes de la ICP | 0,440 | |||
| TIMI 0 | 215 (75,4) | 95 (72,5) | 120 (77,9) | |
| TIMI 1 | 17 (6,0) | 9 (6,9) | 8 (5,2) | |
| TIMI 2 | 28 (9,8) | 12 (9,2) | 16 (10,4) | |
| TIMI 3 | 25 (8,8) | 15 (11,5) | 10 (6,5) | |
| Grado TIMI después de la ICP | 0,014 | |||
| TIMI ≤ 2 | 17 (6,0) | 2 (1,5) | 15 (9,7) | |
| TIMI 3 | 268 (94,0) | 129 (98,5) | 139 (90,3) | |
| Grado de opacificación del miocardio después de la ICP | 0,243 | |||
| Grado 1 | 1 (0,4) | 1 (0,8) | 0 (0,0) | |
| Grado 2 | 19 (6,7) | 6 (4,6) | 13 (8,4) | |
| Grado 3 | 265 (93,0) | 124 (94,7) | 141 (91,6) | |
| Recuento de fotogramas de TIMI | 9 [7-12] | 9 [7-11] | 10 [7-13] | 0,103 |
| Ausencia de restablecimiento del flujo | 17 (6,0) | 5 (3,8) | 12 (7,8) | 0,158 |
| Tromboaspiración | 181 (63,5) | 75 (57,3) | 106 (68,8) | 0,043 |
| Oclusión de rama secundaria | 6 (2,1) | 2 (1,5) | 4 (2,6) | 0,690 |
| Con inhibidores de la glucoproteína IIb/IIIa | 50 (17,5) | 18 (13,7) | 32 (20,8) | 0,119 |
| Número total de stents | 1,2±0,6 | 1,2±0,7 | 1,2±0,6 | 0,954 |
| Diámetro medio del stent | 3,2±0,5 | 3,2±0,5 | 3,2±0,6 | 0,628 |
| Longitud total de stents | 31,0±17,2 | 30,9±17,2 | 31,1±17,2 | 0,952 |
| Índices fisiológicos basados en la angiografía | ||||
| FFR basada en la angiografía tras la ICP | 0,90±0,05 | 0,88±0,05 | 0,92±0,05 | <0,001 |
| IRM basado en la angiografía (U) | 40,6±13,8 | 29,5±6,4 | 50,2±10,9 | <0,001 |
CK-MB: creatincinasa MB; FFR: reserva fraccional de flujo; ICP: intervención coronaria percutánea; IRM: índice de resistencia microcirculatoria; PCR: proteína C reactiva; SRAA: sistema renina-angiotensina-aldosterona; TIMI: Thrombolysis in Myocardial Infarction.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
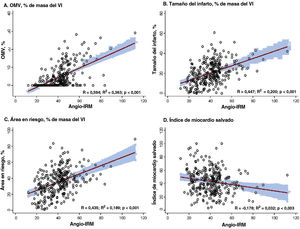
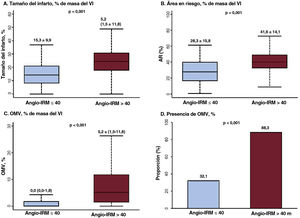
El angio-IRM mostró una correlación significativa con el tamaño del infarto, la extensión de la OMV y el AR determinados en la RMC (p <0,001 en todos ellos) (figura 2). En comparación con los pacientes con angio-IRM ≤ 40 U, los que lo tenían> 40 U presentaron significativamente mayores tamaño del infarto (el 15,3%±9,9% frente al 24,9%±10,4%; p <0,001), AR (el 28,3%±15,8% frente al 41,6%±14,1%; p <0,001) y extensión de la OMV (0,0% [0,0-1,8] frente a 5,2% [1,5-11,8]; p <0,001). En cambio, el grupo con un angio-IRM ≤ 40 U mostró un índice de miocardio salvado significativamente mayor que el observado en el grupo de angio-IRM> 40 U. En el presente estudio, el 62,5% (n=178) de los pacientes con IAMCEST tratados mediante ICPp y examinados por RMC presentaron una OMV (tabla 2). En la mayoría de los pacientes con angio-IRM> 40 U (88,3%) se observó una OMV en la RMC, frente a menos de 1 de cada 3 pacientes con angio-IRM ≤ 40 U (32,1%) (tabla 2 y figura 3). La extensión de la OMV en los pacientes con angio-IRM ≤ 40 U y OMV fue significativamente inferior a la de los pacientes con angio-IRM> 40 U y OMV (3,0% [2,1-5,1] frente a 6,0% [2,5-13,2]; p <0,001) (). En la figura 4 se muestran ejemplos representativos de pacientes con y sin OMV y sus valores de angio-IRM.
Correlación entre el angio-IRM y los parámetros de RMC. Se muestran las correlaciones entre el angio-IRM y varios parámetros obtenidos en la RMC después de una ICPp para un IAMCEST. A: OMV (% de masa del VI). B: tamaño del infarto (% de masa del VI). C: área en riesgo (% de masa del VI). D: índice de miocardio salvado. Angio-IRM: IRM funcional basado en angiografía; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
Parámetros de RMC según el IRM basado en la angiografía
| Parámetros de RMC | Total(n=285) | Angio-IRM ≤ 40 U(n=131, 46,0%) | Angio-IRM> 40 U(n=154, 54,0%) | p |
|---|---|---|---|---|
| Tiempo entre la ICP y la RMC (días) | 3,0 [3,0-5,0] | 4,0 [3,0-5,0] | 3,0 [3,0-4,0] | 0,516 |
| VTDVI (ml) | 146,6±34,5 | 143,3±38,0 | 149,4±31,1 | 0,135 |
| VTSVI (ml) | 72,2±31,4 | 66,8±35,9 | 76,8±26,3 | 0,008 |
| FEVI (%) | 52,1±10,6 | 55,1±11,2 | 49,5±9,3 | <0,001 |
| Tamaño del infarto (ml) | 21,5±12,8 | 15,1±9,7 | 27,0±12,6 | <0,001 |
| Tamaño del infarto (% de masa del VI) | 20,5±11,2 | 15,3±9,9 | 24,9±10,4 | <0,001 |
| Área en riesgo (% de masa del VI) | 35,5±16,3 | 28,3±15,8 | 41,6±14,1 | <0,001 |
| Índice de miocardio salvado | 43,2±18,3 | 46,4±19,4 | 40,5±16,8 | 0,006 |
| OMV | 178 (62,5) | 42 (32,1) | 136 (88,3) | <0,001 |
| OMV (% de masa del VI) | 2,0 [0,0-6,3] | 0,0 [0,0-1,8] | 5,2 [1,5-11,8] | <0,001 |
| Hemorragia intramiocárdica | 136 (48,1) | 39 (30,2) | 97 (63,0) | <0,001 |
FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; VTSVI: volumen telesistólico del ventrículo izquierdo.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Comparación de los parámetros de RMC según el angio-IRM. Se comparan los parámetros obtenidos en la RMC, incluidos los de (A) tamaño del infarto, (B) área en riesgo, (C) extensión de la OMV y (D) proporción de OMV, en función del angio-IRM después de una ICPp para el infarto agudo de miocardio con elevación del segmento ST. Los valores expresan media±desviación estándar o proporciones (%). En los gráficos de cajas y bigotes, la línea horizontal indica la mediana, la caja indica el intervalo intercuartílico y los bigotes, los valores mínimo y máximo, con la exclusión de los valores atípicos. angio-IRM: IRM funcional basado en angiografía; AR: área en riesgo; IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
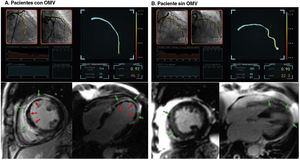
Se muestran 2 ejemplos de casos representativos de pacientes con infarto agudo de miocardio con elevación del segmento ST a los que se practicó con éxito la revascularización del vaso culpable epicárdico (DAI) durante la intervención coronaria percutánea primaria. A: el paciente presentó un valor de angio-IRM elevado de 46,2, que se calculó a partir de las imágenes angiográficas tras la intervención coronaria percutánea. La resonancia magnética cardiaca reveló un área de infarto (flechas verdes) y signos de OMV (flechas rojas). B: el paciente presentó un valor de angio-IRM de 22,3, que indicaba una función microvascular relativamente conservada después de un infarto agudo de miocardio con elevación del segmento ST. Las imágenes de resonancia magnética cardiaca mostraron un área de infarto (flechas verdes) pero sin signos de OMV. IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular.
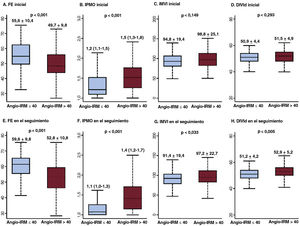
En la tabla 3 y la figura 5 se muestran los parámetros ecocardiográficos basales y de seguimiento según el valor del angio-IRM. En comparación con los pacientes con angio-IRM ≤ 40 U, los que tenían angio-IRM> 40 U tenían FEVI inferiores (55,6±10,4% frente a 49,7±9,8%; p <0,001) y un valor más alto del índice de puntuación del movimiento de la pared (1,2 [1,1-1,5] frente a 1,5 [1,3-1,8]; p <0,001) en la ecocardiografía inicial. Esta diferencia persistió en la ecocardiografía realizada a los 6 meses de seguimiento (FEVI, 59,6±9,8% frente a 52,8±10,8%; índice de puntuación del movimiento de la pared 1,1 [1,0-1,3] frente a 1,4 [1,2-1,7]; p <0,001 en todos los casos). En la situación basal, no hubo una diferencia estadísticamente significativa entre los 2 grupos respecto al índice de masa del VI o la dimensión interna del VI en telediástole. Sin embargo, en la ecocardiografía de seguimiento a los 6 meses, los pacientes con angio-IRM> 40 U presentaron una dimensión interna del VI en telediástole mayor y un índice de masa del VI superior que los pacientes con angio-IRM ≤ 40 U (tabla 3 y figura 5). En la se muestran los cambios observados en los valores de FEVI, E/e’ e índice de puntuación del movimiento de la pared durante el seguimiento según el angio-IRM.
Parámetros ecocardiográficos según el IRM basado en la angiografía
| Parámetros ecocardiográficos | Total(n=285) | Angio-IRM ≤ 40 U(n=131, 46,0%) | Angio-IRM> 40 U(n=154, 54,0%) | p |
|---|---|---|---|---|
| Ecocardiografía inicial | ||||
| Tiempo hasta la ecocardiografía (días) | 2,0 [1,0-3,0] | 3,0 [1,0-4,0] | 2,0 [1,0-3,0] | 0,342 |
| FEVI (%) | 52,4±10,5 | 55,6±10,4 | 49,7±9,8 | <0,001 |
| Índice de puntuación del movimiento de la pared | 1,4 [1,2-1,7] | 1,2 (1,1−1,5) | 1,5 (1,3-1,8) | <0,001 |
| DIVId (mm) | 51,2±4,7 | 50,9±4,4 | 51,5±4,9 | 0,293 |
| DIVIs (mm) | 33,8±6,2 | 32,5±6,0 | 34,8±6,1 | 0,002 |
| Índice de masa del VI | 96,9±22,7 | 94,8±19,4 | 98,8±25,1 | 0,149 |
| E/e’ mitral | 10,8±4,4 | 10,7±5,0 | 10,9±3,8 | 0,722 |
| Ecocardiografía de seguimiento | ||||
| Tiempo hasta la ecocardiografía (días) | 199,0 [179,0-259,0] | 199,0 [179,0-239,0] | 201,0 [178,0-282,0] | 0,470 |
| FEVI (%) | 55,9±10,9 | 59,6±9,8 | 52,8±10,8 | <0,001 |
| Índice de puntuación del movimiento de la pared | 1,2 (1,1−1,6) | 1,1 [1,0-1,3] | 1,4 [1,2-1,7] | <0,001 |
| DIVId (mm) | 52,1±4,8 | 51,2±4,2 | 52,9±5,2 | 0,005 |
| LVIDs (mm) | 33,6±6,2 | 32,0±5,5 | 34,8±6,4 | <0,001 |
| Índice de masa del VI | 94,6±21,4 | 91,4±19,4 | 97,2±22,7 | 0,033 |
| E/e’ mitral | 9,6±3,5 | 9,3±3,7 | 9,8±3,4 | 0,308 |
DIVId: dimensión interna del ventrículo izquierdo en diástole; DIVIs: dimensión interna del ventrículo izquierdo en telesístole; FEVI: fracción de eyección del ventrículo izquierdo; IRM: índice de resistencia microcirculatoria; VI: ventrículo izquierdo.
Los valores expresan mediana [intervalo intercuartílico] o media±desviación estándar.
Parámetros ecocardiográficos basales y del seguimiento, según el valor del angio-IRM. Se comparan los parámetros ecocardiográficos basales (A-D) y del seguimiento (E-H) según los valores del angio-IRM. Los valores expresan media±desviación estándar o proporciones (%). En los gráficos de cajas y bigotes, la línea horizontal indica la mediana, la caja indica el intervalo intercuartílico y los bigotes, los valores mínimo y máximo, con la exclusión de los valores atípicos. DIVId: dimensión interna del ventrículo izquierdo en diástole; FE: fracción de eyección; IMVI: índice de masa del ventrículo izquierdo; IPMO: índice de puntuación del movimiento de la pared; IRM: índice de resistencia microcirculatoria.
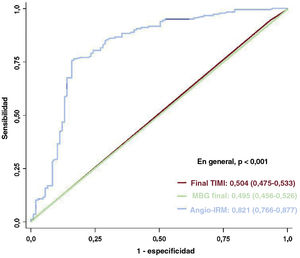
En el análisis de regresión lineal multivariable, un valor elevado de angio-IRM (> 40 U) fue un firme predictor independiente de una OMV en la RMC tras una ICPp para un IAMCEST (OR = 12,24; IC95%, 6,310-23,75; p <0,001) (tabla 4). Además, el angio-IRM como variable continua mostró una asociación independiente con la presencia de OMV (por cada 1 U de aumento del angio-IRM, OR = 1,102; IC95%, 1,068-1,137; p <0,001) (). Al comparar la capacidad discriminatoria del angio-IRM con la de los parámetros angiográficos convencionales de la reperfusión miocárdica, este mostró una capacidad para discriminar OMV significativamente mayor que el flujo TIMI o el grado de opacificación miocárdica tras una IPCp (AUC, 0,821, 0,504 y 0,496 respectivamente; p <0,001) (figura 6). Este resultado persistió con independencia de la localización del vaso culpable (). Además, el angio-IRM mostró también una capacidad para discriminar OMV significativamente superior a la del recuento de fotogramas del TIMI (AUC, 0,821 frente a 0,502; p <0,001) ().
Predictores de OMV independientes determinados mediante RMC
| Variable | Análisis univariable | Análisis multivariable* | ||
|---|---|---|---|---|
| OR (IC95%) | p | OR (IC95%) | p | |
| Angio-IRM> 40 U | 16,01 (8,670-29,57) | <0,001 | 12,24 (6,310-23,75) | <0,001 |
| Edad | 0,991 (0,971-1,011) | 0,362 | ||
| Sexo femenino | 1,795 (0,983-3,279) | 0,057 | 2,137 (0,958-4,765) | 0,064 |
| Diabetes mellitus | 1,556 (0,871-2,777) | 0,135 | ||
| Fumador actual | 1,419 (0,876-2,299) | 0,156 | ||
| Tiempo puerta-balón, cada 1 min de aumento | 0,998 (0,996-1,000) | 0,083 | 0,998 (0,995-1,001) | 0,236 |
| CK-MB máxima, cada 1 ng/ml de aumento | 1,008 (1,005-1,010) | <0,001 | 1,003 (1,000-1,006) | 0,030 |
| Troponina I máxima, cada 1 ng/ml de aumento | 1,011 (1,007-1,015) | <0,001 | 1,006 (1,001-1,010) | 0,011 |
| Flujo TIMI basal 0 | 1,837 (1,063-3,175) | 0,029 | 1,318 (0,622-2,792) | 0,471 |
| Flujo TIMI posterior ≤ 2 | 0,850 (0,314-2,305) | 0,750 | ||
| Blush posterior ≤ 2 | 1,126 (0,434-2,916) | 0,808 | ||
| Flujo no restablecido | 1,475 (0,505-4,308) | 0,478 | ||
| Recuento de fotogramas TIMI | 1,004 (0,951-1,059) | 0,896 | ||
| Con inhibidores de la glucoproteína IIb/IIIa | 0,882 (0,472-1,647) | 0,693 | ||
CK-MB: creatincinasa MB; IC95%: intervalo de confianza del 95%; IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular; OR: odds ratio; RMC: resonancia magnética cardiaca; TIMI: Thrombolysis in Myocardial Infarction.
Comparación de la capacidad discriminatoria para la predicción de la OMV definida en la RMC. Se comparan las curvas de características operativas del receptor del angio-IRM tras la ICP (en azul), el grado de flujo TIMI final (en rojo) y la MBG final (en verde) en la predicción de la OMV definida mediante la RMC. Los valores corresponden al área bajo la curva y el intervalo de confianza del 95%. IRM: índice de resistencia microcirculatoria; MBG: grado de opacificación del miocardio; OMV: obstrucción microvascular; TIMI: Thrombolysis in Myocardial Infarction.
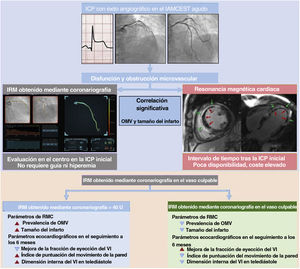
En este estudio se evaluó la viabilidad del uso del IRM funcional obtenido a partir de la angiografía, sin uso de guía (angio-IRM) en la evaluación de la OMV tras una ICPp en pacientes con IAMCEST. El estudio puso de manifiesto que el angio-IRM muestra una asociación significativa con la extensión de la OMV en la RMC y que un valor elevado del angio-IRM> 40 U es un predictor independiente de OMV, con una capacidad discriminatoria significativamente superior a la de los parámetros angiográficos convencionales de la reperfusión miocárdica (figura 7).
Figura central IRM funcional obtenido mediante coronariografía y RMC para determinar la disfunción microvascular después de una ICP realizada con éxito para un IAMCEST. IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IRM: índice de resistencia microcirculatoria; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
A pesar del restablecimiento satisfactorio del flujo sanguíneo coronario epicárdico, se ha descrito falta de reperfusión miocárdica en hasta 2/3 pacientes con IAMCEST cuando aparece una OMV1–3. En coherencia con lo indicado por estudios anteriores, el presente estudio mostró también que en el 62,5% de los pacientes con IAMCEST había signos de OMV en la RMC. La RMC es la técnica más sensible y específica que permite una visualización directa y la cuantificación de la OMV15. Sin embargo, la obtención de una RMC en los pacientes con IAMCEST se ve limitada en la práctica clínica diaria, y el tiempo que transcurre entre la ICPp y la RMC puede mermarle utilidad para la detección de la OMV y orientar los tratamientos adyuvantes que aplicar en la fase inmediatamente posterior a la revascularización. En cambio, las observaciones en la coronariografía, como el flujo sanguíneo anterógrado reducido (flujo TIMI ≤ 2) o el deterioro de la penetración del contraste en el miocardio (opacificación miocárdica <2), permiten la evaluación de la OMV en el momento de la ICPp. Sin embargo, estas mediciones tienen escasas reproducibilidad y exactitud1,2. De hecho, se observaron OMV en más de la mitad de los pacientes con IAMCEST que alcanzaron un flujo TIMI 3 tras la ICPp1,2, y la incidencia de la OMV evaluada mediante la RMC fue significativamente superior a la evaluada con los parámetros angiográficos convencionales3. El estudio evidenció también que la presencia de una OMV no se asoció con flujo no restablecido, flujo TIMI ≤ 2 u opacificación miocárdica < 2 tras la ICPp. Además, el grado final del flujo TIMI y el grado de opacificación del miocardio no mostraron una capacidad discriminatoria que permitiera predecir una OMV, con valores de AUC de 0,504 (IC95%, 0,475-0,533) y 0,496 (IC95%, 0,466-0,526) respectivamente. Estos resultados indican un papel clínico limitado de un indicador angiográfico indirecto de la OMV o la reperfusión miocárdica.
Índice microcirculatorio y evaluación de la obstrucción microvascular en el infarto de miocardio con elevación del segmento STEn este contexto, la evaluación fisiológica con el IRM aportaría un beneficio al permitir una determinación objetiva y más exacta de la función microcirculatoria coronaria en el momento de la ICPp. Los estudios realizados han demostrado que un IRM elevado> 40 U tras la ICPp se asocia significativamente con OMV en la RMC y la posterior aparición de eventos adversos clínicos en los pacientes con IAMCEST1,5–7. Sin embargo, la medición del IRM requiere una guía adicional con sensor de presión-temperatura, lo cual prolonga la intervención, y también la inducción de hiperemia, que generalmente origina una respuesta de hipotensión. Estos requisitos limitan la adopción del IRM en la práctica clínica diaria, en especial por lo que respecta a los pacientes con IAMCEST en situación aguda. Sin embargo, los avances recientes han permitido obtener el IRM a partir de imágenes angiográficas (angio-IRM) sin necesidad de guía para determinar la presión ni agente hiperémico8–10. En consecuencia, la introducción del angio-IRM podría ampliar de manera significativa el uso del IRM en la práctica clínica diaria.
Recientemente hemos publicado un estudio de validación con el mismo programa informático y la misma metodología del presente estudio para calcular el angio-IRM; en ese estudio se evidenció una correlación significativa entre el IRM convencional y el angio-IRM en los pacientes con IAMCEST (R=0,782; p <0,001)11. También se observó una exactitud diagnóstica excelente del angio-IRM para predecir un IRM convencional> 40 U (sensibilidad, 75,0%; especificidad, 84,2%; exactitud, 80,6%; AUC, 0,899; IC95%, 0,786-0,949); en los pacientes con angio-IRM elevado> 40 U tras una ICPp, se observó un riesgo significativamente superior de eventos cardiovasculares adversos11. El presente estudio muestra por primera vez el empleo del angio-IRM en la evaluación de la OMV tras una ICPp para el IAMCEST. Es importante señalar que el angio-IRM elevado> 40 U tras una ICPp para un IAMCEST tuvo un alto valor predictivo de OMV, con una capacidad de discriminación significativamente superior a la de los parámetros angiográficos convencionales de la reperfusión miocárdica.
Consecuencias clínicas y perspectivas futurasDado que la OMV podría ser un posible objetivo terapéutico en los pacientes con IAMCEST, resultaría beneficiosa una oportuna evaluación de la OMV en el centro. Aunque en el presente estudio no se determinó el tiempo exacto necesario para obtener el angio-IRM, el se puede calcular inmediatamente tras la obtención de la angio-FFR, que solo requirió una mediana de 5 [3,5-6,1] min en un estudio reciente16. Esto respalda nuevamente la aplicabilidad del angio-IRM en la práctica clínica diaria. En el presente estudio, el 88,3% de los pacientes con un angio-IRM elevado> 40 U tras una ICPp presentaron signos de OMV en la RMC, con valores de OMV, tamaño del infarto y AR significativamente mayores que lo observado en los pacientes con angio-IRM ≤ 40 U. No obstante, debe señalarse que el 32,1% de los pacientes con angio-IRM ≤ 40 U mostraron también una OMV en la RMC. Sin embargo, la extensión de la OMV de los pacientes con angio-IRM ≤ 40 U y OMV fue significativamente menor que la de los pacientes con angio-IRM> 40 U y OMV (el 3,0% [2,1-5,1] frente al 6,0% [2,5-13,2]; p <0,001). Además, un estudio previo reveló que los pacientes con OMV pero con función microvascular relativamente conservada según el IRM ≤ 40 U presentaron una regresión significativa del tamaño del infarto a lo largo del tiempo sin tratamientos adyuvantes preespecificados tras una ICPp7. Además, el angio-IRM mostró un valor pronóstico significativo tras la ICPp en los pacientes con IAMCEST, pues aumenta 3 veces el riesgo de muerte y reingreso por insuficiencia cardiaca de los pacientes con un angio-IRM elevado> 40 U11. El angio-IRM podría desempeñar un papel en la identificación de los pacientes que puedan obtener mayor beneficio de posibles tratamientos adyuvantes para reducir la OMV tras una ICPp. No obstante, los resultados del presente estudio respaldan que hay relación entre el angio-IRM y la OMV en la RMC, pero no equivalencia entre ambos.
Se han hecho esfuerzos por encontrar tratamientos adyuvantes eficaces, como la administración intracoronaria de fármacos trombolíticos o vasodilatadores, para reducir la disfunción microcirculatoria o la OMV y mejorar los resultados después de una ICPp17–19. Sin embargo, los inhibidores de la glucoproteína IIb/IIIa solo se proponen en la guía vigente si hay signos de flujo no restablecido o complicación trombótica. Un factor importante que falta por determinar es la identificación de los pacientes con mayor riesgo de OMV a los que podrían beneficiar los tratamientos adyuvantes. Dadas la importancia de la función microvascular coronaria y la discrepancia frecuente entre los parámetros angiográficos y los fisiológicos en la evaluación de la OMV, es posible que el angio-IRM permita una mejor selección de los pacientes que podrían beneficiarse de posibles tratamientos adyuvantes después de una ICPp. Un reciente estudio observacional ha puesto de manifiesto los posibles efectos beneficiosos de una oclusión intermitente del seno coronario controlada por presión guiada con el IRM durante la ICPp en los pacientes con IAMCEST20. Se necesitan nuevos estudios para evaluar la viabilidad y la eficacia de las estrategias de tratamiento personalizadas guiadas por el angio-IRM tras una IPCp con objeto de reducir la OMV en los pacientes con IAMCEST.
LimitacionesHay varias limitaciones que es preciso señalar. En primer lugar, dado que en el presente estudio no se obtuvieron datos relativos a los resultados clínicos, no fue posible evaluar las consecuencias pronósticas del angio-IRM y los parámetros de la RMC. En segundo lugar, no se hizo una RMC de seguimiento, lo cual limita la investigación detallada de los cambios dinámicos de la disfunción microvascular después de un IAMCEST. En tercer lugar, dado que el angio-IRM se basa en la angiografía, su exactitud depende de la calidad de las imágenes y de la obtención de proyecciones óptimas. En cuarto lugar, el estudio se centró en la disfunción microcirculatoria limitada al territorio irrigado por el vaso culpable. Por consiguiente, no se evaluó el pronóstico comparativo según la presencia de una disfunción microcirculatoria subyacente en el territorio irrigado por otros vasos. En quinto lugar, el momento de obtención de la RMC fue diferente en cada paciente, y ello podría haber influido en los resultados de la RMC. Sin embargo, la mayoría de las RMC se realizaron en un plazo de 3-5 días tras la ICPp. En sexto lugar, en este estudio no fue posible examinar la exactitud del angio-IRM, dado que no se dispuso del IRM convencional determinado con una guía de presión. No obstante, el angio-IRM tras una ICPp se ha validado en estudios recientes por los autores del presente estudio11 y otros9.
CONCLUSIONESEl angio-IRM mostró una asociación significativa con los valores del tamaño del infarto, la extensión de la OMV y el AR obtenidos en la RMC. Un angio-IRM elevado> 40 U tras una ICPp para un IAMCEST tuvo un alto valor predictivo de OMV en la RMC. Así pues, el angio-IRM, que no requiere una guía con sensor de presión-temperatura ni la inducción de hiperemia, puede ser una alternativa práctica al índice fisiológico convencional determinado mediante guía de presión y permite evaluar la disfunción microvascular y la falta de reperfusión del miocardio tras una ICPp para un IAMCEST.
FINANCIACIÓNEste trabajo contó con el apoyo de Rainmed Ltd (Suzhou, China), que proporcionó el programa informático y la consola para el IRM y la FFR basados en la angiografía. Esta empresa no intervino en modo alguno en el diseño y la realización del estudio, el análisis de los datos o la elaboración del manuscrito.
CONTRIBUCIÓN DE LOS AUTORESD. Shin y J. Kim contribuyeron por igual en este trabajo. Los autores confirman sus contribuciones al artículo: concepción y diseño del estudio: D. Shin, J. Kim, J.M. Lee; obtención de los datos: J. Kim, K.H. Choi, N. Dai, Y. Li, S.H. Lee, H.S. Joh, H.K. Kim, S-M. Kim, S.J. Ha, M.J. Jang, T.K. Park, J.H. Yang, Y.B. Song, J-Y. Hahn, S-H. Choi, Y.H. Choe, H-C. Gwon, J.M. Lee; análisis e interpretación de los resultados: D. Shin, J. Kim, J.M. Lee; preparación de la propuesta inicial del manuscrito: D. Shin, J. Kim, J.M. Lee; revisión critica del manuscrito respecto a contenido intelectual importante: D. Shin, J. Kim, K.H. Choi, N. Dai, Y. Li, S.H. Lee, S.J. Ha, H.K. Kim, S-M. Kim, S.J. Ha, M.J. Jang, T.K. Park, J.H. Yang, Y.B. Song, J-Y. Hahn, S-H. Choi, Y.H. Choe, H-C. Gwon, J.M. Lee. Todos los autores revisaron los resultados y aprobaron la versión final del manuscrito.
CONFLICTOS DE INTERESESJ.M. Lee recibió una subvención de investigación institucional de St. Jude Medical (Abbott Vascular) y Philips Volcano. J.-Y. Hahn recibió una subvención de investigación institucional de St. Jude Medical (Abbott Vascular) y Medtronic Inc. Todos los demás autores declaran no tener ningún conflicto de intereses relacionado con el trabajo presentado.
- –
La OMV identificada en la RMC es un indicador de mal pronóstico en los pacientes con IAMCEST después de una ICPp realizada con éxito.
- –
El IRM es un índice fisiológico determinado mediante una guía con sensor de presión que permite una evaluación cuantitativa de la función microvascular en un territorio vascular determinado.
- –
El IRM medido después de una ICPp para un IAMCEST se asocia con la aparición de OMV y eventos clínicos adversos.
- –
Este estudio evalúa la viabilidad del angio-IRM funcional obtenido sin guía con sensor de presión para la evaluación de la OMV después de una ICPp en pacientes con IAMCEST.
- –
Los pacientes con un angio-IRM> 40 U presentaron un tamaño del infarto y un extensión de la OMV determinados a partir de la RMC significativamente mayores (p <0,001 en ambos casos) que los pacientes con angio-IRM ≤ 40 U.
- –
Un angio-IRM elevado> 40 U fue un firme predictor independiente de OMV en la RMC tras una ICPp para un IAMCEST (OR = 12,24; p <0,001).
- –
El angio-IRM es una alternativa práctica al índice fisiológico convencional determinado mediante guía de presión y permite evaluar la disfunción microvascular y la falta de reperfusión del miocardio después de una ICPp para un IAMCEST.