La neoateroesclerosis es una de las causas de la reestenosis en el stent (RS). Nuestro objetivo es evaluar la influencia de la neoateroesclerosis en el pronóstico y la respuesta al tratamiento de los pacientes con RS.
MétodosSe trata de un análisis conjunto de los subestudios de tomografía de coherencia óptica (OCT) de los RIBS IV y V, 2 ensayos clínicos aleatorizados y multicéntricos que comparan el tratamiento con un balón recubierto con paclitaxel frente al stent liberador de everolimus en pacientes con RS. La evaluación con OCT se realizó basalmente y a los 6-9 meses. La neoateroesclerosis se definió en la OCT basal como una neoíntima con contenido calcificado o lipídico. Se evaluaron los resultados angiográficos y por OCT a los 6-9 meses y la aparición de eventos adversos cardiovasculares mayores a los 3 años de seguimiento en pacientes con y sin neoateroesclerosis tratados con balón recubierto con paclitaxel o stent liberador de everolimus.
ResultadosSe estudió mediante OCT a 64 pacientes en el momento del procedimiento. Se documentó neoateroesclerosis en 23 lesiones (36%). El seguimiento angiográfico a los 6-9 meses no mostró diferencias entre los pacientes con y sin neoateroesclerosis en reestenosis (5 [24%] frente a 6 [15%]; p=0,49), diámetro luminal mínimo (1,79±0,7 frente a 1,94±0,6 mm; p=0,41) o pérdida tardía (0,33±0,7 frente a 0,15±0,5; p=0,34). El seguimiento con OCT confirmó la ausencia de diferencias en los parámetros cuantitativos y las características del tejido de recubrimiento entre los 2 grupos. A los 3 años de seguimiento, la incidencia de eventos fue de 3 (13%) frente a 5 (12%) en los grupos con y sin neoateroesclerosis respectivamente (HR=0,94; IC95%, 0,22-3,93; p=0,93).
ConclusionesEn este estudio con una pequeña muestra de pacientes aleatorizados a tratamiento con balón recubierto con paclitaxel o stent liberador de everolimus por RS, no parece que la presencia de neoateroesclerosis influya en los resultados agudo y a largo plazo.
Palabras clave
Los avances en la tecnología de los stents coronarios han reducido drásticamente las tasas de reestenosis. Sin embargo, este tipo de fallo del stent continúa siendo un problema clínico, incluso con la nueva generación de stents farmacoactivos (SFA). El progreso futuro en su prevención puede requerir un conocimiento más profundo de la enfermedad subyacente.
La evaluación in vivo de la reestenosis en el stent (RS) mediante tomografía de coherencia óptica (OCT), una técnica de exploración por imagen intracoronaria de alta resolución, ha revelado que la estructura de la RS es con frecuencia heterogénea1. Además de mostrar diferentes patrones de RS1, la OCT ha puesto de manifiesto que no es infrecuente que la obstrucción luminal de la RS sea causada por la neoateroesclerosis2,3 y no, como se había pensado anteriormente, por una hiperplasia fibrosa homogénea. Sin embargo, es poco lo que se sabe acerca de si la neoateroesclerosis influye o no en los resultados a largo plazo en los pacientes con RS tratados con una intervención coronaria percutánea (ICP) o si el balón recubierto con paclitaxel (BRP) o los stents liberadores de everolimus (SLE) son igual de eficaces para tratar la RS con neoateroesclerosis. Así pues, los objetivos de este estudio son: a) evaluar la influencia de la neoateroesclerosis definida mediante OCT en los resultados agudos y a largo plazo en pacientes con RS tratados con un BRP o con un SLE, y b) evaluar la respuesta de la neoateroesclerosis al tratamiento con un BRP o un SLE.
MÉTODOSPoblación del estudioSe llevó a cabo un análisis agrupado de los pacientes incluidos en los subestudios de OCT predefinidos de los ensayos clínicos multicéntricos, prospectivos, controlados y aleatorizados RIBS IV y V, en los que se comparó el tratamiento con un BRP frente a un SLE en pacientes con una RS en un SFA (RIBS IV) o en un stent metálico (RIBS V)4,5. La RS se definió como una estenosis > 50% del diámetro de la luz en la evaluación visual en el lugar de implante previo de un stent o que afectara a un margen de 5 mm de sus bordes. La angina o los signos de isquemia fueron un requisito para la inclusión en los estudios. Se excluyó la RS en vasos pequeños (diámetro del vaso de referencia < 2,0 mm), los patrones de RS difusa (> 30 mm de longitud) y la RS que se manifestara por una oclusión total crónica. Otros criterios de exclusión fueron la esperanza de vida <1 año, la incapacidad de realizar un seguimiento angiográfico, las situaciones que impedían el uso de la OCT (tortuosidad angiográfica grave o insuficiencia renal), la incapacidad de mantener un tratamiento antiagregante plaquetario combinado doble durante 1 año y los signos de trombosis en el stent.
Se aleatorizó a los pacientes en una relación 1:1 al tratamiento con un SLE o un BRP mediante un código de aleatorización generado por ordenador. La aleatorización se estratificó según la longitud de la RS (< 10 o > 10 mm) y la ubicación de la lesión (dentro del stent frente a en el borde de la RS). La asignación aleatoria y la supervisión, la gestión y el análisis de los datos corrieron a cargo del centro de coordinación.
El estudio fue aprobado por los Comités de Ética de Investigación de los centros y se atuvo a los principios de la Declaración de Helsinki. Se obtuvo el consentimiento informado por escrito de todos los pacientes.
Protocolo de tratamientoAntes de la intervención, los pacientes recibieron un tratamiento antiagregante plaquetario combinado doble y se utilizó heparina no fraccionada durante la intervención. El protocolo exigía una preparación óptima de la lesión antes del uso del SLE o el BRP. Debía realizarse una predilatación, evitando dañar los segmentos adyacentes y asegurando una expansión suficiente del stent con reestenosis. Después de la preparación de la lesión, los pacientes fueron tratados con un BRP o un SLE según lo establecido en la asignación aleatoria. El tratamiento con un BRP se realizó con un SeQuent Please (B. Braun Surgical, Alemania) utilizando una relación balón/arteria de 1,1/1 y un hinchado del balón durante 60 s a la presión nominal. El SLE (Xience Prime, Abbott Vascular, Estados Unidos) se implantó a una presión alta, con una relación balón/arteria final de 1,1/1. Se recomendó usar una posdilatación después del implante del SLE, pero esta decisión se dejó al criterio del operador.
SeguimientoSe programó un seguimiento angiográfico a los 6-9 meses. Se llevó a cabo un seguimiento clínico a los 6-9 meses, a los 12 meses y luego una vez al año4,5. La obtención de los datos fue supervisada por el centro de coordinación. La validación (adjudicación) de los eventos clínicos (muerte, infarto de miocardio, revascularización de vaso/lesión diana) corrió a cargo de un Comité de Eventos Clínicos independiente que no conocía el grupo de tratamiento en el que se encontraba cada paciente. Los eventos clínicos se definieron de la siguiente forma: a) muerte cardiaca: todas las muertes se consideraron de causa cardiaca, a menos que pudiera documentarse una causa no cardiaca; b) infarto de miocardio: presencia de 2 de las siguientes características: dolor torácico prolongado (> 30 min), aumento de la creatinacinasa > 2 veces el valor local del límite superior de la normalidad (con una fracción de banda miocárdica anormal) o aparición de alteraciones isquémicas persistentes en el electrocardiograma (con o sin aparición de ondas Q patológicas); c) revascularización del vaso diana: nueva revascularización en el vaso diana, y d) revascularización de la lesión diana: nueva revascularización en la lesión diana. Todas las intervenciones llevadas a cabo en el seguimiento debían tener una indicación clínica (síntomas o isquemia demostrada mediante exploraciones invasivas o no invasivas). Se utilizaron los criterios del Academic Research Consortium para definir la trombosis en el stent.
Obtención y análisis de la OCTEl subestudio de OCT se llevó a cabo en un grupo de centros participantes en los ensayos RIBS IV y V e incluyó evaluaciones por OCT basal y a los 6-9 meses durante el seguimiento angiográfico. La obtención de la OCT se realizó con el sistema C7XR y el catéter Dragonfly (Light Lab, St. Jude Medical, Estados Unidos) aplicando una técnica no oclusiva. Se llevó a cabo un análisis offline con QIVUS (Medis, Países Bajos). El segmento analizado incluía la región del stent y los márgenes del stent definidos como el segmento de 5 mm del vaso proximal y distal al stent. Las mediciones se hicieron en pasos longitudinales de 1mm durante todo el proceso de retirada (pullback). Los parámetros cualitativos se analizaron basándose en el acuerdo entre 2 observadores que no conocían las características clínicas ni las características de la intervención.
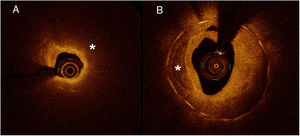
La neoateroesclerosis se definió en la OCT basal como la presencia de tejido reestenótico con calcificación (región de baja señal, bien delimitada, con bordes definidos) o un contenido lipídico (región de baja señal con bordes difusos)6 (figura 1). Se evaluaron también otros parámetros, como la estructura del tejido reestenótico (homogéneo, heterogéneo, en capas), la retrodispersión (backscattering) del tejido reestenótico, el área de baja intensidad peripivotal (ABIPP), la presencia de microvasos (estructuras de baja retrodispersión, bien delimitadas, de un diámetro < 200 μm, que mostraban una trayectoria dentro del vaso), la presencia de macrófagos (identificados como regiones bien delimitadas o confluentes, de señales abundantes, con un sombreado dorsal lineal), la forma de la luz y la presencia intraluminal de material. El análisis de la OCT basal incluyó un análisis cuantitativo del área luminal, el área del stent, la expansión del stent (área mínima del stent/área de referencia del stent) y la simetría del stent (área mínima/máxima del stent). El área de tejido reestenótico se definió como el área del stent menos el área de la luz, y la carga de tejido reestenótico se calculó mediante el área media de tejido reestenótico/área media del stent × 100. Se utilizó la sección transversal que tenía el área luminal mínima para determinar los grosores máximo y mínimo del tejido reestenótico y el cociente de simetría del tejido reestenótico (grosor máximo del tejido reestenótico - grosor mínimo del tejido reestenótico / grosor máximo del tejido reestenótico).
Neoateroesclerosis. A: tejido reestenótico con contenido lipídico (la región de baja señal con bordes difusos indicada mediante *). El ejemplo muestra un caso de atenuación intensa de la luz que impide la visualización de los pivotes (tan solo son visibles de 6 a 11). B: tejido reestenótico con calcificación (la región de baja señal bien delimitada, con bordes definidos e indicados mediante *).
En el seguimiento, se realizaron mediciones de OCT del área de la luz, el área del stent y la expansión del stent, el área de cobertura tisular y la carga de cobertura tisular. En la sección transversal con la carga máxima de cobertura tisular, se evaluaron la estructura y la retrodispersión de la cobertura tisular, la presencia de microvasos, la forma de la luz y la presencia intraluminal de material utilizando las mismas definiciones que se emplearon para la evaluación basal del tejido reestenótico. En los pacientes tratados con un BRP, se evaluó la cobertura tisular por encima de los pivotes del stent implantado anteriormente. Por último, se evaluó también la presencia de pivotes no cubiertos (sin una capa de tejido visible que recubriera su estructura de señal intensa brillante), evaginaciones (abombamiento hacia fuera en el contorno de la luz entre los pivotes que se extendían 3 mm o más a lo largo del vaso, con una profundidad ≥ 10% del diámetro del stent) y ABIPP (área de baja intensidad homogénea alrededor de un pivote del stent sin una atenuación significativa de la señal detrás del área)7,8.
Análisis estadísticoLas variables cualitativas se compararon con la prueba de la χ2 o con la prueba exacta de Fisher, según fuera necesario. Se evaluó la normalidad de la distribución de los datos con la prueba de Kolmogorov-Smirnov. Las variables continuas se expresaron como media ± desviación estándar o mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student o la prueba de Mann-Whitney. Se presentan las estimaciones del efecto principal con sus intervalos de confianza del 95% (IC95%). Las estimaciones de los eventos se expresan mediante estimaciones de Kaplan-Meier de la incidencia acumulada a 1 año y se compararon con la prueba de orden logarítmico o la prueba exacta de Breslow. Se generaron los valores de hazard ratio (IC95%) mediante modelos de riesgos proporcionales de Cox y se compararon con la prueba de Wald. Se utilizó el programa informático de estadística SPSS (versión 15.00). Todos los valores de p presentados fueron bilaterales y se consideró estadísticamente significativo un valor de p < 0,05.
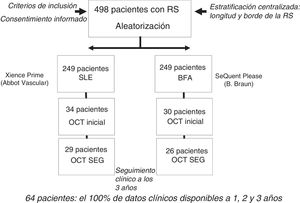
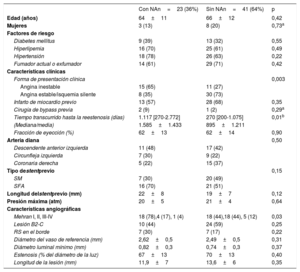
RESULTADOSCaracterísticas clínicas, angiográficas y de OCT basales de las RS con neoateroesclerosisEn la figura 2 se muestra cómo se seleccionó a la población del subestudio de OCT en esta investigación (n=64) de los ensayos RIBS IV y V agrupados (n=498). No se observaron diferencias en las características angiográficas o las características basales de los pacientes con o sin evaluación de OCT (). Se identificó la presencia de neoateroesclerosis en 23 lesiones (36%), y su frecuencia fue superior en los SFA (16 [70%]) en comparación con los stents metálicos (7 [30%]; p = 0,15). La presencia de neoateroesclerosis no estaba relacionada con características basales como la edad, el sexo o los factores de riesgo. Los pacientes con neoateroesclerosis habían presentado con más frecuencia una angina inestable (15 [65%] frente a 11 [27%] de los pacientes con y sin neoateroesclerosis respectivamente; p = 0,003) y en ellos había transcurrido más tiempo tras el implante del stent: 1.117 (270-2.772) frente a 270 (200-1.075) días en los pacientes con y sin neoateroesclerosis respectivamente (p = 0,01) (tabla 1).
Características clínicas y angiográficas basales
| Con NAn=23 (36%) | Sin NAn=41 (64%) | p | |
|---|---|---|---|
| Edad (años) | 64±11 | 66±12 | 0,42 |
| Mujeres | 3 (13) | 8 (20) | 0,73a |
| Factores de riesgo | |||
| Diabetes mellitus | 9 (39) | 13 (32) | 0,55 |
| Hiperlipemia | 16 (70) | 25 (61) | 0,49 |
| Hipertensión | 18 (78) | 26 (63) | 0,22 |
| Fumador actual o exfumador | 14 (61) | 29 (71) | 0,42 |
| Características clínicas | |||
| Forma de presentación clínica | 0,003 | ||
| Angina inestable | 15 (65) | 11 (27) | |
| Angina estable/isquemia silente | 8 (35) | 30 (73) | |
| Infarto de miocardio previo | 13 (57) | 28 (68) | 0,35 |
| Cirugía de bypass previa | 2 (9) | 1 (2) | 0,29a |
| Tiempo transcurrido hasta la reestenosis (días) | 1.117 [270-2.772] | 270 [200-1.075] | 0,01b |
| (Mediana/media) | 1.585±1.433 | 895±1.211 | |
| Fracción de eyección (%) | 62±13 | 62±14 | 0,90 |
| Arteria diana | 0,50 | ||
| Descendente anterior izquierda | 11 (48) | 17 (42) | |
| Circunfleja izquierda | 7 (30) | 9 (22) | |
| Coronaria derecha | 5 (22) | 15 (37) | |
| Tipo destentprevio | 0,15 | ||
| SM | 7 (30) | 20 (49) | |
| SFA | 16 (70) | 21 (51) | |
| Longitud delstentprevio (mm) | 22±8 | 19±7 | 0,12 |
| Presión máxima (atm) | 20±5 | 21±4 | 0,64 |
| Características angiográficas | |||
| Mehran I, II, III-IV | 18 (78),4 (17), 1 (4) | 18 (44),18 (44), 5 (12) | 0,03 |
| Lesión B2-C | 10 (44) | 24 (59) | 0,25 |
| RS en el borde | 7 (30) | 7 (17) | 0,22 |
| Diámetro del vaso de referencia (mm) | 2,62±0,5 | 2,49±0,5 | 0,31 |
| Diámetro luminal mínimo (mm) | 0,82±0,3 | 0,74±0,3 | 0,37 |
| Estenosis (% del diámetro de la luz) | 67±13 | 70±13 | 0,40 |
| Longitud de la lesión (mm) | 11,9±7 | 13,6±6 | 0,35 |
NA: neoateroesclerosis; RS: reestenosis en el stent; SFA: stent farmacoactivo; SM: stent metálico.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
La RS con neoateroesclerosis se manifestó con más frecuencia con un patrón angiográfico Mehran I (18 [78%] frente a 18 [44%]; p = 0,03). Hubo una tendencia no significativa a una mayor reestenosis en los bordes en el grupo de neoateroesclerosis (7 [30%] frente a 7 [17%]; p = 0,22). No hubo diferencias en otros parámetros angiográficos basales (diámetro mínimo de la luz, porcentaje de estenosis del diámetro, longitud de la lesión o diámetro del vaso de referencia) (tabla 1).
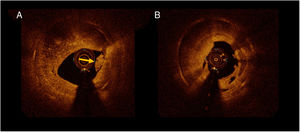
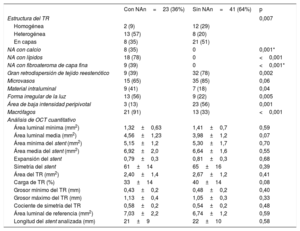
Se observaron diferencias significativas en la estructura de la RS, según lo indicado por las imágenes de OCT, entre las lesiones de RS con y sin neoateroesclerosis. Se identificó con más frecuencia un patrón heterogéneo en las lesiones con neoateroesclerosis (13 [57%] frente a 8 [20%] en las RS sin neoateroesclerosis; p = 0,007], así como una baja retrodispersión (14 [61%] frente a 9 [22%]; p = 0,002). En los casos de neoateroesclerosis fueron más frecuentes una luz irregular (13 [56%] frente a 9 [22%]; p = 0,005], material intraluminal visible (9 [41%] frente a 7 [18%]; p = 0,04) y macrófagos (21 [91%] frente a 13 [33%]; p < 0,001) (figura 3). No hubo diferencias significativas en la prevalencia de microvasos con neoíntima entre las lesiones con y sin neoateroesclerosis. El ABIPP se observó con menos frecuencia en la neoateroesclerosis (3 [13%] frente a 23 [56%]; p = 0,001]. No se apreciaron diferencias en las mediciones de OCT del área de la luz y el área del stent, la expansión del stent y la simetría. Hubo una tendencia a una menor carga de tejido reestenótico en el grupo de neoateroesclerosis (el 33 ± 14% frente al 40 ± 14%; p = 0,08) (tabla 2).
Tomografía de coherencia óptica basal
| Con NAn=23 (36%) | Sin NAn=41 (64%) | p | |
|---|---|---|---|
| Estructura del TR | 0,007 | ||
| Homogénea | 2 (9) | 12 (29) | |
| Heterogénea | 13 (57) | 8 (20) | |
| En capas | 8 (35) | 21 (51) | |
| NA con calcio | 8 (35) | 0 | 0,001* |
| NA con lípidos | 18 (78) | 0 | <0,001 |
| NA con fibroateroma de capa fina | 9 (39) | 0 | <0,001* |
| Gran retrodispersión de tejido reestenótico | 9 (39) | 32 (78) | 0,002 |
| Microvasos | 15 (65) | 35 (85) | 0,06 |
| Material intraluminal | 9 (41) | 7 (18) | 0,04 |
| Forma irregular de la luz | 13 (56) | 9 (22) | 0,005 |
| Área de baja intensidad peripivotal | 3 (13) | 23 (56) | 0,001 |
| Macrófagos | 21 (91) | 13 (33) | <0,001 |
| Análisis de OCT cuantitativo | |||
| Área luminal mínima (mm2) | 1,32±0,63 | 1,41±0,7 | 0,59 |
| Área luminal media (mm2) | 4,56±1,23 | 3,98±1,2 | 0,07 |
| Área mínima del stent (mm2) | 5,15±1,2 | 5,30±1,7 | 0,70 |
| Área media del stent (mm2) | 6,92±2,0 | 6,64±1,6 | 0,55 |
| Expansión del stent | 0,79±0,3 | 0,81±0,3 | 0,68 |
| Simetría del stent | 61±14 | 65±16 | 0,39 |
| Área del TR (mm2) | 2,40±1,4 | 2,67±1,2 | 0,41 |
| Carga de TR (%) | 33±14 | 40±14 | 0,08 |
| Grosor mínimo del TR (mm) | 0,43±0,2 | 0,48±0,2 | 0,40 |
| Grosor máximo del TR (mm) | 1,13±0,4 | 1,05±0,3 | 0,33 |
| Cociente de simetría del TR | 0,58±0,2 | 0,54±0,2 | 0,48 |
| Área luminal de referencia (mm2) | 7,03±2,2 | 6,74±1,2 | 0,59 |
| Longitud del stent analizada (mm) | 21±9 | 22±10 | 0,58 |
NA: neoateroesclerosis; OCT: tomografía de coherencia óptica; TR: tejido reestenótico.
Los valores expresan n (%) o media ± desviación estándar.
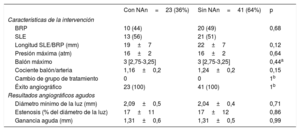
No hubo diferencias entre los pacientes con y sin neoateroesclerosis por lo que respecta a la estrategia de tratamiento. La proporción de pacientes tratados con un BRP o un SLE fue la misma en ambos grupos y no se observaron diferencias en ninguno de los demás aspectos de la intervención (diámetro del balón, presión, longitud del nuevo SLE o BRP). La ganancia aguda angiográfica y el diámetro mínimo de la luz fueron también similares en los 2 grupos (tabla 3).
Características de la intervención y resultados angiográficos agudos
| Con NAn=23 (36%) | Sin NAn=41 (64%) | p | |
|---|---|---|---|
| Características de la intervención | |||
| BRP | 10 (44) | 20 (49) | 0,68 |
| SLE | 13 (56) | 21 (51) | |
| Longitud SLE/BRP (mm) | 19±7 | 22±7 | 0,12 |
| Presión máxima (atm) | 16±2 | 16±2 | 0,64 |
| Balón máximo | 3 [2,75-3,25] | 3 [2,75-3,25] | 0,44a |
| Cociente balón/arteria | 1,16±0,2 | 1,24±0,2 | 0,15 |
| Cambio de grupo de tratamiento | 0 | 0 | 1b |
| Éxito angiográfico | 23 (100) | 41 (100) | 1b |
| Resultados angiográficos agudos | |||
| Diámetro mínimo de la luz (mm) | 2,09±0,5 | 2,04±0,4 | 0,71 |
| Estenosis (% del diámetro de la luz) | 17±11 | 17±12 | 0,86 |
| Ganancia aguda (mm) | 1,31±0,6 | 1,31±0,5 | 0,99 |
BRP: balón recubierto con paclitaxel; NA: neoateroesclerosis; SLE: stent liberador de everolimus.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
El seguimiento angiográfico realizado a los 6-9 meses no mostró diferencias en cuanto a la reestenosis (5 [24%] frente a 6 [15%]; p = 0,49), el diámetro mínimo de la luz (1,79 ± 0,7 frente a 1,94 ± 0,6 mm; p = 0,41) o la pérdida tardía (0,33 ± 0,7 frente a 0,15 ± 0,5; p = 0,34) en los pacientes con y sin neoateroesclerosis respectivamente.
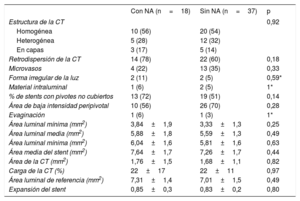
El seguimiento mediante OCT confirmó la ausencia de diferencias entre los 2 grupos en los parámetros cuantitativos (áreas mínima y media de la luz, áreas mínima y media del stent, expansión del stent, área de cobertura tisular). Las características de la cobertura tisular en el seguimiento fueron también similares en los 2 grupos, sin que hubiera diferencias en la cobertura de los pivotes ni en la presencia de evaginaciones (tabla 4).
Resultados del seguimiento mediante tomografía de coherencia óptica
| Con NA (n=18) | Sin NA (n=37) | p | |
|---|---|---|---|
| Estructura de la CT | 0,92 | ||
| Homogénea | 10 (56) | 20 (54) | |
| Heterogénea | 5 (28) | 12 (32) | |
| En capas | 3 (17) | 5 (14) | |
| Retrodispersión de la CT | 14 (78) | 22 (60) | 0,18 |
| Microvasos | 4 (22) | 13 (35) | 0,33 |
| Forma irregular de la luz | 2 (11) | 2 (5) | 0,59* |
| Material intraluminal | 1 (6) | 2 (5) | 1* |
| % de stents con pivotes no cubiertos | 13 (72) | 19 (51) | 0,14 |
| Área de baja intensidad peripivotal | 10 (56) | 26 (70) | 0,28 |
| Evaginación | 1 (6) | 1 (3) | 1* |
| Área luminal mínima (mm2) | 3,84±1,9 | 3,33±1,3 | 0,25 |
| Área luminal media (mm2) | 5,88±1,8 | 5,59±1,3 | 0,49 |
| Área luminal mínima (mm2) | 6,04±1,6 | 5,81±1,6 | 0,63 |
| Área media del stent (mm2) | 7,64±1,7 | 7,26±1,7 | 0,44 |
| Área de la CT (mm2) | 1,76±1,5 | 1,68±1,1 | 0,82 |
| Carga de la CT (%) | 22±17 | 22±11 | 0,97 |
| Área luminal de referencia (mm2) | 7,31±1,4 | 7,01±1,5 | 0,49 |
| Expansión del stent | 0,85±0,3 | 0,83±0,2 | 0,80 |
CT: cobertura tisular; NA: neoateroesclerosis.
Los valores expresan n (%) o media ± desviación estándar.
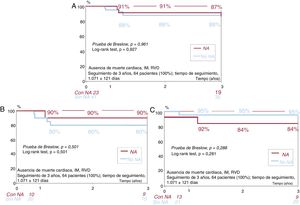
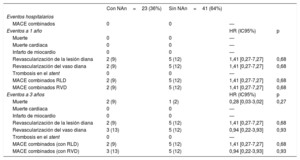
Se llevó a cabo un seguimiento clínico de 1 y 3 años en 64 pacientes (100%). En la tabla 5 y la figura 4 se muestran las tasas de eventos adversos cardiovasculares mayores (MACE) y de cada uno de sus componentes (muerte cardiaca, infarto de miocardio, revascularización de lesión diana, revascularización de vaso diana) en los pacientes con o sin neoateroesclerosis tratados con un BRP o un SLE.
Eventos adversos clínicos mayores
| Con NAn=23 (36%) | Sin NAn=41 (64%) | |||
|---|---|---|---|---|
| Eventos hospitalarios | ||||
| MACE combinados | 0 | 0 | — | |
| Eventos a 1 año | HR (IC95%) | p | ||
| Muerte | 0 | 0 | — | |
| Muerte cardiaca | 0 | 0 | — | |
| Infarto de miocardio | 0 | 0 | — | |
| Revascularización de la lesión diana | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| Revascularización del vaso diana | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| Trombosis en el stent | 0 | 0 | — | |
| MACE combinados RLD | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| MACE combinados RVD | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| Eventos a 3 años | HR (IC95%) | p | ||
| Muerte | 2 (9) | 1 (2) | 0,28 [0,03-3,02] | 0,27 |
| Muerte cardiaca | 0 | 0 | — | |
| Infarto de miocardio | 0 | 0 | — | |
| Revascularización de la lesión diana | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| Revascularización del vaso diana | 3 (13) | 5 (12) | 0,94 [0,22-3,93] | 0,93 |
| Trombosis en el stent | 0 | 0 | — | |
| MACE combinados (con RLD) | 2 (9) | 5 (12) | 1,41 [0,27-7,27] | 0,68 |
| MACE combinados (con RVD) | 3 (13) | 5 (12) | 0,94 [0,22-3,93] | 0,93 |
HR: hazard ratio (eventos en el seguimiento); IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiacos mayores (muerte cardiaca, infarto de miocardio; NA: neoaterosclerosis; RLD revascularización de lesión diana; RVD: revascularización de vaso diana.
Valores de p basados en un análisis de Cox.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
A: curva de supervivencia de los pacientes con y sin neoateroesclerosis. B: curva de supervivencia de los pacientes con y sin neoateroesclerosis en el grupo de tratamiento con BRP. C: curva de supervivencia de los pacientes con y sin neoateroesclerosis en el grupo de tratamiento con SLE. BRP: balón recubierto con paclitaxel; IM: infarto de miocardio; NA: neoateroesclerosis; RVD: revascularización del vaso diana; SLE: stent liberador de everolimus.
Tiene interés señalar que, en los pacientes con neoateroesclerosis tratados con un BRP, la tasa de reestenosis en el seguimiento fue numéricamente inferior (sin significación estadística) (1 de 9 [11%]) en comparación con lo observado en las lesiones sin neoateroesclerosis (4 de 20 [20%]; p = 1). Por el contrario, en los pacientes tratados con un SLE hubo una tendencia a una tasa de reestenosis más alta (sin significación estadística) en el grupo de neoateroesclerosis (4 de 12 [33%] frente a 2 de 21 [10%]; p = 0,16]. Por lo que respecta a los MACE, en esta pequeña población, se observaron unas tasas similares en el grupo de BRP entre los pacientes con y sin neoateroesclerosis. Los resultados clínicos de los pacientes con y sin neoateroesclerosis tratados con un SLE fueron comparables.
De los 23 pacientes con neoateroesclerosis, se trató a 10 con un BRP y a 13 con un SLE. La tasa de reestenosis fue de 1 de 9 (11%) con los BRP frente a 4 de 12 (33%) con los SLE (p=0,34). Los MACE observados en el seguimiento de 1 y 3 años fueron poco frecuentes en esta población, y no hubo ningún caso de muerte o infarto de miocardio. Tan solo hubo 1 revascularización de una lesión diana en cada grupo en el plazo de 1 año. En este grupo pequeño, los MACE en un seguimiento de 1 y 3 años fueron similares entre los pacientes con neoateroesclerosis tratados con un BRP o con un SLE.
DISCUSIÓNEn este subanálisis basado en los datos de OCT de los ensayos RIBS IV y V, se ha observado lo siguiente: a) un número sustancial de lesiones de RS tratadas con una nueva revascularización muestran neoateroesclerosis; b) en esta pequeña población de estudio, la presencia de neoateroesclerosis no parece que influya en los resultados agudos o a largo plazo de la nueva ICP, y c) el presente estudio no permite evaluar las diferencias de resultados entre el SLE y el BRP en el tratamiento de la RS, pero podría indicar que ambas opciones de tratamiento pueden ser eficaces y seguras. Esto tiene importancia, ya que actualmente tanto el BRP como el SLE se recomiendan en las guías de práctica clínica para el tratamiento de los pacientes con una RS.
Otros resultados del estudio son: a) la RS con neoateroesclerosis mostró con más frecuencia una forma de presentación clínica inestable, y b) ello se correlacionaba con la presencia más frecuente de signos de OCT que indican una inestabilidad, como la presencia de material intraluminal, una luz irregular y macrófagos.
Influencia de la neoateroesclerosis en los resultados de la nueva ICPSe ha demostrado que la neoateroesclerosis, definida como la presencia de placa ateroesclerótica en el tejido de neoíntima en el stent, es una causa de fallo del stent (tanto por reestenosis como por trombosis en el stent)9,10. Se ha descrito que la antigüedad del implante, el uso de un SFA, la enfermedad renal crónica y los valores elevados de lipoproteínas de baja densidad son factores predictivos de esta entidad11-16. La prevalencia de neoateroesclerosis descrita en la literatura varía en función del tipo de stent, la indicación para la OCT en el seguimiento y la antigüedad del implante. El 36% de nuestros casos de RS mostraron signos de neoateroesclerosis, y esta prevalencia es similar a la descrita en estudios previos.
En estudios retrospectivos previos realizados en pacientes evaluados por OCT en el seguimiento tras el implante de un stent, se ha observado que para quienes muestran una neoíntima que contiene neoateroesclerosis el pronóstico es peor, con una tasa más alta de eventos y revascularizaciones17-19. Sin embargo, estos estudios no aportaron información sobre las repercusiones de la neoateroesclerosis en la RS clínicamente relevante tratada con una nueva revascularización.
Este es el primer estudio en el que se investiga la influencia de la neoateroesclerosis observada en la OCT en los resultados a largo plazo de los pacientes con RS que requiere una nueva ICP (y que presentan síntomas o isquemia). La fuerza de estas observaciones deriva del carácter prospectivo y de la metodología sólida utilizada en los ensayos aleatorizados RIBS IV y V. A este respecto, resulta tranquilizador que la presencia de neoateroesclerosis no parece que influya en el pronóstico agudo o a largo plazo de estos pacientes. Esto concuerda con los resultados del seguimiento angiográfico (en el que no hubo diferencias entre los 2 grupos en el diámetro mínimo de la luz ni en la pérdida tardía) y con los resultados de la OCT en el seguimiento, que mostraron una respuesta al tratamiento similar entre los pacientes con y sin neoateroesclerosis, sin que hubiera diferencias en la cantidad o las características ópticas de la cobertura tisular.
Tiene interés señalar que el presente estudio indica que sería seguro y eficaz tratar la neoateroesclerosis con un BRP, con unos resultados agudos y a largo plazo similares a los obtenidos con el tratamiento con un SLE en nuestra población. La presencia de un armazón subyacente podría explicar las diferencias de respuesta de la neoateroesclerosis y la ateroesclerosis nativa al tratamiento con un BRP.
Nuestros resultados concuerdan con los de un estudio previo de Tada et al.20 en el que se evaluó la influencia de los patrones de RS en la OCT (neoíntima homogénea, heterogénea o en capas) en los resultados a medio plazo de la nueva ICP con una angioplastia simple con BRP o un SFA. El patrón óptico más frecuente en la RS con neoateroesclerosis en nuestra población fue el heterogéneo, tal como se ha observado también en un estudio histológico en el que se evaluaron las características de la neoíntima después del implante de un SFA21. Tada et al.20 no observaron diferencias en la RS, la revascularización de la lesión diana o la pérdida tardía a los 6-8 meses entre los pacientes con un patrón de RS heterogéneo tratados con un BRP o un SFA, y este resultado concuerda con lo indicado por nuestros datos.
En el grupo tratado con un SLE hubo una tendencia no significativa a una tasa de reestenosis superior en los pacientes con neoateroesclerosis, mientras que en el grupo tratado con un BRP la tasa de reestenosis fue numéricamente inferior en los pacientes con neoateroesclerosis. El pequeño tamaño de la muestra no permite extraer conclusiones más definitivas al respecto. Serán necesarios nuevos estudios para evaluar una posible diferencia de respuesta con distintos enfoques del tratamiento.
Neoateroesclerosis y forma de presentación clínicaEn nuestro estudio, los pacientes con una RS y neoateroesclerosis mostraron con más frecuencia una forma de presentación inicial con angina inestable, mientras que en los pacientes sin neoateroesclerosis la forma de presentación fue más estable. Esto concuerda con lo indicado por un estudio previo de SFA-RS publicado por Kang et al.6 que puso de manifiesto que los pacientes con angina inestable (en comparación con los pacientes con angina estable) tenían con mayor frecuencia una neoíntima que contenía un fibroateroma de capa fina o una rotura de la neoíntima. La forma de presentación con un síndrome coronario agudo fue también más frecuente en las lesiones con un área transversal de neoíntima > 50% cuando tenían neoateroesclerosis. La rotura de la neoíntima con contenido lipídico y posterior formación de trombo puede generar una forma de presentación clínica inestable, y se ha propuesto que ello explica la relación entre la RS y la trombosis tardía en el stent22. Nuestros resultados ponen de manifiesto una frecuencia superior de la luz irregular y de la presencia intraluminal de material (que indica un trombo) en los pacientes con neoateroesclerosis. Los macrófagos, que son otro indicador de la inestabilidad de la placa, fueron también más frecuentes en los pacientes con neoateroesclerosis.
Relación entre la neoateroesclerosis y el ABIPPEn nuestro estudio, el ABIPP se observó con menor frecuencia en los pacientes con neoateroesclerosis. Esta observación de la OCT se ha relacionado histológicamente con la presencia de fibrinoide y proteoglucanos, así como con la neovascularización y la inflamación peripivotal23. Varios estudios han mostrado la existencia de una correlación entre el ABIPP y el grosor de la neoíntima y una relación inversa con el tiempo transcurrido desde el implante del stent24. Así pues, el ABIPP parece ser un fenómeno relacionado con la cicatrización del vaso tras el implante del stent, mientras que la neoateroesclerosis consiste en la nueva formación de ateroesclerosis en el interior de este. Según lo indicado por nuestras observaciones, la evidencia actual no muestra una asociación entre estos 2 fenómenos, a pesar de que la inflamación podría desempeñar un papel en ambos. En consonancia con lo indicado por estudios previos, en los pacientes sin neoateroesclerosis de nuestro estudio (que presentaron con mayor frecuencia un ABIPP) había transcurrido menos tiempo tras el implante del stent y había una cantidad menor (aunque sin diferencia significativa) de tejido reestenótico.
LimitacionesLa principal limitación de este estudio es su pequeño tamaño muestral. El subestudio de OCT de los ensayos RIBS IV y IV se realizó tan solo en algunos de los centros participantes, y ello limitó la inclusión de pacientes. Sin embargo, no hubo diferencias en las características de los pacientes incluidos en el subestudio de OCT en comparación con las de los pacientes no incluidos. Aunque los resultados del presente estudio respecto a la respuesta de neoateroesclerosis al tratamiento con un BRP o un SLE no permiten extraer conclusiones definitivas, sí pueden ser generadores de hipótesis. Para confirmar los resultados, sería necesario un ensayo aleatorizado de comparación de las 2 estrategias en el tratamiento de los pacientes con RS y neoateroesclerosis. Basándonos en nuestros resultados, hemos calculado que el tamaño muestral necesario para este estudio aleatorizado sería de 376 pacientes en cada grupo, lo cual hace difícil su realización, dado el escaso número de pacientes con RS, de los que tan solo se podría seleccionar a los que presentaran neoateroesclerosis. Los estudios de correlación anatomopatológica han mostrado la posible sobrestimación existente en el diagnóstico de la neoateroesclerosis mediante OCT, sobre todo por lo que respecta a la detección del fibroateroma de capa fina23. La neoateroesclerosis es de por sí una entidad heterogénea, que incluye la acumulación de calcio y lípidos en el interior de la neoíntima, la cual podría, pues, responder de un modo diferente al tratamiento con un BRP o un SFA. El pequeño número de pacientes de nuestro estudio no permite extraer conclusiones a este respecto.
CONCLUSIONESLa OCT ha proporcionado un nuevo enfoque para la evaluación de la RS, que permite la identificación de la neoateroesclerosis in vivo y revela diversos patrones y mecanismos que podrían requerir estrategias de tratamiento diferentes. En esta población de estudio, la neoateroesclerosis definida mediante OCT no parece que influya en los resultados agudos y a largo plazo en los pacientes aleatorizados a un tratamiento de la RS con un BRP o un SLE. Además, nuestros resultados podrían indicar que la RS con neoateroesclerosis podría tratarse tanto con un BRP como con un SLE. Los resultados que se presentan aquí son tan solo generadores de hipótesis y serán precisos nuevos estudios para comparar las 2 estrategias de tratamiento en este tipo de RS.
FINANCIACIÓNLos ensayos RIBS fueron iniciativas de los propios investigadores, y se organizaron bajo los auspicios del Grupo de Trabajo de Cardiología Intervencionista de la Sociedad Española de Cardiología. El promotor del estudio fue la Fundación Interhospitalaria para la Investigación Cardiovascular (FIC). B. Braun Surgical y Abbott Vascular aportaron subvenciones de investigación no condicionadas.
CONFLICTO DE INTERESESN. Gonzalo ha recibido honorarios por conferencias en actividades de formación de Abbott Medical. Los demás autores no tienen nada que declarar.
- –
Se ha demostrado que la neoateroesclerosis, definida como la presencia de placa ateroesclerótica en el tejido de neoíntima dentro del stent, es una causa de estenosis en el stent. La OCT es una técnica de imagen intracoronaria de alta resolución que permite la identificación de la neoateroesclerosis in vivo. Es poco lo que se sabe acerca de si la neoateroesclerosis influye o no en los resultados a largo plazo en los pacientes con una RS tratados mediante ICP o si el BRP y el SLE son igual de eficaces para tratar la RS con neoateroesclerosis.
- –
Este es el primer estudio en el que se investiga la influencia de la neoateroesclerosis en el pronóstico y la respuesta al tratamiento en los pacientes con una RS tratados con un SLE o un BRP.
- –
En la pequeña población de nuestro estudio, la neoateroesclerosis definida mediante OCT no influyó en los resultados agudos o a largo plazo obtenidos en los pacientes tratados por una RS.
- –
Nuestros resultados indicarían que la RS con neoateroesclerosis podría tratarse con un BRP o un SLE.