La insuficiencia cardiaca como síndrome, junto con sus complejas manifestaciones, es el resultado de diversos mecanismos fisiopatológicos diferentes1. En las últimas décadas, la incidencia de insuficiencia cardiaca ha aumentado tanto en los países occidentales que se reconoce ahora como una epidemia, comparable y en algunos casos de peor pronóstico que la mayor parte de los procesos neoplásicos2-5. Afortunadamente, también se han producido importantes avances en su tratamiento con el desarrollo de fármacos capaces de modificar el curso natural de la enfermedad —como los bloqueadores beta, los inhibidores de la enzima de conversión de angiotensina, los antagonistas de los receptores de la angiotensina II y los antialdosterónicos— y la utilización de dispositivos implantables como los desfibriladores o los resincronizadores. Terapias todas ellas que se ha demostrado que mejoran la supervivencia, atenúan los síntomas y disminuyen el número de hospitalizaciones1-7. Por otro lado, los avances técnicos en cirugía cardiaca también han introducido nuevos métodos de reconstrucción ventricular, revascularización coronaria y reparación valvular mitral. No obstante, en la insuficiencia cardiaca avanzada, clasificada como terminal o estadio D según el esquema de la American Heart Association/American College of Cardiology (AHA/ACC), el manejo más apropiado no siempre ha estado tan claro8. El uso obligado de inotrópicos en algunos de estos enfermos, que sufren una disminución importante del gasto cardiaco, se ha relacionado frecuentemente con un aumento de la mortalidad a medio o largo plazo1. Para un grupo selecto de pacientes de este tipo, el trasplante cardiaco supone un gran beneficio, con una importante mejora en la calidad de vida y un aumento en la supervivencia a largo plazo. Sin embargo, entre las conocidas limitaciones de esta técnica, es necesario asumir el riesgo del tratamiento inmunodepresor, su elevado coste, un escaso número de donantes y que hay ciertas contraindicaciones9,10. A pesar de ello, desde la introducción de los inhibidores de la calcineurina, el trasplante cardiaco se ha erigido como el tratamiento más efectivo que existe para la insuficiencia cardiaca avanzada. Desafortunadamente, el trasplante es una solución real tan sólo para un pequeño número de pacientes, por lo que se necesitaba una terapéutica adicional9-11. Los dispositivos de asistencia mecánica circulatoria (mechanical circulatory assist devices [MCSD]), más comúnmente conocidos como asistencias ventriculares (ventricular assist devices [VAD]) podrían ocupar este lugar11.
¿Qué es una asistencia ventricular?
Los dispositivos de asistencia mecánica circulatoria son bombas implantables capaces de aportar soporte hemodinámico generando un flujo adicional al del corazón insuficiente (aguda o crónicamente), cuando el tratamiento médico solo o con balón de contrapulsación no basta o no es aplicable. Desde que se implantó la primera asistencia ventricular izquierda en 1963 y el inicio del programa de corazón artificial en Estados Unidos, promovido por el National Heart, Lung and Blood Institute (NHLBI) en 1964, se han desarrollado gran cantidad de dispositivos11.
Las VAD fueron empleadas inicialmente en insuficiencia cardiaca tras cardiotomía en los años setenta. En 1978 se utilizó por primera vez una asistencia ventricular izquierda como puente o transición al trasplante. En la década de los ochenta, la FDA (Food and Drug Administration de Estados Unidos) aprobó las asistencias ventriculares como apoyo circulatorio en el paciente con insuficiencia cardiaca avanzada, y en 1984 se utilizó el primer dispositivo a largo plazo como puente al trasplante. En 1988 se introdujo la primera bomba axial y en los noventa el concepto de paciente ambulatorio, con soporte circulatorio a largo plazo, empezó a ser una práctica habitual. En 1996, tras explantar con éxito una asistencia ventricular en un paciente cuya función cardiaca había mejorado de forma sustancial, el concepto de soporte mecánico circulatorio como «puente a la recuperación» se convirtió en una meta alcanzable en algunos pacientes. En 2001, los resultados del estudio REMATCH probaron la idea de que las asistencias ventriculares podían servir como tratamiento permanente, también denominado «terapia de destino» (destination therapy), como alternativa al tratamiento médico en el enfermo con insuficiencia cardiaca terminal11,12. Este trabajo de referencia, publicado en New England Journal of Medicine, aleatorizó a 129 pacientes sin posibilidad de trasplante, todos en clase funcional IV de la New York Heart Association, a recibir tratamiento médico o asistencia mecánica circulatoria. Los investigadores del estudio demostraron 2 veces más supervivencia en el grupo de las asistencias respecto a la cohorte que recibió sólo tratamiento médico máximo, en lo que se considera que son los pacientes más enfermos que se haya incluido nunca en un ensayo clínico cardiológico. Más recientemente se han desarrollado e introducido en la práctica clínica del día a día, así como en los protocolos de investigación, esperanzadores diseños de asistencias ventriculares de nueva generación13.
A medida que el tamaño de las nuevas generaciones de dispositivos se ha ido reduciendo, se ha podido extender su uso a los niños y adultos más pequeños11,12,14.
Según su emplazamiento, las asistencias ventriculares se pueden dividir en extracorpóreas, cuya bomba se localiza fuera del cuerpo (p. ej., Centrimag, ECMO, Thoratec) o intracorpóreas (Heart Mate I, Heart Mate II o Ventrassist). En otros trabajos de REVISTA ESPAÑOLA DE CARDIOLOGÍA se han descrito más detalles sobre su clasificación15,16.
Las asistencias ventriculares se emplean generalmente para apoyar la función del ventrículo izquierdo (LVAD), aunque también pueden dar soporte al ventrículo derecho (RVAD) o ambos (BiVAD o eventualmente el corazón artificial total)17. De acuerdo con el flujo que son capaces de generar, se las divide en dispositivos de flujo pulsátil o continuo. Actualmente, se tiende a diseñar bombas cada vez más pequeñas, intracorpóreas y más duraderas y fiables (de segunda y tercera generación, como la Heart Mate II y la Ventrassist, respectivamente), que utilizan flujos continuos. Por todo ello, el número de VAD que se implanta cada año está creciendo17.
¿En qué situaciones clínicas se emplean las asistencias ventriculares?
Actualmente se admiten las siguientes estrategias para considerar la utilización del soporte circulatorio mecánico18:
- Puente al trasplante: en este caso, la asistencia se emplea para mantener al paciente que de otra manera fallecería o empeoraría esperando el trasplante. Se ha demostrado que el uso del soporte mecánico circulatorio mejora la función renal y optimiza las presiones en la arteria pulmonar, lo que permite trasplantar al enfermo en mejores condiciones19. Es particularmente útil en pacientes con ciertos grupos sanguíneos, por ejemplo grupo 0, en quienes suele haber un tiempo de espera mucho mayor, para evitar el desarrollo de daño orgánico sistémico.
- Puente a la recuperación: en algunos casos, principalmente tras cardiotomía, las asistencias ventriculares permiten mantener hemodinámicamente al paciente el tiempo necesario para que su corazón se recupere tras la cirugía17,20. Asimismo, se ha descrito la recuperación duradera de insuficiencia cardiaca avanzada secundaria a miocardiopatía no isquémica en pacientes seleccionados que fueron tratados temporalmente con asistencias ventriculares y un régimen médico específico con clembuterol21.
- Puente a la decisión: a veces es muy difícil determinar inmediatamente si un paciente cumple o no los requisitos para trasplante cuando gran cantidad de la información necesaria para éste no se conoce (comorbilidades, adicción a tóxicos, situación psicosocial). Una asistencia puede ser la solución para estabilizar al enfermo hasta completar el estudio de manera adecuada. Otra indicación reciente en este sentido es emplear asistencias ventriculares en pacientes exageradamente obesos, para permitirles perder peso sin percances y que de esta manera después se pueda incluirlos para trasplante.
- Terapia de destino o permanente: cuando no se puede trasplantar al paciente (por edad, razones médicas o sociales). Esta indicación ha ido creciendo una vez que el desarrollo tecnológico ha permitido la utilización de dispositivos más duraderos, con menos complicaciones, y se ha acumulado más experiencia con los programas de pacientes ambulatorios11.
Últimamente estas estrategias han dejado de ser compartimentos estancos, y pueden variar según el curso del paciente, esto es, un mismo enfermo podría encuadrarse en varias de ellas o pasar de una a otra. Así, tras un tiempo mantenido con una asistencia ventricular, un enfermo que experimentara mejoría en la función de sus órganos, disminución de la presión en la arteria pulmonar u otras comorbilidades, que inicialmente se habría catalogado como no trasplantable, podría incluirse en lista de espera y sobrellevar con éxito el procedimiento18,22.
¿Cuáles son sus resultados?
Los resultados han mejorado de manera drástica en los pacientes que han recibido estos dispositivos en los últimos tiempos, debido a los avances tecnológicos, una selección de pacientes adecuada y un mejor manejo perioperatorio y multidisciplinario23. El estudio RE- MATCH mostró una reducción del 48% en el riesgo de muerte por cualquier causa en el grupo que recibió la asistencia ventricular respecto a la cohorte de tratamiento médico aislado (el 52 frente al 25% a 1 año y el 23 frente al 8% a 2 años, respectivamente). La calidad de vida también mejoró de forma significativa a 1 año en el grupo de portadores del dispositivo11. Sorprendentemente, estas diferencias fueron las más grandes jamás demostradas entre dos tipos de tratamiento en pacientes con insuficiencia cardiaca.
Tras la publicación del estudio REMATCH, el diseño de la bomba empleada en él, una Heart Mate eléctrica, fue mejorado de manera importante, y se han comercializado nuevos dispositivos (fig. 1). Un estudio recientemente publicado por Miller et al19 con la utilización de una bomba de nueva generación de flujo continuo (Heart Mate II) demostró una supervivencia con soporte mecánico del 75% a los 6 meses y del 68% a los 12. A los 3 meses, el tratamiento se asoció con una mejoría significativa tanto en la capacidad funcional como en la calidad de vida. Los datos aportados por la Universidad de Wisconsin, que comparó los resultados de asistencias implantadas entre 1990 y 2006, son congruentes con estas importantes mejoras. Así, en el periodo 1990-1996, las tasas de supervivencia 1 y 3 años tras el implante fueron el 54,1 y el 40,5%, en comparación con el 86,8 y el 82,5% en el intervalo 2003-2006, diferencia altamente significativa (p < 0,001)23. Sin embargo, hay que destacar que la selección apropiada de los candidatos a recibir este tratamiento es esencial para obtener mejores resultados24.
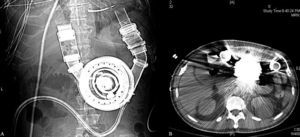
Fig. 1. Radiografía simple (A) y corte tomográfico (B) de paciente portador de un Heart Mate I, dispositivo de asistencia circulatoria intracorpóreo y pulsátil. Modelo con diseño mejorado tras el estudio REMATCH. Aunque hay dispositivos de menor tamaño, éste presenta la ventaja de que se puede utilizar sin anti-coagulación.
Los pacientes con insuficiencia cardiaca avanzada en la fase previa al desarrollo de complicaciones mayores tienen más posibilidades de obtener una excelente supervivencia a 1 año con estos dispositivos24.
¿Cuáles son las complicaciones de las asistencias ventriculares?
Se han descrito gran cantidad de complicaciones tras el implante de asistencias ventriculares11-24. A grandes rasgos, destacan: infección y sepsis, sangrado y taponamiento cardiaco, arritmias, crisis comiciales y eventos neurológicos, disfunción del dispositivo y disfunción ventricular derecha (con VAD izquierdas). Los pacientes del estudio REMATCH en el grupo con el dispositivo tuvieron el doble de probabilidades de sufrir eventos adversos graves (razón de tasas = 2,35; intervalo de confianza del 95%, 1,86-2,95). La sepsis fue la causa más frecuente de muerte (31%) en ese trabajo11. No obstante, Osaki et al23 han descrito más recientemente una disminución en la tasa de sepsis (del 44,4 al 13,2%), en conjunción con las mejoras en el diseño de los aparatos y en la pauta antibiótica profiláctica. La incidencia de infección se ha estimado en 5,9 infecciones cada 1.000 días en riesgo mantenidos con asistencia ventricular25. En un reciente trabajo post-REMATCH, Miller et al19 señalan que el evento adverso más frecuente es el sangrado, principalmente en el postoperatorio inmediato (el 31% con necesidad de cirugía y el 53% con transfusión de 2 o más concentrados de hematíes). El 8% sufre ictus (sobre todo los primeros 2 días tras el implante). Las infecciones localizadas, no relacionadas con el dispositivo, se han descrito en el 28% de los pacientes, mientras que las relacionadas con la bomba se dan en el 14%. La sepsis es la forma de presentación en el 20% de ellos. Entre las restantes complicaciones figura la insuficiencia respiratoria, que se contabiliza en el 26%, las arritmias ventriculares en el 24% y la disfunción ventricular derecha en el 17%; se observaron eventos tromboembólicos no neurológicos en el 7% y hemólisis en el 3%. Las causas más frecuentes de muerte durante los primeros 180 días tras el implante de una VAD incluyeron la sepsis, el ictus isquémico y el fallo multiorgánico19.
En algunos pacientes portadores de una asistencia ventricular como puente al trasplante, se han descrito títulos de anticuerpos elevados pero, en contra de lo que se pensó inicialmente, esto no incrementa el riesgo de rechazo humoral o celular tras el trasplante26. El trasplante cardiaco en pacientes con soporte mecánico ha mostrado unos resultados equiparables a los de los enfermos que no lo precisaron14.
¿Cuánto cuesta una asistencia ventricular?
Los dispositivos de apoyo circulatorio mecánico y su mantenimiento son caros. En el editorial que acompañaba el estudio REMATCH se aseveraba: «Ahora sabemos que las asistencias ventriculares prolongan la vida; lo que todavía no sabemos es cuánto y a qué coste»27. Esta afirmación está aún vigente. Aunque se han publicado muchos estudios económicos, el coste exacto es muy difícil de calcular: medios diferentes, diferentes dispositivos, diferentes políticas de facturación sanitaria, aspectos bioéticos y resultados cambiantes pueden servir para desconcertar al analista.
En 1995, Mehta et al28 consideraron que los pacientes que recibían una asistencia ventricular mostraban una tasa de alta hospitalaria más alta, con un coste diario equivalente. Miller et al29 publicaron menores costes, con mejores resultados y una estancia media menor.
Un estudio realizado con la Heart Mate VE estimó un coste de alrededor de 210.000 dólares para la hospitalización inicial, incluidos la bomba y su implante. Los costes de implantación en pacientes que no sobrevivieron fueron mayores que en los que sí. La conclusión de dicho estudio fue que el coste a largo plazo del implante de la asistencia ventricular izquierda es proporcional respecto a otros tratamientos a «vida o muerte», como el trasplante hepático. Es de esperar que, como tecnología en constante evolución, se produzcan mejoras que reduzcan los costes en un futuro30.
Un trabajo británico concluyó que, en el caso de que el precio de los dispositivos se pudiera reducir a 40.000 libras esterlinas, el beneficio de la supervivencia del sujeto podría justificar fácilmente los estudios sobre asistencias ventriculares como terapia de destino31.
¿Qué equipo necesitamos para iniciar un programa de asistencias ventriculares?
Se necesitaría un equipo multidisciplinario bien entrenado. Dicho equipo compartiría muchas características con un equipo de trasplante: cardiólogos, cirujanos cardiacos, coordinadores de dispositivos, enfermeras, trabajadores sociales, psicólogos, dietistas, apoyo técnico, una unidad de cuidados intensivos, planta y consultas adecuadas23. Tampoco han de olvidarse un plan completo para delinear los criterios de inclusión apropiados y la cuidadosa educación de los pacientes seleccionados.
Conclusiones
Actualmente, los dispositivos de soporte circulatorio mecánico han evolucionado hasta posicionarse como una opción terapéutica adecuada para enfermos con insuficiencia cardiaca avanzada. Los programas de asistencia ventricular y su implantación se han extendido de forma exitosa por todo el mundo, encabezados por Estados Unidos, Japón, Australia y, en Europa, países como Alemania o Reino Unido. Aunque costosas, no son más caras que otros tratamientos disponibles en España, como el trasplante hepático. Para las asistencias ventriculares, el futuro es hoy.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. M. Jessup.
Cardiovascular Division. University of Pennsylvania. Medical Director, Heart Failure/Transplant program. University of Pennsylvania Health System.
6 Penn Tower. 3400 Spruce Street. Philadelphia, PA 19014. Estados Unidos.
Correo electrónico: Mariell.Jessup@uphs.upenn.edu