En los pacientes a los que se han practicado intervenciones sobre la aurícula izquierda (AI) como valvuloplastia mitral con balón percutánea (VMBP), ablación percutánea de una fibrilación auricular o reparación de la válvula mitral, la cuantificación de los cambios del tamaño y la función de la AI se está convirtiendo en un importante objetivo para evaluar el éxito de las intervenciones y técnicas de tratamiento aplicadas. La ecocardiografía sigue siendo la modalidad de elección dentro de las técnicas de imagen para la evaluación de la AI, por su amplia disponibilidad y su relación coste-efectividad favorable. Las nuevas técnicas ecocardiográficas, como la ecocardiografía tridimensional y las técnicas de imagen de deformación, de momento tienen una aplicabilidad limitada, principalmente como instrumentos de investigación, pero podrían aportar una información valiosa sobre el tamaño y la mecánica miocárdica de la AI. En futuros estudios se determinará si estas técnicas pueden ser útiles clínicamente en los pacientes a los que se practican intervenciones sobre la válvula mitral como la VMBP, en las que es prudente vigilar su repercusión en las funciones fásicas de la AI, y conocer el modo en que estos cambios en la función de la AI pueden afectar a las decisiones terapéuticas posteriores, como anticoagular o reintervenir.
La AI desempeña una función que es parte integrante de la acción cardiaca, y actúa como: a) reservorio durante la sístole ventricular izquierda; b) conducto para el paso de la sangre que transcurre de las venas pulmonares hacia el ventrículo izquierdo durante el inicio de la diástole; c) cámara contráctil activa que incrementa el llenado del ventrículo izquierdo en la fase tardía de la diástole, y d) foco de aspiración que se rellena en la fase inicial de la sístole. A través de estas diversas funciones mecánicas (tabla)1, la AI modula el llenado ventricular izquierdo2. Además, la AI actúa como sensor de volumen, de tal manera que la pared de la AI libera péptidos natriuréticos en respuesta a la distensión y genera natriuresis, vasodilatación e inhibición del sistema nervioso simpático y el sistema renina-angiotensina-aldosterona. Dado que la contracción de la AI genera hasta un 30% del volumen de eyección total del ventrículo izquierdo en individuos normales, la contribución activa de la AI es de especial importancia, en el contexto de una disfunción ventricular izquierda, para mantener un volumen de eyección ventricular izquierdo suficiente. La pérdida de la contribución activa de la AI al llenado ventricular izquierdo que se produce con la fibrilación auricular a menudo puede conducir a deterioro funcional.
Parámetros de la función fásica auricular izquierda y sus determinantes
| Función de reservorio | Conducto | Contracción activa | |
| Volúmenes de eyección (ml) | VE total = Vmáx – Vmín | VE pasivo = Vmáx – VpreA | VE activo = VpreA – Vmín |
| Fracciones de vaciado (%) | FE total = VE total/Vmáx | FE pasiva = VE pasivo/Vmáx | FE activa = VE activo/VpreA |
| Determinantes intrínsecos | Relajación activa de la AI | Distensibilidad de la AI | Contractilidad de la AI |
| Distensibilidad de la AI | |||
| Determinantes extrínsecos | Función sistólica del VI con desplazamiento apical del anillo mitralPropagación de la presión de pulso del VD a través de la circulación pulmonarVE del VD | Relajación y llenado inicial del VIObstrucción mecánica de la válvula mitral | Distensibilidad diastólica del VI |
AI: aurícula izquierda; FE: fracción de vaciado; VD: ventrículo derecho; VE: volumen de eyección; VI: ventrículo izquierdo; Vmáx: volumen auricular izquierdo máximo; Vmín: volumen auricular izquierdo mínimo; VpreA: volumen auricular izquierdo antes de la contracción auricular.
Modificado por To et al1.
La estenosis mitral afecta tanto al tamaño como a la función de la AI. Tanto la sobrecarga de presión crónica debida a la obstrucción valvular como la inflamación auricular secundaria a la carditis reumática pueden conducir a la dilatación de la AI y la orejuela de esta, la fibrosis de la pared auricular y la desorganización de los haces miocárdicos de la AI. Todos estos cambios en la AI están en el origen del inicio de la fibrilación auricular. La aparición de la fibrilación auricular se correlaciona de manera independiente con la gravedad de la estenosis mitral y el nivel de presión en la AI, pero también lo está con el grado en que la AI aumenta de tamaño3. Además, se ha demostrado que el tamaño de la AI es un factor predictivo de la estasis y el contraste espontáneo de la AI4. Por consiguiente, teniendo en cuenta las posibles implicaciones pronósticas, demostrar una reducción significativa del tamaño de la AI y una mejora de las funciones de la AI tras la VMBP puede tener trascendencia clínica. Sin embargo, es poco lo que se sabe acerca del efecto de la VMBP en el tamaño y las funciones de la AI5.
Con la ecocardiografía, la cuantificación del tamaño de la AI en los pacientes con estenosis mitral se realiza por convención midiendo el diámetro anteroposterior de la AI y el área de la AI planimetrada en una proyección bidimensional de cuatro cámaras del corazón, aunque se han descrito limitaciones de la evaluación realizada con estos parámetros6. De hecho, las recomendaciones más recientes para la cuantificación de las cámaras cardiacas indican que el volumen de la AI es el parámetro preferido para valorar su tamaño7. La forma de la AI con frecuencia es irregular, y el aumento de tamaño no se produce de manera simétrica6. En consecuencia, las mediciones bidimensionales de tipo lineal, como el diámetro anteroposterior o superoinferior de la AI, podrían no reflejar su tamaño real8. Por otro lado, el cálculo del volumen de la AI mediante la ecocardiografía bidimensional se ve limitado por las importantes presunciones geométricas y la baja reproducibilidad debido a la dificultad de repetir la posición y la orientación exactas de los planos de imagen bidimensionales.
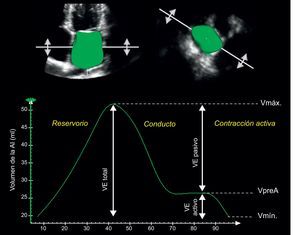
Recientemente se ha demostrado que la ecocardiografía tridimensional es más exacta y reproducible que la bidimensional para la cuantificación del volumen de la AI, en comparaciones directas con la resonancia magnética cardiaca9 y la tomografía computarizada multidetectores de 64 cortes10. Además, la ecocardiografía tridimensional podría llegar a ser un método más fiable para la evaluación de la función de la AI y proporcionar una información exacta sobre los cambios fásicos del volumen de la AI durante el ciclo cardiaco1,11 (figura).
Cuantificar series de datos tridimensionales de volumen completo permite la medición exacta de las funciones fásicas de la aurícula izquierda y de su relación con el ciclo cardiaco. El volumen auricular izquierdo aumenta al máximo durante la fase de reservorio, seguido de dos fases de vaciado progresivo (fases de conducto y de contracción activa), con lo que el volumen disminuye hasta el existente antes de la contracción auricular y, después, al volumen auricular izquierdo mínimo. En consecuencia, el volumen de eyección auricular izquierdo total puede dividirse en un componente pasivo y otro activo (véase también la tabla). AI: aurícula izquierda; VE activo: volumen de eyección auricular izquierdo activo; VE pasivo: volumen de eyección auricular izquierdo pasivo; VE total: volumen de eyección auricular izquierda total; Vmáx: volumen auricular izquierdo máximo; Vmín: volumen auricular izquierdo mínimo; VpreA: volumen auricular izquierdo antes de la contracción auricular.
En este número de Revista Española de Cardiología, Vieira et al12 han utilizado la ecocardiografía bidimensional y tridimensional para estudiar los efectos de la VMBP en los volúmenes y la fracción de vaciado de la AI en 28 pacientes con estenosis mitral sintomática, comparando los parámetros obtenidos antes de la intervención con los existentes a las 72 h y a los 12 meses. Estos autores muestran un significativo remodelado favorable de la AI después de una VMBP practicada con éxito: el volumen máximo de la AI disminuyó de 50 ± 12 a 42 ± 11 ml/m2 a las 72 h de la VMBP, y luego a 40 ± 10ml/m2 en el seguimiento realizado a 1 año. De igual modo, la fracción de vaciado de la AI aumentó de 32 ± 10% a 43 ± 6% a las 72 h de la VMBP y a 47 ± 6% en el seguimiento a 1 año. En este estudio, los volúmenes de la AI medidos con la ecocardiografía bidimensional fueron superiores en un 15% a los obtenidos con la ecocardiografía tridimensional. Esta observación contradice lo indicado por todos los estudios previos en los que se ha comparado la ecocardiografía bidimensional con la tridimensional para la evaluación del volumen de la AI, pues han descrito de manera uniforme unos volúmenes de la AI más altos en la exploración tridimensional11. Lamentablemente, los autores no incluyeron una modalidad de imagen de referencia (es decir, la resonancia magnética o la tomografía computarizada) en su estudio y, por consiguiente, continúa sin conocerse cuál de las dos técnicas ecocardiográficas aporta la medición más exacta.
No obstante, la exactitud o la precisión en la medida en comparación con una técnica de referencia no es el único aspecto clínicamente importante de una prueba o exploración13. De hecho, a veces es motivo de mayor preocupación para los ingenieros que para los clínicos. Los clínicos están habituados a tratar con cierto grado de incertidumbre en su práctica clínica, en la que hay tantas variables que pueden influir en la forma de presentación clínica o la evolución de un paciente que una inexactitud de unos pocos puntos porcentuales en la medición del volumen de la AI, por ejemplo, puede ser irrelevante. Clínicamente es mucho más importante la fiabilidad o la precisión de las mediciones, influidas por el error aleatorio y el sesgo. Una prueba muy precisa o fiable proporciona el mismo resultado en exploraciones secuenciales y es un componente fundamental de una prueba adecuada para uso en el seguimiento de los pacientes. De hecho, si una prueba tiene alta precisión a pesar de tener poca exactitud, la mayor parte de los clínicos la encontrarán muy útil, siempre que el sesgo de las mediciones reales sea reproducible.
La determinación de los volúmenes fásicos de la AI utilizando ecocardiografía bidimensional es laboriosa, y pueden producirse errores como consecuencia de los supuestos geométricos de los cálculos de volumen biplanares, así como por las dificultades debidas a las estrechez de las ventanas de tiempo o los momentos de los procesos auriculares. Actualmente, la técnica tridimensional está pasando a ser la modalidad ecocardiográfica de elección para la determinación de los volúmenes de la AI11, puesto que disponer de series de datos tridimensionales de la AI cuantificables durante todas las diversas fases del ciclo cardiaco permite superar la mayor parte de estas limitaciones. Además, la técnica tridimensional tiene las ventajas de ser independiente de las presunciones geométricas acerca de la forma de la AI, la orientación del plano de imagen ya no influye y se depende menos de la pericia del operador, dada la identificación automática del endocardio. Todas estas características llevan a que la variabilidad test-retest para los volúmenes de la AI en la exploración tridimensional sea inferior que la dimensional14. Por último, aunque no por ello menos importante, la ecocardiografía tridimensional actual tiene una resolución temporal aceptable, que no es fácil de alcanzar con la tomografía computarizada o la resonancia magnética cardiacas, y es crucial obtener una evaluación exacta de las funciones fásicas de la AI.
Los inconvenientes conocidos de la ecocardiografía tridimensional radican en su resolución temporal comparativamente inferior a la de la técnica bidimensional, la mala calidad de la imagen (lo cual puede ser menos problemático con la técnica bidimensional ya que la resolución espacial de esta modalidad es más favorable), y la susceptibilidad a los artefactos de combinación (puesto que son necesarias adquisiciones en simultaneidad con el electrocardiograma obtenidas reuniendo de 4 a 7 subvolúmenes adquiridos en latidos consecutivos para disponer de un conjunto amplio de datos volumétricos con una resolución temporal aceptable). Esto puede ser problemático en pacientes con una fibrilación auricular «irregular».
Además de la función de la cámara de la AI, el estudio de su mecánica miocárdica es un campo emergente que podría aportar nuevas vías para la evaluación de la función fásica de la AI. De forma análoga a la evaluación de la mecánica ventricular izquierda mediante las imágenes de strain y strain rate, las mediciones de la deformación miocárdica por imágenes de velocidad tisular y speckle tracking bidimensional se están adaptando de manera creciente al estudio de la mecánica de la AI15. Estas técnicas serían especialmente útiles para evaluar los cambios de la función de la AI que se producen tras una VMBP practicada con éxito, en especial para diferenciar entre los cambios de volumen de la AI debidos a una disminución brusca de la poscarga auricular y la recuperación real de la función miocárdica de la AI, que puede ser incluso más importante para el pronóstico a largo plazo de los pacientes y la ausencia de complicaciones como fibrilación auricular y episodios embólicos.
En conclusión, evaluar los cambios del tamaño y la función de la AI en los pacientes a los que se han practicado intervenciones sobre la AI, como VMBP, ablación percutánea de fibrilación auricular o reparación de la válvula mitral, se está convirtiendo en un objetivo importante para valorar el éxito de las técnicas/intervenciones. La ecocardiografía continúa siendo la modalidad de elección entre las técnicas de imagen para la evaluación de la AI, por su amplia disponibilidad y su favorable relación coste-efectividad. Las nuevas técnicas ecocardiográficas, como la tridimensional y las imágenes de deformación, por el momento tienen una aplicabilidad limitada principalmente a instrumentos de investigación, pero es posible que puedan aportar información valiosa sobre el tamaño y la mecánica miocárdica de la AI. En futuros estudios se determinará si estas técnicas pueden ser útiles clínicamente para los pacientes a los que se practican intervenciones sobre la válvula mitral, como la VMBP, en las que es prudente vigilar su repercusión en las funciones fásicas de la AI, y conocer de qué manera estos cambios en la función de la AI pueden afectar a decisiones terapéuticas posteriores, como anticoagular o reintervenir.
FINANCIACIÓNDenisa Muraru contó con la financiación de una subvención de investigación concedida por la European Association of Echocardiography.
CONFLICTO DE INTERESESLuigi P. Badano ha recibido subvenciones para equipamiento de GE Healthcare y forma parte del panel de conferenciantes de esta compañía. Denisa Muraru ha recibido financiación para equipamiento y GE Healthcare. Angelica Nour no tiene conflictos de intereses que declarar.