La calcificación de la válvula aórtica (CVA) es una de las principales enfermedades cardiovasculares de la vejez y su resultado es una insuficiencia valvular1. La disfunción endotelial, la inflamación y la agresión oxidativa y mecánica conducen a la remodelación valvular y miocárdica, aunque todavía no se han identificado las vías mecanosensitivas que activan los cambios en la calcificación. La cinasa unida a integrina (ILK) es una proteína clave que regula el tono vascular y la contractilidad cardiaca y actúa como mecanotransductor de las fuerzas hemodinámicas en el miocardio2.
Ya se había observado que la expresión de ILK en las células endoteliales tiene un papel fundamental en la regulación del tono vasomotor, ya que impide el desacoplamiento de la sintasa del óxido nítrico endotelial (eNOS). Se definió una alteración de esta asociación con una clara correlación entre la inhibición de la ILK y la ateroesclerosis3. Como parte de la respuesta inflamatoria, la concentración citotóxica del óxido nítrico (NO) procedente de la sintasa del óxido nítrico inducible (iNOS) activa la endocitosis de la ILK seguida de la degradación lisosómica, lo que conduce a la progresión de la ateroesclerosis4.
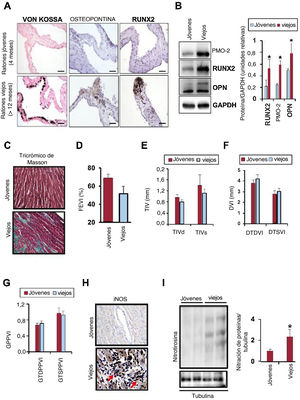
La disfunción endotelial y la ateroesclerosis son dos complicaciones de la vejez en las que la ILK participa de manera importante mediante mecanismos que aún se desconocen. Para comprobar si la ILK puede regular la CVA, se utilizaron ratones jóvenes y viejos que expresaban ILK. La tinción de Von Kossa de las válvulas aórticas de ratones viejos permitió ver grandes depósitos de calcio respecto a los animales jóvenes, junto con la expresión de las proteínas osteogénicas osteopontina y Runx2 (figura 1A,B) y una gran concentración de proteína morfogénica ósea 2 (BMP-2) (figura 1B). En los corazones viejos, la fibrosis era extensa (figura 1C), pero no se observó disfunción sistólica o diastólica del ventrículo izquierdo, aunque el grosor telesistólico del tabique interventricular y la fracción de eyección del ventrículo izquierdo fueran menores que los de ratones jóvenes (figura 1D-G).
Calcificación de las válvulas aórticas relacionada con la edad. A: detección inmunohistoquímica y mediante tinción de Von Kossa de osteopontina y Runx2 en las válvulas aórticas de ratones viejos y jóvenes. B: detección mediante inmunotransferencia de PMO-2, Runx2 y osteopontina en las válvulas aórticas (n=4 por grupo; media±desviación estándar; el asterisco indica p <0,05, jóvenes frente a viejos). C: tricrómico de Masson de las secciones de corazón procedentes de los mismos corazones. D: fracción de eyección del ventrículo izquierdo. E: grosor del tabique interventricular (TIV) en la diástole y la sístole finales. F: diámetro telediastólico del ventrículo izquierdo (DTDVI) y diámetro telesistólico del ventrículo izquierdo (DTSVI). G: grosor telediastólico de la pared posterior del ventrículo izquierdo (GTDPPVI) y grosor telesistólico de la pared posterior del ventrículo izquierdo (GTSPPVI). H: expresión de iNOS. I: detección de nitración de proteínas con anticuerpo antinitrotirosina en los corazones (n=4 por grupo; media±DE; el asterisco indica p <0,05, jóvenes frente a viejos).
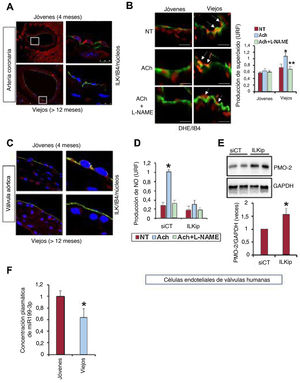
En el corazón de los ratones viejos se halló nitración de proteínas, indicio de sobrecarga de nitratos, como resultado de una alta concentración de NO citotóxico procedente de la mayor expresión de iNOS y la formación de anión superóxido (figura 1H,I), y la ILK endotelial se hallaba considerablemente reducida en las arterias coronarias respecto a la los adultos jóvenes (figura 2A). En consecuencia, la estimulación con acetilcolina de las arterias coronarias de los ratones viejos promueve la formación de superóxido dependiente de eNOS, en lugar del NO derivado del endotelio, ya que la inhibición de eNOS con L-NG-nitroarginina-metil éster (L-NAME) fue suficiente para revertir de manera eficaz este efecto (figura 2B).
Expresión de ILK en el corazón de ratones jóvenes y viejos. A: izquierda, detección de ILK endotelial mediante microscopio confocal (Alexa 488, rojo) en las arterias coronarias; IB4 (isotiocianato de fluoresceína [FITC], verde, como marcador endotelial); derecha, secciones ampliadas (recuadros) (n=4 por grupo). B: detección mediante microscopio confocal de anión superóxido por fluorescencia emitida por dihidroetidio (DHE) (rojo) en las arterias coronarias estimuladas con acetilcolina (ACh) 10 μM durante 30min o 500μM en combinación con L-NAME, el inhibidor de la sintasa del óxido nítrico (NOS) (n=4 por grupo; media±DE; el asterisco indica p <0,05, jóvenes con ACh frente a viejos; el doble asterisco indica p <0,001, viejos con ACh frente a ACh más L-NG-nitroarginina-metil éster [L-NAME]). C: detección mediante microscopio confocal de ILK (rojo) en las válvulas de los mismos ratones (n=4 por grupo). D: producción de NO en células endoteliales de válvulas humanas estimuladas como en B, en las que la expresión de ILK se redujo por el ARN de interferencia (ILKip); como control negativo, se utilizó un ARNip no ILK (siCT) (n=3; media±DE; *p <0,05 ACh frente a L-NAME). E: expresión de PMO-2 en las mismas células (n=3; media±DE; el asterisco indica p <0,05, siCT frente a ILKip). F: concentración plasmática de miR199-3p analizada por RT-qPCR (n=4; media±DE; el asterisco indica p <0,05, jóvenes frente a viejos). URF: unidades relativas de fluorescencia. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Como en las arterias coronarias, la concentración de ILK endotelial observada en las válvulas aórticas de los ratones viejos fue también inferior a la de los adultos jóvenes (figura 2C). La función de la ILK en la CVA se estudió en células endoteliales de válvulas humanas, en las que la expresión de ILK disminuyó por la transfección con un ARN de interferencia pequeño (SiRNA) específico (ILKSi). El silenciamiento de ILK inhibió la producción de NO por las células endoteliales de las válvulas humanas (CEVH) (figura 2D) y se relacionó con una mayor expresión de BMP-2 (figura 2E), al igual que en las válvulas aórticas de los ratones viejos (figura 2B).
Se analizó la expresión de varios microARN implicados en la CVA5. De los 11 microARN expresados de modo diferencial en los ratones viejos frente a los jóvenes, el miR 199-3p se relacionó con la expresión de Notch y eNOS, y ambos genes se relacionaron directamente con la CVA (Notch) y el tono vascular (eNOS). El silenciamiento de Notch-1 aumentó la concentración de Runx2 y activó la calcificación de la válvula. Sorprendentemente, se observó que había relación entre la disminución de la ILK y la concentración reducida de miR-199-3p en los ratones viejos (figura 2F), lo que indica un mecanismo independiente de Notch en lo que respecta a la calcificación por ILK, aunque la participación de la vía Notch en la CVA es discutible, ya que también activa las respuestas osteógenas en las células intersticiales de la válvula aórtica humana6.
En conclusión, se observó por primera vez una relación significativa entre la reducción de la ILK endotelial, el desacoplamiento de eNOS y la calcificación valvular en los ratones viejos, lo que indica que la ILK impide la calcificación de la válvula a través del miRNA199-3p. Para validar la contribución específica de la ILK y los ARNmi indirectos como objetivos en la CVA, serán muy importantes otros estudios que incluyan modelos murinos con inactivación condicional de genes específicos del endotelio.
Todas las intervenciones con los animales fueron aprobadas por el Comité Ético de Experimentación Animal de la Universidad de Alcalá y la Comunidad Autónoma de Madrid (intervención experimental 231.2/20) y conforme a la Directiva de la UE sobre la protección de los animales utilizados con fines experimentales y otros fines científicos (promulgada bajo la ley española 1201/2005).
FINANCIACIÓNP. Reventún, C. Zaragoza, M. Saura y J.L. Zamorano recibieron subvenciones del Proyecto de Investigación Básica en Cardiología de la Sociedad Española de Cardiología para sus investigaciones en el 2019 y M. Saura de la Junta de Comunidades de Castilla-La Mancha (Ayudas a proyectos de investigación) cofinanciadas por los Fondos Europeos de Desarrollo Regional de la Unión Europea: Una manera de hacer Europa (SBPLY/19/180501/000055). A. Cook recibió una beca de investigación predoctoral de la Universidad de Alcalá.
CONTRIBUCIÓN DE LOS AUTORESS. Sánchez: experimentación, obtención de los datos. A. Cook: experimentación, obtención de los datos. P. Reventún: experimentación, obtención de los datos. C. Zaragoza: experimentación, revisión, edición. J.L. Zamorano: revisión, edición, obtención de financiación. M. Saura: conceptualización, metodología, experimentación, preparación del artículo original, redacción, revisión, edición, obtención de financiación.
CONFLICTO DE INTERESESLos autores afirman no tener ningún conflicto de intereses.


![Expresión de ILK en el corazón de ratones jóvenes y viejos. A: izquierda, detección de ILK endotelial mediante microscopio confocal (Alexa 488, rojo) en las arterias coronarias; IB4 (isotiocianato de fluoresceína [FITC], verde, como marcador endotelial); derecha, secciones ampliadas (recuadros) (n=4 por grupo). B: detección mediante microscopio confocal de anión superóxido por fluorescencia emitida por dihidroetidio (DHE) (rojo) en las arterias coronarias estimuladas con acetilcolina (ACh) 10 μM durante 30min o 500μM en combinación con L-NAME, el inhibidor de la sintasa del óxido nítrico (NOS) (n=4 por grupo; media±DE; el asterisco indica p <0,05, jóvenes con ACh frente a viejos; el doble asterisco indica p <0,001, viejos con ACh frente a ACh más L-NG-nitroarginina-metil éster [L-NAME]). C: detección mediante microscopio confocal de ILK (rojo) en las válvulas de los mismos ratones (n=4 por grupo). D: producción de NO en células endoteliales de válvulas humanas estimuladas como en B, en las que la expresión de ILK se redujo por el ARN de interferencia (ILKip); como control negativo, se utilizó un ARNip no ILK (siCT) (n=3; media±DE; *p <0,05 ACh frente a L-NAME). E: expresión de PMO-2 en las mismas células (n=3; media±DE; el asterisco indica p <0,05, siCT frente a ILKip). F: concentración plasmática de miR199-3p analizada por RT-qPCR (n=4; media±DE; el asterisco indica p <0,05, jóvenes frente a viejos). URF: unidades relativas de fluorescencia. Esta figura se muestra a todo color solo en la versión electrónica del artículo. Expresión de ILK en el corazón de ratones jóvenes y viejos. A: izquierda, detección de ILK endotelial mediante microscopio confocal (Alexa 488, rojo) en las arterias coronarias; IB4 (isotiocianato de fluoresceína [FITC], verde, como marcador endotelial); derecha, secciones ampliadas (recuadros) (n=4 por grupo). B: detección mediante microscopio confocal de anión superóxido por fluorescencia emitida por dihidroetidio (DHE) (rojo) en las arterias coronarias estimuladas con acetilcolina (ACh) 10 μM durante 30min o 500μM en combinación con L-NAME, el inhibidor de la sintasa del óxido nítrico (NOS) (n=4 por grupo; media±DE; el asterisco indica p <0,05, jóvenes con ACh frente a viejos; el doble asterisco indica p <0,001, viejos con ACh frente a ACh más L-NG-nitroarginina-metil éster [L-NAME]). C: detección mediante microscopio confocal de ILK (rojo) en las válvulas de los mismos ratones (n=4 por grupo). D: producción de NO en células endoteliales de válvulas humanas estimuladas como en B, en las que la expresión de ILK se redujo por el ARN de interferencia (ILKip); como control negativo, se utilizó un ARNip no ILK (siCT) (n=3; media±DE; *p <0,05 ACh frente a L-NAME). E: expresión de PMO-2 en las mismas células (n=3; media±DE; el asterisco indica p <0,05, siCT frente a ILKip). F: concentración plasmática de miR199-3p analizada por RT-qPCR (n=4; media±DE; el asterisco indica p <0,05, jóvenes frente a viejos). URF: unidades relativas de fluorescencia. Esta figura se muestra a todo color solo en la versión electrónica del artículo.](https://static.elsevier.es/multimedia/03008932/0000007500000001/v1_202112230550/S0300893221002669/v1_202112230550/es/main.assets/thumbnail/gr2.jpeg?xkr=eyJpdiI6Ikc2dWNnUlFBbGNpR3dBUjdQNHR6TXc9PSIsInZhbHVlIjoiWjYzRjlJZ3FlTEMyTnQveVdMb2Z3VGh1Z0ZEZHB0dWhsZ044blUvazRnaz0iLCJtYWMiOiI4YWE2OTA4ZGM0NzJlNjk1YzUwNDNkM2U5MjFjMmNkNzY5MWFlMDk4NDQ2MTllNTM3MjA5ZTVmNGEzOGJkZjNiIiwidGFnIjoiIn0=)