En estudios previos se ha descrito que la intervención coronaria aplicada a lesiones complejas presenta una correlación independiente con las hemorragias mayores. La puntuación SYNTAX es un instrumento angiográfico utilizado para evaluar el grado de complejidad de las enfermedades arteriales coronarias. El objetivo de este estudio es evaluar la capacidad de la puntuación SYNTAX para predecir hemorragias mayores tras el implante de stents liberadores de fármacos.
MétodosSe analizó a un total de 722 pacientes sometidos a implante de stents liberadores de fármacos de una población de pacientes consecutivos incluidos en el estudio entre enero de 2007 y abril de 2010. Se investigó la incidencia de hemorragias mayores y trombosis del stent durante un periodo de 2 años. La hemorragia mayor se evaluó mediante la puntuación CRUSADE y los criterios del Bleeding Academic Research Consortium. Se estratificó a los pacientes en los siguientes grupos según los criterios del ensayo SYNTAX: baja (≤ 22; n=484), intermedia (23-32; n=128) y alta (≥ 33; n=110).
ResultadosSe observaron hemorragias mayores en 47 pacientes (6,5%) en el periodo de estudio de 2 años, y hubo 12 episodios de trombosis del stent (1,7%). Las tasas de hemorragia mayor en los pacientes de los terciles bajo, intermedio y alto de la puntuación SYNTAX fueron del 2,9, el 7,8 y el 20,9% respectivamente (p<0,0001). La puntuación SYNTAX mostró una hazard ratio ajustada de hemorragia mayor a los 2 años de 1,81 (intervalo de confianza del 95%, 1,27-2,57). El valor predictivo del área bajo la curva de características operativas del receptor ajustada por hemorragia mayor mejoró significativamente tras la inclusión de la puntuación CRUSADE (estadístico C, 0,890 frente a 0,812).
ConclusionesAunque la puntuación SYNTAX puede predecir el riesgo de hemorragias mayores, el valor predictivo de la puntuación CRUSADE fue superior. Estas puntuaciones pueden resultar de utilidad en la toma de decisiones clínicas respecto a las estrategias de revascularización y la duración óptima del tratamiento antiagregante plaquetario doble tras implante de stents liberadores de fármacos.
Palabras clave
La hemorragia mayor es una de las complicaciones más frecuentes de la intervención coronaria percutánea (ICP) y el tratamiento antitrombótico1. En la era de los stents metálicos sin recubrimiento, la incidencia de hemorragia mayor tras la ICP era de hasta un 5,4%, lo cual está próximo a la incidencia de eventos adversos cardiacos mayores como muerte, infarto de miocardio y nueva ICP por isquemia2. En los últimos años, se han utilizado pautas de tratamiento antiagregante plaquetario más agresivas y un tratamiento antiagregante plaquetario doble (TAPD) prolongado, con el objetivo de reducir la incidencia de eventos trombóticos tras la ICP. Sin embargo, estas estrategias aumentan el riesgo de complicaciones hemorrágicas3–5. Es importante señalar que las complicaciones hemorrágicas tras la ICP se han asociado con aumento del riesgo de ulteriores resultados adversos, como infarto de miocardio, ictus y muerte6,7. En consecuencia, el riesgo hemorrágico debe contraponerse a los efectos beneficiosos antitrombóticos de estos tratamientos. El ensayo SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery (SYNTAX) fue el primero en que se comparó la cirugía de revascularización aortocoronaria con el implante de stents liberadores de fármaco (SLF) en pacientes con enfermedad de la coronaria principal izquierda y afección de tres vasos. La puntuación SYNTAX (SXscore) es un instrumento angiográfico utilizado para evaluar el grado de complejidad de la enfermedad coronaria8. En un estudio previo, se ha descrito que la ICP de lesiones complejas se correlaciona de manera independiente con las hemorragias mayores9. Así pues, el objetivo de este estudio es evaluar la capacidad de la SXscore de predecir hemorragias mayores tras implante de SLF.
MÉTODOSEntre enero de 2007 y abril de 2010, se trató en el Ohashi Hospital a un total de 845 pacientes consecutivos con enfermedad coronaria mediante implante de SLF. En este estudio se incluyó a todos los pacientes, incluso los que presentaban enfermedad coronaria estable crónica o un síndrome coronario agudo, lo cual refleja lo que sucede en la práctica clínica ordinaria. Se excluyó del estudio a los pacientes con enfermedades malignas, aumento del riesgo de hemorragia (ictus en los 3 meses previos, hemorragia activa, traumatismo reciente o cirugía mayor en el mes anterior) o con contraindicaciones para el uso de un TAPD prolongado (de hasta 12 meses), así como a los pacientes tratados con stents metálicos sin recubrimiento, angioplastia con balón o a los que se había practicado cirugía de revascularización aortocoronaria. También se excluyó a los pacientes a los que no se pudo evaluar con la SXscore y la angiografía realizada. Se analizó a un total de 722 pacientes a los que se implantó SLF. Los datos clínicos y de la intervención se incluyeron de manera prospectiva en una base de datos y se analizaron retrospectivamente. Todos los pacientes dieron su consentimiento informado por escrito.
Tratamiento de implante de stents y tras la intervenciónSe administró a los pacientes programados para ICP una dosis diaria de ácido acetilsalicílico (100mg) y clopidogrel (75mg) durante al menos los 3 días previos a la intervención. En los casos de angina inestable o ICP urgente en las 48h posteriores al ingreso, se administró una dosis de carga de 300mg de clopidogrel antes de la intervención. En todos los pacientes, se utilizó una inyección en bolo de heparina (100 UI/kg) después de la introducción de la vaina y se ajustó la dosis para mantener un tiempo de coagulación activado > 250 s durante toda la intervención. Dado el carácter observacional de este estudio, se dejó al criterio del cardiólogo qué tipo de SLF utilizar (stents liberadores de sirolimus, paclitaxel, zotarolimus o everolimus). Después del implante del stent, se aplicó una técnica de hinchado de balón a alta presión, para alcanzar unos resultados angiográficos satisfactorios con estenosis residual <25% en la estimación visual. Todos los pacientes recibieron 100mg de ácido acetilsalicílico y 75mg de clopidogrel al día durante ≥ 12 meses. La continuación del TAPD y las demás medicaciones cardiacas se prescribieron según el criterio del médico.
Puntuación SYNTAX y análisis angiográficoEn función de lo observado en las angiografías diagnósticas iniciales, se puntuó por separado cada lesión coronaria causante de una estenosis ≥ 50% del diámetro en los vasos ≥ 1,5mm A continuación se sumaron estas puntuaciones para obtener la SXscore general, que se calculó con el algoritmo disponible en la página web del SYNTAX10. Las SXscore de los pacientes las determinaron de manera independiente dos cardiólogos intervencionistas experimentados que no conocían los datos clínicos y tenían experiencia en el cálculo de las SXscore de > 100 pacientes antes de colaborar en este estudio. La variabilidad interobservadores en la estimación de las SXscore fue κ=0,75, mientras que la variabilidad intraobservador fue κ=0,86. En caso de que se produjera una discrepancia respecto a las SXscore, se utilizaba como valor final la media de los valores aportados por los dos evaluadores11.
Definiciones y seguimientoEl objetivo principal fue la incidencia de hemorragia mayor en los 2 años tras la ICP. Se aplicaron los criterios del Bleeding Academic Consortium (BARC), y se definió hemorragia mayor como la correspondiente a los tipos BARC 3 o 5. De forma resumida, los episodios de hemorragia de tipo 3a incluyeron la hemorragia manifiesta junto con una disminución de la hemoglobina (de 3 g/dl a < 5 g/dl) y cualquier transfusión con hemorragia manifiesta. Los episodios hemorrágicos de tipo 3b incluyeron hemorragia manifiesta junto con disminución de la hemoglobina ≥ 5g/dl, taponamiento cardiaco, hemorragia con necesidad de intervención quirúrgica para controlarla y hemorragia con necesidad de fármacos vasoactivos. Los episodios hemorrágicos de tipo 3c incluyeron hemorragia intracraneal con subcategorías confirmadas mediante autopsia, exploraciones de imagen o punción lumbar y hemorragia intraocular con riesgo para la vista. Los episodios hemorrágicos de tipo 5a incluyeron la hemorragia probablemente mortal sospechada clínicamente pero sin confirmación mediante autopsia ni exploraciones de imagen. Los episodios hemorrágicos de tipo 5b incluyeron hemorragia mortal establecida de manera definitiva, hemorragia manifiesta y la confirmación mediante autopsia o técnicas de imagen12. Además, los episodios hemorrágicos se evaluaron con la puntuación de hemorragia Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes With Early Implementation of the American College of Cardiology/American Heart Association Guidelines (CRUSADE)13,14. La puntuación CRUSADE se calculó a partir de las características basales de los pacientes (sexo femenino, diabetes mellitus, enfermedad vascular previa, frecuencia cardiaca, presión arterial sistólica, insuficiencia cardiaca congestiva, hematocrito y aclaramiento de creatinina estimado). El objetivo secundario fue la trombosis del stent establecida de manera definitiva que se diagnosticaba como síndrome coronario agudo con documentación angiográfica de una oclusión o un trombo del vaso diana, en el interior o en una zona adyacente al segmento tratado anteriormente con implante de stent, aplicando la definición del BARC15. Se consideró muerte cardiaca cualquier evento mortal no atribuido a una causa no cardiaca. El seguimiento de los pacientes se mantuvo durante ≥ 2 años tras el implante del stent.
Análisis estadísticoLos datos se presentan en forma de media ± desviación estándar o porcentajes. Las diferencias entre los grupos se evaluaron mediante la prueba de la t de Student bilateral para datos no apareados en el caso de las variables continuas y de la χ2 para las variables discretas. Se llevó a cabo un análisis de supervivencia con el método de Kaplan-Meier, y las diferencias se evaluaron mediante el test de log rank. Se aplicaron modelos de riesgos proporcionales de Cox univariables y multivariables para evaluar las correlaciones independientes de la hemorragia mayor y la trombosis del stent. Todas las variables que se incluyeron en los modelos se muestran en la tabla 1. Las variables continuas se transformaron en datos binarios, asignando el valor «1» a un factor de riesgo que se asume presente y el valor «0» en caso contrario. Por ejemplo, la edad se dicotomizó en grupos de ancianos y no ancianos (> 75 frente a ≤ 75 años) y la fracción de eyección, en grupos de baja o normal (< 40 frente a ≥ 40%). Además, para evitar la arbitrariedad, se utilizó la mediana de valores de cada factor continuo (índice de masa corporal, longitud del stent, longitud de la lesión, etc.) como valor de corte para esa división. Por lo que respecta a las SXscore, las puntuaciones CRUSADE, la frecuencia cardiaca y el filtrado glomerular, se estableció 10 como unidad de medida. Finalmente, se introdujo un ajuste para el cálculo de las hazard ratio (HR) y los intervalos de confianza del 95% (IC95%) solo con las variables clínicamente relevantes con valores de p<0,05 en el análisis univariable. Se realizó un análisis del área bajo la curva de características operativas del receptor para determinar la capacidad de la SXscore y la puntuación CRUSADE para diferenciar a los pacientes con y sin hemorragias mayores. Se consideró que un valor del estadístico C>0,7 tenía una capacidad de discriminación aceptable. Todos los análisis se hicieron con el programa estadístico IBM-SPSS versión 19 y el paquete de software estadístico R. Se consideró que un valor de p<0,05 indicaba significación estadística.
Características iniciales individuales, angiográficas y de la intervención, con o sin hemorragia mayor
| Hemorragia (n=47) | Sin hemorragia (n=675) | p | |
| Edad (años) | 76±9 | 69±10 | < 0,0001 |
| Edad>75 años | 29 (62) | 204 (30) | < 0,0001 |
| Mujeres | 18 (38) | 149 (22) | 0,02 |
| Hipertensión | 40 (85) | 530 (79) | 0,26 |
| Diabetes mellitus | 22 (47) | 280 (41) | 0,54 |
| Usuarios de insulina | 6 (13) | 79 (12) | 0,81 |
| Dislipemia | 25 (53) | 401 (59) | 0,35 |
| Clase Killip ≥ 2 | 13 (28) | 33 (5) | < 0,0001 |
| Presión arterial sistólica (mmHg) | 134±24 | 135±17 | 0,76 |
| Frecuencia cardiaca (lpm) | 78±16 | 70±12 | < 0,0001 |
| Hematocrito (%) | 34,3±5,4 | 39,0±4,9 | < 0,0001 |
| Hematocrito < 36% | 31 (66) | 174 (26) | < 0,0001 |
| Índice de masa corporal | 22,0±3,5 | 23,7±3,3 | 0,0009 |
| Índice de masa corporal < 23,5 | 31 (66) | 329 (49) | 0,02 |
| FGe (ml/min) | 51,8±33,7 | 78,9±32,5 | < 0,0001 |
| Enfermedad renal crónica | 29 (62) | 157 (23) | < 0,0001 |
| Hemodiálisis | 11 (23) | 69 (10) | 0,01 |
| Síndrome coronario agudo | 27 (57) | 290 (43) | 0,07 |
| Puntuación CRUSADE | 51,3±18,9 | 27,2±15,3 | < 0,0001 |
| Infarto de miocardio previo | 13 (28) | 144 (21) | 0,33 |
| FEVI (%) | 53,2±16,9 | 60,7±13,4 | 0,0003 |
| FEVI < 40% | 15 (32) | 77 (11) | 0,0003 |
| Afección de múltiples vasos coronarios | 41 (87) | 417 (62) | 0,0003 |
| Medicaciones | |||
| TAPD>1 año | 41 (87) | 572 (85) | 0,83 |
| TAP en monoterapia>1 año | 6 (13) | 103 (15) | 0,83 |
| Estatinas | 37 (79) | 561 (83) | 0,43 |
| Warfarina | 6 (13) | 53 (8) | 0,26 |
| IECA/ARA-II | 34 (72) | 494 (73) | 0,87 |
| Bloqueadores beta | 9 (19) | 208 (31) | 0,12 |
| Inhibidores de la bomba de protones | 33 (70) | 449 (67) | 0,73 |
| Antagonistas de receptores de histamina 2 | 4 (9) | 80 (12) | 0,68 |
| Lesión diana | |||
| Arteria coronaria principal izquierda | 6 (13) | 70 (10) | 0,15 |
| Descendente anterior izquierda | 18 (38) | 283 (42) | |
| Circunfleja izquierda | 3 (6) | 114 (17) | |
| Derecha | 20 (43) | 208 (31) | |
| Lesiones de tipo B2/C | 38 (81) | 486 (72) | 0,13 |
| Puntuación SYNTAX | 32,0±17,0 | 17,6±12,3 | < 0,0001 |
| Flujo TIMI 0/1 | 14 (30)/1 (2) | 173 (26)/16 (2) | 0,82 |
| Flujo TIMI 2/3 | 2 (4)/30 (64) | 48 (7)/438 (65) | |
| Lesión de oclusión total crónica | 7 (15) | 82 (12) | 0,64 |
| Lesión bifurcada | 16 (34) | 250 (37) | 0,76 |
| Lesión muy calcificada | 10 (21) | 146 (22) | 0,84 |
| Tamaño del vaso (mm) | 2,62±0,59 | 2,80±0,56 | 0,13 |
| Diámetro luminal mínimo (mm) | 0,69±0,45 | 0,77±0,49 | 0,41 |
| Estenosis diametral (%) | 73±17 | 73±17 | 0,90 |
| Longitud de la lesión (mm) | 27,9±21,3 | 24,3±15,1 | 0,25 |
| Acceso vascular | |||
| Femoral | 40 (85) | 480 (71) | 0,05 |
| Radial | 5 (11) | 184 (27) | 0,01 |
| Humeral | 2 (4) | 11 (2) | 0,41 |
| Stents liberadores de fármacos utilizados | |||
| Stent liberador de sirolimus | 14 (30) | 193 (29) | 0,80 |
| Stent liberador de paclitaxel | 26 (55) | 393 (58) | |
| Stent liberador de zotarolimus | 3 (6) | 53 (8) | |
| Stent liberador de everolimus | 4 (9) | 36 (5) | |
| Diámetro del stent (mm) | 3,1±0,4 | 3,1±0,4 | 0,47 |
| Número de stents | 1,8±0,9 | 1,6±0,8 | 0,06 |
| Longitud total del stent (mm) | 41±24 | 35±21 | 0,07 |
ARA-II: antagonistas del receptor de la angiotensina II; CRUSADE: Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes With Early Implementation of the American College of Cardiology/American Heart Association Guidelines; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; IECA: inhibidores de la enzima de conversión de la angiotensina; SYNTAX: SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery; TAP: tratamiento antiagregante plaquetario; TAPD: tratamiento antiagregante plaquetario doble; TIMI: Thrombolysis In Myocardial Infarction.
Los valores expresan n (%) o media ± desviación estándar.
La media de edad de los pacientes era 69 años, el 23% eran mujeres, el 42% tenía diabetes mellitus y el 44% presentaba síndromes coronarios agudos. Se registró afección de la coronaria principal izquierda y lesiones de oclusión total crónica en un 12% de los pacientes en cada caso. La mayoría de los casos (87%) se trató con SLF de primera generación. La gama de valores de SXscore posibles fue 1,0-75,5 (media, 18,5±13,2; mediana, 15). La mediana [intervalo intercuartílico] de la puntuación CRUSADE fue 25 [18-38].
Características de los pacientesEn la tabla 1 se presentan las características clínicas basales de los pacientes de los grupos con hemorragia (n=47) y sin hemorragia (n=675). Los pacientes del grupo de hemorragia eran de más edad, incluían un mayor porcentaje de mujeres y tenían más probabilidad de estar en clase Killip ≥ 2 y tener múltiples vasos coronarios afectados y enfermedad renal crónica que los pacientes del grupo sin hemorragia. El índice de masa corporal, el hematocrito y la fracción de eyección del ventrículo izquierdo de los pacientes del grupo con hemorragias fueron significativamente inferiores que los del grupo sin hemorragia. Además, tanto la SXscore como la puntuación CRUSADE fueron significativamente superiores en el grupo con hemorragia que en el grupo sin hemorragia. Con la excepción de la intervención por vía transradial, no hubo diferencias significativas entre los grupos en cuanto a los factores relativos a la intervención.
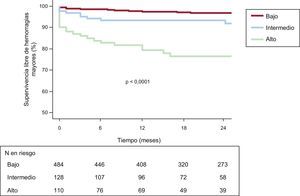
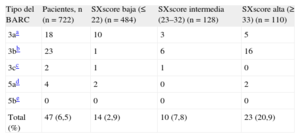
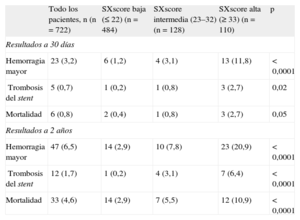
Puntuación SYNTAX y resultados clínicos a 2 añosSe dispuso de datos de seguimiento clínico completos del 93% de los pacientes a 1 año y del 81% a los 2 años. Un total de 613 pacientes (84,9%) utilizaron un TAPD prolongado hasta 2 años después de la ICP. Tal como se indica en la tabla 2, se dividió a los pacientes en 3 grupos según la puntuación del ensayo SYNTAX original: baja (≤ 22; n=484), intermedia (23-32; n=128) y alta (≥ 33; n=110). Se registró una hemorragia mayor según los criterios BARC en 47 pacientes (el 6,5%; tipo 3a, n=18; tipo 3b, n=23; tipo 3c, n=2; tipo 5a, n=4; tipo 5b, n=0). Respecto al momento de aparición de las complicaciones hemorrágicas, 23 pacientes (49%) presentaron una hemorragia mayor en los 30 días siguientes a la intervención, los 24 restantes (51%) tuvieron la hemorragia mayor entre 30 días y 2 años después de la intervención (tabla 3). Por lo que respecta al TAPD en el momento de producirse la hemorragia mayor, los 47 pacientes con hemorragia mayor estaban en tratamiento con TAPD. Por otro lado, se había producido trombosis del stent a los 2 años en 12 pacientes (1,7%); 3 de los cuales tuvieron relación con el cese del tratamiento antiagregante plaquetario. Las tasas de mortalidad fueron del 0,8% a los 30 días y el 4,6% a los 2 años de la ICP respectivamente (tabla 3). En la figura 1 se muestran las curvas de supervivencia de los pacientes que no tuvieron hemorragias mayores en los 3 terciles de la SXscore. La incidencia de hemorragia mayor a los 2 años fue del 20,9% (n=23) de los pacientes con SXscore altas, el 7,8% (n=10) de los pacientes con SXscore intermedias y el 2,9% (n=14) de las SXscore bajas (tabla 3). De igual modo, entre los pacientes con SXscore altas se produjo trombosis del stent con mayor frecuencia (6,4%; n=7) que entre los pacientes con SXscore intermedias (3,1%; n=4) o bajas (0,2%; n=1) (p<0,0001). El análisis del área bajo la curva puso de manifiesto también que la SXscore (estadístico C=0,751; IC95%, 0,674-0,828; p<0,0001) y la puntuación CRUSADE (estadístico C=0,835; IC95%, 0,774-0,897; p<0,0001) tenían una capacidad de discriminación suficiente para diferenciar a los pacientes con y sin hemorragias mayores.
Incidencia de hemorragias mayores según la definición del Bleeding Academic Research Consortium
| Tipo del BARC | Pacientes, n (n=722) | SXscore baja (≤ 22) (n=484) | SXscore intermedia (23–32) (n=128) | SXscore alta (≥ 33) (n=110) |
| 3aa | 18 | 10 | 3 | 5 |
| 3bb | 23 | 1 | 6 | 16 |
| 3cc | 2 | 1 | 1 | 0 |
| 5ad | 4 | 2 | 0 | 2 |
| 5be | 0 | 0 | 0 | 0 |
| Total (%) | 47 (6,5) | 14 (2,9) | 10 (7,8) | 23 (20,9) |
BARC: Bleeding Academic Research Consortium; SXscore: puntuación SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery.
Hemorragia manifiesta más reducción de la hemoglobina de 3 a < 5 g/dl. Cualquier transfusión con hemorragia manifiesta.
Hemorragia manifiesta más reducción de la hemoglobina ≥ 5 g/dl, taponamiento cardiaco, hemorragia que requiere intervención quirúrgica para controlarla y hemorragia que requiere el empleo de fármacos vasoactivos intravenosos.
Hemorragia intracraneal, subcategorías confirmadas mediante autopsia o exploraciones de imagen o punción lumbar y hemorragia intraocular que compromete la vista.
Resultados clínicos a los 30 días y en el seguimiento de 2 años en los 3 grupos
| Todo los pacientes, n (n=722) | SXscore baja (≤ 22) (n=484) | SXscore intermedia (23–32) (n=128) | SXscore alta (≥ 33) (n=110) | p | |
| Resultados a 30 días | |||||
| Hemorragia mayor | 23 (3,2) | 6 (1,2) | 4 (3,1) | 13 (11,8) | < 0,0001 |
| Trombosis del stent | 5 (0,7) | 1 (0,2) | 1 (0,8) | 3 (2,7) | 0,02 |
| Mortalidad | 6 (0,8) | 2 (0,4) | 1 (0,8) | 3 (2,7) | 0,05 |
| Resultados a 2 años | |||||
| Hemorragia mayor | 47 (6,5) | 14 (2,9) | 10 (7,8) | 23 (20,9) | < 0,0001 |
| Trombosis del stent | 12 (1,7) | 1 (0,2) | 4 (3,1) | 7 (6,4) | < 0,0001 |
| Mortalidad | 33 (4,6) | 14 (2,9) | 7 (5,5) | 12 (10,9) | < 0,0001 |
SXscore: puntuación SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery.
Curvas de Kaplan-Meier en las que se muestra la supervivencia sin hemorragias mayores según puntuación SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery. Se estratificó a los pacientes en los siguientes grupos según los criterios del ensayo SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery: baja, ≤ 22; intermedia, 23-32; alta, ≥ 33.
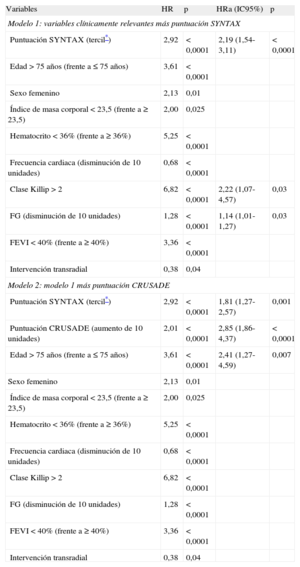
Se utilizó el modelo de riesgos proporcionales de Cox para identificar los factores independientes predictivos de hemorragias mayores y trombosis del stent a los 2 años. Se incluyeron en el modelo las variables indicadas en la tabla 1 que en la situación inicial diferían entre los dos grupos con p<0,05. Tal como se muestra en la tabla 4, el modelo 1 con las variables clínicamente relevantes y la SXscore identificó que dicha puntuación es un factor independiente correlacionado con las hemorragias mayores a 2 años (HR=2,19; IC95%, 1,54-3,11; p<0,0001 para el tercil de SXscore). Además, el modelo 2, que consistió en la adición de la puntuación CRUSADE al modelo 1, puso de manifiesto que tanto la SXscore como la puntuación CRUSADE son factores independientes predictivos de hemorragias mayores.
Dos modelos de análisis de riesgos proporcionales de Cox de hemorragias mayores a 2 años
| Variables | HR | p | HRa (IC95%) | p |
| Modelo 1: variables clínicamente relevantes más puntuación SYNTAX | ||||
| Puntuación SYNTAX (tercil*) | 2,92 | < 0,0001 | 2,19 (1,54-3,11) | < 0,0001 |
| Edad>75 años (frente a ≤ 75 años) | 3,61 | < 0,0001 | ||
| Sexo femenino | 2,13 | 0,01 | ||
| Índice de masa corporal < 23,5 (frente a ≥ 23,5) | 2,00 | 0,025 | ||
| Hematocrito < 36% (frente a ≥ 36%) | 5,25 | < 0,0001 | ||
| Frecuencia cardiaca (disminución de 10 unidades) | 0,68 | < 0,0001 | ||
| Clase Killip>2 | 6,82 | < 0,0001 | 2,22 (1,07-4,57) | 0,03 |
| FG (disminución de 10 unidades) | 1,28 | < 0,0001 | 1,14 (1,01-1,27) | 0,03 |
| FEVI < 40% (frente a ≥ 40%) | 3,36 | < 0,0001 | ||
| Intervención transradial | 0,38 | 0,04 | ||
| Modelo 2: modelo 1 más puntuación CRUSADE | ||||
| Puntuación SYNTAX (tercil*) | 2,92 | < 0,0001 | 1,81 (1,27-2,57) | 0,001 |
| Puntuación CRUSADE (aumento de 10 unidades) | 2,01 | < 0,0001 | 2,85 (1,86-4,37) | < 0,0001 |
| Edad>75 años (frente a ≤ 75 años) | 3,61 | < 0,0001 | 2,41 (1,27-4,59) | 0,007 |
| Sexo femenino | 2,13 | 0,01 | ||
| Índice de masa corporal < 23,5 (frente a ≥ 23,5) | 2,00 | 0,025 | ||
| Hematocrito < 36% (frente a ≥ 36%) | 5,25 | < 0,0001 | ||
| Frecuencia cardiaca (disminución de 10 unidades) | 0,68 | < 0,0001 | ||
| Clase Killip>2 | 6,82 | < 0,0001 | ||
| FG (disminución de 10 unidades) | 1,28 | < 0,0001 | ||
| FEVI < 40% (frente a ≥ 40%) | 3,36 | < 0,0001 | ||
| Intervención transradial | 0,38 | 0,04 | ||
CRUSADE: Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes With Early Implementation of the American College of Cardiology/American Heart Association Guidelines; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; HR: hazard ratio; HRa: hazard ratio ajustada; IC95%: intervalo de confianza del 95; SYNTAX: SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery.
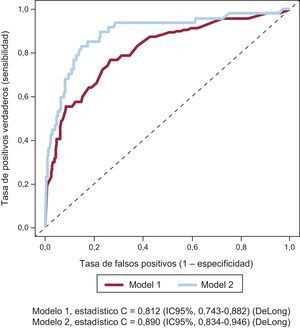
El valor predictivo de la SXscore y la puntuación CRUSADE por lo que respecta a la hemorragia mayor se evaluó calculando el área bajo la curva ajustada en los modelos multivariables 1 y 2. Las áreas bajo la curva ajustadas de los modelos 1 y 2 mostraron una capacidad de discriminación adecuada para diferenciar a los pacientes con y sin hemorragia mayor (modelo 1:C=0,812; modelo 2:C=0,890) (figura 2). Sin embargo, el modelo 2, en el que se añadió la puntuación CRUSADE, mejoró significativamente el estadístico C para la predicción de hemorragias mayores respecto al modelo 1 (z=–2,57; p=0,01).
Curvas de características operativas del receptor ajustadas para predecir hemorragias mayores a los 2 años según los modelos 1 y 2. IC95%: intervalo de confianza del 95%. Modelo 1: variables clínicamente relevantes más puntuación SYNergy between percutaneous coronary intervention with TAXus and cardiac surgery. Modelo 2: modelo 1 más puntuación Can Rapid Risk Stratification of Unstable Angina Patients Suppress Adverse Outcomes With Early Implementation of the American College of Cardiology/American Heart Association Guidelines.
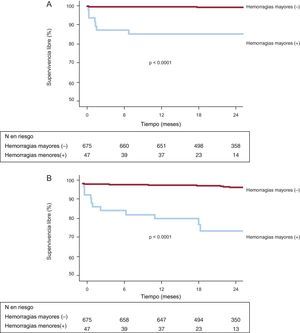
Los factores independientes con valor predictivo de trombosis del stent a los 2 años fueron la SXscore (tercil; HR=4,39; IC95%, 2,02-9,50; p=0,0002) y la lesión muy calcificada (HR=3,97; IC95%, 1,26-12,52; p=0,02). Según hubiera hemorragia mayor o no, las curvas de supervivencia libre de eventos de las figuras 3A y 3B indican que los pacientes con una hemorragia mayor tuvieron una incidencia significativamente mayor de muerte cardiaca (el 14,9 frente al 1,0%; p<0,0001) y muerte por cualquier causa (el 23,4 frente al 2,5%) a los 2 años.
DISCUSIÓNEste estudio es el primero que evalúa la SXscore como factor predictivo de hemorragias mayores según los criterios BARC en una cohorte formada por todos los pacientes consecutivos tratados con implante de SLF. Los resultados principales de este estudio son: a) SXscore presentó una asociación significativa con el aumento de riesgo de hemorragia mayor a los 2 años de la ICP; sin embargo, la puntuación CRUSADE mostró un valor predictivo de hemorragias mayores superior al de la SXscore en la población de este estudio; una SXscore más alta fue un factor independiente predictivo de hemorragias mayores a los 2 años aun después de haber introducido un ajuste respecto a las variables clínicas; tal como se preveía, los pacientes con hemorragia mayor mostraron una asociación significativa con un aumento del riesgo de muerte cardiaca y muerte por cualquier causa a los 2 años, y b) una SXscore más alta se asoció también a un aumento de las trombosis de stent durante los 2 años de seguimiento, si bien la puntuación CRUSADE no tuvo valor predictivo respecto a la aparición de trombosis del stent.
Las complicaciones hemorrágicas tras el implante de un SLF continúan siendo un reto1. La preocupación generada por los eventos trombóticos tardíos, en especial la trombosis del stent muy tardía, ha estimulado el uso de un TAPD de mayor duración y antiagregantes plaquetarios más potentes4. Sin embargo, las pautas de tratamiento antiagregante plaquetario agresivas y el TAPD prolongado se asocian a un aumento del riesgo de complicaciones hemorrágicas5. En consecuencia, teniendo en cuenta el aumento del riesgo de hemorragia, las pautas actuales de tratamiento antiagregante plaquetario deben usarse con precaución. Las complicaciones hemorrágicas pueden conducir a la muerte del paciente o, como mínimo, a la retirada del tratamiento antiagregante plaquetario, lo cual puede aumentar el riesgo de episodios trombóticos. Este estudio ha mostrado una incidencia de mortalidad a los 2 años más alta entre los pacientes con hemorragias mayores. Los resultados coinciden con los de un metanálisis previo de 4 ensayos aleatorizados que demostró que la hemorragia tras la ICP tiene repercusiones pronósticas en la mortalidad a 1 año tras la intervención16.
La puntuación hemorrágica más ampliamente aceptada, la CRUSADE, se calculó a partir de las características de los pacientes y los valores analíticos de laboratorio en situación basal, mientras que la relación entre las complicaciones hemorrágicas y la complejidad de la lesión no se ha estudiado bien en pacientes tratados con implante de SLF y TAPD13. La SXscore es un nuevo instrumento angiográfico que permite cuantificar el grado de aterosclerosis en todo el árbol arterial coronario, incluidas las lesiones culpables10. En este estudio se observó una relación entre valores de SXscore mayores y riesgo de hemorragia mayor. Aunque no está clara la razón de que valores altos de SXscore tengan relación con el aumento del riesgo de hemorragia mayor; esta asociación puede explicarse por la mayor duración de la intervención y por las técnicas más complicadas que son necesarias en los pacientes con una aterosclerosis coronaria más extensa y compleja, que haría esperable un aumento del riesgo de hemorragia. De hecho, en este estudio, aproximadamente la mitad de las complicaciones hemorrágicas se observaron en los primeros 30 días tras la intervención. Sin embargo, después de los primeros 30 días, el número de pacientes con hemorragia mayor fue aumentando gradualmente hasta los 2 años. Por lo que respecta a este resultado, la duración del TAPD necesaria para reducir la incidencia de complicaciones hemorrágicas después del implante de un SLF continúa siendo objeto de controversia.
Equilibrio apropiado de los riesgos de hemorragia mayor y trombosis del stent en los tres gruposPor lo que respecta al riesgo de episodios trombóticos como la trombosis del stent y el infarto de miocardio, los estudios de registro y observacionales han mostrado que el TAPD no es necesario más allá de los primeros 6 meses17,18. El ensayo PRODIGY puso de relieve también que el empleo prolongado de un TAPD se asocia a tasas de episodios hemorrágicos y transfusiones de sangre más altas, sin los efectos protectores de reducción del riesgo de eventos trombóticos19. Se ha observado que la incidencia de trombosis del stent fue muy baja entre los pacientes con SXscore bajas e intermedias. En consecuencia, estos pacientes de bajo riesgo deben pasar lo antes posible del TAPD a un tratamiento antiagregante plaquetario en monoterapia, como ácido acetilsalicílico en dosis bajas, para evitar las complicaciones hemorrágicas. Por el contrario, los pacientes con SXscore alta del presente estudio presentaron incidencias tanto de hemorragia mayor como de trombosis del stent significativamente superiores. En otras palabras, en la ICP llevada a cabo en pacientes con una SXscore alta, aún queda hacer frente al dilema irresoluble de si continuar o no con el TAPD más allá de los primeros 12 meses tras la ICP20. En consecuencia, los resultados del ensayo SYNTAX, junto con los del presente estudio, indican que los pacientes con puntuaciones altas y lechos de los vasos distales adecuados quizá fueran candidatos más apropiados para la cirugía de revascularización aortocoronaria, con la excepción de los pacientes con riesgo quirúrgico elevado e ICP factible. Actualmente están en curso múltiples ensayos clínicos aleatorizados en los que se examina la duración óptima de un TAPD después del implante de SLF21–23. Para poder determinar si la duración del TAPD debe continuar más allá de los primeros 6 o 12 meses después de la ICP, será necesario esperar a los resultados de esos ensayos.
LimitacionesEl presente estudio tiene ciertas limitaciones. En primer lugar, se llevó a cabo en un solo centro de estudio y con un tamaño muestral reducido. Sin embargo, hasta donde se sabe no hay otros estudios en los que se haya evaluado la hemorragia mayor después del implante de un SLF empleando los criterios BARC y la SXscore. Los resultados pueden haberse visto influidos por factores de confusión. Por ejemplo, las decisiones relativas a la duración del TAPD pueden haber sido distintas de un médico responsable a otro. Es de destacar que muchos pacientes (84,9%) recibieron tratamiento con TAPD hasta 2 años después del implante, lo que parece una cifra elevada. La razón podría tener relación con el temor a que aparezca una trombosis del stent muy tardía con el empleo de SLF de primera generación. Además, no se utilizó inhibidores de la glucoproteína IIb/IIIa, prasugrel y bivalirudina. Aunque un 8% de los pacientes del estudio recibieron un tratamiento anticoagulante triple que incluía warfarina, no se observaron diferencias en las complicaciones hemorrágicas. Tal vez el efecto esperado de la warfarina se redujera cuando los pacientes recibían TAPD.
CONCLUSIONESLa SXscore tuvo capacidad predictiva respecto al riesgo de hemorragia mayor en la población total de pacientes consecutivos tratados con implante de SLF. Además, la puntuación CRUSADE tuvo un valor predictivo de hemorragias mayores superior al de la SXscore. En consecuencia, estas puntuaciones pueden ser de utilidad para la toma de decisiones clínicas respecto a la duración óptima del TAPD después de implantar un SLF.
Además, se observó que valores altos de SXscore se asocian con un aumento del riesgo de hemorragia mayor y trombosis del stent. Hoy por hoy se justifica que un equipo cardiaco lo tenga cuidadosamente en cuenta cuando sean necesarias estrategias de revascularización como la ICP o la cirugía de revascularización en pacientes con SXscore altas. Si se aplica una estrategia de revascularización con ICP en un subgrupo de pacientes con valores altos de SXscore, el TAPD debe administrarse tras haber considerado cuidadosamente el esencial equilibrio entre riesgo de episodios trombóticos y riesgo de hemorragia mayor en cada paciente individual.
CONFLICTO DE INTERESESNinguno.