La progresión de la enfermedad coronaria una vez se hace evidente a la clínica tiene una gran variabilidad interindividual. El objetivo es determinar marcadores séricos y genéticos en pacientes con rápida progresión clínica (RPC) de la enfermedad coronaria frente a pacientes con estabilidad clínica mantenida (ECM).
MétodosEstudio retrospectivo de casos (RPC) y controles (ECM) (1:2). Se consideró RPC a los pacientes que precisaron al menos 2 revascularizaciones por progresión de la ateroesclerosis en los 10 años posteriores a una primera angioplastia y ECM a aquellos sin eventos durante el mismo periodo tras la primera angioplastia. Una vez seleccionados, se determinaron los valores séricos, la expresión de ácido ribonucleico mensajero (ARNm) y polimorfismos genéticos de interleucina 6, proteína C reactiva y factor de necrosis tumoral alfa (TNFα) como marcadores de inflamación y proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), receptor de lipoproteínas de baja densidad, proteína 2 de unión a elementos reguladores de esteroles y apolipoproteína B como marcadores aterogénicos.
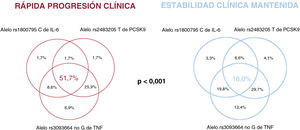
ResultadosSe incluyó a 180 pacientes (58 en RPC y 122 en ECM). Las características basales demográficas, del perfil de riesgo clásico y de la extensión de la enfermedad coronaria fueron comparables. El grupo de RPC presentó valores séricos más altos de interleucina 6 y PCSK9 y mayor expresión de ARNm de TNF. Los alelos de Interleucina-6 rs180075C, de TNF rs3093664 non-G y de PCSK9 rs2483205 T confieren riesgo de RPC (p<0,05 en todos los casos). Un 51,7% de los pacientes del grupo RPC presentaron los tres alelos de riesgo frente al 18% de los pacientes del grupo en ECM (p<0,001).
ConclusionesSe propone la existencia de marcadores genotípicos y fenotípicos asociados con la RPC de enfermedad coronaria y que podrían servir para individualizar la intensidad y el tipo de tratamiento.
Palabras clave
La ateroesclerosis coronaria es una enfermedad crónica cuya presentación clínica, la cardiopatía isquémica, es una de las principales causas de muerte en todo el mundo.
La evolución clínica de los pacientes con cardiopatía isquémica es muy variable, pero debe tenerse en cuenta que la progresión es uno de los factores más importantes que influyen en el pronóstico1,2. Sin embargo, la capacidad de predecir el riesgo de progresión en un paciente determinado es muy limitada. Sería de gran valor poder estimar este riesgo de progresión para caracterizar e individualizar el tipo y la intensidad de las intervenciones de tratamiento y prevención secundaria.
Aunque no existe ninguna definición universal sobre la progresión de la ateroesclerosis, la mayoría de los estudios que describen este fenómeno utilizan un criterio angiográfico: al menos el 10% de reducción del diámetro en al menos 1 lesión preexistente ≥ 50%, o ≥ 30% de reducción del diámetro de una lesión preexistente <50%, o la progresión de una lesión a oclusión total en un corto periodo3–8. Con todo, esta es una definición «anatómica», no necesariamente relacionada con eventos clínicos.
El contexto de progresión rápida implica tanto fenómenos anatómico-fisiológicos (papel de las lesiones complejas) como marcadores inflamatorios4–6,9–12. Numerosos estudios han demostrado que la inflamación está involucrada en la génesis, la progresión y la inestabilidad de la placa ateroesclerótica y marca el camino hacia los síndromes clínicos13–15. También se ha observado una progresión acelerada de la ateroesclerosis en pacientes con enfermedades inflamatorias sistémicas, como la artritis reumatoide16. El papel de las moléculas lipídicas también se ha estudiado en profundidad17–29.
Hasta donde sabemos, el concepto de progresión rápida de la ateroesclerosis coronaria siempre se ha basado en los criterios angiográficos ya mencionados, pero no se ha encontrado ninguna referencia en la bibliografía de la rápida progresión clínica (RPC).
Creemos que esto es una limitación, ya que la progresión en términos anatómicos (en angiografía o imagen intravascular) es mucho más sensible; sin embargo, es un marcador indirecto de lo que es realmente importante: el riesgo de recidiva clínica. Por tanto, una definición basada en la recidiva de eventos clínicos podría ser mucho más válida.
Por ello, este estudio tuvo como objetivo definir a «los pacientes con una rápida progresión clínica» y analizar el fenómeno desde una perspectiva global centrada en sustratos moleculares, principalmente marcadores inflamatorios y moléculas lipídicas. Decidimos no analizar las moléculas trombóticas, ya que nuestro objetivo era centrar nuestro estudio en una fase estable de la enfermedad y hallar los factores fundamentales que están presentes en su transcurso.
MÉTODOSEl RAPROMS (Rapid clinical progressor patient as an emerging clinical entity in patients with coronary atherosclerosis. Exploratory study on possible molecular substrates) es un estudio hospitalario retrospectivo de casos y controles de un solo centro, diseñado para evaluar y comparar el patrón molecular de varios agentes involucrados en la vía de la inflamación o en el metabolismo de las lipoproteínas en 2 grupos de pacientes: aquellos con RPC de ateroesclerosis coronaria (grupo de casos) y aquellos con enfermedad con estabilidad clínica mantenida (ECM) (grupo de controles).
Definiciones de población y subgruposSe consideró que los pacientes con RPC cumplían los siguientes criterios: pacientes vivos con: a) al menos 1 lesión coronaria tratada con una intervención coronaria percutánea (ICP), y b) al menos 2 ICP durante los 10 años siguientes a la primera ICP debido a progresión de la enfermedad (reestenosis excluida) confirmada por arteriografía.
En el grupo de controles, los participantes con ECM debían cumplir todos los siguientes criterios: pacientes vivos a) con al menos 1 lesión coronaria tratados con ICP, y b) sin eventos cardiacos en los 10 años siguientes a la primera ICP, clínicamente asintomáticos de angina a lo largo de ese periodo y con resultados negativos en pruebas no invasivas para detectar isquemia.
Selección de pacientesPara la selección de pacientes, se realizó una búsqueda retrospectiva de toda la base de datos de coronariografías de nuestro centro. A partir de 2007, revisamos tanto de forma consecutiva como retrospectiva las historias de todos los pacientes sometidos a ICP para recopilar información sobre nuevas intervenciones de revascularización o eventos clínicos relevantes en esos pacientes durante los 10 años siguientes. Nuestro hospital es el único especializado de referencia de ICP en la región. Para aumentar la potencia del estudio, y teniendo en cuenta que el grupo de RPC sería menor, se optó por un diseño 1:2 (caso:controles). Los participantes del grupo de controles de ECM fueron emparejados con los casos de RPC por edad y sexo.
Una vez identificados los 2 grupos de pacientes, se contactó con ellos, se les invitó a participar y los que consintieron firmaron el formulario de consentimiento y fueron inscritos en el estudio.
Este estudio fue diseñado, implementado y notificado de acuerdo con los principios éticos establecidos en la Declaración de Helsinki. El protocolo fue aprobado por nuestro Comité de Ética de la Investigación con Medicamentos de Cantabria y una copia de todos los formularios de consentimiento permanece debidamente archivada.
Intervenciones del estudioDatos clínicosSe diseñó un formulario electrónico para recopilar datos sobre el estado clínico de cada paciente en el primer evento de revascularización (evento inicial) y durante los siguientes 10 años, en el cual se recogieron todos los eventos cardiovasculares ocurridos durante ese periodo, independientemente de la necesidad de una nueva revascularización. La información sobre los factores de riesgo cardiovascular tradicionales se recopiló en el momento del evento inicial, así como la aparición de nuevos factores de riesgo durante los siguientes años y su control adecuado o inadecuado a partir de entonces.
Toda la información disponible sobre el tratamiento prescrito a cada participante durante el periodo de estudio se recopiló de la manera más completa posible, haciendo hincapié en el tratamiento relacionado con la cardiopatía isquémica para detectar a potenciales pacientes sin un tratamiento estándar óptimo (debido a la falta de prescripción médica o al escaso cumplimiento terapéutico del paciente). Se anotaron todos los cambios de tratamiento realizados durante el periodo de 10 años.
Se recopiló información sobre la presentación clínica de cada evento que motivó una nueva revascularización, la anatomía coronaria de cada intervención (puntuación SYNTAX y morfología de la lesión) y el tratamiento intervencionista realizado.
Después de firmar el formulario de consentimiento informado, los participantes completaron un cuestionario sociodemográfico y se les extrajo una muestra de sangre. No se les requirió ninguna otra acción.
Se aplicó el cuestionario a los participantes con el objetivo de analizar los aspectos demográficos, socioculturales y sanitarios que podrían afectar a la evolución de la enfermedad.
Análisis de laboratorioSe obtuvieron muestras de sangre de los participantes en una etapa estable (pacientes del grupo de RPC al menos 6 meses después del último evento). Después de una profunda revisión de la bibliografía, se decidió analizar diferentes marcadores de inflamación/ateroesclerosis en 3 ámbitos diferentes (concentración de proteínas, expresión de ácido ribonucleico mensajero [ARNm] y polimorfismos genéticos) para lograr un enfoque más completo de la enfermedad. Se seleccionaron la interleucina 6, la proteína C reactiva (PCR) y el factor de necrosis tumoral alfa (TNFα) como marcadores inflamatorios y la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), el receptor de lipoproteínas de baja densidad (LDL-R), el factor de transcripción de unión a elementos reguladores de esteroles 2 (SREBP2) y la apolipoproteína (Apo) B desde la perspectiva aterogénica. También se obtuvo un perfil lipídico completo. Una explicación más detallada de las técnicas utilizadas para el análisis se puede encontrar en la sección «Métodos» del material adicional. En la tabla 1 del material adicional se presenta una lista de los polimorfismos de un solo nucleótido (SNP) seleccionados en este estudio.
Análisis estadísticosEstudios previos que evaluaron la rápida progresión de la ateroesclerosis coronaria definida por técnica de imagen con el objetivo de identificar su asociación con diversos marcadores inflamatorios o de otro tipo incluyeron a entre 77 y 153 pacientes3–8,30. Por ese motivo en nuestro estudio, que evaluó los marcadores inflamatorios y del metabolismo lipídico en diversas -ómicas, se estimó una muestra de al menos 160 pacientes, con una relación 1:2 entre los grupos de RPC y de ECM.
Las variables continuas se expresan como media ± desviación estándar. Se obtuvo la mediana [intervalo intercuartílico] de todas las variables con distribución no normal. La distribución paramétrica o no paramétrica de las variables probadas se analizó con la prueba de Kolmogorov-Smirnov. Las variables cualitativas se expresan como porcentajes. Los análisis estadísticos específicos utilizados en los resultados de los análisis de laboratorio se pueden encontrar en la sección «Métodos» del material adicional. La fuerza de las asociaciones se estimó mediante odds ratio (OR) e intervalos de confianza del 95% (IC95%), y los resultados se ajustaron por edad, sexo, diabetes mellitus, tabaquismo e hipertensión mediante regresión lineal.
La significación estadística se estableció en p < 0,05. Los análisis estadísticos se realizaron con el software SPSS 24.0 (Statistical Package for Social Sciences, Estados Unidos) y el software estadístico STATA 12/SE (Stata Corp., Estados Unidos).
RESULTADOSDe toda la base de datos de coronariografías en nuestro centro, se identificó a los primeros 70 pacientes que cumplían los criterios de RPC; 61 de ellos aceptaron participar y firmaron el formulario de consentimiento informado. Se emparejó a estos pacientes con 122 participantes con ECM. Al final se pudo procesar 58 muestras del grupo RPC y todas las muestras del grupo de ECM (figura 1 del material adicional).
Debido a la ubicación del hospital donde se llevó a cabo el estudio, todos los pacientes pertenecían al mismo grupo étnico (raza blanca).
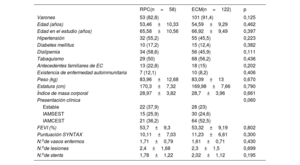
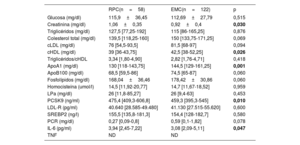
Las características demográficas, el perfil de factores de riesgo y el alcance de la arteriopatía coronaria fueron similares en los 2 grupos. El infarto de miocardio con elevación del segmento ST como presentación clínica fue menos frecuente (tendencia no significativa) en el grupo de RPC (el 36,2 frente al 52,5%; p=0,06) (tabla 1). En la tabla 2 se presentan las concentraciones séricas de marcadores de inflamación/ateroesclerosis y analitos de laboratorio durante una fase estable de la enfermedad de los pacientes. La creatinina estuvo considerablemente más elevada en el grupo de RPC. En cambio, los valores de lipoproteínas de alta densidad y apoA1 fueron significativamente más bajos en el grupo de RPC; en el caso del colesterol unido a lipoproteínas de baja densidad, las cifras fueron igualmente más bajas en este grupo, pero sin alcanzar la significación estadística.
Características demográficas, perfil de factores de riesgo, presentación clínica y grado de la enfermedad coronaria en el primer evento en todos los pacientes
| RPC(n=58) | ECM(n=122) | p | |
|---|---|---|---|
| Varones | 53 (82,8) | 101 (91,4) | 0,125 |
| Edad (años) | 53,46±10,33 | 54,59±9,29 | 0,462 |
| Edad en el estudio (años) | 65,58±10,56 | 66,92±9,49 | 0,397 |
| Hipertensión | 32 (55,2) | 55 (45,5) | 0,223 |
| Diabetes mellitus | 10 (17,2) | 15 (12,4) | 0,382 |
| Dislipemia | 34 (58,6) | 56 (45,9) | 0,111 |
| Tabaquismo | 29 (50) | 68 (56,2) | 0,436 |
| Antecedentes familiares de EC | 13 (22,8) | 18 (15) | 0,202 |
| Existencia de enfermedad autoinmunitaria | 7 (12,1) | 10 (8,2) | 0,406 |
| Peso (kg) | 83,96±12,68 | 83,09±13 | 0,670 |
| Estatura (cm) | 170,3±7,32 | 169,98±7,66 | 0,790 |
| Índice de masa corporal | 28,97±3,82 | 28,7±3,96 | 0,661 |
| Presentación clínica | 0,060 | ||
| Estable | 22 (37,9) | 28 (23) | |
| IAMSEST | 15 (25,9) | 30 (24,6) | |
| IAMCEST | 21 (36,2) | 64 (52,5) | |
| FEVI (%) | 53,7±9,3 | 53,32±9,19 | 0,802 |
| Puntuación SYNTAX | 10,11±7,03 | 11,23±6,61 | 0,300 |
| N.ode vasos enfermos | 1,71±0,79 | 1,61±0,71 | 0,430 |
| N.ode lesiones | 2,4±1,68 | 2,3±1,5 | 0,699 |
| N.ode stents | 1,78±1,22 | 2,02±1,12 | 0,195 |
EC: enfermedad coronaria; ECM: estabilidad clínica mantenida; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; RPC: rápida progresión clínica.
Los valores expresan n (%) o media ± desviación estándar.
Concentraciones séricas de marcadores de inflamación/ateroesclerosis y analitos de laboratorio durante una fase estable de la enfermedad
| RPC(n=58) | EMC(n=122) | p | |
|---|---|---|---|
| Glucosa (mg/dl) | 115,9±36,45 | 112,69±27,79 | 0,515 |
| Creatinina (mg/dl) | 1,06±0,35 | 0,92±0,4 | 0,030 |
| Triglicéridos (mg/dl) | 127,5 [77,25-192] | 115 [86-165,25] | 0,876 |
| Colesterol total (mg/dl) | 139,5 [118,25-160] | 150 [133,75-171,25] | 0,069 |
| cLDL (mg/dl) | 76 [54,5-93,5] | 81,5 [68-97] | 0,094 |
| cHDL (mg/dl) | 39 [36-43,75] | 42,5 [38-52,25] | 0,026 |
| Triglicéridos/cHDL | 3,34 [1,80-4,90] | 2,82 [1,76-4,71] | 0,418 |
| ApoA1 (mg/dl) | 130 [118-143,75] | 144,5 [129-161,25] | 0,001 |
| ApoB100 (mg/dl) | 68,5 [59,5-86] | 74,5 [65-87] | 0,060 |
| Fosfolípidos (mg/dl) | 168,04±36,46 | 178,42±30,86 | 0,060 |
| Homocisteína (umol/l) | 14,5 [11,92-20,77] | 14,7 [11,67-18,52] | 0,959 |
| LPa (mg/dl) | 26 [11,8-85,27] | 26 [9,4-63] | 0,453 |
| PCSK9 (ng/ml) | 475,4 [409,3-606,8] | 459,3 [395,3-545] | 0,010 |
| LDL-R (pg/ml) | 40.640 [28.585-49.480] | 41.130 [27.515-55.620] | 0,600 |
| SREBP2 (ng/l) | 155,5 [135,8-181,3] | 154,4 [128-182,7] | 0,580 |
| PCR (mg/dl) | 0,27 [0,09-0,8] | 0,59 [0,1-1,82] | 0,078 |
| IL-6 (pg/ml) | 3,94 [2,45-7,22] | 3,08 [2,09-5,11] | 0,047 |
| TNF | ND | ND |
Apo: apolipoproteína; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; ECM: estabilidad clínica mantenida; IL–6: interleucina 6; LDL-R: receptor de lipoproteínas de baja densidad; LPa: lipoproteína a; ND: no disponible; PCR: proteína C reactiva; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; RPC: rápida progresión clínica; SREBP2: factor de transcripción de unión a elementos reguladores de esteroles 2; TNF: factor de necrosis tumoral. Los valores expresan media ± desviación estándar o mediana [intervalo intercuartílico].
Los valores de p<0,05 están resaltados en negrita.
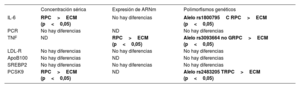
Como ya se ha comentado, se analizaron 7 moléculas a 3 niveles diferentes (concentración de proteínas, expresión de ARNm y polimorfismos genéticos) para obtener un enfoque más completo de la enfermedad. En la tabla 3 se muestra de un vistazo el rendimiento de cada marcador. Algunos no mostraron diferencias importantes en ningún aspecto (LDL-R, ApoB, SREBP2 y PCR). Sin embargo, la interleucina 6 y el TNF en el lado de inflamación y la PCSK9 en el lado de los lípidos mostraron hallazgos coherentes e importantes en más de un nivel. La concentración de TNF en suero fue muy bajo y no se detectó adecuadamente. Las de interleucina 6 y PCSK9 fueron significativamente más altas en el grupo de RPC (figuras 1A y C), mientras que las de apoB100 y PCR tendieron a ser más bajas en este grupo.
Resultados de las moléculas analizadas a 3 niveles moleculares cuando se compara a los pacientes con RPC frente a pacientes con ECM
| Concentración sérica | Expresión de ARNm | Polimorfismos genéticos | |
|---|---|---|---|
| IL-6 | RPC>ECM (p<0,05) | No hay diferencias | Alelo rs1800795C RPC>ECM (p<0,05) |
| PCR | No hay diferencias | ND | No hay diferencias |
| TNF | ND | RPC>ECM (p<0,05) | Alelo rs3093664 no GRPC>ECM (p<0,05) |
| LDL-R | No hay diferencias | No hay diferencias | No hay diferencias |
| ApoB100 | No hay diferencias | ND | No hay diferencias |
| SREBP2 | No hay diferencias | No hay diferencias | No hay diferencias |
| PCSK9 | RPC>ECM (p<0,05) | ND | Alelo rs2483205 TRPC>ECM (p<0,05) |
Apo: apolipoproteína; ECM: estabilidad clínica mantenida; LDL-R: receptor de lipoproteínas de baja densidad; ND: no disponible; PCR: proteína C reactiva; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; RPC: rápida progresión clínica; SREBP2: factor de transcripción de unión a elementos reguladores de esteroles 2; TNF: factor de necrosis tumoral.
Los valores de p<0,05 están resaltados en negrita.
Resultados de la interleucina 6 (IL-6), el factor de necrosis tumoral (TNF) y la proproteína convertasa subtilisina/kexina tipo 9 (PCSK9) a diferentes niveles moleculares. La figura muestra una comparación entre el grupo de rápida progresión clínica y el grupo de estabilidad clínica mantenida a diferentes niveles moleculares. La concentración sérica de IL-6 (A), la expresión del ARNm de TNF (B) y la concentración sérica de PCSK9 (C) son considerablemente mayores en el grupo de rápida progresión clínica. La línea horizontal en las gráficas representa la media. Los valores de p se ajustaron por edad, sexo, diabetes mellitus, tabaquismo e hipertensión. ARNm: ácido ribonucleico mensajero.
Aparte de las concentraciones séricas de interleucina 6 más altas en el grupo de RPC (p=0,002) (figura 1A), se encontraron diferencias en las frecuencias genotípicas y alélicas de la interleucina 6 rs1800795. En concreto, los pacientes con el genotipo CC y el alelo C tenían mayor riesgo de RPC (respectivamente, OR = 2,70; IC95%, 1,02-7,18; p=0,046; OR = 1,71; IC95%, 1,06-2,75; p=0,028). Curiosamente, se observó lo mismo en pacientes con el haplotipo GCG (OR = 2,75; IC95%, 1,19-6,37; p=0,02) (tabla 2 del material adicional).
La expresión del ARNm del TNF estaba aumentada en el grupo de RPC en comparación con el de ECM (p=0,003) (figura 1B). En cuanto a los polimorfismos del TNF analizados, rs3093664 mostró diferencias en las frecuencias alélica y de portadores. En ambos casos, la presencia del alelo G se relacionó con menos riesgo de RPC (OR = 0,27; IC95%, 0,08-0,92; p=0,04; OR = 0,27; IC95%, 0,07-0,95; p=0,04) (tabla 3 del material adicional).
Entre los 6 SNP de la PCSK9 estudiados, rs2483205 mostró diferencias significativas en las frecuencias genotípica y alélica (genotipo CT, OR = 3,39; IC95%, 1,50-7,65; p=0,003; genotipo TT, OR = 3,12; IC95%, 1,12-8,64; p=0,03; alelo T, OR = 1,83; IC95%, 1,15-2,93; p=0,01), lo que demuestra que la presencia del alelo T se asoció con mayor riesgo de RPC (tabla 4 del material adicional).
La figura 2 muestra la prevalencia de alelos T de interleucina 6 rs180075C, TNF rs3093664 no G y PCSK9 rs2483205 (aislados o combinados) en los 2 grupos. El 51,7% de los pacientes con RPC tenían los 3 alelos de riesgo, en comparación con el 18,0% de los pacientes con ECM (p<0,001).
Distribución de los alelos rs180075C de IL-6, rs3093664 no G de TNF y rs2483205 T de PCSK9 en pacientes con RPC y ECM. Los pacientes con los 3 alelos de riesgo fueron más frecuentes en el grupo de RPC (p<0,001). ECM: estabilidad clínica mantenida; IL–6: interleucina 6; PCSK9: proproteína convertasa subtilisina/kexina tipo 9; RPC: rápida progresión clínica; TNF: factor de necrosis tumoral.
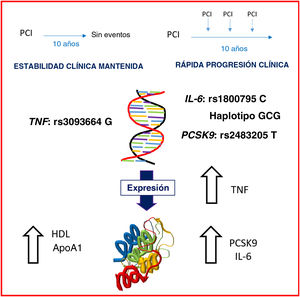
En resumen, como se refleja en la figura 3, en una fase clínicamente estable de la enfermedad, los pacientes con RPC tenían un nivel subyacente de inflamación (tanto en moléculas de interleucina 6 como de TNF) superior y mayores concentraciones séricas de PCSK9, mientras que los pacientes con ECM tenían un perfil lipídico más protector (cifras de lipoproteínas de alta densidad y apoA1 más altas). La combinación de los 3 alelos de riesgo fue más frecuente en el grupo de RPC.
Ilustración central. Visión general de los grupos de casos y controles que muestra las principales diferencias. En una fase estable de la enfermedad, los pacientes con rápida progresión clínica presentan un nivel subyacente de inflamación más alto (tanto en moléculas de interleucina 6 como en moléculas del factor de necrosis tumoral) y mayores concentraciones séricas de proproteína convertasa subtilisina/kexina tipo 9, mientras que los pacientes con estabilidad clínica mantenida tienen un perfil lipídico más protector (concentraciones de lipoproteínas de alta densidad y apolipoproteína A1 más altas). También se identificaron varios polimorfismos como marcadores de mayor o menor riesgo de progresión clínica.
Nuestro estudio muestra varios hallazgos interesantes: a) los perfiles de los 2 grupos de pacientes en el primer evento cardiovascular son muy similares, salvo la presentación clínica, ya que los pacientes con RPC presentaron angina estable con mayor frecuencia que los pacientes con ECM, cuyo primer evento clínico fue más a menudo infarto de miocardio con elevación del segmento ST; esta diferencia no fue estadísticamente significativa, pero podría ser el resultado de un error de tipo II; las restantes variables analizadas fueron notablemente similares entre los grupos; b) el perfil lipídico también mostró resultados interesantes: las cifras de ApoB100 y colesterol unido a lipoproteínas de baja densidad casi siempre fueron más bajas en el grupo de RPC, muy probablemente en relación con un tratamiento mejorado con estatinas en este grupo; en cambio, las de lipoproteínas de alta densidad y ApoA1 fueron claramente más bajas en el grupo de RPC, lo que podría explicarse por un cuadro clínico subyacente de mayor riesgo en la población de RPC; c) las concentraciones séricas de PCSK9 fueron considerablemente mayores en el grupo de RPC; esto, junto con los datos genéticos (mayor presencia del alelo T del polimorfismo rs2483205 en este grupo), coincide con la idea de una situación subyacente de mayor riesgo en estos pacientes; d) nuestros resultados, en cuanto al papel clave que desempeña la inflamación en la ateroesclerosis coronaria, fueron coherentes incluso en una fase estable de la enfermedad; tanto los valores de interleucina 6 como los de TNF se encontraron aumentados considerablemente en los pacientes con RPC, hallazgo que se reflejó en el aspecto genético, pues se detectaron diferencias importantes en las frecuencias de los alelos del polimorfismo rs3093664 del TNF y el polimorfismo rs1800795 de la interleucina 6, y e) hay una probable sinergia entre diferentes vías, ya que la combinación de los 3 alelos de riesgo es la vía relacionada específicamente con la RPC.
Los pacientes con ateroesclerosis coronaria clínicamente evidente tienen un grado de progresión muy variable, y esta progresión es uno de los más importantes factores que influyen en el pronóstico. Esta variabilidad depende en parte de los factores de riesgo tradicionales, pero para mejorar la comprensión es necesario investigar la -ómica, el fenotipo molecular y el genotipo. Esto coincide con el enfoque reciente sobre el tratamiento de enfermedades y la prevención de la medicina de precisión, que tiene en cuenta la variabilidad interindividual en los genes, el medio ambiente y el estilo de vida. En este estudio, se pretendía seguir esta vía, yendo más allá de los factores de riesgo tradicionales para centrarse en la -ómica con el fin de identificar las diferencias en el sustrato de los pacientes y dirigirse a la «prevención de precisión», donde la intensidad y el tipo de intervenciones se pueden adaptar a personas concretas.
Las células inflamatorias y las lipoproteínas interactúan con productos bioquímicos en la pared vascular y ocasionan la formación de placa de ateroma. Los cambios posteriores en la composición de la placa ateroesclerótica y en la inflamación definen la evolución a eventos estables o inestables.
La interleucina 6 y la PCR son 2 de las moléculas cuya implicación en el cuadro clínico inflamatorio está más ampliamente probada. Varios estudios indican que estas 2 moléculas están asociadas con el riesgo a largo plazo de eventos cardiovasculares en pacientes con enfermedad coronaria establecida o en pacientes con riesgo de ateroesclerosis6,31–36.
Los datos de ensayos clínicos y metanálisis indican que existe una relación lógica entre bajas concentraciones de colesterol unido a lipoproteínas de baja densidad y una menor tasa de eventos cardiovasculares importantes24,25. El reciclaje de los LDL-R en la superficie de los hepatocitos desempeña un papel fundamental en el mantenimiento del equilibrio del colesterol corporal y celular, pues regula las concentraciones plasmáticas del colesterol unido a lipoproteínas de baja densidad. Recientemente se ha demostrado que la PCSK9 es esencial en la regulación y el reciclaje del LDL-R. Los anticuerpos monoclonales que inhiben la PCSK9 han surgido como una nueva clase de medicamentos que reducen eficazmente la concentración de colesterol unido a lipoproteínas de baja densidad19, tienen un efecto favorable en la progresión de la ateroesclerosis coronaria20 y repercuten favorablemente en la cifra de eventos cardiovasculares21–23. Cabe destacar que la expresión de PCSK9 aumenta la producción de mediadores inflamatorios, como TNF, NF-κB e interleucina 1, entre otros24. SREBP2 actúa en la homeostasis del colesterol regulando tanto la expresión como la síntesis de LDL-R y PCSK925–29, y también está implicado en el proceso de aterogénesis.
Los estudios genéticos han identificado recientemente los SNP como una forma natural de diversidad genética entre los seres humanos y, con los avances en el genotipado, se han identificado varios polimorfismos genéticos en relación con un efecto fenotípico. Muchos SNP que se localizan en regiones del promotor tienen un impacto funcional a través de cambios importantes en los niveles de expresión del producto génico. En consecuencia, varios estudios han relacionado los SNP de los genes de la interleucina 6 y la PCR con las características clínicas de las enfermedades cardiovasculares37–45. Los SNP en el gen PCSK9 también se han sometido a pruebas en varios estudios que demuestran una clara relación entre los trastornos en la secreción o función de este gen con las cifras de lipoproteínas de baja densidad en plasma y, por lo tanto, los eventos cardiovasculares44,45. Sin embargo, aunque se analizaron la PCR y la lipoproteína(a), no se encontraron diferencias entre los grupos, al contrario que otros autores5,7. Konstantinos et al.32 centraron su estudio en el alelo C del polimorfismo rs1800795 de interleucina 6 y encontraron una asociación con la progresión arteriográfica de la arteriopatía coronaria. Se detectó la misma asociación en nuestro estudio, pero con progresión clínica en nuestro caso.
Otros autores también buscan nuevas dianas en el campo de los lípidos, más allá de los factores de riesgo tradicionales, que podrían afectar a la rápida progresión de la enfermedad cardiovascular, siempre desde una perspectiva anatómica. Sekimoto et al.46 han publicado recientemente un artículo muy interesante que analiza el papel de las lipoproteínas de baja densidad pequeñas y densas en el riesgo de rápida progresión angiográfica de lesiones coronarias no culpables después de un síndrome coronario agudo. Al igual que nosotros, no encontraron diferencias en las características basales y los factores de riesgo tradicionales. Sin embargo, las cifras de lipoproteínas de alta densidad, apoA1 y apoB100 fueron mayores en su grupo de progresión rápida tanto justo después del síndrome coronario agudo como durante la fase estable, a diferencia de nuestros resultados. Estos autores concluyeron que las concentraciones de LDL pequeñas y densas están asociadas con una rápida progresión en el contexto estudiado. Won et al.12 centraron su estudio en el papel del índice aterogénico del plasma y concluyeron que se trata de un marcador independiente de la rápida progresión de la placa.
Sería de gran interés continuar esta línea de investigación con una cohorte de validación prospectiva en poblaciones más amplias para evaluar si este perfil de genotipo y fenotipo molecular podría predecir presentaciones de enfermedad más agresivas y poder abordarlas con una estrategia de tratamiento más precoz e intensa. Esto, entre otras acciones, podría implicar alcanzar antes cifras de lipoproteínas de baja densidad óptimas, aumentar el número de visitas de seguimiento periódicas e incluso realizar un seguimiento con técnicas de imagen, así como fomentar la concienciación del paciente sobre la enfermedad.
LimitacionesEl tamaño muestral de este estudio no es grande, aunque es bastante similar a los de otros estudios que abordan la rápida progresión angiográfica y su relación con varios marcadores biológicos. Se estudió a los pacientes en una etapa estable de la enfermedad coronaria y no durante un evento agudo, en el cual podrían haberse encontrado más diferencias en los marcadores de inflamación. Sin embargo, la decisión de estudiar a los pacientes en una etapa estable fue intencional, ya que se trataba de identificar algún sustrato clínico basal subyacente que pudiera definir a los pacientes a lo largo de la vida. Por lo tanto, se decidió evitar la etapa aguda de la enfermedad coronaria. Puesto que este estudio es retrospectivo, se perdió a todos los no supervivientes que podrían haber sido incluidos en el grupo de RPC y haber tenido una presentación más agresiva de la enfermedad. Reconocemos que este estudio no recoge todos los casos de RPC. En cambio, todos los pacientes del grupo eran realmente RPC. Por último, se definió RPC para los fines de este estudio. No encontramos una definición adecuada de progresión rápida desde una perspectiva clínica en la bibliografía, por lo que se decidió elegir una en función de nuestra percepción como médicos. Sin embargo, esta definición podría haber sido diferente.
La prevalencia de los 3 alelos de riesgo identificados en el grupo de RPC indica sinergia entre varias vías activadas. Con todo, aunque parece que hay cierto grado de acondicionamiento genético, esta misma prevalencia deja espacio para otros determinantes no genéticos, algo propio de la ateroesclerosis per se.
Todos estos resultados requieren validación en otros estudios de cohortes prospectivos.
CONCLUSIONESHasta donde sabemos, nuestro estudio es el primero en abordar la RPC de la ateroesclerosis coronaria. Los resultados de este estudio indican la existencia de marcadores fenotípicos y genotípicos específicos asociados con la rápida progresión de la enfermedad coronaria. Están justificados más estudios de cohortes prospectivos para determinar si estos perfiles podrían usarse para implementar una estrategia de prevención secundaria de precisión en pacientes con enfermedad coronaria.
- –
El ritmo de progresión de la ateroesclerosis coronaria afecta al pronóstico.
- –
La ateroesclerosis coronaria acelerada podría definirse mejor desde una perspectiva clínica.
- –
Los pacientes con estabilidad clínica comprobada comparten características clásicas con aquellos con presentaciones agresivas.
- –
Los alelos rs180075C de interleucina 6, rs3093664 no G de TNF y rs2483205 T de PCSK9 están asociados con una rápida progresión clínica.
Este estudio ha contado con el apoyo de una subvención sin restricciones de AMGEN. S. Remuzgo-Martínez ha contado con financiación de los fondos del Programa RETICS (RD16/0012/0009) del Instituto de Salud Carlos III (ISCIII), cofinanciados por el Fondo Europeo de Desarrollo Regional (FEDER). F. Género ha contado con el apoyo de los fondos del Programa RICORS (RD21/0002/0025) del ISCIII, cofinanciados por la Unión Europea. R. López-Mejías ha recibido una beca del Programa Miguel Servet tipo II del ISCIII, cofinanciada por el Fondo Social Europeo, «Investing in your future» (CPII21/00004). V. Pulito-Cueto ha contado con financiación de los fondos del PI18/00042 del ISCIII, cofinanciados por el FEDER.
CONTRIBUCIÓN DE LOS AUTOREST. García-Camarero, M.Á. González-Gay y J.M. de la Torre Hernández diseñaron el estudio; T. García-Camarero, G. Veiga Fernández, D.-H. Lee Hwang, F. Sainz Laso y A. Gil Ongay seleccionaron a los pacientes; T. García-Camarero y J.M. de la Torre Hernández llevaron a cabo la investigación; S. Remuzgo-Martínez, F. Genre, R. López-Mejías y V. Pulito-Cueto realizaron los análisis de laboratorio: T. García-Camarero, S. Remuzgo-Martínez, F. Genre, R. López-Mejías y V. Pulito-Cueto realizaron los análisis estadísticos; T. García-Camarero y J.M. de la Torre Hernández redactaron el artículo; T. García-Camarero tiene la responsabilidad principal del contenido final. J.M. de la Torre Hernández, S. Remuzgo-Martínez, F. Genre, R. López-Mejías y V. Pulito-Cueto contribuyeron a la interpretación de los datos y comentaron las versiones iniciales del artículo. Todos los autores leyeron y aprobaron el manuscrito final.
CONFLICTO DE INTERESESLos autores declaran que no tienen intereses financieros o relaciones personales que pudieran haber influido en el trabajo presentado en este artículo.