Los indudables progresos en el campo de la oncología han disminuido la mortalidad secundaria al cáncer. Sin embargo, esta población de larga supervivencia se enfrenta ahora a un aumento de la morbimortalidad cardiovascular. Dado que la aparición de cardiotoxicidad se asocia con mal pronóstico, identificarla en una fase subclínica es importante para promover el inicio precoz de tratamientos cardioprotectores y evitar interrupciones del tratamiento oncológico. Las estrategias de detección precoz de la cardiotoxicidad incluyen el uso de biomarcadores y técnicas de imagen cardiaca. Este artículo revisa las técnicas de imagen disponibles, con sus ventajas y limitaciones, para detectar alteraciones precoces de la función miocárdica de pacientes en tratamiento antitumoral y en supervivientes al cáncer.
Palabras clave
Los avances que se han producido en la detección y el tratamiento precoces del cáncer han permitido una disminución de un 20% en la mortalidad relacionada1. Sin embargo, la enfermedad cardiovascular (ECV) ha pasado a ser un riesgo importante de morbilidad y mortalidad para los pacientes que sobreviven al cáncer2. Por ejemplo, entre las supervivientes de cáncer de mama de más de 66 años que habían sobrevivido más de 5, la ECV superó al cáncer de mama como primera causa de muerte2. Este aumento del riesgo de ECV se debe a factores de riesgo comunes al cáncer y las ECV, la influencia directa del tratamiento oncológico en el sistema cardiovascular y las lagunas existentes en la asistencia cardiaca de los pacientes con cáncer3–5. La optimización del tratamiento de los trastornos preexistentes previa al tratamiento es importante, pero es improbable que baste como única estrategia para la prevención de la ECV. Concretamente, para la prevención de la insuficiencia cardiaca (IC) asociada al tratamiento del cáncer, son necesarias estrategias para identificar la lesión miocárdica temprana, de manera que pueda instaurarse un tratamiento dirigido para prevenir la IC clínica. Se ha demostrado que las técnicas de diagnóstico por imagen y los biomarcadores séricos son estrategias clave para identificar el daño miocárdico precoz. Los biomarcadores séricos han resultado enormemente prometedores, pero tienen algunas limitaciones; no está definido qué biomarcador es mejor utilizar ni cuáles son el momento adecuado para realizar las determinaciones y los umbrales para definir las anomalías6. Ha habido un entusiasmo creciente por el uso de las técnicas de imagen cardiaca en la detección del daño miocárdico, ya que aportan una evaluación directa de la función del miocardio7. En esta revisión, se presentan las modalidades de diagnóstico por imagen cardiaca existentes para detectar las alteraciones del miocardio en los pacientes que reciben un tratamiento oncológico y en los supervivientes, así como sus puntos fuertes y limitaciones. También se presentan algunas propuestas prácticas para los clínicos que participan en la asistencia cardiaca de los pacientes con cáncer.
ECOCARDIOGRAFÍA 3DControversias en la definición de la cardiotoxicidadHistóricamente se han utilizado diferentes definiciones de cardiotoxicidad, lo que tiene repercusiones prácticas en cómo se trata a los pacientes8. La controversia más intensa es la definición de la disfunción cardiaca relacionada con el tratamiento del cáncer (DCRTC), tanto en los ensayos clínicos como en los documentos de consenso3,9. En la época moderna, un 5-6% de los pacientes tratados con cardiotóxicos sufre IC clínica o fallece por causas cardiovasculares10,11. El deterioro asintomático de la fracción de eyección del ventrículo izquierdo (FEVI), asociado a una mayor incidencia de IC sintomática, se ha documentado en hasta un 20% de los pacientes, según cuál sea el tratamiento oncológico utilizado12–14.
Todas las definiciones de la DCRTC se basan en una disminución secuencial de la FEVI. Lamentablemente, no hay unos umbrales universales del cambio para definir la DCRTC. El documento de consenso de la American Society of Echocardiography (ASE) define la DCRTC como una disminución ≥ 10% de la FEVI hasta alcanzar un valor < 53%15, basándose en las nuevas recomendaciones de la ASE y la European Association of Cardiovascular Imaging (EACVI) para la cuantificación de cámaras16. Estas recomendaciones han sido avaladas por la Canadian Cardiovascular Consensus Statement17. Recientemente, en el artículo de posicionamiento de 2016 de la Sociedad Europea de Cardiología se ha considerado que el límite inferior de la normalidad de la FEVI determinada mediante ecocardiografía es de un 50%, en consonancia con la definición comúnmente utilizada en los registros y ensayos en pacientes con cáncer18.
Independientemente de los intervalos de referencia normales, para identificar adecuadamente la DCRTC es necesario valorar los cambios relativos entre la FEVI inicial y la observada en el seguimiento. Si la FEVI disminuye más del 10% hasta alcanzar un valor inferior al límite de la normalidad, se recomienda el empleo de inhibidores de la enzima de conversión de la angiotensina (o antagonistas del receptor de la angiotensina II) en combinación con bloqueadores beta (salvo que estén contraindicados) para prevenir un mayor deterioro de la función del ventrículo izquierdo (VI) o IC sintomática15,17,18. Si la FEVI disminuye más del 10% hasta un valor que no está por debajo del límite inferior de la normalidad, debe realizarse una nueva determinación de la FEVI a la brevedad. Además, para estos pacientes debe considerarse un seguimiento ecocardiográfico precoz para evitar retrasos en el inicio del tratamiento de la IC15,17,18.
Este artículo se centra en la definición de la DCRTC de la ASE (límite inferior de la normalidad de una FEVI < 53%) con objeto de mejorar la detección precoz y el tratamiento temprano de la cardiotoxicidad, que son cruciales para alcanzar una recuperación de la función cardiaca19,20. De hecho, Wang et al.11 demostraron que incluso una FEVI normal a menos de 5 puntos del límite inferior de la normalidad se asociaba a un aumento de cerca de 3 veces en la tasa de eventos cardiacos en los pacientes tratados con antraciclinas.
Necesidad de determinaciones precisas de la FEVI: pros y contras de la FEVI-3DEEn los pacientes con cáncer, la evaluación secuencial de la FEVI debe ser lo suficientemente fiable para identificar cambios reales de la función ventricular que conduzcan a posteriores decisiones clínicas y terapéuticas21. Aunque la técnica de diagnóstico por imagen utilizada para la monitorización debe basarse en la experiencia local de cada centro, cada vez se utiliza más la ecocardiografía bidimensional (2DE) debido a su amplia disponibilidad y su seguridad. Esta técnica de imagen permite obtener una caracterización de la función sistólica y diastólica, las presiones pulmonares, la función valvular, la función ventricular derecha y el pericardio. Es recomendable la grabación digital de las imágenes para permitir una comparación visual en los casos dudosos. El método recomendado para la cuantificación de la FEVI-2DE es el método de Simpson biplano modificado16. Sin embargo, como consecuencia de diversos factores (experiencia del evaluador, presunciones geométricas o definición insuficiente del borde endocárdico), la FEVI-2DE tiene una sensibilidad baja para la detección de pequeños cambios de la función del VI y se ha descrito una variabilidad test-retest entre el 9 y el 10,8%, que es superior al umbral utilizado para definir la DCRTC22. Pueden usarse medios de contraste y una detección automática del contorno para reducir la variabilidad. De hecho, en el estudio de Cannesson et al.23, las mediciones automáticas de la FEVI-2DE mostraron una variabilidad interobservadores inferior (3,4%) a la del método biplanar manual (9,8%).
La ecocardiografía tridimensional (3DE) es una alternativa concluyente con múltiples ventajas, similares a las de la cardiorresonancia magnética (CRM)16. Aumenta la capacidad de detectar cambios menores de la FEVI, con una reproducibilidad mayor que la de la 2DE utilizando la CRM como comparación24. Las mediciones volumétricas en la 3DE son independientes de las presunciones geométricas o del acortamiento apical del VI (tabla 1). La menor variabilidad test-retest del observador en la 3DE es atribuible, al menos en parte, al trazado endocárdico automático25. En un estudio reciente, Thavendiranathan et al.26 realizaron un seguimiento de 56 mujeres tratadas con quimioterapia mediante 2DE y 3DE, a intervalos trimestrales durante 1 año, para determinar cuál era la técnica con menor variabilidad. El uso de la 3DE sin contraste proporciona una variabilidad temporal inferior a la de la FEVI-2DE (el 5,8 frente al 9,8%), y ello es de la máxima importancia en estas pacientes.
Técnicas de imagen para la evaluación de la cardiotoxicidad
| Ventajas | Limitaciones | |
|---|---|---|
| FEVI-2DE | Coste bajo Disponibilidad Alta resolución temporal Abundantes datos publicados | Acortamiento apical frecuente Mala definición del borde endocárdico No se aprecian alteraciones no presentes en los planos apicales estándar Baja detección de la toxicidad subclínica |
| FEVI-3DE | No requiere presunciones geométricas No hay acortamiento apical Más exacta y reproducible que la FEVI-2DE | Menor resolución temporal Menos datos publicados sobre los valores normales Dependencia de la calidad de la imagen Baja detección de la toxicidad subclínica |
| GLS | Más exacto y reproducible que la FEVI-2DE Capaz de identificar la toxicidad subclínica Reproducible en manos expertas | Disponibilidad Específico del proveedor y del programa informático Se ve influido por las condiciones de carga Falta de ensayos clínicos aleatorizados a largo plazo |
| CRM | Es el método más exacto para medir la FEVI Aporta una evaluación global de los cambios del tejido miocárdico con un abanico desde las medidas funcionales de la cardiotoxicidad a la identificación de los cambios anatomopatológicos subyacentes | Falta de disponibilidad Varias contraindicaciones Baja resolución temporal Datos limitados sobre su uso en cardio-oncología |
| TC cardiaca | Método no invasivo para evaluar la EC Alta sensibilidad y valor predictivo negativo para la EC | Exposición a la radiación Poca especificidad para la EC obstructiva, en especial en el contexto de una placa calcificada |
2DE: ecocardiografía bidimensional; 3DE: ecocardiografía tridimensional; CRM: cardiorresonancia magnética; EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; GLS: strain longitudinal global; TC: tomografía computarizada.
La reproducibilidad de la 3DE puede ser especialmente relevante en pacientes con una FEVI normal baja. De 114 adultos supervivientes a cáncer infantil tratados con radioterapia torácica o antraciclinas, en 16 (14%) se observó una FEVI < 50% con CRM, patrón de referencia, pero 10 de los 16 fueron clasificados erróneamente por la 2DE como pacientes con FEVI conservada según el método biplano27. En promedio, la 2DE sobrestimó la FEVI en un 5% (media de FEVI del 56% en la CRM, el 55% en la 3DE y el 61% en la 2DE con el método biplanar) y mostró unos intervalos de valores y unos límites de coincidencia más amplios. La FEVI medida con 3DE fue el parámetro ecocardiográfico más sensible para identificar una FEVI < 55% con la CRM. A la vista de estos resultados, se propuso que una FEVI-2DE en el límite inferior de la normalidad (intervalo de valores, 50-59%) justificaba una especial atención y podía requerir una más amplia evaluación cardiaca con objeto de descartar una disfunción28.
La ASE, la EACVI, la Sociedad Europea de Cardiología y la Canadian Cardiovascular Consensus Statement recomiendan realizar una cuantificación seriada de la FEVI con el mejor método disponible en el laboratorio de ecocardiografía15,17,18. Actualmente, la 3DE es la técnica preferida para la monitorización longitudinal de la FEVI de los pacientes con cáncer26,29. Un programa informático totalmente automático reduce la variabilidad de las mediciones de la FEVI-3DE, ahorra tiempo y facilitará la integración de la 3DE en la práctica clínica30. El conocimiento experto del operador, los abordajes estandarizados y las iniciativas de mejora de la calidad en el laboratorio de ecocardiografía son elementos necesarios para alcanzar la superioridad de la FEVI-3DE16,24. Esto último es especialmente importante, dado que se suele usar cambios de tan solo un 10% en la FEVI para definir la DCRTC e iniciar tratamientos de cardioprotección15,17,18.
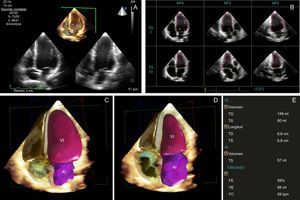
Trucos y propuestas para la práctica clínica diariaLa adquisición de imágenes en la 3DE es similar a la de la 2DE, con un tiempo de adquisición de 1–2 min desde la posición apical (tabla 2)16,25. Se recomienda adquirir de 2 a 3 volúmenes de datos para realizar el análisis con el mejor de ellos. La resolución temporal debe ser > 20 volúmenes por segundo. El análisis generalmente se realiza offline mediante identificación de límites parcial o totalmente automática para delimitar el endocardio y el epicardio. Para integrar las mediciones de la 3DE en la práctica clínica, el siguiente paso lógico es el empleo de un programa informático totalmente automático (figura 1)30.
Trucos e indicaciones para medir por ecocardiografía 3D la fracción de eyección del ventrículo izquierdo
| Optimización de: |
| Calidad de la imagen y frecuencia de registro de volumen |
| Optimizar la profundidad bidimensional, la ganancia, el enfoque y la definición del límite endocárdico |
| Optimizar la anchura y la profundidad del sector tridimensional para incluir todo el VI |
| Se debe obtener 2 o 3 volúmenes de datos para el análisis |
| La resolución temporal debe ser > 20 volúmenes/s |
| Seguimiento del ECG |
| Detección de los puntos de referencia para el análisis con el programa informático |
| Segmentación del ciclo cardiaco |
| Identificación semiautomática o totalmente automática de los bordes |
| Asegurar que las localizaciones del ápex y el anillo mitral sean apropiadas |
| Evaluar la calidad del trazado del borde endocárdico |
ECG: electrocardiograma; VI: ventrículo izquierdo.
Fracción de eyección del ventrículo izquierdo (FEVI) en la ecocardiografía tridimensional (3DE) con un programa informático totalmente automático. A: adquisición de un volumen completo de las 4 cámaras con 3DE, en un solo latido. B: plano apical de 4 cámaras; el usuario puede modificar la localización del borde del endocardio si es necesario. C: imagen TD final. D: imagen TS. E: volúmenes y FE del VI 3D. AI: aurícula izquierda; AP2: proyección apical de 2 cámaras; AP3: proyección apical de 3 cámaras; AP4: proyección apical de 4 cámaras; FC: frecuencia cardiaca; FE: fracción de eyección; TD: telediastólica; TS: telesistólica; VE: volumen de eyección; VI: ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
La mayor parte de las medidas aplicadas para reducir la cardiotoxicidad se centran en el diagnóstico y el tratamiento tempranos de la disfunción del VI. Sin embargo, la FEVI es una medida poco sensible de la disfunción miocárdica temprana13. Cuando un paciente sufre una disfunción del VI, en especial con el empleo de antraciclinas, la lesión miocárdica está ya establecida, y la probabilidad de recuperación, incluso con un tratamiento médico óptimo, se reduce con el paso del tiempo21,31. Está por determinar todavía si estos mismos problemas se dan también con otros fármacos utilizados para tratar el cáncer. Están apareciendo datos que indican que los biomarcadores cardiacos y las nuevas técnicas de ecocardiografía pueden ser más sensibles para la detección precoz de la cardiotoxicidad6,15,17,18.
El corazón tiene una estructura helicoidal formada por 3 capas de fibras miocárdicas. La función sistólica del VI es una acción coordinada entre ellas (contracción longitudinal, acortamiento circular y engrosamiento radial) y la fracción de eyección evalúa predominantemente la función radial. Técnicas como el speckle tracking (STE) han mejorado la evaluación no invasiva de la deformación miocárdica respecto a la 2DE convencional y aportan una información exacta en las fases iniciales de las enfermedades del miocardio32. La determinación de la deformación se denomina strain (deformación) miocárdico. El strain longitudinal global (GLS) es el parámetro más comúnmente estudiado para detectar la enfermedad preclínica33. Es muy reproducible cuando lo evalúa un operador capacitado (variabilidad interobservadores e intraobservador < 4%)34, pero los intervalos de valores normales dependen del proveedor y del programa informático utilizado35,36. La EACVI y la ASE, reconociendo la necesidad crítica de estandarización de las imágenes de strain, invitaron a representantes técnicos de todos los proveedores interesados a participar en un esfuerzo conjunto para reducir la variabilidad interproveedores en las mediciones del strain37. Recientemente, un estudio ha realizado una comparación directa de las mediciones del GLS usando 7 programas informáticos de STE diferentes, en un grupo de voluntarios sanos, con una media de FEVI del 60%. Los valores de GLS oscilaron entre el −18,0 y el −21,5%. Las reproducibilidades interobservadores e intraobservador del GLS fueron comparables o superiores a las de la FEVI (error medio relativo interobservadores del 5,4 al 8,6%, mientras que el error medio relativo intraobservador fue del 4,9 al 7,3%). La diferencia absoluta entre los proveedores en cuanto al GLS fue del 3,7% de las unidades de strain (p < 0,001), e inferior a la de la FEVI38. Aunque la recomendación actual es utilizar el mismo proveedor para el seguimiento15,17,18, las mejoras en la estandarización de las mediciones conducirán pronto a una monitorización de los pacientes con equipos de ecocardiografía de diferentes proveedores39.
Cada vez hay más publicaciones que respaldan el uso del strain miocárdico en los pacientes que reciben tratamientos oncológicos, para la evaluación basal, la monitorización del tratamiento y el seguimiento de los que sobreviven al cáncer40.
Evaluación basal de riesgo de cardiotoxicidadVarios estudios han puesto de manifiesto la utilidad del strain determinado mediante STE como predictor de la evolución de los pacientes con IC33. En los pacientes con cáncer, se ha demostrado que el GLS es superior a la FEVI por lo que respecta a la predicción de la cardiotoxicidad. El GLS previo a la quimioterapia se asoció de manera independiente a eventos cardiacos tras una mediana de seguimiento de 4 años. Un valor absoluto de GLS < 17,5% se asoció a un aumento de 6 veces en la mortalidad de causa cardiaca o la IC sintomática41. Se ha demostrado también que el GLS previo a la quimioterapia es un instrumento eficaz para estratificar el riesgo de cardiotoxicidad de los pacientes con una FEVI basal entre el 50 y el 59%42. Recientemente, se ha demostrado que el strain circunferencial global tiene también un alto valor predictivo de la DCRTC43. Estos estudios abren nuevas líneas de investigación para identificar de manera no invasiva a los pacientes con alto riesgo de IC sintomática antes del tratamiento del cáncer.
Supervisión durante el tratamiento del cáncerEn los pacientes tratados con quimioterapia, el GLS detecta la disfunción miocárdica temprana y predice la DCRTC40. Aunque todavía hay datos disponibles respecto a su capacidad de predicción de la DCRTC a largo plazo, varios estudios han demostrado su utilidad a corto plazo44,45. El grado de cambio del GLS que predijo la posterior aparición de cardiotoxicidad osciló entre el 10 y el 15% en diferentes estudios40. En un estudio inicial se demostró, en 45 mujeres con cáncer de mama tratadas con trastuzumab/antraciclinas, que una reducción relativa del GLS del 10% a los 3 meses predecía la aparición de cardiotoxicidad (definida como una FEVI < 50% a los 6 meses)46. En otro estudio con 81 mujeres consecutivas tratadas prospectivamente con trastuzumab (la mayoría de ellas en tratamiento también con antraciclinas), 24 (30%) sufrieron cardiotoxicidad (definida como una reducción a los 12 meses > 10% de la FEVI basal). Su predictor más potente fue la disminución relativa del GLS > 11% a los 6 meses (área bajo la curva, 0,84; intervalo de confianza del 95%, 8,3%-14,6%)47. Una combinación de biomarcadores y el GLS aumentó la precisión diagnóstica de cardiotoxicidad, y que ambos factores fueran negativos permitó identificar un grupo de riesgo relativamente bajo de DCRTC (valor predictivo negativo de cualquiera de estos marcadores de disfunción del VI en el seguimiento, 91-97%)45,47.
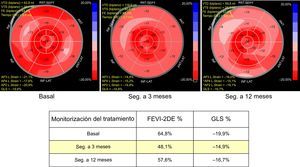
Una reducción relativa del GLS > 15% es el umbral definido por la ASE para identificar una disfunción del VI subclínica, mientras que un cambio < 8% no parece tener trascendencia clínica. Para evitar un diagnóstico falsamente positivo de DCRTC, el valor anormal debe confirmarse con un nuevo examen realizado de 2 a 3 semanas después15 (figura 2).
Monitorización del tratamiento del cáncer. Una mujer de 67 años con cáncer de mama HER2+. La paciente tenía antecedentes de tabaquismo e hipertensión leve. Se realizó una tumorectomía y se trató con antraciclinas y trastuzumab. En el seguimiento realizado a los 3 meses, se documentó una disminución asintomática del GLS y la FEVI-2DE. Con el tratamiento de enalapril y carvedilol, la disfunción cardiaca mejora sin interrumpir el tratamiento oncológico, aunque no se recupera hasta los valores basales. 2DE: ecocardiografía bidimensional; ANT: anterior; AP2 L. Strain: strain longitudinal en el plano de 2 cámaras apical; AP3 L. Strain: strain longitudinal en el plano de 3 cámaras apical; AP4 L. Strain: strain longitudinal en el plano de 4 cámaras apical; DE: desviación estándar; FE: fracción de eyección; FEVI: fracción de eyección del ventrículo izquierdo; GLS: strain longitudinal global; INF: inferior; LAT: lateral; Seg.: seguimiento; SEPT: septal; VTD: volumen telediastólico; VTS: volumen telesistólico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
No hay evidencia sólida que indique cuál es el tratamiento clínico más apropiado cuando la única anomalía es una disminución aislada del strain. Los datos preliminares respaldan el uso de bloqueadores beta para prevenir la DCRTC en los pacientes con cáncer que presentan una disminución significativa del GLS durante el tratamiento48. Sin embargo, será preciso demostrarlo de manera prospectiva. Si se demuestra que un abordaje basado en el strain afecta a los resultados clínicos, esto podría cambiar en el futuro el modo de dar seguimiento a los pacientes que reciben tratamientos oncológicos potencialmente cardiotóxicos, dado que se ha demostrado que este enfoque tiene una relación de coste-efectividad favorable49.
Evaluación en los supervivientesDebe darse seguimiento cardiaco a los pacientes que han sobrevivido a un cáncer y han recibido radioterapia cardiaca o quimioterapia, con objeto de permitir la detección de posibles toxicidades cardiovasculares, idealmente en una fase asintomática de la enfermedad50. En los pacientes que han sobrevivido a un cáncer en la infancia, la anomalía observada con más frecuencia en la ecocardiografía de seguimiento es una reducción significativa del GLS con FEVI conservada (el 28% de los pacientes con GLS anormal y FEVI > 50%)5. En la población con IC, el GLS mejora la estratificación del riesgo, en especial en los pacientes con unos valores de FEVI normal bajos o levemente reducidos33. Serán necesarios más estudios para determinar si este concepto es aplicable a los pacientes que han sobrevivido a un cáncer y si la intervención basada en el strain modifica los resultados clínicos a largo plazo.
Trucos e indicaciones para la práctica clínica diariaEl GLS es una medida sensible y sólida para detectar la disfunción miocárdica subclínica; sin embargo, no hay unas directrices estandarizadas para realizar la medición de manera adecuada, lo que podría contribuir a incrementar la variabilidad interobservadores. La experiencia y la formación influyen en la precisión y la validez de las mediciones del GLS51. Recientemente Negishi et al.52 han publicado un conjunto de instrucciones para mejorar la uniformidad entre los evaluadores en un ensayo multicéntrico internacional sobre el valor incremental del strain para la detección y el tratamiento de la cardiotoxicidad (SUCCOUR ACTRN12614000341628). En la tabla 3 se resumen los pasos para la adquisición de imágenes de STE, así como trucos e indicaciones para la práctica clínica cotidiana. Dado que los intervalos de valores normales de las diversas técnicas no son intercambiables, debe usarse el mismo método para determinar el GLS durante el seguimiento. Es recomendable la grabación digital de las imágenes para facilitar una comparación visual en los casos dudosos.
Trucos e indicaciones para medir el strain miocárdico
| Optimización de: |
| Calidad de la imagen bidimensional |
| Resolución temporal > 50 Hz |
| Ganancia |
| Enfoque |
| Definición del borde endocárdico durante la totalidad del ciclo cardiaco |
| Seguimiento del ECG y el borde endocárdico |
| Detección de los puntos de referencia para el análisis con el programa informático |
| Cierre de válvula aórtica: segmentación del ciclo cardiaco para asegurar la medición del strain sistólico máximo |
| Ajuste de la región de interés |
| Localización apropiada del ápex |
| Evitar la inclusión del músculo papilar |
| La localización del anillo mitral requiere prestar una atención cuidadosa para evitar una aparente reducción del strain regional relacionado con el análisis del tejido auricular |
| La región de interés no debe incluir el tracto de salida del ventrículo izquierdo |
| El grosor adecuado de la región de interés incluye el miocardio pero no el pericardio |
| La anchura de la región de interés es demasiado estrecha: sobrestimación del GLS |
| La región de interés es demasiado ancha: la deformación se reduce |
2D: bidimensional; ECG: electrocardiograma; GLS: strain longitudinal global.
Las aplicaciones de la CRM en cardio-oncología incluyen la determinación exacta de la FEVI y la caracterización del tejido miocárdico.
FEVI medida mediante cardiorresonancia magnéticaSe considera la CRM el patrón de referencia para la medición de los volúmenes ventriculares y la fracción de eyección53. Esto se debe a su exactitud y sus mejores características de variabilidad interobservador, intraobservadores y test-retest54. El uso sistemático de la CRM en cardio-oncología no es viable, excepto en algunos centros seleccionados, dado que no está ampliamente disponible. Sin embargo, cuando se dispone de ella, puede aportar una evaluación más fiable de los cambios pequeños en los volúmenes y la función de los ventrículos izquierdo y derecho55,56. La detección de estos pequeños cambios puede ser un marcador temprano de lesión miocárdica. Sin embargo, esta teoría no se ha evaluado prospectivamente. La aplicación práctica actual de la FEVI medida con CRM en cardio-oncología incluye: a) determinación de la FEVI cuando hay una discrepancia entre su cuantificación y los síntomas clínicos o cuando no hay concordancia entre otras técnicas de diagnóstico por imagen, y b) identificación de la miocardiopatía subclínica en los pacientes que han sobrevivido a un cáncer27.
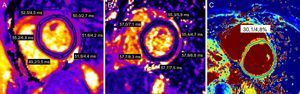
Caracterización del tejido en la cardiorresonancia magnéticaAdemás de la determinación exacta de la FEVI, la CRM tiene también la capacidad única de detectar y cuantificar las alteraciones miocárdicas patológicas de manera no invasiva, lo cual la convierte en un instrumento de inestimable valor en el diagnóstico de las miocardiopatías57–59. Las técnicas de CRM para la caracterización del tejido miocárdico incluyen el contraste temprano con gadolinio, las imágenes o mapas potenciados en T2 y T1 y las imágenes con contraste tardío de gadolinio60. La técnica de contraste temprano de gadolinio permite evaluar la inflamación miocárdica basándose en el hecho de que la inflamación se asocia a hiperemia miocárdica y aumento de la permeabilidad capilar58,61. El aumento del volumen de sangre en el área inflamada da lugar a una mayor concentración de los medios de contraste basados en gadolinio (GBCA) durante la fase vascular inicial. Esto puede detectarse midiendo el cociente de intensidad de señal en las imágenes de spin echo rápido potenciadas en T1 previas e inmediatamente posteriores al contraste58,62. Otra consecuencia de la lesión del miocardio es un aumento de la permeabilidad de las membranas celulares, seguido de una pérdida de la integridad de dichas membranas62. Esto da lugar inicialmente a un edema intracelular que se sigue de edema intersticial. Estos cambios celulares pueden identificarse con secuencias cualitativas potenciadas en T2 o mapping cuantitativo T2 (figura 3), y está en aumento el interés por el empleo de secuencias de mapeo T1 previas al contraste57,63–66. Se considera que un aumento de la señal de tejido en T2 o en los valores T2 o T1 cuantitativos indica edema miocárdico57,63–70. Más recientemente, se ha empleado una combinación de mapeo T1 antes y después del contraste para calcular la fracción de volumen extracelular (VEC) miocárdico (figura 3)71. Con una expansión del espacio extracelular secundaria a fibrosis o edema intersticial, la acumulación de GBCA extracelular será mayor y afectará a los valores de T1 del miocardio72,73. Teniendo en cuenta los respectivos valores de T1 previos a los GBCA, los valores de T1 correspondientes del pool de sangre y el hematocrito del paciente, se puede calcular la fracción de VEC. Aunque se describió fundamentalmente para evaluar la fibrosis miocárdica intersticial difusa, el edema intersticial miocárdico también puede aumentar el VEC72. Por último, las imágenes con contraste tardío de gadolinio pueden usarse para la identificación de la fibrosis de sustitución (cicatriz)74. El medio de contraste de gadolinio se acumulará en el espacio extracelular expandido (a causa de la cicatriz) y reducirá los valores de T1 en esta zona. Esta cantidad de cicatriz puede identificarse entonces mediante recuperación de inversión con ponderación en T175.
Técnicas de caracterización del tejido en la cardiorresonancia magnética. A y B: mapas de T2 de eje corto obtenidos antes del tratamiento del cáncer y después del empleo de antraciclinas, en los que se observa un aumento regional de los valores de T2 que indica edema miocárdico. C: mapa de volumen extracelular en el que se observa un aumento marginal del volumen extracelular en un paciente después del tratamiento oncológico. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
En una reciente revisión sistemática se ha señalado la escasa literatura existente sobre el uso de la caracterización del tejido mediante CRM en cardio-oncología76. Los estudios en modelos animales demuestran que el edema detectado mediante imágenes potenciadas en T1 y T2 permite identificar los signos más tempranos de cardiotoxicidad77,78. En un estudio clínico de 46 mujeres con cáncer de mama tratadas con antraciclinas ± trastuzumab, se demostró mediante imágenes potenciadas en T2 la presencia de edema miocárdico en un 49% de los pacientes a los 1–4 meses de tratamiento. En los pacientes con edema era más probable una reducción persistente de la función ventricular derecha en el seguimiento57. También son escasos los datos que apuntan a que con las antraciclinas se produce un aumento precoz de la captación temprana de gadolinio que permite identificar a los pacientes que después sufrirán una reducción de la FEVI. Diversos estudios han examinado también los cambios del tejido miocárdico en los pacientes que han sobrevivido a un cáncer, y han puesto de manifiesto un aumento del VEC miocárdico, lo cual indica una fibrosis difusa. En los pacientes que han sobrevivido a un cáncer pediátrico, el aumento del VEC se asoció a mala tolerancia al esfuerzo79,80. A pesar del interés de estos datos, no está bien definida la trascendencia clínica de estas alteraciones del tejido miocárdico durante el tratamiento del cáncer y en los pacientes que sobreviven a un cáncer.
Trucos e indicaciones para la práctica clínica diariaLa CRM es la modalidad de elección para una medición exacta de los volúmenes y la función del VI. Su aplicación sistemática en la práctica clínica para el seguimiento de los pacientes a los que se administra un tratamiento para el cáncer no es viable actualmente. Su papel clínico actual está en los casos en que hay una discrepancia de la función del VI determinada con 2 técnicas diferentes, y las decisiones relativas a la continuación de tratamiento oncológico dependen de la determinación exacta de la FEVI. La caracterización del tejido miocárdico es una posible aplicación única de la CRM, en especial para entender las alteraciones fisiopatológicas que aparecen en el miocardio antes de las alteraciones funcionales observadas durante y después del tratamiento del cáncer. Actualmente están en marcha varios estudios para explorar la utilidad clínica de la caracterización del tejido miocárdico en los pacientes que reciben tratamiento para el cáncer.
TOMOGRAFÍA COMPUTARIZADA CARDIACASon escasos los datos sobre el uso de la tomografía computarizada (TC) cardiaca en la evaluación y el tratamiento de los pacientes que reciben una terapia oncológica citotóxica81. Aunque la evaluación funcional puede realizarse con la TC cardiaca, esta tiene la limitación de una resolución temporal significativamente inferior y no se la consideraría una técnica primaria para este fin. Su principal aplicación es para detectar o descartar una arteriopatía coronaria o enfermedad pericárdica. La TC puede tener utilidad en la evaluación del riesgo antes del tratamiento, mediante la identificación de la calcificación coronaria con objeto de detectar una enfermedad coronaria subclínica en pacientes con factores de riesgo establecidos. De hecho, en el estudio Multiethnic Study of Atherosclerosis (MESA), hubo un aumento de la prevalencia de aterosclerosis coronaria en los pacientes con un diagnóstico reciente de cáncer82. La identificación de estos factores de riesgo puede fomentar el uso de tratamientos basados en la evidencia, como estatinas, antes del inicio de un tratamiento oncológico cardiotóxico.
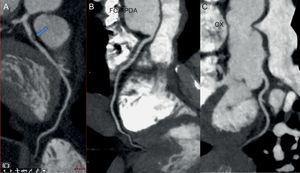
Determinados fármacos de quimioterapia, como los antimetabolitos, los agentes antimicrotúbulo y los inhibidores de la tirosincinasa, se han asociado a la aparición de coronariopatías e isquemia coronaria83. Además, la radioterapia torácica se asocia a la aparición de enfermedad coronaria84. La TC cardiaca tiene un rendimiento diagnóstico excelente en la detección de enfermedad coronaria y es bien conocido su alto valor predictivo negativo (figura 4). De hecho, varios estudios indican que la angio-TC puede ser una técnica ideal para la detección precoz de la enfermedad coronaria inducida por radiación en los pacientes que han sobrevivido a un cáncer en la edad infantil85,86.
Determinadas quimioterapias, al igual que la radioterapia, se asocian a complicaciones pericárdicas. La TC cardiaca aporta una detallada evaluación del derrame o el engrosamiento del pericardio, así como de las calcificaciones pericárdicas. Cuando se sospecha una enfermedad pericárdica, tras la evaluación fisiológica mediante ecocardiografía o CRM, la TC es una excelente modalidad complementaria de diagnóstico por la imagen. El uso de la TC cardiaca en la evaluación de la enfermedad pericárdica en general se ha revisado en una publicación anterior87.
Trucos e indicaciones para la práctica clínica diariaLa TC cardiaca de uso sistemático no tiene utilidad en cardio-oncología, pero sí tiene un posible uso en la evaluación de la enfermedad coronaria subclínica o clínica y en el estudio de una posible enfermedad pericárdica.
CONCLUSIONESA los pacientes que reciben tratamiento para el cáncer se los debe considerar en alto riesgo de complicaciones cardiovasculares; las más frecuentes son la disfunción miocárdica y la IC. No se dispone de datos concluyentes respecto a la pauta óptima de monitorización y no se puede establecer de manera clara unas recomendaciones basadas en la evidencia. Dado que los recursos existentes son limitados, cada centro debe diseñar su propio algoritmo en función de la disponibilidad y la experiencia existente con cada técnica. En laboratorios con experiencia, debe hacerse hincapié en el uso de la FEVI-3DE y el GLS para una monitorización secuencial durante el tratamiento del cáncer. La 3DE es más exacta y reproducible que la 2DE para la determinación de la FEVI, y es la técnica con mejor reproducibilidad temporal durante el tratamiento del cáncer. El GLS para identificar la lesión miocárdica subclínica debe aplicarse en especial a los pacientes en alto riesgo. Actualmente no es viable un uso sistemático de la CRM para el seguimiento de los pacientes en tratamiento oncológico. Su uso es eficaz en caso de discrepancias entre diferentes modalidades y es necesario mantener el tratamiento del cáncer. La posible utilidad de la TC cardiaca está en la evaluación de la enfermedad coronaria subclínica o clínica y en el estudio de una posible enfermedad pericárdica. Según cuál sea la técnica utilizada y la frecuencia de la estrategia de vigilancia viable en cada centro, los equipos locales de cardio-oncología deben llegar a un consenso sobre la forma de tratar a los pacientes con una sospecha de DCRTC o una disfunción miocárdica subclínica, con objeto de estandarizar las decisiones, así como respecto al inicio de la administración de fármacos cardioprotectores o el mantenimiento o la retirada de un tratamiento oncológico que puede salvar la vida del paciente.
CONFLICTO DE INTERESESNinguno.