Anticoagulant therapy with vitamin-K antagonists is highly complex. Novel direct thrombin and Xa inhibitors can be administered at a fixed dose without routine monitoring and dosage adjustment to ensure their effectiveness and safety. A number of phase-III trials for the prevention of venous thromboembolism associated with orthopedic surgery, for the treatment of venous thromboembolism, and for stroke prevention in patients with atrial fibrillation have been completed, with positive results. Attention to drug interactions and renal function will be required, as methods to measure their effects are not precise, cannot quantify the degree of anticoagulation, and are influenced by the changes in drug concentrations during the dosing interval. In the future, patient preferences and pharmacologic characteristics of individual drugs will be able to be matched to optimize therapy. These new agents represent a new paradigm for anticoagulation that promises to improve patient care in the long term.
Keywords
Durante décadas, la anticoagulación oral en el tratamiento y prevención de la tromboembolia venosa ha sido posible gracias a la utilización de fármacos antagonistas de la vitamina K (AVK)1-4. Los AVK también han hecho posible la prevención del ictus en pacientes con fibrilación auricular (FA), la prevención de embolias y trombosis en portadores de válvulas mecánicas cardiacas y para otras indicaciones5,6. El número de pacientes anticoagulados en nuestro medio es muy elevado. Se calcula que en España 13,2/1.000 habitantes reciben AVK7. Los AVK son fármacos de manejo complejo. Su margen terapéutico es estrecho y requieren monitorización periódica para conseguir mantener unos niveles razonables de seguridad y eficacia8. Además, los AVK tienen múltiples interacciones con otros fármacos, con la ingesta dietética de vitamina K o alcohol, con enfermedades intercurrentes y otros factores. Se han realizado avances significativos en el manejo de los AVK mediante unidades de control del tratamiento anticoagulante y con la introducción del autocontrol y automanejo por los propios pacientes8,9. No obstante, en la práctica habitual siguen existiendo muchos problemas y se calcula que los AVK están implicados en gran número de ingresos hospitalarios, urgencias y complicaciones hemorrágicas. En Estados Unidos son los fármacos más frecuentemente implicados en hospitalizaciones urgentes de ancianos10.
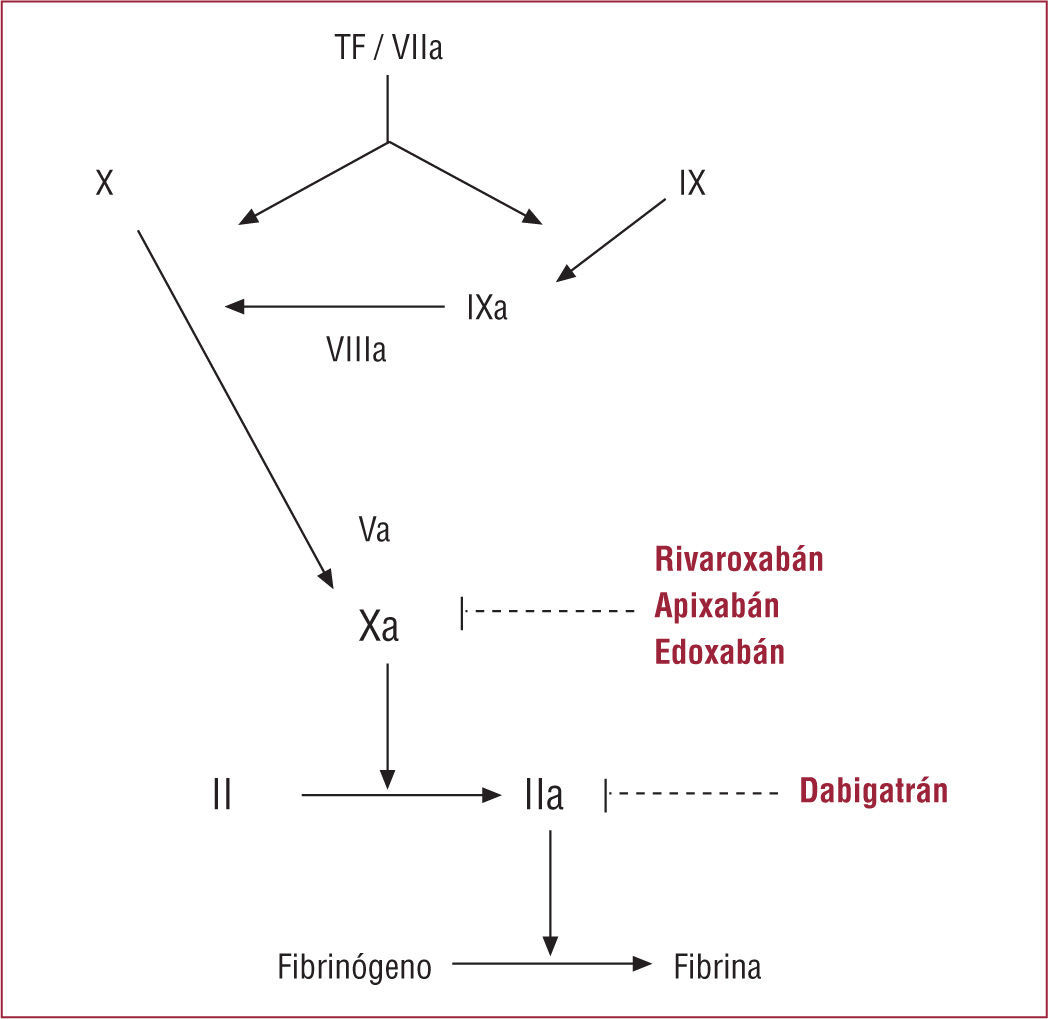
La investigación para encontrar una alternativa a los AVK se ha concentrado en el desarrollo de un anticoagulante oral con amplio margen terapéutico y escasa variabilidad intraindividual e interindividual que pueda administrarse con una dosis fija sin necesidad de monitorizar sistemáticamente la coagulación y con pocas interacciones. El anticoa gulante ideal, además, tendría que ser más seguro y eficaz que los AVK. En la actualidad existen tres inhibidores directos del factor X activado (rivaroxabán, apixabán y edoxabán) y un inhibidor directo de la trombina (dabigatrán) con indicaciones aprobadas en profilaxis y tratamiento antitrombótico en diferentes situaciones11.
Dado que va a haber diversos anticoagulantes disponibles, es preciso entender bien la farmacología, la farmacocinética, la farmacodinámica y su papel terapéutico. Es poco probable que un único fármaco reemplace a los AVK en todas las indicaciones y, como habrá diversas opciones, será necesario un proceso de selección específico ajustado para cada paciente.
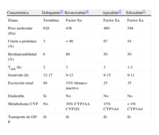
Nuevos anticoagulantes orales aprobados y en desarrollo avanzadoLos cuatro nuevos anticoagulantes con desarrollo clínico más avanzado son dabigatrán, rivaroxabán, apixabán y edoxabán. Su farmacología y su farmacocinética se recogen en la tabla 112-15. Al contrario que los anticoagulantes disponibles hasta el momento, estos fármacos inhiben sus dianas terapéuticas (la trombina o el factor Xa) directamente, en lugar de a través de un cofactor u otros mecanismos indirectos (fig.). Aunque su unión a la zona catalítica de la trombina o del factor Xa es reversible, actualmente no existen antídotos. Su inicio de acción es rápido, tanto como el de las heparinas subcutáneas. Hay otros fármacos en desarrollo, como el darexabán y el betrixabán (inhibidores del factor Xa y de la trombina), pero no tienen estudios en fase III finalizados14,16.
Características de los nuevos anticoagulantes orales
| Característica | Dabigatrán15 | Rivaroxabán14 | Apixabán12 | Edoxabán11 |
| Diana | Trombina | Factor Xa | Factor Xa | Factor Xa |
| Peso molecular (Da) | 628 | 436 | 460 | 548 |
| Unión a proteínas (%) | 3 | > 90 | 87 | 54 |
| Biodisponibilidad (%) | 6 | 80 | 50 | 50 |
| Tmáx (h) | 2 | 3 | 3 | 1-2 |
| Semivida (h) | 12-17 | 9-12 | 8-15 | 9-11 |
| Excreción renal | 80 | 33% fármaco inactivo | 25 | 35 |
| Dializable | Sí | No | No | No |
| Metabolismo CYP | No | 30% CYP3A4, CYP2J2 | 15% CYP3A4 | < 4% CYP3A4 |
| Transporte de GP-P | Sí | Sí | Sí | Sí |
CYP: citocromo P450; GP-P: glucoproteína P; Tmáx: tiempo hasta la concentración máxima.
El rivaroxabán es un inhibidor potente y selectivo del factor Xa. Se une al centro activo del factor Xa y lo inhibe de manera reversible y competitiva. Inhibe el factor Xa libre y el Xa unido en el complejo protrombinasa. Se absorbe vía oral y su biodisponibilidad es superior al 80%. La comida no interfiere en su absorción. El pico plasmático se consigue a las 3h y la semivida es de 5-9h en adultos jóvenes y 11-13 h en ancianos. Un tercio se excreta vía renal sin metabolizar, y el resto de forma inactiva vía renal y en heces en partes iguales. Como otros inhibidores directos del factor Xa, el rivaroxabán prolonga el tiempo de protrombina y reduce el tiempo de tromboplastina parcial activado (TTPA). El mejor test para monitorizar su concentración en plasma es la dosificación de unidades de inhibición del factor Xa (anti-Xa)17. Carece de antídoto, pero hay datos preclínicos de que la administración de concentrado de factores del complejo protrombínico puede ser de utilidad para corregir las alteraciones biológicas en la hemostasia18. No obstante, esto puede no reflejar su eficacia en el sangrado producido por el rivaroxabán19.
ApixabánEl apixabán es un inhibidor selectivo y reversible del centro activo del factor Xa. Al igual que el rivaroxabán, inhibe el factor Xa libre y el que está unido en el complejo protrombinasa. El fármaco se absorbe vía oral y su biodisponibilidad es superior al 50%. El pico plasmático se consigue a las 3h y su semivida puede oscilar entre 8 y 15h. Aproximadamente el 25% se excreta vía renal, mientras el resto aparece en las heces20. La alteración de las pruebas de hemostasia es similar a la que produce el rivaroxabán. Carece de antídoto y es posible que la administración de concentrado de factores del complejo protrombínico sea de utilidad.
Dabigatrán etexilatoEl dabigatrán etexilato se transforma por las esterasas en dabigatrán, que es su metabolito activo. Es un inhibidor directo de la trombina. La biodisponibilidad vía oral es baja, del 6%. El pico plasmático se consigue en 2h y la semivida es de 8h tras una dosis única y de 12-17h tras múltiples dosis. El 80% se elimina vía renal sin metaboli zar. El dabigatrán prolonga el TTPA y tiene un efecto mínimo en el tiempo de protrombina. Prolonga el tiempo de trombina de una manera dependiente de la dosis. Aunque esta es una prueba habitual en los laboratorios de hemostasia y es muy sensible a fármacos inhibidores de la trombina, no es útil para monitorizar su efecto por ser demasiado sensible. Existe una variación del tiempo de trombina, el tiempo de trombina diluido con plasma, que tiene una excelente correlación con la concentración plasmática del dabigatrán. El dabigatrán también prolonga el tiempo de ecarina de manera dependiente de la dosis. El tiempo de ecarina y el tiempo de trombina diluido con plasma son las pruebas más recomendables para evaluar las concentraciones de dabigatrán21.
Papel en la práctica clínicaEl desarrollo clínico de los nuevos anticoagulantes se ha centrado en la prevención y el tratamiento de la tromboembolia venosa, la prevención del ictus y la embolia de origen cardiaco en pacientes con FA no valvular y en prevención secundaria después de un síndrome coronario agudo. En la tabla 2 se muestran las indicaciones actualmente aprobadas por la Agencia Europea del Medicamento (EMA) para los diferentes anticoagulantes. Para la profilaxis de la tromboembolia venosa tras cirugía ortopédica, están aprobados el rivaroxabán, el apixabán y el dabigatrán, porque en diversos ensayos clínicos se ha demostrado eficacia y seguridad similares a las de la enoxaparina, y en algunos aspectos son superiores22-28. El edoxabán está disponible en Japón. El rivaroxabán está aprobado como tratamiento inicial de la trombosis venosa profunda, de la embolia pulmonar y también en la prevención de recurrencias a largo plazo (estudios Einstein-DVT, Einstein-PE y Einstein-EXT)29,30. El dabigatrán ha mostrado eficacia y seguridad similares a las de la warfarina en el tratamiento de la tromboembolia venosa (RE-COVER)31. Los estudios de prevención secundaria en los que se compara el dabigatrán con la warfarina (REMEDY) o con placebo (RE-SONATE) están finalizados, pero aún no se han publicado.
Indicaciones de los nuevos anticoagulantes orales aprobadas por la Agencia Europea del Medicamento
| Dabigatrán | Rivaroxabán | Apixabán | |
| Profilaxis de tromboembolia venosa en cirugía ortopédica programada (prótesis de rodilla o cadera) | Dosis de inicio de 110mg y luego 220mg/24h (75mg y luego 150mg si insuficiencia renal moderada o edad>75 años o con algunos fármacos) | 10mg/24h | 2,5mg/12h |
| Tratamiento de la trombosis venosa profunda (TVP) y de la embolia pulmonar (EP), y prevención de las recurrencias de la TVP y de la EP en pacientes adultos | 15mg/12h 3 semanas, luego 20mg/24h (15mg/24h si insuficiencia renal moderada y riesgo de sangrado superior al de recurrencia) | ||
| Prevención del ictus y la embolia sistémica en pacientes con fibrilación auricular | 150mg/12h (menores de 80 años); 110mg/12h (mayores de 80 años, pacientes con riesgo hemorrágico, combinaciones con algunos fármacos) | 20mg/24h (15mg/24h si insuficiencia renal moderada) |
Tras un síndrome coronario agudo, a pesar del tratamiento con ácido acetilsalicílico o tienopiridinas persiste un riesgo de recurrencias elevado. Debido a que sobre las lesiones ateroscleróticas causantes de la clínica existe una trombosis que es la causa directa del episodio clínico, siempre ha habido interés en investigar los posibles beneficios de los anticoagulantes añadidos al tratamiento antiagregante habitual. En la mayoría de los estudios en fase II, los nuevos anticoagulantes muestran cierta eficacia a costa de un aumento de sangrado dependiente de la dosis. En este contexto se han realizado dos estudios en fase III32,33. Se comparó el apixabán en dosis de 5mg/12h con placebo en pacientes antiagregados después de un síndrome coronario agudo reciente32. El ensayo tuvo que suspenderse prematuramente, tras incluir a 7.392 pacientes, debido a un incremento de sangrados sin una reducción de eventos coronarios recurrentes. El objetivo de eficacia (muerte cardiovascular, infarto e ictus) ocurrió en el 7,5% de los pacientes del grupo de apixabán (13,2% pacientes/año) y en el 7,9% del grupo placebo (14% pacientes/año). Ocurrieron hemorragias mayores en el 1,3% del grupo de apixabán (2,4 eventos/100 pacientes/año) y en el 0,5% del grupo placebo (0,9 eventos/100 pacientes/año) (con apixabán, hazard ratio [HR]=2,59; intervalo de confianza del 95% [IC95%], 1,50-4,46; p=0,001). También se observaron más sangrados intracraneales en el grupo de apixabán.
Sin embargo, los resultados de un estudio similar realizado con rivaroxabán han sido diferentes. El rivaroxabán se ha estudiado en un ensayo clínico controlado con placebo en el que se distribuyó aleatoriamente a 15.526 pacientes en tres grupos33, uno tratado con 2,5mg/12h, otro con 5mg/12h y otro con placebo. El objetivo de eficacia era la suma de infarto de miocardio, ictus y muerte de origen cardiovascular. Se observó que el rivaroxabán, comparado con placebo, reducía de manera significativa el objetivo de eficacia el 8,9 y el 10,7%. Además, la dosis de 2,5mg/12h redujo la mortalidad cardiovascular (el 2,7 contra el 4,1%; p=0,002) y la mortalidad por cualquier causa (el 2,9 contra el 4,5%; p=0,002). Esto no se observó con la dosis de 5mg/12h. El rivaroxabán aumentó el sangrado mayor (el 2,1 frente al 0,6%; p<0,001) y la hemorragia intracraneal (el 0,6 frente al 0,2%; p=0,009) sin incremento de sangrado mortal. La dosis baja de rivaroxabán produjo menos hemorragias mortales que la más alta (el 0,1 frente al 0,4%; p=0,04). El estudio muestra que añadir unas dosis bajas de anticoagulantes a los antiagregantes puede ser útil en la prevención de recurrencias tras un síndrome coronario agudo.
Prevención de ictus y embolia sistémica en pacientes con fibrilación auricularLa FA es la arritmia más frecuente, con una estimación de prevalencia sobre el 1% de la población que posiblemente se incremente en el futuro5,34-36. El ictus isquémico es la complicación más importante, con un riesgo relativo (RR) 2-7 veces mayor que el de los pacientes sin FA5,34,35. Existen dos índices de estratificación de riesgo tromboembólico para pacientes con FA: CHADS2 y CHA2DS2-Vasc. Los ensayos clínicos han utilizado para estatificar los riesgos de los pacientes el índice CHADS2, que incluye factores comunes (insuficiencia cardiaca, hipertensión, edad ≥ 75 años, diabetes mellitus, antecedentes de ictus o isquemia transitoria). Las guías actuales recomiendan anticoagulación si el CHADS2 es ≥ 25,34,35. También proponen anticoagulación si el CHADS2 es 1 y el paciente presenta escaso riesgo hemorrágico.
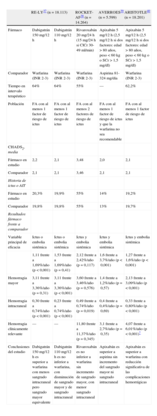
Los nuevos anticoagulantes orales se han evaluado en cuatro ensayos clínicos fundamentales en fase III. Los resultados más importantes se detallan en la tabla 337-40.
Comparación de los ensayos clínicos de fase III en la prevención de las embolias de origen cardiaco en fibrilación auricular.
| RE-LY37 (n=18.113) | ROCKET-AF38 (n=14.264) | AVERROES39 (n=5.599) | ARISTOTLE40 (n=18.201) | ||
| Fármaco | Dabigatrán 150mg/12h | Dabigatrán 110mg/12h | Rivaroxabán 20mg/24h (15mg/24h si ClCr 30-49ml/min) | Apixabán 5mg/12h (2,5mg/12h si dos factores: edad>80 años, peso<60kg o SCr>1,5mg/dl) | Apixabán 5mg/12h (2,5mg/12h si dos factores: edad>80 años, peso<60kg o SCr>1,5mg/dl) |
| Comparador | Warfarina (INR 2-3) | Warfarina (INR 2-3) | Warfarina (INR 2-3) | Aspirina 81-324mg/día | Warfarina (INR 2-3) |
| Tiempo en intervalo terapéutico | 64% | 64% | 55% | — | 62,2% |
| Población | FA con al menos 1 factor de riesgo de ictus | FA con al menos 1 factor de riesgo de ictus | FA con al menos 2 factores de riesgo de ictus | FA con al menos 1 factor de riesgo de ictus y que la warfarina no sea recomendable | FA con al menos 1 factor de riesgo de ictus |
| CHADS2, media | |||||
| Fármaco en estudio | 2,2 | 2,1 | 3,48 | 2,0 | 2,1 |
| Comparador | 2,1 | 2,1 | 3,46 | 2,1 | 2,1 |
| Historia de ictus o AIT | |||||
| Fármaco en estudio | 20,3% | 19,9% | 55% | 14% | 19,2% |
| Comparador | 19,8% | 19,8% | 55% | 13% | 19,7% |
| Resultados fármaco frente a comparador | |||||
| Variable principal de eficacia | Ictus o embolia sistémica | Ictus o embolia sistémica | Ictus y embolia sistémica | Ictus y embolia sistémica | Ictus y embolia sistémica |
| 1,11 frente a 1,69%/año (p<0,001) | 1,53 frente a 1,69%/año (p=0,41) | 2,12 frente a 2,42%/año (p=0,117) | 1,6 frente a 3,7%/año (p<0,001) | 1,27 frente a 1,6%/año (p<0,001) | |
| Hemorragia mayor | 3,11 frente a 3,36%/año (p=0,31) | 3,11 frente a 3,36%/año (p<0,001) | 3,60 frente a 3,46%/año (p=0,576) | 1,4 frente a 1,2%/año (p=0,57) | 2,13 frente a 3,09%/año (p<0,001) |
| Hemorragia intracraneal | 0,30 frente a 0,74%/año (p<0,001) | 0,23 frente a 0,74%/año (p<0,001) | 0,49 frente a 0,74%/año (p=0,019) | 0,4 frente a 0,4%/año (p=0,69) | 0,33 frente a 0,80%/año (p<0,001) |
| Hemorragia clínicamente relevante | — | — | 11,80 frente a 11,37%/año (p=0,345) | 3,1 frente a 2,7%/año (p=0,35) | 4,07 frente a 6,01%/año (p<0,001)* |
| Conclusiones del estudio | Dabigatrán 150mg/12h es superior a warfarina con menos sangrado intracraneal pero sangrado mayor equivalente | Dabigatrán 110mg/12h es no inferior a warfarina, con disminución de sangrado mayor y de sangrado intracraneal | Rivaroxabán es no inferior a warfarina sin incremento de sangrado mayor, con menor sangrado intracraneal | Apixabán es superior a aspirina sin incremento del sangrado mayor ni sangrado intracraneal | Apixabán es superior a warfarina con reducción significativa de las complicaciones hemorrágicas |
AIT: ataque isquémico transitorio; CHADS2: insuficiencia cardiaca, hipertensión, edad>75 años, diabetes mellitus, historia de ictus o AIT; ClCr: aclaramiento de creatinina; FA: fibrilación auricular; INR: razón internacional normalizada; SCr: creatinina en suero.
El ensayo RE-LY estaba previsto como de no inferioridad y evaluó de manera enmascarada dos dosis de dabigatrán comparándolas con warfarina de manera abierta (INR diana, 2-3) en 18.113 pacientes con FA no valvular y riesgo de ictus37. El objetivo de eficacia era el ictus o la embolia sistémica. La tasa de ictus y embolias sistémicas por año fue del 1,69% en el grupo con warfarina, el 1,53% en el grupo de dabigatrán 110mg/12h (RR=0,91; IC95%, 0,74-1,11; p<0,001 para no inferioridad) y el 1,11% en el grupo de dabigatrán 150mg/12h (RR=0,66; IC95%, 0,53-0,82; p<0,001 para superioridad). La tasa de hemorragia mayor por año fue del 3,36% en el grupo de warfarina, frente al 2,71% en el grupo de dabigatrán 110 mg (p=0,003) y el 3,11% en el grupo de dabigatrán 150mg (p=0,31). La tasa de ictus hemorrágico por año fue del 0,38% en el grupo de warfarina, el 0,12% con dabigatrán 110mg (p<0,001) y el 0,10% con dabigatrán 150mg (p<0,001). La mortalidad total por año fue del 4,13% en el grupo de warfarina, el 3,75% en el grupo con dabigatrán 110mg (p=0,13) y el 3,64% en el grupo de dabigatrán 150mg (p=0,051). La conclusión es que la dosis de dabigatrán de 150mg/12h fue superior a la warfarina en la prevención del ictus, con un riesgo hemorrágico similar y mayor riesgo hemorrágico gastrointestinal, pero menor riesgo de hemorragia cerebral37. La dosis de dabigatrán 110mg/12h no fue inferior a la warfarina en la prevención del ictus con menor riesgo hemorrágico. Tras la publicación original, se han realizado múltiples subanálisis que no han cambiado esencialmente las conclusiones generales. En los pacientes que ya habían sufrido un ictus, comparados con los que no, se mantenía la mayor eficacia de la dosis de dabigatrán de 150mg y la menor tasa de hemorragias de la dosis de dabigatrán de 110mg41. Otro subestudio evaluó si los efectos eran diferentes si los pacientes habían tomado warfarina previamente a la inclusión en el estudio RE-LY o no42. No se observaron diferencias respecto a los beneficios del dabigatrán identificados en el estudio principal. También se evaluó si existían diferencias teniendo en cuenta las diferentes puntuaciones del índice CHADS243. Se encontró que las tasas de ictus o embolia sistémica, hemorragia intracraneal, hemorragia mayor y mortalidad se incrementaban con el aumento del índice CHADS2 en todos los pacientes. Las tasas de ictus o embolia sistémica con dabigatrán 150mg/12h o de sangrado intracraneal con ambas dosis de dabigatrán fueron inferiores que con la warfarina en todos los subgrupos. En un análisis teniendo en cuentala calidad del control, se observó que el beneficio de dabigatrán (150mg/12h en la reducción de ictus y 110mg/12h en la reducción de sangrado intracraneal) no estaba influido por la calidad de los controles de los centros, pero para todos los eventos vasculares, eventos no hemorrágicos y mortalidad, el dabigatrán fue superior en los lugares con peor control de INR44.
Durante el estudio RE-LY se realizaron 1.983 cardioversiones electivas en 1.270 pacientes. Se analizó la tasa de complicaciones tromboembólicas, que fue muy baja y similar en los tres brazos del estudio. Por ello, se concluyó que el dabigatrán en ambas dosis era igual de eficaz y seguro que la warfarina en pacientes que precisan cardioversión eléctrica electiva45. De hecho, el tamaño de muestra de este subestudio es el mayor de los que han evaluado anticoagulantes en esta situación, y sus resultados aportan soluciones muy prácticas, ya que en la vida real, cuando se anticoagula a un paciente para este procedimiento, es difícil conseguir un nivel estable de anticoagulación y los procedimientos pueden posponerse debido a que el INR el día que se va a realizar no está en el intervalo deseado. Para estas situaciones puede ser preferible el dabigatrán.
En cuanto a la seguridad, dado que los pacientes ancianos tienen mayor riesgo trombótico, pero también hemorrágico, se ha realizado un análisis de las complicaciones hemorrágicas según la edad. En comparación con la warfarina, los pacientes menores de 75 años tratados con dabigatrán 150mg/12h mostraron menos complicaciones hemorrágicas intracraneales y extracraneales. En cambio, los mayores de 75 años sufrieron menos hemorragias intracraneales pero más hemorragias extracraneales (RR=1,39; p<0,001), en especial de origen gastrointestinal (RR=1,16; p<0,001)46.
Desde la publicación del ensayo RE-LY, existe un debate sobre la posible mayor incidencia de eventos coronarios agudos en los pacientes tratados con dabigatrán47,48. Aunque se han reanalizado los datos y no está clara esta asociación, algunas guías no recomiendan el dabigatrán para pacientes con cardiopatía isquémica5. Algunos autores han analizado si el dabigatrán aumenta o la warfarina disminuye los eventos cardiovasculares isquémicos, y no han encontrado diferencias significativas en las tasas de infarto48. Al contrario, han mostrado una disminución de los eventos cardiovasculares totales en los pacientes tratados con dabigatrán respecto a los tratados con warfarina48.
Estudio ROCKET-AFEl estudio ROCKET-AF38 también ha comparado el rivaroxabán con la warfarina en pacientes con FA no valvular. En este estudio los pacientes presentaban un riesgo mayor de ictus, con una media de edad ligeramente superior y una media de puntuación CHADS2 superior. La calidad de control de la warfarina fue menor que en el estudio RE-LY (el 55% del tiempo en intervalo terapéutico en el ROCKET-AF y el 64% en el RE-LY). Se incluyó a 14.264 pacientes con un diseño a doble ciego; en una rama se administraba warfarina para mantener el INR entre 2 y 3 y en la otra, rivaroxabán 20mg/24h (15mg/24h si el aclaramiento de creatinina era 30-49ml/min). Para mantener el enmascaramiento, los pacientes asignados a la rama de rivaroxabán recibían placebo de warfarina y seguían unos controles simulados de INR, con cambios de dosis de placebo. En el análisis de eficacia, cuando se evaluó en los pacientes que completaron el ensayo clínico según el protocolo, durante el tratamiento con los fármacos del ensayo el objetivo de eficacia (ictus o embolia sistémica) se observó en el 1,7% pacientes/año de los tratados con rivaroxabán y en el 2,2% pacientes/año de los tratados con warfarina (HR=0,79; IC95%, 0,66-0,96; p<0,02). Al realizar el análisis por intención de tratar, el objetivo de eficacia se observó en el 2,1% pacientes/año en el grupo de rivaroxabán y el 2,4% pacientes/año en el grupo de warfarina (HR=0,88; IC95%, 0,74-1,03; p<0,001 para no inferioridad; p=0,12 para superioridad). Tras finalizar el estudio, el 92,2% de los pacientes continuaron con AVK. Durante el periodo de transición, los pacientes que habían recibido rivaroxabán tardaron una media de 13 días en llegar al margen terapéutico de INR (3 días los que ya habían recibido warfarina). En este lapso se observaron más eventos en los pacientes que previamente habían recibido rivaroxabán (22 frente a 7; p=0,008). Esto puede explicarse porque la semivida del rivaroxabán es corta y su efecto desaparece rápidamente. En cambio, los AVK, especialmente la warfarina, tardan varios días en llegar a concentraciones terapéuticas, por lo que los pacientes que realizaron el cambio de rivaroxabán a warfarina estuvieron desprotegidos cierto tiempo, mientras que los que siguieron con warfarina no.
La hemorragia mayor o no mayor pero clínicamente relevante se observó en el 14,9%/año de los pacientes tratados con rivaroxabán y en el 14,5%/año de los tratados con warfarina (HR=1,03; IC95%, 0,96- 1,11; p=0,44), con una significativa reducción del sangrado intracraneal (el 0,5 frente al 0,7%; p=0,02) y la hemorragia mortal (el 0,2 frente al 0,5%; p=0,003) en el grupo tratado con rivaroxabán. En este grupo se registraron más pacientes con descensos de hemoglobina superiores a 2 g/dl y más transfusiones que en el grupo tratado con warfarina (el 2,8%/año frente al 2,3%/año; p=0,02 y el 1,6%/año frente al 1,3%/año; p=0,04). En cambio, las hemorragias en localizaciones anatómicas consideradas críticas (intracraneales, intraespinales, intraoculares, pericárdicas, intraarticulares, intramusculares con compromiso compartimental o retroperitoneal) fueron menos frecuentes en los pacientes que recibieron rivaroxabán (el 0,8%/año frente al 1,2%/año; p=0,007). Una característica diferencial del rivaroxabán respecto a los otros anticoagulantes es que se ha utilizado en una sola dosis diaria.
Estudio AVERROESEl apixabán se ha evaluado en dos estudios. En el estudio AVERROES39, se comparó apixabán con ácido acetilsalicílico en la prevención del ictus en pacientes con FA para quienes no se consideraba adecuada la warfarina, basándose en unos criterios preespecificados. Se distribuyó aleatoriamente a 5.599 pacientes a apixabán 5mg/12h o a ácido acetilsalicílico con dosis entre 81 y 324mg/24h. El objetivo de eficacia (ictus o embolia sistémica) se observó en el 1,6%/año en el grupo de apixabán y el 3,7%/año en el grupo de ácido acetilsalicílico (HR=0,45; IC95%, 0,32-0,62; p<0,001). Las tasas de mortalidad fueron del 3,5%/año en el grupo de apixabán y el 4,4%/año en el grupo de ácido acetilsalicílico (HR=0,79; IC95%, 0,62-1,02; p=0,07). La hemorragia mayor se observó en el 1,4%/año en el grupo de apixabán y el 1,2%/año en el grupo de ácido acetilsalicílico (HR=1,13; IC95%, 0,74-1,75; p=0,57). Los sangrados intracraneales ocurrieron en el 0,4%/año en el grupo de apixabán y el 0,5%/año en el grupo de ácido acetilsalicílico. El estudio tuvo que suspenderse prematuramente al observarse una clara superioridad del apixabán: los pacientes que recibían apixabán mostraban menos eventos tromboembólicos sin incremento del riesgo hemorrágico, comparados con el grupo de ácido acetilsalicílico.
Estudio ARISTOTLEEn el estudio ARISTOTLE40 se comparó el apixabán con la warfarina. Se incluyó a 18.201 pacientes con FA y una puntuación CHADS2 de 2,1 de media y se los aleatorizó a warfarina (INR 2-3) o apixabán 5mg/12h. La dosis de apixabán se disminuyó a 2,5mg/12h para los pacientes con dos o más de los siguientes criterios: más de 80 años de edad, peso<60kg o creatinina>1,5mg/dl. La tasa combinada de ictus isquémico o hemorrágico y embolia sistémica fue del 1,27%/año en el grupo de apixabán y el 1,60%/año en el grupo de warfarina (HR=0,79; IC95%, 0,66-0,95; p<0,001 para no inferioridad; p=0,01 para superioridad). La tasa de sangrado mayor fue más baja en el grupo de apixabán que en el de warfarina (el 2,13 y el 3,09%/año; HR=0,69; IC95%, 0,60-0,80; p<0,001) y la tasa de ictus hemorrágico fue menor (el 0,24% y el 0,47%/año; HR=0,51; IC95%, 0,35-0,75; p<0,001). El tiempo medio en intervalo terapéutico en el grupo warfarina fue del 62%. También se objetivó una menor mortalidad por cualquier causa en el grupo de apixabán: el 3,52 y el 3,94% (HR=0,89; IC95%, 0,80- 0,99; p=0,047).
Consideraciones generales en la práctica clínicaDada la reciente aparición de los nuevos anticoagulantes, todavía no hay una experiencia amplia sobre su uso en la vida real, sobre todo a largo plazo. Su seguridad y su eficacia fuera del contexto de los ensayos clínicos aún no son conocidas. Un problema general de este tipo de fármacos que no precisan control puede ser una menor adherencia de los pacientes al tratamiento49.
Aunque los nuevos anticoagulantes orales representarán un avance en el tratamiento anticoagulante, se plantean retos y cuestiones que no están completamente clarificadas49,50. Por ejemplo, el manejo antes y después de la cirugía, procedimientos invasivos, anestesia neuroaxial, hemorragia, necesidad de cirugía urgente o reversión urgente sin disponibilidad de antídotos. Con los AVK, disponer de la determinación del INR para conocer el grado de efecto anticoagulante y qué estrategia de reversión es más adecuada a la situación clínica facilita el manejo clínico.
No disponer actualmente y en general de un modo de medir el efecto de los nuevos anticoagulantes y el desconocimiento de los intervalos terapéuticos medidos según tests biológicos dificultan su manejo en caso de interacciones medicamentosas o función renal alterada.
Determinación del efecto de los nuevos anticoagulantesA pesar de que no es necesaria la monitorización sistemática, en ciertas circunstancias puede ser recomendable. Por ejemplo, para evaluar el cumplimiento, en situación de complicación tromboembólica o hemorrágica, antes de procedimientos invasivos o cirugía o en caso de anestesia neuroaxial. También puede ser recomendable conocer las concentraciones para ver si es posible realizar una trombolisis en caso de ictus o infarto.
Los nuevos anticoagulantes afectan a los tests generales de manera dependiente de la dosis49.
El tiempo de trombina y de ecarina es sensible a la concentración de dabigatrán. La prueba que muestra una buena correlación con la concentración de dabigatrán es una modificación del tiempo de trombina diluida con plasma normal. El TTPA es sensible, pero no de manera lineal, a las concentraciones altas de dabigatrán49,51. El tiempo de protrombina es poco sensible. El rivaroxabán y el apixabán prolongan el tiempo de protrombina y en menor grado, el TTPA49,52. La prueba más sensible candidata a utilizarse en su monitorización es la determinación de las concentraciones de anti-Xa, más específica por ser su mecanismo de acción. La máxima alteración de las pruebas de laboratorio ocurre al tiempo que el pico de concentración plasmática (tabla 2) y declina con el tiempo. No se ha determinado ni el intervalo terapéutico ni el momento idóneo para su determinación. Las pruebas de laboratorio pueden ser útiles, sobre todo si son normales, para determinar la ausencia de efecto del fármaco. Por el momento no son adecuadas para ajustar la dosis del fármaco ni para cuantificar el efecto anticoagulante53. Esto supone un cambio de la visión de las pruebas de laboratorio en el manejo de los anticoagulantes respecto a la situación con los anticoagulantes clásicos.
Interacciones farmacológicasLos AVK tienen gran número de interacciones farmacológicas, dietéticas, con preparados de herboristería, suplementos alimentarios o cambios de dieta54. Esto facilita su potenciación con el aumento del riesgo hemorrágico o la disminución de efecto, con el consiguiente riesgo tromboembólico. No obstante, las interacciones se detectan con la monitorización del INR, y la dosis de AVK se puede ajustar.
Con los nuevos anticoagulantes, la situación es diferente. Estos fármacos son también susceptibles de interacciones farmacocinéticas, pero no hay demasiada información sobre este campo y los parámetros de laboratorio no pueden guiar la dosificación en caso de que se presenten interacciones.
El dabigatrán, el rivaroxabán y el apixabán son sustratos de la glucoproteína P (GP-P), que es un transportador que funciona como una bomba de flujo que dificulta la absorción de determinadas sustancias. Los inhibidores de la GP-P aumentan la absorción, por lo que causan incremento en las concentraciones plasmáticas, y los inductores de la GP-P las disminuyen. Por ejemplo, los inhibidores de la GP-P (como la amiodarona, el ketoconazol, la quinidina y el verapamilo) incrementan la exposición del dabigatrán, y los inductores como la rifampicina la disminuyen54,55. Es probable que otros inductores e inhibidores de la GP-P influyan en las concentraciones de dabigatrán, rivaroxabán y apixabán, pero la investigación sobre estas interacciones es todavía escasa54,55.
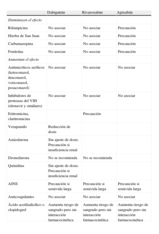
En la tabla 4 se muestran algunas de las interacciones reconocidas con los nuevos anticoagulantes. Un ejemplo del poco conocimiento que se tiene en este campo es la diversidad de recomendaciones de las agencias reguladoras sobre las interacciones. Por ejemplo, el ketoconazol incrementa la exposición a dabigatrán un 140-150%. La Food and Drug Administration (FDA) de Estados Unidos no recomienda un ajuste de dosis, mientras que Canadá y la EMA contraindican esa combinación. La EMA incluye más inhibidores de la GP-P, como la ciclosporina, el itraconazol o el tacrolimus.
Interacciones farmacológicas de los nuevos anticoagulantes.
| Dabigatrán | Rivaroxabán | Apixabán | |
| Disminuyen el efecto | |||
| Rifampicina | No asociar | No asociar | Precaución |
| Hierba de San Juan | No asociar | No asociar | Precaución |
| Carbamazepina | No asociar | No asociar | Precaución |
| Fenitoína | No asociar | No asociar | Precaución |
| Aumentan el efecto | |||
| Antimicóticos azólicos (ketoconazol, itraconazol, voriconazol, posaconazol) | No asociar | No asociar | No asociar |
| Inhibidores de proteasas del VIH (ritonavir y similares) | No asociar | No asociar | No asociar |
| Eritromicina, claritromicina | Precaución | ||
| Verapamilo | Reducción de dosis | ||
| Amiodarona | Sin ajuste de dosis. Precaución si insuficiencia renal | ||
| Dronedarona | No se recomienda | No se recomienda | |
| Quinidina | Sin ajuste de dosis. Precaución si insuficiencia renal | ||
| AINE | Precaución si semivida larga | Precaución si semivida larga | Precaución si semivida larga |
| Anticoagulantes | No asociar | No asociar | No asociar |
| Ácido acetilsalicílico o clopidogrel | Aumenta riesgo de sangrado pero sin interacción farmacocinética | Aumenta riesgo de sangrado pero sin interacción farmacocinética | Aumenta riesgo de sangrado pero sin interacción farmacocinética |
AINE: antiinflamatorios no esteroideos; VIH: virus de la inmunodeficiencia humana.
El dabigatrán no se metaboliza por el sistema del citocromo P450 (CYP), pero el rivaroxabán y el apixabán sí. Parece que el CYP3A4 actúa de manera sinérgica con la GP-P aumentando la biodisponibilidad56. Es posible que los fármacos que tengan efecto en los dos sistemas modifiquen de manera más importante que los que sólo afecten a uno. Por ejemplo, el rivaroxabán ve incrementadas las concentraciones por ketoconazol y otros antifúngicos azólicos, ritonavir y otros inhibidores de proteasas, claritromicina y eritromicina, mientras rifampicina, fenitoína, carbamazepina, fenobarbital e hipérico (hierba de San Juan) las reducen.
Uso en pacientes con insuficiencia renalLos pacientes con insuficiencia renal anticoagulados muestran un aumento del riesgo de hemorragia57. Los nuevos anticoagulantes tienen un grado variable de eliminación renal. El 80% del dabigatrán se elimina por vía renal, el 36% del rivaroxabán y el 25% del apixabán (tabla 2). Los ensayos clínicos en fase III habitualmente excluyen a los pacientes con aclaramiento de creatinina (ClCr)<30ml/min37. El dabigatrán no está indicado en estos pacientes. El rivaroxabán no está recomendado en pacientes con ClCr<15ml/min. A pesar de las tasas de eliminación renal relativamente bajas del rivaroxabán y del apixabán, la posología utilizada en los ensayos de FA se redujo en los pacientes con insuficiencia renal38-40. En el ensayo ROCKET-AF38, se excluyó a los pacientes con ClCr<30ml/min y la dosis de rivaroxabán se redujo para el 21% de los pacientes con ClCr 30-49ml/min. En los ensayos AVERROES39 y ARISTOTLE40, se excluyó a los pacientes con ClCr<25 ml/min y la dosis se redujo de 5 a 2,5mg/12h para los pacientes que presentaban dos de los siguientes criterios: edad>80 años, peso<60kg o creatinina de más de 1,5mg/dl. No se ha comunicado subanálisis de los pacientes que recibieron la dosis inferior, pero la eficacia y la seguridad del apixabán concordaron en los subgrupos según la edad o la función renal.
En el estudio RE-LY no se incluyó a pacientes con insuficiencia renal grave (ClCr<30ml/min), pero sí con insuficiencia renal moderada o leve37,46. Si bien las tasas de sangrado mayor aumentaban de manera general en los pacientes con deterioro de la función renal, al comparar las dos dosis de dabigatrán entre sí o con warfarina, no se apreciaban diferencias entre los grupos, con la excepción de que en los pacientes con ClCr<50ml/min, el menor riesgo hemorrágico de la dosis de dabigatrán 110mg/12h respecto a warfarina observado en el análisis general no se observaba en este subgrupo de pacientes37,46. La FDA aprobó la dosis de 150mg/12h para todos los pacientes con ClCr>30ml/min y una dosis de 75mg/12h para los pacientes con ClCr 15-30ml/min basándose en modelos farmacocinéticos, aunque esta dosis no se ha evaluado clínicamente58. Las demás agencias reguladoras contraindican el dabigatrán si ClCr < 30ml/min.
La falta de métodos para medir adecuadamente la magnitud de la anticoagulación con los nuevos anticoagulantes añade complejidad al uso de estos fármacos en pacientes con insuficiencia renal, particularmente en los que el grado de alteración puede variar dependiendo de situaciones intercurrentes (deshidratación, nefrotoxicidad por otros fármacos, pacientes muy ancianos). También hay preocupación sobre la eliminación en situaciones en que se precise retirar los fármacos por hemorragia o procedimientos invasivos o cirugía49. Harían falta estudios de evaluación de estos fármacos en este tipo de pacientes en cuanto a seguridad y eficacia.
Tratamiento en caso de sangradoLos pacientes anticoagulados pueden sufrir hemorragias por el efecto propio de los fármacos anticoagulantes o por situaciones intercurrentes que puedan desencadenar un sangrado, como traumatismo, caídas, lesiones anatómicas, etc. Aunque los nuevos anticoagulantes pueden ser más seguros, actualmente no existen antídotos que neutralicen su efecto. El tratamiento de la hemorragia relacionada con estos fármacos consiste en las medidas generales de soporte vital, transfusión de hemoderivados, mantener la volemia y esperar a que su efecto desaparezca, dado que su vida media es corta y su eliminación, rápida49,50. En el caso del dabigatrán, puede acelerarse la eliminación por diálisis o forzando la diuresis. Aun así, puede ser necesario antagonizar su efecto con agentes hemostáticos como los concentrados de factores del complejo protrombínico, concentrado de factores del complejo protrombínico con factores activados (FEIBA®) o factor VIIa recombinante (r-FVIIa), que generen trombina suficiente para favorecer la hemostasia. La experiencia clínica es escasa, pero se proponen porque hay datos experimentales en modelos animales o en voluntarios sanos18,19,59. Los datos son dispares ya que, por ejemplo, un concentrado de factores del complejo protrombínico puede corregir las alteraciones biológicas en la hemostasia causadas con rivaroxabán más que las de dabigatrán. En cambio, en un modelo de hemorragia en conejos, ni el r-FVIIa ni los concentrados de factores del complejo protrombínico pudieron disminuir la cuantía de la hemorragia18,19. Es necesario disponer de datos clínicos en situaciones reales para establecer qué tipo de tratamiento hemostático es el más adecuado. También sería muy aconsejable disponer de antídotos específicos capaces de bloquear el efecto del fármaco circulante en caso de intoxicación, cirugía urgente o hemorragia grave.
ConclusionesHasta hace poco, la selección de un anticoagulante oral se limitaba a los AVK, que en la práctica muestran escasas diferencias. Los nuevos fármacos orales inhibidores directos estarán disponibles pronto para diversas indicaciones. En el periodo de transición, habrá que identificar inicialmente qué pacientes pueden beneficiarse de determinado fármaco. Habrá que considerar cuestiones de eficacia, seguridad y farmacológicas, sobre todo en lo referente a la función renal y las interacciones.
La falta de antídoto es una cuestión relevante respecto a la generalización en todas las situaciones y que genera incertidumbre, sobre todo por la poca experiencia existente en el tratamiento de las complicaciones hemorrágicas.
Es muy importante favorecer la adherencia de los pacientes, sobre todo mediante una educación específica como paciente anticoagulado, ya que, independientemente del anticoagulante prescrito, existen riesgos y precauciones comunes a todos los pacientes que reciben anticoagulantes. Si la adherencia a los anticoagulantes disminuye, en parte por la falta de controles y por la falsa sensación de seguridad, las posibles ventajas de eficacia y seguridad pueden verse sobrepasadas por una mayor incidencia de complicaciones tromboembólicas en los pacientes con mala adherencia. Por todo esto, es crucial reforzar en el paciente la importancia de la adherencia y el correcto cumplimiento terapéutico. En este contexto, las unidades de tratamiento anticoagulante pueden tener un papel decisivo tanto en los procesos de transición terapéutica como en los educativos y de resolución de situaciones clínicas complejas.
Conflicto de interesesNinguno.