Los inhibidores del cotransportador de sodio-glucosa tipo 2 son una nueva clase de hipoglucemiantes orales que aumentan de la excreción urinaria de glucosa independientemente de la secreción de insulina. Sin embargo, este mecanismo aparentemente sencillo conduce a efectos metabólicos indirectos más complejos. Los resultados clínicos demuestran su efectividad en el control de la glucemia, pues reducen la glucohemoglobina y, al mismo tiempo, logran una disminución del peso corporal y de la presión arterial sistólica. Esta revisión proporciona una visión general de la evidencia disponible hasta el momento sobre el mecanismo de acción, la eficacia y la seguridad, así como otros factores de riesgo más allá de la glucosa que se podría modular de manera positiva con los fármacos comercializados actualmente. Datos recientes sobre la empagliflozina que muestran un beneficio cardiovascular específico obligan a actualizar el conocimiento de esta nueva clase terapéutica para el tratamiento de la diabetes mellitus tipo 2.
Palabras clave
La diabetes mellitus tipo 2 (DM2) se asocia a un elevado riesgo cardiovascular y, dadas las proporciones epidémicas a las que está llegando1, las distintas guías de manejo ponen de relieve la necesidad de prevenir y reducir las complicaciones cardiovasculares mejorando el control glucémico, especialmente en las etapas precoces de la enfermedad2. El objetivo general del tratamiento es mantener la glucemia lo más cerca posible de la normalidad con el fin de prevenir o retrasar la aparición de complicaciones microvasculares y macrovasculares.
Los fármacos que disminuyen o regulan la glucosa se han incrementado en los últimos años y, a consecuencia de ello, el tratamiento de la DM2 se ha vuelto cada vez más complejo y cambiante. Las actuales recomendaciones hacen hincapié en la individualización de los objetivos glucémicos, y en la mayoría de las ocasiones son necesarias combinaciones de distintos fármacos con diferentes mecanismos de acción para aproximar la glucohemoglobina (HbA1c) a la proporción aconsejada del 7,0% y, dependiendo del tipo de paciente, con objetivos más o menos estrictos.
Como primera línea de tratamiento, se recomienda la metformina, seguida de manera individualizada de una sulfonilurea, la pioglitazona, un inhibidor de la dipeptidil peptidasa tipo 4, un análogo del péptido similar al glucagón tipo 1 o insulina. Sin embargo, cada uno tiene sus propios efectos secundarios y sus limitaciones, como el aumento del riesgo cardiovascular por efecto cardiaco directo en el precondicionamiento isquémico con las sulfonilureas3, la ganancia ponderal y las hipoglucemias con la insulina y el riesgo de insuficiencia cardiaca con pioglitazona. En el caso de las terapias incretínicas, el inconveniente principal es que una sustancial proporción de pacientes serán no respondedores4. Por lo tanto, el desarrollo de nuevas terapias debe basarse en minimizar estos fenómenos reduciendo la hiperglucemia de un modo eficaz y persistente.
La reciente incorporación del nuevo grupo terapéutico de los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2) ha supuesto una gran oportunidad de revisión conceptual del tratamiento de la DM2. Son agentes reductores de la glucosa que, mediante la inducción de glucosuria, reducen la glucemia, el peso y la presión arterial, un efecto triple único entre los agentes hipoglucemiantes por vía oral (HGO). Además, su mecanismo de acción no depende de la función beta pancreática o la resistencia a la insulina, y puede mejorar indirectamente tanto la función de la célula beta como la acción de la insulina debido a su potencial para reducir el fenómeno de la glucotoxicidad.
El triple efecto de este nuevo grupo terapéutico en los factores de riesgo, junto con el inesperado beneficio que se ha demostrado de la empagliflozina en la mortalidad cardiovascular, hace de este un grupo de fármacos especialmente atractivo para el cardiólogo clínico. En esta revisión se resumen los datos disponibles de esta nueva clase de terapia para la DM2.
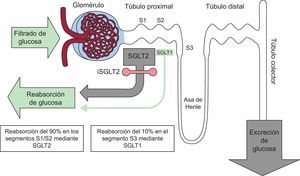
PAPEL DEL RIÑÓN EN EL METABOLISMO DE LA GLUCOSAAdemás de regular el metabolismo glucídico mediante el filtrado glomerular y la reabsorción de glucosa en los túbulos contorneados proximales, contribuye a través de la neoglucogénesis a la liberación de glucosa en el organismo. En ayunas, aunque el hígado es el órgano principal, la contribución renal es de un 20–25%. En cambio, en el periodo posprandial, la neoglucogénesis renal aumenta ostensiblemente y es origen del 60% de la liberación endógena de glucosa, lo que facilita la reposición de las reservas hepáticas de glucógeno.
En el adulto sano se filtran diariamente alrededor de 160-180 g de glucosa, del que reabsorbe más del 99% desde el túbulo contorneado proximal a los capilares peritubulares mediante dos proteínas denominadas cotransportador de sodio-glucosa (SGLT): SGLT2, expresada en los segmentos anteriores S1 y S2 del túbulo y SGLT1 en el segmento S3, pero mucho más abundante en los enterocitos de la mucosa intestinal. El SGLT2 se encarga de la mayor parte de la reabsorción de la carga tubular de glucosa (90%) mediante transporte activo contra gradiente dentro del túbulo proximal. La glucosa residual se reabsorbe en la parte más distal del túbulo a través de SGLT1 (10%)5 (figura 1).
En la DM2, como mecanismo adaptativo a la hiperglucemia, la expresión y la actividad de SGLT2 están aumentadas en las células epiteliales del túbulo para minimizar la glucosuria, pero se traduce en una reabsorción continua de glucosa incluso en presencia de concentraciones plasmáticas elevadas6. Asimismo su liberación endógena mediante la neoglucogénesis renal se triplica respecto a los no diabéticos7. De este modo, los procesos renales, tanto de reabsorción como de producción, representan una mala adaptación en el paciente con DM2 que contribuye a la hiperglucemia e incrementa la glucotoxicidad. La posibilidad de intervenir con los iSGLT2 en estos defectos fisiopatológicos ha supuesto la reconsideración del riñón no solo como víctima de la DM2, sino como un aliado en su tratamiento.
INHIBIDORES DEL COTRANSPORTADOR RENAL DE SODIO-GLUCOSA TIPO 2Actualmente se comercializan tres fármacos: la dapagliflozina, la empagliflozina y la canagliflozina.
DapagliflozinaEs el primer iSGLT2 aprobado en Europa en 2012, y está indicado cuando no se obtiene un adecuado control con metformina. Su selectividad por SGLT2 es 1.200 veces superior que por SGLT1. La concentración plasmática máxima se obtiene a las 1,5 h, con una vida media aproximada de 12 h8. La dosis terapéutica de 10 mg induce una glucosuria media de 70 g/día que condiciona una pérdida de 280 kcal/día. Esta glucosuria inducida se asocia a una mayor sensibilidad muscular a la insulina y, paradójicamente, a un incremento de la concentración de glucagón y la producción endógena de glucosa, con poca relevancia en el control glucémico9. Su desarrollo clínico ha sido extenso, con más de 5.000 pacientes aleatorizados en 14 ensayos clínicos de fase III en los diferentes estadios de la DM2 y tratamientos tanto en monoterapia como en combinación con metformina, sulfonilureas, insulina, pioglitazona y sitagliptina, en poblaciones especiales como la de insuficiencia renal moderada y la de pacientes con riesgo alto de eventos cardiovasculares. El análisis agrupado de los estudios ha demostrado que es efectiva al reducir la HbA1c una media del 0,79%10–14.
En monoterapia con 10mg/día, se obtuvo una reducción de la HbA1c del 0,89% y un descenso ponderal de 3,2 kg15. Combinada con metformina, la HbA1c se redujo un 0,84%, con un descenso de 2,86 kg que se mantuvo a largo plazo16,17.
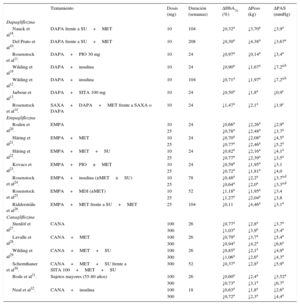
En la tabla 1 se presentan los principales resultados de los estudios pivotales10–14,18–32.
Estudios clínicos con inhibidores del cotransportador de sodio-glucosa tipo 2: resultados de eficacia en glucohemoglobina, peso y presión arterial sistólica
| Tratamiento | Dosis (mg) | Duración (semanas) | ΔHbA1c (%) | ΔPeso (kg) | ΔPAS (mmHg) | |
|---|---|---|---|---|---|---|
| Dapagliflozina | ||||||
| Nauck et al18. | DAPA frente a SU+MET | 10 | 104 | ↓0,32a | ↓3,70a | ↓3,9a |
| Del Prato et al10. | DAPA frente a SU+MET | 10 | 208 | ↓0,30a | ↓4,38a | ↓3,67a |
| Rosenstock et al11. | DAPA+PIO 30 mg | 10 | 24 | ↓0,97a | ↓0,14a | ↓3,4a |
| Wilding et al19. | DAPA+insulina | 10 | 24 | ↓0,90a | ↓1,67a | ↓7,2a,b |
| Wilding et al12. | DAPA+insulina | 10 | 104 | ↓0,71a | ↓1,97a | ↓7,2a,b |
| Jarbour et al13. | DAPA+SITA 100 mg | 10 | 24 | ↓0,50a | ↓1,8a | ↓0,9c |
| Rosenstock et al14. | SAXA+DAPA+MET frente a SAXA o DAPA | 10 | 24 | ↓1,47a | ↓2,1a | ↓1,9c |
| Empagliflozina | ||||||
| Roden et al20. | EMPA | 10 | 24 | ↓0,66a | ↓2,26a | ↓2,9a |
| 25 | ↓0,78a | ↓2,48a | ↓3,7a | |||
| Häring et al21. | EMPA+MET | 10 | 24 | ↓0,70a | ↓2,08a | ↓4,5a |
| 25 | ↓0,77a | ↓2,46a | ↓5,2a | |||
| Häring et al22. | EMPA+MET+SU | 10 | 24 | ↓0,82a | ↓2,16a | ↓4,1a |
| 25 | ↓0,77a | ↓2,39a | ↓3,5a | |||
| Kovacs et al23. | EMPA+PIO±MET | 10 | 24 | ↓0,59a | ↓1,95a | ↓3,1 |
| 25 | ↓0,72a | ↓1,81a | ↓4,0 | |||
| Rosenstock et al24. | EMPA+insulina (±MET±SU) | 10 | 78 | ↓0,48a | ↓2,2a | ↓3,7a,d |
| 25 | ↓0,64a | ↓2,0a | ↓3,3a,d | |||
| Rosenstock et al25. | EMPA+MDI (±MET) | 10 | 52 | ↓1,18a | ↓1,95a | ↓3,4 |
| 25 | ↓1,27a | ↓2,04a | ↓3,8 | |||
| Ridderstråle et al26. | EMPA+MET frente a SU+MET | 25 | 104 | ↓0,11 | ↓4,46a | ↓3,1a |
| Canagliflozina | ||||||
| Stenlöf et al27. | CANA | 100 | 26 | ↓0,77a | ↓2,8a | ↓3,7a |
| 300 | ↓1,03a | ↓3,9a | ↓5,4a | |||
| Lavalle et al28. | CANA+MET | 100 | 26 | ↓0,79a | ↓3,7a | ↓5,4a |
| 300 | ↓0,94a | ↓4,2a | ↓6,6a | |||
| Wilding et al29. | CANA+MET+SU | 100 | 26 | ↓0,85a | ↓2,1a | ↓4,9a |
| 300 | ↓1,06a | ↓2,6a | ↓4,3a | |||
| Schernthaner et al30. | CANA+MET+SU frente a SITA 100+MET+SU | 300 | 52 | ↓0,37a | ↓2,8a | ↓5,9a |
| Bode et al31. | Sujetos mayores (55-80 años) | 100 | 26 | ↓0,60a | ↓2,4a | ↓3,52a |
| 300 | ↓0,73a | ↓3,1a | ↓6,7a | |||
| Neal et al32. | CANA+insulina | 100 | 18 | ↓0,63a | ↓1,8a | ↓2,6a |
| 300 | ↓0,72a | ↓2,3a | ↓4,4a | |||
Δ: variación media respecto al valor basal; CANA: canagliflozina; DAPA: dapagliflozina; EMPA: empagliflozina; HbA1c: glucohemoglobina; MDI: múltiples dosis de insulina (terapia bolo basal); MET: metformina; PAS: presión arterial sistólica; PIO: pioglitazona; SAXA: saxagliptina; SITA: sitagliptina; SU: sulfonilurea.
La empagliflozina es un inhibidor de iSGLT2 aprobado en Europa en 2014. Su concentración plasmática máxima se obtiene en 1,5 h, con una vida media de 12 h. Es el de mayor selectividad por SGLT2 frente a SGLT1, unas 2.500 veces superior. A dosis de 10 y 25 mg, inducen una glucosuria de 66,4 y 78,4 g/día que origina una pérdida de 265 y 313 kcal/día respectivamente. Con empagliflozina también se ha comunicado un aumento en la producción de glucagón33. Se la ha estudiado ampliamente en 12 ensayos clínicos de fase III, con más de 14.000 pacientes, en distintas etapas evolutivas de la DM2 y diversos tratamientos en poblaciones especiales como en todos los estadios de la insuficiencia renal y pacientes con eventos cardiovasculares. En monoterapia o en combinación, con la dosis de 10 mg se ha demostrado una reducción media aproximada de HbA1c del 0,73%, y con la dosis de 25 mg, del 0,82%, con un descenso ponderal del 1-3,1% y de la presión arterial sistólica (PAS)20–25 incluso en pacientes con insuficiencia renal en estadio 2-3a34. En la tabla 1 se muestran los resultados de los principales estudios20–26.
CanagliflozinaDisponible en Europa desde 2015, inhibe, dependiendo de la dosis, tanto SGLT2 como SGLT1, transportador que se encarga de la absorción de glucosa y galactosa en el tracto gastrointestinal. Su concentración plasmática máxima se obtiene entre 1 y 2 h, con una vida media de 13 h. Su selectividad por SGLT2 es 160 veces superior que por SGLT1. A dosis de 300 mg, tiene un efecto clínicamente relevante en el SGLT1 intestinal, posiblemente secundario a altas concentraciones intraluminales del fármaco previas a su absorción. Una posible ventaja que puede ofrecer la inhibición dual es la reducción de la absorción intestinal de glucosa, con capacidad de estimular la secreción del péptido similar al glucagón tipo 1 y así potenciar la secreción posprandial de insulina, lo cual contribuye a mejorar la glucemia posprandial. Las dosis de 100 y 300 mg inducen una glucosuria media de 70 y 119 g/día respectivamente y promueve una pérdida de 308 y 476 kcal/día35. Su desarrollo clínico ha sido extenso, con 15 ensayos de fase III, más de 10.285 pacientes en los distintos estadios y con diferentes tratamientos de la DM2, en poblaciones especiales como mayores de 75 años, la insuficiencia renal moderada y pacientes con antecedentes de eventos cardiovasculares. Los estudios27–32 (tabla 1) han demostrado su efectividad para reducir la HbA1c en monoterapia, doble o triple terapia con HGO o combinada con insulina. Con 100 y 300 mg, la reducción media de la HbA1c fue del 0,72 y el 0,89% respectivamente27–29,31,32. Cuando se comparó canagliflozina 300 mg con sitagliptina 100 mg combinada con metformina y sulfonilurea, se obtuvo mayor reducción de la HbA1c que con sitagliptina (0,37%) y una reducción ponderal de 2,8 kg30. Todos los estudios clínicos con canagliflozina han mostrado reducciones persistentes del 1-3,8% del peso corporal y la PAS27–32.
En pacientes con DM2 e insuficiencia renal, los iSGLT2, aunque tienen un buen perfil de seguridad, se reduce su eficacia debido a su mecanismo de acción34,36,37. En este tipo de pacientes, pueden ocasionar un deterioro transitorio del filtrado glomerular de causa hemodinámica y sin que se haya objetivado daño renal, evaluado mediante el cociente albúmina/creatinina. Con todos los fármacos de esta clase, se aconseja precaución en pacientes para los que un descenso de la presión arterial podría suponer un riesgo, por ejemplo, cuando se sigue un tratamiento antihipertensivo y hay antecedentes de episodios de hipotensión o para los mayores de 75 años. Las indicaciones de inicio y ajuste de dosis según el filtrado glomerular y la edad establecidos en las fichas técnicas se muestran en la tabla 2.
Indicaciones de inicio y ajuste de dosis de los fármacos inhibidores del cotransportador de sodio-glucosa tipo 2 en función del filtrado glomerular y la edad
| FGe ≥ 60 ml/min/1,73 m2 | FGe ≥ 45–60 ml/min/1,73 m2 | FGe ≥ 30–45 ml/min/1,73 m2 | FGe<30 ml/min/1,73 m2 | Edad | |
|---|---|---|---|---|---|
| Dapagliflozina | • Iniciar con 10 mg/díaa | • No iniciar • Suspender si tratamiento en curso y FG<60b | • No iniciar • Suspender si tratamiento en curso | • No iniciar • Suspender si tratamiento en curso | <75 años |
| Empagliflozina | • Iniciar con 10 mg/día • Aumentar a 25 mg/día si hay buena tolerancia y necesidad de mejor control glucémico | • Iniciar con 10 mg/día* • Aumentar a 25 mg si hay buena tolerancia y necesidad de mejor control glucémico | • No iniciar • Suspender si tratamiento en curso y FG<45b | • No iniciar • Suspender cualquier dosis del fármaco | <85 añosc |
| Canagliflozinad | • Iniciar con 100 mg/día • Aumentar a 300 mg/día si hay buena tolerancia y necesidad de mejor control glucémico | • Iniciar con 100 mg/día y no incrementar** • Reducir a 100 mg/día si se trata con 300 mg | • No iniciar • Suspender si tratamiento en curso y FG<45b | • No iniciar • Suspender cualquier dosis del fármaco | >18 añose |
FG: filtrado glomerular; FGe: filtrado glomerular estimado.
Aunque su farmacocinética no se ve afectada por los alimentos, se recomienda tomarla antes de la primera ingesta del día por su potencial efecto de retrasar la absorción intestinal de glucosa.
Más allá de la reducción de la glucosa y la mejoría en la sensibilidad a la insulina, estos fármacos producen efectos favorables en los factores de riesgo cardiovascular clásicos, como la reducción de la presión arterial y el peso, pero también modifican otros parámetros como la adiposidad visceral, la rigidez arterial, la albuminuria y la concentración de ácido úrico. Que estos efectos condicionen una reducción de los eventos cardiovasculares es aún incierto.
Presión arterial y rigidez arterialHasta la fecha, todos los estudios con iSGLT2 han apreciado reducciones significativas de la presión arterial, mayores en la sistólica (de 1,66 a 6,9 mmHg) que en la diastólica (de 0,88 a 3,5 mmHg). Se cree que la reducción inicial de la PAS se debe a los efectos de la diuresis osmótica inducida por glucosuria, la natriuresis y la depleción de volumen intravascular, sin que se produzca aumento de la frecuencia cardiaca, hecho que se ha interpretado como una reducción relativa del tono del sistema nervioso simpático38. Sin embargo, los efectos a largo plazo pueden ser atribuibles a la inhibición del sistema renina-angiotensina-aldosterona (SRAA) y la pérdida ponderal.
En un análisis agrupado de 6 estudios de fase III con más de 4.000 casos tratados con canagliflozina, se observaron reducciones moderadas de la PAS respecto a placebo (3,3 y 4,5 mmHg con 100 y 300 mg respectivamente)39. Del mismo modo, los datos de 4 ensayos de fase III con más de 2.000 casos tratados con empagliflozina (10 o 25 mg) tanto en monoterapia como en combinación reportaron reducciones significativas en el grupo de tratamiento40. La duración del efecto es controvertida pues, en un estudio con dapagliflozina de 2 años de duración, los descensos de la PAS se limitaban en el tiempo y los valores volvían a su situación basal12. Aunque sea moderada, es bien conocido que una disminución de 5 mmHg de la PAS se asocia a una reducción del riesgo relativo de eventos cardiovasculares graves del 14,2%41.
Estos fármacos pueden ayudar a la mejora de la arquitectura vascular modulando los componentes del tejido conectivo que participan en el desarrollo de la rigidez arterial42. Con empagliflozina se ha observado un efecto vascular directo en reducción de la rigidez arterial43.
Peso corporal y masa grasaSe ha demostrado reducción ponderal en la mayoría de los pacientes tratados con iSGLT2, lo cual podría ser beneficioso, dada la potencial asociación de la obesidad con los eventos vasculares en la DM244. La pérdida inicial probablemente se deba al efecto diurético y la disminución del volumen intravascular que producen. Sin embargo, a largo plazo puede atribuirse a la pérdida calórica que la glucosuria origina (265–476 kcal/día).
Con dapagliflozina se obtienen reducciones medias de 3 kg el primer año, y se mantienen 2 años12. Canagliflozina produce también un efecto similar en el peso, con descensos de entre el 1,0 y el 3,8% aproximadamente a los 6 meses de tratamiento27–32. En un estudio a más largo plazo, Rosenstock et al24. comunicaron una disminución persistente de 2,2 kg en pacientes tratados con empagliflozina e insulina basal24.
Aunque las reducciones ponderales podrían valorarse como moderadas, hay estudios que demuestran que, con una pérdida de 2,25 kg, el cambio porcentual en la suma de factores de riesgo cardiovascular desciende un 48% en varones y un 40% en mujeres tras 16 años de seguimiento45.
Potencialmente de mayor interés es el cambio en la grasa visceral debido a su asociación con un mayor riesgo de complicaciones cardiovasculares. Los estudios de composición corporal con los iSGLT226,46,47 mostraron que la pérdida ponderal se debía principalmente a la reducción de la grasa visceral. En estudios a corto plazo también se observaron reducciones significativas de los marcadores indirectos de la adiposidad visceral48. Se está realizando un estudio que examina la influencia de la dapagliflozina en el tejido adiposo epicárdico con la hipótesis de que reducirlo mejoraría la contractilidad cardiaca49.
Proteinuria y función renalEn pacientes con DM2, debido al aumento en la expresión del SGLT2, la reabsorción de sodio está aumentada y origina una disminución de la carga de soluto en la mácula densa, lo que condiciona vasodilatación de la arteriola aferente e hiperfiltración renal. Este cambio hemodinámico y tubular inicial promueve la aparición y la progresión de la microalbuminuria y el descenso gradual del filtrado glomerular. Con los iSGLT2 se ha demostrado nefroprotección, pues neutraliza este defecto de manera directa induciendo natriuresis que condiciona vasoconstricción de la arteriola aferente y reducción de la presión intraglomerular con disminución de la hiperfiltración50 e indirectamente limitando la entrada de glucosa a las células peritubulares, con lo que mejoran los marcadores inflamatorios y fibróticos, como se ha demostrado con la empagliflozina51. Los estudios específicos renales con iSGLT2 mostraron regresión y reducción de la microalbuminuria y descenso de la macroalbuminuria34,37,52. Estos efectos en la función renal causan una disminución de un 30-40% de la proteinuria independientemente del descenso de la PAS, la HbA1c y el peso. Por otro lado, la vía no clásica del SRAA puede influir en la protección renal a través de la enzima de conversión de la angiotensina, que degrada la angiotensina II a angiotensina 1/7 con efectos vasodilatadores, antiinflamatorios y antiproliferativos. El uso de iSGLT2 en pacientes con DM2 tratados con inhibidores del SRAA puede conferir beneficios en el tratamiento de la enfermedad renal diabética a través de la activación de la vía del SRAA no clásica50.
Efectos en el perfil lipídicoEn algunos estudios se apreciaron pequeños cambios en los lípidos. En uno de ellos, con dapagliflozina asociada a metformina se incrementó el colesterol unido a lipoproteínas de alta densidad (cHDL) (del 1,8 al 4,4% respecto al basal), con reducción de los triglicéridos (del 2,4 al 6,2% respecto al basal), comparado con placebo a los 6 meses de tratamiento16. Con canagliflozina, se han comunicado incrementos tanto del cHDL (7,6%) como del colesterol unido a lipoproteínas de baja densidad (cLDL) (11,7%)47.
En estudios de 2 años de duración con dapagliflozina, empagliflozina y canagliflozina, los aumentos del cLDL fueron de 5, 6 y 3 mg/dl y los del cHDL, de 1, 3,5 y 0,6 mg/dl respectivamente, con un descenso medio de los triglicéridos de 9-10 mg/dl53. Un metanálisis que incluyó los estudios clínicos realizados con los distintos fármacos mostró un incremento moderado pero significativo de las cifras de cHDL sin cambios en el cLDL y los triglicéridos54. Son necesarios más estudios para evaluar la relevancia clínica de estos hallazgos.
Efectos en el ácido úricoAdemás de disminuir la glucemia, se ha comunicado una reducción de la concentración sérica de ácido úrico. Un análisis post-hoc de los datos de distintos estudios clínicos con canagliflozina mostró un descenso del 13% (0,7 mg/dl). Por otra parte, en la cohorte con hiperuricemia, la proporción de pacientes que alcanzaron concentraciones séricas de ácido úrico<6 mg/dl en la semana 26 fue del 23,5% con canagliflozina 100 mg y del 32,4% con 300 mg en comparación con el 3,1% con placebo. En los que presentaban hiperuricemia basal hubo una incidencia similar de crisis gotosas o litiasis renal, pero sin diferencias con respecto a placebo55. Datos similares se han comunicado con dapagliflozina17 y empagliflozina20,22,23.
Esta reducción de los títulos de ácido úrico posiblemente esté relacionada con GLUT9, un transportador que secreta urato pasivamente a la orina y los intercambia por glucosa. Queda por demostrar si este efecto puede traducirse en resultados beneficiosos a largo plazo, ya sea en la función renal o en las complicaciones macrovasculares.
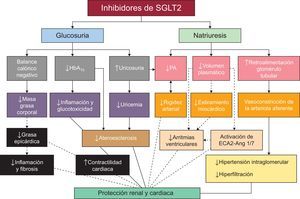
En la figura 2 se resumen esquemáticamente los posibles mecanismos fisiopatológicos de la protección cardiovascular y renal con iSGLT256.
Posibles mecanismos de la protección cardiovascular y renal con los inhibidores del cotransportador renal de sodio-glucosa tipo 2. Las líneas continuas muestran mecanismos demostrados por datos existentes. Las líneas discontinuas indican otros posibles mecanismos en estudio. Ang 1/7: angiotensina 1/7; ECA: enzima de conversión de la angiotensina; HbA1c: glucohemoglobina; PA: presión arterial; SGLT2: cotransportador renal de sodio-glucosa tipo 2. Adaptada con permiso de Rajasekeran et al56..
La hipoglucemia es un factor que limita el logro de los objetivos de control, especialmente en pacientes con enfermedad cardiovascular, debido a su asociación con arritmias ventriculares, por lo que siempre debe tenerse en cuenta el tándem hipoglucemia-macroangiopatía cardiaca como factor clave en la planificación de la estrategia terapéutica.
Los iSGLT2, por su mecanismo de acción independiente de la insulina, producen unas tasas de hipoglucemia muy bajas (0,9-4,3%) y de carácter leve. El mayor incremento se aprecia cuando se combinan con sulfonilureas o insulina, lo que hace aconsejable reducir la dosis de ambos fármacos cuando se combinen con iSGLT2, con el fin de minimizar el riesgo de hipoglucemia57.
Infecciones genitourinariasComo inducen glucosuria, pueden facilitar la aparición de infecciones del tracto genital y urinario. Una revisión sistemática de los datos de seguridad de los pacientes tratados con dapagliflozina58 mostró una clara asociación entre el tratamiento y las infecciones genitales micóticas (el 5% de los tratados frente al 0,9% del grupo placebo) que, por lo general, fueron de naturaleza leve y respondieron a la terapia antifúngica estándar. El primer episodio suele ocurrir durante los primeros meses de tratamiento en ambos sexos, y en una minoría pueden ser recurrentes. Los diagnósticos más frecuentes son las balanitis micóticas y las vulvovaginitis, con una tasa de ocurrencia 7 veces superior en mujeres, principalmente premenopáusicas con antecedentes de infección genital y obesidad, independientemente de la HbA1c.
Las infecciones del tracto urinario, habituales en pacientes con DM2, no aumentan de manera significativa con el uso de los iSGLT2. Los estudios con dapagliflozina a dosis de 10 mg/día muestran un mínimo incremento con respecto a placebo (el 4,3 frente al 3,7%)59. Los síntomas fueron los típicos, respondieron a los antibióticos convencionales y no obligaron a suspender el tratamiento. Los principales factores predisponentes fueron la edad>65 años, el sexo femenino y el antecedente de infecciones recurrentes. Datos similares se han comunicado con empagliflozina60 y canagliflozina30. Con esta, la incidencia se incrementó algo en pacientes ancianos o con más de 12 años de DM2.
CetoacidosisEl tratamiento con iSGLT2 puede aumentar el riesgo de que se produzca la cetoacidosis denominada euglucémica61, la mayoría de los casos en pacientes con diabetes mellitus tipo 1. Se han comunicado también en algunos casos de DM2, especialmente pacientes con escasa reserva pancreática por enfermedad de larga evolución, con autoinmunidad pancreática latente o pertenecientes a grupos étnicos cuya DM2 tiene rápida tendencia a la cetosis. El dato más característico de este tipo de cetoacidosis es que no se suele reconocer la descompenación por presentarse con glucemias <250 mg/dl debido a la glucosuria y con una cetonuria no demasiado elevada, hallazgos que no hacen sospechar que los síntomas sean secundarios a una cetoacidosis, con lo que se retrasa la intervención correctora. En algunos casos se identificaron factores precipitantes, como la reducción o supresión de la insulina, procesos intercurrentes, menor ingesta por enfermedad aguda o cirugía y el abuso de alcohol. Únicamente está aprobada la indicación para DM2 y no se puede utilizar en la diabetes mellitus de tipo 1 hasta que concluyan los estudios clínicos en curso y se apruebe una nueva indicación. Se aconseja retirarlo transitoriamente en prevención de situaciones que puedan originar deshidratación o ayuno prolongado y en cirugía electiva.
Seguridad cardiovascularAunque con los iSGLT2 se ha demostrado un efecto beneficioso en los factores de riesgo cardiovascular clásicos, en cumplimiento de las normativas de las agencias reguladoras internacionales, se han tenido que realizar estudios específicos para evaluar el efecto en el riesgo cardiovascular.
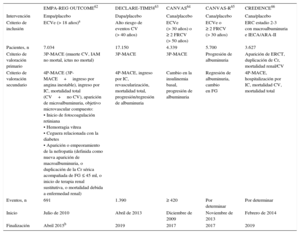
Estos estudios tienen diferencias tanto en el número como en el tipo de diabéticos incluidos (pacientes con enfermedad cardiovascular establecida o factores de riesgo de sufrirla o una combinación de ambos). Una característica común a 3 de ellos62–64 es el criterio de valoración primario, una variable combinada de mortalidad cardiovascular, infarto agudo de miocardio (IAM) e ictus no mortales, mientras que los otros 2 se centran principalmente en resultados renales65,66 (tabla 3).
Diferencias de diseño entre los estudios de seguridad cardiovascular con inhibidores del cotransportador de sodio-glucosa tipo 2
| EMPA-REG OUTCOME62 | DECLARE-TIMI5863 | CANVAS64 | CANVAS-R65 | CREDENCE66 | |
|---|---|---|---|---|---|
| Intervención | Empa/placebo | Dapa/placebo | Cana/placebo | Cana/placebo | Cana/placebo |
| Criterio de inclusión | ECVe (> 18 años)a | Alto riesgo de eventos CV (> 40 años) | ECVe (> 30 años) o ≥ 2 FRCV (> 50 años) | ECVe o ≥ 2 FRCV (> 30 años) | ERC estadio 2-3 con macroalbuminuria e IECA/ARA-II |
| Pacientes, n | 7.034 | 17.150 | 4.339 | 5.700 | 3.627 |
| Criterio de valoración primario | 3P-MACE (muerte CV, IAM no mortal, ictus no mortal) | 3P-MACE | 3P-MACE | Progresión de albuminuria | Aparición de ERCT, duplicación de Cr, mortalidad renal/CV |
| Criterio de valoración secundario | 4P-MACE (3P-MACE+ingreso por angina inestable), ingreso por IC, mortalidad total (CV+no CV), aparición de microalbuminuria, objetivo microvascular compuesto: • Inicio de fotocoagulación retiniana • Hemorragia vítrea • Ceguera relacionada con la diabetes • Aparición o empeoramiento de la nefropatía (definida como nueva aparición de macroalbuminuria, o duplicación de la Cr sérica acompañada de FG ≤ 45 ml, o inicio de terapia renal sustitutiva, o mortalidad debida a enfermedad renal) | 4P-MACE, ingreso por IC, revascularización, mortalidad total, progresión/regresión de albuminuria | Cambio en la insulinemia basal, progresión de albuminuria | Regresión de albuminuria, cambio en FG | 4P-MACE, hospitalización por IC, mortalidad CV, mortalidad total |
| Eventos, n | 691 | 1.390 | ≥ 420 | Por determinar | Por determinar |
| Inicio | Julio de 2010 | Abril de 2013 | Diciembre de 2009 | Noviembre de 2013 | Febrero de 2014 |
| Finalización | Abril 2015b | 2019 | 2017 | 2017 | 2019 |
3P-MACE: variable combinada de tres eventos adversos cardiovasculares mayores; 4P-MACE: variable combinada de cuatro eventos adversos cardiovasculares mayores; ARA-II: antagonistas de los receptores de la angiotensina II; Cana: canagliflozina; Cr: creatinina sérica; CV: cardiovascular; Dapa: dapagliflozina; ECVe: enfermedad cardiovascular establecida; Empa: empagliflozina; ERC: enfermedad renal crónica; ERCT: enfermedad renal crónica terminal; FG: filtrado glomerular; FRCV: factores de riesgo cardiovascular; IAM: infarto agudo de miocardio; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; MACE: eventos adversos cardiovasculares mayores.
El estudio EMPA REG-OUTCOME62, diseñado para examinar los efectos a largo plazo de la empagliflozina añadida al tratamiento habitual en la morbimortalidad de 7.020 pacientes con DM2 de más de 10 años de evolución y enfermedad cardiovascular establecida, ha demostrado clara y precozmente una reducción en la mortalidad cardiovascular, no explicable exclusivamente por el descenso del 0,4% de la HbA1c y 5 mmHg de la PAS o la pérdida ponderal del 3% registradas. En los estudios clásicos de intervención en los factores de riesgo cardiovascular, fueron necesarios muchos años de seguimiento antes de que se objetivara una reducción de la mortalidad.
La variable primaria de valoración fue un objetivo compuesto por mortalidad cardiovascular, IAM o ictus no fatales, que se redujo significativamente en un 14% del grupo de empagliflozina, con una disminución de la mortalidad cardiovascular del 38% y de las hospitalizaciones por insuficiencia cardiaca del 35%, sin que se objetivaran diferencias en las tasas de IAM e ictus no mortales.
Entre los mecanismos del beneficio clínico observado, el que más concuerda es el efecto diurético. La rápida reducción (2-4 meses) de los eventos cardiovasculares en el grupo tratado con empagliflozina orienta hacia un origen hemodinámico. El descenso de la PAS fue altamente significativo al mes y máximo a los 4 meses (∼5 mmHg), al igual que la reducción del peso. Asimismo, la disminución del volumen intravascular persistió hasta el final del estudio, como indica el persistente aumento del hematocrito (4,8%). Esta asociación temporal podría explicar que en los meses iniciales se redujeran los eventos cardiovasculares en el grupo tratado con empagliflozina.
La reducción en la mortalidad fue mucho más pronunciada en los diabéticos sin insuficiencia cardiaca, por lo que se han propuesto otros mecanismos independientes del efecto diurético, entre ellos la activación de la vía no clásica del SRAA por la disminución de la PAS y el volumen que, en pacientes tratados con inhibidores de la enzima de conversión de la angiotensina o los antagonistas del receptor de la angiotensina II (el 81%), originaría la producción de angiotensina 1/7 con efectos cardioprotectores67.
Otro factor que considerar sería que estos fármacos aumentan la concentración de glucagón, cuyos efectos inotrópicos positivos y antiarrítmicos podrían explicar, en parte, el beneficio observado en la mortalidad cardiovascular y las hospitalizaciones por insuficiencia cardiaca68.
Se ha demostrado también que la empagliflozina disminuye la rigidez arterial, la poscarga cardiaca43, los marcadores indirectos de la adiposidad visceral48 y la microalbuminuria34, cuyos beneficios clínicos no son inmediatos, por lo que no parecen fundamentales en la reducción de eventos a corto plazo.
Asimismo, en el estudio EMPA REG-OUTCOME se ha demostrado un efecto favorable en los eventos microvasculares incluidos en los criterios de valoración secundarios69 (tabla 3), que se redujeron significativamente en un 38% en el grupo tratado con empagliflozina. La magnitud de este descenso fue a expensas principalmente de la nefropatía, con una reducción del 39% de la incidencia o el empeoramiento de la nefropatía, del 38% de la progresión a macroalbuminuria, del 44% en duplicar la creatinina sérica con descenso del filtrado glomerular a ≤ 45 ml/min/1,73 m2 y de un 55% en el inicio de terapia renal sustitutiva. Al igual que en los resultados cardiovasculares, el beneficio se objetivó en los primeros 3 meses y se mantuvo hasta el final del estudio. Categorizando a los pacientes en función del filtrado glomerular, el beneficio en la hospitalización por insuficiencia cardiaca concuerda con los datos reportados previamente, con una reducción del 41% en aquellos con filtrado glomerular<60 ml/min y del 30% en aquellos con filtrado glomerular ≥ 60 ml/min.
Estos resultados se observaron en una población de pacientes tratados en su mayoría con inhibidores del SRAA, fármacos recomendados para la enfermedad renal diabética, lo que respalda el uso potencial de empagliflozina en combinación con esta clase terapéutica para pacientes con DM2 y enfermedad renal crónica.
Una explicación parcial de los resultados de este estudio, en el que los beneficios cardiovasculares y renales se produjeron de manera precoz sin una reducción de los eventos aterotrombóticos tradicionales, desde un punto de vista metabólico, podría subyacer en la ligera, pero persistente, cetosis que los tratamientos con iSGLT2 originan. El betahidroxibutirato se capta en el corazón y se oxida en lugar de los ácidos grasos y de la glucosa, lo cual genera una más eficiente fuente miocárdica de energía. Esta selección de sustrato mejoraría la eficiencia miocárdica respecto al consumo de oxígeno y puede mejorar el estado metabólico y la función de otros órganos, principalmente los riñones70.
Se trata del primer estudio que ha demostrado claramente que un HGO reduce los eventos cardiovasculares de los pacientes con DM2 y enfermedad cardiovascular establecida, al igual que los eventos renales clínicamente relevantes, pues muestra una progresión más lenta de la enfermedad renal y confirma también el perfil de seguridad de los iSGLT2. Aunque estos resultados son alentadores y tienen implicaciones clínicas importantes, es necesario plantearse si estos beneficios son aplicables a otros perfiles de pacientes con DM2 y si representan un efecto de clase.
DapagliflozinaEn un estudio de simulación a 20 años, la adición del fármaco a las opciones terapéuticas disponibles resultó en una reducción relativa de la incidencia de IAM e ictus y la mortalidad cardiovascular del 13,8, el 9,1 y el 9,6% respectivamente71. Los resultados de un metanálisis de los 21 estudios de fase II/III para caracterizar el perfil cardiovascular de dapagliflozina agrupando a los pacientes según el grado de riesgo (enfermedad cardiovascular, número de factores de riesgo y edad) no mostraron incremento de riesgo, lo que indica un posible efecto beneficioso en todos los subgrupos de pacientes72.
Aunque parecería que estos hallazgos descartan que el tratamiento con dapagliflozina se acompañe de un aumento del riesgo cardiovascular, habrá que esperar a 2019, cuando finalice el estudio DECLARE-TIMI5863.
CanagliflozinaEn el estudio CANVAS64, cuyos resultados intermedios se emplearon para su aprobación, no se apreció daño cardiovascular en los primeros 18 meses de tratamiento, únicamente un indicador de ictus fatal y no fatal no significativo73. El estudio iniciado en 2009 continúa hasta la aparición de un mínimo de 420 eventos de la variable primaria, lo que puede limitar su potencia para evaluar los beneficios cardiovasculares.
CONCLUSIONESLos nuevos fármacos iSGLT2 se han mostrado efectivos a corto y medio plazo para el manejo de la hiperglucemia en la DM2, tanto en monoterapia como en terapia combinada con cualquiera de los HGO existentes e insulina. Además se han objetivado beneficios más allá del control glucémico, como reducción de peso y PAS. Poseen un buen perfil de seguridad e incluso uno de ellos, la empagliflozina, ha conseguido una reducción de la mortalidad cardiovascular de los pacientes diabéticos con enfermedad cardiovascular establecida. Los resultados de los estudios en curso serán cruciales para corroborar si son extensibles a todo el grupo terapéutico. Por el momento, los datos disponibles proporcionan una base sólida para el uso de empagliflozina en los pacientes con DM2 y enfermedad cardiovascular establecida.
En un plazo relativamente corto, es de esperar que los iSGLT2 se sitúen en una posición destacada en los algoritmos terapéuticos de la DM2.
CONFLICTO DE INTERESESLos autores han participado como investigadores en el estudio EMPA-REG OUTCOME.