Sr. Editor:
Varón de 48 años de edad, con historia de hemorragia subaracnoidea en 1992, infarto cerebeloso debido a oclusión de la arteria vertebral y posterior epilepsia, que ingresó en el hospital para cateterismo cardiaco tras tres episodios recurrentes de dolor torácico con signos de síndrome coronario agudo sin elevación del segmento ST (SCASEST). El ecocardiograma transtorácico mostraba segmentos apicales del ventrículo izquierdo adelgazados y acinéticos, con cicatrización que se extendía al segmento medio del tabique inter-ventricular. La fracción de eyección del ventrículo izquierdo era del 35% y el ápice cicatricial presentaba dos trombos murales de hasta 16 mm de diámetro, con ecocontraste espontáneo que llenaba el área adyacente. En el Doppler color se observó un peculiar patrón de flujo en miocardio normal (acelerado, > 100 cm/s, predominantemente flujo diastólico) que indicaba una colateralización excesiva con flujo coronario apical invertido (fig. 1). La arteria coronaria proximal derecha estaba dilatada (10 mm), mientras que la izquierda no podía visualizarse en su ubicación habitual. Una angiografía coronaria (fig. 2) demostró la coincidencia insólita de dos anomalías coronarias raras. La arteria coronaria descendente anterior izquierda (ADA) presentaba una dilatación masiva que se originaba en la arteria pulmonar principal. El flujo en ADA se invertía debido a un suministro colateral a través de vasos grandes (6 mm de diámetro) que conducía la sangre procedente de las arterias derecha y circunfleja. La arteria coronaria derecha estaba sumamente dilatada (10 mm). La rama circunfleja de la arteria coronaria izquierda (CX) presentaba un origen anormal en el seno coronario derecho y su curso era posterior (detrás de la raíz aórtica). No había signos de compresión ni de angulación excesiva de la CX que diesen lugar a una reducción luminal.
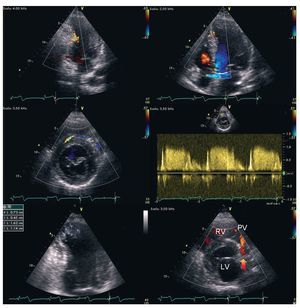
Fig. 1. Ecocardiografía transtorácica. Paneles superiores: el flujo codificado por color dentro de la pared ventricular indica flujo acelerado en la arteria coronaria derecha dilatada (izquierda) y colaterales septales (derecha). Panel medio: vista paraesternal del eje corto que muestra un vaso colateral grande con flujo dirigido frontalmente desde la arteria coronaria derecha hacia la arteria coronaria descendente anterior izquierda con velocidad diastólica máxima > 100 cm/s según Doppler espectral pulsado. Izquierda inferior: trombos observados en el ápice infartado del ventrículo izquierdo (flecha). Derecha inferior: flujo diastólico retrógrado (codificado en rojo, flecha) desde la arteria descendente anterior izquierda hacia la válvula pulmonar (VP). VI: ventrículo izquierdo; VD: ventrículo derecho.
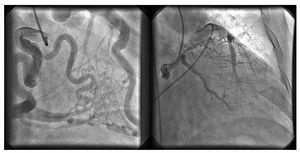
Fig. 2. Angiograma coronario en proyección oblicua anterior derecha a 30°. Izquierda: la inyección de contraste en la arteria coronaria derecha dilatada muestra llenado retrógrado de la arteria coronaria descendente anterior izquierda a través de amplios colaterales septales. Derecha: inyección de contraste en la rama circunfleja con llenado retrógrado de la arteria coronaria descendente anterior izquierda a través de colaterales de las ramas marginales y diagonales. Es evidente el flujo retrógrado del contraste hacia la arteria pulmonar principal (con el catéter Amplatz en la luz)
Debido a los episodios recurrentes de SCASEST y a la anomalía angiográficamente definida, se procedió a realizar una valoración de viabilidad en el paciente. Un estudio con resonancia magnética (RM) de contraste mostró una cicatriz transmural en el territorio de la ADA. El paciente se había mantenido asintomático desde entonces con tratamiento médico.
El hallazgo de arterias coronarias sumamente dilatadas y de colaterales es característico del síndrome de Bland-Garland-White o de ALCAPA (del inglés anomalous left coronary artery from pulmonary artery), una entidad sumamente rara en adultos (se estima 1 cada 300.000 nacidos con vida)1. La concomitancia con otra anomalía coronaria es aún más inusual; existen varios informes sobre casos aislados de ADA originada en la arteria pulmonar con rama circunfleja originada en el seno izquierdo de Valsalva2,3, pero según nuestros datos sólo se han descrito 2 casos de ALCAPA con la CX originada en el seno derecho de Valsalva4,5. Sin embargo, ninguno de dichos estudios notificó las peculiares características de flujo Doppler mostradas en el ecocardiograma transtorácico realizado a nuestro paciente.
Puesto que el área que suministra la arteria pulmonar es profundamente isquémica y generalmente se infarta en la niñez6, la anomalía concomitante de la CX protege una subregión del territorio coronario izquierdo suministrada por la rama circunfleja. En nuestro paciente la rama circunfleja anómala se ha convertido, por lo tanto, en la segunda fuente de sangre oxigenada para la región coronaria izquierda. El cortocircuito derecha-izquierda es otro aspecto del problema y el cociente Qp/Qs en nuestro paciente estaba por debajo de 1,5 (estimación por ecocardiografía); por consiguiente, considerando la ausencia de viabilidad en el territorio de la ADA, no se emprendió ninguna intervención. En otros casos, las alternativas de tratamiento podrían incluir reimplante quirúrgico de la ADA en el seno aórtico o embolización de dicha arteria (para interrumpir la anastomosis en el caso de territorio de ADA sin viabilidad).
Material multimedia adicional (vídeo) disponible en: www.revespcardiol.org