Introducción
La hipertensión arterial pulmonar (HAP) se define como un grupo de enfermedades caracterizadas por un incremento progresivo de la resistencia vascular pulmonar debido a la vasoconstricción, la trombosis y el remodelado estructural de las arteriolas pulmonares con la oclusión de la luz de algunos vasos. Sin tratamiento, la sobrecarga de presión del ventrículo derecho (VD) da lugar a su dilatación e hipertrofia progresivas y a una insuficiencia cardiaca terminal al cabo de 2-3 años. El tratamiento convencional con warfarina, digoxina y diuréticos mejora los síntomas, pero produce efectos limitados sobre la progresión de la enfermedad. En pacientes seleccionados, los antagonistas del calcio y los análogos de la prostaciclina mejoran significativamente la capacidad de ejercicio y prolongan la supervivencia, pero frecuentemente los efectos adversos complican el tratamiento. Un antagonista no selectivo del receptor de la endotelina, activo por vía oral, el bosentán, ha ampliado las opciones terapéuticas de la HAP y hoy día es un tratamiento de primera línea para estos pacientes en general, mientras que los prostanoides se reservarían para los pacientes en estado más grave. A pesar de que estos recientes avances terapéuticos han mejorado el pronóstico a corto y medio plazo de dichos pacientes, muchos de ellos fallecerán precozmente debido a la insuficiencia progresiva del VD1,2.
La estrategia diagnóstica de la HAP requiere establecer el diagnóstico, identificar el tipo de enfermedad, evaluar el deterioro funcional y la hemodinámica, y monitorizar los cambios del estado de la enfermedad y la respuesta al tratamiento. Desde el punto de vista de las técnicas de imagen y de la valoración hemodinámica, esta evaluación diagnóstica incluye principalmente ecocardiografía, gammagrafía pulmonar de ventilación/perfusión, angiografía pulmonar y cateterismo de las cavidades cardiacas derechas1,3,4. La técnica no invasiva de utilización más difundida, la ecocardiografía, es un excelente examen tanto para el diagnóstico como la monitorización de los pacientes con sospecha de HAP o HAP establecida, pero adolece de diversas limitaciones. En primer lugar, se basa en «presunciones geométricas» difíciles de adaptar a la compleja morfología del VD. La estrategia tridimensional es más prometedora; no obstante, no siempre garantiza una visualización adecuada del VD completo. En segundo lugar, la ecocardiografía depende de diversas variables como la presencia de una regurgitación tricúspide detectable, la complexión corporal, una neuropatía coexistente, la frecuencia cardiaca, la postura y el grado de hidratación. Algunas de estas limitaciones también afectan al método de referencia aceptado, el cateterismo de las cavidades cardiacas derechas. La gammagrafía pulmonar de ventilación/perfusión ofrece un método para el diagnóstico de la HAP tromboembólica crónica y su diferenciación de la forma idiopática, pero exige exposición a radiación ionizante. La angiografía pulmonar es útil en la evaluación de la HAP tromboembólica crónica y se requiere practicar un cateterismo de las cavidades cardiacas derechas para confirmar el diagnóstico del proceso, evaluar la gravedad del deterioro hemodinámico y examinar la vasorreactividad de la circulación pulmonar. Sin embargo, estos procedimientos son invasivos, implican exposición a los rayos X y, por lo que respecta a la angiografía pulmonar, implica además la administración de agentes de contraste. Más recientemente, para el diagnóstico por imágenes de la HAP se han introducido la tomografía computarizada espiral y la resonancia magnética (RM) cardiovascular (RMC). La primera se utiliza principalmente para evaluar la enfermedad tromboembólica y descartar un embolismo pulmonar agudo, con la limitación de la exposición a los rayos X. La RMC evita el uso de radiación ionizante y se utiliza cada vez más en pacientes con HAP para la evaluación de los cambios patológicos y funcionales del corazón y de la circulación pulmonar.
Resonancia magnética en la hipertensión pulmonar
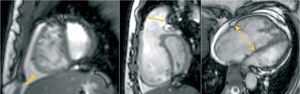
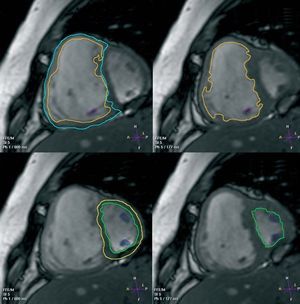
La RMC es una modalidad atractiva para analizar la compleja geometría del VD, puesto que no es preciso hacer asunciones de la forma o localización de la estructura que se está estudiando. Este procedimiento se ha utilizado satisfactoriamente como un instrumento preciso y reproducible para cuantificar los volúmenes y masas ventriculares en individuos tanto sanos como con HAP, y se han establecido límites normales5,6. Progresos tecnológicos recientes han llevado al desarrollo de secuencias de precesión libre en estado de equilibrio (steady-state free precession; SSFP), que proporcionan una relación señal/ruido sustancialmente superior al obtenido con las técnicas eco de gradiente, junto con un excelente contraste entre el miocardio y la sangre7 (fig. 1). La técnica SSFP se está convirtiendo rápidamente en la secuencia de RMC más utilizada para obtener datos volumétricos de los ventrículos izquierdo y derecho (fig. 2).
Fig. 1. Imágenes de cine-RM en eco gradiente adquiridas usando la secuencia steady-state free precession (SSFP) en pacientes con HAP severa. Izquierda: imagen de eje corto que muestra el aumento de tamaño del ventrículo derecho junto con un aumento de la trabeculación y una configuración septal interventricular en forma de D. Es interesante destacar que este aplanamiento septal persiste durante todo el ciclo cardiaco, lo que indica una sobrecarga ventricular derecha tanto sistólica como diastólica. Obsérvese la presencia de un derrame pericárdico (flecha), que es un signo de pronóstico adverso en pacientes con este proceso. Centro: visión modificada del tracto de salida ventricular derecho del mismo paciente en el que se identificaba la deformidad en forma de D y la curvatura hacia la izquierda del tabique. También puede observarse una dilatación del anillo pulmonar (doble flecha). Derecha: visión de las 4 cámaras que demuestra la hipertrofia cardiaca derecha. La aurícula derecha es prominente y el anillo tricúspide está marcadamente dilatado (doble flecha de puntos).
Fig. 2. Imágenes de cine-RM de steady-state free precession (SSFP) de un paciente con hipertensión pulmonar severa. Los volúmenes y masa ventriculares izquierdos y derechos pueden determinarse a partir de una serie de cortes en el eje corto que abarcan ambos ventrículos desde la base a la punta. Los límites endocárdicos de los ventrículos izquierdo y derecho se localizan manualmente en la telediástole y telesístole. Los bordes epicárdicos se localizan en telediástole, mediante cálculo informático de la masa ventricular. Conociendo el grosor de los cortes, en cada fase cardiaca se suman los volúmenes contenidos dentro de todos los bordes endocárdicos y acto seguido se calcula el volumen total con la ayuda de un ordenador. Para calcular la masa, se valora informáticamente el volumen del miocardio contenido dentro de los bordes epicárdicos y endocárdicos y se multiplica por la densidad específica del miocardio (1,05 g/ml). Este método de determinación es independiente de la forma de la cavidad y es ideal para el ventrículo derecho.
Una de las ventajas de la RMC es que proporciona determinaciones e índices anatómicos no influidos por los factores y variables que afectan a la ecocardiografía. Estos índices anatómicos se relacionan con parámetros hemodinámicos que se correlacionan con la gravedad de la HAP, desde un punto de vista clínico, como es el caso de la presión media de la arteria pulmonar. El índice de masa ventricular --cociente entre la masa del VD y la masa ventricular izquierda-- es una de estas variables derivadas de la RMC, que proporciona un medio preciso y práctico de estimar de modo no invasivo la presión media de la arteria pulmonar en la HAP y ofrece una estimación más precisa que la ecocardiografía8. En la figura 2 se describe el método de cálculo de la masa ventricular a partir del que se deriva este índice. En el cateterismo derecho el índice de masa ventricular se correlaciona (r = 0,81) con la presión media de la arteria pulmonar, y su sensibilidad y especificidad para la hipertensión pulmonar son del 84 y el 71%, respectivamente, comparado con el 89 y el 57% para la ecocardiografía.
Además, en pacientes con HAP puede usarse la curvatura en el eje corto en el máximo desplazamiento a la izquierda del tabique interventricular como marcador de la presión de la arteria pulmonar, puesto que entre estos 2 parámetros hay una correlación significativa9. El arco septal se evalúa con RMC, se determina en las imágenes cine-RM de eje corto, y se expresa como curvatura --recíproca del radio--. La curvatura se cuantifica en la imagen que muestra la distorsión más importante de la forma septal normal. Se ha identificado una fiable relación lineal entre las determinaciones invasivas de la presión sistólica de la arteria pulmonar y la curvatura del eje corto del tabique ventricular. Cuando se observa una curvatura dirigida hacia la izquierda, es esperable una presión sistólica de la arteria pulmonar de más de 67 mmHg.
Otra interesante técnica de RMC para evaluar la función global y local miocárdica son las secuencias con «marcaje» miocárdico (tagging). Se ha establecido la RM con marcaje para detectar el movimiento del tejido usando prepulsos de radiofrecuencia que generan un entramado que queda marcado en la imagen. Este entramado se mueve y deforma cuando el corazón se contrae. Las técnicas de marcado miocárdico se han utilizado para cuantificar tridimensionalmente la deformación global y local del VD en individuos sanos, y han dejado la vía libre para estudiar las alteraciones del movimiento regional del VD en diversos tipos de cardiopatías10.
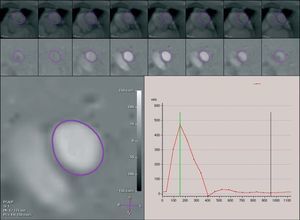
Desde el punto de vista de la evaluación de la hemodinámica de la HAP, la RMC ofrece la posibilidad de obtener un mapa de la distribución de velocidades mediante la técnica de contraste de fase (fig. 3). En pacientes con HAP, la RMC codificada para la velocidad ofrece determinaciones del flujo pulmonar y del gasto cardiaco de las cavidades derechas, similares a las obtenidas por medio de la termodilución, y los índices obtenidos de modo no invasivo para la evaluación de la resistencia vascular pulmonar con una buena reproducibilidad11. A partir de la curva de velocidad de flujo arterial pulmonar, es posible derivar índices como el tiempo de aceleración --definido como el tiempo desde el inicio del flujo hasta la velocidad máxima--, volumen de aceleración -estimado integrando la tasa de flujo desde el inicio del flujo hasta la velocidad máxima-, cambio máximo del flujo durante la eyección --definido como el valor máximo de la pendiente ascendente del flujo-- y el cociente del cambio máximo en el flujo respecto al volumen de aceleración. Se han observado correlaciones inversas entre la resistencia vascular pulmonar y el tiempo de aceleración o volumen de aceleración. La resistencia vascular pulmonar se correlaciona directamente (r = 0,89) con el cociente del cambio máximo en la tasa de flujo respecto al volumen de aceleración. Este cociente puede utilizarse para distinguir a los pacientes con resistencia vascular pulmonar elevada (67 mmHg/min/l) de aquellos cuya resistencia es casi normal o de individuos sanos.
Fig. 3. Mapa de la velocidad de contraste de fase en un plano que atraviesa el tronco pulmonar. El principio en el que se basa esta técnica es que el cambio de fase de los protones en movimiento es proporcional a la velocidad del flujo sanguíneo. En las imágenes resultantes, los valores píxel se relacionan linealmente con la velocidad (inferior izquierda). Para la determinación del flujo sanguíneo pulmonar, se delimita manualmente el área transversal de la luz del tronco pulmonar en cada secuencia de cine durante todo el ciclo cardiaco, y dentro de esta área se mide la velocidad media dirigida axialmente (fila superior y media). Acto seguido, se derivan los flujos instantáneos respectivos a partir de los productos de las áreas luminales individuales y las velocidades medias dentro de ellas. A partir de estos datos, pueden generarse curvas del flujo pulmonar-tiempo (inferior derecha). AP: arteria pulmonar; AA: aorta ascendente.
Otro método informatizado permite la evaluación no invasiva de la presión media de la arteria pulmonar a partir de un mapa de velocidad del contraste de fase a partir de parámetros tanto físicos como biofísicos12. Los parámetros físicos incluyen la velocidad media del flujo sanguíneo a lo largo del área transversal de la arteria pulmonar principal en el pico de la sístole y el valor sistólico máximo del área transversal de la arteria pulmonar principal --obtenido mediante RMC codificada para la velocidad--, mientras que los parámetros biofísicos se relacionan con el paciente individual, caso de estatura, peso y frecuencia cardiaca. Estos parámetros se han determinado en pacientes sometidos a cateterismo derecho, y se ha identificado una correlación significativa entre el valor calculado de la presión media de la arteria pulmonar y el valor de la presión media obtenido directamente mediante cateterismo.
Con frecuencia, la función vascular pulmonar y la del VD determinan la morbilidad y mortalidad en pacientes con formas primarias o persistentes de HAP secundaria, y para una óptima toma de decisiones es esencial su monitorización precisa. Por lo tanto, los parámetros anatómicos y hemodinámicos derivados de la RMC pueden ser útiles en el estudio de pacientes con HAP para decidir si debe practicarse un cateterismo y para el seguimiento de los cambios hemodinámicos asociados al tratamiento médico, como el tratamiento vasodilatador a largo plazo2.
Uno de los progresos más significativos en la RMC ha sido la capacidad de visualizar directamente el miocardio no viable usando una secuencia de eco de gradiente de inversión-recuperación segmentaria después de la administración intravenosa de gadolinio. Con esta técnica, llamada RMC con realce tardío de gadolinio, el miocardio se muestra con hiperrealce (brillante) en presencia de una lesión irreversible (fibrosis)13. Recientemente, se ha revelado que en la mayor parte
de pacientes con HAP existe un realce tardío en los puntos de inserción del VD y en el tabique interventricular14. El realce septal de contraste se asocia a un arco septal interventricular. El grado de realce del contraste se correlaciona además positivamente con el volumen telediastólico del VD/área de superficie corporal, masa del VD, presión media de la arteria pulmonar y resistencia vascular pulmonar, e inversamente con la fracción de eyección del VD. La RMC con realce retardado del contraste puede representar un nuevo marcador de las anomalías septales ocultas relacionadas directamente con el estrés hemodinámico experimentado por los pacientes con HAP. Dadas las correlaciones existentes entre el realce con contraste con los marcadores existentes de la gravedad de la HAP, este parámetro puede ser útil en la clasificación pronóstica de estos pacientes.
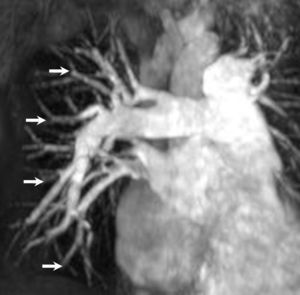
En lo referente a la evaluación de la circulación pulmonar, la angiografía pulmonar con resonancia magnética tridimensional realzada con contraste --gadolinio-- es una modalidad prometedora para la identificación de pacientes con HAP. Un valor del diámetro de la arteria pulmonar derecha > 28 mm es sensible (89%) y muy específico (100%) para el diagnóstico de la HAP crónica15. En particular, en la HAP tromboembólica crónica, la angiografía RM parece tener un potencial sustancial en la detección de los cambios vasculares --material tromboembólico central, cortes de los vasos y afilamiento proximal a distal-- más que en las otras causas de este proceso4 (fig. 4). A pesar de que la combinación de un cateterismo de las cavidades cardiacas derechas y la angiografía pulmonar selectiva por sustracción digital sigue considerándose el procedimiento de referencia para establecer el diagnóstico, para evaluar su gravedad, y determinar la viabilidad técnica de una tromboendarterectomía (tromboembolismo crónico), la angiografía RM con realce de contraste muestra hallazgos angiográficos característicos en todos los pacientes, y sus resultados se correlacionan con los de la angiografía por sustracción digital. Después de la cirugía, la angiografía RM permite documentar la eficacia del procedimiento y puede desempeñar un importante papel --en combinación con la determinación de los parámetros funcionales y de flujo-- en el seguimiento postoperatorio16.
Fig. 4. Angiografía con resonancia magnética realzada con gadolinio de la vasculatura pulmonar en un paciente con hipertensión arterial pulmonar. Se ha obtenido una impresión espacial en esta imagen por medio de un método tridimensional de reconstrucción de datos denominado «proyección de intensidad máxima». La imagen muestra la grandes arterias pulmonares centrales y una reducción difusa de los vasos periféricos de calibre más pequeño (flechas) sin datos de material trombótico en el árbol arterial pulmonar.
Para evaluar la perfusión pulmonar, pueden usarse 2 estrategias17. La primera implementa técnicas de imagen RM con realce de contraste usando secuencias de imágenes bidimensionales o tridimensionales ultrarrápidas. Durante la administración de un bolo intravenoso de gadolinio, se consiguen rápidamente múltiples imágenes. Se han empleado ritmos de adquisición de hasta 3 imágenes por segundo. Las regiones de disminución del flujo sanguíneo parenquimatoso se identifica como áreas de falta de realce regional del contraste. La segunda estrategia para examinar la perfusión pulmonar usa secuencias que no requieren un agente de contraste intravenoso. Estas técnicas se conocen como arterial spin labeling y usan los protones dentro de la sangre intravascular como marcador o isótopo radiactivo endógeno para la evaluación del flujo sanguíneo. Aunque las técnicas de RM perfusión pueden documentar cambios en el flujo sanguíneo con la hipertensión pulmonar, en la actualidad no suelen usarse y se desconoce su importancia en el diagnóstico y tratamiento de esta enfermedad.
La exploración del pulmón con resonancia magnética es inherentemente difícil debido a la baja densidad de protones y al elevado número de interfases tejidos blandos-aire, que reducen la «cantidad» de la señal emitida. No obstante, los progresos en el diseño de equipos informáticos y en las secuencias de obtención de imágenes se han traducido en una mejor evaluación del parénquima pulmonar4.
La mejora reciente tanto de los equipos como de los programas informáticos ha permitido la práctica de un cateterismo cardiaco durante la obtención de imágenes RMC en tiempo real (fluoroscopia RM). Este procedimiento permite guiar un catéter provisto de un balón en la punta hasta la aurícula derecha, en el tracto de salida del VD y la arteria pulmonar principal. El balón se hincha con dióxido de carbono y produce un artefacto circunscrito que se distingue con claridad de la reserva de sangre brillante del corazón y de la arteria pulmonar principal, y permite la visualización de la punta del catéter. En investigaciones recientes se ha demostrado la viabilidad de combinar determinaciones cruentas de RM y de la presión de la arteria pulmonar, con fluoroscopia RM y los datos del flujo derivados de la RMC con codificación de contraste de fase para cuantificar la resistencia vascular pulmonar en seres humanos18,19.
Este nuevo método, que se ha validado frente a la técnica de termodilución en modelos en animales, y ha demostrado proporcionar ventajas sobre el principio de Fick, suscita la posibilidad de disponer de una técnica más precisa para cuantificar la resistencia vascular pulmonar, lo que dará lugar a un mejor tratamiento de pacientes con HAP19,20.
CONCLUSIONES
La RMC es una técnica prometedora y versátil que debe considerarse como instrumento diagnóstico complementario para la evaluación de los pacientes con HAP. A pesar de que el cateterismo derecho continúa siendo el «patrón oro» para la evaluación de la hemodinámica pulmonar y en la práctica clínica habitual prevalece la ecocardiografía, las características exclusivas de este procedimiento la convierten en la técnica ideal para la monitorización no invasiva de la función vascular pulmonar y del VD en la HAP. Por esta razón, posiblemente, pueda desempeñar un importante papel clínico para orientar el tratamiento y determinar el pronóstico en este grupo de pacientes. No obstante, hace falta más experiencia antes de proponer la RMC para la evaluación sistemática del paciente con hipertensión pulmonar.
Correspondencia: Dr. P. Nihoyannopoulos.
Nacional Heart and Lung Institute. Imperial College Faculty of Medicine. Hammersmith Hospital. Cardiology Department.
Du Cane Road. London W12 ONN. United Kingdom.
Correo electrónico: petros@ic.ac.uk