Actualmente, se considera al sangrado un evento pronóstico importante en el manejo del síndrome coronario agudo, relativamente frecuente comparado con los eventos isquémicos, y que tiene implicaciones importantes para el pronóstico, los resultados y los costes. Hay evidencia de que los pacientes que sufren un sangrado mayor en la fase aguda tienen mayor riesgo de muerte en los meses siguientes, aunque la naturaleza causal de esta relación todavía está en discusión. El objetivo de esta revisión es resumir el conocimiento actual sobre la importancia de la estratificación del riesgo de sangrado en el síndrome coronario agudo, así como proporcionar una perspectiva personal sobre las estrategias necesarias para minimizar la incidencia, la extensión y las consecuencias de la hemorragia.
Palabras clave
La rotura de una placa arteriosclerótica vulnerable, con la consiguiente formación de un trombo intravascular, es el mecanismo fisiopatológico que subyace al síndrome coronario agudo (SCA)1. Como consecuencia de la lesión endotelial, se favorece la activación de las plaquetas y de los mecanismos de la coagulación; es necesaria la interacción entre ambos sistemas para la formación del trombo en el árbol coronario2. Los diferentes fármacos empleados actualmente en el SCA actúan a diferentes niveles de la activación plaquetaria y de la cascada de la coagulación para reducir el riesgo de complicaciones trombóticas, pero por otro lado se aumenta irremediablemente el riesgo hemorrágico3. Debido a la evidencia creciente de que el sangrado mayor se asocia a eventos adversos, es fundamental revisar las estrategias para prevenir el sangrado que ayuden a hallar los regímenes terapéuticos más efectivos para los pacientes con SCA.
Relevancia clínica del sangradoEl sangrado es la complicación no isquémica más frecuente tras un SCA. Según los diferentes registros publicados4,5, las tasas de hemorragia mayor en los primeros 30 días tras un SCA oscilan entre el 2,3 y el 9,6%, dependiendo del perfil clínico de los pacientes incluidos en el estudio, los tratamientos y las definiciones de sangrado empleadas. La mayoría de los pacientes lo presentan en una única localización4. En general, el sangrado más frecuente es el gastrointestinal, seguido del relacionado con el acceso femoral, el retroperitoneal y el genitourinario6. Debido al desarrollo de la técnica por vía radial, actualmente el sangrado gastrointestinal es también el tipo más frecuente en el subgrupo de intervencionismo6.
Sabemos que las complicaciones hemorrágicas constituyen un importante factor pronóstico adverso para los pacientes con SCA4,7,8. Se ha descrito que los pacientes con SCA que sufren una hemorragia mayor tienen un riesgo de hasta un 20% de muerte, infarto de miocardio o ictus durante los primeros 30 días, comparado con el 5% en los que no, y este riesgo se extiende más allá del periodo periprocedimiento y aunque la gravedad de la hemorragia no suponga un peligro para la vida7.
Desde el punto de vista fisiopatológico, el riesgo asociado a la hemorragia es multifactorial. Frecuentemente estos pacientes interrumpen el tratamiento con fármacos antitrombóticos, por lo que se benefician en menor medida de esta terapia farmacológica9. Además, la hemorragia puede causar anemia, identificada como predictor de mal pronóstico. También, las transfusiones de repetición son frecuentes en estos pacientes (14,9%) y se relacionan con isquemia recurrente y con un incremento de 3 o 4 veces en el riesgo de muerte a los 30 días10. El mecanismo por el cual las transfusiones se asocian a peor pronóstico no está del todo aclarado, y probablemente esté relacionado con diversos factores3,10. Por este motivo, las guías actuales no recomiendan las transfusiones sistemáticas para los enfermos estables con hematocrito > 25% o hemoglobina > 7 g/dl11.
Definición de sangradoA diferencia de lo que ocurre con las definiciones que hacen referencia a eventos isquémicos (p. ej., muerte cardiaca, infarto de miocardio, trombosis del stent), la gran heterogeneidad en las definiciones de sangrado mayor3,12, 13, 14, 15, 16, 17, 18, 19 (Tabla 1) a menudo dificulta la comparación de resultados entre diferentes series y la estimación de la incidencia real de este y de sus consecuencias. Las primeras definiciones (TIMI13 y GUSTO14) se diseñaron para cuantificar las complicaciones hemorrágicas a corto plazo en pacientes sometidos a agentes trombolíticos, y aunque se han utilizado ampliamente, probablemente hoy no serían muy adecuadas para valorar algunos tipos de hemorragias relacionadas con el intervencionismo coronario percutáneo (ICP).
Tabla 1. Heterogeneidad de las definiciones de sangrado mayor según los diferentes estudios
| Estudios | Clínica | Necesidad de transfusión | Parámetros de laboratorio |
| TIMI 13 , 1987 | Sangrado intracraneal | Caída de hemoglobina > 5 g/dl o del hematocrito ≥ 15% | |
| GUSTO 14 , 1993 | Sangrado intracraneal, sangrado que produzca deterioro hemodinámico o necesidad de intervención | ||
| CURE 15 , 2001 | Sangrado mortal, intraocular que produzca pérdida de visión, intracraneal sintomático o sangrado que requiera inotrópicos o intervención quirúrgica | ≥ 2 CH | Caída de hemoglobina > 5 g/dl |
| GRACE 4 , 2003 | Sangrado mortal, hemorragia subdural, ictus hemorrágico | Caída del hematocrito ≥ 10% | |
| ACUITY 17 , 2006 | Sangrado mortal, intracraneal, retroperitoneal o intraocular, hematoma ≥ 5 cm de diámetro, sangrado del acceso vascular que requiera reintervención por sangrado | Cualquier transfusión | Caída de hemoglobina ≥ 3 g/dl en presencia de sangrado evidente o ≥ 4 g/dl si no hay datos externos de sangrado |
| PLATO 18 , 2009 | Sangrado mortal, intracraneal, intraocular con pérdida permanente de visión, intrapericárdico, taponamiento cardiaco, shock hipovolémico e hipotensión grave que requiera intervención quirúrgica | ≥ 4 CH | Caída de la hemoglobina ≥ 5 g/dl o sangrado asociado a una caída de la hemoglobina de 3-5 g/dl o a necesidad de transfusión de 2-3 CH |
| CRUSADE 5 , 2009 | Sangrado intracraneal o retroperitoneal | Cualquier transfusión con hematocrito ≥ 28% o < 28% con hemorragia manifiesta | Caída del hematocrito ≥ 12% |
| BARC 19 , 2010 | Sangrado mortal, intracraneal, intraocular que compromete la visión, taponamiento cardiaco; sangrado que requiera intervención quirúrgica o fármacos vasoactivos, drenaje de tubo de tórax ≥ 2 l en 24 h | Cualquier transfusión asociada a hemorragia manifiesta o transfusión ≥ 5 unidades de sangre total o CH en 48 h tras CABG | Hemorragia manifiesta con caída de hemoglobina ≥ 3 g/dl |
CABG: cirugía de revascularización coronaria; CH: concentrado de hematíes.
Tras la publicación de diversos estudios sobre pacientes con SCA, han ido apareciendo numerosas definiciones3,12, 13, 14, 15, 16, 17, 18, 19 y escalas de riesgo hemorrágico20,21 (Tabla 1 y Tabla 2).
Tabla 2. Principales escalas de estratificación del riesgo hemorrágico
| Escala Mehran20 | |
| Parámetro | Puntos |
| Sexo | |
| Femenino | +8 |
| Masculino | 0 |
| Edad (años) | |
| < 50 | 0 |
| 50–69 | +3 |
| 60–69 | +6 |
| 70–79 | +9 |
| ≥ 80 | +12 |
| Creatinina sérica (mg/dl) | |
| < 1 | 0 |
| 1,0 | +2 |
| 1,2 | +3 |
| 1,4 | +5 |
| 1,6 | +6 |
| 1,8 | +8 |
| > 2 | +10 |
| Recuento de glóbulos blancos (×109/l) | |
| < 10 | 0 |
| 10 | +2 |
| 12 | +3 |
| 14 | +5 |
| 16 | +6 |
| 18 | +8 |
| > 20 | +10 |
| Anemia* | |
| Sí | +6 |
| No | 0 |
| Presentación clínica | |
| SCACEST | +6 |
| SCASEST con aumento de biomarcadores | +2 |
| SCASEST sin aumento de biomarcadores | 0 |
| Medicación antitrombótica | |
| Heparina+IGP | 0 |
| Bivalirudina en monoterapia | −5 |
| Categoría de riesgo | |
| Bajo | < 10 |
| Moderado | 10–14 |
| Alto | 15–19 |
| Muy alto | ≥ 20 |
| Escala CRUSADE5 | |
| Parámetro | Puntos |
| Hematocrito basal (%) | |
| < 31 | 9 |
| 31–33,9 | 7 |
| 34–36,9 | 3 |
| 37–39,9 | 2 |
| ≥ 40 | 0 |
| Frecuencia cardiaca (lpm) | |
| ≤ 70 | 0 |
| 71–80 | 1 |
| 81–90 | 3 |
| 91–100 | 6 |
| 101–110 | 8 |
| 111–120 | 10 |
| ≥ 121 | 11 |
| Sexo | |
| Varón | 0 |
| Mujer | 8 |
| Diabetes | |
| No | 0 |
| Sí | 8 |
| Aclaramiento de creatinina (ml/min) | |
| < 15 | 39 |
| 15–30 | 35 |
| 30–60 | 28 |
| 60–90 | 17 |
| 90–120 | 7 |
| > 120 | 0 |
| Presión arterial sistólica (mmHg) | |
| ≤ 90 | 10 |
| 91–100 | 8 |
| 101–120 | 5 |
| 121–180 | 1 |
| 181–200 | 3 |
| ≥ 201 | 5 |
| Insuficiencia cardiaca a la admisión | |
| No | 0 |
| Sí | 7 |
| Enfermedad arterial periférica | |
| No | 0 |
| Sí | 7 |
| Categoría de riesgo | |
| Muy bajo | ≤ 20 |
| Bajo | 21–30 |
| Moderado | 31–40 |
| Alto | 41–50 |
| Muy alto | > 50 |
| Escala GRACE4 | |
| Parámetro | Puntos |
| Edad (años) | |
| < 40 | 0 |
| 40–49 | 18 |
| 50–59 | 36 |
| 60–69 | 55 |
| 70–79 | 73 |
| > 80 | 91 |
| Presión arterial (mmHg) | |
| < 80 | 63 |
| 80–99 | 58 |
| 100–119 | 47 |
| 120–139 | 37 |
| 140–159 | 26 |
| 160–199 | 11 |
| > 200 | 0 |
| Clase Killip | |
| I | 0 |
| II | 21 |
| III | 43 |
| IV | 64 |
| Frecuencia cardiaca (lpm) | |
| < 70 | 0 |
| 70–89 | 7 |
| 90–109 | 13 |
| 110–149 | 23 |
| 150–199 | 36 |
| > 200 | 46 |
| Creatinina | |
| 0–34 | 2 |
| 35–70 | 5 |
| 71–105 | 8 |
| 106–140 | 11 |
| 141–176 | 14 |
| 177–353 | 23 |
| ≥ 354 | 31 |
| Otros factores de riesgo | |
| Parada cardiaca al ingreso | 43 |
| Marcadores cardiacos altos | 15 |
| Supradesnivel del ST | 30 |
| Categoría de riesgo | |
| Bajo | ≤ 108 (< 1%) |
| Intermedio | 109–140 (3%) |
| Alto | > 140 (> 3%) |
| Bajo | ≤ 88 (< 3%) |
| Intermedio | 89–118 (3–8%) |
| Alto | > 118 (> 8%) |
| Escala ACTION-GWTG21 | |
| Parámetro | Puntos |
| Edad (años) | |
| ≤ 40 | 0 |
| 41–50 | 1 |
| 51–60 | 2 |
| 61–70 | 3 |
| 71–80 | 5 |
| 81–90 | 5 |
| ≥ 91 | 6 |
| Presión arterial (mmHg) | |
| ≤ 90 | 4 |
| 91–100 | 3 |
| 101–120 | 2 |
| 121–140 | 1 |
| 141–170 | 0 |
| 161–200 | 1 |
| ≥ 201 | 2 |
| Hemoglobina basal (g/dl) | |
| < 5 | 17 |
| 5–7,9 | 15 |
| 8–9,9 | 13 |
| 10–10,9 | 12 |
| 11–13,9 | 9 |
| 14–15,9 | 6 |
| ≥ 16 | 2 |
| Peso corporal (kg) | |
| ≤ 50 | 5 |
| 51–70 | 4 |
| 71–100 | 3 |
| 101–120 | 2 |
| 121–140 | 1 |
| ≥ 141 | 0 |
| Frecuencia cardiaca (lpm) | |
| ≤ 40 | 0 |
| 41–60 | 2 |
| 61–70 | 3 |
| 71–80 | 5 |
| 81–100 | 6 |
| 101–110 | 8 |
| 111–120 | 9 |
| 121–130 | 11 |
| 131–150 | 12 |
| ≥ 151 | 14 |
| Creatinina basal (mg/dl) | |
| < 0,8 | 0 |
| 0,8–1,59 | 1 |
| 1,6–1,99 | 2 |
| 2,00–2,99 | 4 |
| 3,00–3,99 | 6 |
| 4–4,99 | 8 |
| 5,00–5,99 | 10 |
| ≥ 6,00 | 11 |
| Diálisis | 11 |
| Sexo | |
| Mujer | 4 |
| Varón | 0 |
| Diabetes mellitus | |
| No | 0 |
| Sí | 3 |
| Enfermedad arterial periférica previa | |
| No | 0 |
| Sí | 3 |
| Uso de warfarina en casa | |
| No | 0 |
| Sí | 2 |
| Cambios en ECG | |
| Sin cambios en el ST | 0 |
| Descenso del ST o ascenso transitorio | 3 |
| Ascenso del ST | 7 |
| Insuficiencia cardiaca ± shock al ingreso | |
| Ninguno | 0 |
| Solo insuficiencia cardiaca | 3 |
| Insuficiencia cardiaca con shock | 15 |
| Categoría de riesgo | |
| Muy bajo | ≤ 20 |
| Bajo | 21–30 |
| Moderado | 31–40 |
| Alto | 41–50 |
| Muy alto | > 50 |
CABG: cirugía de revascularización coronaria; IGP: inhibidores de la glucoproteína IIb/IIIa; SCACEST: síndrome coronario agudo con elevación del ST; SCASEST: síndrome coronario agudo sin elevación del ST.
* Varones: hemoglobina 13 g/dl; mujeres: 12 g/dl.
Con el objetivo de acercar posturas, el subcomité de control de la International Society on Thrombosis and Haemostasis propuso una definición de hemorragia mayor no quirúrgica16. Más recientemente, el Bleeding Academic Research Consortium desarrolló una nueva definición universal de sangrado19 que se pueda utilizar de manera estandarizada en futuros estudios clínicos cardiovasculares.
Factores predictores del sangradoDada la estrecha relación entre la aparición de una complicación hemorrágica y la evolución clínica adversa de los pacientes con SCA, parece lógico que identificar los factores predictores del riesgo de sangrado sea un proceso de vital importancia3,12,22. Entre los factores que predisponen al sangrado, hay parámetros clínicos, farmacológicos y otros relacionados con los procedimientos invasivos3,6,7. Dependiendo de si se puede intervenir en ellos o no, se pueden dividir en factores no modificables, «potencialmente» modificables o modificables12 (Figura 1). Entre todos ellos, los más potentes son la edad, el sexo femenino, el antecedente de sangrado y anemia, la insuficiencia renal, la presentación clínica como shock cardiogénico, el uso de procedimientos invasivos y de inhibidores de la glucoproteína IIb/IIIa (anti-GPIIb/IIIa), fármacos que duplican el riesgo de sangrado, particularmente en el SCA con elevación del ST12.
Figura 1. Factores predisponentes al sangrado en el síndrome coronario agudo. Modificado con permiso de Phuong-Anh Pham et al 12 ( http://creativecommons.org/licenses/by-nc/3.0/ ) EAC: enfermedad arterial coronaria; HNF: heparina no fraccionada sódica; ICP: intervencionismo coronario percutáneo; IGP: inhibidores de la glucoproteína IIb/IIIa; INR: razón internacional normalizada.
La mayoría de los predictores de complicaciones hemorrágicas también lo son de eventos isquémicos, por lo que estas variables suelen estar compartidas en ambas escalas de estratificación de riesgo8. Los pacientes que han sufrido complicaciones hemorrágicas suelen presentar mayor número de comorbilidades relacionadas con el riesgo de eventos mortales y no mortales12. En los estudios, a pesar del ajuste por dichas comorbilidades, los modelos estadísticos probablemente no identifiquen todas las variables clínicas y demográficas que influyen en el riesgo de sangrado23.
Actualmente existe una serie de escalas diseñadas para predecir las complicaciones hemorrágicas y estratificar el riesgo de hemorragia mayor de los pacientes con SCA, tal y como recomiendan las guías de práctica clínica actuales (recomendación IB)11. Entre las existentes, destacan la escala GRACE4 y las tres más recientemente validadas en nuestro medio: CRUSADE5, Mehran20 y ACTION21 (Tabla 2). En un estudio retrospectivo, Abu-Assi et al24 compararon la validez de estas tres escalas en el SCA, y observaron mejor capacidad del CRUSADE5 para predecir riesgo de hemorragia según la definición específica de cada estudio y según los criterios TIMI.
Hay que destacar las limitaciones de estas escalas para predecir sangrado en algunos grupos especiales de población, como son los ancianos y los jóvenes. Frecuentemente, estos subgrupos se encuentran escasamente representados en los estudios, por lo que la generalización de dichos resultados debe hacerse con cautela. Recientemente, un estudio ha mostrado peor capacidad discriminativa de estas escalas de riesgo hemorrágico (algo menos evidente con la escala GRACE) en ancianos con SCA23. Los autores postulan que la coexistencia de comorbilidades y la mayor fragilidad son factores que contribuyen a dificultar la predicción del riesgo de eventos isquémicos y hemorrágicos en estos pacientes.
Recomendaciones para prevenir el sangradoPara prevenir la hemorragia mayor, se debe incidir en todos los factores de riesgo modificables o «potencialmente» modificables.
FármacosLa sobredosificación y la combinación de estos fármacos están directamente relacionadas con la predisposición al sangrado25. El registro CRUSADE5 reveló que más del 42% de los pacientes con SCA sin elevación del ST recibían al menos un fármaco antitrombótico por encima de las dosis recomendadas. Para minimizar este riesgo, se debería utilizar las pautas de tratamiento antitrombótico que tengan el perfil de eficacia y seguridad más favorable, minimizar su duración y establecer las dosis de fármacos más adecuadas ajustándolas a edad, peso corporal y función renal.
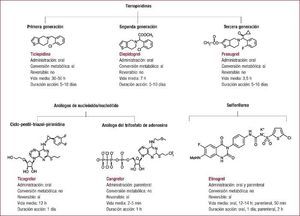
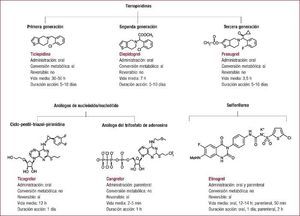
Las guías de práctica clínica actuales11,26,27 recomiendan el doble tratamiento antiplaquetario con ácido acetilsalicílico (AAS) a dosis de 75–100 mg/día y un inhibidor de P2Y12 durante 12 meses como tratamiento de primera línea tras un SCA, con independencia de que se realicen o no ICP e implante de stents. Dos nuevos fármacos antiagregantes, el prasugrel28 y el ticagrelor18, se han demostrado más efectivos que el clopidogrel en la reducción de eventos cardiovasculares tras un SCA, aunque ambos condicionan un incremento del riesgo hemorrágico. Por este motivo, se debe identificar a los subgrupos que más se beneficien de estos nuevos agentes farmacológicos para minimizar las complicaciones hemorrágicas y garantizar la mayor eficiencia posible.
En la fase aguda del SCA, se recomienda la anticoagulación combinada con el tratamiento antiplaquetario para todos los pacientes, ya que la combinación de ambas estrategias es más efectiva que cualquiera de ellas por separado29. La elección del anticoagulante debe hacerse atendiendo al contexto clínico y la estratificación del riesgo isquémico y hemorrágico, y se debe evitar el intercambio entre heparinas (enoxaparina o heparina no fraccionada)11.
En el SCA sin elevación del ST, se prefiere el uso de fondaparinux sobre enoxaparina o heparina no fraccionada, por ser el fármaco con el mejor perfil de eficacia y seguridad (recomendación IA)11. En el SCA con elevación del ST, la bivalirudina tiene una recomendación IB en las guías26, frente a IC o IIbB de la heparina no fraccionada y la heparina de bajo peso molecular respectivamente, ya que se demostró una reducción de las tasas de hemorragia y mortalidad en angioplastia primaria. Por el contrario, en este contexto no se recomienda el fondaparinaux debido a una mayor tasa de complicaciones trombóticas periprocedimiento30.
Según la evidencia disponible actualmente, el uso de anti-GPIIb/IIIa está restringido al ámbito de la angioplastia; en procedimientos de alto riesgo trombótico con bajo riesgo de sangrado, no se recomienda su administración sistemática antes de la angiografía en una estrategia terapéutica invasiva26,31.
Un 5–7% de los pacientes sometidos a ICP y hasta un 10% de los pacientes con SCA tienen indicación de anticoagulación oral (ACO) a largo plazo por diversas causas (principalmente fibrilación auricular con CHA2DS2-VASc ≥ 1 [salvo la asignación de 1 punto por sexo femenino], válvulas cardiacas mecánicas o tromboembolia venosa)32. Estudios previos han demostrado que la doble antiagregación ofrece una protección contra el ictus menos eficaz que los ACO en monoterapia32; por otro lado, los ACO parecen insuficientes para evitar la trombosis del stent33. Por este motivo, en la práctica clínica diaria no es infrecuente que haya que emplear doble (es decir, AAS o clopidogrel más ACO) o incluso triple terapia (doble antiagregación plaquetaria más un ACO), a pesar de que esta combinación de fármacos se asocia a un riesgo elevado (4–16%) de eventos hemorrágicos mortales y no mortales25,32.
Hasta la fecha hay pocos datos procedentes de ensayos clínicos aleatorizados que guíen la actuación que se debe seguir con estos pacientes con indicación de doble o triple terapia, y la mayoría de ellos se han diseñado con AAS, clopidogrel y antagonistas de la vitamina K. Con el objetivo de unificar criterios, se han elaborado dos documentos de consenso que proponen una duración de la triple terapia adaptada al riesgo hemorrágico y trombótico de cada paciente, pero siempre «lo más corta posible», para minimizar las complicaciones hemorrágicas34. El primero fue el del Grupo de Trabajo sobre Trombosis de la Sociedad Europea de Cardiología35, respaldado por la European Heart Rhythm Association y la European Association of Percutaneus Cardiovascular Intervention. Posteriormente surgió en esta misma línea de recomendaciones otro ensayo norteamericano36. Además, un ensayo reciente37 incluyó a 573 pacientes sometidos a angioplastia que tomaban crónicamente antagonistas de la vitamina K y los aleatorizó a recibir doble terapia con clopidogrel o triple terapia. Al año de seguimiento, el grupo de doble terapia mostró una menor incidencia de episodios de sangrado (el 19,4 frente al 44,4%) en todas las localizaciones (excepto la intracerebral, que fue baja en los dos grupos), sobre todo por la reducción de hemorragias menores, así como menor necesidad de transfusión (el 3,9 frente al 9,5%), sin que se observaran diferencias en cuanto a la tasa de eventos trombóticos. Aunque este estudio tiene algunas limitaciones, de confirmarse estos hallazgos con estudios de mayor tamaño muestral y seguimiento más largo, las recomendaciones actuales que aplicamos a estos pacientes podrían verse modificadas.
Además, en pacientes tratados con doble y triple terapia la dosificación de los antagonistas de la vitamina K debe vigilarse estrechamente con un objetivo de razón internacional normalizada (INR) 2–2,5 la mayor parte del tiempo. Valores de INR > 2,5 se han relacionado con aumento de sangrado en estos pacientes34, 35, 36.
Por otra parte, los nuevos ACO se postulan como tratamiento de primera línea en pacientes con fibrilación auricular no valvular debido a su perfil de efectos secundarios más favorable32, pero la experiencia con ellos en el ámbito de la triple terapia es escasa. Los ensayos clínicos que han evaluado la utilidad de estos nuevos agentes en pacientes con SCA sin indicación de ACO a largo plazo38, 39, 40 mostraron un exceso de complicaciones hemorrágicas en los pacientes tratados con triple terapia, comparados con el grupo que recibió AAS y clopidogrel. A día de hoy, no existen estudios que comparen la eficacia de la triple o la doble terapia con los nuevos ACO frente a la habitual con los antagonistas de la vitamina K en pacientes con SCA e indicación de ACO. En cuanto a los nuevos antiagregantes, el único estudio disponible hasta la fecha que evalúa el uso de prasugrel41 (comparado con clopidogrel) en la triple terapia mostró un aumento importante de la tasa de hemorragias mayores, por lo que actualmente no se recomienda. Con respecto al ticagrelor, aún se desconoce su papel en este contexto.
GastroprotecciónSe ha descrito que, durante la fase inicial de los SCA, las hemorragias gastrointestinales suponen hasta un 50% de todos los episodios hemorrágicos espontáneos11. De ahí la importancia de realizar una adecuada gastroprotección tratando con inhibidores de la bomba de protones a los pacientes con factores que predisponen a hemorragia digestiva alta (antecedentes de sangrado digestivo, tratamiento con antiinflamatorios no esteroideos, corticoides o ACO e infección por Helicobacter pylori) tratados con más de un fármaco antitrombótico. La interacción farmacocinética descrita entre el omeprazol y otros inhibidores de la bomba de protones y el clopidogrel no se ha corroborado clínicamente en los estudios desarrollados posteriormente42.
Elección del stentFuera del ámbito del SCA, las actuales guías de práctica clínica sobre revascularización27 recomiendan mantener la doble antiagregacion durante 6–12 meses tras el implante de un stent liberador de fármaco (SLF) y 4 semanas para los stents metálicos sin recubrimiento (SMSR). Tras un SCA, la recomendación actual es mantener la doble antiagregación durante 1 año independientemente de la estrategia de revascularización.
Hay que evitar los SLF en pacientes con alto riesgo hemorrágico y limitarlos a las situaciones clínicas o anatómicas en que se ha demostrado mayor beneficio, es decir, las relacionadas con mayor tasa de reestenosis (lesiones largas y múltiples, vasos pequeños, diabetes mellitus)34, 35, 36. En caso de que sea necesario un SLF, se recomienda emplear los de segunda y tercera generación, que al parecer requieren un periodo de doble antiagregación más corto.
Elección de la vía de accesoSiempre que la situación hemodinámica del paciente y la experiencia del operador lo permitan, se debe escoger la vía de acceso radial, ya que se asocia a una reducción significativa de la tasa de sangrados relacionados con el acceso vascular11,34, 35, 36.
Cirugía de revascularización coronariaEn pacientes derivados a cirugía de revascularización coronaria (CABG), la administración perioperatoria de AAS disminuye la tasa de eventos cardiovasculares y de fracaso del injerto. Sin embargo, estudios clásicos como el CURE15 mostraron que mantener la doble antiagregación suponía mayor riesgo hemorrágico. Aunque más recientemente otros estudios como el ACUITY17 no han identificado al clopidogrel como predictor independiente de sangrado tras tener en cuenta otros factores, se sigue recomendando suspender el clopidogrel 5 días antes de la CABG en ausencia de isquemia activa o de anatomía coronaria de alto riesgo11.
En cuanto a los nuevos antiagregantes, el prasugrel mostró 4 veces más riesgo de sangrado asociado a CABG que el clopidogrel28, por lo que en casos de cirugía no urgente se recomienda suspenderlo 7 días antes11. En el estudio PLATO18, tras suspender el ticagrelor entre 1 y 3 días antes de la CABG, no se encontraron diferencias en las tasas de sangrado con respecto al clopidogrel.
Aún se desconoce cuál es el momento óptimo para reiniciar el clopidogrel o el ticagrelor después de la CABG, por lo que se recomienda reanudarlo con cautela «en cuanto se considere seguro»11.
Cirugía no cardiacaAproximadamente un 5% de los pacientes con stent se someterán a cirugía no cardiaca durante el primer año tras el implante43. Esta es una situación especial de riesgo debido a que la cirugía condiciona un estado protrombótico, a lo que hay que añadir la interrupción de la terapia antiagregante. Este riesgo está condicionado principalmente por la aparición de una trombosis del stent, complicación con alta mortalidad, sobre todo en el perioperatorio (hasta el 85%), y estrechamente relacionada con la interrupción de la antiagregación43. Por otro lado, el riesgo hemorrágico asociado al mantenimiento de la terapia antiagregante puede ser inasumible en algunos tipos de cirugía (intracraneal, canal espinal, etc.).
En situaciones que conllevan alto riesgo trombótico y hemorrágico, se ha planteado el uso de terapia puente con fármacos antiagregantes de vida media corta y efecto rápidamente reversible, como los anti-GPIIb/IIIa o el cangrelor11,43, pero no se dispone aún de evidencia científica sólida, ya que la mayor parte de la información disponible procede de pequeños estudios observacionales.
La terapia puente con heparina de bajo peso molecular no se ha demostrado eficaz para evitar la trombosis del stent; además, se asocia con una mayor tasa de complicaciones hemorrágicas, por lo que no se recomienda en este contexto44.
Dado que esta va a ser una situación compleja y relativamente frecuente en la práctica clínica habitual, se debe realizar un abordaje multidisciplinario, individualizando el riesgo de cada paciente, para consensuar una estrategia que sea al mismo tiempo segura y eficaz (Figura 2).
Figura 2. Algoritmo de manejo perioperatorio de los antiagregantes en cirugía no cardiaca. AAS: ácido acetilsalicílico; DA: arteria descendente anterior; Clopi.: clopidogrel; DM: diabetes mellitus; IGP IIb/IIIa: inhibidores de la glucoproteína IIb/IIIa; SCA: síndrome coronario agudo; TCI: tronco común izquierdo; TEP: tromboembolia pulmonar.
ConclusionesLas complicaciones hemorrágicas son un problema frecuente y un claro predictor de eventos adversos en la evolución clínica de los pacientes con SCA. Por este motivo, es importante identificar todos los factores que predisponen al sangrado e instaurar las medidas preventivas necesarias para evitarlo. La estratificación del riesgo hemorrágico en el SCA debe considerarse parte de la evaluación inicial del paciente, con el fin de guiar las estrategias diagnósticas y terapéuticas durante el ingreso, y después se deberá seguir revaluándolo periódicamente. Para ello es fundamental que se acepte una definición de sangrado estandarizada y que se desarrollen escalas de riesgo hemorrágico con capacidad predictiva y utilidad clínica demostrada, con el fin de mejorar el proceso de estratificación.
Conflicto de interesesNinguno.
Autor para correspondencia: Departamento de Cardiología, Hospital Clínico, Universitario Virgen de la Arrixaca, Universidad de Murcia, Ctra. Madrid-Cartagena, s/n, 30120 El Palmar, Murcia, España. fcomarino@hotmail.com