Hay poca información sobre la utilidad de la ecocardiografía intravascular (IVUS) en el tratamiento de lesiones coronarias largas con stents farmacoactivos de segunda generación. Se evaluaron por IVUS los predictores de eventos adversos cardiovasculares mayores (MACE) a los 12 meses del implante de stents liberadores de everolimus para el tratamiento de lesiones coronarias largas.
MétodosSe incluyó a un total de 804 pacientes, procedentes de 2 ensayos clínicos aleatorizados, a los que se exploró por IVUS después del implante de un stent liberador de everolimus largo (≥ 28 mm). Los MACE se definieron como la combinación de eventos de muerte cardiaca, infarto de miocardio y revascularización de la lesión diana.
ResultadosSe produjeron MACE en 24 pacientes (3,0%) en 12 meses. En el análisis de regresión de Cox multivariable, los factores ecocardiográficos independientes predictivos fueron el área luminal mínima de la lesión diana tras la intervención (HR = 0,623; IC95%, 0,433-0,895; p = 0,010) y el cociente ALM/área luminal del segmento de referencia distal (HR = 0,744; IC95%, 0,572-0,969; p = 0,028). Los valores del ALM y del cociente ALM/área luminal del segmento de referencia distal que predecían mejor qué pacientes sufrirían MAC diferenciándolos de los que no los tendrían fueron 5,0 mm2 y 1,0 respectivamente. Los pacientes con ALM < 5,0 mm2 o menor que el área luminal del segmento de referencia distal tenían mayor riesgo de MACE (HR = 6,231; IC95%, 1,859-20,891; p = 0,003).
ConclusionesLos pacientes con un un ALM medida con IVUS tras la intervención < 5,0 mm2 o menor que el área luminal del segmento de referencia distal tuvieron más riesgo de MACE tras el implante de un stent liberador de everolimus largo.
Palabras clave
Al contrario que con los stents metálicos sin recubrimiento, la utilidad clínica de la ecocardiografía intravascular (IVUS) no se ha establecido claramente por lo que respecta a la intervención coronaria percutánea con los stents farmacoactivos (SFA)1–8. Varios metanálisis han indicado que guiar el procedimiento mediante IVUS puede asociarse a un riesgo de eventos cardiovasculares adversos mayores (MACE) menor que guiándolo por angiografía2,4,6,7. Sin embargo, en los ensayos clínicos aleatorizados no se ha podido confirmar la superioridad del implante de SFA guiado por IVUS1,3,5. En consecuencia, en la era de los SFA, las guías actuales recomiendan considerar el empleo de IVUS en pacientes seleccionados con lesiones complejas, como las del tronco coronario izquierdo9,10. Los implantes de SFA largos conllevan un aumento del riesgo de reestenosis en el stent en comparación con lo que se observa con los stents de menor longitud11,12. En consecuencia, guiar los procedimientos por IVUS puede ser beneficioso para pacientes con lesiones coronarias largas. Recientemente, un ensayo clínico aleatorizado ha demostrado que el implante de SFA largos guiado por IVUS reduce la tasa de revascularizaciones de la lesión diana (RLD)13. Aunque en estudios previos con IVUS se ha observado que un umbral de expansión del stent podría predecir la reestenosis en el stent tras el implante de un SFA12,14, aún son pocos los datos disponibles. Esto resulta especialmente cierto para los pacientes con lesiones coronarias largas. Además, los datos previos se obtuvieron a partir de estudios observacionales retrospectivos o que emplearon los SFA de primera generación12,14.
El objetivo del presente estudio es identificar factores de la IVUS que predijeran los MACE en una serie amplia de pacientes tratados con stents liberadores de everolimus (SLE) largos procedentes de ensayos prospectivos y aleatorizados. Este tipo de stent es uno de los SFA de segunda generación más ampliamente utilizados en la práctica clínica actual15.
MÉTODOSPoblación del estudioSe incluyó a los pacientes de 2 ensayos aleatorizados: el RESET16 y el IVUS-XPL13. De forma resumida, RESET es un ensayo aleatorizado de no inferioridad, en el que se compararon 3 meses de tratamiento antiagregante plaquetario doble tras el implante de stents liberadores de zotarolimus Endeavor sprint (Medtronic Inc.; Santa Rosa, California, Estados Unidos) con 12 meses de tratamiento antiagregante plaquetario doble tras el implante de otro SFA. En el subgrupo preespecificado de pacientes con lesiones largas de este estudio5,16, se aleatorizó a 543 pacientes al tratamiento con el stent liberador de zotarolimus Endeavor sprint o al SLE (Xience V, Abbott Vascular). A continuación se asignó aleatoriamente a los pacientes al implante de un SFA guiado por IVUS o por angiografía (diseño de 2 × 2). En el otro ensayo aleatorizado, el estudio IVUS-XPL, se aleatorizó a un total de 1.400 pacientes con lesiones coronarias largas a implante de SLE (Xience Prime, Abbott Vascular; Santa Clara, California, Estados Unidos) guiado por IVUS o por angiografía. Los protocolos detallados de estos ensayos se publicaron con anterioridad5,13,16. Finalmente, se incluyó en este estudio a un total de 804 pacientes procedentes de estos 2 ensayos a los que se exploró con IVUS después del implante de un SLE largo (≥ 28 mm): 127 pacientes del ensayo RESET y 677 del IVUS-XPL. Los protocolos de estudio de estos ensayos fueron aprobados por el comité de ética de la investigación de cada uno de los centros participantes, y se obtuvo de todos los pacientes el consentimiento por escrito.
Intervención coronaria percutánea y tratamiento farmacológicoEl implante del SLE se llevó a cabo mediante técnicas estándares. Se utilizaron stents solapados si no era posible abarcar toda la lesión con un solo stent. El diámetro y la longitud del stent se eligieron según las mediciones realizadas con la IVUS online. Se realizó una dilatación a alta presión adyuvante a criterio del operador, basándose en las observaciones realizadas en la IVUS5,13. Se permitió el empleo de IVUS en cada paso del implante del SLE (antes, durante o después del implante). Las exploraciones de IVUS antes y durante del implante del SLE no eran obligatorias; sin embargo, sí lo era la exploración tras la intervención5,13. En el ensayo IVUS-XPL, los criterios de IVUS tras la intervención para la optimización del stent fueron un área luminal mínima (ALM) superior al área luminal de los segmentos de referencia distales13. Se utilizó uno de los 2 sistemas de IVUS comercializados (Atlantis o I-Lab, Boston Scientific Corp./SCIMED; Minneapolis, Minnesota, Estados Unidos, o Eagle Eye, Volcano Therapeutics; Rancho Cordova, California, Estados Unidos).
Al menos 12 h antes del implante del SLE, todos los pacientes recibieron una dosis de carga de ácido acetilsalicílico (100 mg) y clopidogrel (300 mg). Sin embargo, si no se administraba esta dosis de carga de clopidogrel, el paciente recibía en su lugar una dosis de carga de 600 mg en el laboratorio de cateterismo inmediatamente antes de la intervención coronaria percutánea. Se administró heparina no fraccionada intraoperatoriamente para mantener un tiempo de coagulación activado > 250 s. Se utilizaron inhibidores de la glucoproteína IIb/IIIa a criterio del operador. Tras el implante del SLE, se prescribió a los pacientes ácido acetilsalicílico (100 mg/día) por tiempo indefinido. La duración del empleo de clopidogrel (75 mg/día) dependió de las asignaciones aleatorizadas de los ensayos RESET e IVUS-XPL. Es de destacar que se asignó 12 meses de tratamiento antiagregante plaquetario doble a todos los pacientes del ensayo RESET.
Análisis de angiografía y ecocardiografía intravascularEn un laboratorio central independiente, situado en el Cardiovascular Research Center de Seúl (Corea), analistas a los que se ocultaron las asignaciones de los pacientes y los tratamientos llevaron a cabo las mediciones de angiografía e IVUS. Antes y después del implante del SLE, se utilizó un sistema de angiografía coronaria cuantitativa off-line (sistema CASS, Pie Medical Instruments; Maastricht, Países Bajos) para llevar a cabo un análisis de angiografía coronaria cuantitativa. Empleando el catéter guía para la ampliación-calibrado, se midieron los diámetros del vaso de referencia (el promedio de los diámetros luminales proximal y distal del vaso de referencia) y el diámetro luminal mínimo antes y después del implante del SLE. Estas mediciones se realizaron a partir de los fotogramas diastólicos en una sola proyección emparejada, que mostraba el diámetro luminal mínimo más pequeño.
Se realizó una planimetría estandarizada de la luz, el stent y el área luminal del vaso empleando un programa informático de planimetría (Echoplaque, INDEC Systems; Santa Clara, California, Estados Unidos) siguiendo lo establecido en la guía de IVUS del American College of Cardiology17. Se realizó una evaluación cuantitativa de la lesión diana y de los segmentos de referencia proximal y distal. La localización de la lesión diana después de la intervención fue el corte de imagen que tenía la ALM. Los segmentos de referencia proximal y distal fueron los segmentos de aspecto más normal situados a menos de 5 mm de la lesión diana, en sentido proximal y distal respectivamente.
Seguimiento y objetivos del estudioDespués del implante del SLE, se realizaron evaluaciones clínicas en el hospital y 1, 3, 6 y 12 meses tras el alta. Las evaluaciones de seguimiento se llevaron a cabo durante una visita en la clínica o mediante entrevistas telefónicas. Los MACE se definieron como la combinación de eventos de muerte cardiaca, infarto de miocardio relacionado con la lesión diana y RLD a causa de isquemia.
Los eventos clínicos se definieron según lo establecido por el Academic Research Consortium y el documento de consenso de expertos de la tercera definición universal del infarto de miocardio18,19. Las muertes se consideraron de origen cardiaco salvo que pudiera establecerse de manera inequívoca una causa no cardiaca18. En el seguimiento realizado al año, el infarto de miocardio relacionado con la lesión diana se definió mediante los siguientes parámetros: síntomas clínicos, alteraciones electrocardiográficas o signos anormales en las exploraciones de imagen indicativos de un infarto de miocardio y un aumento de la banda miocárdica de la creatincinasa por encima del límite superior de la normalidad o un aumento de troponina T/troponina I por encima del percentil 99 del límite superior de la normalidad. El territorio del infarto de miocardio era el irrigado por la arteria coronaria que contenía las lesiones tratadas con stents (stent de longitud ≥ 28 mm implantado)13,19. La RLD a causa de isquemia se definió como la repetición de la intervención coronaria percutánea o la realización de una intervención quirúrgica de bypass coronario para la lesión diana, con alguna de las dos características siguientes: a) estenosis del diámetro angiográfico ≥ 50% en el análisis angiográfico coronario cuantitativo, con prueba de estrés positiva documentada, o b) estenosis ≥ 70% del diámetro angiográfico con independencia de los resultados de la prueba de estrés18.
Análisis estadísticoEl análisis estadístico se realizó con el programa SPSS (versión 18.0.0, SPSS Inc.; Chicago, Illinois, Estados Unidos). Las variables discretas se presentan como número y porcentaje y se compararon con la prueba de la χ2 o la prueba exacta de Fisher. En cambio, las variables continuas se presentan como media ± desviación estándar o mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student o la de la U de Mann-Whitney (si la distribución de datos era asimétrica). Se utilizó un análisis de regresión de Cox multivariable para determinar los parámetros de la IVUS que predecían de manera independiente los MACE durante los 12 meses de seguimiento. Las variables del análisis univariable con p < 0,1 se incluyeron en el modelo multivariable. Se utilizó un análisis de características operativas del receptor para determinar los mejores valores de corte de los parámetros de IVUS con valor predictivo de MACE independiente. Se realizó también un análisis de regresión lineal simple para evaluar la asociación entre el tamaño del vaso de referencia y los resultados de la IVUS. Todos los valores de p fueron bilaterales. Un valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOSUn total de 24 (3%) de los 804 pacientes a los que se implantó SLE sufrieron MACE durante los 12 meses de seguimiento; 3 pacientes fallecieron, 3 sufrieron infarto de miocardio relacionado con la lesión diana y a 22 se les practicó una RLD a causa de isquemia. De ellos, 2 pacientes fallecieron por infarto de miocardio sin tratamiento de revascularización y otro falleció tras un infarto de miocardio a pesar de una revascularización de emergencia.
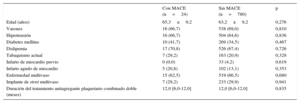
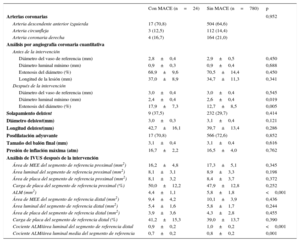
Las características clínicas existentes en el momento de la intervención de cualificación para el estudio se indican en la tabla 1. No hubo diferencias significativas entre los pacientes con y sin MACE en cuanto a las características clínicas. En la tabla 2 se presentan las características de las lesiones y de las intervenciones en los 2 grupos. Tras el implante del SLE, en comparación con los 780 pacientes sin MACE, los 24 que sí sufrieron MACE tenían un diámetro luminal mínimo menor (2,4 ± 0,4 frente a 2,6 ± 0,4 mm; p = 0,019) y estenosis de mayor diámetro (el 17,9 ± 7,3% frente al 12,7 ± 8,5%; p = 0,005) en el análisis angiográfico coronario cuantitativo. En el análisis de la IVUS posterior a la intervención, los 24 pacientes con MACE tenían una ALM menor (4,4 ± 1,1 frente a 5,8 ± 1,8 mm2; p < 0,001), un valor más bajo del cociente de ALM/área luminal del segmento de referencia distal (0,9 ± 0,2 frente a 1,0 ± 0,2; p < 0,001) y un valor más bajo del cociente ALM/área luminal media del segmento de referencia (0,7 ± 0,2 frente a 0,8 ± 0,2; p = 0,001) que los pacientes sin MACE.
Características clínicas basales
| Con MACE (n=24) | Sin MACE (n=780) | p | |
|---|---|---|---|
| Edad (años) | 65,3±9,2 | 63,2±9,2 | 0,276 |
| Varones | 16 (66,7) | 538 (69,0) | 0,810 |
| Hipertensión | 16 (66,7) | 504 (64,6) | 0,836 |
| Diabetes mellitus | 10 (41,7) | 269 (34,5) | 0,467 |
| Dislipemia | 17 (70,8) | 526 (67,4) | 0,726 |
| Tabaquismo actual | 7 (29,2) | 163 (20,9) | 0,328 |
| Infarto de miocardio previo | 0 (0,0) | 33 (4,2) | 0,619 |
| Infarto agudo de miocardio | 5 (20,8) | 102 (13,1) | 0,353 |
| Enfermedad multivaso | 15 (62,5) | 519 (66,5) | 0,680 |
| Implante de stent multivaso | 7 (29,2) | 233 (29,9) | 0,941 |
| Duración del tratamiento antiagregante plaquetario combinado doble (meses) | 12,0 [6,0-12,0] | 12,0 [6,0-12,0] | 0,835 |
MACE: eventos cardiovasculares adversos mayores.
Los datos se presentan como n (%), media±desviación estándar o mediana [intervalo intercuartilico].
Características de la lesión y de la intervención
| Con MACE (n=24) | Sin MACE (n=780) | p | |
|---|---|---|---|
| Arterias coronarias | 0,952 | ||
| Arteria descendente anterior izquierda | 17 (70,8) | 504 (64,6) | |
| Arteria circunfleja | 3 (12,5) | 112 (14,4) | |
| Arteria coronaria derecha | 4 (16,7) | 164 (21,0) | |
| Análisis por angiografía coronaria cuantitativa | |||
| Antes de la intervención | |||
| Diámetro del vaso de referencia (mm) | 2,8±0,4 | 2,9±0,5 | 0,450 |
| Diámetro luminal mínimo (mm) | 0,9±0,3 | 0,9±0,4 | 0,688 |
| Estenosis del diámetro (%) | 68,9±9,6 | 70,5±14,4 | 0,450 |
| Longitud de la lesión (mm) | 37,0±8,9 | 34,7±11,3 | 0,341 |
| Después de la intervención | |||
| Diámetro del vaso de referencia (mm) | 3,0±0,4 | 3,0±0,4 | 0,545 |
| Diámetro luminal mínimo (mm) | 2,4±0,4 | 2,6±0,4 | 0,019 |
| Estenosis del diámetro (%) | 17,9±7,3 | 12,7±8,5 | 0,005 |
| Solapamiento delstent | 9 (37,5) | 232 (29,7) | 0,414 |
| Diámetro delstent(mm) | 3,0±0,3 | 3,1±0,4 | 0,121 |
| Longitud delstent(mm) | 42,7±16,1 | 39,7±13,4 | 0,286 |
| Posdilatación adyuvante | 17 (70,8) | 566 (72,6) | 0,852 |
| Tamaño del balón final (mm) | 3,1±0,4 | 3,1±0,4 | 0,616 |
| Presión de inflación máxima (atm) | 16,7±2,2 | 16,5±4,0 | 0,762 |
| Análisis de IVUS después de la intervención | |||
| Área de MEE del segmento de referencia proximal (mm2) | 16,2±4,8 | 17,3±5,1 | 0,345 |
| Área luminal del segmento de referencia proximal (mm2) | 8,1±3,1 | 8,9±3,3 | 0,198 |
| Área de placa del segmento de referencia proximal (mm2) | 8,1±3,2 | 8,4±3,7 | 0,372 |
| Carga de placa del segmento de referencia proximal (%) | 50,0±12,2 | 47,9±12,8 | 0,252 |
| ALM (mm2) | 4,4±1,1 | 5,8±1,8 | <0,001 |
| Área de MEE del segmento de referencia distal (mm2) | 9,4±4,2 | 10,1±3,9 | 0,436 |
| Área luminal del segmento de referencia distal (mm2) | 5,4±1,6 | 5,8±1,7 | 0,244 |
| Área de placa del segmento de referencia distal (mm2) | 3,9±3,6 | 4,3±2,8 | 0,455 |
| Carga de placa del segmento de referencia distal (%) | 41,2±15,3 | 39,0±13,7 | 0,390 |
| Cociente ALM/área luminal del segmento de referencia distal | 0,9±0,2 | 1,0±0,2 | <0,001 |
| Cociente ALM/área luminal media del segmento de referencia | 0,7±0,2 | 0,8±0,2 | 0,001 |
ALM: área luminal mínima; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores; MEE: membrana elástica externa.
Los datos se presentan como n (%) o media±desviación estándar.
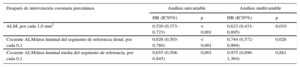
Los parámetros de la IVUS con valor predictivo de MACE se indican en la tabla 3. En el análisis de regresión de Cox multivariable, los parámetros independientes predictivos de MACE fueron la ALM tras la intervención (hazard ratio [HR] = 0,623; intervalo de confianza del 95% [IC95%], 0,433-0,895; p = 0,010) y el cociente ALM/área luminal del segmento de referencia distal (HR = 0,744; IC95%, 0,572-0,969; p = 0,028). Las áreas bajo la curva de características operativas del receptor para la ALM, el cociente ALM/área luminal del segmento de referencia distal y el modelo que los combina fueron 0,731 (IC95%, 0,652-0,811; p < 0,001), 0,696 (IC95%, 0,585-0,807; p = 0,001) y 0,766 (IC95%, 0,691-0,841; p < 0,001) respectivamente.
Parámetros de ecocardiografía intravascular con valor predictivo de eventos adversos cardiacos mayores a los 12 meses de seguimiento
| Después de intervención coronaria percutánea | Análisis univariable | Análisis multivariable | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| ALM, por cada 1,0 mm2 | 0,520 (0,373-0,723) | < 0,001 | 0,623 (0,433-0,895) | 0,010 |
| Cociente ALM/área luminal del segmento de referencia distal, por cada 0,1 | 0,626 (0,503-0,780) | < 0,001 | 0,744 (0,572-0,969) | 0,028 |
| Cociente ALM/área luminal media del segmento de referencia, por cada 0,1 | 0,655 (0,508-0,845) | 0,001 | 0,975 (0,696-1,364) | 0,881 |
ALM: área luminal mínima; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
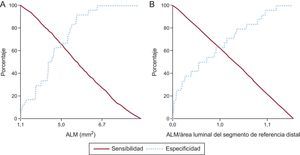
Se utilizaron las curvas de sensibilidad y especificidad para identificar los valores de corte óptimos para la ALM y para el cociente ALM/área luminal del segmento de referencia distal que predecían mejor los MACE tras el implante de un SLE (figura 1): 5,0 mm2 para la ALM y 1,0 para el cociente ALM/área luminal del segmento de referencia distal. La sensibilidad y la especificidad de la ALM < 5,0 mm2 fueron del 66,7% (16 de 24) y el 64,6% (504 de 780) respectivamente. Los valores predictivos positivo y negativo fueron del 5,5% (16 de 292) y el 98,4% (504 de 512). La sensibilidad y la especificidad del ALM menor que el área luminal del segmento de referencia distal en la predicción de MACE fueron del 62,5% (15 de 24) y el 62,1% (484 de 780). Los valores predictivo positivo y negativo fueron del 4,8% (15 de 311) y el 98,2% (484 de 493).
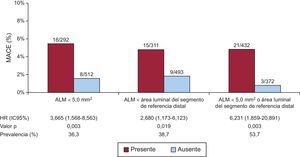
De los 24 pacientes con MACE, 21 (87,5%) tenían un ALM tras la intervención<5,0mm2 o menor que el área luminal del segmento de referencia distal. La tasa de MACE fue del 0,8% de los pacientes (3/372) que no tenían un ALM<5,0mm2 o menor que el área luminal del segmento de referencia distal y del 4,9% (21 de 432) de los que cumplían al menos 1 de esos criterios (HR = 6,231; IC95%, 1,859-20,891; p = 0,003) (figura 2, ).
Tasa de MACE en pacientes con y sin ALM <5,0 mm2 o menor que el área luminal del segmento de referencia distal a los 12 meses de seguimiento, que presentaron un aumento del riesgo de sufrir un MACE (HR=6,231; IC95%, 1,859-20,891; p=0,003). ALM: área mínima luminal; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos cardiovasculares adversos mayores.
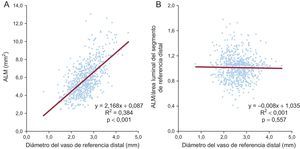
El valor absoluto de la ALM medida en el análisis de IVUS después de la intervención mostró una asociación significativa con el diámetro del vaso de referencia distal medido por análisis angiográfico coronario cuantitativo antes de la intervención (coeficiente = 2,168; IC95%, 1,965-2,370; p < 0,001). En cambio, el cociente ALM/área luminal del segmento de referencia distal no mostró esta asociación (figura 3). En el subgrupo de 320 pacientes con diámetro del vaso de referencia distal < 2,5 mm, la incidencia de MACE en los pacientes con ALM igual o mayor que el área luminal del segmento de referencia distal (1,6%, 3 de 193 pacientes; HR = 0,215; IC95%, 0,058-0,795; p = 0,021) fue menor que en los pacientes con ALM menor que el área luminal del segmento de referencia distal (7,1%, 9 de 127 pacientes).
Asociación entre el diámetro del vaso de referencia distal en la angiografía previa a la intervención y el ALM medida en la ecocardiografía intravascular posterior a la intervención. El tamaño del valor de referencia distal mostró asociación con el ALM posterior a la intervención (A), pero no con el cociente ALM/área luminal del segmento de referencia distal (B). ALM: área luminal mínima.
En este análisis combinado de 804 pacientes tratados con implante de un SLE largo guiado por IVUS, la tasa total de MACE fue del 3% a los 12 meses. En los datos de la IVUS hubo 2 predictores de MACE independientes: un valor absoluto de la ALM de 5,0 mm2 y un aumento relativo de la ALM respecto al área luminal del segmento de referencia distal. Estos 2 predictores mostraron elevados valores predictivos negativos.
La tasa de MACE en este estudio fue inferior a la del ensayo COMPARE, en el que el criterio de valoración combinado formado por muerte cardiaca, infarto de miocardio no mortal y RLD clínicamente justificada se dio en un 5% de los 897 pacientes en un plazo de 12 meses20. En comparación con el ensayo COMPARE (54%), la posdilatación se aplicó con más frecuencia en este (72%), lo que podría deberse al uso de IVUS. En consecuencia, el diámetro luminal mínimo tras la intervención (2,6 mm) en el presente estudio fue superior al observado en el ensayo COMPARE (2,1 mm)20. En los pacientes excluidos del presente estudio porque se usó guía por angiografía, la tasa de MACE fue del 7% en el ensayo RESET y el 6% en el IVUS-XPL. Estos resultados concuerdan con los del COMPARE20.
Un estudio previo con IVUS puso de manifiesto que el parámetro de valoración relativo (es decir, el cociente ALM/área luminal del segmento de referencia) mostraba una asociación significativa con la reestenosis en el stent tras el implante de un stent metálico sin recubrimiento21. Sin embargo, en la era de los SFA, se ha considerado que el parámetro de valoración absoluto (es decir, el ALM) tiene mayor valor predictivo que el parámetro relativo respecto a la permeabilidad adecuada del stent o la reestenosis angiográfica12,14,22. En el subestudio de la IVUS del ensayo SIRIUS realizado con 72 pacientes22, el umbral óptimo para que el ALM medida tras la intervención predijera un ALM >4 mm2 en el seguimiento a 8 meses fue 5,0 mm2 para el SFA liberador de sirolimus. La sensibilidad, la especificidad y el valor predictivo positivo empleando este valor umbral fueron del 76, el 83 y el 90%. En un estudio de seguimiento angiográfico previo (550 pacientes, 670 lesiones coronarias nativas) basado en datos de un registro de la práctica clínica real, se observó de manera similar que un ALM de 5,5 mm2 se asociaba al desarrollo de reestenosis angiográfica en un seguimiento de 6 meses. Sin embargo, la sensibilidad, la especificidad y el valor predictivo positivo fueron relativamente bajos (el 67, el 67 y el 7%) en comparación con los obtenidos en el subestudio del ensayo SIRIUS12. De igual modo, en un registro reciente que ha incluido a 229 pacientes tratados con SLE, se indica que el valor óptimo del ALM tras la intervención para predecir la reestenosis angiográfica es 5,4 mm2 tras un seguimiento de 9 meses14 (lo cual es coherente con el ALM de 5,0 mm2 observada en el presente estudio). A diferencia de otros estudios previos12,14,22, este se basó en 2 ensayos prospectivos y aleatorizados grandes (guiados por IVUS o por angiografía). En ambos se utilizaron SFA de segunda generación (es decir, SLE).
Hay pocos datos sobre la utilidad clínica de los parámetros relativos de la IVUS para la optimización de los SFA son escasos. En un estudio en el que se aplicaron los criterios de IVUS para la optimización de los SFA de ALM ≥ 5 mm2 o > 90% del área luminal del segmento de referencia distal para el vaso pequeño, no se pudo demostrar la superioridad de la IVUS (n = 105 pacientes) respecto a la angiografía (n = 105). Sin embargo, a este ensayo le faltaba muchísima potencia estadística, y no incluía un análisis de la optimización con la IVUS1. En el reciente ensayo aleatorizado IVUS-XPL se ha descrito la utilidad clínica de los parámetros relativos de la IVUS para la optimización de los stents, como el ALM mayor que el área luminal del segmento de referencia distal en los pacientes tratados con implante de SLE largo guiado por IVUS. Los pacientes de ese ensayo (n = 315) que no cumplían los criterios de IVUS presentaron una incidencia del objetivo principal significativamente superior que los que sí (n = 363; el 4,6 frente al 1,5%; p = 0,017)13. En este análisis combinado hubo una asociación significativa entre la aparición de MACE y los pacientes con ALM menor que el área luminal del segmento de referencia distal, incluso después de introducir un ajuste respecto al parámetro absoluto. Incluso en la era de los SFA, alcanzar unas dimensiones del stent suficientes continúa siendo importante para minimizar las reestenosis y las trombosis del stent. Si no se hace así, la insuficiente expansión del stent puede causar una tensión de cizallamiento anormal que podría llevar a hiperplasia neointimal o desarrollo de trombosis. En las lesiones largas, la enfermedad ateroesclerótica tiene una distribución difusa. En consecuencia, la distancia entre los segmentos con el diámetro luminal más pequeño y el segmento de referencia distal es bastante grande. Además, hay una mayor diferencia en el tamaño del vaso de referencia (mayor tamaño del vaso de referencia proximal frente a un menor tamaño del vaso de referencia distal) en las lesiones largas difusas que en las lesiones de menor longitud23. Cuando se considera el implante de un stent de mayor longitud en el tratamiento de lesiones largas difusas, es frecuente que el margen distal de un stent largo se sitúe en una posición adyacente al segmento de referencia distal de pequeño tamaño. Esta situación crea inevitablemente un dilema práctico. Alcanzar un ALM ≥ 5 mm2 resulta mecánicamente imposible en la parte distal del segmento tratado con el stent adyacente al segmento de referencia distal de pequeño tamaño. En este estudio, el ALM tras la intervención estaba limitada por el diámetro de referencia distal previo a la intervención (figura 3). En consecuencia, se hace necesario otro criterio de IVUS para la optimización del stent cuando el margen distal del segmento donde se implanta está situado en una posición adyacente a un segmento de referencia distal de pequeño tamaño. En el presente estudio, 320 (39,8%) de los 804 pacientes tratados con SLE tenían un diámetro del vaso de referencia distal<2,5 mm. En ese subgrupo de pacientes, la obtención de un ALM mayor o igual que el área luminal del segmento de referencia distal se asoció significativamente a menor incidencia de MACE que en los pacientes con ALM menor que el área luminal del segmento de referencia distal.
Limitaciones del estudioLos 2 ensayos tenían diseños de estudio diferentes y puede que los pacientes de estos ensayos aleatorizados incluidos en el análisis no reflejen la práctica clínica real. Dado que en la base de datos actual de este estudio no se disponía de información de IVUS previa a la intervención, no fue posible evaluar la influencia de los datos de IVUS previa a la intervención en los MACE. En consecuencia, las interpretaciones deben limitarse al ámbito de los datos presentados. No se pudo evaluar las asociaciones entre las características de la intervención detalladas y los datos de IVUS tras la intervención, ya que los datos de IVUS analizados se extrajeron de los informes finales redactados tras haber completado la intervención. Las lesiones largas de la arteria coronaria derecha fueron relativamente infrecuentes en los pacientes con MACE. La relación coste-efectividad de la exploración de IVUS queda fuera del ámbito de este estudio. Por último, en la práctica clínica, alcanzar los criterios de IVUS propuestos no siempre será posible, ya que las características de la lesión —p. ej., una calcificación intensa — también impiden un aumento de la luz suficiente. En el presente estudio, la frecuencia de los pacientes con ALM < 5,0 mm2 o menor que el área luminal del segmento de referencia distal fue del 53,7% (432 de 804) (figura 2). El presente estudio no evaluó la influencia de los datos de IVUS previos a la intervención ni de los datos de IVUS en acciones posteriores (como la dilatación adyuvante con un balón más grande) obtenidos tras la exploración de IVUS realizada durante el implante del SFA. En consecuencia, serán necesarios nuevos estudios para esclarecer las consecuencias clínicas de los criterios de IVUS propuestos.
CONCLUSIONESEste análisis combinado de 804 pacientes demostró que la tasa total de MACE fue del 3% en los primeros 12 meses tras el implante de un SLE largo guiado por IVUS. Los predictores de MACE independientes fueron el ALM y el cociente ALM/área luminal del segmento de referencia distal, determinados mediante la IVUS posterior a la intervención. Los valores umbral óptimos del ALM y el cociente ALM/área luminal del segmento de referencia distal que predecían MACE fueron 5,0 mm2 y 1,0. En consecuencia, están en riesgo de MACE los pacientes con ALM tras la intervención < 5,0 mm2 o menor que el área luminal del segmento de referencia distal tras el implante de un SLE largo.
FINANCIACIÓNEste estudio fue financiado por una subvención del Korea Healthcare Technology Research and Development Project, Ministerio de Salud y Bienestar, República de Corea (números A085136 y HI15C1277), el Mid-career Researcher Program a través de una subvención del National Research Foundation of Korea financiada por el Ministry of Education, Science and Technology, República de Corea (número 2015R1A2A2A01002731) y el Cardiovascular Research Center, Seúl, Corea.
CONFLICTO DE INTERESESNinguno.
- –
Aunque en estudios previos de la IVUS se ha observado que un umbral de expansión del stent podría predecir la reestenosis en el stent tras el implante de un SFA, aún hay pocos datos. Esto resulta especialmente cierto en los pacientes con lesiones coronarias largas. Además, los datos previos se obtuvieron de estudios observacionales retrospectivos o que empleaban SFA de primera generación.
- –
Los pacientes con un ALM medida en la IVUS <5,0 mm2 o menor que el área luminal del segmento de referencia distal están en riesgo de sufrir MACE tras el implante de SLE largos.